修饰化外泌体及其制法和外泌体联合pd-1抗体的原位喷雾水凝胶和应用
技术领域
1.本发明属于药物技术领域,具体涉及修饰化外泌体及其制法和外泌体联合pd-1抗体的原位喷雾水凝胶和应用,特别涉及一种同时载有cpg寡聚脱氧核苷酸和肿瘤特异性蛋白ova的修饰化外泌体及其制备方法,并涉及外泌体联合pd-1抗体装载于原位喷雾水凝胶在治疗黑色素瘤术后复发中的应用。
背景技术:
2.使用单克隆抗pd-1抗体(apd-1)阻断程序性细胞死亡蛋白1可缓解免疫抑制,并已被证明可以提高一系列癌症的疗效。但免疫检查点阻断的低响应率总会导致术后肿瘤复发和转移。肿瘤浸润树突状细胞(tidc)和肿瘤引流淋巴结(tdln)中的树突状细胞通常表现出免疫抑制表型,通常因为它们的不成熟和不活跃状态导致t细胞免疫抑制。此外,在切除的肿瘤中没有足够的活化的肿瘤浸润淋巴细胞(til),其治疗效果并不令人满意。因此,在两个部位有效双重激活树突状细胞(tidc和tdln)以及增加肿瘤浸润淋巴细胞(til)以促进全身免疫反应对于黑色素瘤术后免疫治疗至关重要。
3.cpg寡聚脱氧核苷酸(cpg odn)是人工合成的含有非甲基化的胞嘧啶鸟嘌呤二核苷酸(cpg)的寡脱氧核苷酸(odn),是一种toll样受体9激动剂。cpg寡聚脱氧核苷酸可直接促进树突状细胞成熟和活化,从而诱导th1型免疫应答,并能促进细胞因子的分泌,产生较强的免疫反应。但是现有的手段难以将cpg寡聚脱氧核苷酸有效地递送至树突状细胞,因此治疗黑色素瘤的效果不佳,并不能够很好的起到抗肿瘤效果。
技术实现要素:
4.本发明所解决的是黑色素瘤术后复发治疗效果并不理想的问题,提供一种修饰化外泌体及其制法和外泌体联合pd-1抗体的原位喷雾水凝胶和应用。外泌体联合pd-1抗体的原位喷雾水凝胶是一种原位可喷的免疫治疗纤维蛋白凝胶,修饰化外泌体实现了双重响应策略,能够同时激活肿瘤浸润处的树突状细胞和引流淋巴结内的树突状细胞,增强了pd-1抗体的作用效果。所制备的外泌体联合pd-1抗体的原位喷雾水凝胶在术后部位形成一个药物储库,逐渐缓慢地释放修饰化外泌体和pd-1抗体,从而增加肿瘤中的t淋巴细胞浸润并提高当前pd-1抗体的疗效。
5.本发明将cpg寡聚脱氧核苷酸和肿瘤特异性蛋白ova共载于外泌体上,形成修饰化外泌体,再将修饰化外泌体与pd-1抗体联合装载于由纤维蛋白原和凝血酶构成的喷雾水凝胶中。研究其对于延缓b16-f10-ova黑色素瘤的生长,巩固全身性t细胞免疫,抑制肿瘤复发和转移,延长小鼠存活期的效果。
6.为实现上述目的,本发明采用以下技术方案:
7.本发明的一种修饰化外泌体,为同时载有cpg寡聚脱氧核苷酸和肿瘤特异性蛋白ova的外泌体。
8.所述的外泌体为树突状细胞衍生的外泌体。
9.按比例,产生树突状细胞衍生的外泌体的树突状细胞的个数:肿瘤特异性蛋白ova为:1
×
106个:200-400μg。
10.按质量百分比,cpg寡聚脱氧核苷酸为3%-5%,余量为肿瘤特异性蛋白ova和外泌体。
11.所述的修饰化外泌体的粒径为120-150nm。
12.本发明的一种修饰化外泌体的制备方法,包括以下步骤:
13.s1:收集培养小鼠骨髓来源的并给予ova刺激的树突状细胞的无血清培养液,通过外泌体提取分离试剂盒除去细胞及细胞碎片,使用pbs重悬后,得到空白的外泌体(dc-sevs);
14.s2:将cpg odn与硫醇还原剂混合并充分搅拌,得到混合溶液;
15.s3:将胺-巯基交联剂添加到混合溶液中继续搅拌,去除过量的硫醇还原剂和胺-巯基交联剂后,在室温下与dc-sevs在pbs溶液中孵育,得到修饰化外泌体。
16.进一步的,所述的树突状细胞为鼠源性,从c57bl/6小鼠的股骨和胫骨提取而来。所述的给予ova刺激的树突状细胞的无血清培养液的制备过程为:在含有1
×
106个树突状细胞培养基中,以培养基的体积为基准,添加20ng/ml鼠粒细胞-巨噬细胞集落刺激因子(gm-csf),添加5ng/ml白细胞介素-4(il-4)以及50μm/lβ-巯基乙醇。在37℃加湿培养箱中培养3天后,用补充有相同体积的gm-csf和il-4的新鲜培养基替换。在第6天收集树突状细胞,在含有300μg/ml的ova的新鲜培养基中孵育过夜。然后加入30ng/ml lps刺激树突状细胞成熟。随后,使用无血清的培养基培养表达ova的树突状细胞,收集其培养液。
17.所述的硫醇还原剂优选为三(2-羧乙基)膦(tcep)和/或二硫苏糖醇(dtt)。按摩尔比,cpg odn:硫醇还原剂=1:5000。
18.所述的胺-巯基交联剂优选为4-(n-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-smcc)。按摩尔比,cpg odn:胺-巯基交联剂为1:1.5。
19.所述的去除过量的硫醇还原剂和胺-巯基交联剂的方法为:使用3kda的超滤管超滤除去过量的硫醇还原剂和胺-巯基交联剂。
20.本发明的一种外泌体联合pd-1抗体的原位喷雾水凝胶,包括原位喷雾水凝胶基质、pd-1抗体(apd-1)和上述修饰化外泌体,所述的外泌体联合pd-1抗体的原位喷雾水凝胶通过联合pd-1抗体(apd-1)和上述修饰化外泌体装载于原位喷雾水凝胶基质中制得。
21.所述的原位喷雾水凝胶基质由纤维蛋白原和凝血酶组成,当等体积的纤维蛋白原溶液(10mg/ml)与凝血酶溶液(100u/ml)接触时,该基质发生凝胶化,得到原位喷雾水凝胶基质;通过喷雾混合等体积的含有修饰化外泌体的凝血酶溶液和含有pd-1抗体的纤维蛋白原溶液,形成外泌体联合pd-1抗体的原位喷雾水凝胶。
22.按固液比,pd-1抗体:修饰化外泌体中所含cpg odn:原位喷雾水凝胶基质=6-8μg:30-50μg:100-300μl;其中,apd-1均匀分散在原位喷雾水凝胶基质的纤维蛋白原溶液中,修饰化外泌体均匀分散在原位喷雾水凝胶基质的凝血酶溶液中。
23.所述的外泌体联合pd-1抗体的原位喷雾水凝胶的应用,用于作为抑制和/或治疗黑色素瘤术后复发药剂的应用。
24.本发明的修饰化外泌体和外泌体联合pd-1抗体的原位喷雾水凝胶及其制法和应
用,其具有以下有益效果:
25.(1)制备了外泌体联合pd-1抗体的原位喷雾水凝胶,在术后部位形成一个药物储库,逐渐缓慢地释放修饰化外泌体和pd-1抗体。制备了同时载有cpg寡聚脱氧核苷酸和ova的外泌体制剂,能够增强pd-1抗体的抗肿瘤疗效,制备方法简单高效,稳定性好,实现了小分子药物的高效共递送。
26.(2)为了解决pd-1抗体低响应率导致的肿瘤术后复发,研究了联合修饰化外泌体与pd-1抗体的原位喷雾水凝胶。该修饰化外泌体同时载有cpg寡聚脱氧核苷酸和肿瘤特异性蛋白ova,修饰化外泌体携带的cpg odn可以触发肿瘤浸润树突状细胞和肿瘤引流淋巴结中树突状细胞的成熟和活化,从而激活肿瘤浸润的t细胞,具有强大的免疫刺激作用。修饰化外泌体还可以将ova递送到相同的树突状细胞,引发抗原呈递细胞特异性表达肿瘤抗原,从而识别带有ova抗原的肿瘤细胞。同时该外泌体能够归巢至肿瘤引流淋巴结中,刺激淋巴结中的树突状细胞成熟,增加了t细胞的浸润。
27.(3)将pd-1抗体与免疫佐剂和肿瘤抗原共修饰的外泌体联合使用在原位喷雾水凝胶中,可以同时增强肿瘤微环境和淋巴结中的抗肿瘤t细胞免疫,有效地减少肿瘤局部复发和转移。双重激活策略延长了小鼠的存活期,降低了黑色素瘤术后的复发率,为抑制肿瘤复发和转移提供了一种有希望的方法。
附图说明
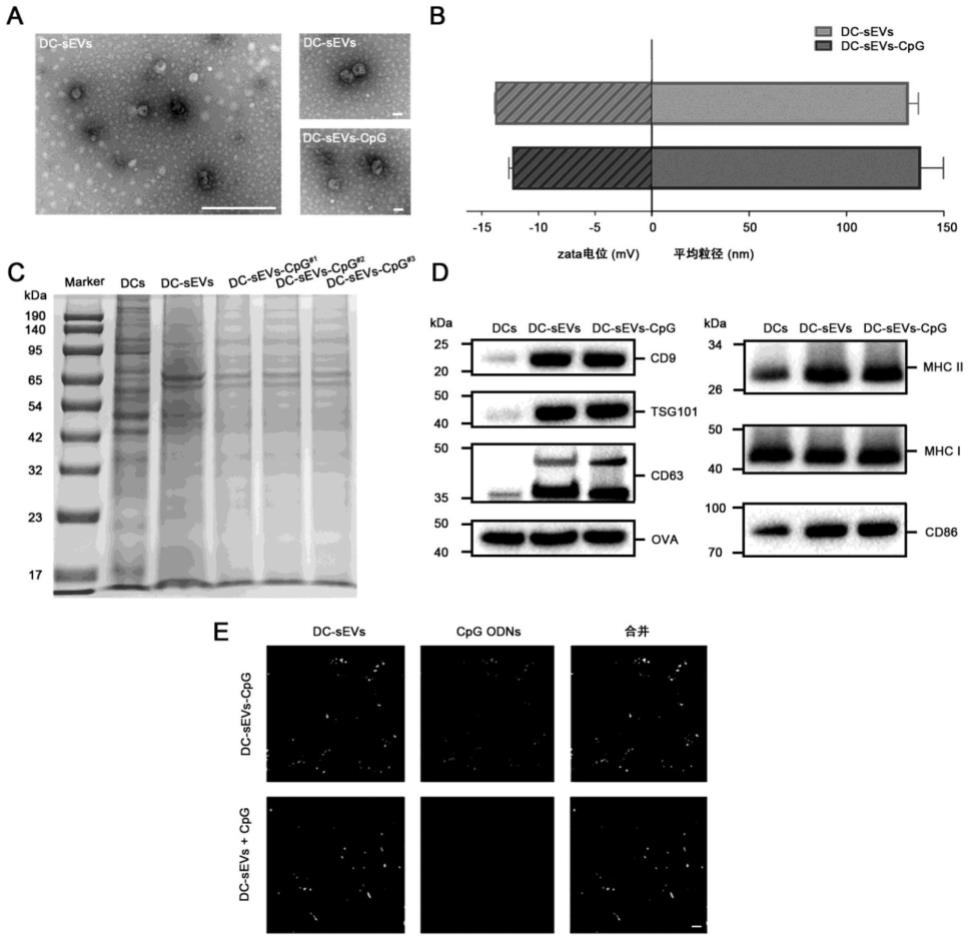
28.图1为本发明实施例1修饰化外泌体的制备与特性实验图。
29.a:dc-sevs和dc-sevs-cpg的透射电子显微镜图
30.b:dc-sevs和dc-sevs-cpg的粒径、zeta电位图。
31.c:dc、dc-sevs和dc-sevs-cpg的sds-page检测图。
32.d:dc、dc-sevs和dc-sevs-cpg的特征性蛋白western blot检测图。
33.e:dc-sevs-cpg的共聚焦荧光图像。
34.图2为本发明实施例2中原位喷雾水凝胶的制备与特性试验图。
35.a:原位喷雾水凝胶的扫描电子显微镜图。
36.b:原位喷雾水凝胶的动态流变特性图。
37.c:cpg odn在ph6.5条件下从凝胶中的释放动力学结果图。
38.d:原位喷雾水凝胶在小鼠体内的释放结果图。
39.图3为本发明实施例3中dc-sevs-cpg的体外摄取图和tlr9定位图。
40.a:dc-sevs-cpg及各对照组处理的树突状细胞的流式细胞术测量图。
41.b:dc-sevs-cpg及各对照组处理的树突状细胞的流式细胞术定量图,***p《0.001,****p《0.0001。
42.c:dc-sevs-cpg及各对照组处理(0.5h和2h)的树突状细胞的共聚焦显微镜测量图。
43.图4为本发明实施例4中dc-sevs-cpg的体外激活实验图。
44.a:dc-sevs-cpg及各对照组处理后树突状细胞表达cd80
cd86
的流式细胞术测量图。
45.b:dc-sevs-cpg及各对照组处理后树突状细胞表达cd80
cd86
的流式细胞术定量
图,***p《0.001。
46.c:dc-sevs-cpg及各对照组处理后tnf-α和il-2的定量图,***p《0.001,****p《0.0001。
47.图5为本发明实施例5中apd-1-dev-cpg@gel的抗肿瘤免疫应答实验图。
48.a:gel、dc-sevs@gel、cpg@gel、dc-sevs-cpg@gel、apd-1@gel、apd-1-dev-cpg@gel治疗后肿瘤浸润m2型巨噬细胞的流式细胞术测量图,**p《0.01,***p《0.001,****p《0.0001。
49.b:各制剂治疗后肿瘤浸润m1型巨噬细胞的流式细胞术测量图,***p《0.001,****p《0.0001。
50.c:各制剂治疗后肿瘤浸润cd8
t细胞的流式细胞术测量图,**p《0.01,***p《0.001,****p《0.0001。
51.d:各制剂治疗后肿瘤浸润调节t细胞的流式细胞术测量图,***p《0.001,****p《0.0001。
52.e:其中三组含有cpg odn的制剂治疗后肿瘤浸润树突状细胞的成熟情况的流式细胞术测量图,****p《0.0001。
53.f:其中三组含有cpg odn的制剂治疗后肿瘤引流淋巴结处的树突状细胞的成熟情况的流式细胞术测量图,****p《0.0001。
54.g:其中三组含有cpg odn的制剂治疗后肿瘤引流淋巴结处的cd8
t细胞的流式细胞术测量图,***p《0.001,****p《0.0001。
55.图6为本发明实施例6中靶向肿瘤引流淋巴结实验中的小鼠淋巴结荧光强度图。
56.图7为本发明实施例7中apd-1-dev-cpg@gel的抗肿瘤复发药效学考察实验图。
57.a:gel、dc-sevs@gel、cpg@gel、dc-sevs-cpg@gel、apd-1@gel、apd-1-dev-cpg@gel治疗后小鼠肿瘤大小的变化图。
58.b:各制剂治疗后肿瘤体积的变化图,***p《0.001,****p《0.0001。
59.c:各制剂治疗后小鼠的生存期。
60.d:各制剂治疗后小鼠的体重变化图。
61.图8为本发明实施例7中药效学考察实验的肿瘤和脾的图。
62.a:不同类型的制剂治疗后,解剖离体的黑色素瘤照片。
63.b:不同类型的制剂治疗后,解剖离体的黑色素瘤重量,***p《0.001,****p《0.0001。。
64.c:不同类型的制剂治疗后,解剖离体的脾的照片。
65.d:不同类型的制剂治疗后,解剖离体的脾重,**p《0.01。
66.图9为本发明实施例7中药效学考察实验的肺转移情况图。
67.图10为本发明实施例7中荷瘤小鼠心、肝、脾、肺、肾和肿瘤的h&e染色图。
68.图11为本发明实施例8中apd-1-dev-cpg@gel的抗远端肿瘤药效学实验考察图。
69.a:未治疗组(gel)和apd-1-dev-cpg@gel治疗后小鼠肿瘤大小的变化图。
70.b:未治疗和治疗后原发性肿瘤和远端肿瘤的体积变化图,***p《0.001,****p《0.0001。
71.图12为本发明实施例8中apd-1-dev-cpg@gel的抗远端肿瘤免疫应答情况图。
72.a:未治疗和治疗后的m2型巨噬细胞的流式细胞术测量图,****p《0.0001。
73.b:未治疗和治疗后的m1型巨噬细胞的流式细胞术测量图,****p《0.0001。
74.c:未治疗和治疗后的cd8
t细胞的流式细胞术测量图,****p《0.0001。
75.d:未治疗和治疗后的调节t细胞的流式细胞术测量图,****p《0.0001。
76.图13为本发明实施例8中apd-1-dev-cpg@gel的抗远端肿瘤药效学实验的肿瘤、脾和主要器官情况图。
77.a:未治疗和治疗后的解剖离体的双侧黑色素瘤照片。
78.b:未治疗和治疗后的解剖离体的脾的照片。
79.c:未治疗和治疗后的解剖离体的双侧黑色素瘤重,****p《0.0001。
80.d:未治疗和治疗后的解剖离体的脾的重量,***p《0.001。
81.e:未治疗和治疗后的荷瘤小鼠心、肝、脾、肺、肾和肿瘤的h&e染色图。
具体实施方式
82.下面结合实施例对本发明作进一步的详细说明。
83.实施例1:修饰化外泌体的制备与特性实验
84.收集从c57bl/6小鼠的股骨和胫骨提取并装载ova的树突状细胞的无血清培养液,将细胞培养液在3000g的转速下离心15min,并收集上清液。其中,装载ova的树突状细胞的无血清培养液的制备过程为:在含有1
×
106个树突状细胞培养基中,以培养基的体积为基准,添加20ng/ml鼠粒细胞-巨噬细胞集落刺激因子(gm-csf),添加5ng/ml白细胞介素-4(il-4)以及50μm/lβ-巯基乙醇。在37℃加湿培养箱中培养3天后,用补充有相同体积的gm-csf和il-4的新鲜培养基替换。在第6天收集树突状细胞,在含有300μg/ml的ova的新鲜培养基中孵育过夜。然后加入30ng/ml lps刺激树突状细胞成熟。随后,使用无血清的培养基培养表达ova的树突状细胞,收集其培养液;
85.将exoquick-tc
tm
试剂盒以1:5的体积比添加到上清液中,充分混合,并在4℃下放置过夜。接下来将混合物在4℃下以1500g的转速离心30min,移除上清液后在4℃下以1500g的转速离心5min。最后,将管底得到的外泌体重悬于pbs缓冲液中。将硫醇化的cpg odn以100μm的浓度溶解在pbs中,与tcep(1mol/l)结合,室温下搅拌30min,将硫醇化的cpg odn在运输过程形成的双硫键还原。然后将sulfo-smcc添加到溶液中搅拌30min。每个步骤之间用pbs洗涤3次(截留分子量=3kda)以去除过量的tcep和sulfo-smcc。最后,在室温下与dc-sevs共孵育1h,并在离心过滤装置(截留分子量=100kda)中纯化得到dc-sevs-cpg。
86.使用tem透射电镜观察dc-sevs和dc-sevs-cpg的形貌特征,用马尔文激光粒度分析仪测定外泌体的粒径和电位,如图1a、图1b所示。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳和免疫印迹试验验证了外泌体的蛋白完整,如图1c、图1d所示。为了证实cpg odn通过共价键成功修饰到dc-sevs上,cy5标记的cpg odn和dio标记的dc-sevs在共聚焦显微镜下观察,如图1e所示,通过图1e,可以看出cpg odn通过共价键成功修饰到dc-sevs上。
87.实施例2:原位喷雾水凝胶的制备与特性试验
88.通过双瓶喷雾喷射等体积的纤维蛋白原(10mg/ml)和凝血酶(100u/ml)制备原位喷雾水凝胶,其中dc-sevs-cpg溶解在纤维蛋白原溶液中,pd-1抗体在凝血酶溶液中稀释。
89.使用sem对原位喷雾水凝胶的形貌进行了表征,如图2a所示,凝胶的动态流变特性
如图2b所示。接下来,取1ml apd-1-dev-cpg@gel置于20ml的pbs(ph=6.5)中孵育,并在37℃恒温水浴振荡器中模拟体外释放,在预定时间点(0,6,12,24,48,72,96,120,144h)取出混合释放液用多功能酶标仪测试,结果如图2c所示,原位喷雾水凝胶能缓慢并持续地释放药物。为了测量体内释放的结果,在小鼠术后部位分别给予apd-1、dc-sevs-cpg、apd-1@gel和dc-sevs-cpg@gel,在第0、2、4、6天通过ivis成像系统观察,结果如图2d所示,原位喷雾水凝胶(dc-sevs-cpg@gel)在第6天仍有药物存在,而apd-1在第6天药物残余量很少,dc-sevs-cpg在第6天药物残余量很少,apd-1@gel在第6天仍有药物存在,说明原位喷雾水凝胶是一个良好的药物储库。
90.实施例3:dc-sevs-cpg的体外摄取和tlr9定位实验
91.为了确定体外树突状细胞对dc-sevs-cpg的摄取,将cy5标记的cpg(6μg)、dc-sevs cpg(直接将dc-sevs和cpg odn在pbs溶液中孵育制得)、和dc-sevs-cpg分别与1
×
106个小鼠骨髓来源的树突状细胞在12孔板中孵育0.5小时和2小时。首先,收集树突状细胞并通过流式细胞仪进行测验,使用flowjo软件进行分析,细胞对dc-sevs cpg的摄取更多(图3a、图3b)。其次,使用共聚焦激光扫描显微镜观察共定位的结果(图3c)。将cy5标记的cpg(6μg)、dc-sevs cpg和dc-sevs-cpg分别与1
×
106个细胞在共聚焦培养皿中孵育0.5小时和2小时,在4℃下用pe缀合的tlr9抗体对细胞进行染色,然后在室温下与hoechst33342一起孵育10分钟。在每个过程之间细胞用pbs洗涤3次。在共聚焦显微镜下观察发现dc-sevs-cpg更容易被细胞摄取。
92.实施例4:dc-sevs-cpg的体外激活实验
93.为了研究体外树突状细胞的活化情况,将pbs,cpg(6μg)、dc-sevs、dc-sevs cpg、和dc-sevs-cpg分别与1
×
106个小鼠骨髓来源的树突状细胞在12孔板中孵育过夜,收集细胞并用cd11c、cd80和cd86抗体染色。使用流式细胞仪测试这些表面标记物的表达情况,并通过flowjo软件进行分析,dc-sevs-cpg对树突状细胞的激活更明显(图4a、图4b)。此外,通过il-2小鼠酶联免疫吸附测定试剂盒和tnf-α小鼠elisa试剂盒收集并测量细胞培养物的上清液,dc-sevs-cpg处理后细胞产生更多的il-2和tnf-α(图4c)。
94.实施例5:apd-1-dev-cpg@gel的抗肿瘤免疫应答实验
95.将b16-f10-ova或luc-b16-f10-ova细胞(每只小鼠接种5
×
106个细胞)皮下注射到雌性c57bl/6小鼠(4-5周周龄,平均体重18-22g)腹部右侧,以研究原位喷雾水凝胶的免疫治疗效果。在接种肿瘤细胞10天后,肿瘤大小达到500mm3左右。将所有小鼠随机分为6组,部分切除肿瘤,留1%的肿瘤模拟术后残留肿瘤模型。该过程可概括如下:首先将小鼠麻醉;然后,使用无菌手术器械切除肿瘤组织,留下约1%的肿瘤组织;最后,立即在手术伤口处喷各种水凝胶(单独凝胶gel、修饰化外泌体凝胶dc-sevs@gel、cpg凝胶cpg@gel、原位喷雾水凝胶dc-sevs-cpg@gel、抗体凝胶apd-1@gel、外泌体联合pd-1抗体的原位喷雾水凝胶apd-1-dev-cpg@gel),并用缝线或伤口夹将伤口闭合。为了测出各个喷雾凝胶的免疫效果,在第16天收集小鼠的肿瘤并在含有消化酶的染色缓冲液中切碎获得单细胞悬液。用f4/80,cd80,cd206,cd3,cd4,cd8,foxp3,cd11c,cd80和cd86抗体染色。通过流式细胞仪测量染色的细胞并通过flowjo软件进行分析(图5a、5b、5c、5d、5e)。结果表示,肿瘤处的m1型巨噬细胞数量增多,m2型巨噬细胞数量减少。另外,肿瘤浸润的cd8
t细胞的比例有所上升,而调节性t细胞比例下降。将肿瘤引流淋巴结(tdlns)转移到培养皿中,并将其按压破碎成单细胞。
使用cd3,cd4,cd8,foxp3,cd11c,cd80和cd86抗体染色,通过流式细胞仪测量染色的细胞并通过flowjo软件进行分析(图5f、图5g)。结果表明,apd-1-dev-cpg@gel治疗后的肿瘤微环境处和引流淋巴结处的dc均获得更高程度的激活,引起更有效的cd8
t细胞免疫效果。
96.实施例6:靶向肿瘤引流淋巴结实验
97.将b16-f10-ova或luc-b16-f10-ova细胞(每只小鼠接种5
×
106个细胞)皮下注射到雌性c57bl/6小鼠(4-5周周龄,平均体重18-22g)腹部右侧。在接种肿瘤细胞10天后,肿瘤大小达到500mm3左右。将所有小鼠随机分为3组,部分切除肿瘤,留1%的肿瘤模拟术后残留肿瘤模型,然后分别给予cpg@gel、dc-sevs-cpg@gel和apd-1-dev-cpg@gel。在给药24h后取出小鼠的肿瘤引流淋巴结置于ivis成像系统中观察各淋巴结的药物荧光强度(图6)。图中可以看出,给予apd-1-dev-cpg@gel后在引流淋巴结处有更多的cpg odn累积。
98.实施例7:apd-1-dev-cpg@gel的抗肿瘤复发药效学实验
99.将b16-f10-ova或luc-b16-f10-ova细胞(每只小鼠接种5
×
106个细胞)皮下注射到雌性c57bl/6小鼠(4-5周周龄,平均体重18-22g)腹部右侧,以研究原位喷雾水凝胶的免疫治疗效果。在接种肿瘤细胞10天后,肿瘤大小达到500mm3左右。将所有小鼠随机分为6组,部分切除肿瘤,留1%的肿瘤模拟术后残留肿瘤模型。在术后伤口部位分别给予gel、dc-sevs@gel、cpg@gel、dc-sevs-cpg@gel、apd-1@gel、apd-1-dev-cpg@gel。将d-荧光素(15mg/ml)的dpbs溶液以10mg/ml的剂量注入小鼠腹腔,10分钟后使用体内生物发光成像系统(ivis)对小鼠进行成像(图7a)。根据宽2×
长
×
1/2测量和计算肿瘤大小,饲养40天观察小鼠生存期(当肿瘤体积超过1.5cm3时实施安乐死),并每隔一天记录小鼠体重(图7b、图7c、图7d)。apd-1-dev-cpg@gel治疗后的小鼠肿瘤复发情况明显减少,并且有更长的生存期。其他小鼠在第22天时处死,收集复发的肿瘤和主要器官,其中肿瘤和脾的大小和重量如图所示(图8a、图8b、图8c、图8d)。apd-1-dev-cpg@gel治疗后的小鼠肿瘤更小,并且脾的大小几乎没有变化。小鼠的肺部肿瘤转移情况如图9所示,apd-1-dev-cpg治疗后有肺部的转移情况得到抑制。将心、肝、脾、肺、肾和肿瘤浸泡在4%多聚甲醛中进行h&e染色,在显微镜下的图像如图10所示。
100.实施例8:apd-1-dev-cpg@gel的抗远端肿瘤药效学实验
101.对于远端肿瘤模型,将b16-f10-ova或luc-b16-f10-ova细胞(每只小鼠接种5
×
106个细胞)皮下注射到雌性c57bl/6小鼠(4-5周周龄,平均体重18-22g)腹部的右侧(原发性肿瘤)。原发性肿瘤生长7天后,将1
×
106个b16-f10-ova或luc-b16-f10-ova细胞注射到小鼠腹部左侧,获得的第二个肿瘤作为远端肿瘤。在原发性肿瘤生长10天时,右侧的肿瘤被部分切除,切除部位给予原位喷雾水凝胶gel和apd-1-dev-cpg@gel。使用ivis成像系统对小鼠成像观察(图11a)。根据宽2×
长
×
1/2测量和计算原发性肿瘤复发的大小和远端肿瘤的大小(图11b)。结果表明,治疗后的小鼠肿瘤复发情况和远端肿瘤大小都得到了抑制。
102.在第16天收集小鼠的肿瘤并在含有消化酶的染色缓冲液中切碎获得单细胞悬液。用f4/80,cd80,cd206,cd3,cd4,cd8和foxp3抗体染色。通过流式细胞仪测量染色的细胞并通过flowjo软件进行分析凝胶喷雾的免疫治疗效果(图12a、图12b、图12c、图12d)。治疗后的m1型巨噬细胞数量增多,m2型巨噬细胞数量减少。并且cd8
t细胞的比例有所上升,而调节性t细胞比例下降。其他小鼠在第22天时处死,收集复发的肿瘤、远端肿瘤和主要器官,其中肿瘤和脾的大小和重量如图所示(图13a、图13b、图13c、图13d)。治疗后的小鼠肿瘤复发
情况和远端肿瘤的大小都受到了明显的抑制,并且脾的大小几乎没有变化。将心、肝、脾、肺、肾和肿瘤浸泡在4%多聚甲醛中进行h&e染色,在显微镜下的图像如图13e所示。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。