1.本发明属于生物医药技术领域,具体涉及一种促进皮肤创伤修复的海洋生物肽及其制备方法和应用。
背景技术:
2.皮肤被覆于身体表面,是人体面积最大的器官之一,也是人体抵御外界伤害的第一道屏障。皮肤与外界直接接触,极易受创伤、烧伤等过程破坏。据世界卫生组织统计,2017年约有900万人烧烫伤。除急性创伤外,多种常见疾病(如糖尿病足、衰老、肥胖、血管疾病、癌症、感染等)影响着全世界超过1%的人,使其伤口愈合缓慢或不能完全愈合,而伤口愈合时间与感染易感性、疼痛持续时间、住院时间、疤痕发生率密切相关。
3.皮肤创伤修复机制常受到众多因素的影响,如年龄、营养状况、内分泌变化、局部血液循环、感染、电离辐射、药物、系统性疾病等。小面积损伤,数天即可愈合,不留瘢痕。但在组织细胞缺失较多、伤口过大的创伤中,再生表皮很难将伤口完全修复,机体则由结缔组织填补伤口,伤口修复后常留下瘢痕,其表面虽有角化表皮覆盖,但缺乏汗腺、毛发和真皮乳头,失去了原有的组织结构和功能。
4.此外,慢性创伤愈合能力不足也尤为明显。在糖尿病中,糖尿病足发病率高达25%,异常高血糖导致组织细胞受损和代谢异常,严重损害伤口修复速率。在肥胖人群中,由于皮肤脂肪层厚,不利于微血管新生,加之伤口容易引起脂肪液化而发生感染,其伤口恢复速度也较慢。在衰老人群中,由于细胞代偿功能衰退,干细胞自我更新功能和受损细胞清除能力减弱,伤口愈合速率明显减慢。
5.由此可见,促进这些急性和慢性伤口快速、高质量愈合是临床护理中不容忽视的问题。在临床治疗上,主要针对急性皮肤创伤和慢性皮肤创伤进行不同的处理和用药。我国基因工程i类新药重组牛碱性成纤维细胞生长因子(rb-bfgf)促进创面愈合,主要用于烧伤、体表慢性溃疡、新鲜创面(包括外伤、供皮区创面、手术伤等)。然而,该多肽和重组蛋白由于制备成本较高,无法在医用生物材料、化妆品等领域中大规模应有和推广。
技术实现要素:
6.本发明的目的之一在于提供一种海洋生物肽,其能有效促进皮肤创伤修复。本发明海洋生物肽皮肤相容性好,能显著提高细胞活力,促进细胞增殖、迁移与血管新生,有效减轻炎症反应,促进皮肤创伤高质量修复,有效减少瘢痕增生。
7.本发明的另一个目的在于提供一种通过酶解、超滤、葡聚糖凝胶g-15分离制备海洋生物肽的方法。该方法简单、成本低廉、绿色环保、生产周期短,适用于大规模工业生产。
8.本发明还有一个目的在于提供一种海洋生物肽的应用,该海洋生物肽可应用于药品中,还可应用于医用生物材料和化妆品中。
9.本发明通过以下技术方案实现上述目的:
10.一方面,本发明提供了一种海洋生物肽,其水溶性和皮肤相容性好。
11.本发明海洋生物肽是鲜活海洋贝类软体部经过蛋白酶酶解所得的产物。
12.这些海洋贝类可以包括但不限于马氏珠母贝、波纹巴非蛤、扇贝中的一种或几种的组合。
13.而所使用的蛋白酶可以是能将蛋白进行酶解的酶,包括但不限于木瓜蛋白酶、中性蛋白酶、胰蛋白酶中的一种或几种的组合。
14.此前发明人将海洋贝类肽用于护肤、护发研究获得了良好的效果。然而由于皮肤创伤组织与正常皮肤组织在生理状态和结构上存在明显差异,目前无报道用于普通皮肤护理的物质也可直接用于皮肤创伤组织的护理。
15.据了解,皮肤组织修复和伤口愈合大致经历三个基本阶段:1、炎症反应;2、组织增生和肉芽形成;3、伤口收缩与瘢痕形成。3个阶段彼此重叠。
16.1、炎症反应:伤后立即开始,通常持续3-5天。其主要改变是血液凝固和纤维蛋白溶解、免疫应答、微血管通透性增高、炎症细胞(起初为中性粒细胞,随后为单核细胞)渗出,其意义在于清除致伤因子(如病原体等外来异物)和坏死组织,防止感染,以奠定组织再生与修复的基础。由血小板释放出的pdgf、igf-1、egf、tgf-β等,作为炎症细胞的趋化剂而发挥重要作用;巨噬细胞在伤口处合成并分泌tgf-β、tgf-α、bfgf、mdgf和hb-egf,这些因子可刺激成纤维细胞、表皮细胞和血管内皮细胞向伤口移动。
17.2、组织增生和肉芽形成:伤后24-48h伤缘上皮细胞开始增生,一部分基底细胞与真皮脱离,向缺损区移行,并可见有丝分裂。同时,伤处出现胞质丰富、呈梭形或星形的成纤维细胞及成肌纤维细胞,后者与前者相似,但含有与细胞长轴平行的微丝束,并附着于薄膜上(有利于细胞收缩)。血管形成主要是由已有的血管“发芽”长出新的毛细血管,已有的血管襻也可能延长。成纤维细胞分泌igf-1、bfgf、tgf-β、pdgf和kgf;内皮细胞合成bfgf和pdgf;角化细胞合成tgf-β、tgf-α和角化细胞来源的自分泌因子(kaf)。这些生长因子刺激细胞增殖、细胞间基质蛋白合成和血管生成。
18.3、伤口收缩与瘢痕形成:伤后3-5天,伤口的边缘开始向中心移动、收缩,以消除创面,恢复机体组织的连续性。它常发生在创面尚未完全上皮化时,起初由于伤缘上皮细胞微纤维束收缩所致,最后为位于伤口中央的肌成纤维细胞发生收缩。pdgf、tgf-β等在肉芽组织转变为瘢痕的过程中具有重要作用。随着愈合过程的进展,胶原纤维不断增加,成纤维细胞和毛细血管逐渐减少,最后转变为细胞和血管均少而纤维较多的瘢痕组织。
19.在创伤愈合过程中,随着成纤维细胞长入,伤区内纤维连接蛋白含量增加,沿胶原分布于肉芽组织中。当新生上皮覆盖创面和胶原成熟时,纤维连接蛋白逐渐消失。创伤愈合的稍后期,伤处有大量的成纤维细胞,它是主要的修复细胞,主要功能是合成胶原纤维。在创伤愈合中胶原大致经历细胞内合成、细胞外沉积和被再吸收的动态过程。生长因子在胶原的合成代谢中起重要调节作用,主要是通过影响胶原蛋白基因表达而实现的。
20.基于以上对皮肤创伤修复过程与机制等的了解,发明人首次将去除葡聚糖凝胶g-15最后一个洗脱单峰组分后获得的海洋生物肽用于创伤皮肤的护理上。
21.作为一种可选的实施方案,海洋生物肽的制备方法为海洋贝类软体部通过蛋白酶酶解、超滤,再经葡聚糖凝胶g-15分离,弃去最后一个洗脱单峰组分后,分别收集或合并各个洗脱峰组分,冻干制得海洋生物肽。
22.优选地,在一些实施方案中,可将海洋贝类软体部木瓜蛋白酶解液,经过截留分子
量10kda超滤膜处理,获得的滤过液(小于10kda)直接通过葡聚糖凝胶g-15分离。
23.优选地,在一些实施方案中,可将海洋贝类软体部胰蛋白酶酶解液,经过截留分子量3kda超滤膜处理,获得的滤过液(小于3kda)再通过葡聚糖凝胶g-15分离。
24.优选地,在一些实施方案中,可将海洋贝类软体部中性蛋白酶解液,依次经过截留分子量10kda、3kda超滤膜处理,获得的截留液(3kda-10kda)再经过葡聚糖凝胶g-15分离。
25.具体如下:鲜活海洋贝类去壳,取软体部匀浆,加入2.5-4倍体积水或pbs缓冲液稀释,加入蛋白酶(2000u/g贝肉-4000u/g贝肉),在温度40℃-50℃,ph值6.5-7.5,酶解4h-6h,沸水浴灭酶10min,6000
×
g-9000
×
g离心10min-15min,离心上清液经过截留分子量10kda超滤膜超滤,滤过液可不经或再次经过截留分子量3kda超滤膜超滤。将木瓜蛋白酶酶解液小于10kda的活性肽、中性蛋白酶酶解液3kda-10kda的活性肽、胰蛋白酶酶解液小于3kda的活性肽溶液分别浓缩,再经过葡聚糖凝胶g-15分离,弃去最后一个洗脱单峰组分后,分别收集或合并其它各个洗脱峰组分,冻干制得海洋生物肽。
26.优选地,所述的洗脱峰组分为第一洗脱峰组分、第二洗脱峰组分、第三洗脱峰组分、第四洗脱峰组分、第五洗脱峰组分或这几种洗脱峰组分的任意组合。
27.优选地,收集的洗脱峰组分为木瓜蛋白酶酶解液小于10kda的活性肽组分经葡聚糖凝胶g-15分离后收集的洗脱峰组分(例如实施例1中马氏珠母贝活性肽、波纹巴非蛤活性肽、扇贝活性肽),其促进细胞增殖与皮肤创伤修复功效显著。
28.优选地,收集的洗脱峰组分为中性蛋白酶酶解液3kda-10kda的活性肽组分经葡聚糖凝胶g-15分离后收集的洗脱峰组分(例如实施例2中n1分离组分f1-f6以及实施例3中n1f1、n1f2)时,其促进细胞增殖与皮肤创伤修复功效显著。
29.优选地,收集的洗脱峰组分为胰蛋白酶酶解液小于3kda的活性肽组分经葡聚糖凝胶g-15分离后收集的洗脱峰组分(例如实施例4中t2f1以及实施例5中t2分离组分f1-f5)时,其促进细胞增殖与皮肤创伤修复功效显著。
30.另一方面,本发明提供了一种可有效促进细胞增殖与皮肤创伤修复的海洋生物肽的应用。其最低有效剂量为100μg/ml。
31.作为一种可选的实施方案,海洋生物肽可用于促进皮肤创伤修复。
32.在本发明的一种优选的实施方案中,海洋生物肽可用于药品中;优选地,该海洋生物肽尤其适用于可有效修复皮肤创伤的药品中,所述的药品剂型包括洗剂、软膏剂、酊剂、擦剂、醑剂、粉剂、油剂、糊剂、硬膏剂、涂膜剂、气雾剂等。当用于药品中时,海洋生物肽在药品中的质量分数为0.01%~2.5%。
33.在本发明的一种优选的实施方案中,海洋生物肽还可用于医用生物材料中;优选地,该海洋生物肽尤其适用于可有效修复皮肤创伤的医用生物材料中,所述的医用生物材料剂型包括洗剂、溶液、敷料、软膏等,所述的敷料类型包括薄膜、水胶体、水凝胶、海绵、喷雾等。当用于医用生物材料中时,海洋生物肽在医用生物材料中的质量分数为0.8%~2.5%。
34.在本发明的一种优选的实施方案中,海洋生物肽可用于化妆品中;优选地,该海洋生物肽尤其适用于可有效促进皮肤创伤修复的化妆品中,所述的化妆品剂型包括膏霜、乳液、凝胶、啫喱、水剂、喷雾等。当用于化妆品中时,海洋生物肽在化妆品中的质量分数为0.05%~1.0%。
35.值得一提的是,本发明提供的海洋生物肽作为功能性成分,其不会引起皮肤过敏,还可明显减轻炎症反应、促进细胞增殖与皮肤创伤修复。因此,当本发明海洋生物肽应用于药品、医用生物材料或化妆品中时,对于医药原料、医用生物材料原料、化妆品原料的种类、用量、制备工艺等的选择较为宽泛。在医药、医用生物材料、化妆品中所使用的所有成分应是皮肤可接受且不影响本发明原有海洋生物肽的性能,即当与人的皮肤接触时或者与其他组分配伍时,不会导致不适当的毒性、不相容性、不稳定性和变应性反应等。
36.本发明的解决方案是基于发明人对皮肤创伤修复机制、海洋生物肽构效关系等的了解,结合现代药理学、医用生物材料和化妆品的研究成果,通过大量创造性实验,寻找、挖掘、制备并优选出与皮肤相容性好、无致敏性,且具有显著促进皮肤创伤修复功效的海洋生物肽。
37.本发明具有如下突出的有益效果:
38.(1)挖掘海洋生物肽促进皮肤创伤修复功效。从众多海洋贝类中,优选出马氏珠母贝、波纹巴非蛤与扇贝,并选取鲜活贝类软体部,利用蛋白酶酶解、超滤、葡聚糖凝胶分离技术,制备获得海洋生物肽。该活性肽可迅速渗入皮肤表层,发挥促进细胞增殖与创伤修复等多重功效。本发明海洋生物肽在极低剂量(50μg/ml)下,仍能显著促进细胞增殖与创伤修复。
39.(2)本发明的海洋生物肽的制备工艺简单、成本低廉、绿色环保、生产周期短,适用于大批量工业生产,具有极大的应用前景。根据海洋贝类组成结构、蛋白酶专一性及作用位点等特点,从众多蛋白酶中,优选出木瓜蛋白酶、中性蛋白酶、胰蛋白酶,将海洋贝类软体部进行定向酶解,酶解液再经过截留分子量10kda和/或3kda超滤膜处理,可将水溶性差、分子量大、无显著促进细胞增殖活性的成分(可能含盐类、游离氨基酸、脂肪酸等)剔除,使获得的活性肽生理功效更好,排放的环境污染物也极少。
40.(3)本发明的海洋生物肽水溶性与皮肤相容性好、不引起皮肤刺激、不致敏且功效显著,可在生物医药、医用生物材料、化妆品中广泛应用。通过葡聚糖凝胶g-15分离,将分子量更小、活性差的洗脱成分剔除,可使活性肽进一步高度富集,在提高生理功效的同时,大幅减少其用量,进而有效降低在生物医药、医用生物材料、化妆品配制过程中对该海洋生物肽的稳定性、配伍性等的要求和操作难度。
41.(4)本发明通过建立的细胞活性实验模型,对制备的各个活性肽组分进行高通量活性评价,最终优选出的海洋生物肽在细胞和动物水平均表现出优异的促进皮肤创伤修复功效,说明利用该细胞实验模型可精准指导本发明海洋生物肽的定向分离与高度富集。
附图说明
42.图1是实施例2中n1(3kda-10kda)组分葡聚糖凝胶g-15分离图谱。
43.图2是实施例2中n2(小于3kda)组分葡聚糖凝胶g-15分离图谱。
44.图3是实施例3中n1(3kda-10kda)组分葡聚糖凝胶g-15分离图谱。
45.图4是实施例3中n1(3kda-10kda)分离组分对hacat细胞活性的影响(与空白对照相比,*p《0.05,**p《0.01)。
46.图5是实施例4中t1(3kda-10kda)组分葡聚糖凝胶g-15分离图谱。
47.图6是实施例4中t2(小于3kda)组分葡聚糖凝胶g-15分离图谱。
48.图7是实施例4中t1(3kda-10kda)分离组分、t2(小于3kda)分离组分对hacat细胞活性的影响(与空白对照相比,*p《0.05,**p《0.01)。。
49.图8是实施例6中n1(3kda-10kda)f4的rp-hplc分离图谱。
50.图9是实施例6中n1(3kda-10kda)f4的rp-hplc分离组分对hacat细胞活性的影响(与空白对照相比,*p《0.05,**p《0.01)。
51.图10是实施例8中海洋生物肽给药后第10天创面图片(control:空白对照;hg:马氏珠母贝活性肽;hl:波纹巴非蛤活性肽;hm:扇贝活性肽)(与空白对照相比,*p《0.05,**p《0.01)。
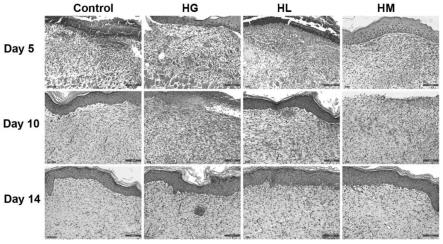
52.图11是实施例8中海洋生物肽给药后皮肤组织he染色(control:空白对照;hg:马氏珠母贝活性肽;hl:波纹巴非蛤活性肽;hm:扇贝活性肽)
53.图12是实施例8中海洋生物肽给药后皮肤组织rt-qpcr分析(control:空白对照;hg:马氏珠母贝活性肽;hl:波纹巴非蛤活性肽;hm:扇贝活性肽)(与空白对照相比,*p《0.05,**p《0.01)。
具体实施方式
54.以下结合附图对本发明作进一步说明,但本发明的实施方式不局限于以下的实施例介绍,凡依照本发明的方法所作的等同的变化或变通都应视为本发明保护的范畴。以下所用原料,除特殊指明外,均为市售。
55.实施例1
56.取符合我国相关海产品使用标准的鲜活马氏珠母贝去壳,将软体部匀浆,并加入3.4倍体积蒸馏水、木瓜蛋白酶(4000u/g贝肉),温度50℃、ph6.5,酶解6h。酶解液煮沸10min,7000
×
g离心10min。上清液依次通过截留分子量10kda的超滤膜超滤。将超滤滤过液(小于10kda活性肽组分)浓缩至浓度约100mg/ml,再经葡聚糖凝胶g-15(100
×
4.0cm)分离:上样量15ml,流动相为蒸馏水,流速10ml/min,检测波长220nm、280nm。合并除最后一个洗脱峰之外的洗脱液组分,浓缩、冻干,制得马氏珠母贝活性肽(hg)。按照同样的方法,分别制备获得波纹巴非蛤活性肽(hl)、扇贝活性肽(hm)。
57.利用体外细胞实验(具体实验方法见实施例7),对这些活性肽(hg、hl、hm)进行功效评价。研究发现,在各给药剂量(50μg/ml-1600μg/ml)下,hg、hl、hm均可显著促进hacat细胞增殖(与空白对照相比,有显著差异)。其中,在较低浓度50μg/ml时,hg、hl、hm即可使hacat细胞活性显著提高10.93%(p《0.05)、11.02%(p《0.05)、11.21%(p《0.05)。
58.将马氏珠母贝活性肽溶液(含hg 2%,溶剂为生理盐水,0.22μm过滤除菌)、波纹巴非蛤活性肽溶液(含hl2%,溶剂为生理盐水,0.22μm过滤除菌)、扇贝活性肽溶液(含hm 2%,溶剂为生理盐水,0.22μm过滤除菌)分别涂于深ⅱ度烧伤、ⅲ度烧伤切削痂创面,可减少病原菌(铜绿假单胞菌、鲍曼不动杆菌、金黄色葡萄球菌等)感染,减轻炎症反应,有效防止创面加深,并促进新生组织形成,提高创面愈合速度和愈合质量,具有显著的促进烧伤创面再生与修复功效。
59.实施例2
60.取符合我国相关海产品使用标准的鲜活栉孔扇贝去壳,将软体部匀浆,并加入3倍体积pbs缓冲液(0.01m,ph7.5)、中性蛋白酶(3000u/g贝肉),温度45℃,酶解5h。酶解液煮沸
10min,7000
×
g离心12min。上清液依次通过截留分子量10kda、3kda的超滤膜超滤。其中,3kda-10kda活性肽组分记为n1,小于3kda活性肽组分记为n2。将n1、n2组分分别浓缩至浓度约100mg/ml,再经葡聚糖凝胶g-15(100
×
4.0cm)分离:上样量15ml,流动相为蒸馏水,流速10ml/min,检测波长220nm、280nm。
61.将n1(3kda-10kda)组分经葡聚糖凝胶g-15洗脱(图1),分别收集分离组分f1、f2、f3、f4、f5、f6、f7,浓缩、冻干。同样地,将n2(小于3kda)组分经葡聚糖凝胶g-15洗脱(图2),分别收集分离组分f1、f2、f3、f4、f5、f6,浓缩、冻干。
62.利用体外细胞实验(具体实验方法见实施例7),对获得的这13个分离组分进行功效评价。研究发现,与空白对照相比,n1分离组分f7、n2分离组分f6给药后,细胞活性显著降低(有明显细胞毒性);n2分离组分f1-f5处理组细胞活性变化不明显(无促进细胞增殖功效)。而n1(3kda-10kda)分离组分f1-f6在较低浓度时(50μg/ml),即可使hacat细胞活性提升明显(与空白对照相比,有显著差异)。
63.由此可见,n1(3kda-10kda)分离组分f1-f6具有显著促进hacat细胞增殖的作用,可将这6个分离组分单独使用,也可进行组合或合并,用于促进细胞增殖与皮肤创伤修复。
64.将n1(3kda-10kda)分离组分f1-f6分别配制成溶液(肽有效剂量为1.5%,溶剂为生理盐水,0.22μm过滤除菌),分别涂于切割损伤、手术缝合创面,可有效减轻炎症反应,促进新生组织形成,提高创面愈合速度和愈合质量,减少瘢痕生成,具有显著的促进切割损伤创面再生与修复功效。
65.实施例3
66.取符合我国相关海产品使用标准的鲜活栉孔扇贝去壳,将软体部匀浆,加入2.5倍体积蒸馏水,调ph值至7.0,加入中性蛋白酶(2000u/g贝肉),温度50℃,酶解5h。酶解液煮沸10min,6000
×
g离心15min。上清液依次通过截留分子量10kda、3kda的超滤膜超滤。其中,3kda-10kda活性肽组分记为n1。将n1组分浓缩至浓度约200mg/ml,再经葡聚糖凝胶g-15(100
×
4.0cm)分离:上样量7ml,流动相为蒸馏水,流速10ml/min,检测波长220nm、280nm。分别收集洗脱组分n1f1、n1f2、n1f3(图3),并浓缩、冻干。
67.利用体外细胞实验(具体实验方法见实施例7),对获得的这3个分离组分进行功效评价(图4)。研究发现,n1f3给药后,细胞活性显著降低(有明显细胞毒性)。而其它2个分离组分(n1f1、n1f2)给药后,细胞活性均有明显提升。其中,n1f1在较低浓度50μg/ml时,即可使hacat细胞活性提高12.31%(p《0.05);n1f2在给药浓度100μg/ml时,可使hacat细胞活性提高20.13%(p《0.01)。
68.由此可见,n1(3kda-10kda)分离组分n1f1、n1f2具有显著促进hacat细胞增殖的作用,可将n1f1、n1f2单独使用,也可进行合并,用于促进细胞增殖与皮肤创伤修复。
69.按以下方法,将n1f1、n1f2分别制备获得海洋生物医用材料(n1f1@海藻酸钙微球/胶原/壳聚糖支架、n1f2@海藻酸钙微球/胶原/壳聚糖支架),并进行功效评价。
70.n1f1@海藻酸钙微球:将海藻酸钠(从上海麦克林生化科技有限公司购得,纯度98%)溶解在蒸馏水中,配制成浓度为2%w/v海藻酸钠溶液,按质量比1:0.05加入n1f1,搅匀制成水相;量取一定体积橄榄油(从上海麦克林生化科技有限公司购得),按1%v/v比例添加吐温80(从上海麦克林生化科技有限公司购得),600rpm搅拌2h,配制成有机相;量取100ml有机相,650rpm搅拌条件下加入20ml水相,750rpm搅拌1h,加入40ml浓度为1%w/v的
氯化钙(从上海麦克林生化科技有限公司购得)溶液,500rpm搅拌1h,再加入10ml异丙酮(天津市富宇化学试剂厂,ar级),400rpm搅拌30min,混合液在6000rpm离心5min,所得沉淀分别用异丙酮、蒸馏水交替洗涤3次,冻干制得。
71.n1f1@海藻酸钙微球/胶原/壳聚糖支架:将胶原溶于浓度为2%w/v的乙酸溶液中,配成浓度为0.015g/ml的胶原溶液;将羧甲基壳聚糖溶于蒸馏水中,配成浓度为0.04g/ml的羧甲基壳聚糖溶液;将胶原溶液、羧甲基壳聚糖溶液按1:1体积比混合,加入n1f1@海藻酸钙微球使其终浓度为0.01g/ml,700rpm磁力搅拌1h,将混合液加入48孔板中,冻干支架脱模后,用edc/nhs溶液(edc浓度0.5mol/l,nhs浓度0.5mol/l)浸泡2h,用蒸馏水洗涤3次,冻干,制得n1f1@海藻酸钙微球/胶原/壳聚糖支架。
72.按同法,制得n1f2@海藻酸钙微球/胶原/壳聚糖支架。
73.分别将n1f1@海藻酸钙微球/胶原/壳聚糖支架、n1f2@海藻酸钙微球/胶原/壳聚糖支架,敷于火器伤(战伤的一种)清创后的创面,可迅速吸收引流创面渗液,为创面提供一个干燥、微酸和低氧环境,减少病原菌(铜绿假单胞菌、鲍曼不动杆菌、金黄色葡萄球菌等)感染,减轻炎症反应,有效防止创面加深,并促进新生组织形成,提高创面愈合速度和愈合质量,具有显著促进火器伤创面再生与修复功效。
74.实施例4
75.取符合我国相关海产品使用标准的鲜活栉孔扇贝去壳,将软体部匀浆,加入3倍体积去离子水,调ph值至7.5,加入胰蛋白酶(3000u/g贝肉),温度40℃,酶解4h。酶解液煮沸10min,8000
×
g离心12min。上清液依次通过截留分子量10kda、3kda的超滤膜超滤。其中,3kda-10kda活性肽组分记为t1,小于3kda活性肽组分记为t2。将t1、t2组分分别浓缩至浓度约100mg/ml,再经葡聚糖凝胶g-15(100
×
4.0cm)分离:上样量10ml,流动相为蒸馏水,流速10ml/min,检测波长220nm、280nm。将t1(3kda-10kda)组分经葡聚糖凝胶g-15分离,分别收集t1f1、t1f2、t1f3(图5),并浓缩、冻干。同样地,将t2(小于3kda)组分经葡聚糖凝胶g-15分离,分别收集t2f1、t2f2(图6),并浓缩、冻干。
76.利用体外细胞实验(具体实验方法见实施例7),对获得的这5个分离组分进行功效评价。研究发现,t1f3、t2f2具有明显细胞毒性,给药后细胞活性显著降低(与空白对照相比,有显著差异);t1f1、t1f2给药后细胞活性变化不大(与空白对照相比,无显著差异)。而t2f1在较低浓度100μg/ml时,则可使hacat细胞活性显著提高10.12%(p《0.01)。
77.由此可见,t2(小于3kda)分离组分t2f1具有显著促进hacat细胞增殖的作用,可用于促进皮肤创伤修复。
78.按照实施例3中医用生物材料的制备方法,制得t2f1@海藻酸钙微球/胶原/壳聚糖支架,敷于糖尿病性溃疡创面,可为创面提供一个清洁、微酸和低氧环境,有效保护溃疡避免损伤和继发感染,并改善局部缺血和水肿状况,促进新生组织形成,提高创面愈合速度和愈合质量,具有较好促进糖尿病性溃疡创面再生与修复功效。
79.实施例5
80.按照实施例4的制备方法,制备获得t2(小于3kda)组分,将其浓缩至浓度约150mg/ml,再经葡聚糖凝胶g-15(100
×
4.0cm)分离:上样量8ml,流动相为蒸馏水,流速10ml/min,检测波长220nm、280nm,依次收集第一到第六洗脱峰组分,浓缩、冻干,分别制得t2(小于3kda)组分,将其浓缩至浓度约150mg/ml,再经葡聚糖凝胶g-15(100
×
4.0cm)分离:上样量
8ml,t2(小于3kda)分离组分f1、f2、f3、f4、f5、f6。
81.利用体外细胞实验(具体实验方法见实施例7),对获得的这6个分离组分进行功效评价。研究发现,t2(小于3kda)分离组分f6具有明显细胞毒性,给药后细胞活性显著降低(与空白对照相比,有显著差异);而t2(小于3kda)分离组分f1-f5在较低浓度时(50μg/ml),即可使hacat细胞活性提升明显(与空白对照相比,有显著差异)。
82.由此可见,t2(小于3kda)分离组分f1-f5具有显著促进hacat细胞增殖的作用,可将这5个分离组分单独使用,也可进行组合或合并,用于促进细胞增殖与皮肤创伤修复。
83.将t2(小于3kda)分离组分f1-f5分别配制成溶液(有效剂量为0.8%,溶剂为生理盐水,0.22μm过滤除菌),涂于深ⅱ度烫伤、ⅲ度烫伤创面,可减少病原菌(铜绿假单胞菌、鲍曼不动杆菌、金黄色葡萄球菌等)感染,减轻炎症反应,有效防止创面加深,并促进新生组织形成,提高创面愈合速度和愈合质量,具有显著促进烫伤创面再生与修复功效。
84.实施例6
85.采用rp-hplc技术,可将海洋生物肽进一步分离和精制。
86.利用高效液相色谱仪agilent 1260,结合ymc triart c18柱(250
×
10mm,s-5μm,12nm),进行活性肽的分离与精制。流动相a:水(含0.1%甲酸);流动相b:乙腈(含0.1%甲酸),温度40℃。样品浓度150mg/ml,上样量50μl,流速2.5ml/min,检测波长200nm、220nm、254nm、280nm。
87.因本发明海洋生物肽各个组分的洗脱条件略有不同,现以实施例2中n1f4组分为例,加以说明。洗脱条件为:0-7min,100%a;7-37min,100%-80%a;37-44min,80%-65%a;44-50min,65%-30%a;50-51min,30%-10%a;51-56min,10%a;56-58min,10%-100%a。在该洗脱条件下,可分别收集6个组分:f1(4-7min)、f2(7-22min)、f3(22-37min)、f4(37-44min)、f5(44-50min)、f6(50-56min)。将各个组分分别浓缩、冻干,制得n1(3kda-10kda)f4分离组分f1、f2、f3、f4、f5、f6(图8)。
88.利用体外细胞实验(具体实验方法见实施例7),对制备的这6个组分(f1、f2、f3、f4、f5、f6)进行功效评价(图9)。研究发现,虽然f1、f5、f6在各浓度(37.5μg/ml-600μg/ml)下可显著提升hacat细胞的活性(与空白对照相比,有显著差异),但其细胞活性仍低于分离前的n1f4组分。
89.由此可见,n1f4组分可直接用于促进细胞增殖与皮肤创伤修复,而无需经rp-hplc技术进一步分离和精制。
90.按照实施例3中医用生物材料的制备方法,制得n1f4@海藻酸钙微球/胶原/壳聚糖支架,敷于火器伤合并海水浸泡损伤的清创后的创面,可快速吸收伤口渗液,为创面提供一个干燥、清洁、微酸和低氧环境,保护创面减少病原菌(创伤弧菌、铜绿假单胞菌、鲍曼不动杆菌、金黄色葡萄球菌等)感染,减轻炎症反应,有效防止创面进一步加深,改善血液循环并促进新生组织形成,提高创面愈合速度和愈合质量,具有促进火器伤合并海水浸泡损伤创面再生与修复功效。
91.实施例7
92.利用离体细胞实验,对各实施例中制备获得的海洋生物肽促进细胞增殖活性进行评价。
93.采用cck-8法测定细胞活性:将密度为6
×
104个/ml的hacat细胞悬液接种于96孔
培养板中(100μl/孔),置37℃、5%co2培养箱中培养24h。每孔吸弃50μl,样品组加入相应浓度样品溶液(终浓度分别为50、100、200、400、800、1600μg/ml,需经孔径0.22μm针头式过滤器除菌),50μl/孔。空白对照组则加入dmem完全培养液,50μl/孔。各组置于co2培养箱中继续培养24h后,采用荧光倒置相差显微镜ckx41(日本奥林巴斯公司),观察细胞形态。随后,每孔加入10μl cck-8溶液,继续培养4h,采用酶标仪multiskan go(thermo fisher scientific公司),测定每孔吸光度,测定波长450nm,参考波长650nm,每组6个平行孔。
94.按照上述实验步骤,将本发明实施例中制备获得的各组分进行功效评价。研究发现,经葡聚糖凝胶g-15分离获得的最后一个洗脱单峰组分:如实施例2中n1分离组分f7、实施例3中n1f3、实施例4中t2f2、实施例5中t2分离组分f6,给药后细胞活性显著降低(有明显细胞毒性);而其它分离组分:如实施例2中n1分离组分f1-f6、实施例3中n1f1、n1f2,实施例4中t2f1、实施例5中t2分离组分f1-f5,给药后细胞活性提升明显(与空白对照相比,有显著差异)。
95.由此可见,在弃去葡聚糖凝胶g-15最后一个洗脱单峰组分后,制备获得的海洋生物肽可有效促进细胞增殖与皮肤创伤修复。
96.实施例8
97.将本发明制备的海洋生物肽(以实施例1中的马氏珠母贝活性肽hg、波纹巴非蛤活性肽hl、扇贝活性肽hm为例)进行皮肤创伤修复功效评价(以全层皮肤缺损模型为例)。
98.软膏基质:peg400(400ml)、peg4000(50g)、司盘40(1ml)、蒸馏水(9ml),60℃热水浴溶解、均质而成。
99.马氏珠母贝活性肽(hg)软膏:含2%马氏珠母贝活性肽,其余为软膏基质。
100.波纹巴非蛤活性肽(hl)软膏:含2%波纹巴非蛤活性肽,其余为软膏基质。
101.扇贝活性肽(hm)软膏:含2%扇贝活性肽,其余为软膏基质。
102.(1)全层皮肤缺损造模:spf级6-8周龄雄性balb/c小鼠72只,购自广东省医学实验动物中心。动物随机分为4组,空白对照组、hg、hl、hm,每组18只小鼠。将小鼠麻醉后去毛,背部划全层皮肤伤口约1.5
×
1.5cm。
103.(2)给药:空白对照组、海洋生物肽处理组(hg、hl、hm)每天分别给药1次(约0.1g软膏/只小鼠),连续给药14天。其中,空白对照组给药软膏基质,海洋生物肽处理组给药相应的软膏样品。
104.(3)创面拍照(测算愈合率):每天观察记录伤口愈合情况,每周2次进行背部伤口处拍照,视野、光线、图片放大倍数保持一致,使用ipp6.0软件对创伤面积进行测算,计算伤口愈合率。分别在第5天,10天和14天,取6只小鼠进行安乐死,剪取创缘处皮肤(尽量选择相同位置的皮肤),进行如下检测。
105.(4)组织病理学检测:取皮肤组织石蜡切片,进行he染色,显微镜镜检并采集图像,利用image j软件测算皮肤组织表皮层、真皮层厚度以及炎性评分。
106.(5)rt-qpcr检测:取皮肤组织,提取mrna(按照相应提取试剂盒说明书操作)后,分别采用rt-qpcr技术,结合镜检、图像采集,检测皮肤组织中转化生长因子tgf-β1、纤维连接蛋白fibronectin、血管内皮生长因子vegf、胶原蛋白collagen-i和表皮生长因子egf mrna表达情况。
107.第10天皮肤伤口愈合率见图10,组织病理学检测见图11,rt-qpcr检测结果见图
12。
108.研究发现,马氏珠母贝活性肽、波纹巴非蛤活性肽、扇贝活性肽可有效促进细胞增殖、迁移,胶原蛋白和弹性纤维生成,并促进毛细血管新生,还可大幅减少炎症因子生成,加速创面收缩,促进再上皮化及毛囊附属器再生,减少瘢痕形成,有效提高愈合速度和愈合质量。
109.与空白对照组相比,马氏珠母贝活性肽(hg)、波纹巴非蛤活性肽(hl)、扇贝活性肽(hm)处理组,在第5天时皮肤组织中tgf-β1、fibronectin、vegf、collagen-i、egf mrna表达水平显著升高;在第10天时,各处理组伤口愈合率显著提高26.07%(p《0.01)、20.70%(p《0.01)、22.32%(p《0.01)。
110.由此可见,本发明制备的海洋生物肽具有显著的促进皮肤创伤修复功效。
111.值得注意的是,本发明的实施例2-5制备的海洋生物肽,在皮肤创伤修复功效评价中,可达到与实施例1相当的水平,其促进伤口愈合和减少瘢痕增生的水平相当。
112.对比例1
113.与实施例3相比,除了将鲜活贝类软体部替换为外套膜外,其它与实施例3相同。
114.利用体外细胞实验(具体实验方法见实施例7),将本实施方式制备的外套膜活性肽进行功效评价。研究发现,在浓度50μg/ml-400μg/ml时,外套膜活性肽处理组细胞活性无明显变化(与空白对照相比,无显著差异)。而本发明制备的n1f1在50μg/ml时即可使hacat细胞活性提高12.31%(与空白对照相比,p《0.05);本发明制备的n1f2在100μg/ml时可使hacat细胞活性提高20.13%(与空白对照相比,p《0.01)。
115.按照实施例3中的方法,将外套膜活性肽制得医用生物材料,敷于火器伤(战伤的一种)清创后的创面,虽有一定的促进新生组织形成功效,但其提高创面愈合速度、改善愈合质量不十分明显。由此可见,本实施方式制备的外套膜活性肽在促进皮肤创伤修复功效方面明显不如实施例3制备的海洋生物肽。
116.对比例2
117.与实施例4相比,除了在酶解前先煮沸10min,酶解过程中加入超声处理外,其它与实施例4相同。
118.利用体外细胞实验(具体实验方法见实施例7),将本实施方式制备的活性肽进行功效评价。研究发现,在浓度50μg/ml-800μg/ml时,活性肽处理组细胞活性无明显变化(与空白对照相比,无显著差异)。而本发明制备的t2f1在较低浓度100μg/ml时,则可使hacat细胞活性显著提高10.12%(与空白对照相比,p《0.01)。
119.按照实施例4中的方法,将活性肽制得海洋医用生物材料,敷于糖尿病性溃疡创面,其改善局部缺血和水肿状况、促进新生组织形成功效,提高创面愈合速度、改善愈合质量均不明显。由此可见,本实施方式制备的活性肽在促进皮肤创伤修复功效方面明显不如实施例4制备的海洋生物肽。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。