1.本发明涉及生物技术领域,具体涉及一种高通量肾脏类器官的诱导分化方法。
背景技术:
2.肾脏疾病是一种全球性的健康威胁,全球范围内约有7.5亿人受到肾脏疾病的影响,肾脏疾病的发生往往会给患者造成了沉重的身体、心理以及经济负担。由于肾脏结构复杂,因此导致体外肾脏疾病研究模型的开发进展缓慢,影响了肾脏病相关病理机制以及药物的研究。
3.相关技术中,基于干细胞分化来源的肾脏类器官逐渐成为一种重要的肾脏生理及疾病研究模型。自2014年科学家首次报道肾脏类器官的建立方法,目前已能成功实现应用在肾小球及肾小管疾病研究工作中。但目前的分化方法仍存在不少问题与缺陷,主要主要问题包括两方面:第一个方面是肾脏类器官分化质量较差,现有的分化方法存在着分化不彻底、分化效率不高等问题。另一方面是分化成本过高,现有分化方法大部分使用的诱导物是价格昂贵的生长因子,这导致生产成本高昂,难以真正意义上的实现普及化使用。而这些问题综合起来极大的限制了干细胞来源的内胚层等关键性组织或器官等的大规模生产。因此,迫切需求一种效率高、成本低的分化方法。
技术实现要素:
4.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种高通量人肾脏类器官诱导分化方法,该方法能够解决现有分化方法分化成本高、分化质量低、分化不彻底、分化效率不高等问题,操作简单且易于实施,构建效果稳定,可实现高通量大规模培养,进而获得更成熟的且具有肾脏主要结构和功能细胞的类器官,具有极高的实用价值。
5.本发明的第一个方面,提供一种人肾脏类器官诱导分化方法,包括如下步骤:
6.(1)向人诱导多能干细胞中加入含有rock通路抑制剂的培养基a处理18~24h;
7.(2)更换为含有gsk-3抑制剂的培养基b处理1~4天;
8.(3)更换为含有gsk-3抑制剂、fgf-9和heparin的培养基b处理1~3天;
9.(4)消化细胞得到细胞悬液,进行3d培养,得到类器官球体;
10.(5)使用含有gsk-3抑制剂的培养基b处理50~70min,转移至培养器中使用含有fgf-9和heparin的培养基b培养1~6天;
11.(6)更换为无添加的培养基b培养1~10天,得到成熟的肾脏类器官。
12.在本发明的一些实施方式中,所述rock通路抑制剂包括但不限于y-27632。
13.在本发明的一些实施方式中,所述rock通路抑制剂在(1)中的终浓度为9~11μm。
14.在本发明的一些实施方式中,所述rock通路抑制剂在(1)中的终浓度为10μm。
15.在本发明的一些实施方式中,所述gsk-3抑制剂包括但不限于ly2090314、chir-98014、bio-acetoxime、azd2858、sar502250、chir99021、chir-99021trihydrochloride中
的至少一种。
16.在本发明的一些实施方式中,所述gsk-3抑制剂为chir99021。
17.在本发明的一些实施方式中,所述gsk-3抑制剂在(2)和(3)中的终浓度为7~9μm。
18.在本发明的一些实施方式中,所述gsk-3抑制剂在(2)和(3)中的终浓度为8μm。
19.在本发明的一些实施方式中,所述fgf-9在(3)和(5)中的终浓度为180~220ng/ml。
20.在本发明的一些实施方式中,所述fgf-9在(3)和(5)中的终浓度为200ng/ml。
21.在本发明的一些实施方式中,所述heparin在(3)和(5)中的终浓度为0.8~1.2μg/ml。
22.在本发明的一些实施方式中,所述heparin在(3)和(5)中的终浓度为1.0μg/ml。
23.在本发明的一些实施方式中,(1)中细胞的接种量为0.5
×
105~1.0
×
105细胞/9~10cm2。
24.在本发明中,细胞的培养容器主要为6孔板,6孔板的底面积约为9.6cm2,液体加入体积约为2~2.5ml。在本发明中,发明人通过试验验证发现,干细胞铺板密度对于人肾脏类器官诱导分化效果具有实质性影响,主要原因在于在肾脏类器官的分化过程中,由于第一阶段诱导分化过程开始后(即第0~7天)不进行消化传代操作,此过程中细胞又处于不断的增殖过程,容易在该阶段后期造成细胞增殖过多而堆积造成细胞营养不足、状态差、甚至挤出死亡等问题。因此起始的干细胞接种密度对于诱导分化的效果尤其重要。而发明人发现基于6孔板,0.5
×
105~1.0
×
105细胞/孔的密度相对诱导分化效果较好。
25.当然,基于培养容器的改变,0.5
×
105~1.0
×
105细胞/9~10cm2可换算为0.5
×
105~1.0
×
105细胞/2~2.5ml等其他表示方式。
26.在本发明的一些实施方式中,(1)中细胞的接种量为0.6
×
105细胞/9~10cm2。
27.当培养容器为6孔板时,(1)中细胞的接种量为0.6
×
105细胞/孔。
28.在本发明中,当接种密度为0.6
×
105细胞/孔时,第7天细胞密度刚好接近铺满培养板,约为95%左右,细胞轮廓清晰,可以观察到细胞触脚,分化至第17天时有类器官形成,小管结构明显,数量丰富,结构紧凑。
29.在本发明的一些实施方式中,(1)中所述人诱导多能干细胞包括人尿源诱导多能干细胞。
30.在本发明中,发明人分别使用人尿源诱导多能干细胞、人皮肤成纤维多能干细胞和人脐血间充质多能干细胞作为测试对象进行对比。发现在相同分化条件下,人尿源诱导多能干细胞分化出结构均匀、小管聚集紧凑规则、小管数量丰富的肾脏类器官。间充质多能干细胞同样可以分化得到具有部分特征的肾脏类器官,虽然有小管样结构,但小管数量明显少于尿源干细胞分化的效果,而且其结构也较前者更为松散。而皮肤成纤维干细胞分化得到的肾脏类器官边缘细胞未见明显的小管结构,形成紧实的团块,也未见明显的其他分化细胞。进一步基于免疫荧光鉴定结果显示,人尿源干细胞分化得到的人肾脏类器官特异性高表达肾脏小管细胞标志蛋白ltl、集合管细胞标志蛋白gata3、足细胞标志蛋白synaptopodin。而另外两种来源的干细胞只能表达小管细胞标志蛋白ltl,而表达gata3和synaptopodin的水平非常低,说明其分化不完全,说明本发明中的方法主要针对于人诱导多能干细胞,尤其是人尿源诱导多能干细胞分化成人肾脏类器官。
31.在本发明的一些实施方式中,(4)中所述3d培养的步骤为:使用v型底96孔培养板对细胞进行高通量培养,并辅助机械刺激。
32.在本发明的一些实施方式中,所述机械刺激的强度为50~150rpm。
33.在本发明的一些实施方式中,所述机械刺激的强度为65~100rpm。
34.在本发明的一些实施方式中,机械刺激的时间为20~50h。
35.在本发明的一些实施方式中,机械刺激的时间为24~48h。
36.在本发明中,发明人发现通过在3d悬浮培养阶段加入一定程度的机械刺激能有效促进类器官球体增殖,其主要原因在于:在细胞逐渐形成球体时,一定程度的机械刺激能够增加球体从培养基中获得营养成分。试验验证发现在接种同样的细胞条件下,65rpm机械刺激组球体体积显著大于静态培养的球体,机械刺激组的球体长径和短径分别是静态对照组的近2倍。
37.在本发明中,发明人打破常规方法中在获得细胞悬液后直接转移至transwell培养板上直接培养的操作,采用先接种于v型底96孔培养板进行高通量3d悬浮培养22~26h后,再转移至transwell培养板上培养。而该步骤使得分化阶段类器官的增殖效果有了显著提高,效率显著提高,类器官均一性好,在分化第16天时肾脏类器官的长径和短径分别生长为第9天的3.56
±
0.69和2.57
±
0.76倍,而常规培养下的长径和短径并不会产生显著增加。
38.在本发明的一些实施方式中,(5)中所述培养器提前使用基质胶包被。
39.在本发明的一些实施方式中,包被时间为25~35min。
40.在本发明的一些实施方式中,包被时间为30min。
41.在本发明的一些实施方式中,包被温度为35~37℃
42.在本发明的一些实施方式中,包被温度为37℃。
43.在本发明中,发明人发现在基质胶提前包被的实验条件下,第15天肾脏类器官显著大于未包被的类器官,且包被条件下的小管分化的形态和丰富程度也明显高于不包被,这可能是因为基质胶包被后提高了分化过程中细胞的营养水平,使细胞生长、分化效果更好。
44.在本发明的一些实施方式中,(5)中所述培养器包括但不限于transwell板。
45.在本发明的一些实施方式中,培养基a为多能干细胞培养基。
46.在本发明的一些实施方式中,培养基a包括但不限于mtesr1培养基。
47.在本发明的一些实施方式中,培养基b为贴壁培养基质或细胞分化培养基。
48.在本发明的一些实施方式中,培养基b包括但不限于stemdiff apel2培养基。
49.在本发明的一些实施方式中,所述人肾脏类器官诱导分化方法具体为:
50.试验第0天,取人诱导多能干细胞以0.5
×
105~1.0
×
105细胞/9~10cm2接种至2~2.5ml含有rock通路抑制剂y-27632的的mtesr1培养基中培养18~24h;
51.试验第1~4天,将培养基更换为添加有chir99021的stemdiff apel2培养基;
52.试验第5~7天,将培养基更换为添加有chir99021、fgf-9和heparin的stemdiff apel2培养基使其进一步分化;
53.试验第8天,消化细胞,加入含chir99021、fgf-9和heparin的stemdiff apel2培养基重悬,得到细胞悬液,转移至v型底96孔培养板中进行高通量3d培养,并且将培养板放在水平摇床进行机械刺激,转速为65rpm,在37℃,5%co2培养箱中培养18~24h,使细胞聚合
成球体,得到高通量的类器官球体;
54.试验第9~14天,将培养基更换为含有chir99021的stemdiff apel2培养基对类器官球体处理50~70min,转移至培养器中使用含有fgf-9和heparin的培养基b培养1~6天;
55.试验第15天,更换新的stemdiff apel2培养基继续培养1~10天,得到成熟的肾脏类器官;
56.其中,chir99021的终浓度均为7~9μm,fgf-9的终浓度均为180~220ng/ml,heparin的终浓度均为0.8~1.2μg/ml。
57.在本发明的一些实施方式中,所述成熟的肾脏类器官在试验第24天获得。
58.在本发明中,本发明中的方法基于最优培养条件(干细胞种类、最佳接种密度、包被方式、机械力刺激、培养天数等)获得了一种高通量的诱导肾脏类器官分化方法,能在短时间内稳定获得高品质的肾脏类器官。
59.本发明的第二个方面,提供本发明第一个方面所述的人肾脏类器官诱导分化方法在药物筛选、毒理学试验、天然免疫研究或病毒感染方面的应用。
60.本发明中的方法能够高效获得成熟的肾脏类器官以用于常规中肾脏类器官相关研究和应用,包括药物筛选、毒理学试验、天然免疫研究或病毒感染等方面。
61.本发明的有益效果是:
62.1.本发明中的高通量人肾脏类器官诱导分化方法操作简单,针对性强,通过明确的干细胞种类选择、铺板密度、分化时间、机械刺激、基质包被等操作有效的提高了诱导分化的效率,显著提高了肾脏类器官的分化稳定性,降低了分化成熟所需时间,增加了肾脏类器官的增殖效率,解决了常规方法中分化效率参差不齐,操作冗杂的问题。
63.2.基于本发明中的方法高效构建肾脏类器官,且分化效果好,得到的肾脏类器官品质佳,相关标志无如肾小管标志蛋白ltl、集合管标志蛋白gata3、足细胞标志蛋白synaptopodin均可被检测到,从而有助于诸如药物筛选,毒理学试验,天然免疫研究,病毒感染试验的研究。
附图说明
64.图1为本发明实施例中的干细胞分化进程流程图。
65.图2为本发明实施例中的各个阶段的诱导物、细胞形态示意图。
66.图3为本发明多能干细胞分化得到成熟肾脏类器官标志物免疫荧光检测结果。
67.图4为不同来源多能干细胞分化成肾脏类器官的结构形态对比。
68.图5为不同来源多能干细胞分化成肾脏类器官标志物表达效果对比。
69.图6为分化第0天不同干细胞接种密度对分化成肾脏类器官的形态对比。
70.图7为分化第8天不同干细胞接种形式对肾脏类器官分化过程中增殖效果对比。
71.图8为分化第8天施加机械刺激对肾脏类器官增殖效果影响对比,其中,a为实物图,b为柱形统计图,实验组与对照组比较,*p<0.05,**p<0.01,***p<0.001,ns代表无统计学差异。
72.图9为分化第9天后基质胶包被对肾脏类器官增殖效果影响对比,a为实物图,b为柱形统计图,实验组与对照组比较,*p<0.05,**p<0.01,***p<0.001,ns代表无统计学差异。
73.图10为不同分化时长对肾脏类器官成熟程度影响对比。
具体实施方式
74.为了使本发明的发明目的、技术方案及其技术效果更加清晰,以下结合具体实施方式,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的具体实施方式仅仅是为了解释本发明,并非为了限定本发明。
75.所使用的实验材料和试剂,若无特别说明,均为常规可从商业途径所获得的耗材和试剂。
76.实施例1高通量肾脏类器官的诱导分化方法
77.在本实施例中,高通量肾脏类器官的诱导分化方法的具体步骤如下:
78.试验第0天,取无异常的人诱导多能干细胞,并以0.6
×
105细胞/孔的量接种至6孔板中,加入2ml含有rock通路抑制剂y-27632的的mtesr1培养基,放置37℃,5%co2培养箱孵育1天,其中,y-27632的终浓度为10μm。
79.试验第1~4天,将培养基更换为2ml添加有chir99021的stemdiff apel2培养基,开始诱导分化,其中,chir99021的终浓度为8μm。
80.试验第5~7天,将培养基更换为2ml添加有chir99021、fgf-9和heparin的stemdiff apel2培养基使其进一步分化,其中,chir99021的终浓度为8μm,fgf-9的终浓度为200ng/ml,heparin的终浓度为1μg/ml。
81.试验第8天,使用1ml accutase对细胞进行消化处理,1000rpm离心5min,加入1ml的含chir99021、fgf-9和heparin的stemdiff apel2培养基重悬,得到细胞悬液。计数。取9000个细胞转移至v型底96孔培养板中进行高通量3d培养,并且将培养板放在水平摇床进行机械刺激,转速为65rpm,在37℃,5%co2培养箱中培养24h,使细胞聚合成球体,得到高通量的类器官球体。
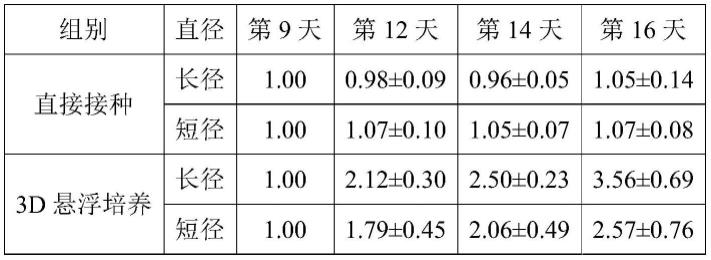
82.试验第9~14天,弃去v型底96孔培养板中的培养基,加入0.2ml含有chir99021(chir99021的终浓度为5μm)的stemdiff apel2培养基对类器官球体处理60分钟。然后将球体轻轻吸出,转移至6孔transwell小室,transwell小室提前用matrigel基质胶包被30分钟,温度条件为37℃,包被结束后弃包被液,直接加入2ml含fgf-9(fgf-9的终浓度为200ng/ml)和heparin(heparin的终浓度为1μg/ml)的stemdiff apel2培养基继续分化培养。
83.在该过程中,类器官球体会进一步逐渐分化。通过显微镜可以观察到球体边缘细胞逐渐分化,呈放射触角状,后逐渐出现管状结构。
84.试验第15天,当显微镜下观察到大量小管样结构,其呈放射状由球体的中心延伸到球体边缘时,则可以确定肾脏类器官已经初步形成,肾脏特异性基因会开始表达,形成小管。此时,更换新的stemdiff apel2培养基,继续培养9天,使肾脏类器官进一步成熟。
85.试验第24天,完成分化,获得成熟的肾脏类器官。
86.实施例1中步骤流程如图1所示。
87.实施例1中时间点的显微镜下图像如图2所示。
88.可以发现,诱导分化前的干细胞处于一种典型的干细胞常规形态,细胞核较大,细胞紧密的聚集生长,形成明显的细胞簇,边界清晰,多数细胞成岛状、簇状、或椭圆状。经过本实施例中的方法定向诱导分化以及3d培养后,细胞集落形成明显的球状,逐渐塌陷形成
丘陵状,随着细胞逐渐分化,开始是球体边缘,随后向球体中心逐渐形成管装结构。
89.进一步对得到的肾脏类器官进行特征性标志物检测,具体步骤为:
90.使用200μl移液枪头沿着得到的成熟类器官圆形边缘1mm处划出一道痕迹,随后使用移液器沿着划痕轻轻吹打几下,使类器官从培养板脱落下来。小心取出类器官放入含4%pfa(v/v,多聚甲醛)的6孔板中室温固定10分钟,使用pbs清洗2次。向冰冻包埋盒中提前注入oct包埋剂(注意不要有气泡),将pbs清洗后的类器官,以最大平面朝上,平缓放在oct中,随后再加入一层oct至完全覆盖类器官,完成包埋。将包埋好的冰冻包埋盒放入-80℃冰箱,使包埋材料充分凝固(约1h),使用切片机进行冰冻切片,切片厚度10μm。切片完成后选取合适的切片进行免疫荧光实验。
91.免疫荧光实验前,将冰冻切片在室温环境下浸入300μl的4%pfa溶液中(300μl/片切片),固定10分钟。使用适量pbs洗去残留pfa,重复2次。加入300μl 0.1%triton x-100室温处理10分钟,使细胞充分通透。使用适量pbs洗去残留triton x-100,重复2次。加入5%bsa(300μl/片切片),室温封闭1h。弃去封闭液,加入以300μl的5%bsa稀释得到的一抗稀释液(包括1:1000稀释的anti-ltl、1:200稀释的anti-gata3和1:200稀释的anti-synaptopodin),室温孵育2h。使用适量pbst(含0.1%吐温20的pbs)洗去残留一抗,重复3次。加入以300μl的5%bsa稀释得到的二抗稀释液(包括1:100稀释的山羊抗兔alexa-647、1:100稀释的山羊抗鼠alexa594),室温孵育1h。使用适量pbst洗去残留二抗,重复3次。加入一滴含dapi防荧光猝灭封片剂(invitrogen),室温避光放置1h。
92.使用共聚焦显微镜成像,结果如图3所示。
93.可以发现,本实施例中培养得到的肾脏类器官特异性表达肾脏小管细胞标志蛋白ltl、集合管细胞标志蛋白gata3和足细胞标志蛋白synaptopodin,说明该肾脏类器官分化出成熟的肾小管细胞、集合管细胞和足细胞,说明该类器官分化成功。
94.综合细胞集落的形态和标志蛋白检测结果,可以看出本发明实施例中的分化方法可以获得具有典型肾脏小管细胞的肾脏类器官。
95.实施例2高通量肾脏类器官的诱导分化方法
96.在本实施例中,高通量肾脏类器官的诱导分化方法的具体步骤如下:
97.试验第0天,取无异常的人诱导多能干细胞,并以0.6
×
105细胞/孔的量接种至6孔板中,加入2ml含有rock通路抑制剂y-27632的的mtesr1培养基,放置37℃,5%co2培养箱孵育1天,其中,y-27632的终浓度为10μm。
98.试验第1~4天,将培养基更换为2ml添加有chir99021的stemdiff apel2培养基,开始诱导分化,其中,chir99021的终浓度为8μm。
99.试验第5~7天,将培养基更换为2ml添加有chir99021、fgf-9和heparin的stemdiff apel2培养基使其进一步分化,其中,chir99021的终浓度为8μm,fgf-9的终浓度为200ng/ml,heparin的终浓度为1μg/ml。
100.试验第8天,使用1ml accutase对细胞进行消化处理,1000rpm离心5min,加入1ml的含chir99021、fgf-9和heparin的stemdiff apel2培养基重悬,得到细胞悬液。计数。取18000个细胞转移至v型底96孔培养板中进行3d培养,并且将培养板放在水平摇床进行机械刺激,转速为100rpm,在37℃,5%co2培养箱中培养48h,使细胞聚合成球体,得到高通量的类器官球体。
101.试验第9~14天,弃去v型底96孔培养板中的培养基,加入0.2ml含有chir99021(chir99021的终浓度为5μm)的stemdiff apel2培养基对类器官球体处理60分钟。然后将球体轻轻吸出,转移至6孔transwell小室,transwell小室提前用matrigel基质胶包被30分钟,温度条件为37℃,包被结束后弃包被液,直接加入2ml含fgf-9(fgf-9的终浓度为200ng/ml)和heparin(heparin的终浓度为1μg/ml)的stemdiff apel2培养基继续分化培养。
102.在该过程中,类器官球体会进一步逐渐分化。通过显微镜可以观察到球体边缘细胞逐渐分化,呈放射触角状,后逐渐出现管状结构。
103.试验第15天,当显微镜下观察到大量小管样结构,其呈放射状由球体的中心延伸到球体边缘时,则可以确定肾脏类器官已经初步形成,肾脏特异性基因会开始表达,形成小管。此时,更换新的stemdiff apel2培养基,继续培养9天,使肾脏类器官进一步成熟。
104.试验第24天,完成分化,获得成熟的肾脏类器官。
105.不同细胞对于人肾脏类器官诱导分化效果的影响
106.诱导分化培养方法同实施例1,区别在于:在实施例中,诱导分化所使用的干细胞分别为人尿源诱导多能干细胞、人皮肤成纤维多能干细胞和人脐血间充质多能干细胞。
107.人尿源诱导多能干细胞、人皮肤成纤维多能干细胞和人脐血间充质干细胞都有被用于分化形成人肾脏类器官的潜力,发明人选择这三种来源的干细胞基于上述实施例中的方法进行诱导分化,对比其形成类器官结构以及人肾脏标志蛋白表达水平等指标差异。
108.结果如图4~5所示。
109.可以发现,在同样基于实施例1中相同分化条件下,人尿源诱导多能干细胞分化出结构均匀、小管聚集紧凑规则、小管数量丰富的肾脏类器官。间充质多能干细胞同样可以分化得到具有部分特征的肾脏类器官,其虽然有小管样结构,但小管数量明显少于尿源干细胞分化的效果,而且其结构也较前者更为松散。而皮肤成纤维干细胞分化得到的肾脏类器官边缘细胞未见明显的小管结构,形成紧实的团块,也未见明显的其他分化细胞。进一步基于免疫荧光鉴定结果显示,人尿源干细胞分化得到的人肾脏类器官特异性高表达肾脏小管细胞标志蛋白ltl、集合管细胞标志蛋白gata3、足细胞标志蛋白synaptopodin。而另外两种来源的干细胞只能表达小管细胞标志蛋白ltl,而表达gata3和synaptopodin的水平非常低,说明其分化不完全,说明上述实施例中的主要针对于人诱导多能干细胞,尤其是人尿源诱导多能干细胞分化成人肾脏类器官。
110.干细胞铺板密度对于人肾脏类器官诱导分化效果的影响
111.诱导分化培养方法同实施例1,区别在于:在本实施例中,第0天时,干细胞铺板密度分别为0.6
×
105细胞/孔和1.0
×
105细胞/孔。
112.在肾脏类器官的分化过程中,由于第一阶段诱导分化过程开始后(即第0~7天)不进行消化传代操作,此过程中细胞又处于不断的增殖过程,容易在该阶段后期造成细胞增殖过多而堆积造成细胞营养不足、状态差、甚至挤出死亡等问题。因此起始的干细胞接种密度对于诱导分化的效果尤其重要。
113.在本实施例中,发明人基于0.6
×
105细胞/孔和1.0
×
105细胞/孔的接种密度,分别于显微镜下观察第7天时细胞密度情况和第17天时干细胞分化结构形态,以评估其干细胞铺板密度对于人肾脏类器官诱导分化效果的影响。
114.结果如图6所示。
115.可以发现,当接种密度为0.6
×
105细胞/孔时,第7天细胞密度刚好接近铺满培养板,约为95%左右,细胞轮廓清晰,可以观察到细胞触脚,分化至第17天时有类器官形成,小管结构明显,数量丰富,结构紧凑。但当接种密度为1.0
×
105细胞/孔时,第7天细胞密度则较为拥挤,可以观察到部分细胞挤出死亡,细胞轮廓不清晰,无法观察到细胞触脚,分化至第17天时,球体未出现明显的分化结构,未观察到小管样结构形成。因此,可以说明,在干细胞分化人肾脏类器官起始时,接种密度为0.6
×
105细胞/孔(6孔板)时利于人肾脏类器官诱导分化。
116.培养板对于人肾脏类器官诱导分化效果的影响
117.诱导分化培养方法同实施例1,区别在于:在本实施例中,第8天时细胞进行不同的处理后分别铺板,即收集第7天的细胞悬液后,a组计数后离心得到细胞团直接接种到transwell培养板上,b组计数后将细胞先接种于v型底96孔培养板进行3d悬浮培养24h后在将球体接种到transwell培养板上。
118.结果如图7和表1所示。
119.表1不同处理方法对于人肾脏类器官诱导分化效果的影响
[0120][0121]
注:将长短径数据均进行归一化处理,以便于对比。(如图8)
[0122]
在肾脏类器官分化方法中,有2d平面培养和3d悬浮培养,但是尚无二者对肾脏类器官分化过程中增殖影响的研究,也未比较过v型底96孔板悬浮培养与直接离心后接种细胞团块的差异。而如图7所示,可以发现,第8天时进行3d悬浮培养24小时后得到的细胞球体接种后,可以显著提高后续分化阶段类器官的增殖效果,分化第16天时肾脏类器官的长径和短径分别生长为第9天的3.56
±
0.69和2.57
±
0.76倍。而第8天直接收集细胞离心后以细胞团的形式接种transwell培养板,其没有显著的增殖发生。因此,在第8天时进行3d悬浮培养24小时后得到细胞球体后再接种对于人肾脏类器官诱导分化具有极为重要的意义。
[0123]
机械刺激对于人肾脏类器官诱导分化效果的影响
[0124]
诱导分化培养方法同实施例1,区别在于:在本实施例中,第8天细胞接种到v型底96孔培养板进行3d悬浮培养时进行不同的机械刺激,对照组进行静态培养,实验组进行65rpm的机械力刺激培养24小时,随后将球体接种到transwell培养板上继续培养。
[0125]
结果如图8所示。
[0126]
由于第8天3d悬浮培养时,细胞逐渐形成球体,为了增加球体从培养基中获得营养成分,本发明实施例中的方法将3d悬浮培养所使用的v型96孔培养板放在水平摇床上进行一定程度的机械刺激,刺激强度优选为65rpm,24小时。结果显示,在接种同样的细胞条件下,65rpm机械刺激组球体体积显著大于静态培养的球体,机械刺激组的球体长径和短径分别是静态对照组的近2倍。因此,通过在3d悬浮培养期间引入65rpm机械刺激24小时能够有
效促进类器官球体增殖。
[0127]
transwell小室包被对于人肾脏类器官诱导分化效果的影响
[0128]
诱导分化培养方法同实施例1,区别在于:在本实施例中,第9天球体接种到transwell培养板上时分为两组,对照组不包被transwell,实验组提前用基质胶包被transwell 30分钟,温度条件为37℃。分别评估不同组在第9天铺板时以及第15天时的肾脏类器官增殖和分化情况。
[0129]
结果如图9所示。
[0130]
可以发现,在基质胶提前包被的实验条件下,第15天肾脏类器官显著大于未包被的类器官,且包被条件下的小管分化的形态和丰富程度也明显高于不包被,这可能是因为基质胶包被后提高了分化过程中细胞的营养水平,使细胞生长、分化效果更好。
[0131]
培养时间对于人肾脏类器官诱导分化效果的影响
[0132]
诱导分化培养方法同实施例1,区别在于:在本实施例中,在第15天更换培养基后,分别培养至第18天、第24天、第27天和第30天,观察不同培养天数肾脏类器官成熟情况的差异。
[0133]
结果如图10所示。
[0134]
可以发现,培养至第18天~第30天,肾小管细胞的标志物ltl均有表达,但是第24~27天ltl表达水平明显高于其他时间,在第30天开始降低。第18天~第24天,集合管细胞的标志蛋白gata3表达逐渐升高,第27天开始降低,第30天几乎无gata3表达。而足细胞标志蛋白则第24天表达最高,第27、30天则逐渐降低。由此可知,基于本实施例中的方法,第24天为肾脏类器官的最佳成熟时间,该时间也显著短于常规方法中的时间。
[0135]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。