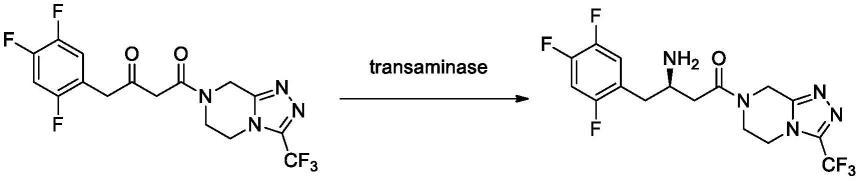
1.本发明属于生物技术领域,具体涉及一种转氨酶、固定化转氨酶,以及该固定化转氨酶在制备西他列汀或其中间体中的应用,本发明还涉及一种西他列汀或其中间体的制备方法。
背景技术:
2.糖尿病是由于胰岛素分泌改变,导致胰岛素缺乏及作用减弱,或者胰岛素活性降低,或者在两者共同影响下,出现的代谢性疾病,以高血糖为特征,并同时伴有蛋白质、糖及脂肪的代谢紊乱。糖尿病及其并发症对人类健康的危害程度居心血管疾病、肿瘤之后的第三位,成为危害人类健康的重要疾病。在糖尿病的四种类型中,ii型糖尿病占90%以上,多见于30岁以上的中老年人,病因主要是由于机体对胰岛素不敏感。
3.西他列汀磷酸盐(sitagliptin phosphate)是2006年fda批准上市的第一个二肽基酶-iv(dpp-4)抑制剂,用于治疗ii型糖尿病。其单用或与二甲双胍、吡格列酮合用都有明显的降血糖作用,且服用安全,耐受性好,不良反应少。
4.美国专利us8293507公开了codexis公司用对节杆菌来源的转氨酶进行改造得到的转氨酶催化4-氧代-4-[3-(三氟甲基)-5,6-二氢-[1,2,4]三唑并[4,3-a]吡嗪-7-(8h)-基]-1-(2,4,5-三氟苯基)丁-2-酮得到西他列汀((2r)-4-氧-4-[3-(三氟甲基)-5,6-二氢-[1,2,4]三唑并[4,3-a]吡嗪-7-(8h)-基]-1-(2,4,5-三氟苯基)丁-2-胺),西他列汀进一步磷酸化得到西他列汀磷酸盐。经改造的转氨酶能够在2g/l酮酰胺底物,0.5m异丙胺,22℃,5%dmso,100μm吡哆醛磷酸(plp)和20mg/ml转氨酶多肽的条件下,将底物4-氧代-4-[3-(三氟甲基)-5,6-二氢-[1,2,4]三唑并[4,3-a]吡嗪-7-(8h)-基]-1-(2,4,5-三氟苯基)丁-2-酮(在本技术中简称为西他双酮)转化成西他列汀到hplc-uv在210nm可检测的水平。其中效果最好的突变体(seq id no:110)的催化转化率可达90-95%。
[0005][0006]
us9617573继续对us8293507中seq id no:110进行改造,所获突变体能够在50g/l酮酰胺底物,1.5m异丙胺(isopropylamine),55℃,50%dmso(v/v),1mm吡哆醛磷酸的条件下,以至少1.2倍于seq id no:110的活性将4-氧代-4-[3-(三氟甲基)-5,6-二氢-[1,2,4]三唑并[4,3-a]吡嗪-7-(8h)-基]-1-(2,4,5-三氟苯基)丁-2-酮转化成西他列汀。其中效果最好的突变体(seq id no:130)的催化转化率可达90-95%。
[0007]
但是这些转氨酶突变体在100%有机溶剂中都是不稳定的,因此将液体酶进行固定,得到固定化酶,以提高转氨酶在有机溶剂中的稳定性。如us9587229公开了将us8293507中的seq id no:110固定在sepabeads exe120树脂上,结果显示seq id no:110的
sepabeads exe120固定化酶在水饱和的ipac(乙酸异丙酯)溶剂中,能催化100g/l的4-氧代-4-[3-(三氟甲基)-5,6-二氢-[1,2,4]三唑并[4,3-a]吡嗪-7-(8h)-基]-1-(2,4,5-三氟苯基)丁-2-酮的底物至西他列汀,ee值99.9%以上。但是us9587229中并没有研究固定化酶的可重复使用率(套用批次数),且反应溶剂为水饱和的ipac(乙酸异丙酯)溶剂,采用此溶剂用于生产时,需要事先将ipac进行水饱和,操作更繁琐,如果用于多批次套用反应,其反应体系中含水量也不好控制,影响固定化酶的水活度,使固定化酶容易失活变性。
[0008]
wo2019011236a1报道了1-吗啉-4-(2,4,5-三氟苯基)-1,3-丁二酮(本发明中又简称为吗啉双酮)可以经转氨酶催化制得(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮,再经多步反应制得西他列汀,但是反应中采用液体酶,含一定量的dmso的水溶剂体系,底物浓度不高,液体酶不能重复利用,应用于生产时成本较高、效率较低。
[0009]
技术实现要素:
[0010]
本发明所要解决的技术问题是为了克服现有技术中将转氨酶制备成固定化酶时用于反应体系时稳定性仍然较差进而用于催化酮酰胺底物以生产西他列汀或其中间体时转化率不高、不能重复利用等缺陷,提供了一种转氨酶、固定化转氨酶及其用于制备西他列汀或其中间体的用途。将本发明的转氨酶制备成固定化转氨酶后,将其用于催化酮酰胺底物以生产西他列汀或其中间体时转化率高且立体选择性好、稳定性好、可重复使用率提高、操作更简单,进而降低了生产成本,有利于工业化生产。
[0011]
本发明人对现有技术中的转氨酶进行了大量研究,发现进行某些具体位点发生突变时,所得的转氨酶进行固定化后,将其用于催化酮酰胺底物时稳定性更高且转化率更高,将其用于西他列汀或其中间体的生产时成本更低。
[0012]
为了解决上述技术问题,本发明第一方面提供了一种固定化转氨酶在制备西他列汀和/或(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮中的用途;
[0013]
其中,所述固定化转氨酶包括树脂和转氨酶,所述转氨酶的氨基酸序列如seq id no:5、seq id no:45、seq id no:47、seq id no:49或其变体所示;所述变体为在如seq id no:5所示氨基酸序列的第241位的r突变为a、h、n、s、l、t、c或m。
[0014]
较佳地,所述变体的氨基酸序列如seq id no:11、seq id no:15、seq id no:21、seq id no:25、seq id no:37、seq id no:39、seq id no:41或seq id no:43所示。更佳地,所述转氨酶的核苷酸序列优选如seq id no:6、seq id no:12、seq id no:16、seq id no:22、seq id no:26、seq id no:38、seq id no:40、seq id no:42、seq id no:44、seq id no:46、seq id no:48或seq id no:50所示;
[0015]
较佳地,所述的转氨酶与所述树脂通过共价键合作用连接。
[0016]
较佳地,所述的树脂优选为环氧树脂,优选hfa。在某一较佳实施例中,所述的树脂为采购于苏州汇通色谱分离纯化有限公司的hfa树脂。
[0017]
较佳地,所述固定化转氨酶中所述树脂上挂载的转氨酶浓度为150~300mg/g(即,每克所述树脂上挂载的转氨酶的质量为150~300mg),例如250mg/g。
[0018]
较佳地,所述用途包括在氨基供体存在时,在反应溶剂中用所述的固定化转氨酶催化酮酰胺底物得所述西他列汀和/或(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮的步骤。
[0019]
更佳地,所述的反应溶剂为异丙醇水溶液,优选所述异丙醇水溶液中水的体积含量(水占整个溶液的体积比)为2%~20%,更优选所述制备的反应体系中还包括转氨酶的辅助因子例如吡哆醛磷酸,其占整个反应体系的浓度优选为0.5~5mg/ml。
[0020]
更佳地,所述酮酰胺底物为4-氧代-4-[3-(三氟甲基)-5,6-二氢-[1,2,4]三唑并[4,3-a]吡嗪-7-(8h)-基]-1-(2,4,5-三氟苯基)丁-2-酮和/或1-吗啉-4-(2,4,5-三氟苯基)-1,3-丁二酮。
[0021]
本发明中,所述的4-氧代-4-[3-(三氟甲基)-5,6-二氢-[1,2,4]三唑并[4,3-a]吡嗪-7-(8h)-基]-1-(2,4,5-三氟苯基)丁-2-酮(本发明中又简称为西他双酮),具体结构式如下:
[0022][0023]
本发明中,所述的1-吗啉-4-(2,4,5-三氟苯基)-1,3-丁二酮(本发明中又简称为吗啉双酮),具体结构式如下:
[0024][0025]
更佳地,所述氨基供体为异丙胺。
[0026]
更佳地,所述氨基供体与所述酮酰胺底物的摩尔比为1:1~5:1。
[0027]
更佳地,所述酮酰胺底物占整个反应体系的浓度为20~200g/l。
[0028]
更佳地,所述固定化转氨酶与所述酮酰胺底物的质量比为1:1~6:1,例如3:1,2.5:1或2:1。
[0029]
更佳地,所述反应的温度为30-60℃,优选45℃。
[0030]
为了解决上述技术问题,本发明第二方面提供了一种固定化转氨酶,其包括树脂和转氨酶,所述转氨酶的氨基酸序列如seq id no:5、seq id no:45、seq id no:47、seq id no:49或其变体所示;所述变体为在如seq id no:5所示氨基酸序列的第241位的r突变为a、h、n、s、l、t、c或m。
[0031]
较佳地,所述变体的氨基酸序列如seq id no:11、seq id no:15、seq id no:21、seq id no:25、seq id no:37、seq id no:39、seq id no:41或seq id no:43所示。更佳地,所述转氨酶的核苷酸序列优选如seq id no:6、seq id no:12、seq id no:16、seq id no:
22、seq id no:26、seq id no:38、seq id no:40、seq id no:42、seq id no:44、seq id no:46、seq id no:48或seq id no:50所示。
[0032]
较佳地,所述的转氨酶与所述树脂通过共价键合作用连接。
[0033]
较佳地,所述的树脂优选为环氧树脂,优选hfa。在某一较佳实施例中,所述的树脂为采购于苏州汇通色谱分离纯化有限公司的hfa树脂。
[0034]
较佳地,所述固定化转氨酶中所述树脂上挂载的转氨酶浓度为150~300mg/g(即,每克所述树脂上挂载的转氨酶的质量为150~300mg),例如250mg/g。为了解决上述技术问题,本发明第三方面提供了一种制备固定化转氨酶的方法,其包括:
[0035]
1)使转氨酶的溶液和树脂接触以形成固定化转氨酶,所述转氨酶的氨基酸序列如seq id no:5、seq id no:45、seq id no:47、seq id no:49或其变体所示;所述变体为在如seq id no:5所示氨基酸序列的第241位的r突变为a、h、n、s、l、t、c或m;
[0036]
2)过滤和冲洗所述固定化转氨酶。
[0037]
较佳地,所述变体的氨基酸序列如seq id no:11、seq id no:15、seq id no:21、seq id no:25、seq id no:37、seq id no:39、seq id no:41或seq id no:43所示;所述转氨酶的核苷酸序列优选如seq id no:6、seq id no:12、seq id no:16、seq id no:22、seq id no:26、seq id no:38、seq id no:40、seq id no:42、seq id no:44、seq id no:46、seq id no:48或seq id no:50所示。
[0038]
较佳地,所述的转氨酶与所述树脂通过共价键合作用连接。
[0039]
较佳地,所述的树脂优选为环氧树脂,优选hfa。在某一较佳实施例中,所述的树脂为采购于苏州汇通色谱分离纯化有限公司的hfa树脂。
[0040]
较佳地,所述转氨酶以转氨酶菌泥的形式存在,所述转氨酶菌泥与所述树脂的质量比为3:1~1:2,例如5:4。
[0041]
较佳地,所述反应的温度为10~40℃,优选20~25℃。
[0042]
较佳地,所述反应的时间为10~30h,优选20~25小时。
[0043]
较佳地,所述反应在搅拌下进行,所述搅拌的速率优选为50~300rpm,例如150或200rpm。
[0044]
在某一较佳实施例中,所述固定化转氨酶的制备方法如下:取5g转氨酶(例如以菌泥的形式存在),加磷酸氢二钾-磷酸二氢钾缓冲液(例如体积为50ml,浓度为100mm)混匀高压均质破碎细胞、离心收集上清液酶液,加入10g k2hpo4·
3h2o、1g kh2po4和0.01g plp,搅拌溶解,加入4ghfa树脂(采购于苏州汇通色谱分离纯化有限公司)进行固定,20~25℃、200rpm摇床固定20~25h,抽滤,去离子洗涤,抽滤得到固定化酶。
[0045]
为了解决上述技术问题,本发明第四方面提供了一种制备西他列汀和/或(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮的方法,其包括在氨基供体存在时,在反应溶剂中用如本发明第二方面所述的固定化转氨酶催化酮酰胺底物得西他列汀和/或(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮的步骤。
[0046]
较佳地,所述酮酰胺底物为4-氧代-4-[3-(三氟甲基)-5,6-二氢-[1,2,4]三唑并[4,3-a]吡嗪-7-(8h)-基]-1-(2,4,5-三氟苯基)丁-2-酮和/或1-吗啉-4-(2,4,5-三氟苯基)-1,3-丁二酮。
[0047]
较佳地,所述反应溶剂为异丙醇水溶液。
[0048]
较佳地,所述氨基供体为异丙胺。
[0049]
较佳地,所述氨基供体与所述酮酰胺底物的摩尔比为1:1~5:1。
[0050]
较佳地,当所述反应溶剂为异丙醇水溶液时,水的体积含量(水占整个溶液的体积比)为2%~20%。
[0051]
较佳地,所述酮酰胺底物占整个反应体系的浓度为20g/l~200g/l。
[0052]
较佳地,所述固定化转氨酶与底物的质量比为1:1~6:1,例如3:1,2.5:1或2:1。
[0053]
较佳地,所述制备的反应体系中还包括转氨酶的辅助因子例如吡哆醛磷酸,其占整个反应体系的浓度优选为0.5~5mg/ml。
[0054]
较佳地,所述反应的温度为30-60℃,优选45℃。
[0055]
为了解决上述技术问题,本发明第五方面提供了一种转氨酶,所述转氨酶的氨基酸序列如seq id no:5、seq id no:45、seq id no:47、seq id no:49或其变体所示;所述变体为在如seq id no:5所示的氨基酸序列的第241位由r突变为a、h、n、s、l、t、c或m。
[0056]
较佳地,所述变体的氨基酸序列如seq id no:11、seq id no:15、seq id no:21、seq id no:25、seq id no:37、seq id no:39、seq id no:41或seq id no:43所示;
[0057]
更佳地,所述转氨酶的核苷酸序列如seq id no:6、seq id no:12、seq id no:16、seq id no:22、seq id no:26、seq id no:38、seq id no:40、seq id no:42、seq id no:44、seq id no:46、seq id no:48或seq id no:50所示。
[0058]
为了解决上述技术问题,本发明第六方面提供了一种多核苷酸,其编码如本发明第五方面所述的转氨酶。
[0059]
为了解决上述技术问题,本发明第七方面提供了一种重组表达载体,其包括如本发明第六方面所述的多核苷酸。
[0060]
较佳地,所述重组表达载体的骨架为质粒pet21a。
[0061]
为了解决上述技术问题,本发明第八方面提供了一种转化体,其为在宿主中导入如本发明第六方面所述的多核苷酸或者如本发明第七方面所述的重组表达载体。
[0062]
较佳地,所述宿主为大肠杆菌;优选大肠杆菌bl21。
[0063]
为了解决上述技术问题,本发明第九方面提供了一种如本发明第五方面所述的转氨酶在制备西他列汀和/或(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮中的用途。
[0064]
较佳地,所述用途包括在氨基供体存在时,在反应溶剂中用转氨酶催化酮酰胺底物得所述西他列汀和/或(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮的步骤。
[0065]
更佳地,所述的反应溶剂为异丙醇水溶液,优选所述异丙醇水溶液中水的体积含量(水占整个溶液的体积比)为2%~20%,更优选所述制备的反应体系中还包括转氨酶的辅助因子例如吡哆醛磷酸,其占整个反应体系的浓度优选为0.5~5mg/ml。
[0066]
更佳地,所述酮酰胺底物为4-氧代-4-[3-(三氟甲基)-5,6-二氢-[1,2,4]三唑并[4,3-a]吡嗪-7-(8h)-基]-1-(2,4,5-三氟苯基)丁-2-酮和/或1-吗啉-4-(2,4,5-三氟苯基)-1,3-丁二酮。
[0067]
更佳地,所述氨基供体为异丙胺。
[0068]
更佳地,所述氨基供体与所述酮酰胺底物的摩尔比为1:1~5:1。
[0069]
更佳地,所述酮酰胺底物占整个反应体系的浓度为20~200g/l。
[0070]
更佳地,所述转氨酶与所述酮酰胺底物的质量比为1:1~6:1,例如3:1,2.5:1或2:1。
[0071]
更佳地,所述转氨酶以固定化的转氨酶的形式存在。
[0072]
更佳地,所述制备的反应体系中还包括转氨酶的辅助因子例如吡哆醛磷酸,其占整个反应体系的浓度优选为0.5~5mg/ml。
[0073]
更佳地,所述反应的温度为30-60℃,优选45℃。
[0074]
本发明中,所述异丙醇水溶液中异丙醇的量能让底物全部溶解即可。异丙醇水溶液中水的体积含量(水占整个溶液的体积比)可以为2%~20%,水太少会让固定化酶失活,水太多则底物溶解不彻底。
[0075]
本发明某一方面还提供了一种西他列汀磷酸盐的制备方法,所述制备方法包括下述步骤:
[0076]
(1)按照如本发明第四方面所述的制备方法,制得西他列汀和/或(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮;
[0077]
(2)将步骤(1)制得的(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮进行反应,得到西他列汀磷酸盐。
[0078]
较佳地,所述西他列汀磷酸盐为西他列汀磷酸盐一水合物。
[0079]
本发明某一方面还提供了一种酶制剂,其包括如本发明第二方面所述的固定化转氨酶或如本发明第五方面所述的转氨酶;
[0080]
较佳地,所述酶制剂还包括转氨酶的辅助因子例如吡哆醛磷酸。
[0081]
本发明中,所述的酶制剂通常可以是从培养物中获得的含转氨酶的转化体宿主细胞或其培养液得到的酶制剂,或者用其加工后得到的制品;其中,所述制品是指由转化体宿主细胞得到的提取物,通过对提取物中的转氨酶进行分离或纯化得到的分离产品,或通过固定化转化体细胞及其提取物或提取物的分离产品而得到的固定化制品。
[0082]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0083]
本发明所用试剂和原料均市售可得。
[0084]
本发明的积极进步效果在于:将本发明的转氨酶制备成固定化转氨酶后,将其用于催化酮酰胺底物以生产西他列汀中间体时转化率高且立体选择性好、稳定性好、可重复使用率提高、操作更简单,进而降低了生产成本,有利于工业化生产。
具体实施方式
[0085]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0086]
本发明中的实验方法如无特别说明均为常规方法,基因克隆操作具体可参加j.萨姆布鲁克等编的《分子克隆实验指南》。
[0087]
本发明中的氨基酸简写符号如无特殊说明均为本领域常规,具体简写符号对应的氨基酸如表1所示。
[0088]
表1
[0089][0090]
所述氨基酸对应的密码子也为本领域常规,具体氨基酸与密码子的对应关系如表2所示。
[0091]
表2
[0092][0093]
pet21a购买自novagen公司;ndei酶、hindiii酶购买自thermo fisher公司,bl21感受态细胞购买自北京鼎国昌盛生物技术有限责任公司。
[0094]
转化率hplc方法:色谱柱:c18柱4.6
×
250mm,5μm;检测器:uv268nm;柱温:40℃;流速:0.8ml/min;进样量:20μl;流动相a:水∶乙腈∶甲酸∶氨水=950∶50∶0.5∶0.5,ph应在3.60~3.80之间,如果ph达不到,10%的氨水或者10%的甲酸调整ph到3.70;也可使用甲酸铵调节ph到3.70;流动相b:水∶乙腈=20∶80;梯度洗脱:100%a(0.01min),60%a 40%b(20min),60%a 40%b(40min),100%a(50min),100%a(60min)。
[0095]
吗啉双酮对照品保留时间:27.820min;(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮对照品保留时间:14.856min;
[0096]
西他双酮对照品保留时间:34.715min;
[0097]
西他列汀对照品(采购于北京盈祥科技有限公司)保留时间:17.705min。
[0098]
其中,吗啉双酮底物原料和对照品(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮由本公司自行合成,合成方法参考wo2019011236a1;3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮消旋体由实验室自行合成,由吗啉双酮进行氨基化和催化加氢制得。对照品(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮构型的确定:(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮可进一步反应制得(3r)-n-叔丁氧羰基-3-氨基-4-(2,4,5-三氟苯基)-丁酸(参考wo2019011236a1),以采购于安徽海康药业有限责任公司(3r)-n-叔丁氧羰基-3-氨基-4-(2,4,5-三氟苯基)-丁酸标准品做对照,可以确定为r构型。
[0099]
构型确定的hplc方法:
[0100]
色谱柱:daicel chiralpak ad-h(4.6mm*250mm,5μm);流动相:正己烷:异丙醇=90:10;检测波长:210nm;流速:1.0ml/min;进样体积:10μl;柱温:25℃;运行时间:40min。
[0101]
西他双酮底物原料由本实验室自行合成,合成方法参考cn100430397c,西他列汀消旋体由本实验室自行合成,由西他双酮进行氨基化和催化加氢制得。
[0102]
手性hplc方法检测产物ee值方法如下:
[0103]
色谱柱:daicel chiralpakad-h柱4.6mm
×
250mm,5μm;流动相:正己烷:异丙醇:二乙胺=40:60:0.1;检测器:uv268nm;柱温:25℃;流速:0.8ml/min;进样量:10μl。
[0104]
3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮消旋体对照品保留时间:10.290min和28.087min;
[0105]
(r)-3-氨基-1-吗啉-4-(2,4,5-三氟苯基)-1-丁酮对照品保留时间:28.093min。
[0106]
西他列汀消旋体对照品保留时间:14.172min和17.702min;
[0107]
西他列汀对照品保留时间:17.665min。
[0108]
实施例1一种转氨酶突变体酶液的制备
[0109]
根据已报道的enz.1(seq id no:1,即us8293507中的seq id no:110)、enz.2(seq id no:3,即us9617573中的seq id no:130)的编码基因,全基因进行合成,酶切位点ndei、hindiii,载体pet21a。基因合成公司为苏州金唯智生物科技有限公司(苏州工业园区星湖街218号生物纳米科技园c3楼)。合成的转氨酶基因转化至宿主大肠杆菌bl21感受态细胞,得到含有转氨酶enz.1、enz.2基因的工程菌株。
[0110]
同样地,将表3中工程化得到的转氨酶enz.3~enz.25的基因,酶切位点ndei、hindiii,载体pet21a。合成的转氨酶基因转化至宿主大肠杆菌bl21感受态细胞,得到表3含有转氨酶基因的工程菌enz.3~enz.25。
[0111]
表3
[0112]
[0113][0114]
将含有转氨酶基因的工程菌在经平皿划线活化后,挑单菌落接种至含50μg/ml卡那霉素的5ml lb液体培养基中,37℃震荡培养12h。按2%(v/v)接种量转接至150ml同样含50μg/ml卡那霉素的新鲜lb液体培养基中,37℃震荡至od600达到0.8左右时,加入iptg至其终浓度为0.5mm,18℃诱导培养16h。培养结束后,将培养液10,000rpm离心10min,弃上清液,收集菌体,置于-80℃超低温冰箱中保存,待用。
[0115]
实施例2固定化转氨酶突变体的制备
[0116]
取5g转氨酶突变体菌泥,加50ml 100mm磷酸氢二钾-磷酸二氢钾缓冲液混匀高压均质破碎细胞、离心收集上清液酶液,加入10g k2hpo4·
3h2o、1g kh2po4和0.01g plp,搅拌溶解,加入4ghfa树脂(采购于苏州汇通色谱分离纯化有限公司)进行固定,20~25℃、200rpm摇床固定20~25h,抽滤,去离子洗涤,抽滤得到固定化酶。
[0117]
实施例3各转氨酶突变体的固定化酶用于催化吗啉双酮
[0118]
三角瓶中,加入10ml异丙醇,0.5g吗啉双酮,0.8ml 16mg/ml的plp水溶液,0.25ml异丙胺和1g实施例2中制得的固定化酶,45℃、200rpm摇床反应,反应4小时和24小时取样检测转化率。检测结果如下表4所示。
[0119]
其中,hplc检测转化率的方法见上述的转化率hplc方法部分。经过检测发现,各底物和产物的保留时间与各自的对照品一致。
[0120]
表4
[0121]
[0122][0123]
结果显示enz.3、enz.6、enz.8、enz.11、enz.13、enz.19、enz.20、enz.21、enz.22、enz.23、enz.24、enz.25的转化率都优于enz.2和enz.1,其中enz.6、enz.11、enz.24的24小时的转化率均可达到80%以上。
[0124]
实施例4固定化酶enz.11-hfa多批次催化吗啉双酮
[0125]
三角瓶中,加入25ml异丙醇,2.5g吗啉双酮,2ml 16mg/ml的plp水溶液,1.24ml异丙胺和7.5g实施例2中制得的固定化酶,45℃、200rpm摇床反应,反应24小时取样检测转化率。过滤反应液得固定化酶,继续加入25ml异丙醇,2.5g吗啉双酮,2ml16mg/ml的plp水溶液,1.24ml异丙胺,45℃、200rpm摇床反应,反应24小时取样检测转化率。按照上述方法固定化酶重复套用,结果显示固定化酶套用10批反应,转化率仍然保持在90%以上,ee值》99.9%,固定化酶比较稳定。而enz.1和enz.2在同样条件下套用3次的转化率都在50%以下,不适合用来催化吗啉双酮。具体套用结果见下表5。
[0126]
表5
[0127][0128]
实施例5各转氨酶突变体的固定化酶用于催化西他双酮
[0129]
三角瓶中,加入10ml异丙醇,0.5g西他双酮,0.8ml 16mg/ml的plp水溶液,0.23ml异丙胺和1g实施例2中制得的固定化酶,45℃、200rpm摇床反应,反应4小时和24小时取样hplc检测转化率,检测结果如下表6所示。
[0130]
其中,hplc检测转化率的方法见上述的转化率hplc方法部分。经检测,各底物和产物的保留时间与各自的对照品一致。
[0131]
表6
[0132]
[0133][0134]
结果显示,enz.3、enz.6、enz.11、enz.13、enz.19、enz.20、enz.21、enz.22的转化率都优于enz.1和enz.2,其中enz.11的效果最优。
[0135]
将这些较好的固定化酶进行蛋白浓度测定,检测方法:采用bradford法检测固定化前后酶液在595nm处吸光值变化,进而计算出蛋白浓度,测定结果如下表7所示:
[0136]
表7
[0137]
[0138][0139]
实施例6固定化酶enz.11-hfa多批次催化西他双酮
[0140]
三角瓶中,加入25ml异丙醇,2.5g西他双酮,2ml 16mg/ml的plp水溶液,1.135ml异丙胺和6.25g实施例2中制得的固定化酶,45℃、200rpm摇床反应,反应24小时取样检测转化率。过滤反应液得固定化酶,继续加入25ml异丙醇,2.5g西他双酮,2ml 16mg/ml的plp水溶液,1.135ml异丙胺,45℃、200rpm摇床反应,反应24小时取样检测转化率。按照上述方法固定化酶重复套用,结果显示固定化酶enz.11-hfa套用10批反应,转化率仍然保持在95%以上,ee值》99.9%,固定化酶比较稳定。具体套用结果见下表8。
[0141]
表8
[0142]
[0143][0144]
*:与enz.1的转化率比较;#:与enz.2的转化率比较
[0145]
以上结果说明,本发明的转氨酶突变在固定化酶催化西他双酮的实验中,显示了比现有技术enz.1和enz.2用于固定化酶催化时转化率更优异的效果,且该差异有统计学意义(p值均小于0.001,其中p值的计算是用t-test双尾实验)。
[0146]
实施例7西他列汀磷酸盐一水合物的制备
[0147]
待实施例6反应结束后,过滤,得到固定化酶和滤液,滤液60℃下浓缩拉干得到浓缩物。加入100ml二氯甲烷溶解,加入100ml纯化水,搅拌,用30%浓盐酸调ph至2-3之间,静置分层。水相加入100ml二氯甲烷,搅拌,加入30%氢氧化钠溶液调ph至11,静置分层。水相再次加入100ml二氯甲烷,搅拌萃取,静置分层。合并两次碱萃的有机相。60℃浓缩,浓缩物加入120ml异丙醇,搅拌溶解,加入10.6g的85%磷酸,升温至75℃,搅拌溶清,缓慢降温使西他列汀磷酸盐结晶析出,5℃保温2h,过滤,滤饼放于60℃烘干干燥,得到西他列汀磷酸盐一水合物。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。