4-10元杂环、c(o)nr6r7、s(o)2nr6r7、nr6cor7、nr6so2r7或c(o)or6;
11.r2是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
2-c6烯基、任选地经取代的c
2-c6炔基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;
12.r3是h、任选地经取代的c
1-c6烷基、任选地经取代的c
2-c6烯基、任选地经取代的 c
2-c6炔基、任选地经取代的环烷基、任选地经取代的杂环烷基、任选地经取代的芳基、任选地经取代的杂芳基、or6或nr6r7;
13.或r2和r3与间插原子一起形成任选地经取代的c
3-c8环烷基或任选地经取代的4-10 元杂环烷基;
14.r4是任选地经取代的c
1-c6烷基、任选地经取代的c
2-c6烯基或任选地经取代的 c
2-c6炔基;
15.x是o或s;
16.y是ch、c-(c
1-c2烷基)或c-卤基或n;
17.z是cr5或n;
18.r5是h或卤素;
19.r6是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;且
20.r7是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;
21.或r6和r7与其连接的氮一起形成任选地经取代的4-7元杂环,
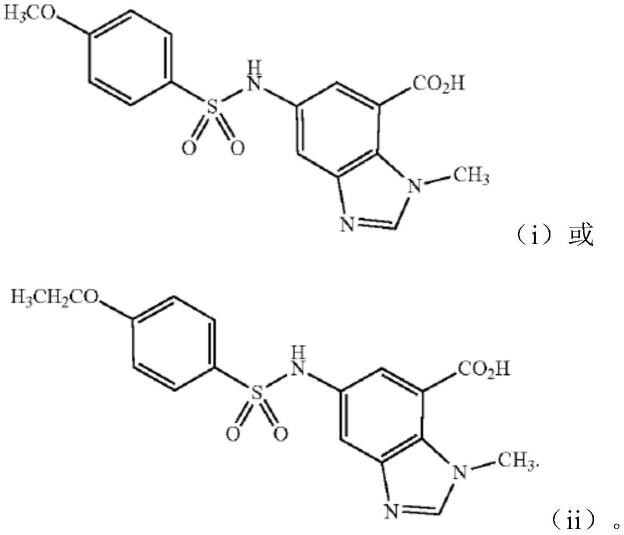
22.条件是所述化合物不为(i)5-[[(4-甲氧基苯基)磺酰基]氨基]-1-甲基-1h-苯并咪唑-7
‑ꢀ
甲酸或(ii)5-[[(4-乙氧基苯基)磺酰基]氨基]-1-甲基-1h-苯并咪唑-7-甲酸。
[0023]
在一些实施例中,化合物具有式(ia-1):
[0024][0025]
在一方面中,本文提供抑制选自由阿贝森蛋白(abl1)、阿贝森相关蛋白(abl2)和嵌合蛋白bcr-abl1组成的群组的蛋白质的酪氨酸激酶酶活性的方法,其包含使有效量的本文提供的化合物或组合物与蛋白质接触。
[0026]
在一方面中,本文提供治疗患者的疾病的方法,其中bcr-abl1活性的调节预防、抑制或改善疾病的病理学和/或症状学,所述方法包含向患者投与治疗有效量的本文提供的化合物或组合物。
[0027]
在一方面中,本文提供治疗患者的白血病的方法,其包含向患者投与治疗有效量的本文提供的化合物或组合物,其中白血病是慢性骨髓性白血病(cml)、急性骨髓性白血病(aml)或急性淋巴母细胞性白血病(all)。
具体实施方式
[0028]
定义
[0029]
除非另有说明,否则如本文中所使用,以下定义应适用。此外,如果本文使用的任何术语或符号未如下所述定义,那么其应具有本领域的普通含义。
[0030]“包含”打算指组合物和方法包括所述要素,但不排除其它要素。当“基本上由
……
组成”用于定义组合物和方法时,应意指排除对组合具有任何本质意义的其它要素。举例来说,基本上由如本文所定义要素组成的组合物将不排除大体上并不影响所主张发明的基本和新颖特性的其它要素。“由
……
组成”应意指排除超过痕量要素的(例如)所述其它成分和实质性方法步骤。由这些过渡术语中的每一者所定义的实施例均在本发明范畴内。
[0031]
化合物或组合物的“有效量”或剂量是指基于本文的揭示内容视需要产生预期结果的化合物或组合物的量。有效量可通过标准医药程序在细胞培养物或实验动物中、例如且并不限于通过测定ld
50
(使50%群体致死的剂量)和ed
50
(在50%群体中治疗有效的剂量)来测定。
[0032]
如本文所用术语“赋形剂”意指可用于产生药物或医药、例如含有本发明化合物作为活性成分的片剂的惰性或无活性物质。术语赋形剂可包涵各种物质,包括但不限于用作粘合剂、崩解剂、包衣、压缩/囊封助剂、乳霜或洗剂、润滑剂、非经肠投与用溶液、可咀嚼片剂用材料、甜味剂或矫味剂、悬浮/胶凝剂或湿式粒化剂的任何物质。粘合剂包括 (例如)卡波姆(carbomer)、聚维酮、黄原胶等;包衣包括(例如)乙酸邻苯二甲酸纤维素、乙基纤维素、结兰胶、麦芽糊精、肠溶包衣等;压缩/囊封助剂包括(例如)碳酸钙、右旋糖、果糖dc(dc=“直接可压缩”)、蜂蜜dc、乳糖(无水物或一水合物;任选地与阿斯巴甜、纤维素或微晶纤维素组合)、淀粉dc、蔗糖等;崩解剂包括(例如)交联羧甲基纤维素钠、结兰胶、羟乙酸淀粉钠等;乳霜或洗剂包括(例如)麦芽糊精、卡拉胶等;润滑剂包括(例如)硬脂酸镁、硬脂酸、硬脂酰基延胡索酸钠等;可咀嚼片剂用材料包括(例如)右旋糖、果糖dc、乳糖(一水合物,任选地与阿斯巴甜或纤维素组合)等;悬浮/胶凝剂包括(例如) 卡拉胶、羟乙酸淀粉钠、黄原胶等;甜味剂包括(例如)阿斯巴甜、右旋糖、果糖dc、山梨醇、蔗糖dc等;且湿式粒化剂包括(例如)碳酸钙、麦芽糊精、微晶纤维素等。
[0033]“患者”是指哺乳动物且包括人类和非人类哺乳动物。患者的实例包括(但不限于)小鼠、大鼠、仓鼠、天竺鼠、猪、兔、猫、狗、山羊、绵羊、牛和人类。在一些实施例中,患者是指人类。
[0034]“医药上可接受的”是指优选对于活体内、更优选对于人类投与安全且无毒。
[0035]“医药上可接受的盐”是指医药上可接受的盐。本文所述化合物可以医药上可接受的盐形式投与。
[0036]“前药”是指投与之后经代谢或以其它方式转化为关于至少一种性质的生物学活性或活性更高的化合物(或药物)的化合物。相对于药物,前药以使其相对于药物活性较低或无活性的方式经化学修饰,但化学修饰使得在前药投与之后通过代谢或其它生物过程产生相应药物。前药可相对于活性药物具有改变的代谢稳定性或运输特征、较少副作用或较低毒性或经改良的风味(参见(例如)参考文献诺格雷迪(nogrady),1985,药物化学生物化学方法(medicinal chemistry a biochemical approach),牛津大学出版社(oxforduniversity press),纽约,第388页到392页,其以引用方式并入本文中)。前药可使用除采
(ch3ch2ch2ch2ch
2-)和新戊基((ch3)3cch
2-)。c
x
烷基是指具有x个数目的碳原子的烷基。
[0044]“烯基”是指具有2到6个碳原子且优选2到4个碳原子且具有至少1个且优选1到2个乙烯基(》c=c《)不饱和位点的直链或具支链单价烃基。所述基团是例如通过乙烯基、烯丙基和丁3-烯1-基来例示。在此术语内包括这些异构体的顺式和反式异构体或混合物。c
x
烯基是指具有x个数目的碳原子的烯基。
[0045]“炔基”是指具有2到6个碳原子且优选2到3个碳原子且具有至少1个且优选1到2个炔系(-c≡c-)不饱和位点的直链或具支链单价烃基。所述炔基的实例包括乙炔基(-c≡ch)和炔丙基(-ch2c≡ch)。c
x
炔基是指具有x个数目的碳原子的炔基。
[0046]“经取代的烷基”是指具有1到5、优选1到3或更优选1到2个选自由以下组成的群组的取代基的烷基:烷氧基、经取代的烷氧基、酰基、酰基氨基、酰氧基、氨基、经取代的氨基、氨基羰基、氨基硫代羰基、氨基羰基氨基、氨基硫代羰基氨基、氨基羰基氧基、氨基磺酰基、氨基磺酰基氧基、氨基磺酰基氨基、甲脒基、芳基、经取代的芳基、芳氧基、经取代的芳氧基、芳基硫基、经取代的芳基硫基、芳基氨基、经取代的芳基氨基、杂芳基氨基、经取代的杂芳基氨基、环烷基氨基、经取代的环烷基氨基、杂环烷基氨基、经取代的杂环烷基氨基、羧基、羧基酯、(羧基酯)氨基、(羧基酯)氧基、氰基、环烷基、经取代的环烷基、环烷基氧基、经取代的环烷基氧基、环烷基硫基、经取代的环烷基硫基、胍基、经取代的胍基、卤基、羟基、杂芳基、经取代的杂芳基、杂芳氧基、经取代的杂芳氧基、杂芳基硫基、经取代的杂芳基硫基、杂环、经取代的杂环、杂环基氧基、经取代的杂环基氧基、杂环基硫基、经取代的杂环基硫基、硝基、so3h、经取代的磺酰基、磺酰基氧基、磺酰基氨基、硫代酰基、硫醇、烷基硫基和经取代的烷基硫基,其中所述取代基是如本文所定义。
[0047]“经取代的烯基”是指具有1到3个取代基且优选1到2个取代基的烯基,所述取代基选自由以下组成的群组:烷氧基、经取代的烷氧基、酰基、酰基氨基、酰氧基、氨基、经取代的氨基、氨基羰基、氨基硫代羰基、氨基羰基氨基、氨基硫代羰基氨基、氨基羰基氧基、氨基磺酰基、氨基磺酰基氧基、氨基磺酰基氨基、甲脒基、芳基、经取代的芳基、芳氧基、经取代的芳氧基、芳基硫基、经取代的芳基硫基、芳基氨基、经取代的芳基氨基、杂芳基氨基、经取代的杂芳基氨基、环烷基氨基、经取代的环烷基氨基、杂环烷基氨基、经取代的杂环基氨基、羧基、羧基酯、(羧基酯)氨基、(羧基酯)氧基、氰基、环烷基、经取代的环烷基、环烷基氧基、经取代的环烷基氧基、环烷基硫基、经取代的环烷基硫基、胍基、经取代的胍基、卤基、羟基、杂芳基、经取代的杂芳基、杂芳氧基、经取代的杂芳氧基、杂芳基硫基、经取代的杂芳基硫基、杂环、经取代的杂环、杂环基氧基、经取代的杂环基氧基、杂环基硫基、经取代的杂环基硫基、硝基、so3h、经取代的磺酰基、磺酰基氧基、磺酰基氨基、硫代酰基、硫醇、烷基硫基和经取代的烷基硫基,其中所述取代基是如本文所定义且条件是任何羟基或硫醇取代都不连接到乙烯基(不饱和)碳原子。
[0048]“经取代的炔基”是指具有1到3个取代基且优选1到2个取代基的炔基,所述取代基选自由以下组成的群组:烷氧基、经取代的烷氧基、酰基、酰基氨基、酰氧基、氨基、经取代的氨基、氨基羰基、氨基硫代羰基、氨基羰基氨基、氨基硫代羰基氨基、氨基羰基氧基、氨基磺酰基、氨基磺酰基氧基、氨基磺酰基氨基、甲脒基、芳基、经取代的芳基、芳氧基、经取代的芳氧基、芳基硫基、经取代的芳基硫基、芳基氨基、经取代的芳基氨基、杂芳基氨基、经取代的杂芳基氨基、环烷基氨基、经取代的环烷基氨基、杂环烷基氨基、经取代的杂环基氨基、羧
基、羧基酯、(羧基酯)氨基、(羧基酯)氧基、氰基、环烷基、经取代的环烷基、环烷基氧基、经取代的环烷基氧基、环烷基硫基、经取代的环烷基硫基、胍基、经取代的胍基、卤基、羟基、杂芳基、经取代的杂芳基、杂芳氧基、经取代的杂芳氧基、杂芳基硫基、经取代的杂芳基硫基、杂环、经取代的杂环、杂环基氧基、经取代的杂环基氧基、杂环基硫基、经取代的杂环基硫基、硝基、so3h、经取代的磺酰基、磺酰基氧基、磺酰基氨基、硫代酰基、硫醇、烷基硫基和经取代的烷基硫基,其中所述取代基是如本文所定义且条件是任何羟基或硫醇取代都不连接到炔系碳原子。
[0049]“烷氧基”是指其中烷基是如本文所定义的基团-o-烷基。烷氧基包括(举例来说)甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、叔丁氧基、仲丁氧基和正戊氧基。
[0050]“经取代的烷氧基”是指其中经取代的烷基是如本文所定义的基团-o-(经取代的烷基)。-o-(经取代的烷基)中的优选经取代的烷基包括卤化烷基且具体来说卤化甲基,例如三氟甲基、二氟甲基、氟甲基和诸如此类。
[0051]“酰基”是指基团h-c(o)-、烷基-c(o)-、经取代的烷基-c(o)-、烯基-c(o)-、经取代的烯基-c(o)-、炔基-c(o)-、经取代的炔基-c(o)-、环烷基-c(o)-、经取代的环烷基-c(o)-、芳基-c(o)-、经取代的芳基-c(o)-、杂芳基-c(o)-、经取代的杂芳基-c(o)-、杂环-c(o)
‑ꢀ
和经取代的杂环-c(o)-,其中烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。酰基包括“乙酰基
”ꢀ
ch3c(o)-。
[0052]“酰基氨基”是指基团-nr
30
c(o)烷基、-nr
30
c(o)取代的烷基、-nr
30
c(o)环烷基、
ꢀ‑
nr
30
c(o)取代的环烷基、-nr
30
c(o)烯基、-nr
30
c(o)取代的烯基、烷氧基、经取代的烷氧基-nr
30
c(o)炔基、-nr
30
c(o)取代的炔基、-nr
30
c(o)芳基、-nr
30
c(o)取代的芳基、
ꢀ‑
nr
30
c(o)杂芳基、-nr
30
c(o)取代的杂芳基、-nr
30
c(o)杂环和-nr
30
c(o)取代的杂环,其中r
30
是氢、烷基、经取代的烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、环烷基、或经取代的环烷基;且其中烷基、经取代的烷基、烯基、经取代的烯基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。
[0053]“酰氧基”是指基团烷基-c(o)o-、经取代的烷基-c(o)o-、烯基-c(o)o-、经取代的烯基-c(o)o-、炔基-c(o)o-、经取代的炔基-c(o)o-、芳基-c(o)o-、经取代的芳基-c(o)o-、环烷基-c(o)o-、经取代的环烷基-c(o)o-、杂芳基-c(o)o-、经取代的杂芳基-c(o)o-、杂环-c(o)o-和经取代的杂环-c(o)o-,其中烷基、经取代的烷基、烯基、经取代的烯基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。
[0054]“氨基”是指基团-nh2。
[0055]“经取代的氨基”是指基团-nr
31r32
,其中r
31
和r
32
独立地选自由以下组成的群组:氢、烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、芳基、经取代的芳基、环烷基、经取代的环烷基、杂芳基、经取代的杂芳基、杂环、经取代的杂环、芳基氨基、经取代的芳基氨基、杂芳基氨基、经取代的杂芳基氨基、环烷基氨基、经取代的环烷基氨基、杂环烷基氨基、经取代的杂环基氨基、磺酰基氨基和经取代的磺酰基,并且其中r
31
和r
32
任选地与其所结合的氮接合在一起以形成杂环或经取代的杂环基,条件
是r
31
和r
32
不都为氢,并且其中烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。当r
31
是氢且r
32
是烷基时,经取代的氨基在本文中有时称作烷基氨基。当r
31
和 r
32
是烷基时,经取代的氨基在本文中有时称作二烷基氨基。当提到经单取代的氨基时,其意指r
31
或r
32
是氢,但不都为氢。当提到经二取代的氨基时,其意指r
31
与r
32
都不为氢。
[0056]“氨基羰基”是指基团-c(o)nr
33r34
,其中r
33
和r
34
独立地选自由以下组成的群组:氢、烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、芳基、经取代的芳基、环烷基、经取代的环烷基、杂芳基、经取代的杂芳基、杂环和经取代的杂环,并且其中r
33
和r
34
任选地与其结合的氮接合在一起以形成杂环或经取代的杂环,并且其中烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。
[0057]“氨基硫代羰基”是指基团-c(s)nr
33r34
,其中r
33
和r
34
独立地选自由以下组成的群组:氢、烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、芳基、经取代的芳基、环烷基、经取代的环烷基、杂芳基、经取代的杂芳基、杂环和经取代的杂环,并且其中r
33
和r
34
任选地与其结合的氮接合在一起以形成杂环或经取代的杂环,并且其中烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。
[0058]“氨基羰基氨基”是指基团-nr
30
c(o)nr
33r34
,其中r
30
是氢、烷基、经取代的烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、环烷基或经取代的环烷基,并且r
33
和r
34
独立地选自由以下组成的群组:氢、烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、芳基、经取代的芳基、环烷基、经取代的环烷基、杂芳基、经取代的杂芳基、杂环和经取代的杂环,并且其中r
33
和r
34
任选地与其所结合的氮接合在一起以形成杂环或经取代的杂环基,并且其中烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。
[0059]“氨基硫代羰基氨基”是指基团-nr
30
c(s)nr
33r34
,其中r
30
是氢、烷基、经取代的烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、环烷基或经取代的环烷基,并且 r
33
和r
34
独立地选自由以下组成的群组:氢、烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、芳基、经取代的芳基、环烷基、经取代的环烷基、杂芳基、经取代的杂芳基、杂环和经取代的杂环,并且其中r
33
和r
34
任选地与其所结合的氮接合在一起以形成杂环或经取代的杂环基,并且其中烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。
[0060]“氨基羰基氧基”是指基团-o-c(o)nr
33r34
,其中r
33
和r
34
独立地选自由以下组成的群组:氢、烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、芳基、经取代的芳基、环烷基、经取代的环烷基、杂芳基、经取代的杂芳基、杂环基和
经取代的杂环基,并且其中r
33
和r
34
任选地与其结合的氮接合在一起以形成杂环基或经取代的杂环基,并且其中烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环基和经取代的杂环基是如本文所定义。
[0061]“氨基磺酰基”是指基团-so2nr
33r34
,其中r
33
和r
34
独立地选自由以下组成的群组:氢、烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、芳基、经取代的芳基、环烷基、经取代的环烷基、杂芳基、经取代的杂芳基、杂环基和经取代的杂环基,并且其中r
33
和r
34
任选地与其结合的氮接合在一起以形成杂环基或经取代的杂环基,并且其中烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环基和经取代的杂环基是如本文所定义。
[0062]“氨基磺酰基氧基”是指基团-o-so2nr
33r34
,其中r
33
和r
34
独立地选自由以下组成的群组:氢、烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、芳基、经取代的芳基、环烷基、经取代的环烷基、杂芳基、经取代的杂芳基、杂环基和经取代的杂环基,并且其中r
33
和r
34
任选地与其结合的氮接合在一起以形成杂环基或经取代的杂环基,并且其中烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环基和经取代的杂环基是如本文所定义。
[0063]“氨基磺酰基氨基”是指基团-nr
30-so2nr
33r34
,其中r
30
是氢、烷基、经取代的烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、环烷基或经取代的环烷基,并且r
33
和r
34
独立地选自由以下组成的群组:氢、烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、芳基、经取代的芳基、环烷基、经取代的环烷基、杂芳基、经取代的杂芳基、杂环和经取代的杂环,并且其中r
33
和r
34
任选地与其所结合的氮接合在一起以形成杂环或经取代的杂环基,并且其中烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。
[0064]“甲脒基”是指基团-c(=nr
35
)nr
33r34
,其中r
33
、r
34
和r
35
独立地选自由以下组成的群组:氢、烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、芳基、经取代的芳基、环烷基、经取代的环烷基、杂芳基、经取代的杂芳基、杂环基和经取代的杂环基,并且其中r
33
和r
34
任选地与其结合的氮接合在一起以形成杂环基或经取代的杂环基,并且其中烷基、经取代的烷基、烯基、经取代的烯基、烷氧基、经取代的烷氧基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环基和经取代的杂环基是如本文所定义。
[0065]“芳基”或“ar”是指具有单环(例如,苯基(ph))或多个稠合环(例如,萘基或蒽基)的6 到14个碳原子的单价芳香族碳环基团,所述稠合环可为或可不为芳香族的(例如,2-苯并噁唑啉酮、2h-1,4-苯并噁嗪3(4h)-酮7-基和诸如此类),条件是连接点位于芳香族碳原子处。优选芳基包括苯基和萘基。
[0066]“经取代的芳基”是指经1到5、优选1到3或更优选1到2个选自由以下组成的群组的取代基取代的芳基:烷基、经取代的烷基、烯基、经取代的烯基、炔基、经取代的炔基、烷氧-o-c(o)o-经取代的芳基、-o-c(o)o-环烷基、o-c(o)o-经取代的环烷基、-o-c(o)o-杂芳基、-o-c(o)o-经取代的杂芳基、-o-c(o)o-杂环和-o-c(o)o-经取代的杂环,其中烷基、经取代的烷基、烯基、经取代的烯基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。
[0078]“氰基”是指基团-c≡n。
[0079]“环烷基”是指具有单一或多个环(包括稠合、桥接和螺环系统)的3到10个碳原子、优选3到8个碳原子且更优选3到6个碳原子的饱和或不饱和、但非芳香族环状烷基。c
x
环烷基是指具有x个数目的碳原子的环烷基。适宜环烷基的实例包括(例如)金刚烷基、环丙基、环丁基、环戊基和环辛基。一或多个环可为芳基、杂芳基或杂环,条件是连接点经过非芳香族、非杂环状环饱和碳环。“经取代的环烷基”是指具有1到5或优选1到3个选自由以下组成的群组的取代基的环烷基:氧代基、硫酮基、烷基、经取代的烷基、烯基、经取代的烯基、炔基、经取代的炔基、烷氧基、经取代的烷氧基、酰基、酰基氨基、酰氧基、氨基、经取代的氨基、氨基羰基、氨基硫代羰基、氨基羰基氨基、氨基硫代羰基氨基、氨基羰基氧基、氨基磺酰基、氨基磺酰基氧基、氨基磺酰基氨基、甲脒基、芳基、经取代的芳基、芳氧基、经取代的芳氧基、芳基硫基、经取代的芳基硫基、羧基、羧基酯、 (羧基酯)氨基、(羧基酯)氧基、氰基、环烷基、经取代的环烷基、环烷基氧基、经取代的环烷基氧基、环烷基硫基、经取代的环烷基硫基、胍基、经取代的胍基、卤基、羟基、杂芳基、经取代的杂芳基、杂芳氧基、经取代的杂芳氧基、杂芳基硫基、经取代的杂芳基硫基、杂环、经取代的杂环、杂环基氧基、经取代的杂环基氧基、杂环基硫基、经取代的杂环基硫基、硝基、so3h、经取代的磺酰基、磺酰基氧基、硫代酰基、硫醇、烷基硫基和经取代的烷基硫基,其中所述取代基是如本文所定义。
[0080]“环烷基氧基”是指-o-环烷基。
[0081]“经取代的环烷基氧基”是指-o-(经取代的环烷基)。
[0082]“环烷基氨基”是指基团-nr
37
(环烷基),其中r
37
是氢、烷基或经取代的烷基。
[0083]“经取代的环烷基氨基”是指基团-nr
37
(经取代的环烷基),其中r
37
是氢、烷基或经取代的烷基,并且经取代的环烷基是如本文所定义。
[0084]“环烷基硫基”是指-s-环烷基。
[0085]“经取代的环烷基硫基”是指-s-(经取代的环烷基)。
[0086]“胍基”是指基团-nhc(=nh)nh2。
[0087]“经取代的胍基”是指-nr
36
c(=nr
36
)n(r
36
)2,其中每一r
36
独立地选自由以下组成的群组:氢、烷基、经取代的烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环基且两个连接到共用胍基氮原子的r
36
基团任选地与其所结合的氮接合在一起以形成杂环或经取代的杂环,条件是至少一个r
36
不为氢,并且其中所述取代基是如本文所定义。
[0088]“卤基”或“卤素”是指氟、氯、溴和碘且优选为氟或氯。
[0089]“羟基(hydroxy或hydroxyl)”是指基团-oh。
[0090]“亚杂烷基”是指亚烷基,其中一或多个碳经-o-、-s-、so2、-nr
q-、
[0091][0092]
部分置换,其中rq是h或c
1-c6烷基。“经取代的亚杂烷基”是指具有1到3个取代基且优选1到2个取代基的亚杂炔基,所述取代基选自针对经取代的亚烷基揭示的取代基。
[0093]“杂芳基”是指环内具有1到10个碳原子且具有1到4个选自由氧、氮和硫组成的群组的杂原子的芳香族基团。所述杂芳基可具有单环(例如,吡啶基或呋喃基)或多个稠合环 (例如,吲嗪基或苯并噻吩基),其中所述稠合环可为或可不为芳香族的和/或含有杂原子,条件是连接点经由芳香族杂芳基的原子。在一个实施例中,杂芳基的氮和/或硫环原子任选地经氧化以提供n-氧化物(n
→
o)、亚磺酰基和/或磺酰基部分。优选杂芳基包括5或6 元杂芳基,例如吡啶基、吡咯基、噻吩基和呋喃基。其它优选杂芳基包括9或10元杂芳基,例如吲哚基、喹啉基、喹啉酮基、异喹啉基和异喹啉酮基。
[0094]“经取代的杂芳基”是指经1到5、优选1到3或更优选1到2个选自由针对经取代的芳基所定义的相同取代基群组成的群组的取代基取代的杂芳基。
[0095]“杂芳基氧基”是指-o-杂芳基。
[0096]“经取代的杂芳氧基”是指基团-o-(经取代的杂芳基)。
[0097]“杂芳基硫基”是指基团-s-杂芳基。
[0098]“经取代的杂芳基硫基”是指基团-s-(经取代的杂芳基)。
[0099]“杂芳基氨基”是指基团-nr
37
(杂芳基),其中r
37
是氢、烷基或经取代的烷基。
[0100]“经取代的杂芳基氨基”是指基团-nr
37
(经取代的杂芳基),其中r
37
是氢、烷基或经取代的烷基,并且经取代的杂芳基是如本文所定义。
[0101]“杂环(heterocycle或heterocyclic)”或“杂环烷基”或“杂环基”是指具有1到10个环碳原子、优选1到8个碳原子且更优选1到6个碳原子和1到4个选自由氮、硫或氧组成的群组的环杂原子、优选1到3个杂原子且更优选1到2个杂原子的饱和或部分饱和、但非芳香族基团。c
x
杂环烷基是指具有x个数目的环原子(包括环杂原子)的杂环烷基。杂环涵盖单环或多个稠合环,包括稠合、桥接和螺环系统。在稠合环系统中,一或多个环可为环烷基、芳基或杂芳基,条件是连接点经由非芳香族环。在一个实施例中,杂环基的氮和/或硫原子任选地经氧化以提供n-氧化物、亚磺酰基、磺酰基部分。
[0102]“亚杂环基”是指具有1到10个环碳原子和1到4个选自由氮、硫或氧组成的群组的环杂原子的二价饱和或部分饱和、但非芳香族基团。“经取代的亚杂环基”是指经1到5或优选1到3个如针对经取代的环烷基所定义的相同取代基取代的亚杂环基。
[0103]“经取代的杂环”或“经取代的杂环烷基”或“经取代的杂环基”是指经1到5或优选1到3 个如针对经取代的环烷基所定义的相同取代基取代的杂环基。
[0104]“杂环基氧基”是指基团-o-杂环基。
[0105]“经取代的杂环基氧基”是指基团-o-(经取代的杂环基)。
[0106]“杂环基硫基”是指基团-s-杂环基。
[0107]“经取代的杂环基硫基”是指基团-s-(经取代的杂环基)。
[0108]“杂环基氨基”是指基团-nr
37
(杂环基),其中r
37
是氢、烷基或经取代的烷基。
[0109]“经取代的杂环基氨基”是指基团-nr
37
(经取代的杂环基),其中r
37
是氢、烷基或经取代的烷基,并且经取代的杂环基是如本文所定义。
[0110]
杂环基和杂芳基的实例包括(但不限于)氮杂环丁基、吡咯基、咪唑基、吡唑基、吡啶基、吡唑基、嘧啶基、哒嗪基、中氮茚基(indolizyl)、异吲哚基、吲哚基、二氢吲哚基、吲唑基、嘌呤基、喹嗪基、异喹啉基、喹啉基、酞嗪基、萘基吡啶基、喹喏啉基、喹唑啉基、啉基、蝶啶基、咔唑基、咔啉基、啡啶基、吖啶基、啡啉基、异噻唑基、吩嗪基、异噁唑基、吩噁嗪基、吩噻嗪基、咪唑烷基、咪唑啉基、哌啶基、哌嗪基、吲哚啉基、邻苯二甲酰亚胺基、1,2,3,4-四氢异喹啉基、4,5,6,7-四氢苯并[b]噻吩基、噻唑基、噻唑烷基、噻吩基、苯并[b]噻吩基、吗啉基、硫吗啉基(thiomorpholinyl)(还称为硫吗啉基(thiamorpholinyl))、1,1-二氧代基硫吗啉基、哌啶基、吡咯烷基和四氢呋喃基。
[0111]“硝基”是指基团-no2。
[0112]“氧代基”是指原子(=o)或(o)。
[0113]“螺环系统”是指具有两个环共用的单环碳原子的二环系统。
[0114]“亚磺酰基”是指二价基团-s(o)-或-s(=o)-。
[0115]“磺酰基”是指二价基团-s(o)
2-或-s(=o)
2-。
[0116]“经取代的磺酰基”是指基团-so
2-烷基、-so
2-经取代的烷基、-so
2-oh、-so
2-烯基、
ꢀ‑
so
2-经取代的烯基、-so
2-环烷基、-so
2-经取代的环烷基、-so
2-芳基、-so
2-经取代的芳基、-so
2-杂芳基、-so
2-经取代的杂芳基、-so
2-杂环、-so
2-经取代的杂环,其中烷基、经取代的烷基、烯基、经取代的烯基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。经取代的磺酰基包括诸如以下等基团:甲基-so
2-、苯基-so
2-和4-甲基苯基-so
2-。经取代的烷基-so
2-上的优选经取代的烷基包括卤化烷基且具体来说卤化甲基,例如三氟甲基、二氟甲基、氟甲基和诸如此类。
[0117]“经取代的亚磺酰基”是指基团-so-烷基、-so-经取代的烷基、-so-烯基、-so-经取代的烯基、-so-环烷基、-so-经取代的环烷基、-so-芳基、-so-经取代的芳基、-so-杂芳基、-so-经取代的杂芳基、-so-杂环、-so-经取代的杂环,其中烷基、经取代的烷基、烯基、经取代的烯基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。经取代的亚磺酰基包括诸如以下等基团:甲基-so-、苯基-so-和4-甲基苯基-so-。经取代的烷基-so
‑ꢀ
上的优选经取代的烷基包括卤化烷基且具体来说卤化甲基,例如三氟甲基、二氟甲基、氟甲基和诸如此类。
[0118]“磺酰基氧基”或“经取代的磺酰基氧基”是指基团-oso
2-烷基、-oso
2-经取代的烷基、
ꢀ‑
oso
2-oh、-oso
2-烯基、-oso
2-经取代的烯基、-oso
2-环烷基、-oso
2-经取代的环烷基、-oso
2-芳基、-oso
2-经取代的芳基、-oso
2-杂芳基、-oso
2-经取代的杂芳基、-oso2‑ꢀ
杂环、-oso
2-经取代的杂环,其中烷基、经取代的烷基、烯基、经取代的烯基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环和经取代的杂环是如本文所定义。
[0119]“磺酰基氨基”是指基团-nr
37
(经取代的磺酰基),其中r
37
是氢、烷基或经取代的烷基,并且经取代的磺酰基是如本文所定义。
[0120]“硫代酰基”是指基团h-c(s)-、烷基-c(s)-、经取代的烷基-c(s)-、烯基-c(s)-、经
取代的烯基-c(s)-、炔基-c(s)-、经取代的炔基-c(s)-、环烷基-c(s)-、经取代的环烷基-c(s)-、芳基-c(s)-、经取代的芳基-c(s)-、杂芳基-c(s)-、经取代的杂芳基-c(s)-、杂环基-c(s)
‑ꢀ
和经取代的杂环基-c(s)-,其中烷基、经取代的烷基、烯基、经取代的烯基、炔基、经取代的炔基、环烷基、经取代的环烷基、芳基、经取代的芳基、杂芳基、经取代的杂芳基、杂环基和经取代的杂环基是如本文所定义。
[0121]“巯基”或“硫醇”是指基团-sh。
[0122]“甲酰基”是指基团-c(o)h。
[0123]“硫代羰基”是指等效于-c(=s)-的二价基团-c(s)-。
[0124]“硫酮”是指原子(=s)。
[0125]“烷基硫基”是指基团-s-烷基,其中烷基是如本文所定义。
[0126]“经取代的烷基硫基”是指基团-s-(经取代的烷基),其中经取代的烷基是如本文所定义。-s-(经取代的烷基)上优选经取代的烷基包括卤化烷基且具体来说卤化甲基,例如三氟甲基、二氟甲基、氟甲基和诸如此类。
[0127]“乙烯基”是指衍生自亚乙基的不饱和烃基团-ch=ch2。
[0128]
贯穿说明书所用的术语“可选”或“任选地”意指随后所述事件或情况可能发生,但不一定发生,并且所述说明包括所述事件或情况发生的情形和所述事件或情况不发生的情形。举例来说,“氮原子任选地经氧化以提供n-氧化物(n
→
o)部分”意指氮原子可能、但不一定经氧化,并且所述说明包括氮原子未经氧化的情形和氮原子经氧化的情形。
[0129]
术语“任选地经取代”是指经取代或未经取代的基团。经取代的基团可经一或多个取代基(例如1、2、3、4或5个取代基)取代。优选地,取代基是选自本文提供的官能基。在某些更优选实施例中,取代基是选自氧代基、卤基、-cn、no2、-co2r
100
、-or
100
、-sr
100
、
ꢀ‑
sor
100
、-so2r
100
、-nr
101r102
、-conr
101r102
、-so2nr
101r102
、c
1-c6烷基、c
1-c6烷氧基、-cr
100
=c(r
100
)2、-ccr
100
、c
3-c
10
环烷基、c
4-c
10
杂环基、c
6-c
14
芳基和c
5-c
12
杂芳基,其中各r
100
独立地是氢或c
1-c8烷基;c
3-c
12
环烷基;c
4-c
10
杂环基;c
6-c
14
芳基;或 c
2-c
12
杂芳基;其中各烷基、环烷基、杂环基、芳基或杂芳基任选地经1-3个卤基、1-3 个c
1-c6烷基、1-3个c
1-c6卤代烷基或1-3个c
1-c6烷氧基取代。更优选地,取代基是选自由以下组成的群组:氯、氟、-och3、甲基、乙基、异丙基、环丙基、-ocf3、-cf3和-ochf2。
[0130]r101
和r
102
独立地是氢;c
1-c8烷基,任选地经-co2h或其酯、c
1-c6烷氧基、氧代基、
ꢀ‑
cr
103
=c(r
103
)2、-ccr、c
3-c
10
环烷基、c
3-c
10
杂环基、c
6-c
14
芳基或c
2-c
12
杂芳基取代,其中各r
103
独立地是氢或c
1-c8烷基;c
3-c
12
环烷基;c
4-c
10
杂环基;c
6-c
14
芳基;或c
2-c
12
杂芳基;其中各环烷基、杂环基、芳基或杂芳基任选地经1-3个烷基或1-3个卤基取代,或r
101
和r
102
与其连接的氮原子一起形成5-7元杂环。
[0131]
除非另有指示,否则本文未明确定义的取代基的命名是通过命名官能基的末端部分、随后朝向连接点的毗邻官能基来实现。举例来说,取代基“烷氧基羰基烷基”是指基团(烷氧基)-c(o)-(烷基)-。
[0132]
应理解,在上文所定义的所有经取代基团中,通过将具有其它取代基的取代基限定为其自身(例如,经取代芳基具有经取代芳基作为取代基,所述取代基自身由经取代的芳基取代等)获得的聚合物并不打算包括在本文中。在所述情形下,所述取代基的最大数目是3。也就是说,上文定义中的每一者受限于例如以下限制:经取代的芳基限于-经取代的芳
基-(经取代的芳基)-经取代的芳基。
[0133]
在经取代的部分的一些实施例中,所述部分经还可经又一基团取代的基团取代,但又一基团不可另外经取代。举例来说,在“经取代的烷基”的一些实施例中,烷基部分经可进一步经取代的基团(例如经取代的烷氧基、经取代的氨基、经取代的芳基、经取代的芳基氧基、经取代的芳硫基、经取代的芳基氨基、经取代的杂芳基氨基、经取代的环烷基氨基、经取代的杂环基氨基、经取代的环烷基、经取代的环烷基氧基、经取代的环烷基硫基、经取代的胍基、经取代的杂芳基、经取代的杂芳基氧基、经取代的杂芳基硫基、经取代的杂环、经取代的杂环基氧基、经取代的杂环基硫基、经取代的磺酰基、经取代的烷硫基)取代,但烷基部分上的经取代的烷氧基、经取代的氨基、经取代的芳基、经取代的芳基氧基、经取代的芳硫基、经取代的芳基氨基、经取代的杂芳基氨基、经取代的环烷基氨基、经取代的杂环基氨基、经取代的环烷基、经取代的环烷基氧基、经取代的环烷基硫基、经取代的胍基、经取代的杂芳基、经取代的杂芳基氧基、经取代的杂芳基硫基、经取代的杂环、经取代的杂环基氧基、经取代的杂环基硫基、经取代的磺酰基或经取代的烷硫基不经自身进一步经取代的部分取代。尽管提供“经取代的烷基”作为实例,但所述实施例打算针对本文所述的每一经取代部分。
[0134]
在经取代的部分的一些实施例中,所述部分经不进一步经取代的基团取代。因此,在一些实施例中,“经取代的烷基”是经一或多个、且在一些方面中1或2或3或4或5个独立地选自由以下组成的群组的部分取代的烷基部分:烷氧基、酰基、酰基氨基、酰氧基、氨基、氨基羰基、氨基硫代羰基、氨基羰基氨基、氨基硫代羰基氨基、氨基羰基氧基、氨基磺酰基、氨基磺酰基氧基、氨基磺酰基氨基、甲脒基、芳基、芳基氧基、芳硫基、芳基氨基、杂芳基氨基、环烷基氨基、杂环烷基氨基、羧基、羧基酯、(羧基酯)氨基、(羧基酯)氧基、氰基、环烷基、环烷基氧基、环烷基硫基、胍基、卤基、羟基、杂芳基、杂芳基氧基、杂芳基硫基、杂环、杂环基氧基、杂环基硫基、硝基、so3h、磺酰基氧基、磺酰基氨基、硫代酰基、硫醇和烷硫基。尽管提供“经取代的烷基”作为实例,但所述实施例打算针对本文所述的每一经取代部分。
[0135]
应理解,上述定义并不打算包括不允许的取代型式(例如经4个氟基团取代的甲基)。所述不允许的取代型式为所属领域技术人员所熟知。
[0136]
应了解,为清晰起见而在单独实施例的上下文中所描述的本发明的某些特征还可在单一实施例中组合提供。相反地,为简便起见在单一实施例的上下文中描述的本发明的各种特征还可单独或以任何适宜子组合提供。关于由变量所代表的化学基团的实施例的所有组合都特定涵盖于本发明且如同每一和每个组合个别且明确地揭示一样以所述组合涵盖产生稳定化合物的化合物(即,可分离、表征和测试生物活性的化合物)的程度揭示于本文中。此外,描述所述变量的实施例中所列举化学基团的所有子组合还特定涵盖于本发明且如同每一和每个化学基团的子组合个别且明确地揭示于本文中一样揭示于本文中。
[0137]
化合物
[0138]
在一个方面中,本发明提供式(i)化合物:
[0139][0140]
或其互变异构体或n-氧化物、或其每一者的同位素变构体、或上述中每一者之前药、或上述的立体异构体、或上述中每一者的医药上可接受的盐、或前述中每一者的溶剂合物,其中:
[0141]
l是-nh-co-、-co-nh-、-nh-so
2-或-so
2-nh-;
[0142]
r1是任选地经取代的c
6-c
10
芳基、任选地经取代的5-10元杂芳基、任选地经取代的 4-10元杂环、c(o)nr6r7、s(o)2nr6r7、nr6cor7或nr6so2r7或c(o)or6;
[0143]
r2是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
2-c6烯基、任选地经取代的c
2-c6炔基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;
[0144]
r3是h、任选地经取代的c
1-c6烷基、任选地经取代的c
2-c6烯基、任选地经取代的 c
2-c6炔基、任选地经取代的环烷基、任选地经取代的杂环烷基、任选地经取代的芳基、任选地经取代的杂芳基、or6或nr6r7;或
[0145]
r2和r3与间插原子一起形成环烷基或杂环烷基、优选任选地经取代的c
3-c8环烷基或任选地经取代的4-10元杂环烷基;
[0146]
r4是任选地经取代的c
1-c6烷基,优选c
1-c3卤代烷基,例如cf3或cf2cl;任选地经取代的c
2-c6烯基、任选地经取代的c
2-c6炔基;
[0147]
x是o或s;
[0148]
y是ch、c-(c
1-c2烷基)或c-卤基或n;
[0149]
z是cr5或n;
[0150]
r5是h或卤素;
[0151]
r6是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;且
[0152]
r7是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;或
[0153]
r6和r7与其连接的氮一起形成任选地经取代的4-7元杂环,
[0154]
条件是所述化合物不为(i)5-[[(4-甲氧基苯基)磺酰基]氨基]-1-甲基-1h-苯并咪唑-7
‑ꢀ
甲酸或(ii)5-[[(4-乙氧基苯基)磺酰基]氨基]-1-甲基-1h-苯并咪唑-7-甲酸。
[0155]
在一些实施例中,提供式(i-i)化合物:
[0156][0157]
或其互变异构体或n-氧化物、或其每一者的同位素变构体、或上述中每一者之前药、或上述的立体异构体、或上述中每一者的医药上可接受的盐、或前述中每一者的溶剂合物,其中:
[0158]
l是-nh-co-、-co-nh-或-nh-so
2-;
[0159]
r1是任选地经取代的c
6-c
10
芳基、任选地经取代的5-10元杂芳基、任选地经取代的 4-10元杂环、c(o)nr6r7、s(o)2nr6r7、nr6cor7或nr6so2r7或c(o)or6;
[0160]
r2是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
2-c6烯基、任选地经取代的c
2-c6炔基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;
[0161]
r3是h、任选地经取代的c
1-c6烷基、任选地经取代的c
2-c6烯基、任选地经取代的 c
2-c6炔基、任选地经取代的环烷基、任选地经取代的杂环烷基、任选地经取代的芳基、任选地经取代的杂芳基、or6或nr6r7;或
[0162]
r2和r3与间插原子一起形成环烷基或杂环烷基、优选任选地经取代的c
3-c8环烷基或任选地经取代的4-10元杂环烷基;
[0163]
r4是任选地经取代的c
1-c6烷基,优选c
1-c3卤代烷基,例如cf3或cf2cl;任选地经取代的c
2-c6烯基、任选地经取代的c
2-c6炔基;
[0164]
x是o或s;
[0165]
y是ch、c-(c
1-c2烷基)或c-卤基或n;
[0166]
z是cr5或n;
[0167]
r5是h或卤素;
[0168]
r6是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;且
[0169]
r7是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;或
[0170]
r6和r7与其连接的氮一起形成任选地经取代的4-7元杂环。
[0171]
本文还提供式(i-a)化合物:
[0172][0173]
其中r1、r2、r3、r4、x、y、z和l是如针对式(i)化合物所定义。
[0174]
在一些实施例中,化合物具有式(ia):
[0175][0176]
应理解,当z是n时,那么r5不存在。类似地,应理解,当r5存在时,那么r5结合到芳基环中的碳原子,使得z是cr5。
[0177]
在一些实施例中,化合物具有式(ia-1):
[0178][0179]
在一些实施例中,化合物是选自式(iia)-(iih):
[0180][0181]
其中r
10
是任选地经取代的5-6元杂芳基,优选地,杂芳基部分具有最多2个环氮原子;
[0182]r20
是任选地经取代的c
1-c3烷基、任选地经取代的c
3-c4环烷基或任选地经取代的4-6 元杂环烷基,优选地,r
20
是甲基、任选地经取代的异丙基或环丙基;
[0183]r30
是h、任选地经取代的c
1-c3烷基、任选地经取代的c
3-c4环烷基或任选地经取代的5-6元杂环烷基,优选任选地经取代的环丙基;
[0184]
环a是任选地经取代的5-6元杂环烷基;且
[0185]
其余变量如本文所定义。
[0186]
在一些实施例中,化合物具有式(iia):
[0187][0188]
在一些实施例中,化合物具有式(iib):
[0189][0190]
在一些实施例中,化合物具有式(iic):
[0191][0192]
在一些实施例中,化合物具有式(iid):
[0193][0194]
在一些实施例中,化合物具有式(iie):
[0195][0196]
在一些实施例中,本文提供的化合物具有式(iif):
[0197][0198]
在一些实施例中,本文提供的化合物具有式(iig):
[0199][0200]
在一些实施例中,本文提供的化合物具有式(iih):
[0201][0202]
在一些实施例中,本文提供的化合物具有式(ib):
[0203][0204]
其中其余变量如本文所定义。
[0205]
在一些实施例中,本文提供的化合物具有式(ic):
[0206][0207]
其中其余变量如本文所定义。
[0208]
在一些实施例中,本文提供的化合物具有式(id)或(ie):
[0209]
[0210]
其中其余变量如本文所定义。
[0211]
在一些实施例中,l是-nh-co-。在一些实施例中,l是-co-nh-。在一些实施例中, l是-nh-so
2-。在一些实施例中,l是-so
2-nh-。
[0212]
在一些实施例中,r1是任选地经取代的c
6-c
10
芳基。在一些实施例中,r1是任选地经取代的5-10元杂芳基。在一些实施例中,r1是任选地经取代的4-10元杂环。在一些实施例中,r1是c(o)nr6r7。在一些实施例中,r1是s(o)2nr6r7。在一些实施例中,r1是 nr6cor7。在一些实施例中,r1是或nr6so2r7。在一些实施例中,r1是c(o)or6。
[0213]
在一些实施例中,r2是h。在一些实施例中,r2是任选地经取代的c
1-c6烷基。在一些实施例中,r2是环烷基烷基。在一些实施例中,r2是杂环基烷基。在一些实施例中, r2是芳基烷基。在一些实施例中,r2是杂芳基烷基。在一些实施例中,r2是任选地经取代的c
3-c8环烷基。在一些实施例中,r2是任选地经取代的4-10元杂环烷基。在一些实施例中,r2是任选地经取代的c
2-c6烯基。在一些实施例中,r2是任选地经取代的c
2-c6炔基。在一些实施例中,r2是任选地经取代的c
6-c
10
芳基。在一些实施例中,r2是任选地经取代的5-10元杂芳基。
[0214]
在一些实施例中,r3是h。在一些实施例中,r3是任选地经取代的c
1-c6烷基。在一些实施例中,r3是任选地经取代的c
2-c6烯基。在一些实施例中,r3是任选地经取代的 c
2-c6炔基。在一些实施例中,r3是任选地经取代的环烷基。在一些实施例中,r3是任选地经取代的杂环烷基。在一些实施例中,r3是任选地经取代的4-6元杂环烷基。在一些实施例中,r3是任选地经取代的芳基。在一些实施例中,r3是任选地经取代的c
6-c
10
芳基。在一些实施例中,r3是任选地经取代的杂芳基。在一些实施例中,r3是任选地经取代的 5-10元杂芳基。在一些实施例中,r3是c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
3-c6环烷基、 4到6元杂环烷基、c
6-c
10
芳基或5到10元杂芳基,其各自任选地由1-3个选自由卤素、羟基和c
1-c6烷基组成的群组的取代基取代。在一些实施例中,r3是or6。在一些实施例中, r3是nr6r7。
[0215]
在一些实施例中,r2和r3与间插原子一起形成环a,所述环a是环烷基。应理解,r2和r3与间插原子一起形成环a,所述环a是环烷基,不包括r2所连接的氮原子。相反,应理解,无除r2所连接的氮原子外的其它杂原子构成环a。在一些实施例中,r2和r3与间插原子一起形成环a,所述环a是杂环烷基。应理解,r2和r3与间插原子一起形成环a,所述环a是杂环烷基,包括r2所连接的氮原子。还应理解,额外杂原子、进一步关于r2所连接的氮原子可构成环a。在一些实施例中,r2和r3与间插原子一起形成环a,所述环a是杂环烷基,并且不包括除r2所连接的氮原子外的任何杂原子。在一些实施例中, r2和r3与间插原子一起形成环a,所述环a是杂环烷基,并且包括r2所连接的氮原子以及额外杂原子。在一些实施例中,r2和r3与间插原子一起形成环a,所述环a是任选地经取代的c
3-c8环烷基。适宜环烷基取代基包括(但不限于)c
1-c6烷基、羟基c
1-c6烷基和经1-3个卤基、优选氟原子取代的c
1-c6烷基。在一些实施例中,r2和r3与间插原子一起形成环a,所述环a是任选地经取代的4-10元杂环烷基。适宜杂环烷基取代基包括(但不限于)c
1-c6烷基、羟基c
1-c6烷基和经1-3个卤基、优选氟原子取代的c
1-c6烷基。
[0216]
在一些实施例中,r4是任选地经取代的c
1-c6烷基。在一些实施例中,r4是c
1-c3卤代烷基。在一些实施例中,r4是cf3。在一些实施例中,r4是cf2cl。在一些实施例中, r4是任选地经取代的c
2-c6烯基。在一些实施例中,r4是任选地经取代的c
2-c6炔基。
[0217]
在一些实施例中,x是o。在一些实施例中,x是s。
[0218]
在一些实施例中,y是ch。在一些实施例中,y是c-(c
1-c2烷基)。在一些实施例中, y是c-卤基。在一些实施例中,y是n。
[0219]
在一些实施例中,z是cr5。在一些实施例中,z是n。
[0220]
在一实施例中,r5是h。在另一实施例中,r5是卤素。
[0221]
在一些实施例中,r6是h。在一些实施例中,r6是任选地经取代的c
1-c6烷基。在一些实施例中,r6是任选地经取代的c
3-c8环烷基。在一些实施例中,r6是任选地经取代的 4-10元杂环烷基。在一些实施例中,r6是任选地经取代的c
6-c
10
芳基。在一些实施例中, r6是任选地经取代的5-10元杂芳基。在一些实施例中,r6是c
1-c6烷基、c
3-c8环烷基、 4-10元杂环烷基、c
6-c
10
芳基或5-10元杂芳基,其各自任选地由1-3个选自由卤素、羟基和c
1-c6烷基组成的群组的取代基取代。
[0222]
在一些实施例中,r7是h。在一些实施例中,r7是任选地经取代的c
1-c6烷基。在一些实施例中,r7是任选地经取代的c
3-c8环烷基。在一些实施例中,r7是任选地经取代的 4-10元杂环烷基。在一些实施例中,r7是任选地经取代的c
6-c
10
芳基。在一些实施例中, r7是任选地经取代的5-10元杂芳基。在一些实施例中,r7是c
1-c6烷基、c
3-c8环烷基、 4-10元杂环烷基、c
6-c
10
芳基或5-10元杂芳基,其各自任选地由1-3个选自由卤素、羟基和c
1-c6烷基组成的群组的取代基取代。
[0223]
在一些实施例中,r6是h;且r7是h、任选地经取代的c
1-c6烷基、任选地经取代的 c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基。
[0224]
在一些实施例中,r6和r7与其连接的氮一起形成任选地经取代的4-7元杂环。在一些实施例中,r6和r7与其连接的氮一起形成任选地由1-3个选自由卤素、羟基和c
1-c6烷基组成的群组的取代基取代的4-7元杂环。
[0225]
在一些实施例中,r
10
是5-6元杂芳基。在一些实施例中,r
10
是5-6元杂芳基,其中杂芳基部分具有最多2个环氮原子。在一些实施例中,r
10
是任选地由1-3个选自由卤素、氰基、羟基、c
1-c6烷氧基、c
1-c6烷基和c
3-c6环烷基组成的群组的取代基取代的5-6元杂芳基。
[0226]
在一些实施例中,r
20
是任选地经取代的c
1-c3烷基。在一些实施例中,r
20
是任选地经取代的c
3-c4环烷基。在一些实施例中,r
20
是甲基。在一些实施例中,r
20
是任选地经取代的异丙基。在一些实施例中,r
20
是环丙基。在一些实施例中,r
20
是c
1-c3烷基、c
3-c4环烷基或4-6元杂环烷基,其各自任选地由1-3个选自由卤素、羟基、c
1-c6烷氧基、c
1-c6烷基、c
3-c6环烷基、4到6元杂环基、氰基、氧代基、-c(o)nh(c
1-c6烷基)和-c(o)nh(c
3-c6环烷基)组成的群组的取代基取代。在一些实施例中,r
30
是h。在一些实施例中,r
30
是任选地经取代的c
1-c3烷基。在一些实施例中,r
30
是任选地经取代的c
3-c4环烷基。在一些实施例中,r
30
是任选地经取代的环丙基。在一些实施例中,r
30
是c
1-c3烷基、c
3-c4环烷基或5-6元杂环烷基,其各自任选地由1-3个选自由卤素、羟基和c
1-c6烷基组成的群组的取代基取代。
[0227]
在一些实施例中,r1是5-6元杂芳基。在一些实施例中,r1是含有最多2个环氮原子的5-6元杂芳基。在一些实施例中,r1是含有2个环氮原子的5-6元杂芳基。在一些实施例中,r1是含有1个环氮原子的5-6元杂芳基。在一些实施例中,r1是含有3个环氮原子的5-6 元杂芳基。在一些实施例中,r1是嘧啶基。在一些实施例中,r1是吡唑基。在一些实施例中,r1是吡啶基。在一些实施例中,r1是三唑基。在一些实施例中,r1是咪唑基。在一些实施例中,r1是哒
嗪基。在一些实施例中,r1是含有1个环氮原子和1个环硫原子的 5-6元杂芳基。在一些实施例中,r1是含有1个环氮原子和1个环氧原子的5-6元杂芳基。在一些实施例中,r1是噻唑基。在一些实施例中,r1是噁唑基。在一些实施例中,r1是异噻唑基。在一些实施例中,r1是异噁唑基。在一些实施例中,r1是含有1个环氮原子的4-5元杂环基。在一些实施例中,r1是任选地由1-2个氧代基取代的4-5元杂环基。在一些实施例中,r1是氮杂环丁基。在一些实施例中,r1是吡咯烷基。在这些实施例的任一者中,r1任选地由1-3个选自由以下组成的群组的取代基取代:卤素、氰基、羟基、c
1-c6烷氧基、c
1-c6烷基和c
3-c6环烷基。在一些变化形式中,r1由1-2个选自由以下组成的群组的取代基取代:卤素、氰基、羟基、c
1-c3烷氧基、c
1-c3烷基和c
3-c6环烷基。在一些变化形式中,r1由1个选自由以下组成的群组的取代基取代:卤素、氰基、羟基、c
1-c3烷氧基、c
1-c3烷基和c
3-c6环烷基。在一些变化形式中,r1由1个选自由以下组成的群组的取代基取代:氟、氯、溴、氰基、羟基、甲氧基、乙氧基、甲基、乙基、环丙基、环丁基、环戊基和环己基。
[0228]
在一些实施例中,r1是
[0229][0230]
在一些实施例中,r1是
[0231][0232]
在一些实施例中,r1是
[0233][0234]
在一些实施例中,r1是
[0235][0236]
在一些实施例中,r1是
[0237][0238]
在一些实施例中,r1是
[0239]
[0240]
在一些实施例中,r1是
[0241][0242]
在一些实施例中,r1是
[0243][0244]
在一些实施例中,r1是
[0245][0246]
在一些实施例中,r1是
[0247][0248]
在一些实施例中,r1是
[0249][0250]
在一些实施例中,r1是
[0251][0252]
在一些实施例中,r1是
[0253][0254]
在一些实施例中,r1是
[0255][0256]
在一些实施例中,r1是
[0257][0258]
在一些实施例中,r1是
[0259][0260]
在一些实施例中,r1是
[0261][0262]
在一些实施例中,r1是
[0263][0264]
在一些实施例中,r1是
[0265][0266]
在一些实施例中,r1是
[0267][0268]
在一些实施例中,r1是
[0269][0270]
在一些实施例中,r1是
[0271][0272]
在一些实施例中,r1是
[0273][0274]
在一些实施例中,r1是
[0275][0276]
在一些实施例中,r1是
[0277][0278]
在一些实施例中,r1是
[0279][0280]
在一些实施例中,r1是
[0281]
[0282]
在一些实施例中,r1是
[0283][0284]
在一些实施例中,r1是
[0285][0286]
在一些实施例中,r1是
[0287][0288]
在一些实施例中,r1是
[0289][0290]
在一些实施例中,r1是
[0291][0292]
在一些实施例中,r
1-conhr7,其中r7是h、c
3-c6环烷基或c
1-c6烷基。
[0293]
在一些实施例中,r1是-conh(c
3-c6环烷基)。在一些实施例中,r1是-conh(c
3-c5环烷基)。在一些实施例中,r1是-conh(c
3-c4环烷基)。
[0294]
在一些实施例中,r1是-conh(环丙基)。
[0295]
在一些实施例中,r1是-conh2。
[0296]
在一些实施例中,r1是-conh(c
1-c6烷基)。在一些实施例中,r1是-conh(c
1-c3烷基)。在一些实施例中,r1是-con(h)(ch3)或-con(h)(c2h5)。
[0297]
在一些实施例中,r2是任选地经取代的c
1-c3烷基。在一些实施例中,r2是甲基。在一些实施例中,r2是乙基。在一些实施例中,r2是丙基。在一些实施例中,r2是任选地经取代的异丙基。在一些实施例中,r2是异丙基。在一些实施例中,r2是丁基。在一些实施例中,r2是叔丁基。在一些实施例中,r2是戊基。在一些实施例中,r2是正戊基、仲戊基、3-戊基或仲异戊基。在一些实施例中,r2是任选地经取代的c
3-c4环烷基。在一些实施例中,r2是环丙基。在一些实施例中,r2是环丁基。在一些实施例中,r2是环戊基。在一些实施例中,r2是4到6元杂环基。在一些实施例中,r2是含有1或2个选自由氮、硫和氧组成的群组的杂原子的4到6元杂环
基。在一些实施例中,r2是四氢呋喃基。在一些实施例中,r2是四氢吡喃基。在一些实施例中,r2是硫杂环丁基。在一些实施例中, r2是吡咯烷基。在这些实施例的任一者中,r2任选地由1-3个选自由以下组成的群组的取代基取代:卤素、羟基、c
1-c6烷氧基、c
1-c6烷基、c
3-c6环烷基、4到6元杂环基、氰基、氧代基、-c(o)nh(c
1-c6烷基)和-c(o)nh(c
3-c6环烷基)。在一些变化形式中,r2由1-3个选自由以下组成的群组的取代基取代:卤素、羟基、c
1-c3烷氧基、c
1-c3烷基、c
3-c5环烷基、4到6元杂环基、氰基、氧代基、-c(o)nh(c
1-c3烷基)和-c(o)nh(c
3-c6环烷基)。在一些变化形式中,r2由1-3个选自由以下组成的群组的取代基取代:氟、氯、溴、羟基、甲氧基、乙氧基、甲基、乙基、环丙基、环丁基、氧杂环丁基、氰基、氧代基、-c(o)nh(ch3)、
ꢀ‑
c(o)nh(ch2ch3)、-c(o)nh(环丙基)、-c(o)nh(环丁基)、-c(o)nh(环戊基)和
ꢀ‑
c(o)nh(环己基)。
[0298]
在一些实施例中,r2是h。
[0299]
在一些实施例中,r2是
[0300][0301]
在一些实施例中,r2是
[0302][0303]
在一些实施例中,r2是
[0304][0305]
在一些实施例中,r2是
[0306][0307]
在一些实施例中,r2是
[0308][0309]
在一些实施例中,r2是
[0310][0311]
在一些实施例中,r2是
[0312][0313]
在一些实施例中,r2是
[0314][0315]
在一些实施例中,r2是
[0316][0317]
在一些实施例中,r2是
[0318][0319]
在一些实施例中,r2是
[0320][0321]
在一些实施例中,r2是
[0322][0323]
在一些实施例中,r2是
[0324][0325]
在一些实施例中,r2是
[0326][0327]
在一些实施例中,r2是
[0328][0329]
在一些实施例中,r2是
[0330][0331]
在一些实施例中,r2是
[0332][0333]
在一些实施例中,r2是
[0334][0335]
在一些实施例中,r2是
[0336][0337]
在一些实施例中,r2是
[0338]
[0339]
在一些实施例中,r2是
[0340][0341]
在一些实施例中,r2是
[0342][0343]
在一些实施例中,r2是
[0344][0345]
在一些实施例中,r2是
[0346][0347]
在一些实施例中,r2是
[0348][0349]
在一些实施例中,r2是
[0350][0351]
在一些实施例中,r2是
[0352][0353]
在一些实施例中,r2是
[0354][0355]
在一些实施例中,r2是
[0356][0357]
在一些实施例中,r2是
[0358][0359]
在一些实施例中,r2是
[0360][0361]
在一些实施例中,r2是
[0362][0363]
在一些实施例中,r2是
[0364][0365]
在一些实施例中,r2和r3与间插原子一起形成环a,所述环a是任选地经取代的5到 6元杂环烷基。在一些实施例中,环a任选地由1-3个选自由以下组成的群组的取代基取代:c
1-c6烷基、羟基、c
1-c6烷基-oh、-c(o)(c
1-c6烷基)和氧代基。在一些变化形式中,环a由1-3个选自由以下组成的群组的取代基取代:c
1-c3烷基、羟基、c
1-c3烷基-oh、
ꢀ‑
c(o)(c
1-c3烷基)和氧代基。在一些变化形式中,环a由1-3个选自由以下组成的群组的取代基取代:甲基、乙基、羟基、-ch2oh、-ch2ch
2-oh、-c(o)ch3、-c(o)ch2ch3和氧代基。
[0366]
在一些实施例中,r2和r3一起形成:
[0367][0368]
在一些实施例中,r2和r3一起形成:
[0369][0370]
在一些实施例中,r2和r3一起形成:
[0371][0372]
在一些实施例中,r2和r3一起形成:
[0373][0374]
在一些实施例中,r2和r3一起形成:
[0375][0376]
在一些实施例中,r2和r3一起形成:
[0377][0378]
在一些实施例中,r2和r3一起形成:
[0379][0380]
在一些实施例中,r2和r3一起形成:
[0381][0382]
在一些实施例中,r2和r3一起形成:
[0383][0384]
在一些实施例中,r2和r3一起形成:
[0385][0386]
在一些实施例中,r2和r3一起形成:
[0387][0388]
在一些实施例中,r2和r3一起形成:
[0389][0390]
在一些实施例中,r2和r3一起形成:
[0391][0392]
在一些实施例中,r2和r3一起形成:
[0393][0394]
在一些实施例中,r2和r3一起形成:
[0395][0396]
在一些实施例中,r2和r3一起形成:
[0397][0398]
在一些实施例中,r2和r3一起形成:
[0399][0400]
在一些实施例中,r2和r3一起形成:
[0401][0402]
在一些实施例中,r2和r3一起形成:
[0403][0404]
在一些实施例中,r2和r3一起形成:
[0405][0406]
在一些实施例中,r2和r3一起形成:
[0407][0408]
在一些实施例中,r2和r3一起形成:
[0409][0410]
在一些实施例中,r2和r3一起形成:
[0411][0412]
在一些实施例中,r2和r3一起形成:
[0413][0414]
在一些实施例中,r2和r3一起形成:
[0415][0416]
在一些实施例中,r2和r3一起形成:
[0417][0418]
在一些实施例中,r3是h。在一些实施例中,r3是任选地经1-3个选自由以下组成的群组的取代基取代的c
1-c6烷基:卤素、羟基和-o(c
1-c6烷基)。在一些实施例中,r3是甲基。在一些实施例中,r3是异丙基。在一些实施例中,r3是二氟甲基。在一些实施例中,r3是羟乙基。在一些实施例中,r3是-ch2ch2oh。在一些实施例中,r3是-c(me)2oh。在一些实施例中,r3是-ch(me)oh。在一些实施例中,r3是甲氧基甲基。在一些实施例中,r3是羟基甲基。在一些实施例中,r3是c
3-c6环烷基。在一些实施例中,r3是由1-3 个选自由以下组成的群组的取代基取代的c
3-c6环烷基:卤素、c
1-c6烷基和羟基。在一些实施例中,r3是环丙基。在一些实施例中,r3是环丁基。在一些实施例中,r3是-or6,其中r6是c
1-c6烷基。在一些实施例中,r3是甲氧基。在一些实施例中,r3是乙氧基。在一些实施例中,r3是4到6元杂环基。在一些实施例中,r3是由1-3个选自由以下组成的群组的取代基取代的4到6元杂环基:卤素、c
1-c6烷基和羟基。在一些实施例中,r3是四氢吡喃基。
[0419]
在一些实施例中,r4是任选地经取代的c
1-c3烷基。在一些实施例中,r4是c
1-c3烷基,其中烷基经一或多个卤基取代基取代。在一些实施例中,r4是经1-3个卤基取代基取代的c
1-c3烷基。在一些实施例中,r4是cf3。在一些实施例中,r4是cf2cl。
[0420]
在一方面中,提供式(i)化合物,其中所述化合物具有以下特征中的一或多者:
[0421]
(i)r1是:
[0422]
(i)任选地由1-3个选自由以下组成的群组的取代基取代的5-6元杂芳基:卤素、氰基、羟基、c
1-c6烷氧基、c
3-c6环烷基和c
1-c6烷基;或
[0423]
(ii)任选地由1-3个选自由以下组成的群组的取代基取代的4-5元杂环基:卤素、氰基、羟基、c
1-c6烷氧基、c
3-c6环烷基、c
1-c6烷基和氧代基;或
[0424]
(iii)r1是-conhr7,其中r7是h、c
3-c6环烷基或c
1-c6烷基;
[0425]
(ii)r2是:
[0426]
(iv)任选地由1-3个选自由以下组成的群组的取代基取代的c
1-c6烷基:卤素、羟基、 c
1-c6烷氧基、c
1-c6烷基、c
3-c6环烷基、4到6元杂环基、氰基、-c(o)nh(c
1-c6烷基)和
ꢀ‑
c(o)nh(c
3-c6环烷基);或
[0427]
(v)r2是任选地由1-3个选自由以下组成的群组的取代基取代的c
3-c6环烷基:卤素、羟基、c
1-c6烷氧基、c
1-c6烷基、c
3-c6环烷基、4到6元杂环基、氰基、氧代基、
ꢀ‑
c(o)nh(c
1-c3烷基)和-c(o)nh(c
3-c6环烷基);或
[0428]
(vi)任选地由1-3个选自由以下组成的群组的取代基取代的4到6元杂环基:卤素、羟基、c
1-c6烷氧基、c
1-c6烷基、c
3-c6环烷基、4到6元杂环基、氰基、氧代基、-c(o)nh(c
1-c3烷基)和-c(o)nh(c
3-c6环烷基);或
[0429]
(vii)h;
[0430]
(iii)r3是
[0431]
(viii)h;或
[0432]
(ix)任选地由1-3个选自由以下组成的群组的取代基取代的c
1-c6烷基:卤素、羟基
和-o(c
1-c6烷基);或
[0433]
(x)-or6,其中r6是c
1-c6烷基;或
[0434]
(xi)任选地由1-3个选自由以下组成的群组的取代基取代的c
3-c6环烷基:卤素、 c
1-c6烷基和羟基;或
[0435]
(xii)任选地由1-3个选自由以下组成的群组的取代基取代的4到6元杂环基:卤素、 c
1-c6烷基和羟基;
[0436]
(iv)r2和r3与间插原子一起形成环a,所述环a是任选地由1-3个选自由以下组成的群组的取代基取代的5到6元杂环烷基:c
1-c6烷基、羟基、c
1-c6烷基-oh、-c(o)(c
1-c6烷基)和氧代基;
[0437]
(v)r4是任选地由1-3个卤素取代的c
1-c3烷基;
[0438]
(vi)l是-nh-co-;
[0439]
(vii)z是-ch、c-卤基或n;
[0440]
(viii)x是-o。
[0441]
在一种变化形式中,(i)适用。在一种变化形式中,(ii)适用。在一种变化形式中,(iii) 适用。在一种变化形式中,(iv)适用。在一种变化形式中,(v)适用。在一种变化形式中, (vi)适用。在一种变化形式中,(vii)适用。在一种变化形式中,(viii)适用。在此变化形式的一个方面中,(i)、(ii)、(iii)、(v)、(vi)、(vii)和(viii)适用。在此变化形式的另一方面中、(i)、(iv)、(v)、(vi)、(vii)和(viii)适用。在一种变化形式中,(v)、(vi)、(vii) 和(viii)适用。在一种变化形式中,(i)、(iv)和(viii)适用。在一种变化形式中,(i)、(v)和 (viii)适用。在一种变化形式中,(iv)、(iv)和(ix)适用。在一种变化形式中,(iv)、(iv)和(x) 适用。在一种变化形式中,(i)、(v)和(ix)适用。在一种变化形式中,(i)、(vi)和(viii)适用。在一种变化形式中,(i)、(iv)和(xi)适用。在一种变化形式中,(i)、(vii)和(viii)适用。在一种变化形式中,(i)、(iv)和(xii)适用。在一种变化形式中,(i)和(iv)适用。在一种变化形式中,(ii)、(iv)和(viii)适用。在一种变化形式中,(ii)和(iv)适用。在一种变化形式中, (iii)、(iv)和(viii)适用。在一种变化形式中,(iii)和(iv)适用。
[0442]
在一方面中,提供式(i)化合物,例如下文实例(例如实例1-49)中所提供和在表1中制成表(实例50-232)的那些化合物,或其互变异构体或n-氧化物、或其每一者的同位素变构体、或上述中每一者之前药、或上述的立体异构体、或上述中每一者的医药上可接受的盐、或前述中每一者的溶剂合物。
[0443]
本揭示内容还包括本文提到的化合物的所有盐、例如医药上可接受的盐。本揭示内容还包括所述化合物的任何或所有立体化学形式,包括任何镜像异构或非镜像异构形式、和任何互变异构体和其它形式,例如n-氧化物、溶剂合物、前药或同位素变构体。除非在化学结构或名称中明确指示立体化学,否则结构或名称打算包涵所绘示化合物的所有可能的立体异构体。另外,在绘示具体立体化学形式的情况下,应理解,本发明还包涵其它立体化学形式。本发明还包涵化合物的所有形式,例如化合物的结晶型或非结晶型。还打算包涵包含本发明化合物的组合物,例如大体上纯的化合物的组合物,包括其具体立体化学形式。本发明还包涵包含以任何比率的本发明化合物的混合物的组合物,包括以任何比率的本发明化合物的两种或更多种立体化学形式的混合物,使得包涵化合物之外消旋、非外消旋、镜像异构富集和成比例消旋混合物。
[0444]
在本文的说明中,应理解,部分的每个说明、变化、实施例或方面可与其它部分的每个说明、变化、实施例或方面组合,如同说明的每一和每个组合明确且个别地列举一样。举例来说,本文关于式(i)的r1提供的每个说明、变化、实施例或方面可与r2、r3、 r4、r5、r6、r7、x、l、y和/或z的每个说明、变化、实施例或方面组合,如同每一和每个组合明确且个别地列举一样。还应理解,式(i)的所有说明、变化、实施例或方面在适用的情形中同样适用于本文详述的其它式,并且同样进行描述,如同每个说明、变化、实施例或方面单独且个别地针对所有式所列举一样。举例来说,式(i)的所有说明、变化、实施例或方面在适用的情形中同样适用于本文详述的式(i-i)、(ia)、(ia)、(ia-1)、(iia)、 (iib)、(iic)、(iid)、(iie)、(iif)、(iig)、(iih)、(ib)、(ic)、(id)和(ie)中的任一者,并且同样进行描述,如同每一和每个说明、变化、实施例或方面单独且个别地针对所有式所列举一样。
[0445]
本发明还包括本文提到的化合物的所有盐、例如医药上可接受的盐。本发明还包括所述化合物的任何或所有立体化学形式,包括任何镜像异构或非镜像异构形式、和任何互变异构体和其它形式,例如n-氧化物、溶剂合物、前药或同位素变构体。除非在化学结构或名称中明确指示立体化学,否则结构或名称打算包涵所绘示化合物的所有可能的立体异构体。另外,在绘示具体立体化学形式的情况下,应理解,本发明还包涵其它立体化学形式。本发明还包涵化合物的所有形式,例如化合物的结晶型或非结晶型。还打算包涵包含本发明化合物的组合物,例如大体上纯的化合物的组合物,包括其具体立体化学形式。本发明还包涵包含以任何比率的本发明化合物的混合物的组合物,包括以任何比率的本发明化合物的两种或更多种立体化学形式的混合物,使得包涵化合物之外消旋、非外消旋、镜像异构富集和成比例消旋混合物。
[0446]
医药组合物和调配物
[0447]
本发明包涵本文详述的化合物中的任一者的医药组合物。因此,本发明包括包含本发明化合物或其医药上可接受的盐和医药上可接受的载剂或赋形剂的医药组合物。在一方面中,医药上可接受的盐是酸加成盐、例如与无机或有机酸形成的盐。本发明的医药组合物可采用适于经口、经颊、非经肠、经鼻、局部或直肠投与的形式或适于通过吸入投与的形式。
[0448]
如本文详述的化合物在一个方面中可呈纯化形式,并且本文详述包含呈纯化形式的化合物的组合物。提供包含如本文详述的化合物或其盐的组合物,例如大体上纯化合物的组合物。在一些实施例中,含有如本文详述的化合物或其盐的组合物呈大体上纯形式。在一种变化形式中,“大体上纯”要指组合物含有不超过35%杂质,其中杂质表示除构成组合物的大部分的化合物或其盐之外的化合物。举例来说,选自表1(a、b等)的化合物的大体上纯化合物的组合物要指组合物含有不超过35%杂质,其中杂质表示除所述化合物或其盐之外的化合物。在一种变化形式中,提供大体上纯化合物或其盐的组合物,其中组合物含有不超过25%杂质。在另一变化形式中,提供大体上纯化合物或其盐的组合物,其中组合物含有或不超过20%杂质。在另一变化形式中,提供大体上纯化合物或其盐的组合物,其中组合物含有或不超过10%杂质。在又一变化形式中,提供大体上纯化合物或其盐的组合物,其中组合物含有或不超过5%杂质。在另一变化形式中,提供大体上纯化合物或其盐的组合物,其中组合物含有或不超过3%杂质。在另一变化形式中,提供大体上纯化合物或其盐的组合物,其中组合物含有或不超过1%杂质。在又一变化形式中,提供大体上纯化合物或其盐的
组合物,其中组合物含有或不超过0.5%杂质。在其它变化形式中,大体上纯化合物的组合物意指组合物含有不超过15%或优选不超过10%或更优选不超过5%或甚至更优选不超过3%杂质且最优选不超过1%杂质,所述杂质可为呈不同立体化学形式的化合物。例如且不限于,大体上纯(s)化合物的组合物意指组合物含有不超过15%或不超过10%或不超过5%或不超过3%或不超过1%的(r)形式的化合物。
[0449]
在一种变化形式中,本文的化合物是制备用于投与个体(例如人类)的合成化合物。在另一变化形式中,提供含有呈大体上纯形式的化合物的组合物。在另一变化形式中,本发明包涵包含本文详述的化合物和医药上可接受的载剂或赋形剂的医药组合物。在另一变化形式中,提供投与化合物的方法。纯化形式、医药组合物和投与化合物的方法适于本文详述的任何化合物或其形式。
[0450]
化合物可经调配用于任何可用的递送途径,包括经口、经粘膜(例如经鼻、舌下、经阴道、经颊或直肠)、非经肠(例如肌内、皮下或静脉内)、局部或经皮递送形式。化合物可与适宜载剂调配在一起以提供包括(但不限于)以下的递送形式:片剂、扁囊剂(caplet)、胶囊(例如硬质明胶胶囊或软质弹性明胶胶囊)、扁胶囊、糖片剂、菱形片剂、树胶、分散液、栓剂、软膏剂、泥敷剂(泥罨剂)、膏糊、粉剂、敷料、乳霜、溶液、贴剂、气溶胶(例如鼻喷雾或吸入器)、凝胶、悬浮液(例如水性或非水性液体悬浮液、水包油乳液或油包水液体乳液)、溶液和酏剂。
[0451]
本文所述的一种或若干种化合物可用于通过组合作为活性成分的一或多种化合物与医药上可接受的载剂(例如上文提到的那些)来制备调配物、例如医药调配物。根据系统的治疗形式(例如经皮贴剂对经口片剂)而定,载剂可呈各种形式。另外,医药调配物可含有防腐剂、增溶剂、稳定剂、再润湿剂、乳化剂、甜味剂、染料、调节剂、和用于调节渗透压的盐、缓冲剂、包衣剂或抗氧化剂。包含化合物的调配物还可含有具有有价值的治疗性质的其它物质。医药调配物可通过已知医药方法来制备。适宜调配物可参见 (例如)雷明顿:药学的科学和实践(remington:the science and practice of pharmacy),利平科特
·
威廉姆斯(lippincott williams)和威尔金斯(wilkins),第21版(2005),其是以引用方式并入本文中。
[0452]
如本文所述的化合物可以广泛接受的经口组合物(例如片剂、包衣片剂和硬壳或软壳中的凝胶胶囊、乳液或悬浮液)形式投与个体(例如人类)。可用于制备所述组合物的载剂的实例是乳糖、玉米淀粉或其衍生物、滑石、硬脂酸酯或其盐等。具有软壳的凝胶胶囊的可接受的载剂是(例如)植物油、蜡、脂肪、半固体和液体多元醇等等。另外,医药调配物可含有防腐剂、增溶剂、稳定剂、再润湿剂、乳化剂、甜味剂、染料、调节剂、和用于调节渗透压的盐、缓冲剂、包衣剂或抗氧化剂。
[0453]
本文所述化合物中的任一者可以所述的任何剂型调配于片剂中。
[0454]
还描述包含本文提供的化合物的组合物。在一种变化形式中,组合物包含化合物和医药上可接受的载剂或赋形剂。在另一变化形式中,提供大体上纯化合物的组合物。
[0455]
使用/治疗方法
[0456]
本文详述的化合物和组合物、例如含有本文提供的化合物或其盐和医药上可接受的载剂或赋形剂的医药组合物可用于如本文提供的投与和治疗方法中。化合物和组合物还可用于活体外方法中,例如出于筛选目的和/或用于执行质量控制分析向细胞投与化合物
或组合物的活体外方法。
[0457]
在一方面中,本文提供抑制选自阿贝森蛋白(abl1)、阿贝森相关蛋白(abl2)或嵌合蛋白bcr-abl1的蛋白质的酪氨酸激酶酶活性的方法,其包含使有效量的本文提供的化合物或组合物与蛋白质接触。在一个实施例中,本文提供抑制阿贝森蛋白(abl1)的酪氨酸激酶酶活性的方法,其包含使有效量的本文提供的化合物或组合物与abl1接触。在另一实施例中,本文提供抑制阿贝森相关蛋白(abl2)的酪氨酸激酶酶活性的方法,其包含使有效量的本文提供的化合物或组合物与abl2接触。在另一实施例中,本文提供抑制嵌合蛋白bcr-abl1的酪氨酸激酶酶活性的方法,其包含使有效量的本文提供的化合物或组合物与嵌合蛋白接触。
[0458]
在一方面中,本文提供治疗有需要的患者的疾病的方法,其包含向患者投与治疗有效量的本文提供的化合物或其盐或本文提供的组合物。在一些实施例中,化合物、或其盐、或组合物是根据本文所述剂量投与。
[0459]
据信本文所述化合物或其盐和本文所述组合物可有效治疗各种疾病和病症。在一些实施例中,本文所述化合物或其盐或本文所述组合物可用于治疗由abl1、abl2和/或 bcr-abl1介导的疾病的方法中。
[0460]
在一方面中,本文提供治疗患者的疾病的方法,其中bcr-abl1活性的调节预防、抑制或改善疾病的病理学和/或症状学,所述方法包含向患者投与治疗有效量的本文提供的化合物或组合物。在一实施例中,本文提供治疗患者的疾病的方法,其中bcr-abl1 活性的调节预防疾病的病理学和/或症状学,所述方法包含向患者投与治疗有效量的本文提供的化合物或组合物。在一实施例中,本文提供治疗患者的疾病的方法,其中 bcr-abl1活性的调节抑制疾病的病理学和/或症状学,所述方法包含向患者投与治疗有效量的本文提供的化合物或组合物。在一实施例中,本文提供治疗患者的疾病的方法,其中bcr-abl1活性的调节改善疾病的病理学和/或症状学,所述方法包含向患者投与治疗有效量的本文提供的化合物或组合物。
[0461]
在一些实施例中,疾病是白血病。在一些实施例中,白血病是慢性骨髓性白血病 (cml)、急性骨髓性白血病(aml)或急性淋巴母细胞性白血病(all)。在一些实施例中,白血病是慢性骨髓性白血病(cml)。
[0462]
在一个方面中,本文提供用于治疗患者的白血病的方法,其包含向患者投与治疗有效量的本文提供的化合物或组合物。在一方面中,本文提供治疗患者的白血病的方法,其包含向患者投与治疗有效量的本文提供的化合物或组合物,其中白血病是慢性骨髓性白血病(cml)、急性骨髓性白血病(aml)或急性淋巴母细胞性白血病(all)。
[0463]
在一些实施例中,本文治疗的白血病是cml或all,并且所述方法进一步包含投与治疗有效量的选自伊马替尼、尼罗替尼、达沙替尼、伯舒替尼(bosutinib)、普纳替尼 (ponatinib)和巴非替尼(bafetinib)的化合物。在一些实施例中,白血病是cml或all,并且所述方法进一步包含投与治疗有效量的选自伊马替尼、尼罗替尼、达沙替尼、伯舒替尼、普纳替尼和巴非替尼的化合物。
[0464]
在一些实施例中,白血病对治疗具有抗性。在一些实施例中,白血病对用伊马替尼、尼罗替尼、达沙替尼、伯舒替尼、普纳替尼和/或巴非替尼的治疗具有抗性。在一些实施例中,cml对标准护理治疗(用伊马替尼、尼罗替尼和达沙替尼中的一或多者的治疗)具有抗
性。在一些实施例中,白血病在先前治疗期间进展。在一些实施例中,先前治疗包含投与伊马替尼、尼罗替尼、达沙替尼、伯舒替尼、普纳替尼和/或巴非替尼。
[0465]
在一些实施例中,所述方法进一步包含投与治疗有效量的选自伊马替尼、尼罗替尼、达沙替尼、伯舒替尼、普纳替尼和巴非替尼的化合物。
[0466]
在一些实施例中,aml是继发性aml,其在骨髓发育不良综合症(mds)或骨髓增生性赘瘤(mpn)后发展。
[0467]
在一个方面中,本文提供用于治疗患者的癌症的方法,其包含向患者投与治疗有效量的本文提供的化合物或组合物。在一些实施例中,癌症是黑色素瘤、遗传性平滑肌瘤病、肾细胞癌(hlrcc)或其它实体肿瘤。
[0468]
在一个方面中,本文提供用于治疗患者的神经退化疾病的方法,其包含向患者投与治疗有效量的本文提供的化合物或组合物。在一些实施例中,神经退化疾病是阿兹海默氏病(alzheimer’s disease)或帕金森氏病(parkinson’s disease)。
[0469]
在另一方面中,提供在患者(例如人类)中延迟由bcr-abl1活性介导的疾病或病症的发作和/或发展的方法,所述患者处于发生所述疾病或病症的风险下。应了解,在个体或患者不发展疾病或病症的情况下,延迟的发展可涵盖预防。在一方面中,处于发展由 bcr-abl1活性介导的疾病或病症的风险下的个体或患者具有一或多个发展疾病或病症的风险因子,例如个体或患者患有疾病或病症、或患有与发展疾病或病症的增加可能性相关的潜在遗传病况的家族史。
[0470]
在一方面中,本文提供延迟有需要的患者的白血病的发作和/或发展的方法,其包含向患者投与治疗有效量的本文提供的化合物或组合物。在一种变化形式中,本文提供延迟有需要的患者的cml的发作和/或发展的方法,其包含向患者投与治疗有效量的本文提供的化合物或组合物。在一种变化形式中,本文提供延迟有需要的患者的aml的发作和/或发展的方法,其包含向患者投与治疗有效量的本文提供的化合物或组合物。在一种变化形式中,本文提供延迟有需要的患者的all的发作和/或发展的方法,其包含向患者投与治疗有效量的本文提供的化合物或组合物。
[0471]
治疗由bcr-abl1介导的疾病、例如各种白血病和诸如此类的方法为所属领域技术人员所熟知且可适用于利用本文提供的化合物或组合物治疗所述疾病。
[0472]
在一些实施例中,患者是哺乳动物。在一些实施例中,患者是灵长类动物、狗、猫、兔或啮齿类动物。在一些实施例中,患者是灵长类动物。在一些实施例中,患者是人类。在一些实施例中,人类为至少约或为约18、21、30、50、60、65、70、75、80或85岁中的任一者。在一些实施例中,人类是儿童。在一些实施例中,人类小于约或为约21、18、 15、10、5、4、3、2或1岁中的任一者。在一些实施例中,患者患有与发展疾病的增加可能性相关的遗传病况、例如白血病。在一些实施例中,患者具有abl1和/或abl2基因突变。在一些实施例中,患者是费城染色体阳性。
[0473]
本文提供的化合物或组合物可根据有效投用方案投与患者达所需时间段或持续时间,例如至少约1个月、至少约2个月、至少约3个月、至少约6个月或至少约12个月或更长时间,在一些变化形式中,其可为患者寿命的持续时间。在一种变化形式中,以每日或间歇时间表投与化合物。可在一段时间内向患者连续(例如,至少每日一次)投与化合物。投用频率还可少于每日一次,例如约每周一次投用。投用频率可超过每日一次,例如每日两次或三
次。投用频率还可为间歇的(例如每日一次投用7天,之后无剂量7天,重复任何14天时间段,例如约2个月、约4个月、约6个月或更长时间)。投用频率中的任一者可采用本文所述的化合物中的任一者以及本文所述的剂量中的任一者。
[0474]
本文提供的化合物或其盐可经由各种途径、包括(例如)静脉内、肌内、皮下、经口和经皮投与患者。
[0475]
投与患者的化合物的剂量可随着特定化合物或其盐、投与方法和特定疾病而定。在一些实施例中,化合物或其盐的量是治疗有效量。
[0476]
在一个方面中,化合物的有效量可为介于约0.01与约100mg/kg之间的剂量。本发明的化合物的有效量或剂量可通过常规方法、例如建模、剂量递增或临床试验、虑及常规因素(例如投与或药物递送的模式或途径、药剂的药物代谢动力学、要治疗的疾病的严重程度和病程、个体的健康状态、情况和体重)来确定。实例性剂量的范围约为一天约0.7mg 到7g、或一天约7mg到350mg、或一天约350mg到1.75g、或一天约1.75到7g。
[0477]
本文还提供本文所述化合物或其盐或本文所述组合物在制造药剂中的用途。在一些实施例中,药剂的制造是用于治疗本文所述疾病。在一些实施例中,药剂的制造是用于治疗由abl1、abl2和/或bcr-abl1介导的疾病。
[0478]
制品和试剂盒
[0479]
本发明进一步提供包含适宜包装中本文所述化合物或其盐、本文所述组合物、或一或多个本文所述单位剂量的制品。在某些实施例中,所述制品用于本文所述方法中的任一者中。适宜包装为业内所知且包括(例如)小瓶、容器、安瓿、瓶、罐、柔性包装和诸如此类。制品可经进一步灭菌和/或密封。
[0480]
本发明进一步提供用于实施本发明方法的试剂盒,其包含一或多种本文所述化合物或包含本文所述化合物的组合物。试剂盒可采用本文揭示的化合物中的任一者。在一种变化形式中,试剂盒采用本文所述化合物或其盐。试剂盒可用于本文所述用途中的任一或多者,并且因此,可含有治疗任何疾病或本文所述、例如治疗癌症的说明书。
[0481]
试剂盒可呈单位剂型、块包装(例如多剂量包装)或亚单位剂量。举例来说,可提供含有足够剂量的如本文揭示的化合物和/或可用于本文详述的疾病的额外医药活性化合物以提供患者的有效治疗达延长时段、例如1周、2周、3周、4周、6周、8周、3个月、4 个月、5个月、7个月、8个月、9个月或更长时间中的任一者的试剂盒。试剂盒还可包括多个单位剂量的化合物和使用说明书且以足以储存和用于药房(例如医院药房和从事复方的药房)的量包装。
[0482]
试剂盒可任选地包括一组说明书、通常书面说明书,但关于本发明方法的组分的使用的含有说明书的电子储存媒体(例如磁碟或光碟)还可接受。与试剂盒一起包括的说明书通常包括关于组分和其向患者的投与的信息。
[0483]
实例性实施例
[0484]
通过以下实施例进一步描述本发明。如果适当且实际,所述实施例中的每一者的特征可与其它实施例中的任一者组合。
[0485]
实施例1.一种式(i)或(ia)化合物,
[0486][0487]
或其互变异构体或n-氧化物、或其每一者的同位素变构体、或上述中每一者之前药、或上述的立体异构体、或上述中每一者的医药上可接受的盐、或前述中每一者的溶剂合物,其中:
[0488]
l是-nh-co-、-co-nh-、-nh-so
2-或-so
2-nh-;
[0489]
r1是任选地经取代的c
6-c
10
芳基、任选地经取代的5-10元杂芳基、任选地经取代的4-10元杂环、c(o)nr6r7、s(o)2nr6r7、nr6cor7或nr6so2r7或c(o)or6;
[0490]
r2是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
2-c6烯基、任选地经取代的c
2-c6炔基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;
[0491]
r3是h、任选地经取代的c
1-c6烷基、任选地经取代的c
2-c6烯基、任选地经取代的 c
2-c6炔基、任选地经取代的环烷基、任选地经取代的杂环烷基、任选地经取代的芳基、任选地经取代的杂芳基、or6或nr6r7;或r2和r3与间插原子一起形成环烷基或杂环烷基、优选任选地经取代的c
3-c8环烷基或任选地经取代的4-10元杂环烷基;
[0492]
r4是任选地经取代的c
1-c6烷基,优选c
1-c3卤代烷基,例如cf3或cf2cl;任选地经取代的c
2-c6烯基、任选地经取代的c
2-c6炔基;
[0493]
x是o或s;
[0494]
y是ch、c-(c
1-c2烷基)或c-卤基或n;
[0495]
z是cr5或n;
[0496]
当z是ch时,r5是h或卤素;
[0497]
r6是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;且
[0498]
r7是h、任选地经取代的c
1-c6烷基、任选地经取代的c
3-c8环烷基、任选地经取代的4-10元杂环烷基、任选地经取代的c
6-c
10
芳基或任选地经取代的5-10元杂芳基;或r6和r7与其连接的氮一起形成任选地经取代的4-7元杂环。
[0499]
实施例2.如实施例1的化合物,其具有式(ia):
[0500][0501]
其中变量是如实施例1中所定义。
[0502]
实施例3.如实施例2的化合物,其是选自式iia-iie:
[0503][0504]
其中r
10
是5-6元杂芳基,优选地,杂芳基部分具有最多2个环氮原子;
[0505]r20
是任选地经取代的c
1-c3烷基或任选地经取代的c
3-c4环烷基,优选地,r
20
是甲基、任选地经取代的异丙基或环丙基;
[0506]r30
是h、任选地经取代的c
1-c3烷基或任选地经取代的c
3-c4环烷基、优选任选地经取代的环丙基;且
[0507]
其余变量是如实施例1中所定义。
[0508]
实施例4.如实施例2或3的化合物,其中x是o。
[0509]
实施例5.如实施例2到4中任一项的化合物,其中r1是5-10元杂芳基、优选含有最多 2个环氮原子的杂芳基部分,或r1是4-10元杂环、优选含有最多2个环氮原子的杂环基部
分。
[0510]
实施例6.如实施例2到5中任一项的化合物,其中r1是:
[0511]-conh(环丙基)、-conh2、-conhme、
[0512][0513]
实施例7.如实施例2到6中任一项的化合物,其中r1是嘧啶基或吡唑基。
[0514]
实施例8.如实施例2到7中任一项的化合物,其中r2是任选地经取代的c
1-c3烷基或任选地经取代的c
3-c4环烷基,优选地,r2是甲基、任选地经取代的异丙基或环丙基。
[0515]
实施例9.如实施例2到7中任一项的化合物,其中r2是:甲基、异丙基、叔丁基、环丙基、环丁基、环戊基、四氢呋喃基、四氢吡喃基、
[0516][0517]
实施例10.如实施例2到9中任一项的化合物,其中r3是:h、甲基、异丙基、二氟甲基、羟乙基、环丙基、环丁基、-c(me)2oh、甲氧基甲基、羟甲基、甲氧基、羟乙基、
ꢀ‑
ch2ch2oh或四氢吡喃基。
[0518]
实施例11.如实施例2到6中任一项的化合物,其中r2和r3一起形成:
[0519][0520]
实施例12.如实施例2到11中任一项的化合物,其中r4是任选地经取代的c
1-c3烷基,优选地,其中所述烷基经一或多个卤基取代基取代,更优选地,r4是cf3或cf2cl。
[0521]
实施例13.如实施例2到12中任一项的化合物,其中r5是h。
[0522]
实施例14.如实施例2到13中任一项的化合物,其中y是ch。
[0523]
实施例15.如实施例1的化合物,其具有式(ib)或(ic):
[0524][0525]
其中其余变量是如实施例1中所定义。
[0526]
实施例16.一种选自实例1到26的式(i)化合物和表1的化合物、或其互变异构体或n
‑ꢀ
氧化物、或其每一者的同位素变构体、或上述中每一者之前药、或上述的立体异构体、或上述中每一者的医药上可接受的盐、或前述中每一者的溶剂合物。
[0527]
实施例17.一种组合物,其包含如实施例2到16中任一项的化合物和至少一种医药上可接受的赋形剂。
[0528]
实施例18.一种抑制选自阿贝森蛋白(abl1)、阿贝森相关蛋白(abl2)或嵌合蛋白 bcr-abl1的蛋白质的酪氨酸激酶酶活性的方法,其包含使有效量的如实施例2到16中任一
项的化合物或如实施例17的组合物与所述蛋白质接触。
[0529]
实施例19.一种治疗患者的疾病的方法,其中bcr-abl1活性的调节预防、抑制或改善所述疾病的病理学和/或症状学,所述方法包含向所述患者投与治疗有效量的如实施例2到16中任一项的化合物或如实施例17的组合物。
[0530]
实施例20.一种治疗患者的白血病的方法,其包含向所述患者投与治疗有效量的如实施例2到16中任一项的化合物或如实施例17的组合物,其中所述白血病是慢性骨髓性白血病(cml)、急性骨髓性白血病(aml)或急性淋巴母细胞性白血病(all)。
[0531]
实施例21.如实施例20的方法,其中所述白血病是cml或all,并且所述方法进一步包含投与治疗有效量的选自伊马替尼、尼罗替尼、达沙替尼、伯舒替尼、普纳替尼和巴非替尼的化合物。
[0532]
实施例22.如实施例20或21的方法,其中所述cml对标准护理治疗(用伊马替尼、尼罗替尼和达沙替尼中的一或多者的治疗)具有抗性。
[0533]
实施例23.如实施例20或21的方法,其中所述aml是继发性aml,其在骨髓发育不良综合症(mds)或骨髓增生性赘瘤(mpn)后发展。
[0534]
实例
[0535]
以下缩写可对于应用有关。
[0536]
缩写
[0537]
ac:乙酰基
[0538]
bn:苄基
[0539]
bu:丁基
[0540]
bz:苯甲酰基
[0541]
cmc:羧甲纤维素
[0542]
dcm:二氯甲烷
[0543]
dipea:二异丙基乙胺
[0544]
dmf:二甲基甲酰胺
[0545]
dmeda:n,n
′‑
二甲基乙二胺
[0546]
dsc:碳酸n,n
′‑
二琥珀酰亚胺基酯或碳酸双(2,5-二氧代基吡咯烷-1-基)酯
[0547]
dppf:1,1'-双(二苯基膦基)二茂铁
[0548]
et:乙基
[0549]
hatu:1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐,
[0550]
nbs:n-溴琥珀酰亚胺
[0551]
peg:聚乙二醇
[0552]
pmb:对甲氧基苄基
[0553]
pr:丙基
[0554]
py:吡啶
[0555]
rt:室温
[0556]
tea:三乙胺
[0557]
tbdps:叔丁基二苯基硅基
[0558]
tbaf:四丁基氟化铵
[0559]
thf:四氢呋喃
[0560]
tms:三甲基硅基
[0561]
tfa:三氟乙酸
[0562]
ts:甲苯磺酰基
[0563]
xphos:2-二环己基膦基-2
′
,4
′
,6
′‑
三异丙基联苯
[0564]
合成实例
[0565]
制备式(i)化合物:合成示意方案
[0566]
如下文式(i)化合物的实例中所绘示,在某些实例性实施例中,式(i)化合物是根据以下一般程序制备。应了解,尽管一般方法绘示本发明的某些化合物的合成,但以下一般方法和所属领域技术人员已知的其它方法可应用于如本文所述的所有化合物和这些化合物中的每一者的子类和种类。
[0567]
示意方案1
[0568][0569]
其中r1和r2是如针对式(i)化合物所定义。
[0570]
式(s7)化合物可通过如示意方案1中所示的一般合成方法来制备。于约室温到回流温度的温度下用适宜溶剂(例如乙醇)中的各种伯胺(s1)和碱(例如但不限于三乙胺)处理1a 且持续从约30分钟到约8小时变化的时间,可容易地产生硝基苯胺(s2)。苯二胺(s3)可通过使用还原剂(例如但不限于铁)在溶剂(例如但不限于乙酸)中于约室温到回流温度的温度下还原硝基苯胺(s2)且持续从约1小时变化的时间来形成。苯二胺(s3)环化成苯并咪唑 (s4)可使用试剂(例如但不限于邻甲酸三甲基酯)在酸(例如但不限于p-tsoh)存在下于约室温到100℃的温度下且持续从约10min到1小时变化的时间来实施。式(s5)化合物可从溴化物(s4)在钯催化剂条件(例如但不限于[1,1
′‑
双(二苯基膦基)二茂铁]二氯钯(ii))下在水和无机碱(例如但不限于碳酸钠、碳酸钾或磷酸钾)存在下在有机溶剂(例如但不限于 1,4-二噁烷)中于升高温度下用芳基、杂芳基或杂环硼酸或硼酸酯处理后制备。在水和有机溶剂(例如但不限于甲醇和/或四氢呋喃)存在下用氢氧化物源(例如但不限于氢氧化锂) 处理酯(s5),产生式(s6)的羧酸。羧酸(s6)与偶合剂(例如但不限于1-[双(二甲基氨
基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐)、碱(例如但不限于二异丙基乙胺)和胺(1h)反应,提供式(s7)的酰胺。
[0571]
示意方案2
[0572][0573]
其中r1和r2是如针对式(i)化合物所定义;x是卤素;且z是ch或n。
[0574]
式(s10)化合物可通过如示意方案2中所示的一般合成方法来制备。在水和有机溶剂(例如但不限于甲醇和/或四氢呋喃)存在下用氢氧化物源(例如但不限于氢氧化锂)处理酯 (s5),产生式(s8)的羧酸。羧酸(s8)与偶合剂(例如但不限于1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐)、碱(例如但不限于二异丙基乙胺) 和胺(1h)反应,提供式(s9)的酰胺。式(s10)化合物可从卤化物(s9)在钯催化剂条件(例如但不限于[1,1
′‑
双(二苯基膦基)二茂铁]二氯钯(ii))下在水和无机碱(例如但不限于碳酸钠、碳酸钾或磷酸钾)存在下在有机溶剂(例如但不限于1,4-二噁烷)中于升高温度下用芳基、杂芳基或杂环硼酸或硼酸酯处理后制备。
[0575]
示意方案3
[0576][0577]
其中r1和r3是如针对式(i)化合物所定义。
[0578]
式(s15)化合物可通过如示意方案3中所示的一般合成方法来制备。可于约80℃到 130℃的温度下用各种羧酸处理化合物(3a)且持续从约1小时到2小时变化的时间,以产生式(s11)的苯并咪唑。在碱(例如但不限于碳酸钾)存在下在有机溶剂(例如但不限于n,n
‑ꢀ
二甲基甲酰胺)中于约50℃的温度下用碘甲烷处理苯并咪唑(s11)且持续约3小时的时间,以产生苯并咪唑(s12)。在水和有机溶剂(例如但不限于甲醇和/或四氢呋喃)存在下用氢氧化物源(例如但不限于氢氧化锂)处理酯(s12),产生式(s13)的羧酸。羧酸(s13)与偶合剂(例如但不限于1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐)、碱(例如但不限于二异丙基乙胺)和胺(1h)在有机溶剂(例如但不限于n,n-二甲基甲酰胺)中于约室温下反应且持续约30分钟的时间,提供式(s14)的酰胺。式(s15)化合物可从溴化物(s14)在钯催化剂条件(例如但不限于[1,1
′‑
双(二苯基膦基)二茂铁]二氯钯(ii))下在水和无机碱(例如但不限于碳酸钠、碳酸钾或磷酸钾)存在下在有机溶剂(例如但不限于 1,4-二噁烷)中于升高温度下用芳基、杂芳基或杂环硼酸或硼酸酯处理后制备。
[0579]
示意方案4
[0580][0581]
其中r1、r2和r3是如针对式(i)化合物所定义。
[0582]
式(s20)化合物可通过如示意方案4中所示的一般合成方法来制备。可于约80℃到 130℃的温度下用各种羧酸处理式(s16)的经取代的苯二胺且持续从约1小时到2小时变化的时间,以产生式(s17)的苯并咪唑。在水和有机溶剂(例如但不限于甲醇和/或四氢呋喃) 存在下用氢氧化物源(例如但不限于氢氧化锂)处理酯(s17),产生式(s18)的羧酸。羧酸 (s18)与偶合剂(例如但不限于1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3
‑ꢀ
氧化物六氟磷酸盐)、碱(例如但不限于二异丙基乙胺)和胺(1h)在有机溶剂(例如但不限于 n,n-二甲基甲酰胺)中于约室温下反应且持续约30分钟的时间,提供式(s19)的酰胺。式 (s20)化合物可从溴化物(s19)在钯催化剂条件(例如但不限于[1,1
′‑
双(二苯基膦基)二茂铁]二氯钯(ii))下在水和无机碱(例如但不限于碳酸钠、碳酸钾或磷酸钾)存在下在有机溶剂(例如但不限于1,4-二噁烷)中于升高温度下用芳基、杂芳基或杂环硼酸或硼酸酯处理后制备。
[0583]
示意方案5
[0584][0585]
其中r1、r2和r3是如针对式(i)化合物所定义。
[0586]
式(s26)化合物可通过如示意方案5中所示的一般合成方法来制备。在水和有机溶剂 (例如但不限于甲醇和/或四氢呋喃)存在下用氢氧化物源(例如但不限于氢氧化锂)处理酯 (s21),产生式(s22)的羧酸。羧酸(s22)与偶合剂(例如但不限于1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐)、碱(例如但不限于二异丙基乙胺) 和胺(1h)在有机溶剂(例如但不限于n,n-二甲基甲酰胺)中于室温到50℃的温度下反应且持续约2小时的时间,提供式(s23)的酰胺。苯二胺(s24)可通过使用还原剂(例如但不限于铁)在溶剂(例如但不限于乙酸)中于约35℃的温度下还原硝基苯胺(s23)且持续从约3小时变化的时间来形成。可于约80℃到130℃的温度下用各种羧酸处理式(s24)的经取代的苯二胺且持续从约1小时到2小时变化的时间,以产生式(s25)的苯并咪唑。式(s26)化合物可从溴化物(s25)在钯催化剂条件(例如但不限于[1,1
′‑
双(二苯基膦基)二茂铁]二氯钯(ii)) 下在水和无机碱(例如但不限于碳酸钠、碳酸钾或磷酸钾)存在下在有机溶剂(例如但不限于1,4-二噁烷)中于升高温度下用芳基、杂芳基或杂环硼酸或硼酸酯处理后制备。
[0587]
示意方案6
[0588][0589]
其中r1、r2和r3是如针对式(i)化合物所定义。
[0590]
式(s29)化合物可通过如示意方案6中所示的一般合成方法来制备。式(s27)化合物可从溴化物(s25)在钯催化剂条件(例如但不限于[1,1
′‑
双(二苯基膦基)二茂铁]二氯钯(ii))下在水和无机碱(例如但不限于碳酸钠、碳酸钾或磷酸钾)存在下在有机溶剂(例如但不限于 1,4-二噁烷)中于升高温度下用芳基、杂芳基或杂环硼酸或硼酸酯处理后制备。在水和有机溶剂(例如但不限于甲醇和/或四氢呋喃)存在下用氢氧化物源(例如但不限于氢氧化锂) 处理酯(s27),产生式(s28)的羧酸。羧酸(s28)与偶合剂(例如但不限于1-[双(二甲基氨基) 亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐)、碱(例如但不限于二异丙基乙胺)和胺(1h)在有机溶剂(例如但不限于n,n-二甲基甲酰胺)中于室温到50℃的温度下反应且持续约2小时的时间,提供式(s29)的酰胺。
[0591]
示意方案7
[0592][0593]
其中r1是如针对式(i)化合物所定义;x是卤化物;且如本文所用,r
15
和r
16
是可选取代基。
[0594]
式(s38)化合物可通过如示意方案7中所示的一般合成方法来制备。在酸(例如但不限于盐酸)存在下在有机溶剂(例如但不限于乙酸乙酯)中于约15℃的温度下且持续约2
小时的时间,式(s30)化合物可转化为式(s31)化合物。于约15℃的温度下用适宜溶剂(例如乙醇)中的(1a)与碱(例如但不限于三乙胺)处理胺(s31)且持续约1小时的时间,可容易地产生硝基苯胺(s32)。苯二胺(s33)可通过使用还原剂(例如但不限于铁)在溶剂(例如但不限于乙酸)中于约室温到回流温度的温度下还原硝基苯胺(s32)且持续从约1小时变化的时间来形成。羧酸(s33)与偶合剂(例如但不限于1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并 [4,5-b]吡啶鎓3-氧化物六氟磷酸盐)、碱(例如但不限于二异丙基乙胺)在有机溶剂(例如但不限于n,n-二甲基甲酰胺)中于约室温的温度下反应且持续约16小时的时间,提供式(s34)的苯并咪唑。在水和有机溶剂(例如但不限于甲醇和/或四氢呋喃)存在下用氢氧化物源(例如但不限于氢氧化锂)处理酯(s34),产生式(s35)的羧酸。羧酸(s35)与偶合剂(例如但不限于1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐)、碱(例如但不限于吡啶)和胺(1h)在有机溶剂(例如但不限于n,n-二甲基甲酰胺)中于约 40℃的温度下反应且持续约6小时的时间,提供式(s36)的酰胺。式(s37)化合物可从溴化物(s36)在钯催化剂条件(例如但不限于[1,1
′‑
双(二苯基膦基)二茂铁]二氯钯(ii))下在水和无机碱(例如但不限于碳酸钠、碳酸钾或磷酸钾)存在下在有机溶剂(例如但不限于1,4-二噁烷)中于升高温度下用芳基、杂芳基或杂环硼酸或硼酸酯处理后制备。或者,式(s37) 化合物可通过stille偶合制备。于升高温度下在在钯催化剂条件(例如但不限于四(三苯基膦)钯)下在有机溶剂(例如但不限于甲苯)中将溴化物(s36)转化为锡烷(s38)。可于升高温度下在钯催化剂条件(例如但不限于四三苯基膦钯)下在有机溶剂(例如但不限于dmso) 中用各种芳基或杂芳基卤化物处理锡烷(s38)。
[0595]
示意方案8
[0596][0597]
其中r1和r6是如针对式(i)化合物所定义。
[0598]
式(s40)化合物可通过如示意方案8中所示的一般合成方法来制备。化合物(s38)可用四甲氧基-烷烃于约50℃的温度下处理且持续约16小时的时间,以得到式(s39)化合物。式(s40)化合物可从溴化物(s39)在钯催化剂条件(例如但不限于[1,1
′‑
双(二苯基膦基)二茂铁]二氯钯(ii))下在水和无机碱(例如但不限于碳酸钠、碳酸钾或磷酸钾)存在下在有机溶剂(例如但不限于1,4-二噁烷)中于升高温度下用芳基、杂芳基或杂环硼酸或硼酸酯处理后制备。
[0599]
示意方案9
[0600][0601]
其中r1和r2是如针对式(i)化合物所定义;且r
15
和r
16
是可选取代基。
[0602]
式(s37和s41)化合物可通过如示意方案9中所示的一般合成方法来制备。可于升高温度下在钯催化剂条件(例如但不限于四三苯基膦钯)下在有机溶剂(例如但不限于甲苯)中用各种芳基和杂芳基锡烷处理化合物(s36),以得到化合物(s37)。另外,可于升高温度下在钯催化剂或铜条件(例如但不限于[(2-二-环己基膦基-3,6-二甲氧基-2
′
,4
′
,6
′‑
三异丙基
ꢀ‑
1,1
′‑
联苯)-2-(2
′‑
氨基-1,1
′‑
联苯)]甲烷磺酸钯(ii)或(bu4ncui2)2)下在有机溶剂(例如但不限于四氢呋喃或1,4-二噁烷)中用各种胺处理溴化物(s36),以得到式(s41)化合物。
[0603]
示意方案10
[0604][0605]
其中r1和r2是如针对式(i)化合物所定义。
[0606]
式(s46)化合物可通过如示意方案10中所示的一般合成方法来制备。在铁和乙酸存在下,可将化合物(s42)环化为式(s43)化合物。在水和有机溶剂(例如但不限于甲醇和/或四氢呋喃)存在下用氢氧化物源(例如但不限于氢氧化锂)处理酯(s43),产生式(s44)的羧酸。羧酸(s44)与偶合剂(例如但不限于1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐)、碱(例如但不限于吡啶)和胺(1h)在有机溶剂(例如但不限于n,n
‑ꢀ
二甲基甲酰胺)中于约40℃的温度下反应且持续约6小时的时间,提供式(s45)的酰胺。式 (s46)化合物可从溴化物(s45)在钯催化剂条件(例如但不限于[1,1
′‑
双(二苯基膦基)二茂铁]二氯钯(ii))下在水和无机碱(例如但不限于碳酸钠、碳酸钾或磷酸钾)存在下在有机溶剂(例如但不限于1,4-二噁烷)中于升高温度下用芳基、杂芳基或杂环硼酸或硼酸酯处理后制备。
[0607]
实例1(一般程序a)
[0608]
n-(4-(氯二氟甲氧基)苯基)-1-甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺
[0609]
标题化合物是根据示意方案1制备。所述一般程序a例示示意方案1且提供如应用于标题化合物的特定合成细节。
[0610][0611]
3-溴-4-(甲基氨基)-5-硝基苯甲酸甲基酯(1c).向3-溴-4-氟-5-硝基-苯甲酸甲基酯(1a,3 g,10.79mmol,1eq)和甲胺盐酸盐(1b,874.23mg,12.95mmol,1.2eq)于etoh(50ml)中的溶液中添加tea(3.28g,32.37mmol,4.51ml,3eq)。在15℃下将混合物搅拌12小时。 tlc(石油醚:乙酸乙酯=5:1,rf=0.50)检测到具有更大极性的一个新的主斑点。在减压下浓缩反应混合物。用水稀释混合物并用etoac萃取。用盐水洗涤合并的有机层,经 na2so4干燥,过滤并在减压下浓缩,以产生黄色固体状1c。1h nmr(400mhz,cdcl
3-d) δ8.52(d,j=2.0hz,1h),8.30(d,j=2.0hz,1h),6.54(br s,1h),3.91(s,3h),3.09(d,j= 5.5hz,3h)。
[0612]
3-氨基-5-溴-4-(甲基氨基)苯甲酸甲基酯(1d).于15℃下向3-溴-4-(甲基氨基)-5-硝基苯甲酸甲基酯(1c,1.5g,5.19mmol,1eq)于acoh(20ml)中的溶液中一次性添加fe(2.90g, 51.89mmol,10eq)。将混合物于15℃下搅拌1小时。于15℃下一次性添加另一批fe(869.31 mg,15.57mmol,3eq)且将混合物于35℃下搅拌1小时。tlc(石油醚:乙酸乙酯=3:
1,rf= 0.30)指示1c完全消耗,并且检测到具有更大极性的一个新的主斑点。添加乙酸乙酯(100 ml)。将有机层用h2o(50ml
×
2)、饱和nahco3(30ml
×
4)和盐水(30ml)洗涤,并且经无水na2so4干燥,过滤且在真空中浓缩。产物未经进一步纯化即用于下一步骤中。获得褐色油状化合物1d。1h nmr(400mhz,cdcl
3-d)δ7.63(d,j=1.8hz,1h),7.31(d,j= 1.8hz,1h),4.05-3.93(m,2h),3.89-3.84(m,3h),3.61(br s,1h),2.81-2.72(m,3h)。
[0613]
7-溴-1-甲基-1h-苯并[d]咪唑-5-甲酸甲基酯(1e).向3-氨基-5-溴-4-(甲基氨基)苯甲酸甲基酯(1d,0.1g,0.386mmol,1eq)于三甲氧基甲烷(15ml)中的溶液中添加p-tsoh(6.65 mg,0.039mmol,0.1eq)。将混合物于100℃下搅拌1hr。lcms显示1d完全消耗且检测到具有所需质量的一个主峰。浓缩混合物且添加乙酸乙酯(20ml)。将有机层用饱和nahco
3 (5ml)和盐水(5ml)洗涤,经无水na2so4干燥,过滤且在真空中浓缩,从而得到白色固体状1e。产物未经进一步纯化即用于下一步骤中。1h nmr(400mhz,cdcl
3-d)δ8.43(d, j=1.5hz,1h),8.16(d,j=1.3hz,1h),7.91(s,1h),4.18(s,3h),4.00-3.92(m,3h)。
[0614]
1-甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酸甲基酯(1f).在n2下向7-溴-1-甲基-1h
‑ꢀ
苯并[d]咪唑-5-甲酸甲基酯(1e,0.1g,0.372mmol,1eq)和嘧啶-5-基硼酸(92.09mg,0.743 mmol,2eq)于二噁烷(5ml)和h2o(0.3ml)中的混合物中添加pd(dppf)cl2(19.03mg, 0.026mmol,0.07eq)、na2co3(78.77mg,0.743mmol,2eq)。在100℃下将混合物搅拌12 小时。lcms显示1e剩余且检测到具有所需质量的一个主峰。过滤并浓缩混合物,从而产生粗制残余物。通过制备型tlc(sio2,乙酸乙酯:甲醇=9:1)纯化残余物。获得褐色固体状化合物1f。1h nmr(400mhz,cdcl
3-d)δ9.35(s,1h),8.90(s,2h),8.62(d,j=1.5 hz,1h),7.97-7.88(m,2h),3.98(s,3h),3.51(s,3h)。
[0615]
1-甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酸(1g).于15℃下在n2下向1-甲基-7-(嘧啶
ꢀ‑
5-基)-1h-苯并[d]咪唑-5-甲酸甲基酯(1f,0.045g,0.168mmol,1eq)于thf(2ml)、meoh (2ml)和h2o(1ml)中的溶液中添加lioh.h2o(14.08mg,0.335mmol,2eq)。在15℃下将混合物搅拌12小时。lcms显示1f完全消耗且检测到具有所需质量的一个主峰。用hcl 水溶液(1m)将混合物调节到ph=5且浓缩,从而产生褐色固体状粗产物1g。产物未经进一步纯化即用于下一步骤中。
[0616]
n-(4-(氯二氟甲氧基)苯基)-1-甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺(1).于 15℃下向1-甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酸(1g,0.04g,0.157mmol,1eq)和 4-(氯二氟甲氧基)苯胺(33.50mg,0.173mmol,1.1eq)、hatu(71.79mg,0.189mmol,1.2 eq)于dmf(1ml)中的溶液中添加diea(61.00mg,0.472mmol,82.21ul,3eq)。在15℃下将混合物搅拌12小时。lcms显示1g完全消耗且检测到所需质量。浓缩混合物,且通过制备型hplc(fa条件,管柱:卢纳(luna)c18 100*30 5u;移动相:[水(0.225%fa)-acn]; b%:35%-50%,14min)纯化所得残余物,从而得到黄色固体状标题化合物1。1h nmr(400 mhz,meod-d4)δ1h nmr(400mhz,meod-d4)δ9.31(s,1h),9.06(s,2h),8.45(d,j= 1.5hz,1h),8.39(s,1h),7.91(d,j=1.5hz,1h),7.84(d,j=9.0hz,2h),7.31(d,j=9.0 hz,2h),3.60(s,3h)。
[0617]
实例2(一般程序b)
[0618]
n-(4-(氯二氟甲氧基)苯基)-1-((1s,3s)-3-羟基环丁基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑
ꢀ‑
5-甲酰胺
[0619]
标题化合物是根据示意方案2制备。所述一般程序b例示示意方案2且提供如应用于标题化合物的特定合成细节。
[0620][0621]
7-溴-1-((1s,3s)-3-羟基环丁基)-1h-苯并[d]咪唑-5-甲酸(2b).向7-溴-1-((1s,3s)-3-羟基环丁基)-1h-苯并[d]咪唑-5-甲酸甲基酯(以与1e类似的方式合成;2a,140mg,0.431mmol, 1eq)于thf(2ml)、meoh(2ml)和h2o(1ml)中的溶液中添加lioh.h2o(27.10mg, 0.646mmol,1.5eq)。在15℃下将混合物搅拌12hr。lcms显示2a完全消耗且检测到所需 ms。利用添加hcl水溶液将水相调节到ph=5。过滤混合物且在真空中浓缩且获得白色固体状化合物2b。1h nmr(400mhz,dmso-d6)δ13.10(br s,1h)8.72(s,1h)8.19(d,j =1.1hz,1h)7.96(s,1h)5.37(br d,j=6.2hz,1h)4.94-5.07(m,1h)4.01-4.11(m,1h) 2.86-2.95(m,2h)2.37-2.44(m,2h)。
[0622]
7-溴-n-(4-(氯二氟甲氧基)苯基)-1-((1s,3s)-3-羟基环丁基)-1h-苯并[d]咪唑-5-甲酰胺(2c)向7-溴-1-((1s,3s)-3-羟基环丁基)-1h-苯并[d]咪唑-5-甲酸(2b,100mg,0.321mmol,1 eq)和4-[氯(二氟)甲氧基]苯胺(74.66mg,0.386mmol,1.2eq)于dmf(2ml)中的溶液中添加hatu(146.65mg,0.386mmol,1.2eq)和diea(83.08mg,0.643mmol,111.97ul,2 eq)。在15℃下将混合物搅拌12hr。lcms显示2b完全消耗且检测到所需ms。将混合物用水(3ml)稀释且用etoac(10ml
×
3)萃取。将合并的有机层用盐水(3ml)洗涤,经 na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc(sio2,乙酸乙酯:甲醇=10:1)纯化残余物,从而产生白色固体状2c。1h nmr(400mhz,dmso-d6)δ 10.48(s,1h)8.72(s,1h)8.40(d,j=1.3hz,1h)8.05(d,j=1.3hz,1h)7.92(d,j=9.0 hz,2h)7.36(d,j=9.0hz,2h)5.37(d,j=6.4hz,1h)4.96-5.08(m,1h)4.01-4.13(m, 1h)2.89-2.98(m,2h)2.36-2.43(m,2h)。
[0623]
n-(4-(氯二氟甲氧基)苯基)-1-((1s,3s)-3-羟基环丁基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑
ꢀ‑
5-甲酰胺(2).向7-溴-n-(4-(氯二氟甲氧基)苯基)-1-((1s,3s)-3-羟基环丁基)-1h-苯并[d]咪唑-5-甲酰胺(2c,40mg,0.082mmol,1eq)和嘧啶-5-基硼酸(20.37mg,0.164mmol,2eq)于二噁烷(3ml)和h2o(0.3ml)中的溶液中添加pd(dppf)cl2(6.01mg,8.22umol,0.1eq)和 k3po4(52.34mg,0.247mmol,3eq)。在100℃下将混合物搅拌12hr。lcms显示2c完全消耗且检测到所需ms。将水相用h2o(5ml)和乙酸乙酯(5ml
×
3)萃取。用盐水(5ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型hplc (nh4hco3条件,管柱:沃特世x桥(waters xbridge)prep obd c18 150*30 10u;移动相: [水(10mm nh4hco3)-acn];b%:25%-45%,10min)纯化混合物,从而产生白色固体状标题化合
物2。[m h]
(c
23h18
o3n5clf2)计算的ms质量要求m/z 486.1,lcms实验值m/z486.1。1h nmr(400mhz,dmso-d6)δ10.46(s,1h)9.36(s,1h)9.06(s,2h)8.62(s,1 h)8.51(d,j=1.5hz,1h)7.94(d,j=9.0hz,2h)7.81(d,j=1.5hz,1h)7.37(d,j=8.8 hz,2h)5.21(d,j=6.6hz,1h)3.97(quin,j=8.0hz,1h)3.66(sxt,j=7.1hz,1h) 2.06-2.16(m,4h)。
[0624]
实例3(一般程序c)
[0625]
n-(4-(氯二氟甲氧基)苯基)-2-(二氟甲基)-1-甲基-4-(嘧啶-5-基)-1h-苯并[d]咪唑-6-甲酰胺
[0626]
标题化合物是根据示意方案3制备。所述一般程序c例示示意方案3且提供如应用于标题化合物的特定合成细节。
[0627][0628]
4-溴-2-(二氟甲基)-1h-苯并[d]咪唑-6-甲酸甲基酯(3b).将3,4-二氨基-5-溴苯甲酸甲基酯(以与1d类似的方式合成;3a,0.2g,0.816mmol,1eq)溶解于chf2cooh(3ml)中,将混合物于130℃下搅拌1hr。tlc(石油醚:乙酸乙酯=3:1)显示起始材料消耗且lcms显示所需ms。浓缩混合物,并且将残余物溶解于etoac(10ml)中。将有机层用aq.nahco
3 (5ml
×
3)洗涤且随后浓缩,从而得到褐色固体状3b。粗产物未经进一步纯化即用于下一步骤中。
[0629]
4-溴-2-(二氟甲基)-1-甲基-1h-苯并[d]咪唑-6-甲酸甲基酯(3c).向4-溴-2-(二氟甲基)-1h-苯并[d]咪唑-6-甲酸甲基酯(3b,200mg,0.656mmol,1eq)于dmf(2ml)中的溶液中添加k2co3(271.82mg,1.97mmol,3eq)和mei(930.52mg,6.56mmol,408.12ul,10 eq)。将混合物于50℃下搅拌10hr。tlc(石油醚:乙酸乙酯=2:1)显示起始材料消耗。浓缩混合物且通过制备型tlc(sio2,石油醚:乙酸乙酯=2:1)纯化残余物,从而得到黄色固体状3c。1h nmr(400mhz,cdcl
3-d)δ8.24(d,j=1.1hz,1h),8.17(d,j=1.1hz,1h), 7.17-6.85(m,1h),4.04(s,3h),3.98(s,3h)。
[0630]
4-溴-2-(二氟甲基)-1-甲基-1h-苯并[d]咪唑-6-甲酸(3d).于25℃下向4-溴-2-(二氟甲基)-1-甲基-1h-苯并[d]咪唑-6-甲酸甲基酯(3c,115mg,0.36mmol,1eq)于thf(3ml)、 meoh(2ml)和h2o(1ml)中的溶液中添加lioh.h2o(30.24mg,0.721mmol,2eq)。在 50℃下将混合物搅拌2hr。tlc(石油醚:乙酸乙酯=2:1)显示起始材料消耗。浓缩混合物且添
加aq.hcl(1m)直到ph=3~4。过滤悬浮液,并且将固体用h2o(1ml)洗涤且干燥,从而产生黄色固体状3d。粗产物未经进一步纯化即用于下一步骤中。1h nmr(400mhz, meod-d4)δ8.35(s,1h),8.07(s,1h),7.70-7.32(m,1h),4.02(s,3h)。
[0631]
4-溴-n-(4-(氯二氟甲氧基)苯基)-2-(二氟甲基)-1-甲基-1h-苯并[d]咪唑-6-甲酰胺(3e). 向4-溴-2-(二氟甲基)-1-甲基-1h-苯并[d]咪唑-6-甲酸(3d,110mg,0.361mmol,1eq)于 dmf(3ml)中的溶液中添加dipea(93.20mg,0.721mmol,125.61ul,3eq)和hatu (205.65mg,0.541mmol,1.2eq)。将混合物于25℃下搅拌0.5hr,之后添加4-(氯二氟甲氧基)苯胺(1h,83.76mg,0.433mmol,1.2eq)。将反应混合物于25℃下搅拌3.5hr。tlc(石油醚:乙酸乙酯=3:1)显示起始材料消耗且lcms显示所需ms。浓缩混合物且通过用制备型tlc(sio2,石油醚:乙酸乙酯=1:1)管柱色谱纯化残余物,从而得到黄色固体状3e。1hnmr(400mhz,cdcl
3-d)δ8.10(d,j=1.2hz,1h),7.98-7.91(m,2h),7.74(d,j=8.9hz, 2h),7.30(d,j=8.9hz,2h),7.18-6.88(m,1h),4.07(s,3h)。
[0632]
n-(4-(氯二氟甲氧基)苯基)-2-(二氟甲基)-1-甲基-4-(嘧啶-5-基)-1h-苯并[d]咪唑-6-甲酰胺(3).在n2下向4-溴-n-(4-(氯二氟甲氧基)苯基)-2-(二氟甲基)-1-甲基-1h-苯并[d]咪唑
ꢀ‑
6-甲酰胺(3e,100mg,0.208mmol,1eq)和嘧啶-5-基硼酸(51.56mg,0.416mmol,2eq)于二噁烷(4ml)和h2o(1ml)中的溶液中添加k3po4(132.49mg,0.624mmol,3eq)和pd(dppf)cl2(15.22mg,0.021mmol,0.1eq)。在n2下于100℃下将混合物搅拌4hr。lcms 显示起始材料消耗且检测到所需产物。将混合物倾倒到水中并用etoac萃取。浓缩有机层且通过制备型hplc(nh4hco3条件,管柱:沃特世x桥prep obd c18 150*30 10u;移动相:[水(10mm nh4hco3)-acn];b%:30%-50%,10min)纯化所得残余物,从而产生白色固体状标题化合物3。[m h]
(c
21h14
clf4n5o2)计算的ms质量要求m/z 480.1,lcms 实验值m/z 480.1。1h nmr(400mhz,dmso-d6)δ10.58(s,1h),9.55(s,2h),9.26(s,1h), 8.46(s,1h),8.32(s,1h),7.93(d,j=9.2hz,2h),7.69-7.37(m,3h),4.08(s,3h)。
[0633]
实例4
[0634]
n-(4-(氯二氟甲氧基)苯基)-1,2-二甲基-4-(嘧啶-5-基)-1h-苯并[d]咪唑-6-甲酰胺
[0635][0636]
7-溴-2-甲基-1h-苯并[d]咪唑-5-甲酸甲基酯(4a).于20℃下向3,4-二氨基-5-溴苯甲酸甲基酯(以与1d类似的方式合成;3a,0.16g,0.653mmol,1eq)于ch3cooh(3ml)中的混合物中添加4-甲苯磺酸(11.24mg,0.065mmol,0.1eq)。将混合物于100℃下搅拌3小时。lcms显示所需ms。将混合物倾倒到水(20ml)中,并且然后用etoac(20ml
×
3)萃取。将合并的有机层用无水na2so4干燥,过滤且在真空中浓缩,从而产生褐色油状4a。
[0637]
4-溴-1,2-二甲基-1h-苯并[d]咪唑-6-甲酸甲基酯(4b).向7-溴-2-甲基-1h-苯并[d]咪唑
ꢀ‑
5-甲酸甲基酯(4a,0.15g,0.557mmol,1eq)和nah(44.59mg,1.11mmol,60%纯度,2eq) 于dmf(1ml)中的混合物中添加ch3i(158.24mg,1.11mmol,69.40ul,2eq)。在15℃下将混合物搅拌16小时。lcms显示所需ms。将混合物倾倒到水(20ml)中,并且然后用 etoac(20ml
×
3)萃取。将合并的有机层经无水na2so4干燥,过滤并在真空中浓缩,从而产生产物。通过制备型tlc(石油醚:乙酸乙酯=0:1,rf=0.40)纯化残余物,从而产生褐色油状4b。
[0638]
1,2-二甲基-4-(嘧啶-5-基)-1h-苯并[d]咪唑-6-甲酸甲基酯(4c).在n2下向4-溴-1,2-二甲基-1h-苯并[d]咪唑-6-甲酸甲基酯(4b,0.02g,0.071mmol,1eq)、嘧啶-5-基-硼酸(26.26 mg,0.212mmol,3eq)和k3po4(44.98mg,0.212mmol,3eq)于二噁烷(2ml)、h2o(0.2ml) 中的混合物中添加pd(dppf)cl2(5.17mg,7.06umol,0.1eq)。在110℃下将混合物搅拌16 小时。lcms显示所需ms。将混合物倾倒到水中且用etoac萃取。将合并的有机层经无水na2so4干燥,过滤并在真空中浓缩,从而产生粗产物。通过制备型tlc(石油醚:乙酸乙酯=0:1,rf=0.37)纯化残余物,从而得到黄色油状4c。
[0639]
1,2-二甲基-4-(嘧啶-5-基)-1h-苯并[d]咪唑-6-甲酸(4d).向4c(0.015g,0.053mmol,1 eq)于h2o(0.5ml)、thf(1ml)、meoh(1ml)的混合物中添加lioh.h2o(4.46mg,0.106 mmol,2eq)。在15℃下将混合物搅拌16小时。lcms显示所需ms。将混合物倾倒到水中且用etoac萃取,将合并的有机层经无水na2so4干燥,过滤且在真空中浓缩,从而产生红色固体状4d。粗产物未经进一步纯化即用于下一步骤中。
[0640]
n-(4-(氯二氟甲氧基)苯基)-1,2-二甲基-4-(嘧啶-5-基)-1h-苯并[d]咪唑-6-甲酰胺(4). 于20℃下向1,2-二甲基-4-(嘧啶-5-基)-1h-苯并[d]咪唑-6-甲酸(4d,15mg,0.056mmol,1 eq)和hatu(25.51mg,0.067mmol,1.2eq)、dipea(14.45mg,0.112mmol,19.48ul,2eq) 于dmf(1ml)中的混合物中添加4-[氯(二氟)甲氧基]苯胺(1h,16.24mg,0.084mmol,1.5 eq)。在20℃下将混合物搅拌16小时。在真空中浓缩混合物。lcms显示所需ms。将混合物倾倒到水中且用etoac萃取,并且将合并的有机层经无水na2so4干燥,过滤且在真空中浓缩,从而产生粗产物。通过制备型hplc(tfa条件,管柱:纳-微尤尼西(nano-microunisil)5-100c18 ultra 100*250mm 5um;移动相:[水(0.1%tfa)-acn];b%:25%-50%, 11min)纯化残余物,从而得到白色固体状标题化合物4。[m 1]
(c
21h16
clf2n5o2)计算的 ms质量要求m/z 444.1,lcms实验值m/z 444.1。1h nmr(400mhz,meod-d4)δ9.33-9.25 (m,3h),8.48(s,1h),8.25(s,1h),7.88(d,j=9.0hz,2h),7.33(d,j=8.8hz,2h),4.07(s, 3h),2.85(s,3h)。
[0641]
实例5(一般程序d)
[0642]
(r)-n-(4-(氯二氟甲氧基)苯基)-2-(二氟甲基)-1-(1-羟基丙-2-基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺
[0643]
标题化合物是根据示意方案4制备。所述一般程序d例示示意方案4且提供如应用于标题化合物的特定合成细节。
[0644][0645]
(r)-7-溴-2-(二氟甲基)-1-(1-羟基丙-2-基)-1h-苯并[d]咪唑-5-甲酸甲基酯(5b).将 (r)-3-氨基-5-溴-4-((1-羟基丙-2-基)氨基)苯甲酸甲基酯(以与1d类似的方式合成;5a,230 mg,0.759mmol,1eq)于2,2-二氟乙酸(4.59g,0.048mmol,3ml,63eq)中的溶液于110℃下搅拌3hr。lcms显示5a完全消耗且检测到所需ms。过滤混合物且在减压下浓缩,从而产生粗制残余物。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1)纯化残余物,以提供白色固体状5b。1h nmr(400mhz,dmso-d6)δ8.34(s,1h)8.11(s,1h),7.37-7.75(m, 1h),5.95-6.10(m,1h),5.31(t,j=5.2hz,1h),3.90(s,3h),3.74-3.87(m,2h),1.59(brd,j=7.3hz,3h)。
[0646]
(r)-7-溴-2-(二氟甲基)-1-(1-羟基丙-2-基)-1h-苯并[d]咪唑-5-甲酸(5c).向(r)-7-溴
ꢀ‑
2-(二氟甲基)-1-(1-羟基丙-2-基)-1h-苯并[d]咪唑-5-甲酸甲基酯(5b,130mg,0.358mmol, 1eq)于thf(1ml)、meoh(1ml)和h2o(0.5ml)中的溶液中添加lioh.h2o(30.04mg, 0.716mmol,2eq)。在15℃下将混合物搅拌2hr。lcms显示5b完全消耗且检测到所需ms。用hcl水溶液将水相酸化到ph 5。过滤混合物并在真空中浓缩。产物未经进一步纯化即用于下一步骤中。获得白色固体状化合物5c。
[0647]
(r)-7-溴-n-(4-(氯二氟甲氧基)苯基)-2-(二氟甲基)-1-(1-羟基丙-2-基)-1h-苯并[d]咪唑-5-甲酰胺(5e).向(r)-7-溴-2-(二氟甲基)-1-(1-羟基丙-2-基)-1h-苯并[d]咪唑-5-甲酸(5c, 100mg,0.286mmol,1eq)和4-(氯二氟甲氧基)苯胺(1h,66.54mg,0.344mmol,1.2eq)于 dmf(2ml)中的溶液中添加hatu(130.69mg,0.344mmol,1.2eq)和diea(148.08mg, 1.15mmol,199.56ul,4eq)。在15℃下将混合物搅拌12hr。lcms显示5c完全消耗且检测到所需ms。将混合物用水(5ml)稀释且用etoac(10ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生粗制残余物。通过制备型tlc(sio2,乙酸乙酯:甲醇=10:1)纯化残余物,从而黄色油状得到5e。1h nmr(400 mhz,dmso-d6)δ10.56(s,1h),8.49(s,1h),8.21(s,1h),7.93(d,j=9.3hz,2h), 7.43-7.71(m,1h),7.38(br d,j=9.0hz,2h),6.02(br d,j=6.2hz,1h),5.23-5.45(m,1 h),3.72-3.93(m,2h),1.60(br d,j=6.8hz,3h)。
eq)和diea(775.28mg,6.00mmol,1.04ml,1.1eq)。将混合物加热到30℃并搅拌12小时。 lc-ms显示检测到具有所需质量的一个主峰。浓缩混合物且通过管柱色谱(sio2,石油醚: 乙酸乙酯=20:1到5:1)纯化所得残余物,从而产生黄色固体状6b。
[0655]
3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-(甲基氨基)苯甲酰胺(6c).于20℃下向3-溴
ꢀ‑
n-(4-(氯二氟甲氧基)苯基)-4-(甲基氨基)-5-硝基苯甲酰胺(6b,2.1g,4.66mmol,1eq)于 acoh(15ml)中的溶液中一次性添加fe(2.60g,46.60mmol,10eq)。将混合物于35℃下搅拌3h。tlc(石油醚:乙酸乙酯=1:1,rf=0.6)指示6b完全消耗且形成一个新的斑点。添加乙酸乙酯(40ml)且经由垫过滤混合物。用h2o(30ml)、饱和 nahco3溶液(20ml
×
3)和盐水(20ml)洗涤滤液,之后经无水na2so4干燥,过滤且在真空中浓缩,从而得到黄色固体状6c。粗产物未经进一步纯化即用于下一步骤中。
[0656]
3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-(甲基氨基)苯甲酰胺(6d).将3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-(甲基氨基)苯甲酰胺(6c,0.075g,0.178mmol,1eq)于2-甲基丙酸(314.18mg,3.57mmol,330.72ul,20eq)中的混合物于130℃下搅拌12小时。混合物从褐色变为暗色。lc-ms显示6e完全消耗且检测到所需质量。通过制备型tlc(sio2, 石油醚:乙酸乙酯=1:1)纯化残余物,从而得到黄色油状6d。
[0657]
n-(4-(氯二氟甲氧基)苯基)-2-异丙基-1-甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺(6).于15℃下在n2下向3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-(甲基氨基)苯甲酰胺 (6d,0.03g,0.063mmol,1eq)和嘧啶-5-基硼酸(15.73mg,0.127mmol,2eq)于二噁烷(4 ml)和h2o(0.3ml)中的混合物中一次性添加pd(dppf)cl2(4.64mg,6.35umol,0.1eq)、 k3po4(40.41mg,0.190mmol,3eq)。在110℃下将混合物搅拌12小时。lc-ms显示起始材料完全消耗且检测到具有所需质量的一个主峰。经由垫过滤混合物且浓缩滤液,从而产生粗制残余物。通过制备型hplc(tfa条件:管柱:卢纳c18 100*30 5u;移动相:[水(0.1%tfa)-acn];b%:15%-45%,14min)纯化残余物,以提供白色固体状标题化合物6。[m h]
(c
23h20
o2n5clf2)计算的ms质量要求m/z 472.1,lcms实验值m/z472.1。1h nmr(400mhz,meod-d4)δ9.34(s,1h),9.07(s,2h),8.43(d,j=1.5hz,1h), 8.01(d,j=1.5hz,1h),7.84(d,j=9.0hz,2h),7.31(d,j=9.0hz,2h),3.64-3.55(m, 4h),1.52(d,j=6.8hz,6h)。
[0658]
实例7(一般程序f)
[0659]
n-(4-(氯二氟甲氧基)苯基)-1,2-二甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺
[0660]
标题化合物是根据示意方案6制备。所述一般程序f例示示意方案6且提供如应用于标题化合物的特定合成细节。
[0661][0662]
1,2-二甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酸甲基酯(7b).在n2下向7-溴-1,2-二甲基-1h-苯并[d]咪唑-5-甲酸甲基酯(以与1e类似的方式合成;7a,0.15g,0.53mmol,1eq)和嘧啶-5-基硼酸(65.65mg,0.53mmol,1eq)于二噁烷(5ml)和h2o(0.5ml)中的混合物中添加pd(dppf)cl2(38.77mg,0.53mmol,0.1eq)和k3po4.3h2o(423.28mg,1.59mmol,3 eq)。在110℃下将混合物搅拌16小时。tlc(乙酸乙酯:甲醇=8:1,rf=0.20)指示7a完全消耗,并且检测到具有更大极性的一个新的主斑点。lc-ms显示7a完全消耗且检测到具有所需质量的一个主峰。过滤混合物且浓缩,从而产生残余物,通过制备型tlc(sio2,乙酸乙酯:甲醇=8:1)对其进行纯化,从而得到浅褐色固体状7b。1h nmr(400mhz, dmso-d6)δ9.30(s,1h),9.01(s,2h),8.21(d,j=1.3hz,1h),7.67(d,j=1.3hz,1h), 3.87(s,3h),3.32-3.31(m,3h),2.55(s,3h)。
[0663]
1,2-二甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酸(7c).向1,2-二甲基-7-(嘧啶-5
‑ꢀ
基)-1h-苯并[d]咪唑-5-甲酸甲基酯(7b,0.06g,0.213mmol,1eq)于thf(2ml)、meoh(2 ml)、h2o(1ml)中的溶液中添加lioh.h2o(17.84mg,0.425mmol,2eq)。将混合物于 50℃下搅拌3小时。lc-ms显示7b完全消耗且检测到具有所需质量的一个主峰。用hcl 水溶液(1m)将混合物调节到ph=5且浓缩,从而产生褐色固体状7c。产物未经进一步纯化即用于下一步骤中。
[0664]
n-(4-(氯二氟甲氧基)苯基)-1,2-二甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺(7) 向1,2-二甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酸(7c,0.057g,0.212mmol,1eq)和4-(氯二氟甲氧基)苯胺(1h,45.24mg,0.234mmol,1.1eq)、hatu(96.95mg,0.255mmol,1.2 eq)于dmf(2ml)中的混合物中添加diea(82.38mg,0.637mmol,111.03ul,3eq)。在 15℃下将混合物搅拌12小时。lc-ms显示7c完全消耗且检测到具有所需质量的一个主峰。浓缩混合物,从而产生粗制残余物,通过制备型hplc(fa条件:管柱:纳-微克罗马斯尔(nano-micro kromasil)c18 100*30mm 5um;移动相:[水(0.225%fa)-acn];b%: 1%-50%,15min)对其进行纯化,从而产生白色固体状标题化合物7。[m h]
(c
21h16
clf2n5o2)计算的ms质量要求m/z 444.1,lcms实验值m/z 444.2。1h nmr(400 mhz,dmso-d6)δ10.42(s,1h),9.32(s,1h),9.06(s,2h),8.35(d,j=1.3hz,1h),7.92(d, j=9.0hz,2h),7.76(d,j=1.5hz,1h),7.36(d,j=9.0hz,2h),3.37(s,3h),2.57(s,3h)。
[0665]
实例8(一般程序g)
[0666]
n-[4-[氯(二氟)甲氧基]苯基]-6-嘧啶-5-基-3,4-二氢-1h-[1,4]噁嗪并[4,3-a]
苯并咪唑
ꢀ‑
8-甲酰胺
[0667]
标题化合物是根据示意方案7制备。所述一般程序g例示示意方案7且提供如应用于标题化合物的特定合成细节。
[0668][0669]
2-(2-氨基乙氧基)乙酸(8b).将2-[2-(叔丁氧基羰基氨基)乙氧基]乙酸(8a,800mg,3.65 mmol,1eq)于hcl/etoac(5ml)中的溶液于15℃下搅拌2hr。lcms显示8)完全消耗且检测到所需ms。过滤混合物且在减压下浓缩,从而产生白色固体状8b。产物未经进一步纯化即用于下一步骤中。1h nmr(400mhz,dmso-d6)δ12.76(br s,1h)8.09(br s,3h) 4.06(s,2h)3.66(t,j=5.2hz,2h)2.87-3.02(m,2h)。
[0670]
2-[2-(2-溴-4-甲氧基羰基-6-硝基-苯胺基)乙氧基]乙酸(8c).向3-溴-4-氟-5-硝基苯甲酸甲基酯(1a,500mg,1.80mmol,1eq)和2-(2-氨基乙氧基)乙酸(8b,335.75mg,2.16mmol, 1.2eq,hcl)于etoh(10ml)中的溶液中添加tea(454.94mg,4.50mmol,625.78ul,2.5 eq)。将混合物于15℃下搅拌1hr。lcms显示1a完全消耗且检测到所需ms。在减压下浓缩反应混合物。将混合物用水(25ml)稀释且用etoac(20ml
×
3)萃取。将合并的有机层用盐水(15ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生粗制残余物。通过硅胶色谱(管柱高度:250mm,直径:100mm,200-300目硅胶,石油醚/乙酸乙酯= 5/1,乙酸乙酯/甲醇/ch3cooh=5/1/0.1%)纯化残余物,从而得到黄色固体状8c。1hnmr(400mhz,dmso-d6)δ8.28(d,j=1.7hz,1h)8.18(d,j=1.7hz,1h)7.09(br s,1 h)3.89(s,2h)3.83(s,3h)3.65(br t,j=5.0hz,2h)3.19-3.28(m,2h)。
[0671]
2-[2-(2-氨基-6-溴-4-甲氧基羰基-苯胺基)乙氧基]乙酸(8d).向2-[2-(2-溴-4-甲氧基羰基-6-硝基-苯胺基)乙氧基]乙酸(8c,420mg,1.11mmol,1eq)于acoh(5ml)中的溶液中添加fe(621.91mg,11.14mmol,10eq)。将反应混合物在35℃下搅拌1hr。lcms显示8c 完
全消耗且检测到所需ms。经由垫过滤混合物且用乙酸乙酯洗涤。在减压下浓缩混合物,从而产生粗制残余物,通过制备型hplc(hcl条件,管柱:菲罗门卢纳 (phenomenex luna)c18 200*40mm*10um;移动相:[水(0.05%hcl)-acn];b%: 15%-45%,10min)对其进行纯化,从而产生黄色固体状8d。1h nmr(400mhz,dmso-d6) δ7.53(s,1h)7.49(s,1h)4.16(br s,2h)4.05(s,3h)3.60(br t,j=4.9hz,2h) 3.26-3.35(m,2h)。
[0672]
6-溴-3,4-二氢-1h-[1,4]噁嗪并[4,3-a]苯并咪唑-8-甲酸甲基酯(8e).向2-[2-(2-氨基-6
‑ꢀ
溴-4-甲氧基羰基-苯胺基)乙氧基]乙酸(8d,100mg,0.261mmol,1eq,hcl)于dmf(20ml) 中的溶液中添加hatu(109.03mg,0.287mmol,1.1eq)和diea(101.07mg,0.782mmol, 136.21ul,3eq)。将混合物于20℃下搅拌16hr。lcms显示8d完全消耗且检测到所需ms。将混合物用水(5ml)稀释且用etoac(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生粗制残余物。通过制备型tlc(sio2, 石油醚:乙酸乙酯=0:1)纯化残余物,从而得到白色固体状8e。1h nmr(400mhz, cdcl
3-d)δ8.34(d,j=1.3hz,1h)8.11(d,j=1.3hz,1h)5.05(s,2h)4.71(t,j=5.3 hz,2h)4.15-4.26(m,2h)3.95(s,3h)。
[0673]
6-溴-3,4-二氢-1h-[1,4]噁嗪并[4,3-a]苯并咪唑-8-甲酸(8f).向6-溴-3,4-二氢-1h-[1,4] 噁嗪并[4,3-a]苯并咪唑-8-甲酸甲基酯(8e,50mg,0.161mmol,1eq)于meoh(1ml)、thf (1ml)和h2o(0.5ml)中的溶液中添加lioh.h2o(13.49mg,0.321mmol,2eq)。将混合物于40℃下搅拌6hr。tlc(石油醚:乙酸乙酯=0:1,rf=0)显示8e完全消耗且检测到具有更大极性的一个新的主斑点。在真空中浓缩混合物。将混合物添加到h2o(3ml)中且用hcl 水溶液将水相调节到ph=5。在真空中浓缩混合物,从而得到白色固体状8f。产物未经进一步纯化即用于下一步骤中。1h nmr(400mhz,dmso-d6)δ8.13(d,j=1.2hz,1h) 7.94(d,j=1.3hz,1h)5.00(s,2h)4.63(t,j=5.3hz,2h)4.16(t,j=5.3hz,2h)。
[0674]
6-溴-n-[4-[氯(二氟)甲氧基]苯基]-3,4-二氢-1h-[1,4]噁嗪并[4,3-a]苯并咪唑-8-甲酰胺(8g).向6-溴-3,4-二氢-1h-[1,4]噁嗪并[4,3-a]苯并咪唑-8-甲酸(8f,45mg,0.151mmol,1 eq)和4-(氯二氟甲氧基)苯胺(1h,35.18mg,0.182mmol,1.2eq)于吡啶(2ml)中的溶液中添加hatu(69.11mg,0.182mmol,1.2eq)。将混合物于40℃下搅拌6hr。lcms显示8f完全消耗且检测到所需ms。将混合物用水(5ml)稀释且用etoac(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生粗制残余物。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1)纯化残余物,以获白色固体状得 8g。1h nmr(400mhz,cdcl
3-d)δ8.11(s,1h)8.00(s,1h)7.96(br s,1h)7.73(d,j= 8.9hz,2h)7.29(br s,2h)5.06(s,2h)4.73(t,j=5.3hz,2h)4.22(t,j=5.1hz,2h)。
[0675]
n-[4-[氯(二氟)甲氧基]苯基]-6-嘧啶-5-基-3,4-二氢-1h-[1,4]噁嗪并[4,3-a]苯并咪唑
ꢀ‑
8-甲酰胺(8).向6-溴-n-[4-[氯(二氟)甲氧基]苯基]-3,4-二氢-1h-[1,4]噁嗪并[4,3-a]苯并咪唑-8-甲酰胺(8g,40mg,0.085mmol,1eq)和嘧啶-5-基硼酸(20.97mg,0.169mmol,2eq)于二噁烷(1ml)和h2o(0.1ml)中的溶液中添加pd(dppf)cl2(6.19mg,8.46umol,0.1eq)和 k3po4(53.89mg,0.254mmol,3eq)。将混合物于110℃下搅拌16hr。lcms显示8g完全消耗且检测到所需ms。将混合物用水(15ml)稀释且用etoac(15ml
×
3)萃取。将合并的有机层用盐水(10ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生粗制残余物。通过制备型tlc(sio2,乙酸乙酯:甲醇=10:1)纯化残余物,从而得到黄色固体状标题化
合物8。[m h]
(c
22h16
o3n5clf2)计算的ms质量要求m/z 472.1,lcms实验值m/z472.1 1
h nmr(400mhz,dmso-d6)δ10.46(s,1h)9.32(s,1h)9.10(s,2h)8.42(s,1h) 7.93(d,j=9.0hz,2h)7.82(s,1h)7.26-7.45(m,1h)7.36(br d,j=8.8hz,1h)5.03(s, 2h)3.98(br t,j=4.9hz,2h)3.70-3.83(m,2h)。
[0676]
实例9(一般程序h)
[0677]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-2-甲氧基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺
[0678]
标题化合物是根据示意方案8制备。所述一般程序h例示示意方案8且提供如应用于标题化合物的特定合成细节。
[0679][0680]
7-溴-n-(4-(氯二氟甲氧基)苯基)-1-异丙基-2-甲氧基-1h-苯并[d]咪唑-5-甲酰胺(9b). 向3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-(异丙基氨基)苯甲酰胺(以与6c类似的方式合成;9a,100mg,0.223mmol,1eq)于acoh(2ml)中的溶液中添加四甲氧基甲烷(197.23 mg,1.45mmol,6.5eq)。将混合物于50℃下搅拌16hr。lcms显示9a完全消耗且检测到所需ms。tlc(石油醚:乙酸乙酯=3:1,rf=0.4)显示9a完全消耗,检测到具有较小极性的一个新的主斑点。在减压下浓缩反应混合物。将混合物用饱和nahco3水溶液洗涤,经 na2so4干燥并蒸发到干燥。通过制备型tlc(sio2,石油醚:乙酸乙酯=3:1)纯化粗制残余物,从而得到白色固体状9b。
[0681]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-2-甲氧基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺(9).将7-溴-n-(4-(氯二氟甲氧基)苯基)-1-异丙基-2-甲氧基-1h-苯并[d]咪唑-5-甲酰胺 (9b,40mg,0.082mmol,1eq)、嘧啶-5-基硼酸(30.42mg,0.246mmol,3eq)、pd(dppf)cl
2 (5.99mg,8.18umol,0.1eq)和k3po4(52.12mg,0.246mmol,3eq)于二噁烷(4ml)和h2o (0.4ml)中的混合物脱气且用n2吹扫3次。将混合物在110℃下在n2气氛下搅拌16hr。 lcms显示9b完全消耗且检测到所需ms。在减压下浓缩反应混合物。通过制备型tlc (sio2,石油醚:乙酸乙酯=1:1)纯化残余物,从而产生白色固体状标题化合物9。[m 1]
(c
23h20
clf2n5o3)计算的ms质量要求m/z 488.1,lcms实验值m/z 488.0。1h nmr(400 mhz,dmso-d6)δ10.33(s,1h),9.33(s,1h),9.06(s,2h),8.21(d,j=1.5hz,1h), 7.94-7.89(m,2h),7.64(d,j=1.5hz,1h),7.35(d,j=9.0hz,2h),4.18(s,3h),3.99-3.91 (m,1h),1.29(d,j=6.8hz,6h)。
[0682]
实例10
[0683]
n-(4-(氯二氟甲氧基)苯基)-7-(4-环丙基-1h-咪唑-1-基)-1-异丙基-1h-苯并[d]咪唑-5
‑ꢀ
甲酰胺
[0684][0685]
n-(4-(氯二氟甲氧基)苯基)-7-(4-环丙基-1h-咪唑-1-基)-1-异丙基-1h-苯并[d]咪唑-5
‑ꢀ
甲酰胺(10).将7-溴-n-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(以与 2c类似的方式合成;10a,50mg,0.109mmol,1eq)、4-环丙基-1h-咪唑(10b,23.58mg, 0.218mmol,2eq)、cui(20.76mg,0.109mmol,1eq)、k2co3(150.65mg,1.09mmol,10eq) 和dmeda(19.22mg,0.218mmol,23.47μl,2eq)于dmf(2ml)中的混合物脱气且用n2吹扫3次,之后将混合物于140℃下在n2气氛下搅拌16hr。浓缩反应混合物,并且用乙酸乙酯(30ml)萃取水相。用盐水(5ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(乙酸乙酯:甲醇=10:1,rf=0.2)纯化粗产物,从而产生粗产物,通过制备型hplc(nh4hco3,管柱:沃特世x桥prep obd c18 150*30 10u;移动相:[水(10mm nh4hco3)-acn];b%:35%-55%,10min)对其进一步纯化,从而产生白色固体状标题化合物10。[m 1]
(c
24h22
clf2n5o2)计算的ms质量要求m/z 486.1,lcms 实验值m/z 486.1;1h nmr(400mhz,meod-d4)δ8.61(s,1h),8.49(d,j=1.5hz,1h), 7.92(s,2h),7.87-7.81(m,2h),7.33-7.24(m,3h),3.78(td,j=6.7,13.4hz,1h),2.01-1.89 (m,1h),1.46(br s,6h),0.93(dd,j=2.0,8.4hz,2h),0.77(br s,2h)。
[0686]
实例11
[0687]
n-(4-(氯二氟甲氧基)苯基)-7-(1h-咪唑-1-基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺
[0688][0689]
n-(4-(氯二氟甲氧基)苯基)-7-(1h-咪唑-1-基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺 (11).向7-溴-n-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(10a,200mg, 0.436mmol,1eq)和咪唑(148.42mg,2.18mmol,5eq)于dmf(2ml)中的溶液中添加 k2co3(602.64mg,4.36mmol,10eq)、cui(83.04mg,0.436mmol,1eq)和dmeda(115.31 mg,1.31mmol,140.79ul,3eq)。将混合物于120℃下搅拌12hr。将混合物溶解于etoac (20ml)中,用水(10ml
×
5)洗涤且浓缩有机层。通过制备型hplc(nh4hco3条件,管柱:沃特世x桥prep obd c18 150*30 10u;移动相:[水(10mm nh4hco3)-acn];b%: 35%-55%,10min)纯化残余物,从而产生白色固体状标题化合物11。[m 1]
(c
21h18
clf2n5o2)计算的ms质量要求m/z 446.1,lcms实验值m/z 446.1;1h nmr(400 mhz,meod-d4)δ8.63(s,1h),8.51(d,j=1.5hz,1h),8.11(s,1h),7.95(d,j=1.5hz, 1h),7.89-7.78(m,2h),7.58(d,j=1.3hz,1h),7.35-7.21(m,3h),3.70(quin,j=6.7hz, 1h),1.43(br s,6h)。
[0690]
实例12
[0691]
n-(4-(氯二氟甲氧基)苯基)-2-(2-羟基乙基)-1-甲基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5
‑ꢀ
甲酰胺
[0692][0693]
3-((3-溴-5-((4-(氯二氟甲氧基)苯基)氨甲酰基)-2-(甲基氨基)苯基)氨基)-3-氧代基丙酸甲基酯(12a).向3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-(甲基氨基)苯甲酰胺(6c,300 mg,0.713mmol)和3-氯-3-氧代基-丙酸甲基酯(107.11mg,0.784mmol,83.68ul,1.1eq)于 dcm中的溶液中逐滴添加tea(72.17mg,0.713mmol,99.27ul,1eq)。将混合物升温到 30℃并搅拌0.5hr。在减压下浓缩反应混合物以去除溶剂。通过制备型tlc(sio2,石油醚:乙酸乙酯=1:1)纯化残余物,从而产生褐色固体状12a。
[0694]
2-(7-溴-5-((4-(氯二氟甲氧基)苯基)氨甲酰基)-1-甲基-1h-苯并[d]咪唑-2-基)乙酸甲基酯(12b).将3-((3-溴-5-((4-(氯二氟甲氧基)苯基)氨甲酰基)-2-(甲基氨基)苯基)氨基)-3-氧代基丙酸甲基酯(12a,130mg,0.25mmol)于acoh中的溶液加热到60℃并搅拌6小时。 lc-ms显示反应物完全消耗且检测到具有所需质量的一个主峰。将混合物倾倒到etoac 中且将混合物用水、饱和nahco3和盐水洗涤。经na2so4干燥合并的有机层并浓缩。通过制备型tlc纯化残余物,从而产生黄色固体状12b。
[0695]
7-溴-n-(4-(氯二氟甲氧基)苯基)-2-(2-羟基乙基)-1-甲基-1h-苯并[d]咪唑-5-甲酰胺 (12c).于20℃下在n2下向2-(7-溴-5-((4-(氯二氟甲氧基)苯基)氨甲酰基)-1-甲基-1h-苯并[d] 咪唑-2-基)乙酸甲基酯(12b,50mg,0.099mmol,1eq)于thf中的溶液中一次性缓慢添加 libh4(10.83mg,0.497mmol,5eq)。将混合物加热到30℃且搅拌50min。lc-ms显示反应物完全消耗且检测到具有所需质量的一个主峰。将反应混合物冷却到0℃后,通过添加h2o淬灭反应混合物,并且用1n hcl酸化到ph=6。在减压下浓缩反应混合物以去除溶剂。通过制备型tlc(sio2,乙酸乙酯:甲醇=10:1)纯化残余物,从而产生黄色固体状 12c。
甲酸甲基酯(13b, 10mg,0.023mmol,1eq)于thf(1ml)、h2o(1ml)和meoh(0.5ml)的混合物中一次性添加lioh.h2o(1.92mg,0.046mmol,2eq)。将混合物加热到45℃并搅拌2小时。lc-ms 显示反应物完全消耗且检测到具有所需质量的一个主峰。在减压下浓缩反应混合物以去除溶剂。将残余物倾倒到h2o(0.5ml)中且用1n hcl酸化到ph=5。过滤混合物,并且用0.5ml h2o洗涤滤饼且在真空中干燥,从而产生粗产物。获得白色固体状粗制残余物 13c且不经进一步纯化即用于下一步骤中。
[0702]n5-(4-(氯二氟甲氧基)苯基)-n
7-环丙基-1-异丙基-1h-苯并[d]咪唑-5,7-二甲酰胺(13). 于20℃下向5-((4-(氯二氟甲氧基)苯基)氨甲酰基)-1-异丙基-1h-苯并[d]咪唑-7-甲酸(13c, 40mg,0.094mmol,1eq)和环丙胺(6.47mg,0.113mmol,7.85ul,1.2eq)于dmf(2ml)中的混合物中一次性添加hatu(39.48mg,0.104mmol,1.1eq)和diea(24.40mg,0.189 mmol,32.88ul,2eq)。将混合物于20℃下搅拌12h。lc-ms显示剩余40%的反应物。利用lc-ms观察到一个新的峰且检测到60%的所需化合物。在减压下浓缩反应混合物以去除溶剂。将etoac(15ml)添加到残余物中。将有机层用h2o(10ml)和盐水(10ml)洗涤,通过na2so4干燥且在减压下浓缩,从而产生粗产物。通过制备型tlc(sio2,etoac:meoh =10:1)纯化残余物,从而产生白色固体状标题化合物13。[m 1]
(c
22h21
clf2n4o3)计算的ms质量要求m/z 463.1,lcms实验值m/z 463.1;1h nmr(400mhz,dmso-d6)δ10.49 (s,1h),8.88(d,j=4.3hz,1h),8.61(s,1h),8.48(d,j=1.6hz,1h),7.96(d,j=9.0hz, 2h),7.89(d,j=1.6hz,1h),7.37(d,j=9.0hz,2h),4.96(quin,j=6.7hz,1h), 3.02-2.87(m,1h),1.50(d,j=6.7hz,6h),0.85-0.70(m,2h),0.65-0.56(m,2h)。
[0703]
实例14
[0704]
n-(4-(氯二氟甲氧基)苯基)-1-((1-羟基环丙基)甲基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑
ꢀ‑
5-甲酰胺
[0705][0706]
3-溴-4-(((1-((叔丁基二苯基硅基)氧基)环丙基)甲基)氨基)-5-硝基苯甲酸甲
7-(嘧啶-5
‑ꢀ
基)-1h-苯并[d]咪唑-5-甲酰胺(14i).于25℃下向1-((1-((叔丁基二苯基硅基)氧基)环丙基) 甲基)-7-(吡啶-3-基)-1h-苯并[d]咪唑-5-甲酸(14g,90mg,0.164mmol,1eq)和1h(38.10 mg,0.197mmol,1.2eq)于dmf(3ml)中的溶液中添加dipea(63.59mg,0.492mmol, 85.71ul,3eq)和hatu(93.55mg,0.246mmol,1.5eq)。将混合物于25℃下搅拌12hr。添加etoac(10ml),用水(10ml
×
5)洗涤混合物,将有机层经na2so4干燥且浓缩,从而产生粗产物。通过管柱色谱纯化残余物。获得浅黄色固体状化合物14i。
[0712]
n-(4-(氯二氟甲氧基)苯基)-1-((1-羟基环丙基)甲基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑
ꢀ‑
5-甲酰胺(14).于25℃下在n2下向1-((1-((叔丁基二苯基硅基)氧基)环丙基)甲基)-n-(4-(氯二氟甲氧基)苯基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺(14i,0.03g,0.041mmol,1eq) 于无水thf(3ml)中的溶液中添加tbaf(1m,41.42ul,1eq)。将混合物于25℃下搅拌2 hr且浓缩。通过制备型hplc(nh4hco3条件,管柱:沃特世x桥prep obd c18 150*30 10u;移动相:[水(10mm nh4hco3)-acn];b%:35%-55%,10min)纯化残余物,从而产生黄色固体状标题化合物14。[m 1]
(c
23h18
clf2n5o3)计算的ms质量要求m/z 486.1, lcms实验值m/z 486.1;1h nmr(400mhz,dmso-d6)δ10.45(s,1h),9.33(s,1h),9.04 (s,2h),8.53(s,2h),7.98-7.93(m,j=9.2hz,2h),7.81(s,1h),7.42-7.33(m,j=9.0hz, 2h),5.46(s,1h),3.94(s,2h),0.61-0.52(m,2h),0.49-0.41(m,2h)。
[0713]
实例15
[0714]
n-(4-(氯二氟甲氧基)苯基)-1-环丙基-2-(二氟甲基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5
‑ꢀ
甲酰胺
[0715][0716]
3-溴-4-(环丙基氨基)-5-(2,2-二氟乙酰胺基)苯甲酸甲基酯(15c).于0℃下向3-氨基-5
‑ꢀ
溴-4-(环丙基氨基)苯甲酸甲基酯(以与1d类似的方式合成;15a,200mg,0.701mmol,1eq) 于dcm(8ml)中的溶液中添加tea(212.93mg,2.10mmol,3eq)和2,2-二氟乙酸酐(15b) (122.08mg,0.701mmol,1eq)。将混合物于15℃下在n2气氛下搅拌2hr。lcms显示检测到具有所需ms的峰。浓缩反应混合物。通过制备型tlc(石油醚:乙酸乙酯=3:1,rf= 0.4)纯化粗产物,从而产生黄色固体状15c。
[0717]
7-溴-1-环丙基-2-(二氟甲基)-1h-苯并[d]咪唑-5-甲酸甲基酯(1d).向15d(80mg,0.220 mmol,1eq)于甲苯(3ml)中的溶液中添加acoh(1.32mg,0.022mmol,10eq)。将混合物于60℃下搅拌16hr。lcms显示具有所需ms的峰。浓缩反应混合物,并且通过制备型tlc (石油醚:乙酸乙酯=1:1,rf=0.4)纯化粗产物,从而产生黄色固体状15d。1h nmr(400 mhz,cdcl
3-d)δ8.43(d,j=1.3hz,1h),8.29(d,j=1.3hz,1h),7.18-6.85(m,1h),3.97 (s,3h),3.70-3.60(m,1h),1.46-1.39(m,2h),1.39-1.34(m,2h)
[0718]
7-溴-1-环丙基-2-(二氟甲基)-1h-苯并[d]咪唑-5-甲酸(15e).向15d(1520mg,0.058 mmol,1eq)于thf(1ml)、meoh(1ml)和h2o(0.5ml)中的溶液中添加lioh.h2o(4.86 mg,0.116mmol,2eq)。在50℃下将混合物搅拌2hr。lcms显示具有所需ms的峰。浓缩混合物且倾倒到h2o(1ml)中,并且通过hcl(1m,于h2o中)将ph调节到5。浓缩混合物,从而产生黄色固体状15e。1h nmr(400mhz,cdcl
3-d)δ8.49(s,1h),8.32(d,j=1.3hz, 1h),7.04-6.89(m,1h),3.65(br dd,j=3.4,7.2hz,1h),1.46-1.41(m,2h),1.37(br s,2h)。
[0719]
7-溴-n-(4-(氯二氟甲氧基)苯基)-1-环丙基-2-(二氟甲基)-1h-苯并[d]咪唑-5-甲酰胺(15g).将15e(18mg,0.054mmol,1eq)、1h(15.79mg,0.082mmol,1.5eq)、hatu(31.01 mg,0.082mmol,1.5eq)和diea(21.08mg,0.163mmol,3eq)于dmf(1ml)中的混合物于 15℃下搅拌2hr。lcms显示具有所需ms的峰。浓缩反应混合物,并且通过制备型tlc(石油醚:乙酸乙酯=2:1,rf=0.5)纯化粗产物,从而产生黄色固体状15g。1h nmr(400 mhz,cdcl
3-d)δ8.20(d,j=1.5hz,1h),8.16(d,j=1.5hz,1h),7.85(s,1h),7.72(d,j= 9.0hz,2h),7.30(br s,2h),7.04(s,1h),3.72(br s,1h),1.47-1.42(m,2h),1.37(br d,j= 4.4hz,2h)。
[0720]
n-(4-(氯二氟甲氧基)苯基)-1-环丙基-2-(二氟甲基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5
‑ꢀ
甲酰胺(15).将15g(35mg,0.069mmol,1eq)、嘧啶-5-基硼酸(25.68mg,0.207mmol,3eq)、 pd(dppf)cl2(5.05mg,6.91umol,0.01eq)、k3po4(43.99mg,0.207mmol,3eq)于二噁烷(2 ml)和h2o(0.2ml)中的混合物脱气且用n2吹扫3次。于100℃下在n2气氛下将反应混合物搅拌8hr。lcms显示具有所需ms的峰。浓缩反应混合物,并且通过制备型tlc(石油醚:乙酸乙酯=0:1,rf=0.45)纯化粗产物,从而产生白色固体状标题化合物15。[m h]
(c
23h16
clf4n5o2)计算的ms质量要求m/z 506.1,lcms实验值m/z 506.1。1h nmr(400 mhz,ch3od-d4)δ9.29(s,1h),9.15(s,2h),8.50(d,j=1.5hz,1h),8.02(d,j=1.5hz, 1h),7.86(d,j=9.0hz,2h),7.48-7.21(m,3h),3.45(td,j=3.3,7.1hz,1h),0.80(br s, 2h),0.60(br d,j=6.6hz,2h)。
[0721]
实例16
[0722]
n-(4-(氯二氟甲氧基)苯基)-1-(1-羟基-2-甲基丙-2-基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑
ꢀ‑
5-甲酰胺
甲酸甲基酯 (16f).向16e(20mg,0.063mmol)于三甲氧基甲烷(1.94g,18.24mmol)中的溶液中添加 ptsa(1.09mg,6.32umol)。将混合物于80℃下搅拌1hr。lcms显示具有所需ms的峰。浓缩反应混合物且通过制备型tlc(乙酸乙酯:甲醇=10:1,rf=0.4)纯化粗制残余物,从而产生黄色油状16f。1h nmr(400mhz,cdcl
3-d)δ9.33(s,1h),8.84(s,2h),8.60(s,1h), 8.31(s,1h),7.70(s,1h),4.85(s,1h),3.96(s,3h),3.58(s,2h),3.09(s,6h),1.44(s,5h), 1.42(br s,1h)。
[0728]
1-(1-羟基-2-甲基丙-2-基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酸甲基酯(16g).向16f (10mg,0.025mmol)于meoh(2ml)中的溶液中添加hcl(0.1m,499.47ul)。将混合物于 15℃下搅拌3hr。lcms显示具有所需ms的峰。浓缩反应混合物,从而产生黄色油状16g。产物未经纯化即用于下一步骤。
[0729]
1-(1-羟基-2-甲基丙-2-基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酸(16h).向16g(10mg, 0.031mmol)于meoh(1ml)、thf(1ml)和h2o(0.5ml)中的溶液中添加lioh.h2o(3.86 mg,0.092mmol)。在50℃下将混合物搅拌3hr。lcms显示具有所需ms的峰。浓缩混合物,并且将残余物倾倒到h2o(1ml)中。通过添加hcl(1m,于h2o中)将溶液的ph调节到4,从而产生白色固体状16h。产物未经进一步纯化即用于下一步骤中。
[0730]
n-(4-(氯二氟甲氧基)苯基)-1-(1-羟基-2-甲基丙-2-基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑
ꢀ‑
5-甲酰胺(16).于15℃下将16h(10mg,0.032mmol)、4-(氯二氟甲氧基)苯胺(1h)、hatu (18.26mg,0.048mmol)和diea(12.41mg,0.096mmol)于dmf(1ml)中的混合物搅拌3 hr。lcms显示具有所需ms的峰。浓缩反应混合物,并且通过制备型hplc(nh4hco3,管柱:艾吉亚
·
达什内尔(agela durashell)c18 150*25 5u;移动相:[水(10mmnh4hco3)-acn];b%:35%-65%,10min)纯化残余物,从而产生白色固体状标题化合物 16。[m 1]
(c
23h20
clf2n5o3)计算的ms质量要求m/z 488.1,lcms实验值m/z 488.1。1hnmr(400mhz,meod-d4)δ9.31(s,1h),8.98(s,2h),8.55(s,1h),8.47(d,j=1.8hz, 1h),7.83(d,j=9.0hz,2h),7.71(d,j=1.8hz,1h),7.29(d,j=9.0hz,2h),3.56(s,2h), 1.41(s,6h)。
[0731]
实例17
[0732]
n-(4-(氯二氟甲氧基)苯基)-7-(4-氟-1h-吡唑-5-基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺
[0733][0734]
4-氟-1-(4-甲氧基苄基)-1h-吡唑(17b).于0℃下向4-氟-1h-吡唑(17a,1g,11.62mmol) 于thf(15ml)中的溶液中添加nah(697.06mg,17.43mmol,60%纯度)。搅拌10min后,向反应混合物中缓慢添加1-(氯甲基)-4-甲氧基-苯(2.18g,13.94mmol)。将所得溶液于 15℃下搅拌16hr。tlc(石油醚:乙酸乙酯=5:1,rf=0.4)指示生成新的斑点。lcms显示具有所需ms的峰。浓缩反应混合物。向残余物中添加h2o(20ml)且用乙酸乙酯(60ml) 萃取水相。用盐水(5ml
×
2)洗涤有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过硅胶管柱色谱(石油醚:乙酸乙酯=50:1~30:1)纯化粗产物,从而产生黄色油状 17b。1h nmr(400mhz,cdcl
3-d)δ7.35(d,j=4.0hz,1h),7.21-7.17(m,3h),6.91-6.87 (m,2h),5.14(s,2h),3.81(s,3h)。
[0735]
5-溴-4-氟-1-(4-甲氧基苄基)-1h-吡唑(17d).于-70℃下向17b(850mg,4.12mmol)于 thf(15ml)中的溶液中缓慢添加n-buli溶液(2.5m,2.47ml,1.5eq)。将混合物搅拌15 min,同时维持温度低于-60℃。向反应混合物中添加1,2-二溴-1,1,2,2-四氯乙烷(17c,1.61 g,4.95mmol)于thf(1ml)中的溶液且将所得溶液连续搅拌额外2hr。tlc(石油醚:乙酸乙酯=3:1,rf=0.6)指示生成新的斑点。lcms显示具有所需ms的峰。利用添加水h2o (20ml)且之后添加乙酸乙酯(80ml)淬灭反应混合物。淬灭反应后,将反应混合物倾倒到分液漏斗中且分离。浓缩有机层且通过硅胶管柱色谱(石油醚:乙酸乙酯=45:1~10:1) 纯化粗产物,从而产生黄色固体状17d。1h nmr(400mhz,cdcl
3-d)δ7.43(d,j=4.8hz, 1h),7.20(d,j=8.8hz,2h),6.89-6.85(m,2h),5.23(s,2h),3.80(s,3h)。
[0736]
4-氟-1-(4-甲氧基苄基)-5-(三甲基锡烷基)-1h-吡唑(17e).将17d(300mg,1.05mmol)、三甲基(三甲基锡烷基)锡烷(413.68mg,1.26mmol)、pd(pph3)4(121.59mg,0.105mmol) 于甲苯(5ml)中的混合物脱气且用n2吹扫3次。将混合物在130℃下在n2气氛下搅拌16 hr。tlc(石油醚:乙酸乙酯=3:1,rf=0.7)指示生成新的斑点。lcms显示检测到具有所需ms的峰。通过添加kf(5ml)、之后添加乙酸乙酯(40ml)淬灭反应混合物。淬灭反应后,将反应混合物倾倒到分液漏斗中且分离。浓缩有机层且通过制备型tlc(石油醚: 乙酸乙酯=3:1,rf=0.7)纯化残余物,从而产生黄色油状17e。1h nmr(400mhz, cdcl
3-d)δ7.40(d,j
=4.8hz,1h),6.92(t,j=8.4hz,2h),6.88-6.83(m,2h),5.21(s, 2h),3.79(s,3h),0.25(s,9h)。
[0737]
n-(4-(氯二氟甲氧基)苯基)-7-(4-氟-1-(4-甲氧基苄基)-1h-吡唑-5-基)-1-异丙基-1h
‑ꢀ
苯并[d]咪唑-5-甲酰胺(17g).将7-溴-n-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(10a,74.58mg,0.163mmol)、17e(120.00mg,0.325mmol)和pd(pph3)4(37.58 mg,0.033mmol)于dmso(3ml)中的混合物脱气且用n2吹扫3次。将混合物在100℃下在 n2气氛下搅拌16hr。lcms显示检测到具有所需ms的峰。利用添加水(40ml)淬灭混合物且用乙酸乙酯(60ml
×
3)萃取混合物,将合并的有机层经na2so4干燥,过滤并浓缩,从而产生粗产物。通过制备型tlc(乙酸乙酯:甲醇=10:1,rf=0.6)纯化粗制残余物,从而产生黄色油状17g。1h nmr(400mhz,cdcl
3-d)δ8.49(d,j=1.5hz,1h),8.13-8.08 (m,1h),7.87(s,1h),7.72(s,2h),7.61-7.56(m,2h),7.49(s,2h),7.28(br s,1h),6.77(d,j =8.6hz,2h),6.70-6.65(m,2h),5.70-5.57(m,1h),5.10-4.92(m,3h),3.91-3.78(m,2h), 3.66(s,3h),1.67(d,j=6.6hz,2h),1.34(d,j=6.6hz,3h),1.15(d,j=6.6hz,3h)。
[0738]
n-(4-(氯二氟甲氧基)苯基)-7-(4-氟-1h-吡唑-5-基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(17).将17g(80mg,0.137mmol)于tfa(2ml)中的溶液于15℃下搅拌16hr。lcms显示检测到具有所需ms的峰。浓缩反应混合物。通过制备型tlc(乙酸乙酯:甲醇=10:1,rf= 0.4)纯化粗制残余物,从而产生白色固体状标题化合物17。[m h]
(c
21h17
clf3n5o2)计算的ms质量要求m/z 464.1,lcms实验值m/z 464.0。1h nmr(400mhz,meod-d4)δ8.56(brs,1h),8.43(br s,1h),7.93(d,j=1.8hz,1h),7.87-7.80(m,3h),7.29(d,j=9.0hz,2h), 4.67(br s,1h),1.43(d,j=6.6hz,6h)。
[0739]
实例18
[0740]
n-(4-(氯二氟甲氧基)苯基)-1-环丙基-7-(4-氟-1h-吡唑-5-基)-1h-苯并[d]咪唑-5-甲酰胺
[0741][0742]
n-(4-(氯二氟甲氧基)苯基)-1-环丙基-7-(4-氟-1-(4-甲氧基苄基)-1h-吡唑-5-基)-1h
‑ꢀ
苯并[d]咪唑-5-甲酰胺(18b).向7-溴-n-(4-(氯二氟甲氧基)苯基)-1-环丙基-1h-苯并[d]咪唑
ꢀ‑
5-甲酰胺(以与10a类似的方式合成;18a,100mg,0.219mmol,1eq)和4-氟-1-(4-甲氧基苄基)-5-(三甲基锡烷基)-1h-吡唑(17e,80.81mg,0.219mmol,1eq)于dmso(1.5ml)中的混合物中添加pd(pph3)4(12.65mg,0.011mmol,0.05eq)。将反应混合物于100℃下搅拌16 hr。lcms显示检测到具有所需ms的峰。将混合物倾倒到水(10ml)中且用etoac
(10ml
ꢀ×
2)萃取混合物。浓缩合并的有机层且通过制备型tlc(etoac:meoh=10:1,rf=0.6)纯化,从而产生黄色油状18b。
[0743]
n-(4-(氯二氟甲氧基)苯基)-1-环丙基-7-(4-氟-1h-吡唑-5-基)-1h-苯并[d]咪唑-5-甲酰胺(18).将n-(4-(氯二氟甲氧基)苯基)-1-环丙基-7-(4-氟-1-(4-甲氧基苄基)-1h-吡唑-5
‑ꢀ
基)-1h-苯并[d]咪唑-5-甲酰胺(18b,120mg,0.206mmol,1eq)溶解于tfa(3ml)中。将反应混合物在20℃下搅拌2hr。lcms显示检测到具有所需ms的峰。在真空下蒸发溶剂且将残余物溶解于etoac(5ml)中。将有机层用饱和nahco3(2ml)、盐水(2ml)洗涤且浓缩,从而产生粗制残余物,通过制备型tlc(etoac:meoh=10:1,rf=0.3)对其进行纯化,从而产生白色固体状标题化合物18。[m h]
(c
21h15
clf3n5o2)计算的ms质量要求 m/z 462.1,lcms实验值m/z 462.0。1h nmr(400mhz,cdcl
3-d)δ9.55(br s,1h),8.31(s, 1h),8.01(s,1h),7.92(s,1h),7.82-7.75(m,2h),7.50(d,j=4.6hz,1h),7.22(br d,j= 8.8hz,2h),3.42(br d,j=3.3hz,1h),0.80-0.63(m,4h)。
[0744]
实例19
[0745]
n-(4-(氯二氟甲氧基)苯基)-1-(1,1-二氧代基硫杂环丁-3-基)-7-(嘧啶-5-基)-1h-苯并 [d]咪唑-5-甲酰胺
[0746][0747]
n-(4-(氯二氟甲氧基)苯基)-7-(嘧啶-5-基)-1-(硫杂环丁-3-基)-1h-苯并[d]咪唑-5-甲酰胺(19c).在n2下向7-溴-n-(4-(氯二氟甲氧基)苯基)-1-(硫杂环丁-3-基)-1h-苯并[d]咪唑-5
‑ꢀ
甲酰胺(19a,130mg,0.266mmol,1eq)、嘧啶-5-基硼酸(以与2c类似的方式合成;19b, 98.87mg,0.798mmol,3eq)、k3po4(169.38mg,0.798mmol,3eq)于二噁烷(2ml)和h2o (0.2ml)中的混合物中添加pd(dppf)cl2(19.46mg,0.27mmol,0.1eq)。在100℃下将混合物搅拌16小时。lcms显示所需ms。将混合物倾倒到水中,并且然后用etoac萃取。将合并的有机层经无水na2so4干燥,过滤并在真空中浓缩,从而产生粗产物。通过制备型tlc (乙酸乙酯:甲醇=10:1,rf=0.30)纯化残余物,从而得到白色固体状19c。1h nmr(400mhz, cdcl
3-d)δ9.36(s,1h),8.82(s,2h),8.43(s,1h),8.31(s,1h),8.01(s,1h),7.71(s,1h), 7.66(br d,j=8.8hz,2h),7.22(br s,2h),5.06(quin,j=8.2hz,1h),3.63(t,j=9.0hz, 2h),3.14(t,j=9.0hz,2h)。
[0748]
n-(4-(氯二氟甲氧基)苯基)-1-(1,1-二氧代基硫杂环丁-3-基)-7-(嘧啶-5-基)-1h-苯并 [d]咪唑-5-甲酰胺(19).于0℃下将n-(4-(氯二氟甲氧基)苯基)-7-(嘧啶-5-基)-1-(硫杂环丁-3
‑ꢀ
基)-1h-苯并[d]咪唑-5-甲酰胺(19c,40mg,0.082mmol,1eq)的混合物溶解于dcm(2ml) 中,添加饱和碳酸氢钠水溶液和mcpba(70.74mg,0.328mmol,80%纯度,
4eq)。将反应混合物于15℃下搅拌16小时。lcms显示所需ms。将混合物倾倒到水中,并且然后用 etoac萃取。将合并的有机层经无水na2so4干燥,过滤并在真空中浓缩,从而产生所需产物。通过制备型tlc(乙酸乙酯:甲醇=10:1,rf=0.37)纯化残余物,从而得到白色固体状标题化合物19。[m 1]
(c
22h16
clf2n5o4s)计算的ms质量要求m/z 520.1,lcms实验值 m/z 520.0。1h nmr(400mhz,dmso-d6)δ10.50(s,1h),9.38(s,1h),9.03(s,2h),8.83(s, 1h),8.55(s,1h),7.95(br d,j=8.8hz,2h),7.88-7.77(m,1h),7.38(br d,j=8.6hz,2h), 4.94-4.83(m,1h),4.74(br d,j=13.2hz,2h),4.41-4.26(m,2h)。
[0749]
实例20
[0750]
n-(4-(氯二氟甲氧基)苯基)-6-氟-1-异丙基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺
[0751][0752]
2-氟-4-(异丙基氨基)-5-硝基苯甲酸甲基酯(20b).于15℃下向2,4-二氟-5-硝基苯甲酸甲基酯(20a,2g,9.21mmol,1eq)于thf(10ml)中的溶液中逐滴添加tea(2.80g,27.63 mmol,3.85ml,3eq),之后逐滴添加丙-2-胺(653.37mg,11.05mmol,949.67ul,1.2eq)。将所得混合物于0℃下搅拌1hr。tlc(石油醚:etoac=5:1,rf=0.50)指示20a完全消耗,并且检测到一个新的主斑点。用etoac(20ml
×
3)萃取水相。用盐水(30ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。产物未经进一步纯化即用于下一步骤中。获得黄色固体状化合物20b。1h nmr(400mhz,cdcl
3-d)δ8.91(d,j=7.8hz,1h), 8.29(br d,j=4.9hz,1h),6.52(d,j=13.7hz,1h),3.90(s,3h),3.83-3.70(m,1h),1.36 (d,j=6.4hz,6h)。
[0753]
3-溴-2-氟-4-(异丙基氨基)-5-硝基苯甲酸甲基酯(20c).向2-氟-4-(异丙基氨基)-5-硝基苯甲酸甲基酯(20b,2g,7.81mmol,1eq)于dcm(5ml)中的溶液中添加br2(2.00g,12.51 mmol,645.16ul,1.60eq)。将混合物于0℃下搅拌1hr。tlc(石油醚:etoac=5:1,rf= 0.50)指示20b完全消耗。通过添加饱和na2so3(5ml)淬灭反应混合物。用h2o(20ml) 稀释残余物并用dcm(10ml
×
3)萃取。将合并的有机层用盐水(30ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生粗产物。通过硅胶管柱色谱(sio2,石油醚:乙酸乙酯=10:1)纯化残余物,从而得到黄色固体状20c。1h nmr(400mhz,cdcl
3-d)δ8.72(d, j=7.3hz,1h),4.49-4.34(m,1h),3.93(s,3h),1.29-1.27(m,6h)。
[0754]
5-氨基-3-溴-2-氟-4-(异丙基氨基)苯甲酸甲基酯(20d).向3-溴-2-氟-4-(异丙基氨基)-5
‑ꢀ
硝基苯甲酸甲基酯(20c,1g,2.98mmol,1eq)于etoh(20ml)中的溶液中添加fe(1.67g, 29.84mmol,10eq)和nh4cl(1.60g,29.84mmol,1.04ml,10eq)。将混合物于80℃下搅拌 6hr。tlc(石油醚:etoac=3:1)指示20c完全消耗。在减压下浓缩反应混合物。用h2o(20 ml)稀释残余物并用etoac(10ml
×
3)萃取。将合并的有机层用盐水(30ml)洗涤,经 na2so4干燥,过滤,并在减压下浓缩,从而产生粗产物。通过管柱色谱(sio2,石油醚/ 乙酸乙酯=10/1到1:1)纯化残余物。获得褐色油状化合物20d。1h nmr(400mhz,cdcl
3-d) δ7.21(d,j=6.8hz,1h),3.90(s,3h),3.80-3.71(m,1h),1.17(d,j=6.4hz,6h)。
[0755]
7-溴-6-氟-1-异丙基-1h-苯并[d]咪唑-5-甲酸甲基酯(20e).向5-氨基-3-溴-2-氟-4-(异丙基氨基)苯甲酸甲基酯(20d,180mg,0.590mmol,1eq)于ch(ome)3(2ml)中的溶液中添加p-tsoh(10.16mg,0.059mmol,0.1eq)。在100℃下将混合物搅拌1.5hr。tlc(石油醚: 乙酸乙酯=1:1)指示20d完全消耗。在减压下浓缩反应混合物。用h2o(20ml)稀释残余物并用ea(10ml
×
3)萃取。将合并的有机层用盐水(30ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生粗产物。通过制备型tlc(sio2,石油醚/乙酸乙酯=1:1)纯化残余物。获得白色固体状化合物20e。1h nmr(400mhz,cdcl
3-d)δ8.34(d,j=5.9hz, 1h),8.15(s,1h),5.64(quind,j=6.7,13.4hz,1h),3.97(s,3h),1.65(d,j=6.4hz,6h)。
[0756]
7-溴-6-氟-1-异丙基-1h-苯并[d]咪唑-5-甲酸(20f).向7-溴-6-氟-1-异丙基-1h-苯并[d] 咪唑-5-甲酸甲基酯(20e,140mg,0.444mmol,1eq)于thf(5ml)、meoh(5ml)和h2o(2 ml)中的溶液中添加lioh.h2o(46.60mg,1.11mmol,2.5eq)。在50℃下将混合物搅拌12 hr。tlc(石油醚:乙酸乙酯=1:1)指示20e完全消耗。用hcl水溶液(1m)将混合物调节到 ph=5且浓缩,从而产生白色固体状20f,其不经进一步纯化即用于下一步骤中。
[0757]
7-溴-n-(4-(氯二氟甲氧基)苯基)-6-氟-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(20g).向7
‑ꢀ
溴-6-氟-1-异丙基-1h-苯并[d]咪唑-5-甲酸(20f,70mg,0.232mmol,1eq)于dmf(2ml)中的溶液中添加hatu(106.07mg,0.279mmol,1.2eq)、4-[氯(二氟)甲氧基]苯胺(1h,49.50 mg,0.256mmol,1.1eq)和diea(90.13mg,0.697mmol,121.47ul,3eq)。在50℃下将混合物搅拌3hr。tlc(石油醚:乙酸乙酯=1:1)指示20f完全消耗。在减压下浓缩反应混合物。用h2o(10ml)稀释残余物并用etoac(10ml
×
3)萃取。将合并的有机层用盐水(10ml) 洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生粗产物。通过管柱色谱(sio2,石油醚/乙酸乙酯=10/1到1:1)纯化残余物。获得白色固体状化合物20g。1h nmr(400mhz, meod-d4)δ8.57(s,1h),8.01(d,j=6.4hz,1h),7.82(d,j=8.8hz,2h),7.30(d,j=9.3 hz,2h),5.70(td,j=6.7,13.6hz,1h),1.67(d,j=6.8hz,6h)。
[0758]
n-(4-(氯二氟甲氧基)苯基)-6-氟-1-异丙基-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺 (20).向7-溴-n-(4-(氯二氟甲氧基)苯基)-6-氟-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(20g,50 mg,0.105mmol,1eq)于二噁烷(2.5ml)和h2o(0.5ml)中的溶液中添加pd(dppf)cl2(7.68 mg,0.01mmol,0.1eq)、嘧啶-5-基硼酸(38.99mg,0.315mmol,3eq)和k3po4(66.80mg, 0.315mmol,3eq)。将混合物于100℃下搅拌6hr。lc-ms显示20g完全消耗且检测到具有所需ms的一个主峰。浓缩混合物,从而产生粗产物。通过制备型hplc(nh4hco3条件,管柱:沃特世x桥150*50 10u;移动相:[水(10mm nh4hco3)-meoh];b%:55%-75%,12 min)纯化残余物,从而得到白色固体状标题化合物20。[m h]
(c
22h17
clf3n5o2)计算的 ms质量要求
m/z 476.1,lcms实验值m/z 476.1;1h nmr(400mhz,cdcl
3-d)δ9.42(s, 1h),8.93(s,2h),8.74(d,j=7.3hz,1h),8.44(br d,j=15.7hz,1h),8.18(s,1h),7.72(d, j=8.8hz,2h),7.25(d,j=8.8hz,2h),3.96(td,j=6.8,13.3hz,1h),1.38(d,j=6.8hz, 6h)。
[0759]
实例21
[0760]
n-(4-(氯二氟甲氧基)苯基)-1-(2-(环丙基氨基)-2-氧代基乙基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺
[0761][0762]
7-溴-n-(4-(氯二氟甲氧基)苯基)-1-(2-(环丙基氨基)-2-氧代基乙基)-1h-苯并[d]咪唑
ꢀ‑
5-甲酰胺(21c).在n2下向7-溴-n-(4-(氯二氟甲氧基)苯基)-1h-苯并[d]咪唑-5-甲酰胺(以与2c类似的方式合成;21a,80mg,0.192mmol,1eq)和2-氯-n-环丙基乙酰胺(21b,30.78mg, 0.230mmol,1.2eq)于dmf(1ml)中的混合物中添加k2co3(18.58mg,0.134mmol,0.7 eq)。将混合物于80℃下搅拌4小时。tlc(乙酸乙酯:甲醇=10:1,rf=0.32)显示反应完成。将混合物倾倒到水(20ml)中,并且然后用etoac(20ml
×
3)萃取。将合并的有机层经无水na2so4干燥,过滤并在真空中浓缩,从而产生粗产物。通过制备型tlc(乙酸乙酯:甲醇=10:1,rf=0.32)纯化残余物,从而产生白色固体状21c。1h nmr(400mhz,meod-d4) δ8.21(d,j=6.2hz,2h),8.01(s,1h),7.74(d,j=8.9hz,2h),7.20(br d,j=8.9hz,2h), 5.19(s,2h),2.61(dt,j=3.7,7.5hz,1h),0.65(br d,j=5.1hz,2h),0.46(br d,j=2.4 hz,2h)。
[0763]
n-(4-(氯二氟甲氧基)苯基)-1-(2-(环丙基氨基)-2-氧代基乙基)-7-(嘧啶-5-基)-1h-苯并[d]咪唑-5-甲酰胺(21).向7-溴-n-(4-(氯二氟甲氧基)苯基)-1-(2-(环丙基氨基)-2-氧代基乙基)-1h-苯并[d]咪唑-5-甲酰胺(21c,10mg,0.019mmol,1eq)和嘧啶-5-基硼酸(21d,4.82 mg,0.039mmol,2eq)于二噁烷(2ml)和h2o(0.4ml)中的溶液中添加pd(dppf)cl2(1.42 mg,1.95umol,0.1eq)和k3po4(12.40mg,0.058mmol,3eq)。将反应混合物于100℃下搅拌6hr。lcms显示检测到具有所需ms的峰。浓缩反应混合物,将残余物溶解于etoac(5 ml)中且用h2o(2ml)和盐水(5ml)洗涤。浓缩有机层且通过制备型tlc(etoac:meoh =5:1)纯化,从而得到白色固体状标题化合物21。[m h]
(c
24h19
clf2n6o3)计算的ms质量要求m/z 513.1,lcms实验值m/z 513.1。1h nmr(400mhz,meod-d4)δ8.91(s,1h), 8.54(s,2h),8.08(d,j=1.5hz,1h),7.91(s,1h),7.50-7.41(m,3h),6.92(d,j=9.0hz, 2h),4.32(s,2h),2.05(tt,j=3.9,7.2hz,1h),0.31-0.21(m,2h),0.01-0.00(m,2h)。
[0764]
实例22(一般程序i)
[0765]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(噻唑-4-基)-1h-苯并[d]咪唑-5-甲酰
胺
[0766]
标题化合物是使用与示意方案9中所概述类似的偶合反应来制备。所述一般程序i例示示意方案9且提供如应用于标题化合物的特定合成细节。
[0767][0768]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(噻唑-4-基)-1h-苯并[d]咪唑-5-甲酰胺(22).向微波管中添加二噁烷(4ml)中的7-溴-n-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(10a,100mg,0.218mmol,1eq)、三丁基(噻唑-4-基)锡烷(22b,97.89mg,0.262 mmol,1.2eq)和pd(pph3)4(25.19mg,0.022mmol,0.1eq)。在微波辐照下将密封管加热到 150℃并保持3hr。向反应混合物中添加水(5ml),并且用etoac(10ml
×
2)萃取。浓缩合并的有机层,并且通过制备型hplc(tfa条件,管柱:卢纳c18 100*30 5u;移动相: [水(0.1%tfa)-acn];b%:15%-50%,10min)纯化粗制残余物,从而得到黄色固体状标题化合物22。[m 1]
(c
21h17
clf2n4o2s)计算的ms质量要求m/z 463.1,lcms实验值m/z 463.0。1h nmr(400mhz,cdcl
3-d)δ8.95-8.91(m,1h),8.86(d,j=1.6hz,1h),8.40(s, 1h),8.03(s,1h),7.84(s,1h),7.74(br d,j=8.8hz,2h),7.50(d,j=1.6hz,1h), 7.24-7.15(m,2h),4.53(td,j=6.6,13.3hz,1h),1.26(d,j=6.6hz,6h)。
[0769]
实例23
[0770]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(4h-1,2,4-三唑-4-基)-1h-苯并[d]咪唑-5-甲酰胺
[0771][0772]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-((4-甲氧基苄基)氨基)-1h-苯并[d]咪唑-5-甲酰胺(23b).向7-溴-n-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(10a, 900mg,1.96mmol)于dme(15ml)中的混合物中添加pmbnh2(323.00mg,2.35mmol, 304.71ul)、naobu-t(565.70mg,5.89mmol)、xphos(93.54mg,0.196mmol)和pd2(dba)
3 (179.68mg,0.196mmol)。在100℃下在n2气氛下将混合物搅拌12hr。lcms显示检测到具有所需ms的峰。在减压下浓缩反应混合物。用水(5ml)稀释残余物且用etoac(5ml
×ꢀ
3)萃取。用盐水(5ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过硅胶色谱(石油醚/乙酸乙酯=3/1,1/3)纯化残余物,从而得到黄色固体状23b。 [m 1]
(c
26h25
clf2n4o3)计算的ms质量要求m/z 515.2,lcms实验值m/z 515.2。1h nmr (400mhz,dmso-d6)δ10.24(s,
1h),8.38-8.36(m,1h),7.93-7.89(m,2h),7.78(d,j=1.2 hz,1h),7.38(d,j=8.6hz,2h),7.33(br d,j=9.0hz,2h),7.04(s,1h),6.91(d,j=8.7 hz,2h),6.01-5.94(m,1h),5.32-5.23(m,1h),4.40(br d,j=5.3hz,2h),3.72(s,3h),1.57 (d,j=6.5hz,6h)。
[0773]
7-氨基-n-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(23c).将 n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-((4-甲氧基苄基)氨基)-1h-苯并[d]咪唑-5-甲酰胺 (23b,100mg,0.194mmol)于hcl/二噁烷(40ml)中的溶液于20℃下搅拌12hr。lcms显示检测到所需ms。在减压下浓缩反应混合物。通过制备型hplc(nh4hco3条件,管柱:艾吉亚
·
达什内尔c18 150*25 5u;移动相:[水(10mm nh4hco3)-acn];b%:35%-65%,10 min)纯化混合物,从而产生黄色固体状23c。[m 1]
(c
18h17
clf2n4o2)计算的ms质量要求 m/z 395.1,lcms实验值m/z 395.1。1h nmr(400mhz,meod-d4)δ8.34(br s,1h),7.82(d, j=9.0hz,2h),7.69(d,j=1.6hz,1h),7.29(d,j=9.2hz,2h),7.23(d,j=1.6hz,1h), 5.25-5.12(m,1h),1.66(d,j=6.7hz,6h)。
[0774]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(4h-1,2,4-三唑-4-基)-1h-苯并[d]咪唑-5-甲酰胺(23).向7-氨基-n-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(23c,14 mg,0.035mmol)和n-甲酰胺基甲酰胺(9.37mg,0.106mmol)于吡啶(1.5ml)中的溶液中添加氯-三甲基-硅烷(57.79mg,0.532mmol,67.51ul)和tea(25.12mg,0.248mmol,34.55 ul)。将混合物于100℃下搅拌18hr。lcms显示23c完全消耗且检测到具有所需质量的一个主峰。在减压下浓缩反应混合物。通过制备型hplc(管柱:沃特世亚特兰蒂斯t3 150*30*5um;移动相:[水(0.225%fa)-acn];b%:20%-60%,13min)纯化残余物,从而得到白色固体状标题化合物23。[m 1]
(c
20h17
clf2n6o2)计算的ms质量要求m/z447.1,lcms实验值m/z 447.1。1h nmr(400mhz,cdcl
3-d)δ8.50-8.45(m,3h),8.23(s, 2h),7.91(d,j=1.0hz,1h),7.75(d,j=8.8hz,2h),7.29(br d,j=9.3hz,2h),3.74-3.61 (m,1h),1.45(d,j=6.4hz,6h)。
[0775]
实例24(一般程序j)
[0776]
(s)-n-(4-(氯二氟甲氧基)苯基)-1-(5-氧代基吡咯烷-3-基)-7-(嘧啶-5-基)-1h-苯并[d] 咪唑-5-甲酰胺
[0777]
所述一般程序j提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂来制备。
[0778][0779]
3-溴-4-氟-5-硝基苯甲酸(24b).向4-氟-3-硝基苯甲酸(24a,5g,27.01mmol)于h2so
4 (30ml)中的溶液中添加nbs(5.77g,32.41mmol)。将混合物于60℃下搅拌6hr。在剧烈搅拌下将混合物逐滴添加到冰水(2l)中。过滤沉淀,从而得到白色固体状24b。1h nmr (400mhz,cdcl
3-d)δ8.72(dd,j=2.2,6.4hz,1h),8.58(dd,j=2.2,5.5hz,1h)。
[0780]
3-溴-n-(4-(氯二氟甲氧基)苯基)-4-氟-5-硝基苯甲酰胺(24c).将3-溴-4-氟-5-硝基苯甲酸(24b,150mg,0.568mmol)于socl2(2ml)中的悬浮液于60℃下搅拌3小时。浓缩混合物以获得白色固体状3-溴-4-氟-5-硝基-苯甲酰氯(214mg,粗制)。在n2下向4-(氯二氟甲氧基)苯胺(1h,146.64mg,0.758mmol)和吡啶(89.89mg,1.13mmol,91.72ul)于thf(2ml) 中的混合物中添加3-溴-4-氟-5-硝基-苯甲酰氯(213.97mg,0.758mmol)。将混合物于20℃下搅拌3小时。lcms显示所需ms。用乙酸乙酯(2ml
×
3)萃取混合物,将合并的有机层用盐水(5ml
×
2)洗涤,经无水na2so4干燥,过滤且在真空中浓缩。通过制备型tlc(sio2, 石油醚:乙酸乙酯=1:1,rf=0.3)纯化残余物。获得白色固体状化合物24c。
[0781]
(s)-3-溴-n-(4-(氯二氟甲氧基)苯基)-5-硝基-4-((5-氧代基吡咯烷-3-基)氨基)苯甲酰胺 (24e).向3-溴-n-(4-(氯二氟甲氧基)苯基)-4-氟-5-硝基苯甲酰胺(24c,100mg,0.228mmol) 和(4s)-4-氨基吡咯烷-2-酮(24d,22.78mg,0.228mmol)于etoh(2ml)中的混合物中添加 tea(69.06mg,0.682mmol,94.99ul)。将混合物于50℃下搅拌3h。lcms显示所需ms。浓缩混合物且通过制备型tlc(sio2,石油醚:乙酸乙酯=3:1,rf=0.1)纯化,从而得到黄色固体状24e。1h nmr(400mhz,meod-d4)δ8.62(d,j=2.2hz,1h),8.45(d,j=2.2hz, 1h),7.84-7.80(m,2h),7.30(d,j=8.8hz,2h),4.64(br s,1h),3.80(dd,j=6.8,10.7hz, 1h),3.39(dd,j=4.2,10.7hz,1h),2.80(dd,j=7.9,17.1hz,1h),2.41(dd,j=4.8,17.1 hz,1h)。
[0782]
(s)-3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-((5-氧代基吡咯烷-3-基)氨基)苯甲酰胺 (24f).于20℃下在n2下向(s)-3-溴-n-(4-(氯二氟甲氧基)苯基)-5-硝基-4-((5-氧代基吡咯烷-3-基)氨基)苯甲酰胺(24e,0.053g,0.102mmol)于acoh(1ml)中的混合物中一次性添加 fe(56.95mg,1.02mmol),并且将混合物于35℃下搅拌2小时。lcms显示所需ms。将混合物倾倒到饱和nahco3中且用乙酸乙酯(5ml
×
2)萃取。将合并的有机层用盐水(5ml
×ꢀ
2)洗涤,经无水na2so4干燥,过滤且在真空中浓缩,从而产生黄色固体状24f。
[0783]
(s)-7-溴-n-(4-(氯二氟甲氧基)苯基)-1-(5-氧代基吡咯烷-3-基)-1h-苯并[d]咪唑-5-甲酰胺(24g).于20℃下在n2下向(s)-3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-((5-氧代基吡咯烷-3-基)氨基)苯甲酰胺(24f,0.0358g,73.11mmol)于ch(ome)3(2ml)中的混合物中一次性添加tsoh(1.26mg,7.31umol),并且将混合物于20℃下搅拌30min。lcms显示所需ms。用乙酸乙酯(3ml
×
2)萃取混合物,将合并的有机层用盐水(5ml
×
2)洗涤,经无水na2so4干燥,过滤且在真空中浓缩,以获得黄色固体状24g。
[0784]
(s)-n-(4-(氯二氟甲氧基)苯基)-1-(5-氧代基吡咯烷-3-基)-7-(嘧啶-5-基)-1h-苯并[d] 咪唑-5-甲酰胺(24).在n2下向(s)-7-溴-n-(4-(氯二氟甲氧基)苯基)-1-(5-氧代基吡咯烷-3
‑ꢀ
基)-1h-苯并[d]咪唑-5-甲酰胺(24g,35.3mg,0.071mmol)和嘧啶-5-基硼酸(17.51mg, 0.141mmol)于h2o(0.1ml)和二噁烷(1ml)中的混合物中一次性添加pd(dppf)cl2(5.17 mg,7.06umol)、k3po4(29.99mg,0.141mmol)。在100℃下将混合物搅拌12小时。lcms 显示所需ms。用乙酸乙酯(3ml
×
3)萃取混合物,将合并的有机层用盐水(5ml
×
2)洗涤,经无水na2so4干燥,过滤且在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯= 1:5,rf=0.1)纯化残余物,从而得到褐色固体状标题化合物24。[m 1] (c
23h17
clf2n6o3) 计算的ms质量要求m/z 499.1,lcms实验值m/z 499.1。1h nmr(400mhz,dmso-d6)δ 9.39(s,1h),8.90(br s,2h),8.49(s,1h),8.40(s,1h),8.10(s,1h),7.83(s,1h),7.78(s, 1h),7.28(br s,2h),6.12(br s,1h),4.69(br s,1h),3.65(dd,j=6.5,11.1hz,1h),3.51(brd,j=11.7hz,1h),2.82-2.60(m,2h)。
[0785]
实例25
[0786]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(5-氧代基-4,5-二氢-1,2,4-噁二唑-3-基)-1h
‑ꢀ
苯并[d]咪唑-5-甲酰胺
[0787][0788]
n-(4-(氯二氟甲氧基)苯基)-7-氰基-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(25b).将7-溴
ꢀ‑
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(10a,0.15g,0.327 mmol)、zn(cn)2(57.60mg,0.491mmol,31.14ul)和pd(pph3)4(18.89mg,0.016mmol)于 dmf(3ml)中的溶液放入微波管中。将密封的管于150℃下在微波辐照下加热2h。lcms 显示所需ms。用乙酸乙酯(2ml
×
3)萃取混合物,将合并的有机层用盐水(5ml
×
2)洗涤,经无水na2so4干燥,过滤且在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯= 0:1,rf=0.67)纯化残余物,从而得到白色固体状1b。1h nmr(400mhz,cdcl
3-d)δ8.52 (s,1h),8.30-8.21(m,2h),8.09(s,1h),7.73(d,j=8.8hz,2h),7.28(d,j=8.6hz,2h), 5.32(spt,j=6.7hz,1h),1.72(d,j=6.6hz,6h)。
[0789]
(z)-n-(4-(氯二氟甲氧基)苯基)-7-(n'-羟基亚氨甲酰基)-1-异丙基-1h-苯并[d]咪唑-5
‑ꢀ
甲酰胺(25c).向n-(4-(氯二氟甲氧基)苯基)-7-氰基-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(25b,20mg,0.049mmol)于dmf(3ml)中的溶液中添加nh2oh.hcl(34.33mg,0.494 mmol)和tea(49.99mg,0.49mmol,68.76ul)。将混合物于75℃下搅拌12小时。lcms显示所需ms。用乙酸乙酯(5ml
×
3)萃取水相。用盐水(10ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1, rf=0.5)纯化残余物,从而得到白色固体状25c。[m 1]
(c
19h18
clf2n5o3)计算的ms质量要求m/z 438.1,lcms实验值m/z 438.3。
[0790]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(5-氧代基-4,5-二氢-1,2,4-噁二唑-3-基)-1h
‑ꢀ
苯并[d]咪唑-5-甲酰胺(25).在n2下向(z)-n-(4-(氯二氟甲氧基)苯基)-7-(n'-羟基亚氨甲酰基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(25c,0.02g,0.046mmol)于thf(2ml)中的溶液中添加碳酸双(2,5-二氧代基吡咯烷-1-基)酯(15.21mg,0.059mmol)和tea(9.24mg,0.091 mmol,12.72ul)。在60℃下将混合物搅拌12小时。lcms显示所需ms。用乙酸乙酯(3ml
ꢀ×
3)萃取水相,将合并的有机层用盐水(5ml
×
2)洗涤,经无水na2so4干燥,过滤且在真空中浓缩。通过制备型tlc(sio2,乙酸乙酯:甲醇=10:1,rf=0.1)纯化残余物,从而产生黄色固体状标题化合物25。[m 1]
(c
20h16
clf2n5o4)计算的ms质量要求m/z 464.1, lcms实验值m/z 464.1;1h nmr(400mhz,meod-d4)δ8.55(s,1h),8.43(d,j=1.6hz, 1h),8.09(d,j=1.6hz,1h),7.85(d,j=9.0hz,2h),7.29(d,j=8.9hz,2h),5.25(td,j= 6.6,13.3hz,1h),1.53(d,j=6.7hz,6h)。
[0791]
实例26
[0792]n5-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5,7-二甲酰胺
[0793][0794]n5-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5,7-二甲酰胺(26).向n-(4-(氯二氟甲氧基)苯基)-7-氰基-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(25b,30mg,0.074mmol) 于dmso(3ml)中的溶液中添加nh2oh.hcl(41.20mg,0.593mmol)和tea(13.86mg, 0.137mmol)。将混合物于80℃下搅拌12小时。lcms显示所需ms。用乙酸乙酯(5ml
×
3) 萃取水相。用盐水(10ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1,rf=0.5)纯化残余物,从而得到白色固体状标题化合物26。[m 1]
(c
19h17
clf2n4o3)计算的ms质量要求m/z 423.1,lcms 实验值m/z 423.0。1h nmr(400mhz,dmso-d6)δ10.48(s,1h),8.62(s,1h),8.48(d,j=1.6hz,1h),8.27(s,1h),7.98(d,j=1.7hz,1h),7.97-7.94(m,2h),7.78(s,1h),7.37(d,j =9.0hz,2h),5.09(quin,j=6.6hz,1h),1.52(s,3h),1.50(s,3h)。
[0795]
实例27
[0796]
n-(4-(氯二氟甲氧基)苯基)-3-异丙基-4-(嘧啶-5-基)-3h-咪唑并[4,5-c]吡啶-6-甲酰胺
[0797][0798]
4-氯-3-异丙基-3h-咪唑并[4,5-c]吡啶-6-甲酸甲基酯(27b).向4-氯-3h-咪唑并[4,5-c] 吡啶-6-甲酸甲基酯(27a,200mg,0.945mmol)和2-碘丙烷(482.01mg,2.84mmol,283.53 ul)于dmf(3ml)中的溶液中添加k2co3(391.88mg,2.84mmol)。将混合物于30℃下搅拌16hr。lcms显示27a完全消耗且检测到所需ms。将混合物用水(5ml)稀释且用etoac (5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc(sio2,石油醚:乙酸乙酯=1:2)纯化残余物,从而得到白色固体状27c。1h nmr(400mhz,cdcl
3-d)δ8.54(s,1h),8.30(s,1h), 5.60-5.42(m,1h),4.04(s,3h),1.70(d,j=6.7hz,6h)。
[0799]
3-异丙基-4-(嘧啶-5-基)-3h-咪唑并[4,5-c]吡啶-6-甲酸甲基酯(27c).向4-氯-3-异丙基
ꢀ‑
3h-咪唑并[4,5-c]吡啶-6-甲酸甲基酯(27b,70mg,0.276mmol)和嘧啶-5-基硼酸(68.38 mg,0.552mmol)于二噁烷(1ml)和h2o(0.1ml)中的溶液中添加pd(dppf)cl2(20.19mg, 27.59umol)和k3po4(175.71mg,0.828mmol)。将混合物在110℃下在n2下搅拌16hr。 lcms显示27b完全消耗且检测到所需ms。将混合物用水(5ml)稀释且用etoac(5ml
×ꢀ
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc(sio2,乙酸乙酯:甲醇=10:1)纯化残余物,从而得到白色固体状27c。1h nmr(400mhz,meod-d4)δ9.36(s,1h),9.13(s,2h),8.82(s,1h), 8.56(s,1h),4.36-4.23(m,1h),4.01(s,3h),1.45(d,j=6.6hz,6h)。
[0800]
3-异丙基-4-(嘧啶-5-基)-3h-咪唑并[4,5-c]吡啶-6-甲酸(27d).向3-异丙基-4-(嘧啶-5
‑ꢀ
基)-3h-咪唑并[4,5-c]吡啶-6-甲酸甲基酯(27c,35mg,0.118mmol)于thf(0.5ml)、meoh (0.5ml)和h2o(0.25ml)中的溶液中添加lioh.h2o(9.88mg,0.235mmol)。在20℃下将混合物搅拌2hr。tlc(乙酸乙酯:甲醇=10:1,rf=0.0)显示27c完全消耗且检测到具有更大极性的一个新的主斑点。在真空中浓缩混合物。然后将混合物添加到h2o(3ml)中且将水相用hcl水溶液酸化到ph=5。在真空中浓缩混合物。产物未经进一步纯化即用于下一步骤中。获得白色固体状化合物27d。1h nmr(400mhz,meod-d4)δ9.69(s,1h), 9.46(s,1h),9.22(s,2h),8.80-8.67(m,1h),4.42(s,1h),1.50(d,j=6.6hz,6h)。
[0801]
n-(4-(氯二氟甲氧基)苯基)-3-异丙基-4-(嘧啶-5-基)-3h-咪唑并[4,5-c]吡啶-6-甲酰胺 (27).向3-异丙基-4-(嘧啶-5-基)-3h-咪唑并[4,5-c]吡啶-6-甲酸(27d,32mg,0.113mmol)和 1h(32.80mg,0.169mmol)于dmf(2ml)中的溶液中添加diea(43.80mg,0.339mmol, 59.03ul)和hatu(51.54mg,0.136mmol)。在25℃下将混合物搅拌4hr。lcms显示27d 完全消耗且检测到所需ms。将混合物用水(5ml)稀释且用etoac(5ml
×
3)萃取。将合并
的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1)纯化残余物,从而得到白色固体状 27。[m h]
(c
21h17
o2n6clf2)计算的ms质量要求m/z 459.1,lcms实验值m/z 459.0。1hnmr(400mhz,dmso-d6)δ10.61(s,1h),9.42(s,1h),9.30(s,2h),8.94(s,1h),8.50(s, 1h),8.05-7.95(m,2h),7.37(d,j=9.0hz,2h),4.38-4.09(m,1h),1.38(d,j=6.7hz,6h)。
[0802]
实例28(一般程序k)
[0803]
(r)-n-(4-(氯二氟甲氧基)苯基)-2-(二氟甲基)-1-(1-氟丙-2-基)-7-(1h-吡唑-5-基)-1h
‑ꢀ
苯并[d]咪唑-5-甲酰胺
[0804]
所述一般程序k提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂来制备。
[0805][0806]
n-(4-(氯二氟甲氧基)苯基)-2-(二氟甲基)-1-((r)-1-氟丙-2-基)-7-(1-(四氢-2h-吡喃-2
‑ꢀ
基)-1h-吡唑-5-基)-1h-苯并[d]咪唑-5-甲酰胺(28b).向(r)-7-溴-n-(4-(氯二氟甲氧基)苯基)-2-(二氟甲基)-1-(1-氟丙-2-基)-1h-苯并[d]咪唑-5-甲酰胺(以与15g类似的方式合成; 28a,30mg,0.057mmol)和1-四氢吡喃-2-基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2
‑ꢀ
基)吡唑(63.38mg,0.228mmol)于dme(1.5ml)、etoh(1.5ml)和h2o(0.3ml)中的溶液中添加pd(pph3)2cl2(4.00mg,5.70umol)、na2co3(12.07mg,0.114mmol)。在80℃下将混合物搅拌2hr。lcms显示28a完全消耗且检测到所需ms。将混合物用水(5ml)稀释且用etoac(5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc(sio2,石油醚:乙酸乙酯=2:1)纯化残余物,从而得到黄色固体状28b。
[0807]
(r)-n-(4-(氯二氟甲氧基)苯基)-2-(二氟甲基)-1-(1-氟丙-2-基)-7-(1h-吡唑-5-基)-1h
‑ꢀ
苯并[d]咪唑-5-甲酰胺(28).向n-(4-(氯二氟甲氧基)苯基)-2-(二氟甲基)-1-((r)-1-氟丙-2
‑ꢀ
基)-7-(1-(四氢-2h-吡喃-2-基)-1h-吡唑-5-基)-1h-苯并[d]咪唑-5-甲酰胺(28b,25mg,0.042 mmol)于dcm(1ml)中的溶液中添加tfa(1.54g,13.51mmol,1ml)。将混合物于20℃下搅拌1hr。lcms显示28b完全消耗且检测到所需ms。将混合物用水(5ml)稀释且用etoac (5ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc(sio2,石油醚:乙酸乙酯=1:1)纯化残余物,从
而得到白色固体状28。[m h]
(c
22h17
o2n5clf5)计算的ms质量要求m/z 514.1,lcms 实验值m/z 514.1。1h nmr(400mhz,meod-d4)δ8.47(d,j=1.3hz,1h),7.98(d,j=1.7 hz,1h),7.88(br s,1h),7.87-7.81(m,2h),7.44-7.15(m,3h),6.66(d,j=2.2hz,1h), 4.70-4.67(m,1h),4.63-4.45(m,2h),1.52(br d,j=7.2hz,3h)。
[0808]
实例29
[0809]
n-(4-(氯二氟甲氧基)苯基)-6-(嘧啶-5-基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4] 噻嗪-8-甲酰胺2,2-二氧化物
[0810][0811]
6-溴-n-(4-(氯二氟甲氧基)苯基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噻嗪-8-甲酰胺2,2-二氧化物(29b).向6-溴-n-(4-(氯二氟甲氧基)苯基)-3,4-二氢-1h-苯并[4,5]咪唑并 [2,1-c][1,4]噻嗪-8-甲酰胺(以与8g类似的方式合成;29a,2mg,4.09umol)于丙酮(0.5ml) 和h2o(0.1ml)中的溶液中添加过硫酸氢钾复合盐(5.03mg,8.18umol)。在20℃下将混合物搅拌24hr。tlc(石油醚:乙酸乙酯=0:1,rf=0.77)指示29a完全消耗且检测到具有更大极性的一个新的主斑点。将反应物通过硫化钠淬灭。在减压下浓缩反应混合物以去除丙酮。用h2o(10ml)稀释残余物并用etoac(10ml
×
3)萃取。将合并的有机层用盐水(10 ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc (sio2,石油醚:乙酸乙酯=0:1)纯化残余物,从而得到褐色固体状29b。1h nmr(400 mhz,meod-d4)δ8.18(d,j=1.5hz,1h),8.05(d,j=1.5hz,1h),7.73(d,j=8.8hz,2h), 7.20(br d,j=8.8hz,2h),5.17-5.12(m,2h),5.08(s,2h),3.81-3.75(m,2h)。
[0812]
n-(4-(氯二氟甲氧基)苯基)-6-(嘧啶-5-基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4] 噻嗪-8-甲酰胺2,2-二氧化物(29).将6-溴-n-(4-(氯二氟甲氧基)苯基)-3,4-二氢-1h-苯并 [4,5]咪唑并[2,1-c][1,4]噻嗪-8-甲酰胺2,2-二氧化物(29b,6mg,0.012mmol)、嘧啶-5-基硼酸(4.28mg,0.035mmol)、pd(dppf)cl2(843.09ug,1.15umol)、k3po4(7.34mg,0.035 mmol)于二噁烷(1ml)和h2o(0.1ml)中的混合物脱气且用n2吹扫三次,并且然后在n2气氛下于110℃下将混合物搅拌16hr。tlc(石油醚:乙酸乙酯=0:1,rf=0.3)指示29b完全消耗且检测到具有更大极性的一个新的主斑点。在减压下浓缩反应混合物以去除二噁烷。用h2o(1ml)稀释残余物并用乙酸乙酯(1ml
×
3)萃取。将合并的有机层用盐水(1 ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,从而产生残余物。通过制备型tlc(石油醚:乙酸乙酯=0:1)纯化残余物,从而得到白色固体状29。1h nmr(400mhz, dmso-d6)δ10.49(s,1h),9.33(s,1h),9.09(s,2h),8.45(d,j=1.0hz,1h),7.91(d,j=9.3hz,2h),7.83(d,j
=1.5hz,1h),7.36(d,j=8.8hz,2h),5.09(s,2h),4.12(br t,j=5.9 hz,2h),3.75(br t,j=5.6hz,2h)。
[0813]
实例30(一般程序l)
[0814]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(1h-1,2,3-三唑-5-基)-1h-苯并[d]咪唑-5-甲酰胺
[0815]
所述一般程序l提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂和/或去保护试剂来制备。
[0816][0817]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-((三甲基硅基)乙炔基)-1h-苯并[d]咪唑-5-甲酰胺(30a).在n2下向7-溴-n-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺 (10a,80mg,0.174mmol)和乙炔基(三甲基)硅烷(85.65mg,0.872mmol,120.81ul)于tea (1ml)中的混合物中添加cui(3.32mg,0.017mmol)、pd(pph3)2cl2(12.24mg,0.017 mmol),将混合物于80℃下搅拌2小时。lcms显示所需ms。向反应混合物中添加水且用乙酸乙酯(5ml
×
3)萃取混合物。用盐水(10ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯=1:1,rf=0.4) 纯化残余物,从而产生白色固体状30a。1h nmr(400mhz,cdcl
3-d)δ8.31(s,1h),8.15 (br d,j=7.2hz,2h),8.00(s,1h),7.75(br d,j=8.9hz,2h),7.30-7.27(m,2h),5.65(td,j =6.8,13.4hz,1h),1.66(d,j=6.7hz,6h),0.31(s,9h)。
[0818]
n-(4-(氯二氟甲氧基)苯基)-7-乙炔基-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(30b).向 n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-((三甲基硅基)乙炔基)-1h-苯并[d]咪唑-5-甲酰胺 (30a,70mg,0.147mmol)于meoh(2ml)中的混合物中添加k2co3(40.65mg,0.294 mmol,2eq)。在20℃下将混合物搅拌0.5小时。tlc(石油醚:乙酸乙酯=1:1,rf=0.5)指示30a消耗,并且检测到具有更大极性的一个新的主斑点。浓缩混合物且用乙酸乙酯(5 ml
×
3)萃取。用盐水(10ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1,rf=0.5)纯化残余物,从而产生黄色固体状30b。1h nmr(400mhz,cdcl
3-d)δ8.33(d,j=1.6hz,1h),8.22-8.13(m, 2h),8.06(d,j=1.5hz,1h),7.78-7.72(m,2h),7.29(s,2h),5.68-5.49(m,1h),3.44(s, 1h),1.66(d,j=6.7hz,6h)。
[0819]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(1-(4-甲氧基苄基)-1h-1,2,3-三唑-4-基)-1h
‑ꢀ
苯并[d]咪唑-5-甲酰胺(30c).在n2下向n-(4-(氯二氟甲氧基)苯基)-7-乙炔基-1-异丙基-1h
‑ꢀ
苯并[d]咪唑-5-甲酰胺(30b,50mg,0.124mmol)和1-(叠氮基甲基)-4-甲
氧基-苯(22.23mg, 0.136mmol)于thf(1ml)、h2o(1ml)中的混合物中添加cuso4.5h2o(1.55mg,6.19 umol)和(2r)-2-[(1s)-1,2-二羟基乙基]-4-羟基-5-氧代基-2h-呋喃-3-醇酸钠(2.45mg,0.012 mmol)。将混合物于20℃下搅拌3小时。lcms显示所需ms。用乙酸乙酯(3ml
×
3)萃取混合物。用盐水(5ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1,rf=0.4)纯化残余物,从而产生黄色固体状30c。1h nmr(400mhz,cdcl
3-d)δ8.28(s,1h),8.20(s,1h),8.09(br s,1h), 7.79-7.66(m,4h),7.32(br d,j=8.4hz,2h),7.26-7.25(m,1h),6.95(d,j=8.4hz,2h), 5.59(s,2h),5.11-5.02(m,1h),3.84(s,3h),1.36(d,j=6.7hz,6h)。
[0820]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(1h-1,2,3-三唑-5-基)-1h-苯并[d]咪唑-5-甲酰胺(30).将n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(1-(4-甲氧基苄基)-1h-1,2,3-三唑-4
‑ꢀ
基)-1h-苯并[d]咪唑-5-甲酰胺(30c,40mg,0.071mmol)于tfa(3ml)中的混合物于60℃下搅拌12小时。lcms显示所需ms。浓缩混合物且用乙酸乙酯(5ml
×
3)萃取。用盐水(10 ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc (sio2,石油醚:乙酸乙酯=0:1,rf=0.3)纯化残余物,从而产生灰白色固体状30。[m 1]
(c
20h17
clf2n6o2)计算的ms质量要求m/z 447.1,lcms实验值m/z 447.0;1h nmr(400 mhz,dmso-d6)δ10.47(s,1h),8.62(s,1h),8.48(d,j=1.3hz,1h),8.31(br s,1h),7.95 (d,j=9.0hz,2h),7.85(d,j=1.3hz,1h),7.36(d,j=9.0hz,2h),4.63(br s,1h),1.32(d, j=6.6hz,6h)。
[0821]
实例31(一般程序m)
[0822]
n-(4-(氯二氟甲氧基)苯基)-7-(4-氰基-1h-吡唑-3-基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺
[0823]
所述一般程序m提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂和/或去保护试剂来制备。
[0824][0825]
n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(三甲基锡烷基)-1h-苯并[d]咪唑-5-甲酰胺 (31a).在n2下向7-溴-n-(4-(氯二氟甲氧基)苯基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(10a, 94.7mg,0.206mmol)和三甲基(三甲基锡烷基)锡烷(270.57mg,0.826mmol,171.25ul)于甲苯(3ml)中的混合物中添加pd(pph3)4(23.86mg,0.021mmol)。在130℃下将混合物搅拌12小时。lcms显示所需ms。向反应混合物中添加水且用乙酸乙酯(5ml
×
2)萃取混合物。用盐水(10ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯=1:1,rf=0.4)纯化残余物,从而产生无色油状31a。
[0826]
n-(4-(氯二氟甲氧基)苯基)-7-(4-氰基-1-((2-(三甲基硅基)乙氧基)甲基)-1h-吡唑-3
‑ꢀ
基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(31b).在n2下向n-(4-(氯二氟甲氧基)苯基)-1-异丙基-7-(三甲基锡烷基)-1h-苯并[d]咪唑-5-甲酰胺(31a,50mg,0.92mmol)和3-碘-1-(2-三甲基硅基乙氧基甲基)吡唑-4-甲腈(64.37mg,0.184mmol)于dmso(3ml)中的混合物中添加pd(pph3)4(10.65mg,9.22umol)。在100℃下将混合物搅拌12小时。lcms显示所需ms。过滤混合物且用乙酸乙酯(3ml
×
3)和水萃取。用盐水(5ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯= 0:1,rf=0.6)纯化残余物,从而得到黄色油状31b。[m 1]
(c
28h31
clf2n6o3si)计算的ms 质量要求m/z 601.2,lcms实验值m/z 601.2。
[0827]
n-(4-(氯二氟甲氧基)苯基)-7-(4-氰基-1h-吡唑-3-基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(31).将n-(4-(氯二氟甲氧基)苯基)-7-(4-氰基-1-((2-(三甲基硅基)乙氧基)甲基)-1h-吡唑-3-基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(31b,20mg,33.27mmol)于tfa(0.5ml)和 dcm(0.5ml)中的混合物于20℃下搅拌2小时。lcms显示所需ms。在减压下浓缩混合物。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1,rf=0.4)纯化残余物,从而产生黄色固体状31。[m 1]
(c
22h17
clf2n6o2)计算的ms质量要求m/z 471.1,lcms实验值m/z 471.0;1h nmr(400mhz,dmso-d6)δ14.16(br s,1h),10.52(s,1h),8.90-8.78(m,1h), 8.68(br s,1h),8.59(br s,1h),7.96(d,j=9.0hz,2h),7.91(s,1h),7.37(br d,j=8.8hz, 2h),4.39(br s,1h),1.36(br d,j=6.7hz,6h)。
[0828]
实例32
[0829]
(r)-n
8-(4-(氯二氟甲氧基)苯基)-n6,4-二甲基-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-6,8-二甲酰胺
[0830][0831]
(r)-8-((4-(氯二氟甲氧基)苯基)氨甲酰基)-4-甲基-3,4-二氢-1h-苯并[4,5]咪唑并 [2,1-c][1,4]噁嗪-6-甲酸甲基酯(32b).在n2下向(r)-6-溴-n-(4-(氯二氟甲氧基)苯基)-4-甲基-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(以与8g类似的方式合成;32a,50 mg,0.103mmol)于meoh(1ml)和dmf(3ml)中的溶液中添加pd(dppf)cl2(15.03mg, 0.021mmol)、tea(51.98mg,0.514mmol,71.50ul)、pd(oac)2(4.61mg,0.021mmol)、 xantphos(11.89mg,0.021mmol)、pph3(5.39mg,0.021mmol)和dppp(8.47mg,0.021 mmol)。将悬浮液在真空下脱气并用co吹扫若干次。将混合物在co(2mpa)下于120℃下搅拌12小时。lcms显示检测到所需ms。在减压下浓缩反应混合物。将残余物用h2o(10 ml)
稀释,并且用etoac(10ml
×
3)萃取混合物。将合并的有机层用盐水(10ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc(sio2,乙酸乙酯:石油醚=3:1,rf=0.3)纯化残余物,从而得到褐色固体状标题化合物32b。1h nmr (400mhz,meod-d4)δ8.53-8.42(m,2h),7.88-7.81(m,2h),7.30(d,j=9.0hz,2h),5.41 (br dd,j=1.8,6.5hz,1h),5.18-4.95(m,2h),4.24-4.18(m,1h),4.12-4.08(m,1h),4.04(s, 3h),1.40(d,j=6.5hz,3h)。
[0832]
(r)-8-((4-(氯二氟甲氧基)苯基)氨甲酰基)-4-甲基-3,4-二氢-1h-苯并[4,5]咪唑并 [2,1-c][1,4]噁嗪-6-甲酸(32c).向(r)-8-((4-(氯二氟甲氧基)苯基)氨甲酰基)-4-甲基-3,4-二氢
ꢀ‑
1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-6-甲酸甲基酯(32b,22mg,0.047mmol)于meoh(1 ml)、thf(1ml)和h2o(1ml)中的溶液中添加lioh.h2o(7.93mg,0.189mmol)。将混合物于50℃下搅拌5hr。lcms显示检测到所需ms。在减压下浓缩反应混合物以去除溶剂。添加h2o,并且向混合物中逐滴添加1m hcl直到ph=5。浓缩混合物,从而产生粗产物,其未经纯化即用于下一步骤中。1h nmr(400mhz,dmso-d6)δ10.60(s,1h),8.55 (d,j=1.7hz,1h),8.38(d,j=1.7hz,1h),7.96(d,j=9.2hz,2h),7.38(d,j=9.0hz, 2h),5.38-5.26(m,1h),5.16-4.90(m,2h),4.29-3.98(m,2h),1.31(d,j=6.5hz,3h)。
[0833]
(r)-n
8-(4-(氯二氟甲氧基)苯基)-n6,4-二甲基-3,4-二氢-1h-苯并[4,5]咪唑并 [2,1-c][1,4]噁嗪-6,8-二甲酰胺(32).向(r)-8-((4-(氯二氟甲氧基)苯基)氨甲酰基)-4-甲基
ꢀ‑
3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-6-甲酸(32c,21mg,0.046mmol)和甲胺盐酸盐(31.38mg,0.465mmol)于dmf(2ml)中的溶液中添加hatu(53.02mg,0.139umol) 和diea(48.06mg,0.372mmol,64.77ul)。在20℃下将混合物搅拌24hr。lcms显示检测到所需ms。在减压下浓缩反应混合物以去除溶剂。用h2o(5ml)稀释残余物并用etoac(5 ml
×
3)萃取。将合并的有机层用盐水(5ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1,rf=0.60)纯化残余物,从而得到白色固体状标题化合物32。[m 1]
(c
21h19
clf2n4o4)计算的ms质量要求 m/z 465.1,lcms实验值m/z 465.1。1h nmr(400mhz,dmso-d6)δ10.50(s,1h), 8.85-8.73(m,1h),8.42(d,j=1.6hz,1h),8.04-7.90(m,3h),7.37(d,j=9.0hz,2h), 5.13-4.89(m,3h),4.18-3.95(m,2h),2.87(d,j=4.6hz,3h),1.28(d,j=6.5hz,3h)。
[0834]
实例33(一般程序n)
[0835]
(r)-n-(4-(氯二氟甲氧基)苯基)-3-甲基-5-(1h-吡唑-5-基)-2,3-二氢苯并[4,5]咪唑并 [2,1-b]噁唑-7-甲酰胺
[0836]
所述一般程序n提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂来制备。
[0837][0838]
(r)-5-溴-n-(4-(氯二氟甲氧基)苯基)-3-甲基-2,3-二氢苯并[4,5]咪唑并[2,1-b]噻唑-7
‑ꢀ
甲酰胺(33b)和(r)-5-溴-n-(4-(氯二氟甲氧基)苯基)-3-甲基-2,3-二氢苯并[4,5]咪唑并 [2,1-b]噁唑-7-甲酰胺(33c).将(r)-1-(3-氨基-5-溴-4-((1-羟基丙-2-基)氨基)苯基)-2-(4-(氯二氟甲氧基)苯基)乙酮(以与6c类似的方式合成;33a,330mg,0.71mmol)和二(咪唑-1-基) 甲烷硫酮(379.68mg,2.13mmol)于thf(15ml)中的溶液于15℃下搅拌16hr。tlc(石油醚:乙酸乙酯=0:1,rf=0.6)显示生成两个新的斑点。lcms显示检测到具有33b和33c的 ms的两个峰。浓缩混合物。通过硅胶管柱色谱(石油醚:乙酸乙酯=3:1~0:1)纯化粗产物,从而产生黄色固体状33b。1h nmr(400mhz,cdcl
3-d)δ8.14(s,1h),7.99(d,j=1.5hz, 1h),7.93(d,j=1.5hz,1h),7.77-7.69(m,2h),7.28(br s,1h),7.26(br s,1h),5.39(quin, j=6.5hz,1h),4.35-4.24(m,1h),3.48(d,j=11.1hz,1h),1.57(d,j=6.4hz,3h)。通过硅胶管柱色谱(石油醚:乙酸乙酯=3:1~0:1)进一步纯化一批粗产物,从而产生无色固体状33c。1h nmr(400mhz,cdcl
3-d)δ8.49(s,1h),8.02(d,j=1.3hz,1h),7.92(d,j=1.5 hz,1h),7.79-7.72(m,2h),7.28(br s,1h),7.26(s,1h),5.37(quin,j=6.6hz,1h),4.26 (dd,j=7.2,11.1hz,1h),4.13(q,j=7.2hz,1h),3.46(d,j=11.0hz,1h),1.56(d,j=6.4 hz,3h)。
[0839]
(r)-n-(4-(氯二氟甲氧基)苯基)-3-甲基-5-(1h-吡唑-5-基)-2,3-二氢苯并[4,5]咪唑并 [2,1-b]噁唑-7-甲酰胺(33).将(r)-5-溴-n-(4-(氯二氟甲氧基)苯基)-3-甲基-2,3-二氢苯并 [4,5]咪唑并[2,1-b]噁唑-7-甲酰胺(33c,20mg,0.042mmol)、5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1h-吡唑(32.84mg,0.169mmol)、k3po4(26.94mg,0.127mmol)、 pd(dppf)cl2(6.19mg,8.46umol)和boc2o(4.62mg,0.021umol,4.86ul)于二噁烷(2ml) 和h2o(0.2ml)中的混合物脱气且用n2吹扫3次、将混合物在110℃下在n2气氛下搅拌16 hr。lcms显示剩余33c。向此混合物中添加5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2
‑ꢀ
基)-1h-吡唑(24.63mg,0.127mmol)、k3po4(17.96mg,0.085mmol)和pd(dppf)cl2(6.19 mg,8.46umol)。在110℃下在n2气氛下将混合物搅拌4hr。lcms显示检测到具有所需 ms的峰。tlc(乙酸乙酯:甲醇=10:1,rf=0.48)显示生成新的斑点。浓缩反应混合物并添加h2o(10ml)。用乙酸乙酯(20ml
×
3)萃取混合物。用盐水(10ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(乙酸乙酯:甲醇=10:1, rf=0.48)纯化粗产物,从而产生粗产物,通过制备型tlc(dcm:甲醇=10:1,rf=0.5) 对其进一步纯化,从
而产生白色固体状33。[m 1]
(c
21h16
clf2n5o3)计算的ms质量要求 m/z 460.1,lcms实验值m/z 460.1。1h nmr(400mhz,meod-d4)δ8.00(br d,j=9.7hz, 2h),7.88-7.81(m,3h),7.29(d,j=8.8hz,2h),6.79(br s,1h),5.29(br d,j=7.9hz,2h), 4.79(br d,j=5.7hz,1h),1.00(br d,j=4.9hz,3h)。
[0840]
实例34(一般程序o)
[0841]
(r)-n-(4-(氯二氟甲氧基)苯基)-4-(羟基甲基)-6-(1h-吡唑-5-基)-3,4-二氢-1h-苯并 [4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺
[0842]
所述一般程序o提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂和/或去保护试剂来制备。
[0843][0844]
(r)-6-溴-4-(羟基甲基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酸甲基酯 (34b).将(r)-4-((苄基氧基)甲基)-6-溴-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酸甲基酯(以与8e类似的方式合成;34a,1.2g,2.78mmol)于tfa(10ml)中的溶液于75℃下搅拌16小时。lcms显示所需ms。浓缩混合物,从而得到黄色油状34b。[m 1]
(c
13h13
brn2o4)计算的ms质量要求m/z 341.0,lcms实验值m/z 341.0。
[0845]
(r)-6-溴-4-(羟基甲基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酸(34c).向 (r)-6-溴-4-(羟基甲基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酸甲基酯(34b, 0.95g,2.78mmol)于thf(5ml)、meoh(5ml)和h2o(1ml)中的溶液中添加lioh.h2o (233.71mg,5.57mmol)。将混合物于50℃下搅拌1小时。lcms显示所需ms。浓缩混合物且将残余物溶解于水(5ml)中。将悬浮液用乙酸乙酯(10ml
×
2)萃取且向水相中逐滴添加hcl(1m)直到ph=3。通过过滤收集沉淀的固体且干燥,从而得到白色固体状34c。1h nmr(400mhz,dmso-d6)δ8.12(s,1h),7.95(d,j=1.2hz,1h),5.45-5.36(m,1h), 5.13-5.05(m,1h),4.97-4.88(m,1h),4.38(d,j=12.1hz,1h),4.02(br d,j=11.9hz,1h), 3.90(br d,j=10.1hz,1h),3.67(dt,j=5.9,10.1hz,1h)。
[0846]
(r)-6-溴-n-(4-(氯二氟甲氧基)苯基)-4-(羟基甲基)-3,4-二氢-1h-苯并[4,5]咪唑并 [2,1-c][1,4]噁嗪-8-甲酰胺(34d).向(r)-6-溴-4-(羟基甲基)-3,4-二氢-1h-苯并[4,5]咪唑并 [2,1-c][1,4]噁嗪-8-甲酸(34c,0.85g,2.60mmol)和4-(氯二氟甲氧基)苯胺(1h,528.13mg, 2.73mmol)于吡啶(10ml)中的混合物中添加hatu(1.48g,3.90mmol)。将混合物于40℃下搅拌6小时。lcms显示所需ms。将反应混合物倾倒到水(30ml)中且用乙酸乙酯(50ml
ꢀ×
3)萃取混合物。用盐水(100ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过管柱色谱(sio2,石油醚:乙酸乙酯=100:1到0:1,rf=0.4)纯化残余
物,从而产生白色固体状34d。[m 1]
(c
19h15
brclf2n3o4)计算的质量要求m/z 502.0,lcms 实验值m/z 502.0;1h nmr(400mhz,cdcl
3-d)δ8.10(brs,1h),8.04(d,j=1.3hz,1h), 7.98(d,j=1.3hz,1h),7.72(d,j=9.0hz,2h),7.28(s,2h),5.16(d,j=16.5hz,1h), 5.12-5.06(m,1h),4.94(d,j=16.3hz,1h),4.57(d,j=12.3hz,1h),4.22(dd,j=2.8, 10.5hz,1h),4.15-4.08(m,2h),2.27(br s,1h)。
[0847]
(r)-n-(4-(氯二氟甲氧基)苯基)-4-(羟基甲基)-6-(1h-吡唑-5-基)-3,4-二氢-1h-苯并 [4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(34).在n2下向(r)-6-溴-n-(4-(氯二氟甲氧基)苯基)-4-(羟基甲基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(34d,0.5g, 0.995mmol)和嘧啶-5-基硼酸(369.72mg,2.98mmol)于二噁烷(5ml)、h2o(0.5ml)中的混合物中添加k3po4(422.27mg,1.99mmol)、pd(dppf)cl2(72.78mg,0.099mmol)、 (boc)2o(217.08mg,0.995mmol,228.51ul)。在110℃下将混合物搅拌16小时。lcms显示所需ms。过滤混合物且浓缩。通过管柱色谱(sio2,石油醚:乙酸乙酯=100:1到0:1,rf=0.3)纯化残余物,从而产生黄色固体状34。[m 1]
(c
22h18
clf2n5o4)计算的质量要求m/z 490.1,lcms实验值m/z 490.1;1h nmr(400mhz,meod-d4)δ8.29(br s,1h),7.95(s, 1h),7.84(br d,j=8.6hz,3h),7.30(br d,j=8.8hz,2h),6.71(br s,1h),5.17-4.93(m, 2h),4.37(br d,j=12.2hz,1h),4.08(br d,j=11.0hz,1h),3.60(s,1h),3.53-3.40(m, 2h)。
[0848]
实例35
[0849]
(s)-n-(4-(氯二氟甲氧基)苯基)-4-(氟甲基)-6-(1h-吡唑-5-基)-3,4-二氢-1h-苯并[4,5] 咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺
[0850][0851]
(s)-6-溴-n-(4-(氯二氟甲氧基)苯基)-4-(氟甲基)-3,4-二氢-1h-苯并[4,5]咪唑并 [2,1-c][1,4]噁嗪-8-甲酰胺(35a).于0℃下在n2下向(r)-6-溴-n-(4-(氯二氟甲氧基)苯基)-4-(羟基甲基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(34d,0.03g, 0.06mmol)于dcm(2ml)中的混合物中添加dast(19.24mg,0.119mmol,15.77ul)。将混合物于25℃下搅拌8小时。lcms显示所需ms。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1,rf=0.6)纯化粗产物,从而产生白色固体状35a。[m 1]
(c
19h14
brclf3n3o3)计算的ms质量要求m/z 504.0,lcms实验值m/z 504.0。
[0852]
(s)-n-(4-(氯二氟甲氧基)苯基)-4-(氟甲基)-6-(1h-吡唑-5-基)-3,4-二氢-1h-苯并[4,5] 咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(35).向(s)-6-溴-n-(4-(氯二氟甲氧基)苯基)-4-(氟甲基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(35a,10mg,0.02mmol)和 5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1h-吡唑(11.53mg,0.059mmol)于二噁烷(2ml)和h2o(0.2ml)中的混合物中添加(boc)2o(4.32mg,0.02mmol,4.55ul)、 pd(dppf)cl2(1.45mg,1.98umol)、k3po4(12.62mg,0.059mmol)。在110℃下将混合物搅拌12小时。lcms显示所需ms。过滤混合物且浓缩。通过制备型hplc(管柱:纳-微克罗马斯尔c18 100*30mm 5um;移动相:[水(0.1%tfa)-acn];b%:36%-53%,10min) 纯化残余物,从而产生白色固体状35。[m 1]
(c
22h17
clf3n5o3)计算的ms质量要求m/z
492.1,lcms实验值m/z 492.1;1h nmr(400mhz,cdcl
3-d)δ8.21(br s,1h),8.11(br s, 1h),7.92(s,1h),7.80-7.73(m,3h),7.29(s,2h),6.68(br s,1h),5.33(br s,1h),5.18(br d, j=16.1hz,1h),5.05-4.92(m,1h),4.49-4.27(m,2h),4.17-3.98(m,2h)。
[0853]
实例36
[0854]
(r)-n-(4-(氯二氟甲氧基)苯基)-6-(3-羟基氮杂环丁-1-基)-4-甲基-3,4-二氢-1h-苯并 [4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺
[0855][0856]
(r)-n-(4-(氯二氟甲氧基)苯基)-6-(3-羟基氮杂环丁-1-基)-4-甲基-3,4-二氢-1h-苯并 [4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(36).在n2下向(r)-6-溴-n-(4-(氯二氟甲氧基)苯基)-4-甲基-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(32a,20mg,0.041 mmol)、氮杂环丁-3-醇(36a,15.02mg,0.205mmol)于thf(0.8ml)中的混合物中添加 brettphos pd g3(3.73mg,4.11umol)和t-buona(2m,41.09ul)。将混合物于100℃下在密封管中搅拌16hr。lcms显示具有所需ms的峰。tlc(乙酸乙酯:甲醇=10:1,rf=0.47) 显示生成新的斑点。浓缩反应混合物。通过制备型tlc(乙酸乙酯:甲醇=10:1,rf= 0.47)纯化粗产物,通过制备型hplc(管柱:沃特世x桥150*25 5u;移动相:[水(10mmnh4hco3)-acn];b%:25%-55%,7min)对其进一步纯化,从而得到白色固体状36。 [m 1]
(c
22h21
clf2n4o4)计算的ms质量要求m/z 479.1,lcms实验值m/z 479.1;1h nmr (400mhz,meod-d4)δ7.91(d,j=1.3hz,1h),7.86-7.81(m,2h),7.54(d,j=1.3hz,1h), 7.30(d,j=9.0hz,2h),5.05-4.99(m,2h),4.95(s,1h),4.72-4.65(m,1h),4.36(br t,j= 6.5hz,1h),4.22(dd,j=3.3,12.0hz,1h),4.10-4.04(m,2h),4.02-3.96(m,1h),3.54(t,j =6.3hz,1h),1.56(d,j=6.4hz,3h)。
[0857]
实例37
[0858]
n-(4-(氯二氟甲氧基)苯基)-9-(1h-吡唑-5-基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺
[0859][0860]
9-溴-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(37b).向3-氨基-5-溴
ꢀ‑
4-(哌啶-1-基)苯甲酸甲基酯(以与1d类似的方式合成;37a,160mg,0.511mmol)
于甲酸(3 ml)中的溶液中添加h2o2(521.32mg,4.60mmol,441.79ul,30%纯度)。将混合物于回流温度下加热40min。lcms显示37a完全消耗且检测到具有所需质量的一个主峰。tlc(石油醚:乙酸乙酯=2:1,rf=0.20)指示反应物完全消耗且形成一个新的斑点。在减压下浓缩混合物。将残余物溶解于乙酸乙酯(30ml)中。将有机层用饱和nahco3水溶液(10ml
×ꢀ
3)洗涤,经na2so4干燥,过滤且浓缩。通过制备型tlc(石油醚:乙酸乙酯=2:1,rf=0.20) 纯化粗产物,从而得到白色固体状37b。1h nmr(400mhz,cdcl
3-d)δ8.24-8.18(m,1h), 8.00(d,j=1.3hz,1h),4.61-4.55(m,2h),3.87(s,3h),3.09-3.01(m,2h),2.10-2.03(m, 2h),1.99-1.89(m,2h)。
[0861]
9-溴-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸(37c).向9-溴-1,2,3,4-四氢苯并 [4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(37b,50mg,0.162mmol)于meoh(1ml)、h2o(1 ml)和thf(1ml)中的溶液中添加lioh.h2o(13.57mg,0.323mmol)。在50℃下将混合物搅拌2hr。lcms显示37b完全消耗且检测到具有所需质量的一个主峰。浓缩混合物以去除thf和meoh。然后向反应混合物中逐滴水中的1m hcl直到ph=5。过滤悬浮液,并且将滤饼用h2o(1ml)洗涤且干燥,从而得到白色固体状37。1h nmr(400mhz, cdcl
3-d)δ8.34(d,j=1.3hz,1h),8.31(d,j=1.2hz,1h),4.87-4.84(m,2h),3.32-3.32 (m,2h),2.28-2.06(m,4h)。
[0862]
9-溴-n-(4-(氯二氟甲氧基)苯基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺 (37d).向9-溴-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸(37c,47mg,0.159mmol)于 dmf(4ml)中的溶液中添加hatu(72.66mg,0.191mmol)、diea(61.75mg,0.478mmol, 83.22ul)和4-(氯二氟甲氧基)苯胺(1h,61.66mg,0.319umol)、将混合物于15℃下搅拌16 hr。lcms显示37c完全消耗且检测到具有所需质量的一个主峰。tlc(乙酸乙酯:甲醇= 10:1,rf=0.36)指示37c完全消耗且形成一个新的斑点。向混合物中添加h2o(20ml)。用乙酸乙酯(10ml
×
3)萃取混合物。用盐水(20ml)洗涤合并的有机层,经na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(乙酸乙酯:甲醇=10:1,rf=0.36)纯化粗产物,从而得到白色油状37d。1h nmr(400mhz,cdcl
3-d)δ8.01(d,j=1.5hz,1h),7.96(d,j= 1.5hz,1h),7.75-7.67(m,2h),7.15(d,j=8.8hz,2h),4.60(t,j=6.2hz,2h),3.02(t,j= 6.5hz,2h),2.09-2.04(m,2h),1.97-1.88(m,2h)。
[0863]
n-(4-(氯二氟甲氧基)苯基)-9-(1h-吡唑-5-基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺(37).将9-溴-n-(4-(氯二氟甲氧基)苯基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺(37d,20mg,0.042mmol)、3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2
‑ꢀ
基)-1h-吡唑(24.73mg,0.127mmol)、pd(dppf)cl2(3.11mg,4.25umol)和k3po4(27.06mg, 0.127mmol)于二噁烷(1ml)和h2o(0.1ml)中的混合物脱气且用n2吹扫3次。将混合物在110℃下在n2气氛下搅拌16hr。lcms显示37d完全消耗且检测到具有所需质量的一个主峰。tlc(二氯甲烷:甲醇=10:1,rf=0.44)指示37d完全消耗且形成一个新的斑点。浓缩混合物且添加h2o(10ml)。用乙酸乙酯(10ml
×
3)萃取混合物。用盐水(10ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(二氯甲烷:甲醇=10:1,rf=0.30)纯化粗产物,从而得到白色固体状37。[m 1]
(c
22h18
clf2n5o2)计算的ms质量要求m/z 458.1,lcms实验值m/z 458.1;1h nmr(400mhz,meod-d4)δ 8.26-8.23(m,1h),7.86-7.81(m,4h),7.29(d,2h,j=9.0hz),6.62(s,1h),3.86(br s,2h), 3.12(br t,2h,j=
6.1hz),1.99(br s,4h)。
[0864]
实例38(一般程序p)
[0865]
(r)-n-(4-(氯二氟甲氧基)苯基)-4-羟基-9-(1h-吡唑-5-基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺
[0866]
标题化合物是根据示意方案10制备。所述一般程序p例示示意方案10且提供如应用于标题化合物的特定合成细节。
[0867][0868]
(r)-9-溴-2-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(39b)和 (r)-9-溴-4-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(38c).将甲基 (r)-3-溴-4-(3-羟基哌啶-1-基)-5-硝基苯甲酸甲基酯(以与1d类似的方式合成;38a,100mg, 0.278mmol)于acoh(3ml)中的溶液于30℃下搅拌。经32hr向反应混合物中逐份缓慢添加铁粉(155.48mg,2.78mmol)。tlc(乙酸乙酯:甲醇=10:1,rf=0.37)显示生成两个新的斑点。lcms显示检测到具有所需ms的两个峰。过滤反应混合物,并且将滤液分配在乙酸乙酯(50ml)与h2o(50ml)之间。将分离的有机层用水(50ml
×
3)洗涤,并且然后用饱和nahco3水溶液(30ml
×
3)洗涤,经na2so4干燥且蒸发到干燥。通过制备型tlc(乙酸乙酯:甲醇=10:1,rf=0.3)纯化粗产物,从而产生黄色固体状38b。1h nmr(400mhz, meod-d4)δ8.16(d,j=1.1hz,1h),8.02(d,j=1.3hz,1h),4.82-4.74(m,1h),4.69-4.61 (m,1h),4.50-4.42(m,1h),3.93(s,3h),3.25(dd,j=6.7,9.8hz,1h),3.13-3.04(m,1h), 2.20-2.09(m,2h)。通过制备型tlc(乙酸乙酯:甲醇=10:1,rf=0.37)纯化粗产物,从而产生获得黄色固体状38c。1h nmr(400mhz,meod-d4)δ8.27(d,j=0.9hz,1h),8.07(d, j=1.1hz,1h),4.97(t,j=5.4hz,1h),4.79-4.70(m,1h),4.65-4.52(m,1h),3.94(s,3h), 2.38(br dd,j=6.8,13.5hz,1h),2.26-2.04(m,3h)。
[0869]
(r)-9-溴-4-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸(38d).向(r)-9-溴-4
‑ꢀ
羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(38c,25mg,0.077mmol)于 meoh(1ml)、h2o(1ml)和thf(1ml)中的溶液中添加lioh.h2o(6.45mg,
0.154 mmol)。将混合物于50℃下搅拌2hr。tlc(乙酸乙酯:甲醇=10:1,rf=0.0)显示生成新的斑点。浓缩混合物以去除溶剂。向反应混合物中逐滴添加1m hcl直到ph=5。浓缩混合物,并且粗产物未经进一步纯化即用于下一步骤中。
[0870]
(r)-9-溴-n-(4-(氯二氟甲氧基)苯基)-4-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶
ꢀ‑
7-甲酰胺(38e).向(r)-9-溴-4-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸(38d, 30mg,0.096mmol)于dmf(2ml)中的溶液中添加hatu(54.99mg,0.145mmol)、diea (124.62mg,0.964mmol,167.95ul)和4-[氯(二氟)甲氧基]苯胺(1h,28.00mg,0.145 mmol)。将混合物于15℃下搅拌16hr。tlc(乙酸乙酯:甲醇=10:1,rf=0.3)指示生成新的斑点。lcms显示检测到具有所需ms的峰。将混合物用水(20ml)淬灭且将混合物用乙酸乙酯(30ml
×
3)萃取。用盐水(20ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(乙酸乙酯:甲醇=10:1,rf=0.3)纯化粗产物,从而产生黄色固体状38e。
[0871]
(r)-n-(4-(氯二氟甲氧基)苯基)-4-羟基-9-(1h-吡唑-5-基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺(38).将(r)-9-溴-n-(4-(氯二氟甲氧基)苯基)-4-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺(38e,15mg,0.031mmol)、5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1h-吡唑(17.94mg,0.092mmol)、pd(dppf)cl2(4.51mg,6.16umol)、 k3po4(19.63mg,0.092mmol)于二噁烷(2ml)和h2o(0.2ml)中的混合物脱气且用n2吹扫3次。将混合物在120℃下在n2气氛下搅拌16hr。tlc(乙酸乙酯:甲醇=5:1,rf=0.2) 显示生成新的斑点。lcms显示检测到具有所需ms的峰。浓缩混合物。通过制备型hplc (管柱:卢纳c18 100*30 5u;移动相:[水(0.225%fa)-acn];b%:1%-50%,12min)纯化粗产物,从而产生白色固体状38。[m 1]
(c
22h18
clf2n5o2)计算的质量要求m/z 474.1, lcms实验值m/z 474.1;1h nmr(400mhz,meod-d4)δ8.34(s,1h),7.88(d,j=1.6hz, 1h),7.87-7.82(m,3h),7.29(d,j=8.9hz,2h),6.62(d,j=2.1hz,1h),5.01(t,j=5.1hz, 1h),3.95-3.76(m,2h),2.19(br d,j=6.7hz,2h),2.07-1.88(m,2h)。
[0872]
实例39(一般程序q)
[0873]
(r)-n-(4-(氯二氟甲氧基)苯基)-6-(4-羟基吡啶-2-基)-4-甲基-3,4-二氢-1h-苯并[4,5] 咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺
[0874]
所述一般程序q提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂来制备。
[0875][0876]
(r)-n-(4-(氯二氟甲氧基)苯基)-4-甲基-6-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2
‑ꢀ
基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(39a).将(r)-6-溴-n-(4-(氯二氟甲氧基)苯基)-4-甲基-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(32a,200 mg,0.411mmol)、4,4,5,5-四甲基-2-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1,3,2
‑ꢀ
二氧杂硼杂环戊烷(939.17mg,3.70mmol)、pd(oac)2(9.23mg,0.041mmol)、xphos(48.97 mg,0.103mmol)和k3po4(261.68mg,1.23mmol)于二噁烷(6.2ml)中的混合物脱气且用 n2吹扫3次。将混合物于60℃在n2气氛下在微波下搅拌16hr。lcms显示检测到所需ms。在减压下浓缩反应混合物以去除溶剂。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1) 纯化残余物,从而得到白色固体状39a。
[0877]
(r)-n-(4-(氯二氟甲氧基)苯基)-6-(4-羟基吡啶-2-基)-4-甲基-3,4-二氢-1h-苯并[4,5] 咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(39).将(r)-n-(4-(氯二氟甲氧基)苯基)-4-甲基-6-(4,4,5,5
‑ꢀ
四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(39a,5mg,9.37umol)、2-溴吡啶-4-醇(2.44mg,0.014mmol)、pd(dppf)cl2(685.43ug, 9.37umol)、na2co3(2.98mg,0.028mmol)于dme(0.5ml)和h2o(0.1ml)中的混合物脱气且用n2吹扫3次。将混合物于120℃在n2气氛下在微波反应器中搅拌1hr。lcms显示39a 完全消耗且检测到所需ms。在减压下浓缩反应混合物以去除溶剂。通过制备型hplc(管柱:仙替马特(xtimate)c18 150*25mm*5um;移动相:[水(10mm nh4hco3)-acn];b%: 25%-55%,10min)纯化残余物,从而得到白色固体状39。[m 1]
(c
24h19
clf2n4o4)计算的 ms质量要求m/z 501.1,lcms实验值m/z 501.1;1h nmr(400mhz,meod-d4)δ8.41(d, j=1.5hz,1h),8.03(br d,j=6.8hz,1h),7.96(d,j=1.5hz,1h),7.88-7.81(m,2h),7.29 (d,j=8.8hz,2h),6.79(br s,1h),6.68(br d,j=6.8hz,1h),5.15-4.96(m,2h),4.46(br s, 1h),4.13(br d,j=3.1hz,1h),3.99(d,j=12.3hz,1h),1.14(d,j=6.6hz,3h)。
[0878]
实例40(一般程序r)
[0879]
(s)-n-(4-(氯二氟甲氧基)苯基)-2-(1-羟基乙基)-1-异丙基-7-(1h-吡唑-5-基)-1h-苯并 [d]咪唑-5-甲酰胺
[0880]
所述一般程序r提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂来制备。
[0881][0882]
(s)-3-溴-n-(4-(氯二氟甲氧基)苯基)-5-(2-羟基丙酰胺基)-4-(异丙基氨基)苯甲酰胺 (40a).向3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-(异丙基氨基)苯甲酰胺(9a,350mg, 0.78mmol)于dcm(1ml)中的溶液中添加diea(302.44mg,2.34mmol,407.60ul)、 (2s)-2-羟基丙酸(140.53mg,1.56mmol,116.14ul)和2-氯-1,3-二甲基咪唑啉鎓氯化物 (158.24mg,0.936mmol)。将混合物于15℃下搅拌4hr。tlc(石油醚:乙酸乙酯=1:1,rf=0.45)指示9a完全消耗且检测到具有更大极性的一个新的主斑点。lcms检测到所需ms。将反应混合物用h2o(20ml)稀释且用dcm(10ml
×
3)萃取。将合并的有机层用盐水(30 ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc (sio2,石油醚:乙酸乙酯=1:1)纯化残余物,从而得到白色固体状40b。1h nmr(400 mhz,meod-d4)δ8.53(d,j=2.4hz,1h),7.99(d,j=2.0hz,1h),7.83-7.80(m,2h),7.30 (br d,j=9.3hz,2h),4.34(q,j=6.8hz,1h),3.56(td,j=6.4,12.7hz,1h),1.49(d,j= 6.8hz,3h),1.24(d,j=6.4hz,6h)。
[0883]
(s)-7-溴-n-(4-(氯二氟甲氧基)苯基)-2-(1-羟基乙基)-1-异丙基-1h-苯并[d]咪唑-5-甲酰胺(40b).向(s)-3-溴-n-(4-(氯二氟甲氧基)苯基)-5-(2-羟基丙酰胺基)-4-(异丙基氨基)苯甲酰胺(40a,40mg,0.077mmol)于甲苯(1ml)中的溶液中添加4-甲苯磺酸(2.65mg,0.015 mmol)。将混合物于100℃下搅拌4hr。tlc(石油醚:乙酸乙酯=1:1,rf=0.15)指示40a完全消耗且检测到具有更大极性的一个新的主斑点。lcms检测到所需ms。将残余物用h2o (20ml)稀释且用dcm(10ml
×
3)萃取。将合并的有机层用盐水(30ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc(sio2,石油醚:乙酸乙酯=1:1)纯化残余物,从而得到白色固体状40b。1h nmr(400mhz,meod-d4)δ8.29 (s,1h),8.14(br s,1h),7.86(d,j=9.3hz,2h),7.32(br d,j=9.3hz,2h),4.92-4.92(m, 1h),4.87-4.86(m,1h),1.91(br s,3h),1.76(br d,j=6.4hz,6h)。
[0884]
(s)-n-(4-(氯二氟甲氧基)苯基)-2-(1-羟基乙基)-1-异丙基-7-(1h-吡唑-5-基)-1h-苯并 [d]咪唑-5-甲酰胺(40).将(s)-7-溴-n-(4-(氯二氟甲氧基)苯基)-2-(1-羟基乙基)-1-异丙基
ꢀ‑
1h-苯并[d]咪唑-5-甲酰胺(40b,10mg,0.02mmol),5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1h-吡唑(11.58mg,0.06mmol)、k3po4(12.67mg,0.06mmol)、pd(dppf)cl
2 (1.46mg,1.99umol)和5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环
戊烷-2-基)-1h-吡唑(11.58 mg,0.06mmol)于二噁烷(1ml)和h2o(0.1ml)中的混合物脱气且用n2吹扫3次。将混合物在115℃下在n2气氛下搅拌4hr。tlc(乙酸乙酯:甲醇=20:1,rf=0.24)指示40b完全消耗,并且检测到具有更大极性的一个新的主斑点。lcms检测到所需ms。在减压下浓缩反应混合物以去除溶剂。用h2o(20ml)稀释残余物并用乙酸乙酯(10ml
×
3)萃取。将合并的有机层用盐水(30ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型tlc(乙酸乙酯:甲醇=20:1)纯化残余物,从而得到白色固体状40。 [m 1]
(c
23h22
clf2n5o3)计算的质量要求m/z 490.1,lcms实验值m/z 490.1;1h nmr (400mhz,meod-d4)δ8.34(br s,1h),7.92-7.79(m,4h),7.29(d,j=9.3hz,2h),6.61(d, j=2.0hz,1h),5.29(q,j=6.0hz,1h),4.76(br s,1h),1.73(d,j=6.4hz,3h),1.45(dd,j =7.1,12.0hz,6h)。
[0885]
实例41
[0886]
(r)-n-(4-(氯二氟甲氧基)苯基)-4-甲基-6-(吡咯烷-1-基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺
[0887][0888]
(r)-n-(4-(氯二氟甲氧基)苯基)-4-甲基-6-(吡咯烷-1-基)-3,4-二氢-1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(41).将(r)-6-溴-n-(4-(氯二氟甲氧基)苯基)-4-甲基-3,4-二氢
ꢀ‑
1h-苯并[4,5]咪唑并[2,1-c][1,4]噁嗪-8-甲酰胺(32a,50mg,0.103mmol)、吡咯烷(438.39 mg,6.16mmol,514.54ul)、(bu4ncui2)2(23.00mg,0.021mmol)、cs2co3(66.95mg,0.205 mmol)和3,4,7,8-四甲基-1,10-菲咯啉(2.43mg,0.01mmol)于二噁烷(2ml)中的混合物脱气且用n2吹扫3次。将混合物在120℃下在n2气氛下搅拌16hr。lcms显示检测到所需质量。过滤反应混合物且在减压下浓缩,从而产生残余物。通过制备型tlc(sio2,乙酸乙酯: 甲醇=20:1)纯化残余物,从而得到白色固体状41。[m 1]
(c
23h23
clf2n4o3)计算的质量要求m/z 477.1,lcms实验值m/z 477.1。1h nmr(400mhz,cdcl
3-d)8.61(s,1h),7.74(d, j=9.0hz,2h),7.25(s,1h),7.22(d,j=6.6hz,2h),5.16-4.92(m,2h),4.47(br s,1h), 4.15-4.00(m,2h),3.26(br s,4h),2.12(br s,4h),1.63(d,j=6.6hz,3h)。
[0889]
实例42(一般程序s)
[0890]
(r)-n-(4-(氯二氟甲氧基)苯基)-3-甲基-5-(嗒嗪-3-基)-2,3-二氢苯并[4,5]咪唑并 [2,1-b]噁唑-7-甲酰胺
[0891]
所述一般程序s提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂来制备。
[0892][0893]
(r)-3-氨基-5-溴-4-((1-((叔丁基二甲基硅基)氧基)丙-2-基)氨基)-n-(4-(氯二氟甲氧基)苯基)苯甲酰胺(42a).将(r)-3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-((1-羟基丙-2-基) 氨基)苯甲酰胺(33a,2g,4.30mmol)、咪唑(439.50mg,6.46mmol)、tbscl(973.05mg,6.46 mmol,791.10ul)和dmap(52.58mg,430.40umol)于dcm(30ml)中的混合物脱气且用 n2吹扫三次,并且然后将混合物于15℃下在n2气氛下搅拌2hr。tlc(石油醚:乙酸乙酯= 3:1,rf=0.5)显示生成新的斑点。lcms显示检测到具有所需ms的峰。浓缩反应混合物并添加h2o(20ml)。用乙酸乙酯(30ml
×
3)萃取水相。用盐水(10ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过硅胶管柱色谱(石油醚:乙酸乙酯= 10:1~5:1)纯化粗产物,从而产生黄色油状42a。1h nmr(400mhz,cdcl
3-d)δ7.69(br s, 1h),7.66(d,j=9.0hz,2h),7.37(d,j=1.8hz,1h),7.25(br d,j=8.8hz,2h),7.14(d,j =1.8hz,1h),4.31(br s,2h),3.78-3.66(m,2h),3.62-3.50(m,2h),1.15(d,j=6.2hz, 3h),0.94(s,9h),0.11(s,6h)。
[0894]
(r)-7-溴-1-(1-((叔丁基二甲基硅基)氧基)丙-2-基)-n-(4-(氯二氟甲氧基)苯基)-2-硫酮
ꢀ‑
2,3-二氢-1h-苯并[d]咪唑-5-甲酰胺(42b).将(r)-3-氨基-5-溴-4-((1-((叔丁基二甲基硅基) 氧基)丙-2-基)氨基)-n-(4-(氯二氟甲氧基)苯基)苯甲酰胺(42a,2.4g,4.15mmol)、二(咪唑
ꢀ‑
1-基)甲烷硫酮(2.22g,12.44mmol)、diea(1.07g,8.29mmol,1.44ml)于thf(20ml) 中的混合物脱气且用n2吹扫三次。将混合物于60℃下在n2气氛下搅拌16hr。tlc(石油醚:乙酸乙酯=2:1,rf=0.54)指示生成新的斑点。lcms显示检测到具有所需ms的峰。浓缩混合物且添加h2o(50ml)。用乙酸乙酯(50ml
×
3)萃取水相。用盐水(20ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过硅胶管柱色谱(石油醚:乙
酸乙酯=8:1~2:1)纯化粗产物,从而产生黄色固体状42b。1h nmr(400mhz,cdcl
3-d)δ 11.21(s,1h),7.96(s,1h),7.86(d,j=1.1hz,1h),7.75-7.67(m,3h),7.28(s,1h),7.26(s, 1h),6.11-5.97(m,1h),4.99(t,j=9.6hz,1h),3.95(dd,j=5.1,10.4hz,1h),1.86(d,j= 7.1hz,3h),0.68(s,9h),0.00(s,3h),-0.12(s,3h)。
[0895]
(r)-7-溴-1-(1-((叔丁基二甲基硅基)氧基)丙-2-基)-n-(4-(氯二氟甲氧基)苯基)-2-(甲硫基)-1h-苯并[d]咪唑-5-甲酰胺(42c).向(r)-7-溴-1-(1-((叔丁基二甲基硅基)氧基)丙-2
‑ꢀ
基)-n-(4-(氯二氟甲氧基)苯基)-2-硫酮-2,3-二氢-1h-苯并[d]咪唑-5-甲酰胺(42b,2.4g, 3.86mmol)于dmf(20ml)中的溶液中添加mei(822.82mg,5.80mmol,360.89ul)和 k2co3(1.07g,7.73mmol)。将混合物于15℃下搅拌2hr。tlc(石油醚:乙酸乙酯=2:1,rf=0.72)指示生成新的斑点。lcms显示检测到具有所需ms的峰。将混合物用水(50ml) 淬灭且用乙酸乙酯(50ml
×
3)萃取,将合并的有机层用盐水(20ml)洗涤,经无水na2so4干燥,过滤且在真空中浓缩。通过硅胶管柱色谱(石油醚:乙酸乙酯=3:1~2:1)纯化粗产物,从而产生黄色油状42c。1h nmr(400mhz,cdcl
3-d)δ8.03(d,j=1.6hz,1h),7.97(d, j=1.6hz,1h),7.89(s,1h),7.74-7.67(m,2h),7.28(s,1h),7.25(s,1h),6.21-6.05(m, 1h),4.28(dd,j=9.2,10.4hz,1h),3.89(dd,j=5.7,10.6hz,1h),2.83(s,3h),1.67(d,j= 7.3hz,3h),0.67(s,9h),-0.04(s,3h),-0.18(s,3h)
[0896]
(r)-7-溴-n-(4-(氯二氟甲氧基)苯基)-1-(1-羟基丙-2-基)-2-(甲硫基)-1h-苯并[d]咪唑
ꢀ‑
5-甲酰胺(42d).向(r)-7-溴-1-(1-((叔丁基二甲基硅基)氧基)丙-2-基)-n-(4-(氯二氟甲氧基) 苯基)-2-(甲硫基)-1h-苯并[d]咪唑-5-甲酰胺(42c,1g,1.57mmol)于thf(20ml)中的溶液中添加tbaf(1m,1.73ml)。在15℃下将混合物搅拌3hr。tlc(石油醚:乙酸乙酯=0:1, rf=0.65)显示生成新的斑点。lcms显示检测到具有所需ms的峰。用aconh4(30ml) 淬灭混合物并用乙酸乙酯(50ml
×
3)萃取。用盐水(20ml)洗涤合并的有机层,经无水 na2so4干燥,过滤并在真空中浓缩。通过硅胶管柱色谱(石油醚:乙酸乙酯=3:1~0:1)纯化粗产物,从而产生黄色固体状42d。1h nmr(400mhz,cdcl
3-d)δ8.63(s,1h),7.87(d, j=9.0hz,2h),7.62(d,j=1.7hz,2h),7.31(d,j=8.8hz,2h),6.14(ddd,j=4.6,7.4, 10.0hz,1h),4.59(dd,j=10.0,12.7hz,1h),3.91(dd,j=4.4,12.8hz,1h),2.84(s,3h), 1.59(d,j=7.3hz,3h)。
[0897]
(r)-5-溴-n-(4-(氯二氟甲氧基)苯基)-3-甲基-2,3-二氢苯并[4,5]咪唑并[2,1-b]噁唑-7
‑ꢀ
甲酰胺(42e)将(r)-7-溴-n-(4-(氯二氟甲氧基)苯基)-1-(1-羟基丙-2-基)-2-(甲硫基)-1h-苯并[d]咪唑-5-甲酰胺(42d,500mg,960.11umol)于dmf(6ml)中的溶液脱气且用o2吹扫三次且将混合物冷却到0℃。添加nah(46.08mg,1.15mmol,60%纯度,1.2eq)。将混合物在0~15℃下在o2下搅拌6hr。tlc(石油醚:乙酸乙酯=1:2,rf=0.5)显示生成新的斑点。 lcms显示检测到具有所需ms的峰。将混合物用nh4cl(50ml)淬灭且用乙酸乙酯(50ml
ꢀ×
3)萃取,将合并的有机层用盐水(20ml)洗涤,经无水na2so4干燥,过滤且在真空中浓缩。通过硅胶管柱色谱(石油醚:乙酸乙酯=2:1~0:1)纯化粗产物,从而产生白色固体状 42e。1h nmr(400mhz,cdcl
3-d)δ8.24(s,1h),7.90(dd,j=1.3,15.9hz,2h),7.74(d,j= 9.0hz,2h),7.25(s,1h),5.29-5.19(m,1h),5.09-4.98(m,1h),4.78(dd,j=2.2,8.6hz, 1h),1.69(d,j=6.4hz,3h)
[0898]
(r)-n-(4-(氯二氟甲氧基)苯基)-3-甲基-5-(嗒嗪-3-基)-2,3-二氢苯并[4,5]咪
唑并 [2,1-b]噁唑-7-甲酰胺(42).将(r)-5-溴-n-(4-(氯二氟甲氧基)苯基)-3-甲基-2,3-二氢苯并 [4,5]咪唑并[2,1-b]噁唑-7-甲酰胺(42e,25mg,52.89umol)、三丁基(嗒嗪-3-基)锡烷(39.05 mg,105.78umol,2eq)、三叔丁基磷烷钯(2.70mg,5.29umol,0.1eq)于二噁烷(2ml)中的混合物脱气且用n2吹扫三次,并且然后将混合物于110℃下在n2下搅拌16hr。tlc(乙酸乙酯:甲醇=10:1,rf=0.31)显示生成新的斑点。lcms显示检测到具有所需ms的峰。浓缩反应混合物并添加h2o(20ml)。用乙酸乙酯(30ml
×
3)萃取水相。用盐水(10ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(乙酸乙酯:甲醇=10:1,rf=0.31)纯化粗产物,从而产生粗产物,通过制备型hplc(管柱:卢纳 c18 100*30 5u;移动相:[水(0.225%fa)-acn];b%:20%-70%,12min.)对其进一步纯化,从而产生浅黄色固体状42。[m 1]
(c
22h16
clf2n5o3)计算的ms质量要求m/z 472.1, lcms实验值m/z 472.0;1h nmr(400mhz,meod-d4)δ9.28(dd,j=1.5,4.9hz,1h),8.33 (dd,j=1.5,8.6hz,1h),8.21-8.17(m,1h),8.16(d,j=1.6hz,1h),7.95(dd,j=5.0,8.6 hz,1h),7.88-7.84(m,2h),7.31(d,j=9.0hz,2h),5.39-5.26(m,2h),4.83(dd,j=2.8,8.4 hz,1h),0.94(d,j=6.4hz,3h)。
[0899]
实例43(一般程序t)
[0900]
(s)-n-(4-(氯二氟甲氧基)苯基)-2-羟基-9-(嘧啶-5-基)-1,2,3,4-四氢苯并[4,5]咪唑并 [1,2-a]吡啶-7-甲酰胺
[0901]
所述一般程序t提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂来制备。
[0902][0903]
(s)-3-氨基-5-溴-4-(3-((叔丁基二甲基硅基)氧基)哌啶-1-基)苯甲酸甲基酯(43b).于 20℃下在n2下向(s)-3-氨基-5-溴-4-(3-羟基哌啶-1-基)苯甲酸甲基酯(以与1d类似的方式合成;43a,970mg,2.95mmol)和咪唑(501.52mg,7.37mmol)于dcm(20ml)中的混合物中一次性添加tbscl(666.18mg,4.42mmol)和dmap(36.00mg,0.295mmol)。在20℃下将混合物搅拌12小时。tlc(石油醚:乙酸乙酯=3:1,rf=0.7)指示43a完全消耗且形成一个新的斑点。将混合物用水(8ml
×
3)和盐水(8ml)洗涤,经na2so4干燥,过滤且浓缩,从而产生黄
色油状43b,其不经进一步纯化即用于下一步骤中。
[0904]
(s)-9-溴-2-((叔丁基二甲基硅基)氧基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(43c).于20℃下在n2下向(s)-3-氨基-5-溴-4-(3-((叔丁基二甲基硅基)氧基)哌啶
ꢀ‑
1-基)苯甲酸甲基酯(43b,1.18g,2.66mmol)于2,2,2-三氟乙醇(10ml)中的溶液中一次性添加氯铱;(1z,5z)-环辛-1,5-二烯(268.11mg,0.399mmol)。将混合物加热到85℃并搅拌72 小时。lcms显示43b完全消耗且检测到具有所需质量的一个主峰。tlc(石油醚:乙酸乙酯=1:1,rf=0.4)指示43b完全消耗且形成一个新的斑点。在减压下浓缩反应混合物以去除溶剂。通过管柱色谱(sio2,石油醚/乙酸乙酯=20/1到2/1)纯化残余物,从而产生黄色油状43c。1h nmr(400mhz,cdcl
3-d)δ8.30(s,1h),8.08(s,1h),4.69-4.57(m,2h),4.46(brd,j=3.9hz,1h),4.15-4.06(m,1h),3.95(s,3h),3.41-3.29(m,1h),3.12-3.07(m,1h), 2.13-2.09(m,1h),0.88(s,9h),0.15(br d,j=6.4hz,6h)。
[0905]
(s)-9-溴-2-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(43d).于20℃下向(s)-9-溴-2-((叔丁基二甲基硅基)氧基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(43c,550mg,1.25mmol)于thf(10ml)中的溶液中一次性添加tbaf(1m,1.38 ml)。将混合物于20℃下搅拌30min。tlc(乙酸乙酯:甲醇=10:1)指示43c完全消耗且形成一个新的斑点。在减压下浓缩混合物。将残余物溶解到etoac(20ml)中,用水(7ml
×ꢀ
3)和盐水(5ml)洗涤,经na2so4干燥,过滤且浓缩,从而产生黄色油状43d,其不经进一步纯化即用于下一步骤中。1h nmr(400mhz,dmso-d6)δ8.09(d,j=1.3hz,1h),7.90 (d,j=1.5hz,1h),5.34(d,j=3.4hz,1h),4.57(d,j=3.9hz,2h),4.37-4.28(m,1h), 3.87(s,3h),3.18-2.96(m,2h),2.04-1.99(m,2h)。
[0906]
(s)-9-溴-2-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸(43e).于20℃下向 (s)-9-溴-2-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(43d,320mg, 0.984mmol)于thf(5ml)和h2o(2ml)中的溶液中一次性添加lioh.h2o(61.95mg, 1.48mmol)。在20℃下将混合物搅拌16小时。lcms显示43d完全消耗且检测到具有所需质量的一个主峰。在减压下浓缩反应混合物以去除溶剂。将残余物溶解到h2o(1ml)中且通过hcl(1m)将ph调节到4-5。过滤混合物且用h2o(0.5ml)洗涤滤饼,从而产生白色固体状43e,其不经进一步纯化即用于下一步骤中。1h nmr(400mhz,dmso-d6)δ8.05 (s,1h),7.88(s,1h),5.41-5.28(m,1h),4.56(br s,2h),4.38-4.25(m,1h),3.16-2.91(m, 2h),1.99(br s,2h)。
[0907]
(s)-9-溴-n-(4-(氯二氟甲氧基)苯基)-2-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶
ꢀ‑
7-甲酰胺(43f).于20℃下向(s)-9-溴-2-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸(43e,280mg,899.94umol)和hatu(376.40mg,989.93umol)于dmf(3ml)中的混合物中一次性添加4-(氯二氟甲氧基)苯胺(1h,209.05mg,1.08mmol)和dipea(232.62mg, 1.80mmol)。在20℃下将混合物搅拌12小时。lcms显示43e完全消耗且检测到具有所需质量的一个主峰。tlc(甲醇:二氯甲烷=10:1,rf=0.41)指示43e完全消耗且形成一个新的斑点。将混合物倾倒到etoac(20ml)中,用水(5ml
×
4)和盐水(5ml)稀释,经na2so4干燥,过滤并浓缩。通过制备型tlc(sio2,乙酸乙酯:甲醇=10:1)纯化残余物,从而产生黄色固体状43f。1h nmr(400mhz,cdcl
3-d)δ10.47(s,1h),8.25(d,j=1.1hz,1h), 7.99(d,j=1.2hz,1h),7.96-7.90(m,2h),7.36(d,j=8.9hz,2h),5.37(d,j=3.4hz, 1h),4.58(d,j=
3.8hz,2h),4.38-4.30(m,1h),3.22-2.96(m,2h),2.04-1.99(m,2h)。
[0908]
(s)-n-(4-(氯二氟甲氧基)苯基)-2-羟基-9-(嘧啶-5-基)-1,2,3,4-四氢苯并[4,5]咪唑并 [1,2-a]吡啶-7-甲酰胺(43).于20℃下在n2下向(s)-9-溴-n-(4-(氯二氟甲氧基)苯基)-2-羟基
ꢀ‑
1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺(43f,30mg,0.062mmol)和嘧啶-5-基硼酸(15.28mg,0.123mmol)于二噁烷(2ml)和h2o(0.2ml)中的混合物中一次性添加 pd(dppf)cl2(4.51mg,6.16umol)和k3po4(39.25mg,184.92umol)。将混合物加热到110℃并搅拌12小时。lcms显示43f完全消耗且检测到具有所需质量的一个主峰。tlc(乙酸乙酯:甲醇=10:1,rf=0.4)指示43f完全消耗且形成一个新的斑点。经由硅藻土垫过滤混合物。用etoac(10ml)洗涤垫且浓缩滤液,从而产生粗产物。通过制备型tlc(sio2,乙酸乙酯:甲醇=10:1)纯化残余物,从而产生黄色固体状43。[m 1]
(c
23h18
clf2n5o3)计算的质量要求m/z 486.1,lcms实验值m/z 486.1;1h nmr(400mhz,dmso-d6)δ10.44(s, 1h),9.34(s,1h),9.06(s,2h),8.37(d,j=1.6hz,1h),7.94(d,j=9.2hz,2h),7.76(d,j= 1.5hz,1h),7.37(d,j=9.0hz,2h),5.16(d,j=3.3hz,1h),4.12(br d,j=2.1hz,1h), 3.84(dd,j=3.7,11.7hz,1h),3.45(br dd,j=4.4,11.7hz,1h),3.19-2.97(m,2h), 2.02-1.92(m,2h)。
[0909]
实例44(一般程序u)
[0910]
(s)-n-(4-(氯二氟甲氧基)苯基)-3-羟基-6-(1h-吡唑-5-基)-3,4-二氢-2h-苯并[4,5]咪唑并[2,1-b][1,3]噁嗪-8-甲酰胺
[0911]
所述一般程序u提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂来制备。
[0912][0913]
(s)-3-溴-n-(4-(氯二氟甲氧基)苯基)-4-((2,3-二羟基丙基)氨基)-5-硝基苯甲酰胺 (44b).向3-溴-n-(4-(氯二氟甲氧基)苯基)-4-氟-5-硝基苯甲酰胺(24c,1.2g,2.73mmol)和 (s)-3-氨基丙烷-1,2-二醇(44a,261.16mg,2.87mmol,221.32ul)于etoh(3ml)中的混合物中添加tea(552.49mg,5.46mmol,759.96)。在25℃下将混合物搅拌12小时。lcms显示所需ms。浓缩混合物且倾倒到水中,过滤,从而产生红色固体状44b。1h nmr(400 mhz,meod-d4)δ8.53(d,j=2.1hz,1h),8.38(d,j=2.2hz,1h),7.80(d,j=9.0hz,2h), 7.28(br d,j=8.9hz,2h),3.83-3.75(m,1h),3.61-3.41(m,3h),3.26-3.22(m,1h)。
[0914]
3-溴-n-(4-(氯二氟甲氧基)苯基)-5-硝基-4-((((4s)-2-苯基-1,3-二氧戊环-4-基)甲基)氨基)苯甲酰胺(44d).于0℃下在n2下向(s)-3-溴-n-(4-(氯二氟甲氧基)苯基)-4-((2,3-二羟基丙基)氨基)-5-硝基苯甲酰胺(44b,1.2g,2.35mmol)和tsoh(40.46mg,0.235mmol)于dcm (10ml)中的混合物中添加二甲氧基甲苯(44c,1.07g,7.05mmol,1.06ml)。在25℃下将混合物搅拌12小时。tlc(石油醚:乙酸乙酯=3:1,rf=0.60)指示44b完全消耗且形成两个新的斑点。用乙酸乙酯(30ml
×
3)萃取混合物并用盐水(50ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过管柱色谱(sio2,石油醚:乙酸乙酯=100:1到3:1,rf=0.60)纯化残余物,从而产生黄色固体状44d。1h nmr(400mhz, dmso-d6)δ10.46(s,1h),10.43(s,1h),8.54(d,j=2.1hz,1h),8.47(d,j=2.1hz,1h), 8.46(d,j=2.1hz,1h),8.42(d,j=2.2hz,1h),7.89(d,j=1.3hz,2h),7.86(s,2h), 7.42-7.31(m,14h),6.75(t,j=5.7hz,1h),6.67(t,j=5.7hz,1h),5.84(s,1h),5.72(s, 1h),
4.51-4.42(m,2h),4.18(dd,j=6.6,8.4hz,1h),3.94(dd,j=5.0,8.5hz,1h),3.73 (dd,j=6.4,8.5hz,1h),3.61-3.53(m,1h),3.49-3.42(m,2h)。
[0915]
3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-((((4s)-2-苯基-1,3-二氧戊环-4-基)甲基)氨基)苯甲酰胺(44e).向3-溴-n-(4-(氯二氟甲氧基)苯基)-5-硝基-4-((((4s)-2-苯基-1,3-二氧戊环-4-基)甲基)氨基)苯甲酰胺(44d,0.7g,1.17mmol)于acoh(10ml)中的溶液中添加fe (652.86mg,11.69mmol)。将混合物于35℃下搅拌0.5hr。tlc指示44d完全消耗且形成一个新的斑点。将混合物倾倒到水中并用乙酸乙酯(10ml
×
2)萃取。将合并的有机层用饱和nahco3洗涤,用盐水(50ml
×
2)洗涤,经无水na2so4干燥,过滤且在真空中浓缩,从而产生黄色油状44e。
[0916]
7-溴-n-(4-(氯二氟甲氧基)苯基)-1-(((4s)-2-苯基-1,3-二氧戊环-4-基)甲基)-2-硫酮
ꢀ‑
2,3-二氢-1h-苯并[d]咪唑-5-甲酰胺(44f).向3-氨基-5-溴-n-(4-(氯二氟甲氧基)苯基)-4-((((4s)-2-苯基-1,3-二氧戊环-4-基)甲基)氨基)苯甲酰胺(44f,0.9g,1.58mmol)、二(咪唑-1-基)甲烷硫酮(845.96mg,4.75mmol)于thf(10ml)中的溶液添加diea(408.99mg, 3.16mmol,551.20ul)且将混合物于60℃下搅拌12小时。lcms显示所需ms。用乙酸乙酯(30ml
×
2)萃取混合物,将合并的有机层用盐水(50ml
×
2)洗涤,经无水na2so4干燥,过滤且在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯=1:1,rf=0.30)纯化残余物,从而产生黄色固体状44f。1h nmr(400mhz,dmso-d6)δ13.55(s,1h),10.53(s, 1h),8.05(dd,j=1.5,4.2hz,1h),7.92-7.85(m,2h),7.78(d,j=1.2hz,1h),7.50-7.45 (m,1h),7.42-7.33(m,6h),6.11-5.69(m,1h),5.17-4.69(m,3h),4.35-4.27(m,1h), 4.08-3.98(m,1h)。
[0917]
7-溴-n-(4-(氯二氟甲氧基)苯基)-2-(甲硫基)-1-(((4s)-2-苯基-1,3-二氧戊环-4-基)甲基)-1h-苯并[d]咪唑-5-甲酰胺(44g).向7-溴-n-(4-(氯二氟甲氧基)苯基)-1-(((4s)-2-苯基
ꢀ‑
1,3-二氧戊环-4-基)甲基)-2-硫酮-2,3-二氢-1h-苯并[d]咪唑-5-甲酰胺(44f,0.72g,1.18 mmol)于dmf(10ml)中的溶液中添加mei(184.03mg,1.30mmol,80.72ul)和k2co
3 (325.80mg,2.36mmol)。在25℃下将混合物搅拌2小时。lcms显示所需ms。用乙酸乙酯(20ml
×
3)萃取混合物。用盐水(50ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过管柱色谱(sio2,石油醚:乙酸乙酯=100:1到1:1)纯化残余物,从而产生白色固体状44g。1h nmr(400mhz,dmso-d6)δ10.44(s,1h),8.29(d,j=1.2 hz,1h),8.00(s,1h),7.97-7.90(m,2h),7.52-7.47(m,1h),7.43-7.33(m,5h),6.07-5.70 (m,1h),4.85-4.60(m,3h),4.46-3.91(m,2h),2.79-2.71(m,3h)。
[0918]
(s)-1-(2-(苄基氧基)-3-羟基丙基)-7-溴-n-(4-(氯二氟甲氧基)苯基)-2-(甲硫基)-1h-苯并[d]咪唑-5-甲酰胺(44h).于0℃下向7-溴-n-(4-(氯二氟甲氧基)苯基)-2-(甲硫基)-1-(((4s)-2-苯基-1,3-二氧戊环-4-基)甲基)-1h-苯并[d]咪唑-5-甲酰胺(44g,0.06g,0.96 mmol)、znbr2(64.87mg,0.288mmol,14.42ul)于dcm(2ml)中的溶液中添加bh
3-me2s (10m,11.52ul,1.2eq)。在25℃下将混合物搅拌12小时。lcms显示所需ms。将混合物通过饱和nahco3淬灭且用dcm(2ml
×
2)萃取。用盐水(5ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1, rf=0.40)纯化残余物,从而产生白色固体状44h。1h nmr(400mhz,dmso-d6)δ10.43 (s,1h),8.28(d,j=1.2hz,1h),7.97-7.91(m,3h),7.37(d,j=8.8hz,2h),7.09-7.04(m, 3h),6.89-6.85(m,
2h),5.00(t,j=5.6hz,1h),4.68-4.59(m,1h),4.47(d,j=12.2hz, 2h),4.13(d,j=12.2hz,1h),3.89(br dd,j=4.0,9.5hz,1h),3.67(t,j=4.9hz,2h),2.72 (s,3h)。
[0919]
(s)-3-(苄基氧基)-6-溴-n-(4-(氯二氟甲氧基)苯基)-3,4-二氢-2h-苯并[4,5]咪唑并 [2,1-b][1,3]噁嗪-8-甲酰胺(44i).于0℃下在o2下向(s)-1-(2-(苄基氧基)-3-羟基丙基)-7-溴
ꢀ‑
n-(4-(氯二氟甲氧基)苯基)-2-(甲硫基)-1h-苯并[d]咪唑-5-甲酰胺(44h,20mg,0.032 mmol)于thf(2ml)中的混合物中添加nah(1.78mg,0.045mmol,60%纯度)。在25℃下将混合物搅拌12小时。lcms显示所需ms。将混合物通过h2o淬灭且用乙酸乙酯(2ml
×ꢀ
3)萃取。用盐水(5ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1,rf=0.40)纯化残余物,从而产生白色固体状44i。
[0920]
(s)-6-溴-n-(4-(氯二氟甲氧基)苯基)-3-羟基-3,4-二氢-2h-苯并[4,5]咪唑并[2,1-b][1,3] 噁嗪-8-甲酰胺(44j).于-70℃下在n2下向(s)-3-(苄基氧基)-6-溴-n-(4-(氯二氟甲氧基)苯基)-3,4-二氢-2h-苯并[4,5]咪唑并[2,1-b][1,3]噁嗪-8-甲酰胺(44i,30mg,0.052mmol)于 dcm(2ml)中的混合物中添加bcl3(1m,259.16ul)。将混合物于-70℃下搅拌1小时。 lcms显示所需ms。将反应物用水和dcm(3ml
×
2)淬灭。将合并的有机层用盐水(5ml
ꢀ×
2)洗涤,经无水na2so4干燥,过滤且在真空中浓缩,从而产生白色固体状44j。1h nmr (400mhz,dmso-d6)δ10.42(s,1h),8.08(s,1h),7.95-7.86(m,3h),7.36(br d,j=8.8hz, 2h),4.66(br d,j=11.9hz,1h),4.58-4.49(m,2h),4.46-4.36(m,2h)。
[0921]
(s)-n-(4-(氯二氟甲氧基)苯基)-3-羟基-6-(1h-吡唑-5-基)-3,4-二氢-2h-苯并[4,5]咪唑并[2,1-b][1,3]噁嗪-8-甲酰胺(44).向(s)-6-溴-n-(4-(氯二氟甲氧基)苯基)-3-羟基-3,4-二氢
ꢀ‑
2h-苯并[4,5]咪唑并[2,1-b][1,3]噁嗪-8-甲酰胺(44j,15mg,0.031mmol)、5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1h-吡唑(17.87mg,0.092mmol)于二噁烷(2ml)、h2o (0.2ml)中的溶液中添加k3po4(19.55mg,0.092mmol)和pd(dppf)cl2(2.25mg,3.07 umol)、(boc)2o(6.70mg,0.031umol,7.05ul)。在110℃下将混合物搅拌12小时。tlc(乙酸乙酯:甲醇=10:1,rf=0.24)指示44j完全消耗且形成许多新的斑点。过滤混合物且倾倒到水中,用乙酸乙酯(5ml
×
2)萃取。用盐水(10ml
×
2)洗涤合并的有机层,经无水 na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,乙酸乙酯:甲醇=10:1)纯化残余物,从而产生黄色固体状44。1h nmr(400mhz,meod-d4)δ8.06(s,1h),7.85-7.77 (m,4h),7.28(d,j=9.0hz,2h),6.64(s,1h),4.57-4.44(m,2h),4.28(br s,1h),4.12(br d, j=13.1hz,1h),3.73(br s,1h)。
[0922]
实例45(一般程序v)
[0923]
(s)-n-(4-(氯二氟甲氧基)苯基)-4-(羟基甲基)-6-(嗒嗪-3-基)-3,4-二氢-2h-苯并[4,5]咪唑并[2,1-b][1,3]噁嗪-8-甲酰胺
[0924]
所述一般程序v提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变偶合剂来制备。
[0925][0926]
(s)-6-溴-n-(4-(氯二氟甲氧基)苯基)-4-(羟基甲基)-3,4-二氢-2h-苯并[4,5]咪唑并 [2,1-b][1,3]噁嗪-8-甲酰胺(45b)、(s)-5-溴-n-(4-(氯二氟甲氧基)苯基)-3-(2-羟基乙基)-2,3
‑ꢀ
二氢苯并[4,5]咪唑并[2,1-b]噁唑-7-甲酰胺(45c).于0℃下向(s)-7-溴-n-(4-(氯二氟甲氧基) 苯基)-1-(1,4-二羟基丁-2-基)-2-(甲硫基)-1h-苯并[d]咪唑-5-甲酰胺(以与42d类似的方式合成;45a,260mg,0.472mmol)于thf(5ml)中的溶液中添加nah(28.32mg,0.708 mmol,60%纯度)。将混合物在20℃下在o2下搅拌1hr。lcms显示45a完全消耗且检测到所需ms。tlc(乙酸乙酯:甲醇=10:1,p1:rf=0.5,p2:rf=0.4)显示反应完成。将混合物用aq.nh4cl(10ml)稀释且用etoac(20ml
×
3)萃取。将合并的有机层用盐水(10ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过硅胶色谱(石油醚/ 乙酸乙酯=5/1,0/1,乙酸乙酯:甲醇=20/1)纯化残余物,从而产生白色固体状45b和白色固体状45c。(45b)1h nmr(400mhz,meod-d4)δ7.92(d,j=1.5hz,1h),7.83-7.77(m, 2h),7.62(d,j=1.8hz,1h),7.29(d,j=9.0hz,2h),6.13-5.99(m,1h),4.22(q,j=7.6 hz,1h),4.18-4.06(m,2h),3.99(dt,j=5.1,8.0hz,1h),2.75-2.58(m,1h),2.41-2.23(m, 1h)。(45c)1h nmr(400mhz,dmso-d6)δ10.40(s,1h),8.06(d,j=1.1hz,1h), 7.98-7.85(m,3h),7.35(br d,j=9.0hz,2h),5.30-5.22(m,1h),5.15(dd,j=2.3,8.7hz, 1h),5.12-5.00(m,1h),4.68(t,j=4.8hz,1h),3.52(td,j=5.8,11.4hz,2h),2.27-2.14 (m,1h),2.09-2.00(m,1h)。
[0927]
(s)-n-(4-(氯二氟甲氧基)苯基)-4-(羟基甲基)-6-(嗒嗪-3-基)-3,4-二氢-2h-苯并[4,5]咪唑并[2,1-b][1,3]噁嗪-8-甲酰胺(45).向(s)-6-溴-n-(4-(氯二氟甲氧基)苯基)-4-(羟基甲基)-3,4-二氢-2h-苯并[4,5]咪唑并[2,1-b][1,3]噁嗪-8-甲酰胺(45b,40mg,0.08mmol)和三丁基(嗒嗪-3-基)锡烷(58.74mg,0.159mmol)于二噁烷(4ml)中的溶液中添加三叔丁基磷烷钯(4.07mg,7.96umol)。将混合物在110℃下在n2下搅拌16hr。lcms显示45b完全消耗且检测到所需ms。将反应混合物用h2o(5ml)稀释且用etoac(10ml
×
2)萃取。将合并的有机层经na2so4干燥,过滤并在减压下浓缩,从而产生残余物。通过pre-hplc(fa,管柱:菲罗门卢纳c18 200*40mm*10um;移动相:[水(0.225%fa)-acn];b%: 40%-70%,12min)进一步纯化混合物,从而产生白色固体状45。[m 1]
(c
23h18
clf2n5o4) 计算的ms质量要求m/z 502.1,lcms实验值m/z 502.1;1h nmr(400mhz,meod-d4)δ 9.35(dd,j=1.5,5.1hz,1h),8.17(dd,j=1.4,8.5hz,1h),8.01(dd,j=5.1,8.4hz,1h), 7.84-7.78(m,3h),7.76(d,j=1.8hz,1h),7.29(d,j=9.0hz,2h),4.16-3.99(m,3h), 3.91-3.82(m,1h),3.79-3.70(m,1h),2.54-2.43(m,1h),2.01(br s,1h)
[0928]
实例46
[0929]
(r)-n-(4-(氯二氟甲氧基)苯基)-4-羟基-9-(嗒嗪-3-基)-1,2,3,4-四氢苯并[4,5]咪唑并 [1,2-a]吡啶-7-甲酰胺
[0930][0931]
9-溴-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(46b).在n2下向3-氨基-5
‑ꢀ
溴-4-(哌啶-1-基)苯甲酸甲基酯(46a,1.8g,5.75mmol)于hcooh(20ml)中的混合物中添加h2o2(5.86g,51.73mmol,4.97ml,30%纯度)。将混合物于110℃下搅拌40min。lcms 显示所需ms。将混合物用饱和na2s2o3淬灭,用nahco3(ph=7)使得呈碱性且用乙酸乙酯(50ml
×
3)萃取。用盐水(100ml)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过管柱色谱(sio2,石油醚:乙酸乙酯=100:1到0:1,rf=0.20)纯化残余物,从而产生褐色固体状46b。
[0932]
4,9-二溴-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(46c).向9-溴-1,2,3,4
‑ꢀ
四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(46b,0.7g,2.26mmol)、aibn(37.18mg, 0.226umol)于ccl4(20ml)中的溶液中添加nbs(402.99mg,2.26mmol)。在50℃下将混合物搅拌12小时。lcms显示所需ms。将混合物通过h2o淬灭且用dcm(30ml
×
2)萃取。用盐水(50ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过管柱色谱(sio2,石油醚:乙酸乙酯=100:1到1:1,rf=0.50)纯化残余物,从而产生褐色固体状46c。
[0933]
9-溴-4-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(46d).向4,9-二溴
ꢀ‑
1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(46c,0.7g,1.80mmol)于mecn(5 ml)和h2o(5ml)中的溶液中添加过硫酸氢钾复合盐(2.22g,
3.61mmol)。在50℃下将混合物搅拌12小时。lcms显示所需ms。浓缩混合物,倾倒到水中且用乙酸乙酯(10ml
×ꢀ
2)萃取。用盐水(30ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过管柱色谱(sio2,石油醚:乙酸乙酯=100:1到0:1)纯化残余物,从而产生白色固体状46d。
[0934]
9-溴-4-氧代基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(46e).于0℃下向9-溴-4-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(46d,0.3g,0.922 mmol)于dcm(5ml)中的溶液中添加dmp(395.24mg,0.932mmol)。将混合物于25℃下搅拌10min。tlc(石油醚:乙酸乙酯=0:1,rf=0.50)指示46d完全消耗且形成一个新的斑点。将混合物倾倒到水中并用乙酸乙酯(3ml
×
2)萃取。用盐水(5ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1,rf=0.50)纯化残余物,从而产生褐色固体状46e。
[0935]
(r)-9-溴-4-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(46f).将二氯钌;1-异丙基-4-甲基-苯(18.00mg,29.40umol)、n-[(1r,2r)-2-氨基-1,2-二苯基-乙基]-4-甲基-苯磺酰胺(25.86mg,70.56umol)于h2o(10ml)中的溶液于70℃下搅拌1.5小时。添加 thf(5ml)中的甲酸钠(199.93mg,2.94mmol,158.68ul)、9-溴-4-氧代基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(46e,0.19g,0.588mmol)且将混合物于40℃下搅拌0.5小时。lcms显示所需ms。过滤混合物,倾倒到水中且用乙酸乙酯(10ml
×
2)萃取。用盐水(30ml
×
1)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,石油醚:乙酸乙酯=0:1,rf=0.20)纯化残余物,从而产生黄色固体状 46f。
[0936]
(r)-9-溴-4-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸(46g).向(r)-9-溴-4
‑ꢀ
羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(46f,0.06g,0.185mmol)于 meoh(0.5ml)、thf(0.5ml)和h2o(0.1ml)中的溶液中添加lioh.h2o(15.49mg,0.369 mmol)。在50℃下将混合物搅拌0.5小时。lcms显示所需ms。tlc(乙酸乙酯:甲醇=10:1, rf=0.05)且指示46f完全消耗。浓缩混合物且倾倒到aq.hcl(1m)中以调节ph=5-6。过滤沉淀且干燥,从而产生白色固体状46g。
[0937]
(r)-9-溴-n-(4-(氯二氟甲氧基)苯基)-4-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶
ꢀ‑
7-甲酰胺(46h).向(r)-9-溴-4-羟基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸(46g, 0.06g,0.193mmol)、4-[氯(二氟)甲氧基]苯胺(1h,41.06mg,0.212mmol)于dmf(2ml) 中的溶液中添加hatu(87.99mg,0.23mmol)和diea(74.77mg,0.579mmol,100.77ul)。在25℃下将混合物搅拌12小时。lcms显示所需ms。用乙酸乙酯(3ml
×
3)萃取混合物。用盐水(5ml
×
2)洗涤合并的有机层,经无水na2so4干燥,过滤并在真空中浓缩。通过制备型tlc(sio2,乙酸乙酯:甲醇=10:1,rf=0.40)纯化残余物,从而产生黄色油状46h。
[0938]
(r)-n-(4-(氯二氟甲氧基)苯基)-4-羟基-9-(嗒嗪-3-基)-1,2,3,4-四氢苯并[4,5]咪唑并 [1,2-a]吡啶-7-甲酰胺(46).向(r)-9-溴-n-(4-(氯二氟甲氧基)苯基)-4-羟基-1,2,3,4-四氢苯并 [4,5]咪唑并[1,2-a]吡啶-7-甲酰胺(46h,0.05g,0.103mmol)、三丁基(嗒嗪-3-基)锡烷(75.84 mg,0.205mmol)于二噁烷(2ml)中的溶液中添加三叔丁基磷烷钯(5.25mg,10.27umol). 在120℃下将混合物搅拌12小时。lcms显示所需ms。过滤混合物且倾
四氢苯并 [4,5]咪唑并[1,2-a]吡啶-7-甲酰胺(48).向(s)-n-(4-(氯二氟甲氧基)苯基)-4-(3-羟基-3-甲基哌啶-1-基)-3-硝基-5-(1h-吡唑-5-基)苯甲酰胺(48c,20mg,0.038mol)于acoh(1ml)中的溶液中添加fe(21.40mg,0.383mmol)。将混合物于35℃下搅拌1hr。lcms显示检测到所需ms。通过添加etoac(15ml)淬灭反应混合物。向混合物中添加nahco3(50ml)且用 etoac(10ml
×
3)萃取混合物。将合并的有机层用盐水(15ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过制备型hplc(中性条件;管柱:沃特世x 桥beh c18 100*25mm*5um;移动相:[水(10mm nh4hco3)-acn];b%:30%-45%,10min) 纯化残余物,从而产生白色固体状48。[m 1]
(c
23h20
clf2n5o3)计算的质量要求m/z 488.1,lcms实验值m/z 488.1。1h nmr(400mhz,meod-d4)δ8.25(br s,1h),7.92-7.77 (m,3h),7.29(br d,j=8.9hz,2h),6.63(br s,1h),3.91-3.65(m,2h),3.28-3.21(m,1h), 3.20-3.05(m,1h),2.14-1.94(m,2h),1.30(s,3h)。
[0950]
实例49(一般程序w)
[0951]
(1r,4r)-n-(4-(氯二氟甲氧基)苯基)-4-羟基-1-甲基-9-(1h-吡唑-5-基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺
[0952]
所述一般程序w提供如应用于标题化合物的特定合成细节。额外化合物可根据此方法通过改变胺和偶合剂来制备。
[0953][0954]
(r)-3-溴-4-(2-甲基哌啶-1-基)-5-硝基苯甲酸甲基酯(49b).向3-溴-4-氟-5-硝基苯甲酸甲基酯(1a,1000mg,3.60mmol)于dipea(4.65g,35.97mmol,6.26ml)中的溶液中且添加(2r)-2-甲基哌啶(49a,713.40mg,7.19mmol)。将混合物于40℃下搅拌16hr。lcms显示检测到所需ms。tlc(石油醚:乙酸乙酯=5:1,rf=0.60)显示生成新的主斑点。在减压下浓缩反应混合物以去除溶剂。用h2o(5ml)稀释残余物并用etoac(5ml
×
3)萃取。将合并的有机
层用盐水(5ml)洗涤,经na2so4干燥,过滤,并在减压下浓缩,从而产生残余物。通过管柱色谱(sio2,石油醚/乙酸乙酯=50/1到10/1)纯化残余物,从而产生白色固体状49b。1h nmr(400mhz,cdcl3)δ8.38(br s,1h),8.15(br s,1h),3.97-3.92(m,1h), 3.95(s,2h),3.11(br d,j=11.5hz,2h),1.76(br d,j=13.1hz,2h),1.63(br s,1h), 1.53-1.41(m,1h),1.39-1.23(m,1h),0.83(br s,3h)。
[0955]
(r)-3-氨基-5-溴-4-(2-甲基哌啶-1-基)苯甲酸甲基酯(49c).向甲基(r)-3-溴-4-(2-甲基哌啶-1-基)-5-硝基苯甲酸甲基酯(49b,0.78g,2.18mmol)于acoh(5ml)中的溶液中添加fe (1.22g,21.84mmol)。将混合物于35℃下搅拌1hr。lcms显示检测到所需ms。过滤反应混合物且在减压下浓缩,从而产生残余物。将混合物用etoac溶解并用nahco3洗涤。在减压下浓缩有机层,从而产生褐色油状49c,其未经进一步纯化即用于下一步骤中。1hnmr(400mhz,cdcl
3-d)δ=7.49(d,j=1.8hz,1h),7.32(d,j=1.8hz,1h),4.56(br s, 2h),3.88(s,3h),3.74-3.61(m,1h),3.38(dt,j=2.4,11.8hz,1h),2.74(br d,j=11.7hz, 1h),1.90-1.67(m,3h),1.66-1.38(m,3h),1.35-1.19(m,2h),0.81(d,j=6.4hz,3h)。
[0956]
(r)-9-溴-1-甲基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(49d).向甲基 (r)-3-氨基-5-溴-4-(2-甲基哌啶-1-基)苯甲酸甲基酯(49c,300mg,0.917mmol)于2,2,2-三氟乙醇(2ml)中的溶液中添加氯铱;(1z,5z)-环辛-1,5-二烯(92.38mg,0.138mmol)。将混合物于80℃下在o2气氛下搅拌4hr。lcms显示检测到所需ms。过滤反应混合物且在减压下浓缩,从而产生残余物。通过制备型hplc(中性条件;管柱:沃特世x桥prep obdc18 150*40mm*10um;移动相:[水(10mm nh4hco3)-acn];b%:30%-65%,8min)纯化残余物,从而产生褐色固体状49d。1h nmr(400mhz,cdcl
3-d)δ8.29(d,j=1.3hz, 1h),8.10(d,j=1.3hz,1h),5.45(br t,j=6.2hz,1h),3.95(s,3h),3.27(br dd,j=5.0, 17.3hz,1h),3.01(ddd,j=6.4,11.2,17.9hz,1h),2.28-2.06(m,3h),2.03(s,1h),1.52(d, j=6.6hz,3h)。
[0957]
(1r)-4,9-二溴-1-甲基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(49e).向 (r)-9-溴-1-甲基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(49d,30mg,0.093 mmol)于ccl4(1ml)中的溶液中添加nbs(16.52mg,0.093mmol)和aibn(1.52mg, 0.0093mmol)。在50℃下将混合物搅拌12hr。tlc(石油醚:乙酸乙酯=0:1,rf=0.7)显示形成具有低极性的新的斑点。添加aibn(5.33mg,0.032mmol)和nbs(8.26mg,0.046 mmol)。在50℃下将混合物搅拌12hr。lcms显示检测到所需ms。tlc(乙酸乙酯:石油醚=2:1,rf=0.58)显示形成新的斑点。在减压下浓缩反应混合物以去除溶剂。通过制备型 tlc(sio2,乙酸乙酯:石油醚=2:1,rf=0.58)纯化残余物,从而产生白色固体状49e。1hnmr(400mhz,meod-d4)δ8.27(d,j=1.3hz,1h),8.15(d,j=1.3hz,1h),5.76(br s, 1h),5.66-5.54(m,1h),3.95(s,3h),2.89-2.68(m,2h),2.37(br d,j=15.4hz,1h),2.07(brd,j=13.8hz,1h),1.66(d,j=6.5hz,1h),1.50(d,j=6.6hz,3h)。
[0958]
(1r,4r)-9-溴-4-羟基-1-甲基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯 (49f).(1r,4s)-9-溴-4-羟基-1-甲基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯 (49g).向(1r)-4,9-二溴-1-甲基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(49e, 40mg,0.099mmol)于mecn(2ml)和h2o(2ml)中的溶液中添加过硫酸氢钾复合盐(183.48mg,0.298mmol)。将混合物于50℃下搅拌16hr。lcms显示检
测到所需ms。tlc (石油醚:乙酸乙酯=1:2rf=0.40)显示形成新的斑点。在减压下浓缩反应混合物以去除溶剂。通过制备型hplc(fa条件;管柱:菲罗门卢纳c18 100*30mm*5um;移动相:[水 (0.2%fa)-acn];b%:15%-45%,10min)纯化残余物,从而产生白色固体状49f和白色固体状49g。(49f)1h nmr(400mhz,meod-d4)δ8.29(d,j=1.3hz,1h),8.12(d,j=1.3hz, 1h),5.54-5.43(m,1h),5.01(br s,1h),4.61(br s,1h),3.94(s,3h),2.72-2.58(m,1h),2.35 (tt,j=3.5,14.4hz,1h),2.07(br dd,j=2.6,14.6hz,1h),1.92(br d,j=14.6hz,1h), 1.50(d,j=6.4hz,3h)。(49g)1h nmr(400mhz,meod-d4)δ8.28(s,1h),8.09(s,1h), 5.48-5.37(m,1h),4.93(br s,2h),3.93(s,3h),2.44-2.23(m,2h),2.19-2.03(m,2h),1.55 (d,j=6.6hz,3h)。
[0959]
(1r,4r)-9-溴-4-羟基-1-甲基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸(49h).向 (1r,4r)-9-溴-4-羟基-1-甲基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酸甲基酯(49f, 15mg,0.044mmol)于meoh(1ml)、thf(1ml)和h2o(1ml)中的溶液中添加lioh.h2o (2.78mg,0.066mmol)。将混合物于15℃下搅拌16hr。tlc(石油醚:乙酸乙酯=0:1)显示 49f剩余且形成新的斑点。向反应混合物中添加lioh.h2o(927.89ug,0.022mmol)。将混合物于15℃下搅拌16hr。lcms显示检测到所需ms。用hcl水溶液(1m)将混合物调节到 ph=4且浓缩,从而产生白色固体状49h,其不经进一步纯化即用于下一步骤中。1h nmr (400mhz,meod-d4)δ8.40(d,j=1.1hz,2h),5.67(br t,j=4.9hz,1h),5.20(br d,j= 3.2hz,1h),2.71-2.40(m,2h),2.18-1.99(m,2h),1.67(d,j=6.6hz,3h)。
[0960]
(1r,4r)-9-溴-n-(4-(氯二氟甲氧基)苯基)-4-羟基-1-甲基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺(49i).向(1r,4r)-9-溴-4-羟基-1-甲基-1,2,3,4-四氢苯并[4,5]咪唑并 [1,2-a]吡啶-7-甲酸(49h,10mg,0.031mmol)、4-[氯(二氟)甲氧基]苯胺(1h,7.14mg,0.037 mmol)于dmf(1ml)中的溶液中添加hatu(14.03mg,0.037mmol)和diea(11.92mg, 0.092mmol,16.07ul)。将混合物于15℃下搅拌5hr。lcms显示检测到所需ms。tlc(乙酸乙酯:甲醇=10:1,rf=0.40)显示形成新的斑点。在减压下浓缩反应混合物以去除溶剂。用h2o(10ml)稀释残余物并用etaoc(10ml
×
3)萃取。用盐水洗涤合并的有机层,经na2so4干燥,过滤并在减压下浓缩,从而产生残余物。通过制备型tlc(sio2,乙酸乙酯:甲醇=10:1)纯化残余物,从而产生白色固体状49i。1h nmr(400mhz,cdcl
3-d)δ8.09 (d,j=1.3hz,1h),8.00(d,j=1.3hz,1h),7.71(d,j=8.9hz,2h),7.25(s,1h),5.46(br t, j=5.8hz,1h),5.18(br s,1h),2.76-2.60(m,1h),2.39-2.17(m,2h),1.96-1.86(m,1h), 1.53(d,j=6.6hz,3h)。
[0961]
(1r,4r)-n-(4-(氯二氟甲氧基)苯基)-4-羟基-1-甲基-9-(1h-吡唑-5-基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺(49).将(1r,4r)-9-溴-n-(4-(氯二氟甲氧基)苯基)-4-羟基-1-甲基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡啶-7-甲酰胺(48i,8mg,0.016mmol)、 5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1h-吡唑(9.30mg,0.048mmol)、k3po
4 (10.17mg,0.048mmol)、pd(dppf)cl2(1.17mg,1.60umol)于二噁烷(2ml)和h2o(0.2ml) 中的混合物脱气且用n2吹扫3次。将混合物于120℃下在n2气氛下搅拌16hr。lcms显示检测到所需ms。在减压下浓缩反应混合物以去除溶剂。通过制备型hplc(中性条件;管柱:沃特世x桥beh c18 100*30mm*10um;移动相:[水(10mm nh4hco3)-acn];b%: 35%-55%,10min)纯化残余物,从而产生白色固体状49。[m 1]
(c
23h20
clf2n5o3)计算
的质量要求m/z 488.1,lcms实验值m/z 488.1。1h nmr(400mhz,meod-d4)δ8.34(br s, 1h),7.94(s,1h),7.85(d,j=8.9hz,3h),7.30(d,j=8.8hz,2h),6.69(br s,1h), 5.14-4.94(m,2h),2.75-2.55(m,1h),2.25(br t,j=14.2hz,1h),2.04(br d,j=11.9hz, 1h),1.73(br d,j=13.8hz,1h),0.88(br d,j=6.2hz,3h)。
[0962]
下表(表1)中的化合物是且可遵循上述程序类似地制得。
[0963]
表1
[0964]
[0965]
[0966]
[0967]
[0968]
[0969]
[0970]
[0971]
[0972]
[0973]
[0974]
[0975]
[0976]
[0977]
[0978]
[0979]
[0980]
[0981]
[0982]
[0983]
[0984]
[0985]
[0986]
[0987]
[0988]
[0989]
[0990]
[0991]
[0992]
[0993]
[0994]
[0995]
[0996]
[0997]
[0998]
[0999]
[1000]
[1001]
[1002]
[1003]
[1004]
[1005]
[1006]
[1007]
[1008]
[1009]
[1010]
[1011]
[1012]
[1013]
[1014]
[1015]
[1016]
[1017]
[1018]
[1019]
[1020]
[1021]
[1022]
[1023]
[1024]
[1025][1026]
*表2中报告的化合物(其立体化学在表1中标注为任意地分配)的生物数据可通过参考相应的1h核磁共振数据与表1的适当化合物相关联。因此,与给定的1h nmr和生物数据集相关联的化合物可能具有与立体化学在表1中标注为任意地分配的化合物相同的绝对立体化学或不同的绝对立体化学。
[1027]
生物实例
[1028]
生物分析
[1029]
abl1生物化学激酶分析
[1030]
通过与sf9昆虫细胞中的yoph共表达产生含有n-末端his标签的abl1 wt蛋白 (64-515aa)。通过离心收获细胞且重新悬浮于50mm tris、500mm nacl、5mmβ-me(ph 8.2)中。通过超声波处理溶解细胞且通过离心澄清。通过亲和色谱使用具有4%洗涤缓冲液(50mm tris、500mm nacl、500mm咪唑、5mmβ-me,ph 8.2)中的洗涤步骤且以相同缓冲液的线性梯度洗脱的histrap管柱纯化abl1。汇集含有abl1的部分,浓缩且使用经50mm tris(ph 8.3)洗涤且用洗脱缓冲液(50mm tris、1m nacl,ph 8.3)的线性梯度洗脱的离子交换管柱进一步纯化。将纯化蛋白于-80℃下在50mm tris(ph 8.2)、300mmnacl、1mm dtt和20%甘油中储存。
[1031]
使用ez读取器微流体迁移率变动分析(珀金斯默(perkinelmer),沃尔瑟姆
(waltham), 马萨诸塞州(ma))测试酶和化合物抑制的活性。对于抑制研究来说,使用11点3倍格式将化合物从1000μm最高化合物浓度在dmso中连续稀释。使用声学转移系统(艾克(echo) 550)将20nl/孔的连续稀释的化合物转移到格雷纳(greiner)聚丙烯平底384孔分析板。向每一孔中添加15μl含有荧光肽、酶、缓冲液、辅因子和清洁剂的反应混合物且于室温(rt) 下培育30分钟。然后添加5μl/孔的atp溶液且实施反应90分钟,之后用70μl含有500mmedta的停止缓冲液淬灭。在ez读取器(珀金斯默,沃尔瑟姆,马萨诸塞州)上使用迁移率变动读出读取反应。每一反应中的最终浓度是1.5μm fl-肽2(珀金斯默,沃尔瑟姆,马萨诸塞州)、1nm abl1 wt(64-515aa)酶、50mm hepes(ph 7.5)、1mm egta、2mmdtt、0.05%bsa、10mm mgcl2、0.01%triton-x100和20μm atp。最终dmso浓度是 0.1%且最终抑制剂浓度范围为1000nm到0.017nm。一式两份地测试每一化合物且使用 ic
50
回归曲线拟合使用graphpad prism分析抑制剂剂量反应曲线。
[1032]
abl1 k562分析
[1033]
使用细胞效价格鲁(cell titer glo)分析(ctg,普洛麦格(promega))测试化合物活性。将k562细胞(慢性骨髓性白血病)维持于imdm 10%fbs中。在测试化合物活性之前一天,将800个k562细胞/孔以16k个细胞/ml平铺于培养基中且于37℃、5%co2下培育过夜。使用9点3倍格式将化合物从2000nm最高化合物浓度在imdm 10%fbs中连续稀释。dmso浓度于0.4%下保持恒定。将50μl/孔的连续稀释的化合物转移到含有k562细胞的板且于37℃、5%co2下培育72h(最终dmso浓度为0.2%)。72h后,将板和ctg试剂平衡到室温并保持30分钟,之后添加25μl/孔的ctg试剂。将板振荡2分钟且然后于室温下培育10分钟。在恩韦仁(envision)发光读取器(珀金斯默,沃尔瑟姆,马萨诸塞州)上读取反应。一式两份地测试每一化合物且使用ic
50
回归曲线拟合使用graphpad prism分析抑制剂剂量反应曲线。
[1034]
结果于下表2中制表。
[1035]
表2
[1036]
[1037]
[1038]
[1039]
[1040]
[1041]
[1042]
[1043][1044]
nd=未测定
[1045]
kcl-22异种移植物模型-双药剂治疗中的活体内效能
[1046]
向6-8周龄雌性裸小鼠的右背部腋窝区中皮下植入2
×
106个于50%基质胶(bd生物科学(biosciences))中的kcl-22细胞。在肿瘤体积达到189mm3的平均值时(肿瘤植入后
约9天),起始药物治疗。每周制备于磷酸盐缓冲盐水溶液中的本文提供的化合物且通过经口胃管灌食以约25-35mg/kg每日两次投用,并且尼罗替尼溶液以75mg/kg每日两次投用。动物接受单独药剂或同时二者的组合。通过每周两次数字卡尺测量测定肿瘤体积且其计算为长度
×
宽度2/2。经单独尼罗替尼治疗的动物在4周每日治疗后可实现肿瘤消退,并且肿瘤可复发,例如,其后达到》500mm3。具有尼罗替尼抗性肿瘤的动物然后接受本文提供的化合物的每日治疗,并且监测其肿瘤反应。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。