1.本发明属于组织工程技术领域,更具体涉及一种类痤疮表型的体外重组表皮模型的构建方法;还涉及通过该方法构建的类痤疮表型的体外重组表皮模型以及使用该模型的化妆品祛痘功效的评估方法。
背景技术:
2.痤疮(acne)是侵犯毛囊皮脂腺单元的一种疾病,主要见于青春期人群,好发于皮脂腺丰富部位,如:面、胸及背部,临床上主要表现为囊肿、粉刺、丘疹、结节、脓疱及瘢痕等。部分患者在痊愈后其皮损部位会有瘢痕遗留,对面部美观影响较大。有关调查表明,在12~30岁人群中约有80%有过不同程度的痤疮。
3.在正常的代谢过程中,毛囊皮脂腺导管上皮细胞脱屑,皮脂腺分泌皮脂,皮脂腺携带脱屑从毛囊口排除,其中毛囊可以寄生大量的皮肤正常菌群,例如痤疮丙酸杆菌、需氧葡萄球菌等。不正常的因素导致的性激素紊乱和皮脂腺痤疮丙酸杆菌的大量繁殖、皮脂腺导管的异常角化、皮脂的大量分泌导致了痤疮的产生。
4.痤疮的发病原因包括毛囊角化过度、皮脂腺紊乱、皮肤表面微生物过度生长和急慢性炎症。其中痤疮丙酸杆菌与以上因素的产生高度相关。(1)痤疮通常以微粉刺开始,由漏斗部过度角化产生,其大小和颗粒层数增加。角质细胞过度增生会引起皮脂腺导管上皮细胞层不断增厚、管径变小、通畅度减弱,最终导致毛囊皮脂腺导管急性闭塞,毛囊隆起而形成粉刺。微粉刺演变成开放或封闭的粉刺。而角化过度的诱发因素则包括雄激素、il-1和皮脂成分的改变
1.。(2)当毛囊通道被痤疮丙酸杆菌定植,通过toll样受体发展和刺激细胞因子产生,导致炎症性病变。炎症因子中il-1的产生会加剧漏斗部的过度角化,而il-8是一种中性粒细胞趋化因子,可将中性粒细胞吸引到滤泡壁中。一旦毛囊壁破裂,就会产生皮下硬结、瘢痕和瘢痕疙瘩的肉芽肿性病变
2.。(3)在痤疮形成的过程中,雄激素导致皮脂腺紊乱造成油脂分泌异常,过度的油脂分泌为痤疮丙酸杆菌提供厌氧环境和营养物质,痤疮丙酸杆菌通过水解甘油三酯为甘油和游离脂肪酸,而这些脂质代谢物会加剧炎症和过度角化的反应。
5.根据以上机制,目前针对痤疮的产品主要集中在控油、抑菌、剥脱角质和抗炎四个方面。大量宣称“祛痘”功效的产品属于化妆品类,根据2015年发布的《化妆品监督管理条例》修订草案送审稿中
3.,明确提出“化妆品的功效宣称应当有充分的科学依据。并且2021年《化妆品功效宣称评价规范》的公告
4.,明确指出对“祛痘”类产品宣称需要人体功效评价试验。但是,由于直接进行临床实验由于实验周期及安全性等问题的限制,实现比较困难,因此在进行临床试验之前,需要设计合理的实验模型进行初步效果实验。由于痤疮发病机制的复杂性,目前国内外对“治疗痤疮”的原料和产品筛选主要是通过单一因素进行实验:(1)痤疮丙酸杆菌的体外抑菌实验;(2)基于皮脂腺细胞的控油实验;(3)基于角质形成细胞或免疫细胞的抗炎实验;(4)基于角质形成细胞的过度增殖实验。现有的实验模型检测体系通常是以细胞为模型,检测的是痤疮的单一性因素,无法进行综合性评判,并且通过细胞作
为检测模型存在结果存在一定的误差性。
6.利用组织工程技术开发出皮肤替代物通过造模后,具有与人体相似的结构特点,因此可作为良好的检测模型。然而,如今市面上仍缺乏一套综合化、标准化和稳定化的痤疮体外检测模型。因此,基于痤疮发病机制建立体外类痤疮表型的体外重组表皮模型,并基于该模型进行产品安全和功效的体外评价方式是必要的。
7.参考文献:
8.[1]kurokawa i,danby f w,ju q,et al.new developments in our understanding of acne pathogenesis and treatment[j].experimental dermatology,2009.
[0009]
[2]cong t x,hao d,wen x,et al.from pathogenesis of acne vulgaris to anti-acne agents[j].archives of dermatological research,2019,311(5):337-349.
[0010]
[3]《化妆品监督管理条例》
[0011]
[4]《化妆品功效宣称评价规范》
技术实现要素:
[0012]
针对现有技术的上述缺陷和问题,本发明基于组织工程技术开发了一种类痤疮表型的体外重组表皮模型,从而可用于化妆品祛痘功效的评估。
[0013]
本发明第一方面提供了一种类痤疮表型的体外重组表皮模型的构建方法,所述构建方法包括以下步骤:
[0014]
步骤(1):表皮细胞的准备;
[0015]
取原代角质形成细胞,复苏扩增后,使用p3~p7代细胞,用消化液消化,制成单细胞悬液,按照1.0
×
105~5
×
105个/ml的细胞密度,接种于培养瓶中培养;
[0016]
步骤(2):表皮细胞的液下培养;
[0017]
取步骤(1)得到的对数生长期的表皮细胞,用细胞培养液ⅰ制成细胞密度为1.25
×
106~2.5
×
106个/ml的表皮细胞悬浮液,取适量接种到含有聚碳酸酯滤膜的细胞培养小室中,培养0.3~2小时;然后将细胞培养小室置于培养皿内,每只培养皿添加细胞培养液ⅰ,继续培养1~3天;
[0018]
步骤(3):体外重组表皮模型的构建;
[0019]
将所述步骤(2)中的细胞培养小室内的培养液弃掉,将培养皿内的培养液更换为细胞培养液ⅱ,向培养皿内添加细胞培养液ⅱ使液面与细胞培养小室内细胞上表面位于同一水平线,进行气液面培养,培养时间为5~9天;
[0020]
步骤(4):将痤疮丙酸杆菌定植于体外重组表皮模型;
[0021]
将痤疮丙酸杆菌以2.0
×
107~2.0
×
109个/ml密度接种于步骤(3)获得的体外重组表皮模型表面,继续进行气液面培养24-72小时。优选地,该方法还包括在向重组表皮模型接种痤疮丙酸杆菌之前和之后的特定时间点检测培养基中细胞因子,例如tnf-α、il-8的分泌。
[0022]
可选地,所述消化液为浓度2.0%-3.0%的胰酶消化液。
[0023]
可选地,所述步骤(1)中用mcdb153培养基制成单细胞悬液。
[0024]
可选地,所述细胞培养液ⅰ是以mcdb153为基础培养基,添加胰岛素0.5~5μg/ml,
异丙肾上腺素0.1~1μm,氢化可的松0.02~0.2μg/ml,表皮生长因子1~10ng/ml,腺嘌呤10~50μg/ml,转铁蛋白5~12μg/ml,l-肉碱0.001~0.1mm和氯化钙0.03~0.2mm配制的。
[0025]
可选地,所述细胞培养液ⅱ是以mcdb153为基础培养基,添加胰岛素0.5~5μg/ml,异丙肾上腺素0.1~1μm,表皮生长因子1~10ng/ml,腺嘌呤10~50μg/ml,转铁蛋白5~12μg/ml,l-肉碱0.001~0.1mm,l-丝氨酸0.01~0.1mm,棕榈酸0.01~0.05mm,油酸0.01~0.05mm,精氨琥珀酸0.05~0.1mm,氯化钙1.0~1.5mm,角质细胞生长因子1~10ng/ml和粒细胞集落刺激因子10~20ng/ml配制的。
[0026]
可选地,所述步骤(3)中气液面培养的培养时间为6-8天;优选地,培养时间为6天。
[0027]
可选地,所述步骤(4)中将痤疮丙酸杆菌以2.0
×
108个/ml密度接种于步骤(3)获得的体外重组表皮模型表面。
[0028]
可选地,所述步骤(4)中继续进行气液面培养48小时。
[0029]
本发明的发明人经过大量实验,筛选出步骤(3)气液面培养时间6天、步骤(4)中痤疮丙酸杆菌以2.0
×
108个/ml密度接种,以及继续进行气液面培养48小时为优选条件。在步骤(3)气液面培养时间6天的条件下,构建的重组皮肤表皮模型最适合痤疮丙酸杆菌接种与定植,便于观察组织形态学变化,并不会造成其他不良现象。发明人还发现,采用2.0
×
108个/ml密度接种痤疮丙酸杆菌得到的结果最优,浓度低,结果较不理想;浓度高,会产生染菌现象。对于痤疮丙酸杆菌造模时间,发明人发现孵育48小时产生的细胞因子量相对于空白已具有显著的提高,组织形态学也出现明显变化。基于此,综合考虑将以上条件确定为本发明的优选条件。
[0030]
本发明另一方面还提供了一种类痤疮表型的体外重组表皮模型,其特征在于,所述模型通过上述构建方法构建而成。
[0031]
本发明另一方面还提供了一种化妆品祛痘功效的评估方法,其特征在于,所述方法使用上述体外重组表皮模型实现。具体地,该评估方法通过将待测化妆品施用于本发明的类痤疮重组表皮模型,并检测相应细胞因子,例如tnf-α、il-8分泌的变化来验证待测化妆品的祛痘功效。
[0032]
本发明提供的类痤疮体外重组表皮模型的构建方法,兼并了体外抑菌作用和细胞抗炎作用两种检测模型基础上,还可通过形态学直观表征“过度角化”现象。此外,体外检测的方式容易实现标准化和稳定化,可以避免种属差异和个体差异,同时提高检测效率。此外本发明提供的类痤疮体外重组表皮模型,不仅能够检测水溶性的原料和成品,对于不可溶解的油状、膏状成品类产品也可提供检测。
附图说明
[0033]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
[0034]
图1为实施例2构建的重组表皮模型的炎症因子il-8检测结果。
[0035]
图2为实施例3构建的重组表皮模型的炎症因子il-8检测结果。
[0036]
图3为实施例3构建的重组表皮模型的炎症因子tnf-α检测结果。
[0037]
图4为实施例3构建的重组表皮模型痤疮丙酸杆菌刺激后h&e结果图。
具体实施方式
[0038]
下面结合实施例进一步说明本发明,应当理解,实施例仅用于进一步说明和阐释本发明,并非用于限制本发明。
[0039]
除非另外定义,本说明书中有关技术术语和科学术语与本领域内的技术人员所通常理解的意思相同。虽然在实验或实际应用中可以应用与此间所述相似或相同的方法和材料,本文还是在下文中对材料和方法做了描述。在相冲突的情况下,以本说明书包括其中的定义为准。另外,材料、方法和例子仅供说明,而不具限制性。
[0040]
以下实施例中所使用的mcdb153培养基、胰岛素、氢化可的松、表皮生长因子、腺嘌呤、转铁蛋白、l-肉碱、l-丝氨酸、棕榈酸、油酸、精氨琥珀酸、氯化钙和粒细胞集落刺激因子购自sigma,胰酶消化液购自gibco,异丙肾上腺素购自上海和丰制药,角质细胞生长因子购自peprotech,pbs购自博士德。本发明实施例中所采用的试验方法、检测方法和常规实验试剂配制方法,如无特别说明,均按照本领域常规操作。
[0041]
原代角质形成细胞获取参考专利cn1253558c中所公开的的制备方法进行制备。具体方法如下:将人皮肤组织用含抗菌素的pbs缓冲液清洗;置蛋白酶液中消化;剥离表皮与真皮层;收集表皮皮片,置质量比为0.025%的edta-胰酶消化液中,37℃、5%co2培养箱中消化10min,消化完成后,加入0.1的胎牛血清的dmem培养终止消化终止,后过200目网筛,800rpm离心6min,稍加吹打,过滤后收集表皮细胞悬液,离心弃上清,加入新鲜培养液,重悬细胞,计数板计数。用表皮细胞培养液按照3e6/瓶接种一瓶,后续待用。
[0042]
实施例1类痤疮的体外重组表皮模型的构建方法
[0043]
步骤一、表皮细胞的准备
[0044]
取原代角质形成细胞,复苏扩增后,使用p7代细胞,用2.5%胰酶(100mlpbs,2.5g胰酶)消化液消化,用mcdb153培养基制成单细胞悬液,按照2.25
×
105个/ml的密度,接种于培养瓶中,置于37℃、5%co2条件下培养。
[0045]
步骤二、表皮细胞的液下培养
[0046]
取对数生长期细胞,用细胞培养液ⅰ制成细胞密度为2.0
×
106个/ml的表皮细胞悬浮液,取200μl接种到含有聚碳酸酯滤膜的细胞培养小室(thermo,货号140620,下同)中,置于37℃、5%co2条件下培养1小时;后将小室置于模型培养皿内,每皿添加70ml细胞培养液ⅰ,37℃、5%co2条件下继续培养2天,每天换液,实现表皮细胞的液下培养。
[0047]
所使用的细胞培养液ⅰ以mcdb153为基础培养基,添加胰岛素2.5μg/ml,异丙肾上腺素0.5μm,氢化可的松0.1μg/ml,表皮生长因子5ng/ml,腺嘌呤25μg/ml,转铁蛋白8μg/ml,l-肉碱0.05mm以及氯化钙0.1mm。
[0048]
步骤三、表皮细胞增殖与分化调控
[0049]
将上述步骤二中的细胞培养小室内的培养液弃掉,更换模型培养皿内的培养液为细胞培养液ⅱ,添加量为每只培养皿70ml,使液面与细胞培养小室内细胞上表面位于同一水平线,进行气液面培养,培养时间为3天,培养周期较短,仅形成微弱的一层角质结构。培养期间每天换液,培养结束,重组皮肤表皮模型构建完成。
[0050]
细胞培养液ⅱ以mcdb153为基础培养基,添加胰岛素2.5μg/ml,异丙肾上腺素0.5μm,氢化可的松0.1μg/ml,表皮生长因子5ng/ml,腺嘌呤25μg/ml,转铁蛋白8μg/ml,l-肉碱0.05mm,l-丝氨酸0.05mm,棕榈酸0.025mm,油酸0.025mm,精氨琥珀酸0.075mm,氯化钙
1.25mm,角质细胞生长因子5ng/ml,粒细胞集落刺激因子15ng/ml配置而成。
[0051]
步骤四、类痤疮的重组表皮模型的构建
[0052]
本发明的类痤疮的体外重组表皮模型构建方法中,选择采用痤疮丙酸杆菌(atcc6919)作为刺激物,接种于重组表皮模型表面。痤疮丙酸杆菌是痤疮发生过程中的关键因素,通过与细胞接触诱发炎症反应,导致炎症性病变,且炎症反应会造成皮肤角化异常现象。在本发明中,通过炎症因子检测和形态学检测,可更好地评价痤疮杆菌对皮肤模型的接种和刺激效果。
[0053]
将构建好的重组皮肤表皮模型转移至六孔板中,六孔板的每孔内预先添加3.7ml细胞培养液ⅱ,将模型固定于支架上,实现气液面培养。根据该模型的实际情况选择痤疮丙酸杆菌终浓度和后孵育时间。痤疮丙酸杆菌终浓度为1.0
×
106cfu/每个模型,重复3组。将菌液均匀涂抹于模型表面,置于37℃,5%co2孵箱中后孵育72小时。每天换液,同步收集上清液进行炎症因子检测。
[0054]
以上实验过程得到痤疮丙酸杆菌刺激后的体外重组表皮模型。对其分别进行炎症因子elisa检测和形态学检测,观察每一试验组所得到的表皮模型的形态和生化指标。
[0055]
由于本实施例方法中步骤3培养时间为3天,培养周期较短,培养获得的皮肤模型仅形成微弱的一层角质结构,不适合痤疮丙酸杆菌接种与定植。经实验验证,通过该方法构建的类痤疮皮肤模型效果较差,在炎症因子和形态学检测方面结果都不理想。
[0056]
实施例2类痤疮重组表皮模型的构建方法
[0057]
步骤一、表皮细胞的准备
[0058]
取原代角质形成细胞,复苏扩增后,使用p7代细胞,用2.5%胰酶(100mlpbs,2.5g胰酶)消化液消化,用mcdb153培养基制成单细胞悬液,按照2.5
×
105个/ml的密度,接种于培养瓶中,置于37℃、5%co2条件下培养。
[0059]
步骤二、表皮细胞的液下培养
[0060]
取对数生长期细胞,用细胞培养液ⅰ制成细胞密度为2.5
×
106个/ml的表皮细胞悬浮液,取200μl接种到含有聚碳酸酯滤膜的细胞培养小室中,置于37℃、5%co2条件下培养0.5小时;后将小室置于模型培养皿内,每皿添加70ml细胞培养液ⅰ,37℃、5%co2条件下继续培养2天,每天换液,实现表皮细胞的液下培养。
[0061]
所使用的细胞培养液ⅰ以mcdb153为基础培养基,添加胰岛素2.5μg/ml,异丙肾上腺素0.5μm,氢化可的松0.1μg/ml,表皮生长因子5ng/ml,腺嘌呤25μg/ml,转铁蛋白8μg/ml,l-肉碱0.05mm以及氯化钙0.1mm。
[0062]
步骤三、表皮细胞增殖与分化调控
[0063]
将上述步骤二中的细胞培养小室内的培养液弃掉,更换模型培养皿内的培养液为细胞培养液ⅱ,添加量为每只培养皿70ml,使液面与细胞培养小室内细胞上表面位于同一水平线,进行气液面培养,培养时间为8天,培养周期较长,可形成正常完整的角质层。培养期间每天换液,培养结束,类痤疮重组皮肤表皮模型构建完成。
[0064]
细胞培养液ⅱ以mcdb153为基础培养基,添加胰岛素2.5μg/ml,异丙肾上腺素0.5μm,氢化可的松0.1μg/ml,表皮生长因子5ng/ml,腺嘌呤25μg/ml,转铁蛋白8μg/ml,l-肉碱0.05mm,l-丝氨酸0.05mm,棕榈酸0.025mm,油酸0.025mm,精氨琥珀酸0.075mm,氯化钙1.25mm,角质细胞生长因子5ng/ml,粒细胞集落刺激因子15ng/ml配置而成。
[0065]
步骤四、类痤疮的重组表皮模型的构建
[0066]
为了成功构建模型,首先进行痤疮丙酸杆菌造模浓度筛选。
[0067]
将构建好的重组皮肤表皮模型转移至六孔板中,六孔板的每孔内预先添加3.7ml细胞培养液ⅱ,将模型固定于支架上,实现气液面培养。对痤疮丙酸杆菌浓度进行梯度设置,将实验分为3组,每组3个平行模型。由于本实验培养时间较长,得到的皮肤模型较强,所以可尝试向上提高痤疮丙酸杆菌浓度进行筛选。采用的痤疮丙酸杆菌终浓度分别为2.0
×
106、2.0
×
107、2.0
×
108cfu/每个模型。将菌液均匀涂抹于模型表面,置于37℃,5%co2孵箱中后孵育72小时。对照组的皮肤模型不添加痤疮丙酸杆菌,其余操作与实验组一致。每天换液,同步收集上清液进行炎症因子检测。
[0068]
以上实验过程得到采用不同浓度的痤疮丙酸杆菌刺激后的体外重组表皮模型,分别进行炎症因子elisa检测和形态学检测,观察每一试验组所得到的表皮模型的形态和生化指标。
[0069]
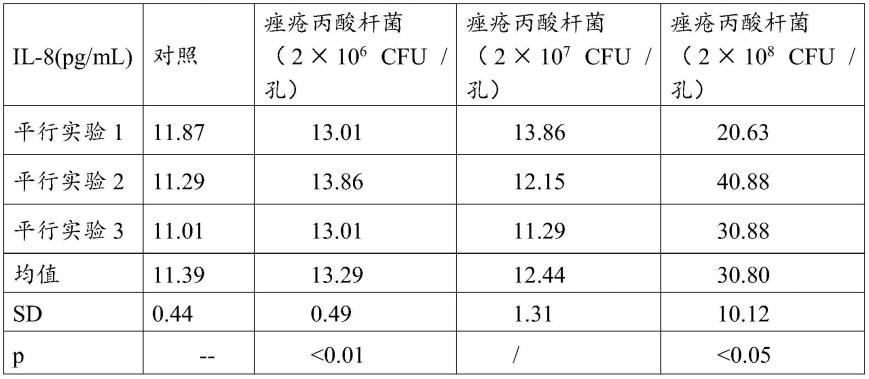
检测il-8分泌情况:收集三种浓度痤疮丙酸杆菌孵育72h后的培养基检测炎症因子的分泌量。实验结果如表1所示。
[0070]
表1:不同浓度痤疮丙酸杆菌刺激表皮模型elisa检测il-8分泌情况
[0071][0072]
表1中的结果表示为mean
±
sd,p《0.05被认为具有显著性差异,**p《0.01表示极显著差异。将实验结果应用graphpadprism5.0软件进行作图,得到图1。
[0073]
根据表1实验结果可见,使用2
×
106cfu/孔和2
×
107cfu/孔的痤疮丙酸杆菌刺激气液面培养8天的表皮模型并未出现较为严重的炎症损伤。使用2
×
108/孔的痤疮丙酸杆菌刺激气液面培养8天的表皮模型则出现明显的炎症损伤(p《0.05)。根据此案例推断,菌落浓度对表皮模型的刺激较为重要,因此之后菌落浓度采用2
×
108cfu/孔。
[0074]
实施例3类痤疮重组表皮模型的构建方法
[0075]
步骤一、表皮细胞的准备
[0076]
取原代角质形成细胞,复苏扩增后,使用p7代细胞,用2.5%胰酶(100mlpbs,2.5g胰酶)消化液消化,用mcdb153培养基制成单细胞悬液,按照2.5
×
105个/ml的密度,接种于培养瓶中,置于37℃、5%co2条件下培养。
[0077]
步骤二、表皮细胞的液下培养
[0078]
取对数生长期细胞,用细胞培养液ⅰ制成细胞密度为2.5
×
106个/ml的表皮细胞悬
浮液,取200μl接种到含有聚碳酸酯滤膜的细胞培养小室中,置于37℃、5%co2条件下培养0.5小时;后将小室置于模型培养皿内,每皿添加70ml细胞培养液ⅰ,37℃、5%co2条件下继续培养2天,每天换液,实现表皮细胞的液下培养。
[0079]
所使用的细胞培养液ⅰ以mcdb153为基础培养基,添加胰岛素2.5μg/ml,异丙肾上腺素0.5μm,氢化可的松0.1μg/ml,表皮生长因子5ng/ml,腺嘌呤25μg/ml,转铁蛋白8μg/ml,l-肉碱0.05mm以及氯化钙0.1mm。
[0080]
步骤三、表皮细胞增殖与分化调控
[0081]
将上述步骤二中的细胞培养小室内的培养液弃掉,更换模型培养皿内的培养液为细胞培养液ⅱ,添加量为每只培养皿70ml,使液面与细胞培养小室内细胞上表面位于同一水平线,进行气液面培养,培养时间为6天,相较实施例1角质层更完整,但与实施例2相比,形成的角质层相对薄弱,既能保证后续痤疮丙酸杆菌的定植,又能充分产生组织学形态变化。培养期间每天换液,培养结束,重组皮肤表皮模型构建完成。
[0082]
细胞培养液ⅱ以mcdb153为基础培养基,添加胰岛素2.5μg/ml,异丙肾上腺素0.5μm,氢化可的松0.1μg/ml,表皮生长因子5ng/ml,腺嘌呤25μ/ml,转铁蛋白8μg/ml,l-肉碱0.05mm,l-丝氨酸0.05mm,棕榈酸0.025mm,油酸0.025mm,精氨琥珀酸0.075mm,氯化钙1.25mm,角质细胞生长因子5ng/ml,粒细胞集落刺激因子15ng/ml配置而成。
[0083]
步骤四、类痤疮的重组表皮模型的构建
[0084]
本实施例采用实施例2筛选出的最优痤疮丙酸杆菌浓度2.0
×
108cfu进行实验,并进一步进行了痤疮丙酸杆菌造模时间筛选。
[0085]
将构建好的重组皮肤表皮模型转移至六孔板中,六孔板的每孔内预先添加3.7ml细胞培养液ⅱ,将模型固定于支架上,实现气液面培养。痤疮丙酸杆菌终浓度分别为2.0
×
108cfu/每个模型,每组重复3个模型。将菌液均匀涂抹于模型表面,置于37℃,5%co2孵箱中后孵育48小时。对照组的皮肤模型不添加痤疮丙酸杆菌,其余操作与实验组一致。每天换液,在孵育24h和48h时收集上清液进行炎症因子检测。
[0086]
以上实验过程得到采用不同浓度的痤疮丙酸杆菌刺激后的体外重组表皮模型,分别进行炎症因子elisa检测和形态学检测,观察每一试验组所得到的表皮模型的形态和生化指标。
[0087]
(1)elisa检测tnf-α、il-8分泌情况:收集孵育24h和48h的培养基检测炎症因子的分泌量。实验结果如表2和表3所示。
[0088]
表2:痤疮丙酸杆菌刺激不同时间下elisa检测tnf-α分泌情况
[0089][0090]
表3:痤疮丙酸杆菌刺激不同时间下elisa检测il-8分泌情况
[0091][0092]
表2,表3中的结果表示为mean
±
sd,p《0.05被认为具有显著性差异,**p《0.01表示极显著差异。将实验结果应用graphpadprism5.0软件进行作图,得到图2,图3。
[0093]
根据表2,表3所示的实验结果,可以观察到:使用2.0
×
108cfu/每个模型的痤疮丙酸杆菌刺激气液面培养6天的表皮模型在24h的后孵育时间时,造模组与空白对照组中表皮的tnf-α组含量无显著性变化。而48h时,则出现显著性上调。il-8的分泌量在24h和48h的后孵育时间中,造模组与空白对照组相比均有极显著性差异(p《0.01)。由于48h时已出现炎症爆发,所以立即停止实验,防止损伤过度。
[0094]
(2)形态学染色h&e检测:
[0095]
实验方法:每组取3个吸去水分的表皮模型,用刀片把体外重组表皮模型从细胞培养小室中环切下来,并转移到1.5ml ep管中,加入10%多聚甲醛固定4小时。使用乙醇溶液由低浓度到高浓度进行系列脱水,二甲苯透明处理,常规石蜡包埋,切片,制成切片后进行h&e染色,然后显微镜下拍照观察。实施例3的表皮模型所制得的切片观察到的组织学切片he染色结果及组织形态学变化如图4所示。
[0096]
图4中可以明显观察到:正常表皮模型(空白对照,control)含典型四层表皮复层化结构,包括角质层、颗粒层、棘层与基底层。当痤疮丙酸杆菌定植24h后,模型的结构基本
未变,角质层出现少量空泡但是厚度无明显变化,活细胞层活细胞数目明显减少。而当痤疮丙酸杆菌定植48h后,角质层空泡增多,即角化异常现象加重,并且模型各层之间空泡增多且对棘层有较大的影响,活细胞层活细胞数目明显减少,角质层增厚显著。
[0097]
综合elisa检测il-8和tnf-α分泌情况和形态学染色h&e检测结果,本发明的重组表皮模型在痤疮丙酸杆菌刺激48h后il-8和tnf-α分泌量显著性升高(p《0.01),且组织形态学出现明显改变,因此确定将2.0
×
108cfu/每个模型的痤疮丙酸杆菌接种刺激48h确定为本发明类痤疮重组表皮模型构建的优选刺激条件。
[0098]
应该理解到披露的本发明不仅仅限于描述的特定的方法、方案和物质,因为这些均可变化。还应理解这里所用的术语仅仅是为了描述特定的实施方式方案的目的,而不是意欲限制本发明的范围,本发明的范围仅受限于所附的权利要求。
[0099]
本领域的技术人员还将认识到,或者能够确认使用不超过常规实验,在本文中所述的本发明的具体的实施方案的许多等价物。这些等价物也包含在所附的权利要求中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。