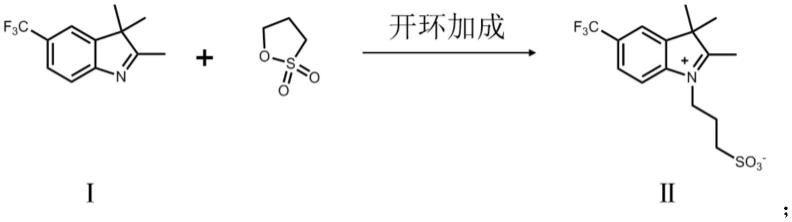
1.本发明涉及医药技术领域的技术领域,具体的更涉及烷基取代那可丁衍生物及其制备方法与应用。
背景技术:
2.环境污染以及人类生活方式的改变,导致恶性肿瘤的发病率成年上升,严重威胁着人类健康。世界卫生组织公布的最新统计数据显示,2020年全球恶性肿瘤新增病例为1929万例,新增死亡病例为996万例,死亡率高达50%;而我国癌症新增病例为457万例,死亡病例为300万例,均位居全球首位。
3.小分子化学药物是对抗恶性肿瘤的主要手段,临床上常用的抗肿瘤药物主要包括细胞毒药物和靶向药物两种。然而细胞毒药物,通常表现出较强的毒副作用,严重影响了恶性肿瘤患者的生存质量。靶向药物,则表现出日益增加的耐药性,成为其临床应用的瓶颈。因此亟需发展高效低毒,治疗指数高的抗肿瘤药物,来应对这一挑战。
4.那可丁(noscapine)是来源于罂粟的苯酞四氢异喹啉类生物碱,结构简单,含量丰富,价格低廉,最早作为非处方镇咳药在临床上广泛使用,可口服给药。1998年被发现对各种恶性肿瘤细胞,如肺癌和结肠癌细胞等,表现出中等的抑制活性。其作用机制通常被认为是微管蛋白抑制剂,通过与微管蛋白相结合,干扰微管动态平衡,致使肿瘤细胞停滞于有丝分裂g2/m期而凋亡,产生抗肿瘤作用。然而,作为微管蛋白抑制剂,那可丁却并没有表现出明显的毒副作用,反而可有效克服临床上此类抗肿瘤药物广泛存在的耐药性,并可透过血脑屏障,用于脑部神经胶质瘤的治疗,代表着一个极具开发前景的抗肿瘤药物先导物。
5.研究表明,9
′‑
位是那可丁结构改造的主要位点之一。该位点取代基变化对那可丁抗肿瘤活性具有较大影响。有鉴于此,以发散性思维为导向,从9
′‑
br-n-boc那可丁出发,利用光镍协同催化还原偶联反应,我们制备一系列9
′‑
位烷基取代那可丁衍生物。大部分该类衍生物,都表现出较那可丁更高的抗肿瘤活性,有望开发为高效低毒的抗肿瘤药物。
技术实现要素:
6.本发明的目的在于克服现有技术存在的不足,本发明的第一个方面提供了烷基取代那可丁衍生物,结构通式如通式1所示:
[0007][0008]
其中,r1基团选自烷基、氮杂烷基、环烷基、桥环烷基,氧杂环烷基、氮杂环烷基、环
烷甲基、氧杂环烷甲基、氮杂环烷甲基;
[0009]
r2基团选自氧甲酰基或烷基。
[0010]
作为一种优选的技术方案,本发明中所述r1基团和r2基团中的烷基分别独立的选自c2-c8烷基或c2-c8氘代烷基。
[0011]
作为一种优选的技术方案,本发明中所述氮杂烷基选自c2-c8氮杂烷基或c2-c8氘代氮杂烷基。
[0012]
作为一种优选的技术方案,本发明中所述环烷基选自c3-c10环烷基或c3-c10氘代环烷基;所述桥环烷基选自c5-c12桥环烷基或c5-c12氘代桥环烷基。
[0013]
作为一种优选的技术方案,本发明中所述氧杂环烷基选自c3-c7氧杂环烷基或c3-c7氘代氧杂环烷基。
[0014]
作为一种优选的技术方案,本发明中所述氮杂环烷基选自c3-c7氮杂环烷基或c3-c7氘代氮杂环烷基;所述环烷基甲基中的环烷基为c3-c10环烷基或c3-c10氘代环烷基;所述氧杂环烷基甲基中的氧杂环烷基为c3-c7氧杂环烷基或c3-c7氘代氧杂环烷基;所述氮杂环烷基甲基中的氮杂环烷基为c3-c7氮杂环烷基或c3-c7氘代氮杂环烷基。
[0015]
作为一种优选的技术方案,本发明中所述氧甲酰基为烷氧甲酰基。
[0016]
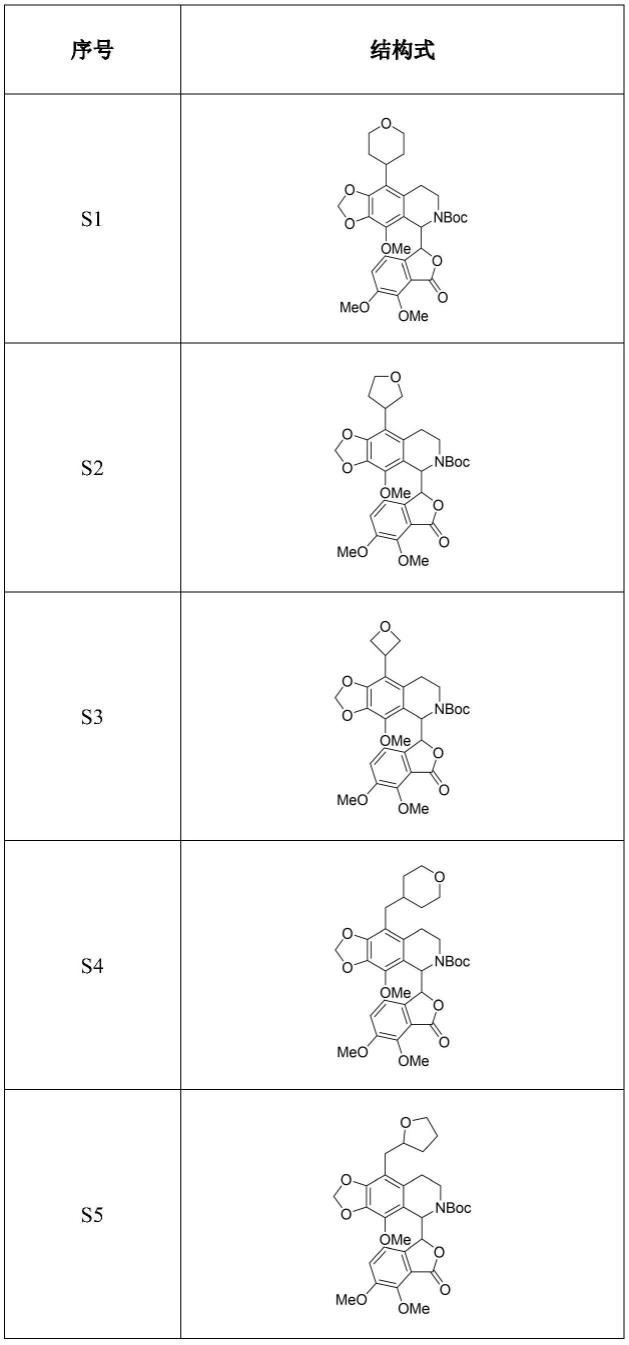
作为一种优选的技术方案,本发明中所述的烷基取代那可丁衍生物,通式1的结构选自表1中序号s1-s29中的至少一种;
[0017]
表1
[0018]
[0019]
[0020]
[0021]
[0022]
[0023][0024]
本发明的第二个方面提供了一种所述的烷基取代那可丁衍生物的应用,应用于肿瘤相关的疾病。
[0025]
本发明的第三个方面提供了一种所述的烷基取代那可丁衍生物的制备方法,步骤至少包括:
[0026]
步骤(1):那可丁在氢溴酸和液溴条件下,得到9-溴那可丁i,经氧化脱甲基反应得中间体ii,进一步在碱性条件下引入boc基团,得中间体iii;
[0027]
步骤(2):中间体iii与烷基溴化物在光镍协同催化下,发生还原偶联,即得。
[0028]
作为一种优选的技术方案,本发明中所述的烷基取代那可丁衍生物的制备方法,还包括步骤(3):将化合物s15在酸性条件下反应得s29。
[0029]
本发明有益效果:本发明通过基于光镍协同催化还原偶联策略的半合成方法,合成了一系列那可丁9
′
位烷基取代衍生物。这些衍生物对各种恶性血液瘤和恶性实体瘤细胞
均显示出抑制活性,可用于制备高效且低毒的抗肿瘤治疗药物。
具体实施方式
[0030]
下面结合实施例对本发明的技术方案进行详细描述,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。本发明所用试剂和原料均市售可得。
[0031]
本发明的第一个方面提供了烷基取代那可丁衍生物,结构通式如通式1所示:
[0032][0033]
其中,r1基团选自烷基、氮杂烷基、环烷基、桥环烷基,氧杂环烷基、氮杂环烷基、环烷甲基、氧杂环烷甲基、氮杂环烷甲基;
[0034]
r2基团选自氧甲酰基或烷基。
[0035]
在一些实施方式中,所述r1基团和r2基团中的烷基分别独立的选自c2-c8烷基或c2-c8氘代烷基。
[0036]
在一些实施方式中,所述氮杂烷基选自c2-c8氮杂烷基或c2-c8氘代氮杂烷基。
[0037]
在一些实施方式中,所述环烷基选自c3-c10环烷基或c3-c10氘代环烷基;所述桥环烷基选自c5-c12桥环烷基或c5-c12氘代桥环烷基。
[0038]
在一些实施方式中,所述氧杂环烷基选自c3-c7氧杂环烷基或c3-c7氘代氧杂环烷基。
[0039]
在一些实施方式中,所述氮杂环烷基选自c3-c7氮杂环烷基或c3-c7氘代氮杂环烷基;所述环烷基甲基中的环烷基为c3-c10环烷基或c3-c10氘代环烷基;所述氧杂环烷基甲基中的氧杂环烷基为c3-c7氧杂环烷基或c3-c7氘代氧杂环烷基;所述氮杂环烷基甲基中的氮杂环烷基为c3-c7氮杂环烷基或c3-c7氘代氮杂环烷基。
[0040]
在一些实施方式中,所述氧甲酰基为烷氧甲酰基。
[0041]
在一些实施方式中,通式1的结构选自表1中序号s1-s29中的至少一种;
[0042]
表1
[0043]
[0044]
[0045]
[0046]
[0047][0048]
本发明的第二个方面提供了一种所述的烷基取代那可丁衍生物的应用,应用于肿瘤相关的疾病。
[0049]
本发明的第三个方面提供了一种所述的烷基取代那可丁衍生物的制备方法,步骤至少包括:
[0050]
步骤(1):那可丁在氢溴酸和液溴条件下,得到9-溴那可丁i,经氧化脱甲基反应得中间体ii,进一步在碱性条件下引入boc基团,得中间体iii;
[0051]
步骤(2):中间体iii与烷基溴化物在光镍协同催化下,发生还原偶联,即得。
[0052]
在一些实施方式中,所述的烷基取代那可丁衍生物的制备方法,还包括步骤(3):将化合物s15在酸性条件下反应得s29。
[0053]
在一些优选的实施方式中,一种所述的烷基取代那可丁衍生物的制备方法,步骤包括:
[0054]
1)化合物i的合成:
[0055]
将那可丁(2.0g,4.5mmol,1.0equiv)加入装有磁力搅拌子的干燥反应瓶中,再加入8ml48%的溴化氢水溶液混合均匀,密封,室温下边剧烈搅拌边滴加25ml新配制的溴水溶液,直至溶液中黄色固体析出完全,反应1小时后,用氨水将ph调至10,再用dcm(3
×
25ml)萃取,将有机相合并,用饱和食盐水洗,干燥浓缩,所得粗产物通过快速柱层析纯化(pe:ea=3:1),得白色固体(2.1g,90%)。
[0056]
2)化合物iii的合成:
[0057]
将上步所得产物i(1.4g,2.8mmol,1.0equiv)溶于35ml氯仿中,在-5℃分批加入间氯过氧苯甲酸(1.0g,5.6mmol,2.0equiv),反应2小时后,分别用42ml冰氯仿、10ml冰异丙醇、10%冰氢氧化钠溶液(3
×
5ml)、冰水(2
×
10ml)及10%盐酸水溶液(2
×
6ml)洗,干燥旋蒸,将所得粗产物溶于112ml甲醇,在-5℃加入七水合硫酸亚铁(1.5g,5.6mmol,2.0equiv),反应8小时后,旋蒸并溶于125ml氯仿,分别用乙二胺四乙酸水溶液(3
×
40ml,0.1mol/l)、氢氧化钠水溶液(2
×
40ml,1mol/l)洗,干燥旋蒸,无需纯化直接投入下一步;将粗产物ii(944mg,2.0mmol,1.0equiv)溶于67ml乙酸乙酯,加入boc-酸酐(920ul,4.0mmol,2.0equiv)和2ml的三乙胺,室温下搅拌1小时,浓缩,所得粗产物通过快速柱层析纯化(pe:ea=1:1),得iii为白色固体(920mg,57%,rr=1:1)。
[0058]
3)将关键中间体iii(57.8mg,0.1mmol,1.0equiv),含卤素单体(33.6ul,0.3mmol,3.0equiv),ir[df(cf3)ppy]2(dtbbpy)pf6(1.12mg,1.0umol,0.01equiv),(me3si)3sih(30.8ul,0.1umol,1.0equiv)和无水na2co3(21.2mg,0.2mmol,2.0equiv)加入装有磁力搅拌子的干燥反应瓶中,将反应瓶用衬有特氟龙的隔膜螺帽密封,抽真空并回填氮气3次,再通过注射器加入0.8mldme溶液混合均匀。同时,向另一个反应瓶中加入nicl2
·
glyme(2.2mg,5.0umol,0.05equiv)和4,4'-二叔丁基-2,2'-联吡啶(2.68mg,5.0umol,0.05equiv),用隔膜螺帽密封,加入0.4mldme溶液混合均匀,将连有氮气球的长针头通过隔膜插入反应瓶液面以下,再插入一个短针头进行排气(长针头不要插到液面以下,防止倒吸),进行超声鼓泡脱气5分钟,然后用注射器取0.2ml混合溶液加入装有样品的反应瓶中,并通过连有氮气球的长针头继续超声鼓泡脱气10分钟,最后,用34wblue led照射密封的反应瓶,同时用风扇进行降温,以保持反应温度在25℃,16小时后,暴露反应混合物在空气中以淬灭,用乙酸乙酯进行萃取,所得粗产物通过快速柱层析纯化(pe:ea=1:1),即得。
[0059]
在一些实施方式中,所述的含卤素单体选自4-溴四氢吡喃、3-溴四氢呋喃、3-溴氧杂环丁烷、4-(溴甲基)四氢吡喃、2-(溴甲基)四氢呋喃、4-溴哌啶-1-羧酸叔丁酯、3-溴吡咯烷-1-羧酸叔丁酯、3-溴氮杂环丁烷-1-羧酸叔丁酯、3-(溴甲基)吡咯烷-1-羧酸叔丁酯、3-(溴甲基)氮杂环丁烷-1-羧酸叔丁酯、溴代环丙烷、溴代环丁烷、溴代环戊烷、溴代环己烷、溴代环庚烷、溴代金刚烷、(溴甲基)环丙烷、(溴甲基)环丁烷、(溴甲基)环戊烷、(溴甲基)环己烷、1-溴辛烷、1-溴-2-甲基丁烷、1-溴-2,2-二甲基丙烷、6-溴己腈、4-溴庚烷、2-溴己烷、2-溴辛烷。
[0060]
本发明所述那可丁衍生物通过如下制备方法获得:
[0061][0062]
下面结合具体的实施例进行说明。
[0063]
实施例1:化合物s1的合成
[0064]
1)化合物i的合成:
[0065]
将那可丁(2.0g,4.5mmol,1.0equiv)加入装有磁力搅拌子的干燥反应瓶中,再加入8ml48%的溴化氢水溶液混合均匀,密封,室温下边剧烈搅拌边滴加25ml新配制的溴水溶液,直至溶液中黄色固体析出完全,反应1小时后,用氨水将ph调至10,再用dcm(3
×
25ml)萃取,将有机相合并,用饱和食盐水洗,干燥浓缩,所得粗产物通过快速柱层析纯化(pe:ea=3:1),得白色固体(2.1g,90%)。1hnmr(400mhz,cdcl3)δ7.02(d,j=8.1hz,1h),6.29(d,j=8.1hz,1h),6.02(s,2h),5.49(d,j=4.3hz,1h),4.33(d,j=4.3hz,1h),4.09(s,3h),3.98(s,3h),3.87(s,3h),2.78
–
2.55(m,2h),2.51(s,3h),2.49
–
2.43(m,1h),1.99
–
1.92(m,1h).hrms(esi)calcd.for c22h23brno7[(m h) ]492.0652,found492.0656.
[0066]
2)化合物iii的合成:
[0067]
将上步所得产物i(1.4g,2.8mmol,1.0equiv)溶于35ml氯仿中,在-5℃分批加入间氯过氧苯甲酸(1.0g,5.6mmol,2.0equiv),反应2小时后,分别用42ml冰氯仿、10ml冰异丙醇、10%冰氢氧化钠溶液(3
×
5ml)、冰水(2
×
10ml)及10%盐酸水溶液(2
×
6ml)洗,干燥旋蒸,将所得粗产物溶于112ml甲醇,在-5℃加入七水合硫酸亚铁(1.5g,5.6mmol,2.0equiv),反应8小时后,旋蒸并溶于125ml氯仿,分别用乙二胺四乙酸水溶液(3
×
40ml,0.1mol/l)、氢氧化钠水溶液(2
×
40ml,1mol/l)洗,干燥旋蒸,无需纯化直接投入下一步;将粗产物ii(944mg,2.0mmol,1.0equiv)溶于67ml乙酸乙酯,加入boc-酸酐(920ul,4.0mmol,2.0equiv)和2ml的三乙胺,室温下搅拌1小时,浓缩,所得粗产物通过快速柱层析纯化(pe:ea=1:1),得iii为白色固体(920mg,57%,rr=1:1)。1hnmr(400mhz,cdcl3)δ6.90
–
7.21(m,1h),6.79
–
6.88(6.45
–
6.53)(m,1h),5.61
–
6.08(m,4h),3.95
–
4.11(m,3h),3.86(s,3h),3.61
–
3.85(m,
3h),2.34
–
3.07(m,4h),1.46(s,9h).hrms(esi)calcd.for c26h28brnnao9[(m na) ]600.0840,found 600.0839.
[0068]
化合物s1的合成:
[0069]
将关键中间体iii(57.8mg,0.1mmol,1.0equiv),4-溴四氢吡喃1a(33.6ul,0.3mmol,3.0equiv),ir[df(cf3)ppy]2(dtbbpy)pf6(1.12mg,1.0umol,0.01equiv),(me3si)3sih(30.8ul,0.1umol,1.0equiv)和无水na2co3(21.2mg,0.2mmol,2.0equiv)加入装有磁力搅拌子的干燥反应瓶中,将反应瓶用衬有特氟龙的隔膜螺帽密封,抽真空并回填氮气3次,再通过注射器加入0.8mldme溶液混合均匀。同时,向另一个反应瓶中加入nicl2
·
glyme(2.2mg,5.0umol,0.05equiv)和4,4'-二叔丁基-2,2'-联吡啶(2.68mg,5.0umol,0.05equiv),用隔膜螺帽密封,加入0.4mldme溶液混合均匀,将连有氮气球的长针头通过隔膜插入反应瓶液面以下,再插入一个短针头进行排气(长针头不要插到液面以下,防止倒吸),进行超声鼓泡脱气5分钟,然后用注射器取0.2ml混合溶液加入装有样品的反应瓶中,并通过连有氮气球的长针头继续超声鼓泡脱气10分钟,最后,用34wblue led照射密封的反应瓶,同时用风扇进行降温,以保持反应温度在25℃,16小时后,暴露反应混合物在空气中以淬灭,用乙酸乙酯进行萃取,所得粗产物通过快速柱层析纯化(pe:ea=1:1),得黄色固体s1(33mg,57%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.05
–
7.15(m,1h),6.90
–
7.04(6.60
–
6.67)(m,1h),5.68
–
6.01(m,4h),3.95
–
4.12(m,5h),3.87(s,3h),3.56
–
3.83(m,3h),3.26
–
3.52(m,4h),2.70
–
2.98(m,3h),2.14
–
2.31(m,2h),1.62
–
1.71(m,2h),1.49(s,9h);13c nmr(100mhz,cdcl3)δ167.6,162.6,155.4,152.4,147.7,146.9,140.7,138.3,133.9,128.9,119.2,118.6,117.9,115.9,100.31,82.1,80.3,68.6,62.3,58.9,56.9,52.4,40.9,36.5,34.9,31.5,28.5,25.1.hrms(esi)calcd.for c31h37nnao10[(m na) ]606.2315,found 606.2308.
[0070]
实施例2:化合物s2的合成
[0071]
将实施例1中的4-溴四氢吡喃替换为相同当量比下的3-溴四氢呋喃,其余试剂、操作同s1的合成一样,得黄色固体s2(28mg,50%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.09
–
7.17(m,1h),6.87
–
7.08(6.61
–
6.67)(m,1h),5.68
–
6.01(m,4h),3.95
–
4.12(m,5h),3.88(s,3h),3.70
–
3.86(m,3h),3.57
–
3.68(m,2h),3.30
–
2.54(m,2h),2.62
–
3.03(m,3h),1.99
–
2.31(m,2h),1.49(s,9h).hrms(esi)calcd.for c
30h35
nnao
10
[(m na)
]592.2159,found 592.2159.
[0072]
实施例3:化合物s3的合成
[0073]
将实施例1中的4-溴四氢吡喃替换为相同当量比下的3-溴氧杂环丁烷,其余试剂、操作同s1的合成一样,得黄色固体s3(24mg,44%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.04
–
7.17(m,1h),6.85
–
7.03(6.60
–
6.65)(m,1h),5.68
–
6.01(m,4h),4.97
–
5.16(m,2h),4.81
–
4.94(m,2h),4.38
–
4.52(m,1h),3.95
–
4.10(m,3h),3.87(s,3h),3.54
–
3.84(m,3h),3.24
–
3.41(m,2h),2.36
–
2.83(m,2h),1.49(s,9h).hrms(esi)calcd.for c
29h33
nnao
10
[(m na)
]578.2002,found 578.2008.
[0074]
实施例4:化合物s4的合成
[0075]
将实施例1中的4-溴四氢吡喃替换为相同当量比下4-(溴甲基)四氢吡喃,其余试剂、操作同s1的合成一样,得黄色固体s4(29mg,48%,rotamer ratio=1:1)。1h nmr
(400mhz,cdcl3)δ7.07
–
7.17(m,1h),6.89
–
7.06(6.60
–
6.67)(m,1h),5.66
–
6.01(m,4h),3.89
–
4.14(m,5h),3.87(s,3h),3.51
–
3.80(m,3h),3.22
–
3.47(m,4h),2.60
–
2.96(m,2h),2.36
–
2.58(m,2h),1.58
–
1.78(m,2h),1.50(s,9h),1.19
–
1.41(m,3h).hrms(esi)calcd.for c
32h39
nnao
10
[(m na)
]620.2472,found 620.2475.
[0076]
实施例5:化合物s5的合成
[0077]
将实施例1中的4-溴四氢吡喃替换为相同当量比下2-(溴甲基)四氢呋喃,其余试剂、操作同s1的合成一样,得黄色固体s5(26mg,44%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.09
–
7.17(m,1h),6.81
–
7.08(6.54
–
6.65)(m,1h),5.67
–
6.01(m,4h),3.94
–
4.14(m,4h),3.87(s,3h),3.79
–
3.86(m,2h),3.56
–
3.75(m,3h),3.13
–
3.50(m,2h),2.58
–
2.95(m,4h),1.78
–
2.05(m,4h),1.49(s,9h).hrms(esi)calcd.for c
31h37
nnao
10
[(m na)
]606.2315,found 606.2318.
[0078]
实施例6:化合物s6的合成
[0079]
将实施例1中的4-溴四氢吡喃替换为相同当量比下4-溴哌啶-1-羧酸叔丁酯,其余试剂、操作同s1的合成一样,得白色固体s6(48mg,71%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.07
–
7.17(m,1h),6.87
–
7.06(6.50
–
6.61)(m,1h),5.66
–
6.07(m,4h),4.13
–
4.56(m,2h),3.93
–
4.12(m,3h),3.87(s,3h),3.51
–
3.83(m,3h),3.12
–
3.51(m,2h),2.35
–
3.03(m,5h),1.86
–
2.15(m,2h),1.63
–
1.84(m,2h),1.49(s,9h),1.47(s,9h).hrms(esi)calcd.for c
36h46
n2nao
11
[(m na)
]705.2999,found 705.3004.
[0080]
实施例7:化合物s7的合成
[0081]
将实施例1中的4-溴四氢吡喃替换为相同当量比下3-溴吡咯烷-1-羧酸叔丁酯,其余试剂、操作同s1的合成一样,得白色固体s7(50mg,75%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.07
–
7.17(m,1h),6.81
–
7.06(6.55
–
6.73)(m,1h),5.61
–
6.14(m,4h),3.95
–
4.19(m,3h),3.88(s,3h),3.58
–
3.83(m,3h),3.21
–
3.57(m,6h),2.48
–
3.07(m,3h),2.16
–
2.44(m,1h),1.89
–
2.09(m,1h),1.49(s,9h),1.47(s,9h).hrms(esi)calcd.for c
35h44
n2nao
11
[(m na)
]691.2843,found 691.2837.
[0082]
实施例8:化合物s8的合成
[0083]
将实施例1中的4-溴四氢吡喃替换为相同当量比下3-溴氮杂环丁烷-1-羧酸叔丁酯,其余试剂、操作同s1的合成一样,得白色固体s8(47mg,73%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.07
–
7.17(m,1h),6.81
–
7.06(6.54
–
6.71)(m,1h),5.62
–
6.01(m,4h),4.09
–
4.32(m,4h),3.93
–
4.09(m,3h),3.86(s,3h),3.54
–
3.83(m,3h),3.21
–
3.51(m,3h),2.71
–
2.89(m,1h),2.48
–
2.64(m,1h),1.47(s,9h),1.44(s,9h).hrms(esi)calcd.for c
34h42
n2nao
11
[(m na)
]677.2686,found 677.2681.
[0084]
实施例9:化合物s9的合成
[0085]
将实施例1中的4-溴四氢吡喃替换为相同当量比下3-(溴甲基)吡咯烷-1-羧酸叔丁酯,其余试剂、操作同s1的合成一样,得白色固体s9(42mg,62%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.03
–
7.17(m,1h),6.73
–
7.02(6.38
–
6.68)(m,1h),5.61
–
6.07(m,4h),3.93
–
4.12(m,3h),3.86(s,3h),3.51
–
3.83(m,3h),3.09
–
3.53(m,6h),2.48
–
2.84(m,4h),1.71
–
1.93(m,3h),1.49(s,9h),1.44(s,9h).hrms(esi)calcd.for c
36h46
n2nao
11
[(m na)
]705.2999,found 705.3012.
[0086]
实施例10:化合物s10的合成
[0087]
将实施例1中的4-溴四氢吡喃替换为相同当量比下3-(溴甲基)氮杂环丁烷-1-羧酸叔丁酯,其余试剂、操作同s1的合成一样,得白色固体s10(42mg,63%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.03
–
7.17(m,1h),6.81
–
7.01(6.50
–
6.65)(m,1h),5.67
–
6.01(m,4h),3.90
–
4.16(m,5h),3.87(s,3h),3.63
–
3.83(m,3h),3.51
–
3.62(m,2h),3.16
–
3.44(m,2h),2.56
–
2.97(m,5h),1.49(s,9h),1.43(s,9h).hrms(esi)calcd.for c
35h44
n2nao
11
[(m na)
]691.2843,found 691.2849.
[0088]
实施例11:化合物s11的合成
[0089]
将实施例1中的4-溴四氢吡喃替换为相同当量比下溴代环丙烷,其余试剂、操作同s1的合成一样,得黄色油状物s11(4mg,7%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.03
–
7.17(m,1h),6.75
–
7.01(6.35
–
6.63)(m,1h),5.69
–
6.21(m,4h),3.98
–
4.26(m,3h),3.88(s,3h),3.62
–
3.86(m,3h),3.03
–
3.51(m,2h),2.47
–
3.01(m,2h),1.89
–
2.11(m,1h),1.57
–
1.82(m,2h),1.49(s,9h),1.27
–
1.39(m,2h).hrms(esi)calcd.for c
29h33
nnao9[(m na)
]562.2053,found 562.2056.
[0090]
实施例12:化合物s12的合成
[0091]
将实施例1中的4-溴四氢吡喃替换为相同当量比下溴代环丁烷,其余试剂、操作同s1的合成一样,得黄色油状物s12(10mg,18%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.03
–
7.17(m,1h),6.89
–
7.01(6.51
–
6.63)(m,1h),5.68
–
6.01(m,4h),3.95
–
4.12(m,3h),3.87(s,3h),3.57
–
3.85(m,3h),3.08
–
3.48(m,2h),2.57
–
2.88(m,3h),2.16
–
2.55(m,4h),1.76
–
1.98(m,2h),1.49(s,9h).hrms(esi)calcd.for c
30h35
nnao9[(m na)
]576.2210,found 576.2200.
[0092]
实施例13:化合物s13的合成
[0093]
将实施例1中的4-溴四氢吡喃替换为相同当量比下溴代环戊烷,其余试剂、操作同s1的合成一样,得黄色油状物s13(9mg,16%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.03
–
7.17(m,1h),6.85
–
7.01(6.51
–
6.63)(m,1h),5.68
–
6.01(m,4h),3.95
–
4.16(m,3h),3.87(s,3h),3.57
–
3.85(m,3h),3.33
–
3.51(m,1h),2.97
–
3.28(m,1h),2.60
–
2.93(m,2h),1.73
–
1.94(m,5h),1.56
–
1.71(m,4h),1.49(s,9h).hrms(esi)calcd.for c
31h37
nnao9[(m na)
]590.2366,found 590.2371.
[0094]
实施例14:化合物s14的合成
[0095]
将实施例1中的4-溴四氢吡喃替换为相同当量比下溴代环己烷,其余试剂、操作同s1的合成一样,得黄色油状物s14(13mg,22%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.03
–
7.17(m,1h),6.83
–
7.01(6.51
–
6.63)(m,1h),5.68
–
6.03(m,4h),3.95
–
4.13(m,3h),3.88(s,3h),3.57
–
3.85(m,3h),3.11
–
3.50(m,2h),2.56
–
2.92(m,3h),1.53
–
2.07(m,10h),1.49(s,9h).hrms(esi)calcd.for c
32h39
nnao9[(m na)
]604.2523,found 604.2531.
[0096]
实施例15:化合物s15的合成
[0097]
将实施例1中的4-溴四氢吡喃替换为相同当量比下溴代环庚烷,其余试剂、操作同s1的合成一样,得黄色油状物s15(9mg,15%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.03
–
7.17(m,1h),6.87
–
7.01(6.51
–
6.63)(m,1h),5.68
–
6.01(m,4h),3.95
–
4.12(m,3h),
3.87(s,3h),3.57
–
3.85(m,3h),3.14
–
3.43(m,1h),2.59
–
2.93(m,4h),1.52
–
1.99(m,12h),1.49(s,9h).hrms(esi)calcd.for c
33h41
nnao9[(m na)
]618.2679,found 618.2675.
[0098]
实施例16:化合物s16的合成
[0099]
将实施例1中的4-溴四氢吡喃替换为相同当量比下溴代金刚烷,其余试剂、操作同s1的合成一样,得黄色油状物s16(7mg,11%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.03
–
7.17(m,1h),6.92
–
7.01(6.55
–
6.69)(m,1h),5.33
–
6.01(m,4h),3.95
–
4.12(m,3h),3.88(s,3h),3.57
–
3.85(m,3h),3.42
–
3.53(m,1h),3.10
–
3.23(m,1h),2.71
–
2.89(m,2h),2.13
–
2.26(m,2h),1.94
–
2.09(m,2h),1.56
–
1.76(m,4h),1.55(s,9h),1.37
–
1.52(m,7h).hrms(esi)calcd.for c
36h43
nnao9[(m na)
]656.2830,found 656.2833.
[0100]
实施例17:化合物s17的合成
[0101]
将实施例1中的4-溴四氢吡喃替换为相同当量比下(溴甲基)环丙烷,其余试剂、操作同s1的合成一样,得黄色油状物s17(14mg,25%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.02
–
7.17(m,1h),6.76
–
6.99(6.43
–
6.63)(m,1h),5.70
–
6.01(m,3h),4.92
–
5.07(m,1h),3.94
–
4.27(m,3h),3.87(s,3h),3.52
–
3.81(m,3h),2.94
–
3.49(m,2h),2.42
–
2.85(m,3h),2.10
–
2.32(m,1h),1.60
–
1.84(m,3h),1.49(s,9h),1.21
–
1.44(m,2h).hrms(esi)calcd.for c
30h35
nnao9[(m na)
]576.2210,found 576.2228.
[0102]
实施例18:化合物s18的合成
[0103]
将实施例1中的4-溴四氢吡喃替换为相同当量比下(溴甲基)环丁烷,其余试剂、操作同s1的合成一样,得黄色固体s18(28mg,50%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.01
–
7.17(m,1h),6.83
–
6.99(6.45
–
6.59)(m,1h),5.68
–
6.01(m,4h),3.95
–
4.11(m,3h),3.86(s,3h),3.53
–
3.85(m,3h),3.09
–
3.43(m,1h),2.39
–
2.87(m,6h),1.61
–
2.01(m,6h),1.49(s,9h).hrms(esi)calcd.for c
31h37
nnao9[(m na)
]590.2366,found590.2374.
[0104]
实施例19:化合物s19的合成
[0105]
将实施例1中的4-溴四氢吡喃替换为相同当量比下(溴甲基)环戊烷,其余试剂、操作同s1的合成一样,得黄色固体s19(30mg,53%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.02
–
7.17(m,1h),6.79
–
6.99(6.45
–
6.61)(m,1h),5.68
–
6.01(m,4h),3.95
–
4.17(m,3h),3.86(s,3h),3.57
–
3.84(m,3h),3.06
–
3.45(m,1h),2.40
–
2.89(m,5h),1.89
–
2.10(m,1h),1.58
–
1.84(m,4h),1.49(s,9h),1.10
–
1.37(m,4h).hrms(esi)calcd.for c
32h39
nnao9[(m na)
]604.2523,found 604.2519.
[0106]
实施例20:化合物s20的合成
[0107]
将实施例1中的4-溴四氢吡喃替换为相同当量比下(溴甲基)环己烷,其余试剂、操作同s1的合成一样,得黄色固体s20(33mg,55%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.01
–
7.17(m,1h),6.76
–
6.97(6.39
–
6.61)(m,1h),5.68
–
6.09(m,4h),3.95
–
4.14(m,3h),3.87(s,3h),3.58
–
3.85(m,3h),3.29
–
3.52(m,1h),3.01
–
3.20(m,1h),2.29
–
2.88(m,4h),1.56
–
1.82(m,7h),1.50(s,9h),1.13
–
1.29(m,4h).hrms(esi)calcd.for c
33h41
nnao
9
[(m na)
]618.2679,found 618.2675.
[0108]
实施例21:化合物s20的合成
[0109]
将实施例1中的4-溴四氢吡喃替换为相同当量比下1-溴辛烷,其余试剂、操作同s1
的合成一样,得黄色油状物s21(14mg,23%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.01
–
7.17(m,1h),6.79
–
6.97(6.42
–
6.59)(m,1h),5.71
–
6.04(m,4h),3.95
–
4.22(m,3h),3.87(s,3h),3.55
–
3.85(m,3h),3.06
–
3.49(m,1h),2.38
–
2.92(m,5h),1.50(s,9h),1.18
–
1.47(m,12h),0.87(t,j=8.0hz,3h).hrms(esi)calcd.for c
34h45
nnao9[(m na)
]634.2992,found 634.3008.
[0110]
实施例22:化合物s22的合成
[0111]
将实施例1中的4-溴四氢吡喃替换为相同当量比下1-溴丁烷,其余试剂、操作同s1的合成一样,得黄色油状物s22(12mg,21%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.01
–
7.17(m,1h),6.78
–
6.98(6.43
–
6.59)(m,1h),5.68
–
6.05(m,4h),3.95
–
4.16(m,3h),3.86(s,3h),3.57
–
3.84(m,3h),3.26
–
3.48(m,1h),2.99
–
3.24(m,1h),2.39
–
2.86(m,4h),1.62
–
1.87(m,2h),1.49(s,9h),1.28
–
1.37(m,2h),0.93(t,j=8.1hz,3h).hrms(esi)calcd.for c
30h37
nnao9[(m na)
]578.2366,found 578.2373.
[0112]
实施例23:化合物s23的合成
[0113]
将实施例1中的4-溴四氢吡喃替换为相同当量比下1-溴-2-甲基丁烷,其余试剂、操作同s1的合成一样,得黄色油状物s23(16mg,29%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.01
–
7.17(m,1h),6.80
–
6.99(6.43
–
6.59)(m,1h),5.63
–
6.04(m,4h),3.94
–
4.16(m,3h),3.86(s,3h),3.50
–
3.84(m,3h),3.26
–
3.45(m,1h),2.99
–
3.24(m,1h),2.22
–
2.84(m,4h),1.49(s,9h),1.12
–
1.42(m,3h),0.91(t,j=8.1hz,3h),0.76
–
0.84(d,j=8.0hz,3h).hrms(esi)calcd.for c
31h39
nnao9[(m na)
]592.2523,found 592.2514.
[0114]
实施例24:化合物s24的合成
[0115]
将实施例1中的4-溴四氢吡喃替换为相同当量比下1-溴-2,2-二甲基丙烷,其余试剂、操作同s1的合成一样,得黄色油状物s24(8mg,15%,rotamerratio=1:1)。1hnmr(400mhz,cdcl3)δ7.04
–
7.17(m,1h),6.93
–
7.03(6.62
–
6.73)(m,1h),5.62
–
6.01(m,4h),3.93
–
4.12(m,3h),3.88(s,3h),3.57
–
3.85(m,3h),3.35
–
3.53(m,2h),2.68
–
2.89(m,2h),2.31
–
2.58(m,2h),1.55(s,9h),1.49(s,6h),0.93(s,3h).hrms(esi)calcd.for c
31h39
nnao9[(m na)
]592.2523,found 592.2528.
[0116]
实施例25:化合物s25的合成
[0117]
将实施例1中的4-溴四氢吡喃替换为相同当量比下6-溴己腈,其余试剂、操作同s1的合成一样,得黄色固体s25(35mg,60%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.02
–
7.17(m,1h),6.73
–
7.01(6.31
–
6.65)(m,1h),5.55
–
6.19(m,4h),3.95
–
4.29(m,3h),3.87(s,3h),3.53
–
3.85(m,3h),3.22
–
3.50(m,2h),2.24
–
3.06(m,4h),1.58
–
2.11(m,4h),1.48(s,9h),1.13
–
1.36(m,4h).hrms(esi)calcd.for c
32h38
n2nao9[(m na)
]617.2475,found 617.2481.
[0118]
实施例26:化合物s26的合成
[0119]
将实施例1中的4-溴四氢吡喃替换为相同当量比下4-溴庚烷,其余试剂、操作同s1的合成一样,得黄色油状物s26(11mg,19%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ6.95
–
7.10(m,1h),6.67
–
6.91(6.31
–
6.47)(m,1h),5.69
–
6.04(m,4h),3.97
–
4.17(m,3h),3.86(s,3h),3.54
–
3.85(m,3h),3.27
–
3.45(m,1h),3.02
–
3.19(m,1h),2.57
–
2.84(m,2h),2.28
–
2.46(m,1h),1.64
–
1.88(m,4h),1.50(s,9h),1.01
–
1.23(m,4h),0.72
–
0.99(m,6h)
.hrms(esi)calcd.for c
33h43
nnao9[(m na)
]620.2836,found 620.2833.
[0120]
实施例27:化合物s27的合成
[0121]
将实施例1中的4-溴四氢吡喃替换为相同当量比下2-溴己烷,其余试剂、操作同s1的合成一样,得黄色油状物s27(10mg,17%,rotamer ratio=1:1)。1h nmr(400mhz,cdcl3)δ7.06
–
7.17(m,1h),6.93
–
7.05(6.63
–
6.72)(m,1h),5.68
–
5.98(m,4h),3.95
–
4.13(m,3h),3.88(s,3h),3.62
–
3.86(m,3h),3.41
–
3.52(m,1h),3.05
–
3.24(m,1h),2.71
–
2.89(m,2h),1.95
–
2.08(m,1h),1.59
–
1.77(m,2h),1.50(s,9h),1.11
–
1.27(m,7h),0.77
–
0.94(m,3h).hrms(esi)calcd.for c
32h41
nnao9[(m na)
]606.2679,found 606.2669.
[0122]
实施例28:化合物s28的合成
[0123]
将实施例1中的4-溴四氢吡喃替换为相同当量比下2-溴辛烷,其余试剂、操作同s1的合成一样,得黄色油状物s28(8mg,14%,rotamer ratio=1:1)。1hnmr(400mhz,cdcl3)δ7.01
–
7.15(m,1h),6.81
–
6.99(6.43
–
6.55)(m,1h),5.65
–
6.02(m,3h),5.22
–
5.48(m,1h),3.95
–
4.22(m,3h),3.87(s,3h),3.55
–
3.85(m,3h),2.98
–
3.48(m,2h),2.47
–
2.97(m,3h),1.81
–
2.16(m,2h),1.49(s,9h),1.17
–
1.31(m,11h),0.81
–
0.95(m,3h).hrms(esi)calcd.for c
34h45
nnao9[(m na)
]634.2992,found 634.2988.
[0124]
实施例29:化合物s29的合成
[0125]
将s15(40mg,0.068mmol,1.0equiv)装入反应瓶,加入1.8ml的dcm,混合均匀,再加入180ultfa,在室温条件下搅拌30分钟,旋干,所得粗产物溶于200ul的hcooh溶液中,边搅拌边加入100ulhcho溶液(37%),加热回流30分钟,浓缩,加入h2o和dcm,在搅拌情况下,以氨水调节ph值至9.0-10.0,dcm萃取三次,合并有机层,用饱和食盐水洗涤三次,干燥,浓缩,所得粗产物经快速柱层析纯化(pe:ea=5:1),得白色固体(15mg,43%)。1h nmr(400mhz,cdcl3)δ6.88(d,j=8.1hz,1h),5.91(dd,j=8.1,1.3hz,3h),5.50(d,j=4.1hz,1h),4.45(d,j=4.1hz,1h),4.08(s,3h),3.98(s,3h),3.85(s,3h),2.61
–
2.85(m,2h),2.54(s,3h),2.43
–
2.53(m,1h),2.23
–
2.39(m,1h),1.51
–
1.95(m,13h).hrms(esi)calcd.for c
29h36
no7[(m h)
]510.2492,found 510.2483.
[0126]
性能测试
[0127]
测试合成那可丁衍生物具有抗肿瘤活性,运用cck-8法开展相应的细胞增殖抑制活性分析,具体操作如下:
[0128]
1.细胞株:kasumi-1、u937、rs4;11、k562、jurkat、jeko-1、raji、snk6、mm1s、snu-1、hela、u251、a549、huh7、sk-ov-3、capan-1
[0129]
2.培养液
[0130]
rpmi 1640 20%fbs
[0131]
rpmi 1640 10%fbs
[0132]
aimv hs il2
[0133]
dmem 10%fbs
[0134]
mccoy's 5a 10%fbs
[0135]
imdm 20%fbs
[0136]
3.其他材料
[0137]
全波长多功能酶标仪:型号varioskan flash,生产厂商thermo scientific,进口
384孔板等
[0138]
4.实验方法:本实验采用的是cck-8法。在384孔板中加入细胞和药物,使每孔体积为60ul,细胞浓度为2
×
105个/ml,每个药物浓度为30um,铺好后摇晃,使之均匀,不挂壁(对于贴壁细胞,需提前铺好细胞,放入培养箱内,使得第二天加药时达到30%-50%的融合度);铺好后,放入37℃、5%co2的培养箱中培养48小时;48小时后向每个孔中加入5ul的cck-8溶液,放入培养箱内孵育2-6小时后,用多功能酶标仪测od
450
的吸光值,并根据公式计算细胞的抑制活性。
[0139]
其药理实验结果如下,体外白血病细胞株抑制活性结果见表2:
[0140]
表2那可丁衍生物对白血病细胞株的抗增殖活性
[0141]
[0142][0143]
体外淋巴瘤和骨髓瘤细胞株抑制活性结果见表3:
[0144]
表2那可丁衍生物对淋巴瘤和骨髓瘤细胞株的抗增殖活性
[0145]
[0146][0147]
体外实体瘤细胞株抑制活性结果见表4:
[0148]
表4那可丁衍生物对实体瘤细胞株的抗增殖活性
[0149][0150][0151]
以上所述仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,
任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。