猪faps永生化细胞的构建方法及用途
技术领域
1.本发明涉及一种猪永生化成纤维/成脂祖细胞 (fibro-adipogenic progenitors, faps) 的建立方法及用途,属于现代农业和食品研究领域的应用技术。
背景技术:
2.沉积在骨骼肌中的肌内脂肪(intramuscular fat, imf)又称为风味脂肪,其含量与猪肉的感官、食用品质密切相关,直接影响肉的风味、多汁性、嫩度、色泽等多个指标。猪肉的理想imf含量在 2.5%~3.0%,imf含量低会严重影响肉的风味和口感,降低肉品质。前期研究发现,imf细胞是由多种来源的干细胞或祖细胞分化而来,包括侧群细胞、周细胞、多能间充质干细胞、肌卫星细胞及faps等,其中faps是小鼠和人肌肉再生过程中脂肪化的主要细胞来源,faps 特异性表达 pdgfrα和 sca-1。近期研究同样发现,faps是猪肌内脂肪形成的重要细胞来源。因此,如何在不影响猪肉产量的前提下适当提高猪肉中imf含量,是改善猪肉品质的关键策略。另一方面,从人类健康的角度来看,imf沉积与衰老、骨骼肌功能异常、糖尿病及其他慢性代谢病密切相关,而猪的生理结构和解剖特性与人类极为相似,被研究者认为是一种接近人类的动物模型。因此,了解猪faps的分化、成熟机制等过程,同样为治疗人类疾病提供新的方案。
3.就目前来看,猪faps相关研究处于起步阶段:没有猪faps的相关研究报道;没有成熟的分离纯化方法;只是简单用肌肉消化后的混合细胞研究肌内脂肪细胞分化聚酯,没考虑纯化faps等。目前获得猪faps的方法是通过免疫磁珠或流式分选pdgfra
细胞,这类方法不仅获取成本高(每次需要屠宰动物、获取肌肉组织),并且原代faps细胞在体外培养几代之后,培养效率显著下降。
技术实现要素:
4.为了克服现有技术中的问题,本发明的目的是提供一种猪 faps 永生化细胞的构建方法及用途。
5.猪 faps永生化细胞的构建方法及用途,包括以下步骤:1)猪 faps细胞的分离培养:将3日龄仔猪麻醉后,将其体表用酒精擦拭、消毒,随后在无菌超净台中取背最长肌,充分剪碎组织后按组织体积:消化酶体积=1:3加入0.2% 胶原酶ⅰ;在 37 ℃消化1 h后,依次经70 μm和40 μm的滤网过滤,离心后收集细胞;随后经磁珠分选方法分离pdgfrα阳性细胞(即faps细胞),接种于12孔板培养;2)转染过表达sv40t的慢病毒:待细胞生长至40%左右,加入慢病毒,感染72 h后观察荧光,检测转染效率;3)抗生素筛选成功转入sv40t慢病毒的猪 faps细胞:待感染sv40t慢病毒的猪 faps细胞生长至90%时,根据慢病毒本身的抗性基因,利用嘌呤霉素筛选转入sv40t慢病毒的猪 faps细胞;4)验证猪 faps永生化细胞的永生化能力:经嘌呤霉素筛选纯化得到的sv40t阳性
的猪 faps细胞记为第1代(p1),待细胞生长至80%~85%时传代,在p5、p10、p15、p20、p25、p30代时进行增殖(ki67染色)和成脂分化能力(尼罗红染色)检测。
6.5)建立猪 faps细胞成纤维分化诱导方法:含5% fbs的基础培养基中10ng/ml tgfβ1处理48h,可诱导猪 faps细胞成纤维分化。经免疫荧光染色和实时荧光定量pcr(rt-pcr)检测发现,成纤维诱导显著提高纤维化标志基因acta2和col3a的表达水平。
7.6)猪 faps永生化细胞应用于3d培养、细胞培养肉研发:将猪 faps细胞接种于3d凝胶体系培养,faps细胞具有较好的增殖能力,且能形成细胞球。
8.一种根据所述的猪 faps永生化细胞,表达pdgfrα;一种根据所述的猪 faps永生化细胞的构建方法及用途,用于研究猪肌内脂肪的形成调控及其分子机制,用于研究faps细胞成脂/成纤维分化的命运决定机制,用于研究猪 faps 细胞成脂/成纤维分化过程中糖脂代谢规律以及基因功能,还可用于培养肉生产、筛选靶向促进faps细胞增殖或成脂分化的营养素和生物活性因子等。
9.本发明的有益效果:本发明提供了一种猪 faps 永生化细胞的构建方法,克服每次faps分离时动物的牺牲量,满足动物福利的要求;同时,确定了猪faps细胞的感染复数(multiplicity of infection, moi),为后期转染慢病毒、腺病毒以及基因功能研究提供参考;通过体外培养,确定了诱导猪 faps成纤维分化的方法,这为调控猪 faps的分化命运提供有力的模型;通过将猪 faps用于3d培养,证明猪 faps在体外有较好的成球能力,这为后期细胞培养肉的研发提供了新方案。
10.本发明建立的猪 faps 永生化细胞在体外长期保持良好的前体状态,传代至第30代仍具有较好的增殖和分化能力,可用于体外探究调控猪 faps 细胞成脂、成纤维分化等方面的研究,开拓了目前研究猪肌内脂肪沉积及 faps 细胞分化命运调控研究的新方法;其次,分离得到的猪 faps 细胞可用于3d 细胞培养,可以探究体内条件下肌内脂肪的形成机制;而且,faps 细胞是肌内脂肪的主要细胞来源,可以当作种子细胞在体外用于细胞培养肉的研发、生产;还可用于体外筛选靶向调控faps 细胞增殖和分化的营养素和生物活性因子等,为提高培养肉的生产效率、调控猪肌内脂肪沉积提供新方案,应用前景巨大。
附图说明
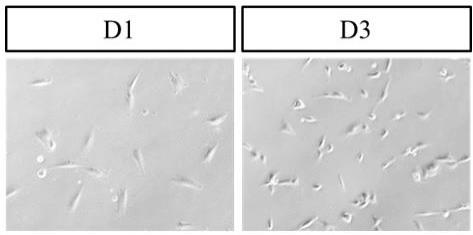
11.图 1 是p1代猪 faps 细胞形态观察。
12.图 2 是猪 faps 细胞的moi值探究,moi值约为30。
13.图 3 是sv40t慢病毒感染72h 的荧光检测结果。
14.图 4 是 puromycin的最适浓度筛选结果,添加4μg/ml的puromycin较好。
15.图 5 是用4μg/ml的puromycin 筛选24h 的检测结果。
16.图 6 是不同代数猪faps细胞的形态观察结果。
17.图 7 是不同代数猪faps细胞的ki67染色结果。
18.图 8 是不同代数猪faps细胞的尼罗红染色结果。箭头所指样细胞为faps分化成的成熟肌内脂肪细胞。
19.图 9 是猪faps细胞成纤维分化结果。
20.图 10 是3d凝胶系统培养猪faps细胞的图片,箭头所指的是死细胞。
21.图 11 是猪faps细胞球体的图片。
具体实施方式
22.下面结合附图和具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。
23.(一)、猪 faps细胞的分离培养1、猪背最长肌的分离与消化1)将购自杭州灯塔种猪有限公司的3日龄仔猪麻醉后放血处死,用75% 乙醇擦拭仔猪全身,经灭菌处理后,将仔猪转移至无菌超净工作台,取出仔猪背最长肌先放入盛有75% 乙醇的50ml离心管中,经涮洗几次后转移至已预冷处理的pbs中。用手术剪快速将其剪碎至1 mm3的大小,随后将剪碎后的组织转移至无菌的15 ml离心管中。
24.2)按组织体积:消化酶体积=1:3加入0.2% 胶原酶ⅰ(由pbs溶液配制)。将组织、消化酶混合液置于 37℃水浴锅消化1 h(具体消化时间根据实际消化情况决定)。
25.3)加入1/2体积含血清的培养基,先后经70 μm、40 μm的滤网过滤,收集滤液,500 g离心6 min。
26.2、用免疫磁珠分选猪 faps 细胞1)去除红细胞去掉离心后的上清液,用1 ml洗涤液(含有0.1% bsa的pbs溶液)重悬细胞,并充分吹散细胞;加入9 ml 红细胞裂解液(博士德生物),额外加入1 ml胰酶(赛默飞公司)防止聚团,充分混匀后在4 ℃裂解4 min;300 g离心4 min。
27.2)去除死细胞去掉离心后的上清液,用1 ml 1
×
的binding buffer(miltenyi biotec)重悬细胞,加入100 μl的死细胞去除剂(miltenyi biotec);充分混匀后在室温静置15 min,300 g离心4 min。
28.3)孵育pdgfrα(cd140a)-biotin抗体去掉离心后的上清液,用1 ml 1
×
的binding buffer重悬、吹散细胞,取20 μl的细胞悬液,用细胞计数仪检测细胞密度;按2.5μg/106个细胞加入pdgfrα (cd140a)-biotin抗体(130-101-905, miltenyi biotec),于4 ℃孵育5 min,300 g离心4 min。
29.4)孵育磁珠去掉离心后的上清液,用2 ml的洗涤液重悬、洗涤细胞;300g 离心4 min;去掉离心后的上清液,1ml 1
×
的binding buffer重悬、吹散细胞;加入20 μl anti-biotin microbeads(130-090-485, miltenyi biotec),4 ℃孵育15 min;300 g 离心4 min。
30.5)猪faps细胞分选、培养根据仪器操作说明安装好分选柱(130-042-109, miltenyi biote),随后取500 μl 1
×
的binding buffer充分润洗分选柱;随后去掉离心后的上清液,取500 μl binding buffer重悬、吹散细胞;用100 μl的移液枪吸取细胞悬液,pdgfrα阴性细胞可通过分选柱流入收集的离心管,收集停留于分选柱的细胞为pdgfrα阳性细胞,即faps细胞。随后用含15�s、1%双抗的完全培养基培养,用显微镜观察faps细胞的形态(图1)。
31.(二)、转染过表达sv40t的慢病毒
1、探究猪faps细胞的感染复数(multiplicityofinfection,moi)1)将生长状态良好的猪faps细胞消化计数后稀释至1
×
105/ml,以100μl/孔接种于96孔板,保证第二天细胞的汇合率约为40%左右。
32.2)吸去培养基,每孔加入50μl/孔培养基,取值moi=3、10、30、10,将病毒原液加入细胞中,轻轻混匀后放入细胞培养箱培养。每孔加入的病毒量参照(表1)。
33.表196孔板中不同moi值加入病毒液体积细胞量moi值病毒滴度病毒液体积1
×
1043108tu/ml0.3μl1
×
10410108tu/ml1μl1
×
10430108tu/ml3μl3)感染后第2天,吸去含病毒的培养液,换上新的完全培养液。
34.4)感染后第3天,感染效率在80%左右,且细胞生长状态良好的组,对应的moi为后续实验的参考moi。
35.结果为:取moi=30时,带gfp荧光的猪faps细胞比例接近80%,故猪faps细胞的moi值约为30(图2)。
36.2、猪faps细胞转染慢病毒1)将状态良好的猪faps细胞接种到24孔板,使细胞浓度为3
×
105/ml,500μl/孔,保证第2天细胞的汇合率为40%左右。
37.2)吸去培养基,每孔加入250μl新鲜培养基及15μl慢病毒,慢病毒感染4h后补充250μl培养基。
38.3)感染后第2天,吸去含病毒的培养液,换上新的完全培养液。
39.4)感染后72h观察转染效率。
40.结果为:按moi=30加入病毒液,感染后72h的转染效率达80%(图3)。
41.(三)、抗生素筛选成功转入sv40t慢病毒的猪faps细胞1)确定puromycin的最适浓度将转入慢病毒的猪faps细胞接种于24孔板,使第2天的细胞汇合率约60%,24h后更换为含不同浓度(2、4、6、8μg/ml)的puromycin完全培养基处理48h,选取能够杀死90%以上的空细胞的最低浓度进行后续实验。经试验发现,添加2μg/ml的puromycin筛选效率较低,而浓度8μg/ml的puromycin影响的猪faps细胞的增殖,则puromycin浓度为4μg/ml时效果较好(图4)。
42.2)puromycin筛选将转入慢病毒的猪faps细胞接种于24孔板,待细胞生长至汇合率为60%~70%时,换成含4μg/ml的puromycin完全培养基培养。当空细胞的死亡率达90%以上,换成不含puromycin的完全培养基培养。连续筛选两代后得到较纯的转入sv40t慢病毒的猪faps细胞,之后正常传代培养。
43.结果为:用含4μg/ml的puromycin完全培养基培养可有效筛选到转入慢病毒的细胞(图5)。
44.(四)、验证猪faps细胞永生化能力1、细胞增殖能力检测1)经嘌呤霉素筛选纯化得到的sv40t阳性的猪faps细胞记为第1代(p1),待细胞生长至80%~85%时传代,在p1、p5、p10、p15、p20、p25、p30代时进行增殖(ki67染色),同时记录白光照片(图6)。
45.2)ki67染色收取细胞,弃培养基,pbs洗3次,4%多聚甲醛溶液固定15min,pbs洗两次,3%bsa室温封闭30min,ki67一抗(购自abcam)过夜孵育,pbs洗3次,荧光二抗(购自abcam)室温孵育60min,pbs洗3次,dapi染5min,pbs洗3次,随后于荧光显微镜观察(图7)。
46.2、细胞成脂分化能力检测1)成脂诱导在p5、p10、p15、p20、p25、p30代时,取一部分猪faps细胞接种于24孔板,待细胞生长至汇合率为90%左右时换成成脂诱导培养基,分为两阶段诱导:mdimedium诱导4天,insmedium诱导天,期间2天换液一次。
47.mdimedium包含ibmx500μm、胰岛素10μg/ml、罗格列酮2μg/ml和地塞米松1μm;insmedium包含胰岛素10μg/ml。
48.2)尼罗红染色吸去培养基,pbs洗3次,随后4%多聚甲醛固定液固定15min,pbs洗3次,尼罗红染料(1:2000稀释)染6min,pbs洗3次,dapi(1:2500)染5min,用于标记细胞核;pbs洗3次,随后在荧光显微镜下观察脂滴沉积情况(图8)。
49.结果为:猪faps细胞传代培养至第30代仍具有良好的增殖和成脂能力,为fap细胞相关研究、培养肉研发提供可靠的细胞模型(图6、7、8)。
50.(五)、建立猪faps细胞成纤维分化诱导方法1)将生长状态良好的猪faps细胞以5
×
104/ml接种于12孔板,待细胞生长至汇合率为85%时,换为包含5�s和10ng/ml的培养基处理48h。
51.2)收取细胞,一部分经漂洗、固定后用于免疫荧光染色(操作参照[0044]);另一部分细胞经pbs漂洗后,加入trizol裂解液,用于rna提取及rt-pcr检测,相关操作按照试剂盒进行。
[0052]
结果为:用包含5�s和10ng/ml的培养基处理48h可诱导猪faps永生化细胞成纤维分化(图9)。
[0053]
(六)、应用于3d培养或细胞培养肉研发1、制备海藻酸钠/明胶3d凝胶球1)将海藻酸钠、明胶、氯化钙溶于蒸馏水中,分别得到浓度为1%、3%、2%的海藻酸钠溶液、明胶溶液、氯化钙溶液。
[0054]
2)将海藻酸钠溶液、明胶溶液和氯化钙溶液分别于98℃下加热3h,紫外照射3h灭菌,氯化钙溶液经0.22μm滤膜过滤确保无菌。
[0055]
3)将海藻酸钠、明胶溶液以体积比1:1混合,得到海藻酸钠/明胶混合溶液。
[0056]
2、在海藻酸钠和海藻酸钠/明胶3d支架上接种faps细胞1)猪faps细胞于37
°
c、5% co2培养箱中培养至细胞汇合率达到约80%时,通过胰蛋白酶消化和离心获得细胞悬液。
[0057]
2)在12孔细胞培养板中加入无菌氯化钙溶液。
[0058]
3)将细胞悬液(1.5
×
105 cell/ml)与海藻酸钠、海藻酸钠/明胶混合溶胶分别按体积比1:1混合均匀,用1ml移液枪逐滴滴入氯化钙溶液中,交联10 min形成凝胶球。
[0059]
4)弃去剩余氯化钙溶液,补充生长培养基,在37
°
c、5% co2培养箱中培养。
[0060]
3、细胞活力检测1)在培养2、4 d后取一部分水凝胶样品于96孔细胞培养板中,pbs充分清洗。
[0061]
2)按照试剂盒说明书操作,加入预先配制好的pi染液,37℃避光孵育20min,用pbs再次清洗后置于荧光倒置显微镜下观察(图10、11)。
[0062]
3)水凝胶样品中的faps细胞自带绿色荧光,已死亡的细胞会被激发出红色荧光,观察视野中绿色荧光与红色荧光的比重即可判断猪永生化faps细胞在3d水凝胶中的生长情况。
[0063]
结果为:猪 faps永生化细胞在3d凝胶体系中展现较好的增殖活力,且能形成细胞球,可用于faps 3d培养和细胞培养肉相关研究(图10、11)。
[0064]
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形,比如用于药物筛选和制备。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。