1.本技术涉及一种瑞马唑仑中间体的制备方法。
背景技术:
2.瑞马唑仑是一种临床常用的短时神经系统抑制剂,临床由静脉施用:手术前镇静,抗焦虑以及手术事件的遗忘用途;在短期诊断,手术或者内窥镜检查过程中进行意识方面的镇静。此外该化合物还可用于包括镇静催眠、抗焦虑、肌肉松弛和抗惊厥等目的。
3.(3s)-7-溴-2,3-二氢-2-氧代-5-(2-吡啶基)-1h-1,4-苯并二氮卓-3-丙酸甲酯是合成瑞马唑仑的重要中间体,多篇文献都对其合成进行了报道。
4.wo2011032692a1报道了采用boc保护的l-谷氨酸-5-甲酯合成化合物4。该路线采用dcc缩合制备化合物3,再用酸脱去boc保护基,进而通过调节ph将氨基游离出来进行关环得到化合物4。该路线缩合反应时间比较长,升高温度虽然能够加快反应速度,但是所得化合物3的手性纯度显著降低。脱boc在强酸溶液中完成,需要大量的碱去中和,三废比较多,不利于商业化生产。
[0005][0006]
wo2019020790a1报道了采用fmoc保护的l-谷氨酸-5-甲酯,合成化合物4。该步骤以l-谷氨酸-5-甲酯为起始原料,先进行fmoc保护得到化合物6,进而在亚硫酰氯作用下制得酰氯后,与化合物2反应得到化合物7。化合物7在三乙胺作用下脱去fmoc并关环成化合物4。该路线式化合物6的制备操作比较繁琐,工艺稳定性不高;在合成化合物7时,同样存在缩合反应时间长的问题,纯度不高的问题。此外所得的化合物4纯度(94%)和收率(40%)均不理想。
[0007]
cn108264499同样报道了fmoc作为保护基制备化合物4,其采用柱层析对化合物4进行纯化,再进一步结晶得到纯度>99%样品,收率为48%。但是显然柱层析并不适合放大生产。
[0008]
技术实现要素:
[0009]
本发明所要解决的技术问题是为了克服现有技术中瑞马唑仑中间体的制备方法杂质含量高、产率低、三废多、工艺稳定性差和成本高中的一个或多个问题,而提供了一种瑞马唑仑中间体的制备方法。本发明的瑞马唑仑中间体的制备方法具有如下一个或多个优点:工艺合理、操作简单、三废少、反应收率高和杂质含量少。
[0010]
本发明是通过以下技术手段解决上述技术问题。
[0011]
本发明提供了一种式i化合物的制备方法,其包括以下步骤:
[0012][0013]
步骤1a:溶剂中,式ii化合物在三乙胺的存在下进行脱保护反应,得到含式ii-1化合物的反应液,与酸的水溶液混合,使用有机溶剂进行萃取,合并水相;所述式ii化合物和所述三乙胺的摩尔比为1:1~1:5;所述溶剂为乙腈或四氢呋喃;
[0014]
步骤2a:使用碱调节步骤1a所得水相的ph,使用有机溶剂进行萃取,合并有机相,除去有机溶剂,进行重结晶,得到式i化合物。
[0015]
在一实施方案中,步骤1a中,所述溶剂的用量可为本领域此类反应常规的用量,较佳地,所述式ii化合物和所述溶剂的质量体积比可为80g/l~120g/l,优选为100g/l。
[0016]
在一实施方案中,步骤1a中,所述式ii化合物和所述三乙胺的摩尔比优选为1:2~1:3,更优选为1:2.5。
[0017]
在一实施方案中,步骤1a中,所述的溶剂优选为乙腈。
[0018]
在一实施方案中,步骤1a中,所述酸的水溶液中的酸可为本领域此类操作常规的酸,较佳地,所述的酸可为无机酸或有机酸。所述的无机酸可为硫酸、盐酸和磷酸中的一种或两种以上。所述的有机酸可为三氟乙酸和三氟甲磺酸中的一种或两种。所述的酸优选为无机酸,更优选为盐酸。所述酸的水溶液的浓度可为0.5mol/l~2mol/l,优选为1mol/l。
[0019]
在一实施方案中,步骤1a中,所述酸的水溶液的用量可为本领域此类操作常规的用量,较佳地,所述酸的水溶液中的酸与所述三乙胺的摩尔比为2:1~3:1,优选为2.6:1。
[0020]
在一实施方案中,步骤1a中,所述的有机溶剂可为本领域此类操作常规的有机溶剂,优选为乙酸乙酯,乙酸异丙酯,二氯甲烷,甲基四氢呋喃,甲基叔丁基醚,甲苯和二甲苯中的一种或两种以上,更优选为甲基叔丁基醚。
[0021]
在一实施方案中,步骤1a中,所述脱保护反应的反应温度可为本领域此类反应常规的反应温度,优选为10℃~50℃,更优选为32℃~38℃。所述脱保护反应的反应时间可为本领域此类反应常规的反应时间,优选为5~16小时,更优选为6小时。
[0022]
在一实施方案中,步骤1a中,所述酸的水溶液的温度、所述混合的温度和所述萃取的温度各自独立地可为本领域此类操作常规的温度,优选为-1℃~2℃。
[0023]
在一实施方案中,步骤1a中,所述萃取的方式可为本领域常规的萃取方式,例如,使用有机溶剂a进行第一次萃取,所得水相再使用有机溶剂b进行第二次萃取。所述有机溶
剂a和所述有机溶剂b独立地可为本领域此类操作常规的有机溶剂,优选为乙酸乙酯,乙酸异丙酯,二氯甲烷,甲基四氢呋喃,甲基叔丁基醚,甲苯和二甲苯中的一种或两种以上,更优选为甲基叔丁基醚。所述有机溶剂a和所述有机溶剂b的体积比可为本领域此类反应常规的体积比,例如为1.5:1~2.5:1,优选为2:1。
[0024]
在一实施方案中,步骤2a中,所述的碱可为本领域此类反应常规的碱,例如为无机碱或有机碱。所述的无机碱可为碳酸钠,碳酸钾和碳酸氢钠中的一种或两种以上。所述的有机碱可为三乙胺,n,n-二异丙基乙胺和吡啶中的一种或两种以上。所述的碱优选为无机碱,更优选为碳酸氢钠。
[0025]
在一实施方案中,步骤2a中,所述的有机溶剂可为本领域此类操作常规的有机溶剂,优选为乙酸乙酯,乙酸异丙酯,二氯甲烷,甲基四氢呋喃,甲基叔丁基醚,甲苯和二甲苯中的一种或两种以上,优选为二氯甲烷。
[0026]
在一实施方案中,步骤2a中,所述碱的用量可为本领域此类操作常规的用量,优选为将所述水相的ph调节至6.5~7.5所需的用量,更优选为将所述水相的ph调节至7所需的用量。
[0027]
在一实施方案中,步骤2a中,所述有机溶剂的用量可为本领域此类操作常规的用量,较佳地,所述有机溶剂与所述水相的体积比可为0.8:1~1.7:1,优选为1:1或1.5:1。
[0028]
在一实施方案中,步骤2a中,所述的重结晶可为本领域常规的重结晶。所述重结晶中,使用的结晶溶剂可为本领域此类操作常规的结晶溶剂,较佳地,所述的结晶溶剂可为有机溶剂或有机溶剂和水的混合溶剂。所述的有机溶剂可为本领域此类操作常规的有机溶剂,优选为甲醇、乙醇、异丙醇、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺和丙酮中的一种或两种以上。所述的结晶溶剂优选为异丙醇、n,n-二甲基甲酰胺、或者n,n-二甲基甲酰胺和水的混合溶剂,更优选为n,n-二甲基甲酰胺和水的混合溶剂。所述的混合溶剂中,所述有机溶剂和水的体积比可为3:4~3:10,优选为2:3。所述有机溶剂的用量可为本领域此类操作常规的用量,较佳地,所述式ii化合物和所述有机溶剂的质量体积比可为350g/l~450g/l,优选为400g/l。
[0029]
在一实施方案中,步骤2a中,当所述结晶溶剂为有机溶剂和水的混合溶剂时,所述的重结晶可包括以下步骤:加入有机溶剂,搅拌至溶清后,升温,再滴加水,然后降温、搅拌并过滤,所得滤饼用水淋洗后,得到式i化合物。所述升温后的温度可为40℃~50℃,优选为45℃。所述降温后的温度可为20℃~35℃,优选为25℃~30℃。
[0030]
在一实施方案中,所述式i化合物的制备方法还可进一步包括式ii化合物的制备方法,其包括以下步骤:
[0031][0032]
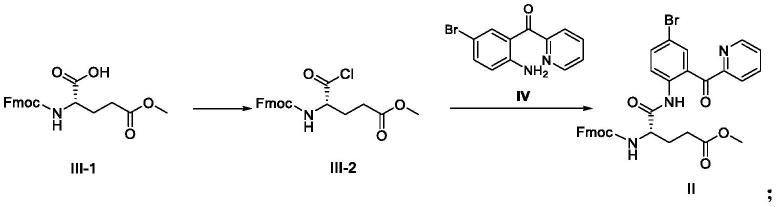
步骤1b:溶剂中,式iii-1化合物在酰氯化试剂和酰氯化反应催化剂的存在下进行酰氯化反应,得到式iii-2化合物;
[0033]
步骤2b:溶剂中,式iii-2化合物与式iv化合物在碱的存在下进行缩合反应,得到式ii化合物。
[0034]
在一实施方案中,步骤1b中,所述溶剂可为本领域此类反应常规的溶剂,例如为1,2-二氯甲烷、二氯甲烷、甲苯和2-甲基四氢呋喃中的一种或两种以上,优选为二氯甲烷。
[0035]
在一实施方案中,步骤1b中,所述酰氯化试剂可为本领域此类反应常规的酰氯化试剂,例如为氯化亚砜,草酰氯或三氯氧磷,优选为氯化亚砜。
[0036]
在一实施方案中,步骤1b中,所述酰氯化反应催化剂可为本领域此类反应常规的催化剂,例如为dmf。
[0037]
在一实施方案中,步骤1b中,所述酰氯化反应的反应温度可为本领域此类反应常规的反应温度,例如为15℃~35℃,优选为15℃~25℃。所述酰氯化反应的反应时间可为本领域此类反应常规的反应时间,例如为4~8小时,优选为6小时。
[0038]
在一实施方案中,步骤2b中,所述溶剂可为本领域此类反应常规的溶剂,例如为1,2-二氯甲烷、二氯甲烷、甲苯和2-甲基四氢呋喃中的一种或两种以上,优选为二氯甲烷。
[0039]
在一实施方案中,步骤2b中,所述碱可为本领域此类反应常规的碱,例如为无机碱或有机碱。所述的无机碱可为碳酸钠,碳酸钾或碳酸氢钠中的一种或两种以上。所述的有机碱可为三乙胺,n,n-二异丙基乙胺或吡啶中的一种或两种以上。所述的碱优选为有机碱,更优选为n,n-二异丙基乙胺。
[0040]
在一实施方案中,步骤2b中,所述缩合反应的反应温度可为本领域此类反应常规的反应温度,例如为-15℃~10℃,优选为0℃~10℃或-10℃~-5℃。所述缩合反应的反应时间可为本领域此类反应常规的反应时间,例如为2~4小时,优选为2小时。
[0041]
在一实施方案中,所述步骤2b可进一步包括以下步骤:所述缩合反应完成后加水猝灭,并使用有机溶剂进行萃取,合并有机相,除去有机溶剂,进行重结晶,得到式ii化合物。所述萃取的方式可为本领域常规的萃取方式,例如,所述加水猝灭后,所得水相使用有机溶剂进行萃取,合并有机相。所述有机溶剂可为本领域此类操作常规的有机溶剂,优选为乙酸乙酯,乙酸异丙酯,二氯甲烷,甲基四氢呋喃,甲基叔丁基醚,甲苯和二甲苯中的一种或两种以上,更优选为二氯甲烷。所述的重结晶可为本领域常规的重结晶,例如,加入良溶剂后,加入不良溶剂,再搅拌、过滤、淋洗并干燥。所述重结晶中,所述良溶剂可为本领域此类操作常规的有机溶剂,优选为甲醇、乙醇、异丙醇、乙酸乙酯和乙酸异丙酯中的一种或两种以上,更优选为乙酸异丙酯。所述的不良溶剂优选为异丙醚、正庚烷、正己烷和石油醚中的一种或两种以上,更优选为正庚烷。所述良溶剂和不良溶剂的体积比可为2:1~3:1,优选为2.5:1。所述良溶剂的用量可为本领域此类操作常规的用量,较佳地,所述式iv化合物和所述良溶剂的质量体积比可为100g/l~200g/l,优选为140g/l。所述搅拌的温度可为本领域此类操作常规的温度,优选为10℃-20℃。所述搅拌的时间可为本领域此类操作常规的时间,优选为1h-3h,更优选为2h。所述淋洗使用的溶剂可为本领域此类操作常规的溶剂,优选为正庚烷。
[0042]
在一实施方案中,所述式i化合物的制备方法还可进一步包括式iii-1化合物的制备方法,其包括以下步骤:
[0043][0044]
溶剂中,式iii化合物和氨基保护试剂在碱的存在下进行氨基保护反应,得到式iii-1化合物。
[0045]
在一实施方案中,所述溶剂可为本领域此类反应常规的溶剂,例如为有机溶剂或有机溶剂和水的混合溶剂。所述有机溶剂可为二氯甲烷、四氢呋喃、甲苯、甲基叔丁基醚、乙腈或二氧六环中的一种或两种以上,优选为乙腈。所述混合溶剂优选为乙腈和水的混合溶剂。所述的混合溶剂中,所述有机溶剂和水的体积比可为1:1~1:10,优选为3:10~7:10,最优选为1:2。
[0046]
在一实施方案中,所述的氨基保护试剂可为本领域此类反应常规的氨基保护试剂,优选为fmoc-osu。
[0047]
在一实施方案中,所述的碱可为本领域此类反应常规的碱,例如为无机碱或有机碱。所述的无机碱可为碳酸钠,碳酸钾或碳酸氢钠中的一种或两种以上。所述的有机碱可为三乙胺,n,n-二异丙基乙胺或吡啶中的一种或两种以上。所述的碱优选为无机碱,更优选为碳酸氢钠。
[0048]
在一实施方案中,所述溶剂的用量可为本领域此类反应常规的用量,较佳地,所述式iii化合物和所述溶剂的质量体积比可为50g/l~200g/l,优选为50g/l~100g/l,例如为66.67g/l。
[0049]
在一实施方案中,所述碱的用量可为本领域此类反应常规的用量,较佳地,所述式iii化合物和所述碱的摩尔比可为1:1.5~1:3,优选为1:2.2。
[0050]
在一实施方案中,所述氨基保护试剂的用量可为本领域此类反应常规的用量,较佳地,所述式iii化合物和所述氨基保护试剂的摩尔比可为1:1~1:2,优选为1:1。
[0051]
在一实施方案中,所述氨基保护反应的反应温度可为本领域此类反应常规的反应温度,例如为10℃~35℃,优选为15℃~20℃。所述氨基保护反应的反应时间可为本领域此类反应常规的反应时间,例如为10~40小时,优选为15~20小时,更优选为16小时。
[0052]
在一实施方案中,所述的氨基保护反应还包括以下后处理步骤:所述的氨基保护反应完成后,对所得反应液进行萃取,合并有机相,除去有机溶剂,得到式i化合物;所述萃取的方式可为本领域常规的萃取方式,例如,当所述氨基保护反应中的溶剂为有机溶剂时,使用有机溶剂a和水进行第一次萃取,所得水相调节ph至3,再使用有机溶剂b进行第二次萃取,得到有机相;当所述氨基保护反应中的溶剂为有机溶剂和水的混合溶剂时,使用有机溶剂a进行第一次萃取,所得水相调节ph至3,再使用有机溶剂b进行第二次萃取,得到有机相。所述有机溶剂a和所述有机溶剂b独立地可为本领域此类操作常规的有机溶剂,优选为乙酸乙酯,乙酸异丙酯,二氯甲烷,甲基四氢呋喃,甲基叔丁基醚,甲苯和二甲苯中的一种或两种以上。所述有机溶剂a优选为乙酸乙酯。所述有机溶剂b优选为二氯甲烷。所述有机溶剂a和所述有机溶剂b的体积比可为本领域此类反应常规的体积比,例如为0.5:1~2.5:1,优选为1:1。
[0053]
本发明还提供了一种式iii-1化合物的制备方法,其包括以下步骤:
[0054][0055]
溶剂中,式iii化合物和氨基保护试剂在碱的存在下进行氨基保护反应,得到式iii-1化合物;所述的氨基保护试剂为fmoc-osu;所述溶剂为有机溶剂或“有机溶剂和水的混合溶剂”;所述有机溶剂为二氯甲烷、四氢呋喃、甲苯、甲基叔丁基醚、乙腈或二氧六环中的一种或两种以上;
[0056]
所述式iii-1化合物的制备方法中其他参数和条件如本发明任一项所述。
[0057]
本发明还提供了一种式ii化合物的制备方法,其包括以下步骤:
[0058][0059]
步骤1b:溶剂中,式iii-1化合物在酰氯化试剂和酰氯化反应催化剂的存在下进行酰氯化反应,得到式iii-2化合物;
[0060]
步骤2b:溶剂中,式iii-2化合物与式iv化合物在碱的存在下进行缩合反应,得到式ii化合物;
[0061]
所述式ii化合物的制备方法中其他参数和条件如本发明任一项所述。
[0062]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0063]
本发明所用试剂和原料均市售可得。
[0064]
本发明的积极进步效果在于:本发明的制备方法有效的降低了反应中所产生的杂质含量,简化纯化方式,以高收率和高纯度制得式i化合物。本发明的制备方法具有以下一个或多个优点:工艺合理,操作简单,反应收率高和纯度高,更有利于扩大化生产。
具体实施方式
[0065]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0066]
以下实施例1-4制得的式i化合物,经hplc检测其难除杂质,其中,hplc的分析方法如下:
[0067]
(1)仪器与试剂
[0068]
电子天平(十万分之一)
[0069]
ph计
[0070]
高效液相色谱仪(推荐agilent 1260infinity
ꢀⅱ
)
[0071]
磷酸二氢铵(ar)
[0072]
磷酸(ar)
[0073]
三乙胺(ar)
[0074]
乙腈(色谱纯)
[0075]
超纯水
[0076]
(2)方法条件
[0077][0078]
(3)溶液配制
[0079]
流动相a:取磷酸二氢铵1.15g,加水800ml使溶解,加入0.5ml三乙胺,用磷酸调节ph值至3.8,加水稀释至1000ml。
[0080]
流动相b:乙腈。
[0081]
稀释液:水-乙腈(75-25,v/v)
[0082]
式i化合物溶液:精密称定制备得到的式i化合物15mg,置100ml量瓶中,用稀释液溶解并稀释至刻度,摇匀,作为式i化合物溶液。
[0083]
注意:在室温条件下,所有溶液应临用新制,样品溶液应在4h内进样分析完毕。
[0084]
(4)测定方法
[0085]
取稀释液10μl注入液相色谱仪,记录色谱图,至少进样1次;取供试品溶液10μl注入液相色谱仪,进样1次。
[0086]
(5)hplc检测结果显示,式i化合物的rt为14.106min;且式i化合物含有以下保留时间的难除杂质中的一种或多种:rt为8.715min、rt=9.18min、rt为16.600min,rt为18.910min和rt为20.721min,后文提及的难除杂质的含量是指以上杂质的总含量。
[0087]
实施例1:式i化合物的合成
[0088][0089]
式iii-1化合物的合成
[0090]
氮气保护下,将100g的式iii化合物加入到500ml的乙腈中,依次加入1l的水和114g的碳酸氢钠(2.2eq),搅拌至溶清;调整温度在15℃~20℃,分批加入209.3g的fmoc-osu(1.0eq);搅拌16h;反应完毕后往反应液中加入1l的乙酸乙酯;搅拌分层分出有机相;水相用500ml的乙酸乙酯萃取一次;合并有机相,用纯化水萃取两次(1l,500ml);合并水相加入1l的二氯甲烷,调节ph到3;分出有机相,水相用500ml的二氯甲烷萃取一次,合并有机相;常压浓缩至总体积约1l;折算成式iii-1化合物为216g,收率91%,纯度95%。溶液直接投到下一步。
[0091]
式ii化合物的合成
[0092]
步骤1:将上步所得式iii-1化合物的二氯甲烷溶液调整温度到15~20℃,加入4g的dmf(0.1eq)和107.3g的氯化亚砜(1.6eq),维持15~20℃搅拌6h;真空浓缩除掉氯化亚砜和副产物氯化氢;
[0093]
步骤2:将所得的酰氯再次溶解于1l的二氯甲烷,降温到-10℃~-5℃;将140g的式iv化合物(0.9eq)溶于1l的二氯甲烷,控制温度在-10℃~-5℃,滴加到上述酰氯溶液中;完毕后滴加145g的n,n-二异丙基乙胺(2eq);维持-10℃~-5℃,搅拌2h;加入1l的水淬灭反应,升温到15℃~25℃,分出有机相;水相用500ml的二氯甲烷萃取一次;合并有机相,浓缩到总体积300ml,滴加1l的乙酸异丙酯,再次浓缩到300ml;滴加700ml的乙酸异丙酯,再滴加400ml的正庚烷;降温到10~20℃,搅拌2h过滤,滤饼用正庚烷淋洗,干燥得301g的灰色固体,纯度98%,收率75%(以式iii-1化合物计)。
[0094]
式i化合物的合成
[0095]
步骤1:将100g的式ii化合物溶于1l的乙腈,往反应液中加入39.3g的三乙胺(2.5eq);升温到32℃~38℃,搅拌6h;将反应液滴加到预冷到-1℃~2℃的1l的1m盐酸水溶液中(期间有固体析出);维持温度在-1℃~2℃,加入500ml的甲基叔丁基醚,搅拌分层;水相再用250ml的甲基叔丁基醚萃取一次;
[0096]
步骤2:维持温度在-1℃~2℃,往水相中加入1l的二氯甲烷,调节ph到7;分出有机相,水相用500ml的二氯甲烷萃取一次;合并二氯甲烷相,浓缩至无液体滴出,往反应液中加入250ml的dmf,搅拌溶清,升温至45℃,滴加375ml的水;完毕后降温到25℃~30℃,搅拌2h,
过滤,滤饼用100ml的水淋洗;干燥得53g的类白色固体(式i化合物),收率85%,纯度99.1%(以式ii化合物计)。
[0097]
以下实施例2-4中,v代表1l/kg。
[0098]
实施例2:合成式i化合物的条件筛选
[0099][0100]
表1:碱及其用量的筛选
[0101][0102]
表2:溶剂的筛选
[0103][0104][0105]
可见,当溶剂选用乙腈或四氢呋喃时,难除杂质的含量较小。
[0106]
表3:温度及反应时间的筛选
[0107][0108]
实施例3:合成式ii化合物的条件筛选
[0109]
表5
[0110][0111]
实施例4:合成式iii-1化合物的条件筛选
[0112]
表6:fmoc氨基保护试剂及其用量的筛选
[0113][0114]
表7:碱及其用量的筛选
[0115][0116]
表8:溶剂及其用量的筛选
[0117]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。