1.本发明属于细胞生物学和医学生物学领域,具体涉及一种评价免疫细胞抗癌有效性的方法。
背景技术:
2.随着工业化、城镇化和人口老龄化进程的加快,以及不良的生活方式和环境污染等问题的存在,恶性肿瘤的发病率、死亡率也呈逐年上升的趋势。目前,肿瘤已经成为威胁国人生命的第一大要素。基于医学攻克肿瘤的必要性和迫切性,个人免疫疗法治疗肿瘤成为医学研究的热门。
3.事实上,所有希望获得临床成功的个人免疫疗法都必须通过大量严格的临床前实验进行评估和验证。传统的单层细胞系和动物模型(患者来源的异种移植物,pdx)是目前临床前评估的两个常见选择。单层细胞系可以在简单的体外培养条件下轻松扩增,但却缺乏肿瘤特异性,然而肿瘤特异性正是个体化治疗评估的关键因素,因此单层细胞系的应用受到限制。pdx能较好的还原其原位肿瘤生物学特征,但建模过程费事费力,且接种成功率不高也是关键的制约因素。肿瘤类器官(patient-derived organoids,pdos)是用取自患病者体内原发性肿瘤,在实验室中培养出的微型3d肿瘤细胞模型,可高度模拟肿瘤组织的特征,并且保留了个体之间的肿瘤异质性。由于传统临床前评估模型的局限,pdo模型有望成为很好的替代。
4.申请号cn2018800890391,发明名称为“免疫细胞类器官共培养物”的专利公开了一种利用类器官和免疫细胞的共培养物来鉴定治疗疾病的试剂的方法。该专利使用的是同一患者来源的免疫细胞(即自体免疫细胞)与肿瘤类器官进行共培养,通过检测共培养物中生物标志物的变化来解决药物筛选的问题。但该专利没有解决免疫细胞本身对肿瘤是否具备抗癌的有效性等问题。
5.因此,有必要提供一种更准确、全面、直观和简便的评估免疫细胞治疗有效性的方法。
技术实现要素:
6.有鉴于此,本发明的目的在于提供一种评价免疫细胞抗癌有效性的方法,具体技术方案如下。
7.一种评价免疫细胞抗癌有效性的方法,包括:步骤一:分离或制备单个或多个免疫细胞或免疫工程细胞;步骤二:制备肿瘤类器官;步骤三:将免疫细胞或免疫工程细胞与肿瘤类器官共培养形成共培养体系,所述免疫细胞或免疫工程细胞和所述肿瘤类器官的共培养比例为1:1-1:10;步骤四:取步骤三所述共培养体系的上清液进行生物标志物检测,判断免疫细胞或免疫工程细胞活化水平和细胞毒性;步骤五:向步骤三所述共培养体系中加入抗体药物培养36-72h,加入caspase3/7荧光探针利用高内涵成像检测凋亡肿瘤细胞;或者,利用酶标仪检测细胞荧光强度。
8.进一步,所述免疫细胞或免疫工程细胞包括t细胞、nk细胞、pbmc细胞、car-t细胞或car-nk细胞。
9.进一步,所述免疫细胞或免疫工程细胞为异体细胞。
10.进一步,所述免疫细胞或免疫工程细胞还可以包括同体细胞。
11.进一步,所述步骤三中免疫细胞或免疫工程细胞与肿瘤类器官在免疫细胞培养基或免疫工程细胞培养基里共培养。
12.加入免疫细胞培养基或工程免疫细胞培养基的目的是为了使类器官适应新的环境。该方法不仅适用于消化成单细胞的类器官,也适用于细胞团。
13.进一步,所述免疫细胞或免疫工程细胞为p1-p10代细胞;所述肿瘤类器官为p1-p10代类器官。
14.进一步,所述生物标志物包括ifn-γ、ldh、il-2、il-6、穿孔素或颗粒酶b。
15.进一步,所述免疫细胞或免疫工程细胞和所述肿瘤类器官的共培养比例为1:2、1:5或1:10。
16.进一步,所述抗体药物包括免疫检查点类抗体药物和自身免疫性疾病抗体药物。
17.优选的,所述抗体药物包括纳武利尤单抗、帕博利单抗、阿达木单抗、培塞利珠单抗、信迪利单抗、卡瑞利珠单抗或特瑞普利单抗。
18.进一步,所述方法用于评价免疫细胞或免疫工程细胞直接抗癌有效性和免疫细胞或免疫工程细胞间接抗癌有效性。
19.基于上述评价方法,建立的免疫细胞抗癌有效性评价模型。
20.有益技术效果。
21.1)由于肿瘤类器官具有与患者肿瘤组织相似的肿瘤特异性,因此本发明方法在不需要构建动物模型的前提下,仅采用肿瘤类器官与免疫细胞共培养,实现了准确评估免疫细胞抗癌的有效性,以及相比传统动物模型提高了操作的简便性。
22.2)本发明方法通过检测相关生物标志物和显微镜下观测肿瘤类器官与免疫细胞或工程免疫细胞的相互作用,以及肿瘤类器官被杀伤后的细胞形态变化,可更为直观、准确和全面地评估异体免疫细胞或异体工程免疫细胞对肿瘤类器官的杀伤情况。提供了一种相比个人定制化精准医疗,普适性更广的免疫细胞抗癌有效性评估平台。
23.3)本发明方法通过加入caspase3/7荧光探针,利用高内涵成像,评估抗体药物诱导激活免疫细胞对肿瘤的杀伤效果,即间接杀伤肿瘤的效力,以此可以反向筛选出对肿瘤有效的药物。
24.4)本发明方法利用atp检测pbmc直接对肿瘤的杀伤效果,以此可以直接筛选出对特定肿瘤有杀伤效力的免疫细胞。
25.5)运用本发明方法提供的平台,可简单、直观的评价car-nk、car-t、nk细胞、t细胞、pbmc等对肿瘤的杀伤作用,其效果能够接近人体里内的真实反应,对于临床精准治疗的药物筛选具有重大价值。
附图说明
26.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍。显而易见地,下面描述中的附图是本发
明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。
27.图1为细胞流式图(a:纯化的nk细胞流式图;b:纯化的cd8 t细胞流式图);图2为car-nk细胞与肿瘤类器官的不同效靶比杀伤效果图(o:类器官;o car-nk:类器官 car-nk);图3为两个时间点下类器官与car-nk不同靶效比的明场杀伤效果图;图4为不同类器官在不同药物浓度下的肉眼可见荧光强度图(a:随机视野及荧光统计图,b:孔板全景图及荧光统计图);图5为用酶标仪检测的pbmc对肿瘤类器官的杀伤作用图;图6为类器官、类器官 工程免疫细胞、工程免疫细胞不同比例杀伤实验设置表;图7为不同患者来源的pbmc细胞对同种抗体药物的ic50值汇总表。
具体实施方式
28.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
29.需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者装置不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者装置所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括该要素的过程、方法、物品或者装置中还存在另外的相同要素。
30.如在本说明书中使用的,术语“大约”,典型地表示为所述值的 /-5%,更典型的是所述值的 /-4%,更典型的是所述值的 /-3 %,更典型的是所述值的 /-2 %,甚至更典型的是所述值的 /-1 %,甚至更典型的是所述值的 /-0.5%。
31.在本说明书中,某些实施方式可能以一种处于某个范围的格式公开。应该理解,这种“处于某个范围”的描述仅仅是为了方便和简洁,且不应该被解释为对所公开范围的僵化限制。因此,范围的描述应该被认为是已经具体地公开了所有可能的子范围以及在此范围内的独立数字值。例如,范围1
〜
6的描述应该被看作已经具体地公开了子范围如从1到3,从1到4,从1到5,从2到4,从2到6,从3到6等,以及此范围内的单独数字,例如1,2,3,4,5和6。无论该范围的广度如何,均适用以上规则。
32.本发明所述的“免疫细胞”是指参与免疫应答或与免疫应答相关的细胞,其包括天然免疫细胞和工程免疫细胞。
33.本发明所述的“抗癌有效性”是指免疫细胞直接对癌细胞的杀伤效力,以及,抗体药物诱导激活免疫细胞对癌细胞的杀伤效力,即间接杀伤效力。
34.实施例1nk细胞的分离和扩增。
35.抽取肿瘤病人10ml外周血,加rpmi 1640基础培养基10ml混匀后,缓慢加入至15ml ficoll淋巴细胞分离液中,在2500rpm,25℃的条件下离心30min;小心吸取中间白细胞层,
用pbs洗涤白细胞层两次,获得外周血单个核细胞(pbmc)。
36.将获得的外周血单个核细胞用macs缓冲液重悬,在500g,25℃的条件下离心10min。弃去上清液,再用80μl macs缓冲液重悬沉淀物,加20μl cd3磁珠去除大部分t细胞,然后于4℃孵育15min。加入2ml macs缓冲液,300g离心10min,弃上清;用500μl macs缓冲液重悬沉淀物,置macs力架进行分选,再用macs缓冲液冲洗三次,每次500μl,得到cd3 t细胞,加入cd56荧光标记的抗体,再通过cd56磁珠正向分选获得nk细胞,用流式细胞仪进行分选,确定所获得的nk细胞纯度,见附图1a。
37.在t25细胞培养瓶中培养0.5*10
6 细胞/ml,然后转移到免疫细胞培养基中培养,所述培养基含有1640培养基、人血清及il-2。前5天,向该培养基中添加抗cd3抗体(正克隆okt-3的最终浓度为10 ng/ml)以刺激nk细胞增殖。培养第5天,洗去含有okt-3的培养基,加入含有il-2 (500 u/ml)和5%人血清的新鲜培养基。在整个培养过程中,每隔一天向培养液中注入新鲜培养基,培养20天,获得扩增的nk细胞。
38.实施例2car-nk细胞的制备。
39.将fcεriγ的胞内信号段作为car的胞内信号段,以cd28作为跨膜区,4-1bb为共刺激因子,构建靶向cd19的car,并人工合成car序列cd19scfv
‑‑
cd28
‑‑
4-1bb—fcεriγ。
40.将所合成的car序列cd19scfv
‑‑
cd28
‑‑
4-1bb
‑‑
fcεriγ整合进慢病毒目的载体质粒中,得到目的质粒。
41.取对数生长期的293t细胞接种于细胞培养皿中,将上述所得到的目的质粒连同包装质粒和包膜质粒加入293t细胞中包装出病毒,最后收集病毒液,浓缩,检测浓缩病毒的浓度,即得目的质粒的病毒浓缩液。
42.将实施例1中获得的nk细胞,加入得到的目的质粒的病毒浓缩液,再加入多肽(多肽的序列为:ac-kkknwfdwtnwlwywk-nh2)以提高转染效率,使其终浓度为20~70ng/μl;然后再37℃孵育4-6h后,收集细胞,600~1000g/min离心4~7min,弃病毒液,pbs洗涤,1640培养基重悬细胞,得到car-nk细胞。
43.实施例3cd8 t细胞的分离与扩增。
44.1、将计数后的淋巴细胞300g,常温离心10min,弃去上清。
45.2、用80ul buffer重悬细胞,根据磁珠说明书加入适量cd8微珠,混匀,在2-4℃避光孵育15min。
46.3、加入1-2ml buffer洗涤细胞,300g,20℃离心10min弃去上清。
47.4、500ul buffer重悬细胞,分选器安装时,标识朝外;分选柱安装时,卡口朝外。
48.5、加入500ul buffer润洗分选柱。
49.6、待润柱的buffer 流空后,开始加样本,下部放一个阴性收集管。(此时,被磁珠标记的阳性细胞会滞留在分选柱上,而没有被标记的成分会流下来)。
50.7、待样本流完之后,开始洗柱子,将500ul的buffer加到分选柱中,同样的操作重复三次。前一次液体流空后再加下一次,不要挂壁。
51.8、待流体流空之后,将分选柱转移到新的阳性收集管中(15mlbd),加1mlbuffer到分选柱中,用活塞快速将样本推下去。如需增加纯度可再过一根新柱子,用流式细胞仪进行
分选,确定所获得的cd8 t细胞纯度,见附图1b。
52.9、使用磁珠抗体之前要重悬,使用涡旋仪涡旋超过30s。
53.10、将所需体积的磁珠抗体转移到管中,加入缓冲液,至少1ml混合涡旋5s。
54.11、将离心管放置在磁铁上1min中,丢弃上清。
55.12、取出管子,取与初始体积相同体积的培养基重悬磁珠抗体。
56.13、将8*104个纯化的t细胞接种于96孔板内,100-200ul培养基。
57.14、加入2ul的磁珠抗体使磁珠与细胞的比例为1:1。
58.15、加入30u/ml的il-2,放入培养箱。
59.16、按1*106个t细胞/ml在24孔板中扩增,加入25ul磁珠抗体和30u/ml il-2。
60.17、每天检查培养物,注意细胞大小和形状。通常在培养基耗尽的细胞培养物中观察到细胞收缩和增值率降低。
61.18、在重新悬浮后,每周至少对细胞进行两次计数。
62.19、当密度超过2*106或者培养基变黄时,将t细胞传代至含有30u/ml il-2的培养基中。
63.20、通常培养到7-10天需要添加新鲜的包含磁珠抗体的培养基进行再刺激。再刺激之前要去除之前加入的磁珠。
64.21、再刺激的间隔时间为,首次再刺激为7-9天,之后的间隔时间为7-10天。
65.实施例4car-t细胞的制备。
66.1、将实施例3获得的cd8 t细胞,以下简称t细胞,接种于car-t培养基中,培养18~24小时。
67.2、将携带嵌合抗原受体序列和嘌呤霉素抗性基因的载体导入步骤1获得的细胞,培养18~24小时。
68.3、收集步骤2获得的细胞,以0.5~1
×
106/ml的细胞密度接种于car-t培养基中,培养36~48小时。
69.4、收集步骤3获得的细胞,以0.5~1
×
106/ml的细胞密度接种于car-t培养基中,并加入嘌呤霉素,培养36~48小时。
70.5、收集步骤4获得的细胞并除去其中的死细胞,以0.5~1
×
106/ml的细胞密度接种于car-t培养基中,并加入嘌呤霉素,培养36~48小时,得到所述car-t细胞。
71.实施例5pbmc的分离。
72.1、在离心管中加入淋巴细胞分离液ficoll。
73.2、取抗凝外周血(全血)与无菌pbs按照1:1充分混匀,用移液管沿管壁缓慢叠加于分层液面上,动作一定要轻,注意保持清楚的界面。外周血,pbs,淋巴细胞分离液最终体积比为1:1:1。
74.3、水平离心400 g
×
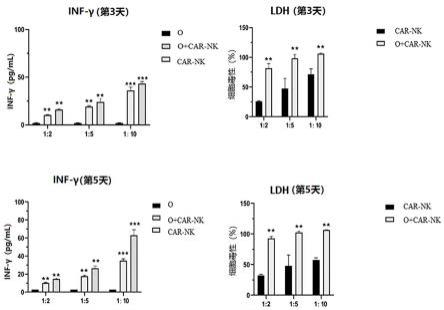
30分钟(可根据淋巴细胞分离液 ficoll 或离心机转子要求调整)。
75.4、离心后可看见管内分为三层,上层为血浆和pbs,下层主要为红细胞和粒细胞,中层为淋巴细胞分离液。在上、中层界面处有一条以单个核细胞为主的白色云雾层狭窄带,
spondin、noggin、egf、fgf-basic、fgf-10、wnt-3a、prolactin、y27632)的无血清培养基中培养3天即得类器官。
97.5、将4中长成的类器官,用pbs收集起来,离心(600g,3min),弃上清,用5ml tryple express混匀并消化10-20min,用细胞计数仪计数,种1000-5000个类器官在48孔板中。
98.实施例9对car-nk细胞与肿瘤类器官不同靶效比杀伤效果的评价。见附图2、附图3。可以理解的是,本实验也可以用car-t细胞进行。
99.1、将实施例6中肾癌类器官从48孔板中,收集至15ml bd 中,并加入tryple,使其成为单细胞。
100.2、将收集到的单细胞计数,并铺于96孔板,并用car-nk细胞培养基培养一天(可以理解的是,也可以使用car-t细胞或其他工程免疫细胞的培养基),使细胞适应培养环境。
101.3、第0天,将类器官以5000个细胞/孔接种于96孔板内,并加入100ul car-nk细胞培养基。
102.4、第1天,收集car-nk细胞并计数,按照表1所示的靶效比(即免疫细胞或免疫工程细胞与肿瘤类器官的共培养比例)分组加入96孔内,保证每孔最终体系体积为150ul。
103.5、每天观察并拍照,于共培养第3、5天收集样本分别检测inf-γ与ldh。实验设置见附图6。该实验分别设置:组别1:类器官(o);组别2:类器官(o);组别3:类器官 car-nk(o car-nk)靶效比1:2;组别4:类器官 car-nk(o car-nk)靶效比1:5;组别5:类器官 car-nk(o car-nk)靶效比1:10;组别6:car-nk靶效比1:2;组别7:car-nk靶效比1:5;组别8:car-nk靶效比1:10。
104.实验结果:如图2(左侧)所示,inf-γ是免疫细胞活化水平相关的细胞因子,是表征免疫细胞活化水平的指标。o car-nk组细胞因子inf-γ的分泌高于car-nk细胞组,其中以靶效比(即共培养比例)1:10组最高。这说明了car-nk细胞的激活和工作可以刺激inf-γ的释放,当肿瘤类器官与car-nk细胞的共培养比例为1:10时,car-nk细胞的活性最高,所以释放的inf-γ的量也就最多,对肿瘤的杀伤力最大。
105.图2(右侧)所示,ldh (乳酸脱氢酶)是一种活细胞内酶,细胞死亡后才会释放至培养上清中,因此可用来检测细胞毒性。ldh在胞浆内含量丰富,当细胞受损伤或死亡时可释放到细胞外,释放出的ldh出现在培养基上清中,可通过酶反应来检测。在乳酸脱氢酶的作用下,nad 被还原生成nadh,nadh和int(a tetrazolium salt)被硫辛酰胺脱氢酶(diaphorase)催化反应生成nad 和红色的甲臜(formazan),甲臜的量与裂解的细胞数成正比,在490nm波长下产生吸收峰,从而可以通过比色来定量乳酸脱氢酶的活性。吸光度与乳酸脱氢酶活性成线性正相关,进而ldh的量可表征被免疫细胞杀死的肿瘤细胞数量。当肿瘤类器官与car-nk细胞的共培养比例为1:10时,被杀死的肿瘤细胞最多。但是当o car-nk的靶效比分别为1:2和1:5时,依然可以检测到ldh的分泌,说明免疫细胞对肿瘤类器官具有杀伤作用。
106.图3示出了第3天和第5天的类器官与car-nk不同靶效比的明场杀伤效果图,分别是5000个类器官:10000个car-nk细胞/ 25000个car-nk细胞/ 50000个 car-nk细胞。
107.实施例10利用高内涵成像表征药物介导cd8 t细胞毒性分析。可以理解的是,本实施例也可
以采用使用cd8 t细胞合成的car-t细胞来进行。
108.1、第一天,收集实施例7中乳腺类器官,将其消化成单细胞,并计数。
109.2、将消化后的细胞用t细胞培养基重悬。所述t细胞培养基为rpmi1640培养基、il-2和fbs。
110.3、铺于96孔板中,每孔5000 细胞/100μl。
111.4、第二天,将t细胞消化并计数。
112.5、用t细胞培养基重悬t细胞,密度为10000个/100ul。
113.6、并将不同浓度的纳武利尤单抗(100、20、4、0.8、0.16nm )与t细胞一起,加入至第一天铺了类器官的96孔板中,一起培养。
114.7、然后以2滴/ml滴加cellevent
®ꢀ
caspase-3/7green readyprobes
™ꢀ
reagent试剂至孔板中。
115.8、分别在72h时在细胞成像仪中观察细胞凋亡情况,并计算得到的平均荧光强度。
116.9、按照两种不同方式在4x目镜下进行拍照,并计算平均荧光强度:(1)随机取10个类器官视图,计算不同药物浓度作用后的平均荧光强度,(2)利用成像仪进行全孔扫描,计算不同药物浓度作用后的平均荧光强度,可见附图4a和4b。
117.实验结果:随着药物浓度的升高,荧光强度越强,肿瘤细胞凋亡越多,说明该抗体药物诱导激活了更多的免疫细胞,所以该抗体药物对该肿瘤细胞具有较强的毒性。
118.可以理解的是,本实施例可使用不同的抗体药物来进行,包括但不限于纳武利尤单抗、帕博利单抗、阿达木单抗、培塞利珠单抗、信迪利单抗、卡瑞利珠单抗或特瑞普利单抗。
119.实施例11利用atp检测pbmc对肿瘤类器官杀伤作用。atp是表征活细胞数量,可分析细胞毒性。
120.1、第一天,收集实施例8中的膀胱类器官,将其消化成单细胞,并计数。
121.2、将消化后的细胞用pbmc细胞培养基重悬。
122.3、铺于96孔板中,每孔5000 细胞/100ul。
123.4、第二天,将pbmc细胞消化并计数。
124.5、用pbmc细胞培养基重悬pbmc细胞,密度为5000个/100ul。
125.6、并将不同浓度的阿达木单抗(100、20、4、0.8、0.16nm)与pbmc细胞一起,加入至第一天铺了类器官的96孔板中,一起培养72h,共检测六个不同pbmc。
126.7、弃上清,用pbs清洗三次,加100ul/孔 1640培养基,再每孔加入100ul atp检测液,避光孵育10min。
127.8、用多功能酶标仪检测发光强度,并分析数据得到半抑制浓度。可见附图5。
128.实验结果:本实施例中,同种药物,对于不同个体来源的pbmc诱导杀伤肿瘤细胞的强度有所不同,可由ic50值看出(见附图7)。ic50值越低药物敏感性越高,效果越好。因此,可通过该体系来帮助不同患者筛选合适的抗癌药物。
129.实验结果为:pbmc1,ic50值2.97pm;pbmc2,ic50值11.61 pm;pbmc3,ic50值12.47 pm;pbmc4,ic50值11.22 pm;pbmc5,ic50值11.28 pm;pbmc6,ic50值5.82 pm。
130.可以理解的是,本实施例可使用不同的抗体药物来进行,包括但不限于纳武利尤
单抗、帕博利单抗、阿达木单抗、培塞利珠单抗、信迪利单抗、卡瑞利珠单抗或特瑞普利单抗。
131.上面结合附图对本发明的实施例进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,而不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离本发明宗旨和权利要求所保护的范围情况下,还可做出很多形式,这些均属于本发明的保护之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
