1.本发明涉及发酵工程领域,具体涉及一株枯草芽孢杆菌、菌剂、应用及制备四甲基吡嗪的方法。
背景技术:
2.四甲基吡嗪(ttmp)是一类含氮的杂环化合物,具有烘烤和坚果的特殊香气,其香味阈值极低,被广泛应用于食品添加剂;在医学上,作为活性生物碱成分,具有扩张血管、控制血小板粘附聚集和血栓形成等良好的药理作用。生产ttmp的方法主要有植物提取、化学合成、生物合成3种。其中微生物发酵法是消费者更倾向的天然ttmp合成方法,其中乙偶姻是合成ttmp的重要前体物质。
3.现有技术中公开了使用地衣芽孢杆菌、枯草芽孢杆菌、贝莱斯芽孢杆菌、解淀粉芽孢杆菌、高温放线菌、甲基营养型芽孢杆菌、短小芽孢杆菌等菌株利用液态发酵、固态发酵、混合蒸馏等方式提升白酒、麸曲、大曲中四甲基吡嗪的含量。例如,cn101445786a公开了一株高产四甲基吡嗪的枯草芽孢杆菌,保藏编号为cctcc no. m 208157,该枯草芽孢杆菌以蔗糖豆饼粉为底物时,37 ℃条件下摇瓶培养120 h可获得4.08 g/l的四甲基吡嗪。但是,现有技术公开的菌株的四甲基吡嗪产量均不高,摇瓶液态发酵产量不超过5.16 g/l。此外,现有技术公开的菌株的丁二醇等副产物的产量较高(约1-20 g/l),不利于乙偶姻的积累。此外,目前通过菌株发酵进行四甲基吡嗪的制备工艺通常为在发酵后再将发酵液采用降温结晶、过滤洗涤方式分离得到四甲基吡嗪,但是降温结晶并过滤后的滤出液中仍有较多的四甲基吡嗪,使得四甲基吡嗪的收率较低,并且这种方法的步骤较多,使得制备四甲基吡嗪的周期较长。
4.筛选高产乙偶姻的菌株,将有效提高四甲基吡嗪的产量,降低生产成本,提高麸曲、大曲、白酒、醋等发酵食品及物料中的风味物质。因此,亟需开发一种具有高产四甲基吡嗪的微生物菌株。
技术实现要素:
5.本发明的目的是为了克服现有技术存在的问题,提供一株枯草芽孢杆菌、菌剂、制备四甲基吡嗪的方法及其应用。该枯草芽孢杆菌的乙偶姻产量高、四甲基吡嗪产量高,能够在较短的发酵时间内得到高产量且纯度高的四甲基吡嗪,用于制备发酵用物料或发酵食品时能够在显著提高其中四甲基吡嗪等有益健康的风味物质的含量的同时还能够降低生产成本,用于生产四甲基吡嗪时能够降低生产成本并且四甲基吡嗪产量高。
6.为了实现上述目的,本发明一方面提供一种枯草芽孢杆菌,该枯草芽孢杆菌的保藏号为cgmcc no. 25206。
7.本发明第二方面提供一种菌剂,所述菌剂含有如前所述的枯草芽孢杆菌。
8.本发明第三方面提供如前所述的枯草芽孢杆菌或如前所述的菌剂在制备四甲基吡嗪中的应用。
25206。
20.本发明第二方面提供一种菌剂,所述菌剂含有如前所述的枯草芽孢杆菌。
21.本发明中,所述菌剂的形态可以是本领域常规的菌剂形态,比如可以为固体、液体或半固体形态。
22.本发明的一些实施方式中,该菌剂含有所述枯草芽孢杆菌的活菌体。
23.本发明中,所述菌剂中活菌体的数量可以在较宽的范围内选择,只要满足相关标准的要求即可。优选的情况下,所述菌剂中活菌体的含量在2
×
10
9 cfu/g菌剂以上。
24.所述菌剂的制备方法可以参照本领域常规的制备方法,在此不再赘述。
25.本发明第三方面提供如前所述的枯草芽孢杆菌或如前所述的菌剂在制备四甲基吡嗪中的应用。
26.本发明第四方面提供一种制备四甲基吡嗪的方法,所述方法包括:将如前所述的枯草芽孢杆菌或如前所述的菌剂接种至发酵培养基中进行发酵。
27.本发明中,所述发酵培养基可以为本领域常用的用于发酵枯草芽孢杆菌的培养基,例如可以为lb培养基、pca培养基、葡萄糖培养基或蔗糖培养基。优选的情况下,所述培养基中还含有铵盐,所述铵盐可以是本领域常规选择,例如硫酸铵、氯化铵、硝酸铵、氨水、磷酸氢二铵、磷酸二氢铵等。优选的情况下,所述铵盐的加入量使得培养基中nh
4
的浓度为1-15 g/l。
28.本发明的一些实施方式中,为了进一步提高四甲基吡嗪的产量,所述发酵培养基的组成为:蔗糖50-100 g/l,豆饼粉20-50 g/l,酵母膏1-10 g/l,磷酸氢二铵5-40 g/l,ph 6.5-7.5。
29.本发明的一些实施方式中,为了进一步提高四甲基吡嗪的产量,所述发酵培养基的组成为:葡萄糖50-120 g/l、酵母浸粉5-15 g/l、磷酸氢二铵10-25 g/l、磷酸氢二钾5-15 g/l、硫酸锰0.1-0.5 g/l,微量元素溶液0.1-5 ml/l。其中,所述微量元素溶液的组成为:七水硫酸铁0.1-5 g/l、四水氯化锰0.1-15 g/l、七水硫酸锌0.1-1 g/l、五水硫酸铜0.1-1 g/l、六水氯化钴0.1-5 g/l。
30.本发明的一些实施方式中,所述发酵的条件为:30-37℃,摇床转速200
‑ꢀ
220 rpm,ph值为6-8,时间为48-150 h。
31.本发明的一些实施方式中,为了进一步提高四甲基吡嗪的产量,可以先使所述枯草芽孢杆菌产生大量乙偶姻,再在适宜枯草芽孢杆菌将乙偶姻转化为四甲基吡嗪的条件下继续发酵。因此,所述发酵可以包括:先进行第一阶段发酵得到第一发酵液,再对第一发酵液进行第二阶段发酵得到第二发酵液。
32.本发明的一些实施方式中,所述第一阶段发酵的条件为:30-37℃,ph值为5-7.5,时间为15-72 h。优选的情况下,所述第一阶段发酵的ph值为5-7,时间为15-48 h。所述枯草芽孢杆菌在上述条件下进行第一阶段发酵时,乙偶姻产量较高,也即第一发酵液中的乙偶姻浓度较高,利于后续四甲基吡嗪的生产。本发明所述的枯草芽孢杆菌能够产生高达78.4 g/l的乙偶姻。本发明的一些实施方式中,第一发酵结束时,所述第一发酵液中的乙偶姻浓度为50-78.4 g/l。
33.本发明的一些方式中,为了进一步提高乙偶姻的产量,所述方法还包括:在第一发酵阶段进行补料。其中,所述补料为补加葡萄糖,补加的方式、葡萄糖的形式可以为本领域
中补加葡萄糖的常规选择,例如可以为采用流加的方式补加葡萄糖溶液。优选的情况下,所述补加使得发酵体系中葡萄糖的消耗率维持在5-10 g/l
·
h。
34.本发明的一些实施方式中,所述第二阶段发酵的条件为:50-90℃,ph值为5-8,时间为24-72 h。优选的情况下,所述第二阶段发酵的ph值为6-7.5。所述枯草芽孢杆菌在上述条件下进行第二阶段发酵时,能够进一步将第一发酵液中的乙偶姻转化为四甲基吡嗪,进而提高四甲基吡嗪的产量。本发明所述的枯草芽孢杆菌能够产生高达17.22 g/l的四甲基吡嗪。
35.本发明的一些实施方式中,为了进一步提高四甲基吡嗪的产量,所述第二阶段发酵还包括:在第二发酵开始时向第一发酵液中加入铵盐。其中,所述铵盐的加入量使得nh
4
的浓度为第一发酵结束时第一发酵液中乙偶姻浓度的1-3倍。
36.本发明的一些实施方式中,所述方法还可以包括:将第二发酵液进行结晶处理,得到含有四甲基吡嗪的晶体。
37.本发明中,所述结晶处理可以为降温结晶处理、蒸发结晶处理等,所述结晶处理可以在第二发酵结束时进行,也可以与第二发酵同时进行。优选的情况系下,所述结晶处理与第二发酵同时进行。
38.本发明的一些实施方式中,为了除去结晶水,所述方法还包括:对所述含有四甲基吡嗪的晶体进行干燥,得到四甲基吡嗪晶体。
39.本发明中,所述干燥可以为本领域常规技术选择,只要能够获得绝干的四甲基吡嗪即可,例如可以为烘干、吸附干燥、真空干燥等。
40.本发明中,所述发酵可以为摇瓶发酵或发酵罐发酵。
41.本发明中,所述第一阶段发酵、第二阶段发酵可以在同一反应容器中进行,也可以在不同反应容器中进行。优选的情况下,为了便于四甲基吡嗪晶体的回收,所述第一阶段发酵、第二阶段发酵在不同反应容器中进行。优选的情况下,发明人研究发现,所述第二阶段发酵在专利202222116015.7所述的反应装置(专利202222116015.7中记载了该反应装置,其全文引入本发明)中进行时,能够进一步提高四甲基吡嗪的产量,并且能够获得纯度高的四甲基吡嗪晶体。此外,使用专利202222116015.7所述的反应装置时,可以向反应釜中连续添加含有乙偶姻的发酵液,定期对四甲基吡嗪进行收集,可实现连续、快速获得纯度高的四甲基吡嗪晶体,省略了后期结晶工艺及清洗工艺,提高了四甲基吡嗪的合成效率,提高了四甲基吡嗪的收率。
42.本发明中,所述晶体的纯度指的是:结晶产品采用气相色谱-质谱联用仪检测,出峰位置与标准品匹配,峰面积与标准品峰面积的比值即为晶体的纯度。
43.本发明第五方面提供如前所述的枯草芽孢杆菌或如前所述的菌剂在制备发酵食品或发酵用物料中的应用。
44.本发明的一些实施方式中,所述发酵食品为白酒、黄酒、酱油和食醋中的至少一种。
45.本发明的一些实施方式中,所述发酵用物料为麸曲和/或大曲。
46.本发明中,所述发酵食品的制备方法可以是本领域常规的方法,本领域技术人员可以根据需要选择。
47.以下将通过实施例对本发明进行详细描述。
48.除非特殊说明,ttmp含量检测方法为:(1)制作标准曲线四甲基吡嗪标准储备液:于10 ml容量瓶中将四甲基吡嗪标准物质用50%(v/v)乙醇溶液溶解配制浓度为1000 mg/l的四甲基吡嗪标准溶液储备液。分别准确移取10.0 ml、5.0 ml、2.0 ml、1.0 ml、0.5 ml、0.25 ml的1000 mg/l四甲基吡嗪标准溶液储备液,置于10 ml容量瓶中,用50%(v/v)乙醇溶液定容至10 ml。最终得到1000 mg/l、500 mg/l、200 mg/l、100 mg/l、50 mg/l、25 mg/l四甲基吡嗪标准溶液,分别吸取3.0 ml四甲基吡嗪标准溶液置于20 ml顶空瓶中,加入3 ml水和3 g nacl及60 μl内标溶液(2-甲氧基-3-甲基吡嗪)进行气相色谱-质谱联用仪检测。色谱柱:hp-ffap(50 m
×
200 μm
×
0.33 μm i.d.,j&w p/n:19091f-105),载气:he,载气流量:1 ml/min;柱温箱:50 ℃保持2 min;以1.5 ℃/min,从50 ℃升至 85 ℃,保持0.1 min;以3.5 ℃/min升至205 ℃,保持2 min;以5 ℃/min,升至235 ℃,保持0 min;进样口温度:250 ℃;进样量:1.0 μl;分流比:2:1;传输线温度:235 ℃;离子源温度:230 ℃;四级杆:150 ℃;四甲基吡嗪监测离子:54,136,42,39;2-甲氧基-3-甲基吡嗪监测离子:124,40,109,42。
49.按照制备的不同浓度的标准溶液测定得到的数据,根据气相色谱-质谱联用仪定量分析软件,以检测结果以2-甲氧基-3-甲基吡嗪为内标,以四甲基吡嗪为目标化合物,建立定量分析方法(即制作标准曲线)。
50.(2)样品采用50%(v/v)乙醇进行稀释得到稀释溶液(稀释倍数根据四甲基吡嗪浓度及标准曲线范围确定),吸取3 ml稀释溶液置于20 ml顶空瓶中,加入3 ml水和3 g nacl及60 μl内标溶液(2-甲氧基-3-甲基吡嗪)进行气相色谱-质谱联用仪检测。色谱柱:hp-ffap(50 m
×
200 μm
×
0.33 μm i.d.,j&w p/n:19091f-105),载气:he,载气流量:1 ml/min;柱温箱:50 ℃保持2 min;以1.5 ℃/min,从50 ℃升至 85 ℃,保持0.1 min;以3.5 ℃/min升至205 ℃,保持2 min;以5 ℃/min,升至235 ℃,保持0 min;进样口温度:250 ℃;进样量:1.0 μl;分流比:2:1;传输线温度:235 ℃;离子源温度:230 ℃;四级杆:150 ℃;四甲基吡嗪监测离子:54,136,42,39;2-甲氧基-3-甲级吡嗪监测离子:124,40,109,42。
51.除非特殊说明,乙偶姻(或双乙酰)及其含量的检测方法为:取1ml样品,加入1 ml o’meara试剂(含有3 g/l肌酸的400 g/l氢氧化钠溶液),震荡1-2 min,37℃反应40 min,反应液呈伊红色表明有乙偶姻或双乙酰生成;将反应液在510 nm检测以显示乙偶姻(或双乙酰)的含量。
52.丁二醇(除非特殊说明,以下丁二醇指的是2,3-丁二醇)含量的检测方法:(1)将丁二醇标准品溶解于50%(v/v)乙醇水溶液制备浓度为1000 mg/l、500 mg/l、300 mg/l、200 mg/l、100 mg/l、50 mg/l的丁二醇标准溶液;内标混合储备液制备:将叔戊醇标准溶液溶解于50%(v/v)乙醇水溶液中,浓度为2%(v/v),得到内标储备液。吸取0.01 ml内标储备液添加到1ml标准溶液中,上样检测。按照以下方法进行气相色谱检测:使用fid检测器,色谱柱:cp-wax 57cb acidic,载气流量:1.0 ml/min,载气:n2,进样量:1.0 μl,分流比:20:1,进样口温度:250℃,检测器温度:250℃;检测方法:35℃(1 min)以3℃/min的升温速度升温至70℃,再以3.5℃/min的升温速度继续升温至180℃,再以15℃/min的升温速度升温至210℃,维持15 min。根据得到的气相色谱检测结果以丁二醇浓度为横坐标、以丁二醇与内标峰面积之比为纵坐标制作丁二醇标准曲线。
53.(2)样品采用50%(v/v)乙醇溶液稀释至标准曲线范围,加入0.01 ml内标(2%(v/v)叔戊醇)混匀,定容至1 ml,上样检测。检测设备采用气相色谱检测,fid检测器,色谱柱:cp-wax 57cb acidic,载气流量:1.0 ml/min,载气:n2,进样量:1.0 μl,分流比:20:1,进样口温度:250℃,检测器温度:250℃。检测方法:35℃(1 min)以3℃/min的升温速度升温至70℃,再以3.5℃/min的升温速度继续升温至180℃,再以15℃/min的升温速度升温至210℃,维持15 min。
54.实施例1本实施例用于说明本发明的枯草芽孢杆菌的获得。
55.1、初步筛选取一定量的某国内酒厂中高温大曲,粉碎后加入盛有玻璃珠的适量无菌的生理盐水中,37℃、200 rpm震荡2 h,得到菌悬液。将制成的菌悬液于80℃下处理20 min,然后稀释至不同梯度,涂布于lb培养基(酵母粉5 g/l,蛋白胨10 g/l,氯化钠10 g/l,琼脂20 g/l)平板上,37 ℃培养24-48 h,挑取生长较好、菌落形态不同的菌株连续划线纯化2-3次,直至为单菌落。
56.挑取单菌落接种于lb培养基活化,按照2%(v/v)接种量转接于v-p培养基(葡萄糖5 g,蛋白胨5 g,nacl 5 g,加水至 1000 ml,ph调至7.2,于121
°
c湿热灭菌20 min),30 ℃培养48 h。将得到的菌液于8000 rpm离心10 min,取1 ml上清检测是否生成乙偶姻(或双乙酰)及其含量,以乙偶姻(或双乙酰)的生成量表示各个菌株代谢葡萄糖生成乙偶姻/双乙酰的能力。对乙偶姻生成量较高的菌株进行16s rdna和gyrb鉴定,选取5株通过16s rdna和gyrb鉴定结果确定为枯草芽孢杆菌进行摇瓶复筛。
57.复筛培养基:蔗糖100 g/l,豆饼粉40 g/l,酵母膏5 g/l,磷酸氢二铵30 g/l,ph 7.5。
58.培养条件:将初筛得到的5株枯草芽孢杆菌的甘油冻存管按照1
‰
(v/v)接种量接种于新鲜lb培养基中37℃培养过夜,检测其od
600
,归一化使其od
600
相同后,按照2 %(v/v)接种量接种于复筛培养基,37℃,200 rpm培养48 h后,取部分菌液于8000 rpm离心10 min,取1 ml上清检测是否生成乙偶姻(或双乙酰)及其含量。将温度提高至55℃,继续培养至120 h,将得到的菌液离心取上清,检测ttmp含量。
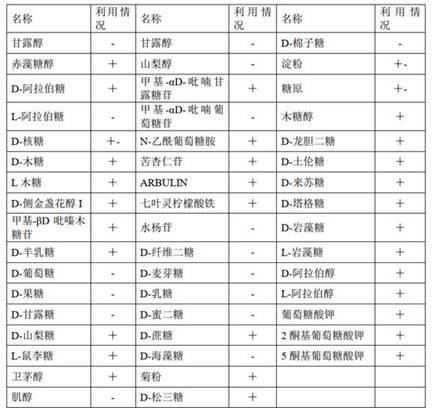
59.筛选得到一株四甲基吡嗪产量达到4.01 g/l的菌株(原始菌株),并对其进行api50检测,对其对碳源利用进行分析,结果如表1所示。
60.表1 菌株api50检测结果
2、诱变育种为提高该菌株(原始菌株)代谢生成乙偶姻的能力,对该菌株进行航天诱变及常温常压等离子体诱变,搭载神州十二号载人飞船太空诱变3个月,在此基础上结合常温常压等离子体诱变,应用上述初筛、复筛方法,使用qpix单克隆挑取机器人和高通量移液工作站于768株突变体中,筛选得到一株四甲基吡嗪产量达7.17 g/l的菌株(诱变菌株),产量较原始菌株提升了78.8%。
61.3、适应性驯化乙偶姻作为ttmp的前体,发酵后期,高浓度的乙偶姻会影响菌体生长、存活和发酵能力,进而限制了乙偶姻产量的提升。因此,采用驯化的方式提升步骤2中得到的菌株(诱变菌株)的性能,使其发酵过程中可积累更多的乙偶姻前体,为后面转化生成ttmp做准备。
62.将步骤2的菌株(诱变菌株)甘油管按照1
‰
(v/v)的接种量接种于30 ml新鲜lb培养基中,37℃,200 rpm培养过夜,将得到的培养液作为种子液按照2%(v/v)接种量转接如含有10 g/l乙偶姻的新鲜lb培养基中,培养过夜,待菌生长至稳定期,持续转接5次,提升菌株的耐受乙偶姻的能力。
63.将驯化后的菌株于37℃在lb平板上培养16 h,菌落形态如图1所示;驯化后的菌株的显微镜下细胞形态如图2所示。
64.将驯化后的菌株进行16s rdna和gyrb鉴定结果确定为枯草芽孢杆菌,保藏于中国微生物菌种保藏管理委员会普通微生物中心(缩写为cgmcc),保藏地址:北京市朝阳区北辰西路1号院3号,其保藏编号为cgmcc no. 25206,保藏日期为2022年06月29日。
65.测试例1本测试例用于说明本技术的菌株的ttmp产量与其他产ttmp的菌株的ttmp产量比
较试验菌株:本发明的枯草芽孢杆菌(保藏编号为cgmcc no. 25206),以及来源于白酒酿造过程中高产四甲基吡嗪的贝莱斯芽孢杆菌cicc 24695(购自中国工业微生物菌种保藏管理中心)。
66.摇瓶ttmp产量检测试验:将甘油管按照1
‰
(v/v)接种于lb培养基中,37℃培养过夜,按照1%(v/v)接种量转接于发酵培养基(蔗糖100 g/l、豆饼粉40 g/l、酵母膏5 g/l、磷酸氢二铵30 g/l,初始ph 7.5)中,37℃,200 rpm培养120 h后,采用上述ttmp的检测方法进行检测。比较结果如表2所示。
67.表2从表中可以看出,cgmcc no. 25206菌株的摇瓶ttmp产量明显高于cicc 24695,且远高于cn101445786b中枯草芽孢杆菌cctcc no. m208157所能产的ttmp含量的最高值(cn101445786b中的实施例6,4.08g/l)。
68.实施例2本实施例用于证明本发明的枯草芽孢杆菌的发酵能力。
69.1、第一阶段发酵发酵培养基的配方:葡萄糖80 g/l、酵母浸粉5 g/l、磷酸氢二铵13.2 g/l、磷酸氢二钾11.4 g/l、硫酸锰0.3 g/l,微量元素溶液1 ml/l(七水硫酸铁2.78 g/l、四水氯化锰10.49 g/l、七水硫酸锌0.288 g/l、五水硫酸铜0.25 g/l、六水氯化钴0.952 g/l,过膜灭菌)。
70.将甘油冻存管保存的本发明的枯草芽孢杆菌按照1
‰
(v/v)接种量接种于新鲜lb培养基中37℃培养过夜,5%(v/v)接种量接种于发酵培养基,发酵过程中控制温度在37℃,控制溶氧为30 %,控制ph值为5.5(使用盐酸溶液对ph进行调节),得到发酵液(即第一发酵液)。过程中每隔2 h用生物传感器(sba-40d型)检测葡萄糖浓度,当葡萄糖浓度下降至10 g/l时进行补料,补料方法为:采用流加的方式补加葡萄糖溶液以维持葡萄糖的消耗率为10 g/l
·
h。过程中每隔2 h取部分发酵液,8000 rpm离心10 min,取1 ml上清检测乙偶姻含量并计算乙偶姻浓度。补加葡萄糖直至葡萄糖消耗速率下降,乙偶姻浓度不再上升,即为补料过程结束。发酵30 h最终得到1 l第一发酵液,第一发酵液中乙偶姻浓度为78.4 g/l,丁二醇浓度为0.477g/l。
71.发酵过程中实时检测发酵液的od值、乙偶姻浓度、ph值,发酵过程中菌株生长性能(od值)、乙偶姻浓度、ph值的曲线结果如图3所示。
72.2、第二阶段发酵及结晶过程将得到的第一发酵液用氨水调节ph至7,立即转入到容量为2 l的反应装置中(所述反应装置为专利202222116015.7中的反应装置),同时加入磷酸氢二铵使nh
4
浓度为发酵液中乙偶姻浓度的2倍,得到1 l的转化体系,开始进行转化,转化过程中控制60℃,搅拌转
速控制200 rpm,并控制ph值为7,转化过程中保证有空气的置换,以便转化反应的顺利进行。
73.在转化过程中,ttmp遇到与转化体系温度具有温差的结晶板,随即析出结晶。转化过程中每隔5 h检测转化体系中乙偶姻的含量,当乙偶姻含量低至1 g/l时即为转化结束。30 h转化结束,按照以下方法进行ttmp产量检测:(1)晶体中ttmp含量检测收集晶体,称量晶体重量为22.95 g。取部分晶体,将晶体用水配制成0.1 g/l的溶液,然后按照上述ttmp含量检测方法定量检测,并计算得到晶体中ttmp含量的百分比,最终计算得到晶体中ttmp的含量。经过检测和计算,最终得到晶体中ttmp的含量百分比为51.33%,也即22.95 g晶体中含有11.78 ttmp。同时通过晶体含量计算得到晶体中含水量为48.67%。
74.(2)对转化完成后的转化体系进行ttmp含量检测,结果显示转化完成后的转化体系中ttmp含量为5.44 g/l。
75.将晶体和转化完成后的转化体系中的ttmp含量相加后,得到ttmp的产量为17.22 g/l转化体系。
76.从收集的晶体中取部分晶体进行晶体纯度检测:由于ttmp一般为三水合四甲基吡嗪,采用烘干的方式获得绝干的ttmp,准确称取绝干的ttmp,用水配制成0.1 g/l的溶液,先采用顶空固相微萃取技术对溶液进行萃取吸附,然后利用气质联用色谱仪检测,得到的谱图与用四甲基吡嗪标准品(购自tci公司,结合3个水,纯度≥98%)得到的谱图进行对标。结果显示,本发明的晶体的谱图的出峰位置与四甲基吡嗪标准品的出峰位置相匹配,同时峰面积比四甲基吡嗪标准品的峰面积高。由于四甲基吡嗪标准品的纯度≥98%,因此本发明的晶体的纯度》98%。
77.实施例3本实施例用于说明含有本发明的枯草芽孢杆菌(保藏编号为cgmcc no. 25206)的菌剂的制备工艺于甘油管中吸取10 μl冻存液,转接入30 ml的新鲜lb培养基中,37℃培养20 h,将得到的培养液作为种子液按照5 %(v/v)接种量转接入3 l高密度发酵培养基(葡萄糖10 g/l,玉米粉10 g/l,酵母浸粉10 g/l,硫酸镁2 g/l,硫酸锰0.2 g/l,碳酸钙1.5 g/l),37℃发酵,全部转孢后结束发酵过程,发酵时间为15 h。离心收集菌泥,用30 g/l淀粉溶液重悬菌泥,然后用喷雾干燥设备进行干燥以制备菌剂产品。喷雾干燥的条件:进风温度120 ℃,出风温度60℃,风量0.4 m3/min,送液速度12 ml/min,喷雾压力为0.01 mpa。菌剂中活菌数为1000
×
10
8 cfu/g,室温放置1年,未发生数量级上的变化。
78.测试例2本测试例用于检测含有本发明的枯草芽孢杆菌(保藏编号为cgmcc no. 25206)的强化细菌曲在制备酿酒过程中的四甲基吡嗪含量种子液的准备:从斜面保藏的菌种上挑取一环菌落接种至30 ml lb培养基中,37℃,200 rpm培养过夜至od
600
为2.67左右,得到种子液。
79.细菌曲的制备:将麸皮:玉米粉:黄豆粉:小麦粉按照质量比例为3:3:2:2混合,麸皮、玉米粉、黄豆粉、小麦粉的总重量为500 g。然后添加磷酸氢二铵6 g,添加水600 ml,混
匀后121 ℃湿热灭菌20 min,得到发酵基质,然后将上述种子液按照10 ml/100 g发酵基质的接种量接种至发酵基质中,37℃培养2天后,60℃继续培养2天,得到细菌曲。
80.细菌曲中ttmp含量检测方法为:将得到的细菌曲用基酒(也即原浆酒,来自于国内某酒厂的原浆酒,原浆酒中ttmp含量为0 mg/l,酒精度为50 %(v/v))进行充分浸泡,超声处理15 min,之后对物料进行串蒸,离心取上清,采用顶空固相微萃取前处理结合气质联用技术,先对上清进行萃取吸附,然后进入气相色谱-质谱联用仪检测得到细菌曲中ttmp的含量。
81.细菌曲中ttmp的含量达460.35 mg/kg细菌曲,明显高于cn 107446860b的曲中ttmp的含量。
82.测试例3本测试例用于说明含有本发明的枯草芽孢杆菌(保藏编号为cgmcc no. 25206)的复合麸曲于食醋酿造过程中的应用。
83.种子液的准备:从斜面保藏的本发明的枯草芽孢杆菌菌种上挑取一环菌落接种至30 ml lb培养基中,37℃,200 rpm培养过夜至od
600
为2.67左右,得到种子液。
84.麸曲制备:20 g麸皮中添加18 g水,混拌均匀,121℃,20 min蒸料灭菌。灭菌后,打散物料,冷却至室温,得到发酵基质,将上述种子液按照5 ml/100 g发酵基质的接种量接种到发酵基质中,37℃培养48 h得到麸曲,即试验组麸曲。
85.将贝莱斯芽孢杆菌cicc 24695按照上述种子液、麸曲制备方法制备得到cicc24695组麸曲。
86.模拟醋醅发酵过程:取出一定量的发酵阶段的醋醅,分为3份,向其中2份醋醅分别加入5%(w/w)试验组麸曲、5%(w/w)cicc24695组麸曲,混拌均匀,分别得到试验组混合物和cicc24695组混合物;剩余1份醋醅不添加上述麸曲作为空白对照组混合物。将试验组、cicc24695组和空白对照组的混合物置于发酵槽中,室温发酵5天后翻醅,之后每2天翻醅一次,酿造过程温度不宜过高。发酵30天后,发酵结束,得到发酵结束的醋醅。
87.样品采集:发酵结束后取样,采用多点取样法取样后混合,测定其乙偶姻、四甲基吡嗪含量。结果如下表表3所示。
88.表3测试例4本测试例用于说明本发明的枯草芽孢杆菌在酿造酱油中的应用泡豆与蒸煮:黄豆水中浸泡4 h后,高温高压蒸煮10 min,室温冷却至30℃,过滤得到熟豆渣。
89.曲制备:熟豆渣:小麦粉按照质量比1:2.5的比例混合,添加0.05%(w/w)的米曲霉(米曲霉购自中国工业微生物菌种保藏管理中心,编号为cicc2066),28℃发酵30 h,发酵第12 h、28 h翻曲各一次,得到成曲。
90.种子液的准备:从斜面保藏的本发明的枯草芽孢杆菌菌种上挑取一环菌落接种至
30 ml lb培养基中,37℃,200 rpm培养过夜至od
600
为2.67左右,得到试验组种子液。
91.将贝莱斯芽孢杆菌cicc24695按照上述种子液制备方法制备得到cicc24695组种子液。
92.酱醪发酵:将成曲与盐水(nacl浓度为160 g/l)混合均匀,盐水添加比例为成曲的1.5倍质量,得到酱醪。将酱醪分为试验组、cicc24695组和对照组,向试验组、cicc24695组中的酱醪分别添加上述试验组种子液、cicc24695组种子液,种子液的添加量使得酱醪中的活菌数为10
8 cfu/ml;空白对照组中不添加种子液的酱醪直接进行发酵。室温下发酵90天,然后经灭菌和过滤得到发酵酱油。分别检测发酵酱油中四甲基吡嗪含量。
93.试验组的发酵酱油中四甲基吡嗪的含量为29.17 μg/l,对照组的发酵酱油中四甲基吡嗪的含量为3.69 μg/l,cicc 24695组的发酵酱油中四甲基吡嗪的含量为13.43 μg/l。
94.以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
