1.本发明涉及细胞炎症模型技术领域,尤其涉及体外感染牛肠道病毒建立牛肾细胞炎症模型的方法。
背景技术:
2.牛肠道病毒(bovine enterovirus,bev)广泛存在于人类和各类动物机体内并且能够引起其呼吸道系统和消化系统的疾病,可引起呼吸道疾病、繁殖障碍、流产、腹泻、产奶量下降、睾丸炎、包皮炎、黏膜炎、流产、死胎、盲肠结肠炎等临床症状,危害牛健康、降低经济效益,bev在发生多种临床症状(呼吸系统、消化系统、繁殖障碍性疾病)牛群中都得到了分离。
3.由于其临床症状在临床实验动物模型中很难被复制,因而bev和机体之间的相互作用、致病机理等相关研究仍处于初步研究的阶段。为此,建立一种细胞模型用于研究bev感染的致病机理,以及用于研究药物对ebv感染的防治作用及其机制,将为临床上防治bev感染提供有价值的参考,对养牛业健康发展具有非常重要的意义。
技术实现要素:
4.本发明的目的在于提供一种体外感染牛肠道病毒建立牛肾细胞炎症模型的方法,解决现有牛肠道病毒危害牛健康、降低经济效益的技术问题。为研究bev体外感染mdbk引起细胞炎症反应及其机制,以及药物对该炎症反应调控作用及其机制提供较理想的体外模型。
5.为了实现上述目的,本发明采用的技术方案如下:
6.体外感染牛肠道病毒建立牛肾细胞炎症模型的方法,所述方法包括如下步骤:
7.步骤1:将牛肾细胞经复苏传代后,使用细胞计数仪计数,确保活细胞数>96%后调整细胞浓度备用;
8.步骤2:牛肾细胞铺在孔装培养板中培养至长成单层;
9.步骤3:设置细胞对照组和不同浓度牛肠道病毒感染组,细胞对照组加入dmem培养液,牛肠道病毒感染组加入相应浓度病毒液,分别与细胞孵育1h后弃液,pbs洗涤3次,加入2000ul不含fbs的dmem培养液后继续培养,分别于第4、8、12、24、36、48h收样,用于细胞分泌炎性相关因子指标的测定。
10.进一步地,步骤1的而具体过程为:将牛肾细胞从液氮罐取出置于37℃恒温水浴锅中使其充分融化,转入含10%fbs的dmem培养液的25cm3细胞瓶中,置于37℃、5%co2培养箱中培养,每天观察细胞生长情况,在24小时弃掉培养液,使用预冷无菌pbs洗涤三次,将细胞碎片等洗净,换上新鲜含10%fbs的dmem培养液继续培养。当细胞长至85%以上时进行传代培养,首先弃掉细胞瓶内的培养液,然后使用预冷无菌pbs洗涤三次,将细胞碎片等洗净,再使用0.25%胰酶消化,再以1∶4的比例进行传代培养,生长良好的传代细胞,将其洗脱并进行细胞计数及稀释,将mdbk细胞浓度调整为1x106cell/ml备用。
11.进一步地,步骤2的而具体过程为:分别设置细胞对照组和6个不同浓度牛肠道病毒感染组,每组3个重复,按2000ul/孔将调整好浓度的mdbk细胞加至12孔板内,置于37℃、5%co2培养箱中培养过夜使细胞贴壁长成单层。
12.进一步地,步骤3的而具体过程为:孔装培养板为12孔培养板,孔内细胞长成单层后弃去培养液,无菌预冷pbs缓冲液洗3次,细胞对照组加入不含fbs的dmem培养液800ul,病毒组分别加入等量的用不含fbs的dmem稀释的不同浓度牛肠道病毒液,置于培养箱中孵育1小时,弃去病毒液,pbs缓冲液清洗3次后,每孔加入2000ul不含fbs的dmem培养液后继续培养,分别于第4、8、12、24、36、48h收集细胞培上清液,用于炎性因子指标测定。
13.进一步地,牛肠道病毒感染组分为6个不同浓度,分别是10-1
、10-2
、10-3
、10-4
、10-5
、10-6
bev。
14.进一步地,炎性因子指标测定指标包括细胞lif、tnf-α、csf2、il-1β、il-2、il-6、il-8、il-10、il-11炎性因子水平。
15.本发明采用bev体外感染mdbk诱导细胞出现炎症反应。该模型具有构建技术方法先、操作简单,模型稳定性好、实用性强的特点。应用本发明建立bev体外感染mdbk细胞炎症模型后,通过测定bev感染mdbk后,细胞lif、tnf-α、csf2、il-1β、il-2、il-6、il-8、il-10、il-11炎性因子水平,可探讨bev病毒不同的感染量、感染时间与mdbk细胞炎性因子水平变化的相关性,可评价bev对mdbk的致炎作用。此外,应用本发明建立bev体外感染mdbk细胞炎症模型,通过测定bev感染mdbk细胞后,在药物的作用下细胞炎性因子水平等,可探讨药物使用量、作用方式、作用时间对细胞炎症反应的影响。因此,本发明为研究bev感染mdbk引起细胞炎症反应及作用机制提供了较理想的体外模型,也为研究药物对bev感染mdbk引起细胞炎症反应的调控作用及机制提供了较好的体外模型,进而为研究bev感染致病的机理及其防控治疗提供参考
16.本技术的采用bev体外感染mdbk诱导细胞出现炎症反应只能针对牛肠道病毒中的探究具有实践应用意义,在其他的病毒感染上没有相应的应用意义。
17.本发明由于采用了上述技术方案,具有以下有益效果:
18.(1)本发明使用牛肠道病毒(bev)作为诱因,建立了体外感染bev诱导mdbk细胞产生炎症的细胞模型的方法,即使用bev体外感染mdbk细胞。该方法技术先进、构建便捷、模型稳定、实用性强。应用本发明建立bev体外感染mdbk细胞炎症模型后,通过测定bev感染mdbk后细胞lif、tnf-α、csf2、il-1β、il-2、il-6、il-8、il-10、il-11炎性因子水平,可探讨bev病毒感染量、感染时间与细胞炎性因子水平动态变化的相关性,进而探讨bev对mdbk的致炎作用强毒。此外,使用本发明建立bev体外感染mdbk细胞炎症模型,通过测定bev感染mdbk细胞后,在药物的作用下细胞的活性和炎性因子水平变化等,可探讨药物对炎症反应的调控作用。因此,本发明为研究bev感染mdbk引起细胞炎症反应及作用机制提供了较理想的体外模型,也为研究药物对bev感染mdbk引起细胞炎症反应的调控作用及机制提供了较好的体外模型,进而为研究bev感染致病的机理及其防控治疗提供参考;
19.(2)本发明首次使用bev作为诱因,建立mdbk细胞炎症模型,确定了bev的最佳感染浓度(滴度为10
2.5
tcid
50
/0.1ml)和mdbk细胞产生炎症的最适感染时间(4-8h),所需的试剂、耗材可从市售渠道获得,细胞培养条件简单,初次进行bev感染mdbk诱导炎症反应研究的人员依照本方法操作步骤可较顺利的建立mdbk炎症模型。
附图说明
20.图1 bev感染mdbk细胞对细胞分泌lif的影响图;
21.图2 bev感染mdbk细胞对细胞分泌tnf-α的影响图;
22.图3 bev感染mdbk细胞对细胞分泌csf2的影响图;
23.图4 bev感染mdbk细胞对细胞分泌il-1β的影响图;
24.图5 bev感染mdbk细胞对细胞分泌il-2的影响图;
25.图6 bev感染mdbk细胞对细胞分泌il-6的影响图;
26.图7 bev感染mdbk细胞对细胞分泌il-8的影响图;
27.图8 bev感染mdbk细胞对细胞分泌il-10的影响图;
28.图9 bev感染mdbk细胞对细胞分泌il-11的影响图。
具体实施方式
29.为使本发明的目的、技术方案及优点更加清楚明白,以下参照附图并举出优选实施例,对本发明进一步详细说明。然而,需要说明的是,说明书中列出的许多细节仅仅是为了使读者对本发明的一个或多个方面有一个透彻的理解,即便没有这些特定的细节也可以实现本发明的这些方面。
30.如图1-9所示,体外感染牛肠道病毒建立牛肾细胞炎症模型的方法,包括如下步骤。
31.(一)材料选取:bev体外感染mdbk细胞炎症模型方法建立的研究过程。其中,牛肠道病毒bev、mdbk细胞由本专利申请者制备保存;胎牛血清fbs、dmem购自gibco公司;炎性因子elisa检测试剂盒购自上海酶联生物科技公司;其他试剂均为国产分析纯产品。
32.(二)实验方法
33.(1)mdbk细胞的复苏和培养:将牛肾细胞从液氮罐取出置于37℃恒温水浴锅中使其充分融化,转入含10%fbs的dmem培养液的25cm3细胞瓶中,置于37℃、5%co2培养箱中培养,每天观察细胞生长情况,在24小时弃掉培养液,使用预冷无菌pbs洗涤三次,将细胞碎片等洗净,换上新鲜含10%fbs的dmem培养液继续培养,待细胞长至85%时进行传代,传代培养时首先使用预冷无菌pbs洗涤三次,将细胞碎片等洗净弃之,然后使用0.25%胰酶消化,再以1∶4的比例进行传代培养。生长良好的传代细胞,使用0.25%胰酶消化,细胞计数仪计数活细胞数>96%,将mdbk细胞浓度调整为1x106cell/ml备用。
34.(2)细胞铺板培养:分别设置细胞对照组和6个不同浓度bev病毒感染组(10-1
、10-2
、10-3
、10-4
、10-5
、10-6
bev),每组3个重复,按2000ul/孔将调整好浓度的mdbk细胞加至12孔板内,置于培养箱中培养过夜使细胞贴壁长成单层。
35.(3)细胞处理:长成单层细胞的培养孔弃去培养液,无菌预冷pbs缓冲液洗3次,细胞对照组加入不含血清dmem培养液800ul,病毒组分别加入等量的用不含血清dmem培养液稀释的不同浓度bev病毒液(10-1
、10-2
、10-3
、10-4
、10-5
、10-6
bev),置于培养箱中孵育1h,弃去病毒液,pbs缓冲液清洗3次后,每孔加入2000ul不含fbs的dmem培养液后继续培养,分别于第4、8、12、24、36、48h收集培养上清液,用于指标测定。
36.检测指标包括细胞lif、tnf-α、csf2、il-1β、il-2、il-6、il-8、il-10炎性因子水平。
37.(4)细胞炎性因子检测:细胞处理后分别在第4、8、12、24、36、48h时间点取上清,按照试剂盒说明书测定lif、tnf-α、csf2、il-1β、il-2、il-6、il-8、il-10炎性因子水平。
38.(5)实验数据采用ssp22.0统计软件进行单因素方差分析(one-way anova),dun can组间比较,结果以χ
±
s表示。肩标*表示与对照组相比p<0.05,肩标**表示与对照组相比p<0.01。
39.(三)实验结果
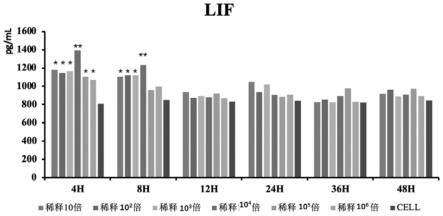
40.bev体外感染mdbk细胞对细胞分泌lif的影响(图1)
41.图1显示,与细胞对照组相比,10-4
bev病毒组感染mdbk细胞4h和8h后极显著升高lif水平(p<0.01)。10-1
、10-2
、10-3
bev病毒组感染mdbk细胞4h和8h后显著升高lif水平(p<0.05);10-4
、10-5
bev病毒组感染mdbk细胞4h后细胞分泌lif水平升高,与细胞对照组相比差异显著(p<0.05)。
42.bev体外感染mdbk细胞对细胞分泌tnf-α的影响(图2)
43.图2显示,与细胞对照组相比,10-4
bev病毒组感染mdbk细胞4h和8h后极显著、显著升高tnf-α水平(p<0.01,p<0.05),10-1
bev病毒组感染mdbk细胞4h后显著升高tnf-α水平(p<0.05),10-2
bev病毒组感染mdbk细胞4h和8h后显著升高tnf-α水平(p<0.05)。
44.bev体外感染mdbk细胞对细胞分泌csf2的影响(图3)
45.图3显示,与细胞对照组相比,10-4
bev病毒组感染mdbk细胞4h和8h后极显著、显著升高tnf-α水平(p<0.01,p<0.05)。
46.bev感染mdbk细胞对细胞分泌il-1β的影响(图4)
47.图4显示,与细胞对照组相比,10-4
bev病毒组感染mdbk细胞4h后极显著升高il-1β水平(p<0.01);10-1
bev病毒组感染mdbk细胞8h后显著升高il-1β水平(p<0.05)。
48.bev感染mdbk细胞对细胞分泌il-2的影响(图5)
49.图5显示,与细胞对照组相比,10-3
bev病毒组感染mdbk细胞4h后极显著高、显著升高il-2水平(p<0.01,p<0.05)。
50.bev感染mdbk细胞对细胞分泌il-6的影响(图6)
51.图6显示,与细胞对照组相比,10-4
、10-5
bev病毒组感染mdbk细胞8h显著升高il-6水平(p<0.05)。10-4
bev病毒组感染mdbk细胞48h极显著升高il-6水平(p<0.01)。
52.bev感染mdbk细胞对细胞分泌il-8的影响(图7)
53.图7显示,与细胞对照组相比,10-4
bev病毒组感染mdbk细胞4h后极显著升高il-8水平(p<0.01);10-2
、10-4
bev病毒组感染mdbk细胞8h后显著升高il-8水平(p<0.05)。
54.bev感染mdbk细胞对细胞分泌il-10的影响(图8)
55.图8显示,与细胞对照组相比,10-4
bev病毒组感染mdbk细胞4h后极显著升高il-10水平(p<0.01);10-4
bev病毒组感染mdbk细胞8、12、24h后显著升高il-10水平(p<0.05);10-5
bev病毒组感染mdbk细胞4h后显著升高il-10水平(p<0.05);10-1
、10-2
bev病毒组感染mdbk细胞8h后显著升高il-10水平(p<0.05)。
56.bev感染mdbk细胞对细胞分泌il-11的影响(图9)。
57.图9显示,与细胞对照组相比,10-4
bev病毒组感染mdbk细胞4、8h后极显著升高il-11水平(p<0.01);10-4
bev病毒组感染mdbk细胞12h后显著升高il-11水平(p<0.05)。
58.(四)研究结论
59.在本方法建立研究中,bev与mdbk细胞共同孵育1h后,在4、8、12、24、36、48h取培养上清液,提取病毒rna,使用rt-pcr扩增检测bev特异性核酸,使用琼脂糖凝胶电泳观察bev特异性扩增条带。结果显示,bev病毒感染后4h-48h均检测到bev特异性条带,表明bev成功感染mdbk细胞。为研究不同bev感染量、作用时间对mdbk细胞炎症的影响,设置了细胞对照组和6个bev浓度对照组,采样时间设置为4、8、12、24、36、48h,检测指标包含lif、tnf-α、csf2、il-1β、il-2、il-6、il-8、il-10炎性因子水平。通过bev病毒感染组与细胞对照组对比,10-4
bev病毒组感染mdbk细胞4h极显著升高lif、tnf-α、csf2、il-1β、il-8、il-10、il-11水平(p<0.01);10-4
bev病毒组感染mdbk细胞8h显著升高lif、tnf-α、csf2、il-6、il-8、il-10、il-11水平(p<0.05);10-1
、10-2
、10-3
、10-5
bev病毒组感染mdbk细胞也一定程度上改变了细胞炎性因子分泌水平,诱导细胞产生炎症。
60.因此,本发明成功建立了牛肠道病毒bev体外感染牛肾细胞mdbk细胞炎症模型,选择10-4
bev作为该模型的病毒感染剂量,感染时间确定为4h。
61.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。