一种sotorasib新晶型及其制备方法与应用
技术领域
1.本发明属于医药技术领域,具体说是sotorasib的新晶型及其制备方法与应用。
背景技术:
2.sotorasib,化学名为(1r)-6-氟-7-(2-氟-6-羟基苯基)-1-[4-甲基-2-(1-甲基乙基)-3-吡啶基]-4-[(2s)-2-甲基-4-(1-氧代-2-丙烯-1-基)-1-哌嗪基]-吡啶并[2,3-d]嘧啶-2(1h)-酮,其结构式如下:
[0003][0004]
sotorasib是由安进公司开发的用于治疗转移性非小细胞肺癌的药物(制剂商品名:lumakras),于2021年5月获fda批准上市。2021年1月29日,中国国家药品监督管理局(nmpa)的药品审评中心(cde)授予了sotorasib突破性疗法认定。
[0005]
sotorasib属水难溶性物质,剂型一般为口服片剂,因此对其晶型的研究具有十分重要的意义。原研安进公司的专利wo2020236947公开了sotorasib无定形,无水物form i、ii、iii,水合物form i、ii以及多种溶剂合物;wo2020236948公开了sotorasib盐酸盐form i-vii,磷酸盐form i,甲磺酸盐form i。另外,teva的专利wo2021236920公开了sotorasib无水物form iv,水合物form h2、h3、h4,以及琥珀酸盐。
技术实现要素:
[0006]
本发明提供一种sotorasib的新晶型,均不同于现有技术中公开的各种晶型,结构经pxrd、nmr、dsc、tga和gc表征确认。该晶型化学性质稳定,容易保存,适合制成各种制剂。相比现有晶型,新晶型的制备过程简单易行,适合工业化生产,为sotorasib制剂开发提供了新的选择。
[0007]
本发明提供的sotorasib的新晶型,为sotorasib的乙酸溶剂化物。
[0008]
现有技术中公开的sotorasib晶型,有无水物、水合物,也有溶剂合物,如乙醇化物、乙酸乙酯化物等,而乙酸为弱酸,通常认为会与sotorasib形成乙酸盐,例如现有技术中公开了sotorasib与琥珀酸成盐。
[0009]
在本发明中,发明人通过控制乙酸与sotorasib的配比、溶清和析晶条件,获得sotorasib的乙酸溶剂化物,经过相关表征确认,为sotorasib的一种新晶型,与现有公开的sotorasib晶型均不相同。
[0010]
在本发明中,术语“溶剂化物”依据其公认的含义进行解释,即它涉及掺入sotorasib晶体结构中的溶剂分子。
[0011]
上述的sotorasib的新晶型,其x射线粉末衍射在衍射角2θ为:7.0
°±
0.2
°
、9.1
°±
0.2
°
、9.6
°±
0.2
°
、10.6
°±
0.2
°
、13.7
°±
0.2
°
、14.2
°±
0.2
°
、14.5
°±
0.2
°
、16.6
°±
0.2
°
、17.0
°±
0.2
°
、17.6
°±
0.2
°
、18.6
°±
0.2
°
、19.1
°±
0.2
°
、19.5
°±
0.2
°
、21.0
°±
0.2
°
、21.4
°±
0.2
°
、22.4
°±
0.2
°
、22.8
°±
0.2
°
、23.1
°±
0.2
°
、24.3
°±
0.2
°
、24.7
°±
0.2
°
、25.3
°±
0.2
°
、25.5
°±
0.2
°
和28.5
°±
0.2
°
的一处或多处特征峰处。
[0012]
进一步地,本发明sotorasib的新晶型的差示扫描量热法热图包含在172~175℃起始的吸热。
[0013]
进一步地,本发明sotorasib的新晶型的热重分析热图包含从35~40℃加热至195~200℃时9.7~10.2%的重量损失。
[0014]
进一步地,本发明sotorasib的新晶型的气相检测残留溶剂,含有88000~95000ppm的乙酸。
[0015]
本发明还提供sotorasib的新晶型的制备方法,包括以下步骤:
[0016]
1)将sotorasib固体用乙酸溶清并过滤;
[0017]
2)将sotorasib的乙酸溶液滴加到水和乙酸的溶剂化物中;
[0018]
3)将析出的固体抽滤并烘干。
[0019]
进一步地,步骤1)中的sotorasib固体与乙酸的质量体积比为1:1~1:3g/ml。
[0020]
进一步地,步骤1)和步骤2)中的sotorasib固体溶清温度和析晶温度均为30~50℃。
[0021]
本发明还提供上述sotorasib的新晶型的用途,用于制备治疗kras g12c基因突变引起的相关疾病的药物。
[0022]
本发明还提供一种药物组合物,包含有效治疗量的上述sotorasib新晶型及药学上可接受的赋形剂。
[0023]
通过实施上述技术方案,本发明具有如下的优点:
[0024]
本发明提供一种sotorasib的新晶型,化学性质稳定,容易保存,适合制成各种制剂。而且制备过程简单易行,适合工业化生产。
附图说明
[0025]
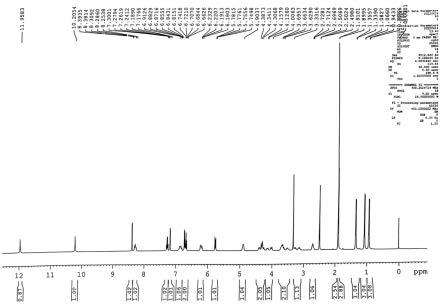
附图1为本发明所得sotorasib的新晶型的1h nmr图谱;
[0026]
附图2为本发明所得sotorasib的新晶型的
13
c nmr图谱;
[0027]
附图3为本发明所得sotorasib的新晶型的pxrd图谱;
[0028]
附图4为本发明所得sotorasib的新晶型的dsc图谱;
[0029]
附图5为本发明所得sotorasib的新晶型的tga图谱;
[0030]
附图6为本发明对比例1所得sotorasib的新晶型的pxrd图谱。
具体实施方式
[0031]
结合以下实施例对本发明做详细说明,所述实施例详细描述本发明的晶型的制备和使用方法。对本领域技术人员显而易见的是,对于材料和方法两者的许多改变可在不脱
离本发明范围的情况下实施。
[0032]
实施例1:
[0033]
sotorasib乙酸溶剂化物的制备
[0034]
向5g sotorasib固体加入10ml乙酸,升温至35℃溶清,过滤。将7ml乙酸和30ml水混合均匀,升温至35℃,再慢慢滴入上述所得滤液,30min滴完。滴完35℃保温搅拌1.0h,有较多固体析出。抽滤,滤饼用少量水洗涤,40℃真空干燥,得白色粉末4.8g,即乙酸溶剂化物。
[0035]1h nmr图谱见附图1,
13
c nmr图谱见附图2。产物核磁表征结果如下:
[0036]1h nmr(400mhz,dmso-d6),δ11.96(1h,s),10.21(1h,s),8.39(1h,d),8.29(1h,t),7.27(1h,q),6.90(1h,d),6.91~6.82(1h,m),6.74~6.66(2h,m),6.23~6.18(1h,m),5.78~5.75(1h,dd),4.90(1h,s),4.39~4.31(2h,m),4.16~4.01(1h,m),3.70~3.49(2h,m),3.28~3.12(1h,m),2.71(1h,t),1.91(2.5h,s,hoac),1.90(3h,s),1.34(3h,s),1.07(3h,s),0.93(3h,s)。
[0037]
13
c nmr(100mhz,dmso-d6),δ172.5,165.5,163.9,163.0,161.9,159.4,157.4,157.3,154.3,153.7,151.2,150.0,148.8,145.8,144.9,144.7,132.1,132.0,131.3,128.4,128.2,123.7,123.4,123.2,112.2,110.3,110.2,110.1,110.1,106.3,106.1,105.8,105.8,51.9,51.5,49.4,45.9,45.1,44.1,42.1,40.6,40.4,39.5,39.3,30.3,22.4,22.1,21.5,17.5,16.0,15.3。
[0038]
nmr 0.8mol hoac。
[0039]
pxrd图是在bruker d2 phaser型x-射线衍射仪上采集,具体参数如下:
[0040]
光源:cu ka(1.5406a)
[0041]
管压:30kv
[0042]
管流:10ma
[0043]
发散狭缝:1.0mm
[0044]
接收狭缝:3.0mm
[0045]
防空气散射狭缝(刀口):1.0mm
[0046]
2θ扫描范围:2
°
~4
°
[0047]
扫描速率步时:0.2s/step
[0048]
步长:0.02
°
[0049]
pxrd图谱见附图3,pxrd峰表见表1。
[0050]
表1 pxrd峰值表
[0051]
角度(2θ)相对强度(%)角度(2θ)相对强度(%)7.067.624.39.99.179.924.713.79.634.325.342.810.6100.025.529.711.16.026.25.011.82.027.08.913.729.827.64.2
14.295.528.16.214.517.528.510.716.690.528.75.017.050.529.45.317.638.530.33.818.634.030.95.719.138.431.23.219.527.633.02.320.36.233.64.221.016.733.94.221.446.034.61.822.417.535.52.022.812.436.42.523.113.136.75.423.87.037.73.6
[0052]
dsc吸热起始在约174℃,见附图4。tga包含当从约39℃加热至约197℃时约10.1%的重量损失,见附图5。(1.0mol hoac)。
[0053]
通过gc测定残留溶剂:hoac 93358ppm(1.0mol hoac)。
[0054]
实施例2:
[0055]
sotorasib乙酸溶剂化物的制备
[0056]
向5g sotorasib固体加入15ml乙酸,升温至50℃溶清,过滤。将8ml乙酸和40ml水混合均匀,升温至50℃,再慢慢滴入上述所得滤液,30min滴完。滴完50℃保温搅拌1.0h,有较多固体析出。抽滤,滤饼用少量水洗涤,40℃真空干燥,得白色粉末3.9g,即乙酸溶剂化物。
[0057]
产物表征结果同实施例1。
[0058]
实施例3:
[0059]
sotorasib乙酸溶剂化物的制备
[0060]
向5g sotorasib固体加入5ml乙酸,升温至40℃溶清,过滤。将7ml乙酸和30ml水混合均匀,升温至40℃,再慢慢滴入上述所得滤液,30min滴完。滴完40℃保温搅拌1.0h,有较多固体析出。抽滤,滤饼用少量水洗涤,40℃真空干燥,得白色粉末4.7g,即乙酸溶剂化物。
[0061]
产物表征结果同实施例1。
[0062]
对比例1:
[0063]
向5g sotorasib固体加入10ml乙酸,升温至60℃溶清,过滤。将7ml乙酸和30ml水混合均匀,升温至60℃,再慢慢滴入上述所得滤液,30min滴完。滴完60℃保温搅拌1.0h,有较多固体析出。抽滤,滤饼用少量水洗涤,40℃真空干燥,得白色粉末4.2g。
[0064]
产物pxrd表征结果同原研专利wo2020236947的无水form i,详见附图6。
[0065]
对比例2:
[0066]
向5g sotorasib固体加入5ml乙酸,升温至40℃溶清,过滤。将40ml水升温至40℃,再慢慢滴入上述所得滤液,30min滴完。滴完40℃保温搅拌1.0h,有较多固体析出。抽滤,滤
饼用少量水洗涤,40℃真空干燥,得白色粉末4.4g。
[0067]
产物pxrd表征结果同对比例1。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。