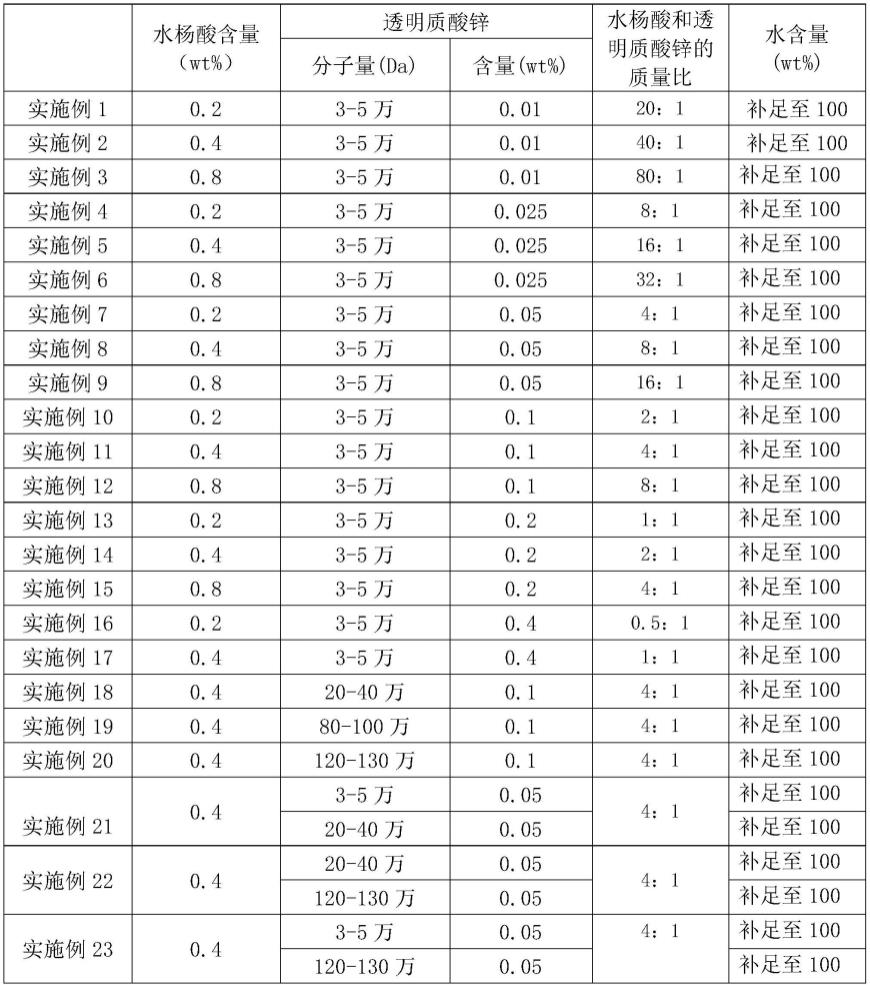
基于不饱和脂肪酸缀合的cp2c靶向肽的抗癌剂
技术领域
1.本发明涉及基于cp2c靶向肽的抗癌剂。
背景技术:
2.尽管迄今为止已经开发和使用了许多蛋白质/肽抗癌剂和基于小分子化合物的抗癌剂,但这样的抗癌剂不仅选择性地作用于体内的癌细胞,而且会引起还影响正常细胞的严重副作用,并且其效力由于药物抗性癌细胞的出现而是微不足道的。另外,由于许多正在开发的蛋白质/肽抗癌剂具有短的体内半衰期,因此已经进行了多种研究以克服这一缺点。尽管全世界竞相努力来开发抗癌剂,但尚未开发出没有体内稳定性、安全性和药物抗性问题的抗癌剂。因此,如果开发出确保能够在体内保持长时间段的稳定性、可以不仅选择性地去除多种类型的癌细胞、而且还作用于药物抗性癌细胞的抗癌剂,那么将能够为全世界带来高附加值。
3.公开内容
4.技术问题
5.本发明的目的是提供基于cp2c靶向肽的抗癌剂,其确保了能够在体内保持长时间段的稳定性,可以仅选择性地去除多种类型的癌细胞,而且还作用于药物抗性癌细胞。
6.技术方案
7.根据本发明的cp2c靶向肽是指通过与转录因子cp2c结合以抑制cp2c转录因子复合物(cp2c同四聚体和cp2c/cp2b/pias1异六聚体)的形成来诱导癌细胞特异性细胞死亡的肽。由于cp2c靶向肽(仅由抗癌作用所必需的氨基酸组成的tyr-pro-gln-arg(seq id no:1))对应于最小尺寸的肽。因此,基本上包含这四个氨基酸并且通过与cp2c蛋白相互作用来显示出抗癌作用的肽可用作根据本发明的cp2c靶向肽。
8.根据本发明的cp2c靶向肽可以是由包含seq id no:1的氨基酸序列的4至20个氨基酸组成的肽。优选地,根据本发明的cp2c肽可以是包含6个氨基酸(6aa)
′
nypqrp(asn-try-pro-gln-arg-pro,seq id no:2)’的肽(acp52)。
9.根据本发明的cp2c靶向肽可通过与细胞穿透肽(cell-penetrating peptide,cpp)结合来用于增强细胞通透活性。
10.例如,根据本发明的cp2c靶向肽可以是包含内化rgd(internalizing rgd,irgd)的肽作为由nypqrp(asn-try-pro-gln-arg-pro)和细胞穿透肽(cpp)组成的肽,所述内化rgd是由9个氨基酸(9aa)
‘
[crgdkgpdc(cys-arg-gly-asp-lys-gly-pro-asp-cys,seq id no:3]’组成的肽。作为根据本发明的cp2c靶向肽的一个实例,
‘
acp52c’是其中irgd与acp52的c端pro结合,并且nh2(酰胺基)与irgd的c端结合的肽。
[0011]
在先前的研究中,出于确保由本技术人常规开发的cp2c靶向肽的体内稳定性的目的,制备了与饱和脂肪酸棕榈酰酸结合的cp2c靶向肽-脂肪酸缀合物,并且预计当使脂肪酸与cp2c靶向肽结合时,通过与血液中的白蛋白结合而提高了体内稳定性从而提供了高治疗作用。然而,其实际作用不如单独使用cp2c靶向肽的情况,这确定了棕榈酰酸作为饱和脂肪
酸彼此聚集以形成胶束结构,并因此cp2c靶向肽无法与白蛋白结合,并且细胞穿透肽irgd也进入到胶束中以抑制向癌细胞的递送。确定了不会形成胶束的不饱和脂肪酸可以用作克服这样的问题的方法,并且作为通过合成其中全顺式-二十二碳-4,7,10,13,16,19-六烯酸(dha)分别与acp52和acp52c结合的复合物在多种癌细胞系和hep3b异种移植小鼠模型中分析作为癌症治疗剂的特征的结果,确定了优异的作用,从而完成了本发明。
[0012]
不饱和脂肪酸可以是c
12
至c
22
脂肪酸,但不限于此。在本发明的一个示例性实施方案中,不饱和脂肪酸可以是c
22
不饱和脂肪酸,例如全顺式-二十二碳-4,7,10,13,16,19-六烯酸(dha)。
[0013]
根据本发明的cp2c靶向肽脂肪酸缀合物可包含提供cp2c靶向的cp2c靶向肽(例如,acp52)和cpp(例如,irgd)和/或将其连接在脂肪酸之间的接头肽。作为接头肽,可以使用由本领域已知的氨基酸组成的肽或其组合而没有限制。具体地,接头肽可包含甘氨酸(gly,g),例如gn(在此,n为1至6的整数)。
[0014]
在本发明的另一个示例性实施方案中,接头肽可由通过gnkgm(在此,n和m各自独立地为0至6的整数)表示的氨基酸序列组成。例如,当n或m为0时,赖氨酸(lys,k)可位于接头肽的n端或c端,并且当n和m不为0时,赖氨酸可位于甘氨酸之间。包含在接头肽中的赖氨酸(lys,k)被包含在内以用于脂肪酸和肽的缀合。具体地,赖氨酸的末端官能团(-hn2)使得另外的氨基酸能够结合。因此,本发明的接头肽可另外地包括由eglfg表示的氨基酸序列,其是与赖氨酸或蛋白酶组织蛋白酶b的官能团结合的谷氨酸(glu,e)的靶序列。
[0015]
在本发明的另一个示例性实施方案中,由egflg表示的氨基酸序列(其是谷氨酸(glu,e)或蛋白酶组织蛋白酶b的靶序列)是与脂肪酸结合的接头肽的一部分,并且在根据本发明的cp2c靶向肽-氨基酸缀合物中,氨基酸序列可以通过赖氨酸的官能团(nh2)与谷氨酸的α或γ-羧基之间的肽键与由gnkgm表示的接头肽的赖氨酸连接,并且可以通过脂肪酸的羧基与肽的氨基之间的肽键与脂肪酸连接。
[0016]
在根据本发明的cp2c靶向肽-脂肪酸缀合物的合成期间,由egflg表示的氨基酸序列(其是谷氨酸(glu,e)或蛋白酶组织蛋白酶b的靶序列)首先与由gnkgm表示的接头肽结合,并随后可以与脂肪酸连接,但不限于所述合成顺序。
[0017]
同时,对于本发明中使用的cp2c靶向肽-脂肪酸缀合物,肽的n端和/或c端可被修饰,以便获得该肽的提高的稳定性、增强的药理学特性(半衰期、吸收性、效能、效力等)、改变的特异性(例如,广泛的生物活性谱)以及降低的抗原性。优选地,以上的修饰可以是以其中乙酰基、芴基甲氧基羰基、酰胺基、甲酰基、豆蔻基、硬脂酰基或聚乙二醇(polyethylene glycol,peg)与该肽的n端和/或c端结合的形式,但肽的修饰可以特别地包括可以提高肽稳定性的任何组分而没有限制。本文中使用的术语“稳定性”不仅是指保护本发明的肽免受体内蛋白水解酶攻击的体内稳定性,而且也指储存稳定性(例如,室温储存稳定性)。由于肽的n端与根据本发明的cp2c靶向肽-脂肪酸缀合物中的不饱和脂肪酸结合,因此cp2c靶向肽-脂肪酸缀合物可具有其中仅c端被酰胺基修饰的结构。
[0018]
根据本发明示例性实施方案的cp2c靶向肽的结构如下:
[0019][0020]
例如,在根据本发明的cp2c靶向肽-脂肪酸缀合物中,acp52和acp52c的结构具体如下:
[0021][0022]
在本发明的一些示例性实施方案中,在体内使用4种合成的cp2c靶向肽-脂肪酸缀合物以在肝癌细胞异种移植(hep3b)或乳腺癌细胞异种移植(mda-mb-231)小鼠模型中分析体内稳定性、抗癌效力、肿瘤转移抑制效力和生理毒性,并且作为结果,确定了体内稳定性和肿瘤抑制和肿瘤转移抑制作用是优异的,并且确定了cp2c靶向肽-脂肪酸缀合物是对生物体无毒的安全物质。
[0023]
因此,本发明还提供了用于预防、改善或治疗癌症的药物组合物和健康功能性食品组合物,其包含根据本发明的cp2c靶向肽-脂肪酸缀合物作为活性成分。
[0024]
在本发明中,癌症还可以包括对抗癌剂、特别是基于根据本发明的cp2c靶向肽-脂
肪酸缀合物的抗癌剂显示出抗性的药物抗性癌症。
[0025]
根据本发明的一个示例性实施方案,癌症包括胃癌、肺癌、非小细胞肺癌、乳腺癌、卵巢癌、肝癌、支气管癌、鼻咽癌、喉癌、胰腺癌、膀胱癌、结直肠癌、结肠癌、宫颈癌、骨癌、非小细胞骨癌、血液恶性肿瘤、皮肤癌(黑素瘤等)、头颈癌、子宫癌、直肠癌、肛周癌、结肠癌、输卵管癌、子宫内膜癌、阴道癌、外阴癌、霍奇金病(hodgkin’s disease)、食管癌、小肠癌、内分泌癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、慢性或急性白血病、淋巴细胞性淋巴瘤、肾癌或输尿管癌、肾细胞癌、肾盂癌、多倍体癌、唾液腺癌、肉瘤癌、假黏液瘤、肝母细胞瘤、睾丸癌、胶质母细胞瘤、唇癌、卵巢生殖细胞瘤、基底细胞癌、多发性骨髓瘤、胆囊癌、脉络膜黑素瘤、法特壶腹癌、腹膜癌、肾上腺癌、舌癌、小细胞癌、小儿淋巴瘤、神经母细胞瘤、十二指肠癌、输尿管癌、星形细胞瘤、脑膜瘤、肾盂癌、阴部癌、胸腺癌、中枢神经系统(cns)肿瘤、原发性中枢神经系统淋巴瘤、脊髓肿瘤、脑干神经胶质瘤和垂体腺瘤,但不限于此。
[0026]
本文中使用的术语“治疗”是指通过施用根据本发明的肽或包含该肽的药物组合物来改善或有益地改变癌症症状的所有行为。
[0027]
在本发明中,“包含
……
作为活性成分”是指以适用于医学治疗的合理收益/风险比足以治疗疾病的量,并且有效剂量水平可根据以下来确定:患者的疾病类型和严重程度、药物的活性、患者的药物敏感性、施用时间、施用途径和释放速率、治疗持续时间、包括与本发明的组合物同时使用的药物的要素,或医学领域公知的其他因素。根据本发明的肽或包含该肽的药物组合物可作为单独的治疗剂或可与其他治疗剂组合施用,可与现有技术中的治疗剂顺序或同时施用,并且可以以单剂量或多剂量施用。考虑到所有上述因素,以可获得最大作用且无任何副作用的最小量施用组合物是重要的,并且这可由本领域技术人员容易地确定。本发明的药物组合物的剂量和频率通过作为活性成分的药物的类型,以及多种相关因素例如待治疗的疾病、施用途径、患者的年龄、性别、体重以及疾病的严重程度来确定。
[0028]
因此,根据本发明的药物组合物可包含多种可药用载体,只要包含根据本发明的肽作为活性成分即可。作为可药用载体,当用于经口施用时,可以使用黏合剂、润滑剂、崩解剂、赋形剂、增溶剂、分散剂、稳定剂、助悬剂、着色剂、矫味剂等;在注射的情况下,可混合并使用缓冲剂、防腐剂、镇痛剂、增溶剂、等张剂、稳定剂等;以及在表面施用的情况下,可使用基质、赋形剂、润滑剂、防腐剂等。本发明的药物组合物的制剂可通过将本发明的药物组合物与如上所述的可药用载体混合来进行多种制备。例如,当经口施用时,制剂可以以片剂、锭剂、胶囊剂、酏剂、混悬剂、糖浆剂、晶片剂等形式制备;以及在注射的情况下,注射剂可以配制成单位剂量安瓿或多剂型。本发明的药物组合物可配制成其他溶液剂、混悬剂、片剂、丸剂、胶囊剂、持续释放制剂等。
[0029]
同时,作为适合于制剂的载体、赋形剂和稀释剂的实例,可以使用乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、褐藻胶、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁、矿物油等。此外,本发明的药物组合物可以另外地包含填充剂、抗凝剂、润滑剂、润湿剂、矫味剂、防腐剂等。
[0030]
本发明的药物组合物以药学有效量施用。在本发明中,“药学有效量”意指以适用于医学治疗的合理收益/风险比足以治疗疾病的量,并且有效剂量水平可根据包括以下的
因素确定:患者的疾病类型、疾病的严重程度、药物活性、对药物的敏感性、施用时间、施用途径、排泄率、治疗期和同时使用的药物以及在医学领域公知的其他因素。根据本发明的药物组合物可作为单独的治疗剂或与其他治疗剂组合施用,可与现有技术中的治疗剂顺序或同时施用,并且可以以单剂量或多剂量施用。考虑到所有上述因素,以可获得最大作用而没有任何副作用的最小量施用组合物是重要的,并且该量可以由本领域技术人员容易地确定。
[0031]
本文中使用的术语“施用”是指通过任何合适的方法将预定物质,即根据本发明的肽衍生物或包含该肽衍生物的药物组合物引入到对象中,并且施用途径可以是通过任何常见途径,只要药物可到达靶组织即可。例如,施用途径可以是腹膜内施用、静脉内施用、肌内施用、皮下施用、皮内施用、经口施用、表面施用、鼻内施用、肺内施用或经直肠施用等,但不限于此。然而,由于肽在经口施用期间被消化,因此优选地,待配制具有包被的或以其他方式免于胃降解的活性剂的经口组合物。优选地,本发明的药物组合物可以以注射剂的形式施用。另外,根据本发明的药物组合物也可通过可允许将活性物质运输至靶细胞的任何装置来施用。
[0032]
由于根据本发明的肽也可以作为活性成分包含在健康功能性食品组合物中,因此根据本发明的食品组合物可通过与已知具有抗癌功能的已知活性成分混合以组合物的形式进行制备,并且可另外地包含营养学上可接受的食品补充添加剂。本发明的健康功能性食品组合物包括针对所有类型的食品(例如功能性食品、营养补充剂、健康食品和食品添加剂)的组合物。
[0033]
这些类型的食品组合物可以通过本领域公知的典型方法以多种形式制备。例如,健康食品可以以多种形式(例如片剂、丸剂、散剂、胶囊剂、胶剂、维生素复合物、果汁和饮料)来制备,并且包含根据本发明的肽作为活性成分的食品组合物可以以颗粒剂、胶囊剂或散剂的形式摄取。本发明的食品组合物可包含通常在制备食品期间添加的成分,并且包括例如蛋白质、碳水化合物、脂肪、营养素和调味品。例如,当本发明的食品组合物作为饮料制备时,除了本发明的肽之外,所述组合物还可另外地包含柠檬酸、高果糖玉米糖浆、糖、蔗糖、乙酸、苹果酸、果汁、枣提取物、甘草提取物等。此外,本发明的食品组合物可以包含本领域中典型的食品添加剂,例如矫味剂、调味剂、着色剂、填充剂、稳定剂等作为食品补充添加剂。此外,本发明的食品组合物可包含多种矫味剂或天然碳水化合物等作为另外的成分,如在典型的饮料中。天然碳水化合物的一些具体实例包括例如,单糖例如葡萄糖和果糖,二糖例如麦芽糖和蔗糖,典型的糖,例如多糖例如糊精和环糊精,以及糖醇例如木糖醇、山梨糖醇和赤藓糖醇。作为除上述那些之外的矫味剂,还可包含天然矫味剂[奇异果甜蛋白,甜菊提取物(例如,莱鲍迪苷a、甘草甜素等)]和合成矫味剂(糖精、阿斯巴甜等)。
[0034]
此外,本发明的食品组合物可含有多种营养素、维生素、矿物质(电解质)、调味剂例如合成调味剂和天然调味剂、着色剂和填充剂(乳酪、巧克力等)、果胶酸及其盐、藻酸及其盐、有机酸、保护性胶体增稠剂、ph调节剂、稳定剂、防腐剂、甘油、醇、用于碳酸饮料的碳酸化剂等。这些成分可单独或以其组合使用。
[0035]
在下文中,将通过实施例更详细地描述本发明,并且提供以下实施例来帮助更好地理解本发明,并不旨在限制本发明的范围。
[0036]
有益效果
[0037]
在本发明中,为了鉴定使显示出作为泛抗癌剂的作用的转录因子cp2c靶向肽acp52c体内稳定性提高的最终候选物质,将脂肪酸与cp2c靶向肽先导物质acp52c连接,以在癌细胞异种移植小鼠模型中确定体内稳定性和抗癌效力。此外,在多种癌细胞和正常细胞中确定了最终抗癌候选物质的癌细胞特异性抗癌效力。
附图说明
[0038]
图1示出了显示出以下的实验结果:鉴定干扰cp2c复合物形成及其dna结合能力的肽(pep#5-2)的过程。
[0039]
图2是示出了通过acp52c处理在多种癌细胞系中gi
50
值的图。
[0040]
图3示出了通过acp52c和/或cp2c过表达处理,mda-mb-231和hepg2细胞系的集落形成能力。
[0041]
图4是示出了以下的一组facs视图:通过acp52c处理在g2/m期的细胞周期阻滞、细胞死亡诱导(subg1细胞)、以及调节细胞周期和凋亡的p53和亚调节子的表达。
[0042]
图5是示出了以下的一组视图:acp52c处理对凋亡的诱导。
[0043]
图6示出了acp52c的安全性和稳定性分析的结果。
[0044]
图7示出了acp52c的结构和特征。
[0045]
图8示出了为了提高体内稳定性,其中白蛋白-亲和性饱和脂肪酸(棕榈酰酸)与acp52c结合的缀合物(acp52cg)和其中白蛋白-亲和性饱和脂肪酸(棕榈酰酸)和组织蛋白酶b敏感肽与acp52c结合的缀合物(acp52ck)的结构。
[0046]
图9示出了通过用c16饱和脂肪酸结合肽(acp52c、acp52cg、acp52ck)处理的细胞生长分析结果。
[0047]
图10示出了通过用c16饱和脂肪酸结合肽(acp52c、acp52cg、acp52ck)处理,在正常细胞系(hmsc)、非致瘤性转化细胞系(beas-2b)和癌细胞系(hep3b、mda-mb-231和hepg2)中的细胞生长分析结果。
[0048]
图11示出了在hep3b细胞系异种移植小鼠模型中acp52cg和acp52ck的抗癌作用分析结果。
[0049]
图12示出了对人体无害的天然不饱和脂肪酸ω-3的细胞通透性和胞内功能。
[0050]
图13示出了通过用不饱和脂肪酸dha(0至100μm)处理,在正常细胞系(hmsc)、非致瘤性转化细胞系(beas-2b)和癌细胞系(hep3b、mda-mb-231和hepg2)中的细胞生长分析结果。
[0051]
图14示出了通过用10μm或更少的不饱和脂肪酸dha处理,在癌细胞系(hep3b和mda-mb-231)中的细胞生长分析结果。
[0052]
图15示出了通过用不饱和脂肪酸dha和acp52c组合处理,在正常细胞系(hmsc)、非致瘤性转化细胞系(beas-2b)和癌细胞系(hep3b、mda-mb-231和hepg2)中的细胞生长分析结果。
[0053]
图16示出了作为提高体内稳定性的努力,已与不饱和脂肪酸dha缀合的示例性药物(dha-紫杉醇)和已与不饱和脂肪酸dha缀合的acp52衍生的肽dha-acp52c和dha-acp52c的结构。
[0054]
图17示出了通过用dha-acp52或dha-acp52c肽处理,在正常细胞系(hmsc)、非致瘤
性转化细胞系(beas-2b)和癌细胞系(mda-mb-231和hepg2)中的细胞生长分析结果。
[0055]
图18示出了通过用acp52c或dha-acp52c处理,在癌细胞(mda-mb-231和hepg2)中cp2c、mdm2、yy1、p53、p63和p73的蛋白质表达水平。
[0056]
图19示出了通过用acp52c或dha-acp52c处理,在癌细胞(mda-mb-231和hepg2)中细胞周期和凋亡调节子蛋白表达水平的变化。
[0057]
图20示出了在hep3b异种移植小鼠模型中的抗癌作用,在所述小鼠模型中以3天的间隔通过尾静脉注射索拉非尼(sorafenib)、dha-acp52或dha-acp52c。
[0058]
图21示出了在hep3b异种移植小鼠模型中的体重以及血液学和组织学数据,在所述小鼠模型中以3天的间隔通过尾静脉注射索拉非尼、dha-acp52或dha-acp52c。
[0059]
图22示出了在hep3b异种移植小鼠模型中acp52c、dha-acp52和dha-acp52c的抗癌作用,在所述小鼠模型中以5天的间隔通过尾静脉注射索拉非尼、dha-acp52或dha-acp52c。
[0060]
图23示出了在hep3b异种移植小鼠模型中的体重以及血液学和组织学数据,在所述小鼠模型中以5天的间隔通过尾静脉注射索拉非尼、dha-acp52或dha-acp52c。
具体实施方式
[0061]
在下文中,将通过实施例更详细地描述本发明,并且提供以下实施例以帮助更好地理解本发明,并不旨在限制本发明的范围。
[0062]
[制备例1]与细胞穿透肽结合的cp2c靶向肽的制备
[0063]
已知转录因子cp2c在多种癌症中过表达,并且由美国研究组进行的研究报道了在肝癌细胞系中抑制cp2c的表达抑制了细胞生长,并且当cp2c过表达时,发生了癌症的恶性和转移(grant et al.,antiproliferative small-molecule inhibitors of transcription factor lsf reveal oncogene addiction to lsf in hepatocellular carcinoma.proc natl acad sci usa 2012,109:4503-4508)。
[0064]
本发明人通过噬菌体展示方法鉴定了与转录因子cp2c(也称为tfcp2、lsf、lbp1、ubp1等)结合的肽(kang et al.,identification and characterization of four novel peptide motifs that recognize distinct regions of the transcription factor cp2.febs 2005,272:1265-1277),并且其确定了其中的一种肽(pep#5,seq id no:1)通过抑制cp2c转录因子复合物的形成来干扰cp2c转录因子复合物[cp2c同四聚体和cbp(cp2c、cp2b和pias1)异六聚体]的dna结合。特别地,确定了在pep#5的羧基端由6个氨基酸组成的pep#5-2(seq id no:2)也显示出与pep#5相同的作用,并且其被选择作为cp2c靶向肽(图1)。由于pep#5-2本身不能进入细胞,因此为了提高pep#5-2的细胞通透性,将细胞穿透肽(cpp),即内化rgd(irgd)(其是由9个氨基酸(9aa)
′
crgdkgpdc(cys-arg-gly-asp-lys-gly-pro-asp-cys,seq id no:3)组成的肽)与cp2c靶向肽结合并将其命名为acp52c(图7)。
[0065]
[实施例1]acp52c的抗癌作用的确定
[0066]
所选择的肽通过与cp2c结合以抑制cp2c转录因子复合物(cp2c同四聚体和cp2c/cp2b/pias1异六聚体)的形成来间接干扰cp2c的dna结合。通过分析acp52c在多种癌细胞系中的抗癌效力,确定了acp52c显示出癌细胞特异性生长抑制和细胞死亡效力(图2)。acp52c还有效地抑制了mda-mb-231和hepg2细胞系的集落形成能力。此外,当cp2c过表达时,集落形成能力被更有效地抑制,确定了acp52c的效力依赖于cp2c的表达水平(图3)。这一结果与
其中大多数癌细胞系中cp2c的表达是正常细胞中的50倍或更高以及acp52c在癌细胞中显示出嗜致癌性的现象一致。
[0067]
通过由facs对acp52c处理依赖性细胞周期变化进行分析,确定了acp52c在mda-mb-231细胞系中诱导了细胞周期阻滞,提高了在g2/m和subg1期的细胞,然而acp52c在mcf10a(非致瘤性乳腺上皮细胞系)中对细胞周期进展没有作用。另外,证实了在经acp52c处理的mcf7细胞中,cdc2(cdk1)和周期蛋白b1的表达通过p53/chk1/cdc25c线降低,其中发生了g2/m期阻滞。为了更准确地分析acp52c对细胞周期进展的作用,当对从双胸苷阻断法介导的g1/s期同步中释放的细胞进行acp52c处理时,确定了acp52c诱导伴随多倍体染色体形成的g2/m期阻滞。同时,当对从诺考达唑(nocodazole)处理介导的g2/m期同步释放的细胞进行acp52c处理时,确定了除了g2/m期阻滞和多倍体形成之外,subg1细胞的数量也随时间提高(图14)。因此,可以推测通过acp52c处理诱导的细胞死亡依次通过g2/m细胞周期阻滞、多倍体形成和subg1细胞形成而发生。
[0068]
通过由western印迹对模拟(未经处理)和经acp52处理的细胞蛋白中的凋亡相关蛋白随时间的表达水平进行分析,确定了acp52c处理通过凋亡诱导了细胞死亡,提高了促凋亡标志物蛋白的表达水平,降低了抗凋亡标志物蛋白的表达水平,并激活了半胱天冬酶级联(图5a和5b)。当通过电子显微术分析用acp52c处理的细胞的亚细胞特征时,在mda-mb-231细胞中观察到凋亡的显著特征,如细胞核凝聚,但在mcf10a细胞中则完全没有(图5c)。acp52c通过凋亡诱导细胞死亡的事实也通过膜联蛋白v/pi染色法得到确定(图5d)。因此,可以推测acp52c通过凋亡过程显示出细胞死亡效力。
[0069]
以下方法可用于确定癌细胞特异性细胞死亡诱导acp52c的稳定性和安全性。首先,当通过hplc测量acp52c在血清(体外)和血液(体内)中的半衰期时,acp52c在体外稳定持续长达24小时,而其在体内在2小时内降解至一半(图6a和6b)。当人红细胞用acp52c在ph 7.4下处理8小时时,没有出现溶血(图6c)。同时,当通过尾静脉将经cy5标记的肽(cy5-acp52c)注射到hep3b细胞系异种移植小鼠中,并随后随时间进行实时成像时,尽管在5天之后可在肾、肝和肿瘤中观察到肽,但大多数注射的acp52在24小时内消失。acp52c在体内的半衰期测量为约7.95小时(图6d)。推测acp52c经受肾分泌而不是被蛋白酶降解,因为acp52c(由15个氨基酸组成的肽)足够短而容易地从肾中分泌。
[0070]
[制备例2]cp2c靶向肽-饱和脂肪酸缀合物的合成
[0071]
实施例1的结果表明acp52c通过凋亡引起癌细胞特异性细胞死亡,且很少影响正常细胞。然而,由于需要确保体内稳定性以便成为抗癌剂的候选物质,因此意在使用白蛋白亲和性脂肪酸缀合的肽作为实现该目的的方法。白蛋白是血液中丰富的且与脂肪酸良好结合的稳定蛋白质,并因此,当药物与脂肪酸结合时,提议可通过与白蛋白结合来抑制药物的肾分泌(sleep et al.,albumin as a versatile platform for drug half-life extension.biochim biophys acta 2013,1830:5526-5534;van witteloostuijin et al.,half-life extension of biopharmaceuticals using chemical methods:alternatives to pegylation.chemmedchem 2016,11:2474-2495)。另外,临床上用作糖尿病治疗剂的利拉鲁肽(lilaglutide)也具有与肽结合的c16棕榈酰酸,以确保在血液中的稳定性。基于这些事实,合成了其中c16棕榈酰酸与acp52c的n端结合的肽c16-acp52c(acp52cg)(图8a)。在另一方面,我们推测与acp52c肽缀合的脂肪酸可抑制肽的cp2c靶向或
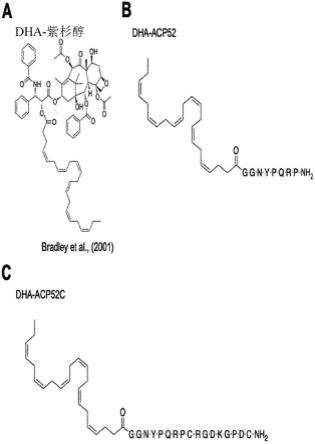
neoplastic and non-cancerous human mammary epithelial cell lines.br j cancer 1994,70:219-227)。特别地,由于已知对癌症和神经退行性疾病具有潜在的治疗作用(youdim et al.,essential fatty acids and the brain:possible health implications.int j dev neurosci 2000,18:383-399;jaracz et al.,recent advances in tumor-targeting anticancer drug conjugates.bioorg med chem2005,13:5043-5054;yu et al.,docohexaenoic acid suppresses neuroinflammatory responses and induces heme oxygenase-1expression in bv-2microglia:implications of antidepressant effects for omega-3fatty acids.neuropsychopharmacology 2010,35:2238-2248),因此dha单独用于临床试验。因此,确定探索其中dha与acp52c结合的化合物的抗癌作用。
[0078]
[制备例3]cp2c靶向肽-dha缀合物的合成
[0079]
首先,为了测试dha本身的作用,用过浓度的dha处理乳腺癌细胞系(mda-mb-231)、肝癌细胞系(hep3b和hepg2)、正常hmsc细胞系(la211)和非致瘤性肺细胞系(beas-2b),并随后通过mtt测定来分析细胞生长。作为结果,dha对正常细胞系没有显示出细胞毒性,但在癌细胞和beas-2b中在20μm或更高的浓度下显示出细胞毒性(图13)。然而,由于acp52c在10μm或更小的有效浓度下诱导癌细胞特异性细胞死亡,因此分析了当dha与acp52c组合使用时,dha本身在10μm或更小的浓度下是否显示出抗癌作用。然而,在hep3b和mda-mb-231细胞系中没有显示出抗癌作用(图14)。同时,当分析2μm acp52c与1至3μm dha组合的细胞死亡作用时,组合处理在正常hmsc细胞系(la211)和非致瘤性肺细胞系(beas-2b)中没有显示出任何抑制或有益作用,但在乳腺癌细胞系(mda-mb-231)中显示出抑制作用,表现出比单独acp52c更低的效力(图15)。因此,推测dha在高浓度下可以表现出抗癌作用,但在确保acp52c体内稳定性的浓度下,dha本身不具有抗癌作用。
[0080]
因此,合成了其中dha与acp52的n端直接缀合的两种肽:dha-acp52(仅dha与acp52缀合,由于dha本身具有细胞膜通透性)和dha-acp52c(缀合了dha和细胞穿透肽irgd二者)(图16)。
[0081]
[实施例4]cp2c靶向肽-dha缀合物对体外抗癌作用的确定
[0082]
当用dha结合肽处理正常细胞系和癌细胞系,并随后通过mtt测定监测细胞生长时,dha-acp52和dha-acp52c在正常细胞系和非致瘤性beas-2b细胞系中均未显示出毒性。在乳腺癌(mda-mb-231)和肝癌(hepg2)细胞系中,dha-acp52显示出gi
50
值为5.7至6.95μm,表明该效力远低于acp52c的2μm,然而dha-acp52c显示出gi
50
值为1.43至2.4μm,与acp52c效力相似(图17)。另外,dha-acp52c处理显示出与acp52c处理相似的参与胞内凋亡和细胞周期阻滞的因子的表达谱(图18和图19)。因此,由于dha-acp52的抗癌作用不如acp52c,因此推测与irgd相比,dha具有不显著的细胞通透性,尽管已知dha本身通过细胞膜进入细胞。
[0083]
[实施例5]在多种癌细胞系异种移植小鼠模型中cp2c靶向肽-dha缀合物对肿瘤生长抑制和一般生理毒性的测试
[0084]
还在体内hep3b异种移植小鼠模型中确定了在细胞系水平上验证的cp2c靶向肽-dha缀合物的效力。连同盐水(模拟)作为阴性对照和索拉非尼(10mg/kg)作为阳性对照,将dha-acp52(1.65mg/kg)和dha-acp52c(2.79mg/kg)作为实验组以3天的间隔通过尾静脉总共6次注射到hep3b异种移植小鼠中(图20a)。当在实验期间每3天一次测量小鼠的肿瘤尺寸
时,确定了用索拉非尼和dha-acp52c处理的组比用模拟或dha-acp52处理的组更有效地抑制癌症生长(图20b)。当在完成实验之后在处死小鼠中分析肿瘤尺寸、形状和重量时,dha-acp52c显示出比索拉非尼更好的抗癌效力,但是与模拟相比,索拉非尼显示出显著的抗癌效力,而dha-acp52没有显示出任何作用(图20c和20d)。考虑到经dha-acp52c处理的小鼠显示出与不同处理组(包括对照)相似的体重、血液学和组织学参数,可推测出dha-acp52c在体内对正常细胞不会显示出任何不良副作用(图21)。在另一方面,当连同阴性对照盐水(模拟)和阳性对照acp52c(2mg/kg)组,以5天的间隔通过尾静脉注射总共6次在hep3b异种移植小鼠模型中分析dha-acp52(1.65mg/kg)和dha-acp52c(2.79mg/kg)在体内的抗癌作用(图22a),并在实验期间每3天测量小鼠的肿瘤尺寸时,dha-acp52c显示出比acp52c更好的效力,而dha-acp52显示出与阴性对照相似的效力(图22b)。当在实验完成之后在处死小鼠中分析肿瘤尺寸、形状和重量时,仅dha-acp52c显示出显著的抗癌效力(图22c和22d)。考虑到经dha-acp52c处理的小鼠显示出与不同处理组(包括对照)相似的体重、血液学和组织学参数,可推测出dha-acp52c不会对体内正常细胞显示出任何不良副作用(图23)。
[0085]
总之,dha-acp52c显示出与细胞系水平上常规acp52c相似的癌细胞生长抑制作用,但dha-acp52c在hep3b异种移植小鼠模型中显示出比acp52c优异的抗癌作用。特别地,acp52c在以3天的间隔注射时显示出显著的抗癌作用,但在以5天的间隔注射时没有显示出显著的抗癌作用(图11和图20)。相比之下,dha-acp52c当以3或5天的间隔注射时显示出明显的抗癌作用(图20和图22)。因此,确定了dha提高了dha-acp52c中acp52c的体内稳定性,但在正常细胞和正常组织中不会产生任何不良副作用。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。