包含前列腺干细胞抗原(psca)嵌合抗原受体(cars)的组合物和方法
1.相关申请的交叉引用
2.本技术根据35u.s.c.
§
119(e)享有2020年3月5日提交的美国临时专利申请号62/985,808和2019年9月11日提交的美国临时专利申请号62/898,896的优先权,在此通过引用将其全部内容并入本文。
背景技术:
3.前列腺癌是最常见的癌症诊断,也是美国男性癌症相关死亡的第二主要原因。尽管最近在局部疾病的检测和治疗方面取得了进展,但该疾病的管理仍存在重大挑战。目前的诊断方式受到限制,缺乏特异性并且不能预测哪些患者处于发展为转移性疾病的风险。前列腺特异性抗原(psa)虽然对于鉴定可能患有前列腺癌的男性有效,但在患有良性前列腺增生、前列腺炎和其他非恶性病症的男性中通常会升高。psa和其他当前标志物无法准确鉴别惰性和侵袭性癌症。对于20-40%在手术或放射疗法后出现复发性疾病的患者或在诊断时患有转移性疾病的患者,没有有效的治疗方法。尽管激素消融疗法可以缓和这些患者,但大多数患者不可避免地发展进展为无法治愈的雄激素非依赖性疾病。
4.本领域需要用于治疗前列腺癌的组合物和方法。本发明解决了这种需要。
技术实现要素:
5.本发明基于这样的发现:前列腺干细胞抗原(psca)嵌合抗原受体(car)t细胞表现出有效的抗肿瘤活性。本发明还基于这样的发现:能够结合psca和前列腺特异性膜抗原(psma)的双特异性car和双重car表现出显著增强的抗肿瘤活性。
6.因此,在某些方面,本公开提供了嵌合抗原受体(car),其包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域、跨膜结构域和胞内结构域。
7.在某些示例性实施方式中,抗原结合结构域包含重链可变区,该重链可变区包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及轻链可变区,该轻链可变区包含三个轻链互补决定区(lcdr),其中lcdr1包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),和lcdr3包含氨基酸序列qqwssspft(seq id no:6)。
8.在某些示例性实施方式中,重链可变区包含与seq id no:7至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列:和/或轻链可变区包含与seq id no:8至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
9.在某些示例性实施方式中,抗原结合结构域是单链可变片段(scfv),其包含与seq id no:9至少80%、85%、90%、95%、96%、97%、98%、99%、或100%相同的氨基酸序列。
10.在某些示例性实施方式中,胞内结构域包含蛋白质的共刺激结构域,该蛋白质选自tnfr超家族中的蛋白质、cd28、4-1bb(cd137)、ox40(cd134)、pd-1、cd7、light、cd83l、
dap10、dap12、cd27、cd2、cd5、icam-1、lfa-1、lck、tnfr-i、tnfr-ii、fas、cd30、cd40、icos、nkg2c和b7-h3(cd276)、或其变体,或源自杀伤性免疫球蛋白样受体(kir)的胞内结构域。
11.在某些示例性实施方式中,car能够结合前列腺干细胞抗原(psca)并且包含与seq id no:21、23、25或27至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同。
12.在另一个方面,本公开提供了双特异性嵌合抗原受体(car),其包含胞外结构域,该胞外结构域包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域和能够结合前列腺特异性膜抗原(psma)的抗原结合结构域、跨膜结构域和胞内结构域。
13.在某些示例性实施方式中,胞外结构域包含能够结合psca的抗原结合结构域,其包含:包含三个重链互补决定区(hcdr)的第一重链可变区,其中hcdr1包含氨基酸序列dyyih(seq id no:1)、hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);和包含三个轻链互补决定区(lcdr)的第一轻链可变区,其中lcdr1包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列酸序列qqwssspft(seq id no:6)。胞外结构域还包含能够结合psma的抗原结合结构域,其包含:包含三个重链互补决定区(hcdr)的第二重链可变区,其中hcdr1包含氨基酸序列snwig(seq id no:28)、hcdr2包含氨基酸序列iiypgdsdtryspsfqg(seq id no:29),并且hcdr3包含氨基酸序列qtgflwsfdl(seq id no:30);以及其包含三个轻链互补决定区(lcdr)的第二轻链可变区,其中lcdr1包含氨基酸序列rasqdissala(seq id no:31),lcdr2包含氨基酸序列dassles(seq id no:32),并且lcdr3包含氨基酸序列qqfnsyplt(seq id no:33)。
14.在某些示例性实施方式中,双特异性car的第一重链可变区包含与seq id no:7至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;并且第一轻链可变区包含与seq id no:8至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,和/或双特异性car的第二重链可变区包含与seq id no:34至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;并且第二轻链可变区包含与seq id no:35至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
15.在某些示例性实施方式中,能够结合psca的抗原结合结构域是单链可变片段(scfv),其包含与seq id no:9至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
16.在另一个方面,本公开提供了能够结合前列腺干细胞抗原(psca)和前列腺特异性膜抗原(psma)的双特异性嵌合抗原受体(car),其包含与seq id no:40、42、80、81或82至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
17.在另一个方面,本公开提供了一种核酸,其包含编码本文公开的car或双特异性car中的任何一个的多核苷酸序列。
18.在另一个方面,本公开提供了一种核酸,其包含编码能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car)的多核苷酸序列,嵌合抗原受体(car)包含抗原结合结构域、跨膜结构域和胞内结构域。抗原结合结构域包含:重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及
轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdr1包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6)。
19.在某些示例性实施方式中,抗原结合结构域包含由与seq id no:43至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码的重链可变区;和/或由与seq id no:44至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码的轻链可变区;和/或抗原结合结构域是由与seq id no:45至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码的单链可变片段(scfv)。
20.在另一个方面,本公开提供了一种核酸,其包含编码能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car)的多核苷酸序列,其包含与seq id no:20、22、24或26至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列。
21.在另一个方面,本公开提供了一种核酸,其包含编码能够结合前列腺干细胞抗原(psca)和前列腺特异性膜抗原(psma)的双特异性嵌合抗原受体(car)的多核苷酸序列,其中双特异性car包含胞外结构域、跨膜结构域、和胞内结构域,胞外结构域包括能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域。
22.在某些示例性实施方式中,胞外结构域包含:能够结合psca的抗原结合结构域,包含:第一重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及第一轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdrl包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6)。胞外结构域还包含能够结合psma的抗原结合结构域,其包含:包含三个重链互补决定区(hcdr)的第二重链可变区,其中hcdr1包含氨基酸序列snwig(seq id no:28),hcdr2包含氨基酸序列iiypgdsdtryspsfqg(seq id no:29),并且hcdr3包含氨基酸序列qtgflwsfdl(seq id no:30);以及包含三个轻链互补决定区(lcdr)的第二轻链可变区,其中lcdr1包含氨基酸序列rasqdissala(seq id no:31),lcdr2包含氨基酸序列dassles(seq id no:32),并且lcdr3包含氨基酸序列qqfnsyplt(seq id no:33)。
23.在某些示例性实施方式中,第一重链可变区由与seq id no:43至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码;并且第一轻链可变区由与seq id no:44至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码;和/或第二重链可变区由与seq id no:46至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码;并且第二轻链可变区由与seq id no:47至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码;和/或核酸包含胞内结构域,其包含选自以下的蛋白质的共刺激结构域:tnfr超家族的蛋白质、cd28、4-1bb(cd137)、ox40(cd134)、pd-1、cd7、light、cd83l、dap10、dap12、cd27、cd2、cd5、icam-1、lfa-1、lck、tnfr-i、tnfr-ii、fas、cd30、cd40、icos、nkg2c、icos、和b7-h3(cd276)、或其变体,或源自杀伤性免疫球蛋白样受体(kir)的胞内结构域。
24.在某些示例性实施方式中,双特异性car由与seq id no:39或41或79至少80%、
85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码。
25.在另一个方面,本公开提供了包含本文考虑的任何核酸的载体。
26.在某些示例性实施方式中,载体是表达载体;和/或载体选自dna载体、rna载体、质粒、慢病毒载体、腺病毒载体、腺相关病毒载体和逆转录病毒载体。
27.在另一个方面,本公开提供了修饰的免疫细胞或其前体细胞,其包含本文考虑的任何car、本文考虑的任何核酸、或本文考虑的任何载体。
28.在另一个方面,本公开提供了一种修饰的免疫细胞或其前体细胞,其包含嵌合抗原受体(car),该嵌合抗原受体包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域、跨膜结构域和胞内结构域.
29.在某些示例性实施方式中,修饰的细胞还包含psma-car,其中psma-car包含抗原结合结构域、跨膜结构域和胞内结构域。
30.在另一个方面,本公开提供了一种修饰的免疫细胞或其前体细胞,包含:第一嵌合抗原受体(car),其包含能够结合前列腺干细胞抗原(psca)的第一抗原结合结构域;和第二car,其包含能够结合前列腺特异性膜抗原(psma)的第二抗原结合结构域,其中第一和第二car各自包含跨膜结构域和胞内结构域。
31.在某些示例性实施方式中,修饰的细胞还包含开关受体(switch receptor)。
32.在某些示例性实施方式中,至少一种car能够结合人psca;和/或至少一种car能够结合人psma;和/或修饰的细胞是修饰的免疫细胞;和/或修饰的细胞是作为修饰的t细胞的修饰的免疫细胞。
33.在另一个方面,本公开提供了一种药物组合物,其包含治疗有效量的本文所考虑的任何修饰的细胞。
34.在另一个方面,本公开提供了一种在对其有需要的受试者中治疗疾病的方法,包括向受试者施用有效量的本文所考虑的任何修饰的细胞或本文考虑的任何药物组合物。
35.在某些示例性实施方式中,疾病是癌症;和/或疾病是癌症,其中癌症是前列腺癌;和/或疾病是癌症,其中癌症是转移性去势抵抗性前列腺癌。
36.在另一个方面,本公开提供了在对其有需要的受试者中治疗前列腺癌的方法,包括向受试者施用有效量的修饰的t细胞,该修饰的t细胞包含:能够结合前列腺干细胞抗原的第一嵌合抗原受体(car)(psca-car)和能够结合前列腺特异性膜抗原的第二嵌合抗原受体(car)(psma-car),其中第一car和第二car各自包含抗原结合结构域、跨膜结构域和胞内结构域。
37.在另一个方面,本公开提供了在对其有需要的受试者中治疗前列腺癌的方法,包括向受试者施用有效量的包含双特异性嵌合抗原受体(car)的修饰的t细胞。双特异性car包含胞外结构域,该胞外结构域包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域和能够结合前列腺特异性膜抗原(psma)的抗原结合结构域、跨膜结构域和胞内结构域。
38.在某些示例性实施方式中,修饰的t细胞还包含显性负性受体;和/或修饰的t细胞进一步包含开关受体。
39.在某些示例性实施方式中,方法还包括向受试者施用淋巴清除(lymphodepleting)化学疗法。
40.在某些示例性实施方式中,受试者是人。
附图说明
41.通过以下结合附图对示例性实施方式的详细描述,本发明的上述和其他特征和优点将得到更充分的理解。
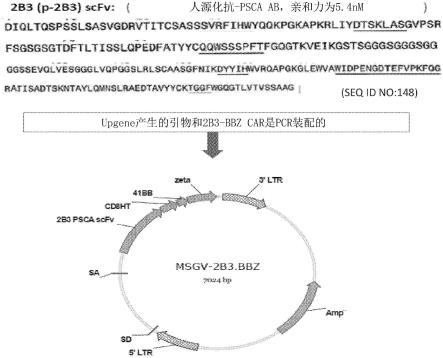
42.图1示例了前列腺干细胞抗原(psca)特异性car的产生。构建了由来自人源化抗psca ab(2b3)的scfv组成的psca car并将其克隆到逆转录病毒载体msgv中。
43.图2示例了用具有4-1bb和cd3z结构域的psca car(2b3.bbz)和/或具有4-1bb和cd3z结构域的psma car(j591.bbz)的体外转录rna电穿孔的t细胞的car表达(上图(upper panel)),以及与双特异性抗体10a5-1412(apdl1-acd28双特异性ab;表示为10a5)或tgfb3-1412(atgfbrii-acd28双特异性ab;表示为tgfb3)共电穿孔的psca car的pd-l1-fc染色。
44.图3示例了用pc3-psca-psma或k562刺激的rna共电穿孔的t细胞的cd107a表达。如图所示,用具有4-1bb和cd3z结构域的psca car(2b3.bbz)和/或具有4-1bb和cd3z结构域的psma car(j591.bbz)对t细胞进行电穿孔。
45.图4示例了用具有突变icos信号传导结构域(icos.ymnm)的psca(2b3)car慢病毒转导的t细胞显示出提高的溶解能力、降低的体外细胞因子产生和与4-1bb信号传导psca car等同的体内抗肿瘤活性。具有icos或icos.ymnm信号传导结构域的psca car被构建并克隆到慢病毒载体中。car表达水平与4-1bb或cd28信号传导结构域car(上)相当。用psca阳性细胞系pc3.psca.psma.cbg或pc3.psca.psma.cbg.pd-l1刺激car-t细胞并检查其细胞因子(il-2和ifn-γ)的产生(下图(lower panel))。还使用了人肺癌细胞系a549和人乳腺癌细胞系mda468。缩写:具有icos和cd3z结构域的psca(2b3)car(2b3.icosz或psca.2b3.icosz);具有变体icos(ymnm)和cd3z结构域的psca(2b3)car(2b3.icosz.ymnm或psca.2b3.icosz.ymnm);具有cd28和cd3z结构域的psca(2b3)car(2b3.28z或psca.2b3.28z);具有icos和与pd1-cd28开关受体共表达的cd3z结构域的psca(2b3)car(pd1.282b3.icosz或pd1.28.psca.2b3.icosz);具有变体icos(ymnm)和与pd1-cd28开关受体共表达的cd3z结构域的psca(2b3)car(pd1.282b3.icosz.ymnm或pd1.28.psca.2b3.icosz.ymnm);具有4-1bb和cd3z结构域的psca(2b3)car(2b3.bbz或psca.2b3.bbz);具有4-1bb和与pd1-cd28开关受体共表达的cd3z结构域(2b3.bbz)的psca(2b3)car(pd1.28.2b3.bbz或pd1.28.psca.2b3.bbz);和非转导的(no td或ntd)。
46.图5a示例了来自表达具有icos或icos.ymnm信号传导结构域的psca car的t细胞的cd107a测定的结果。图5a中使用的缩写与图4中的那些相同。
47.图5b示例了表达具有icos或icos.ymnm信号传导结构域的psca car的t细胞的杀伤测定的结果。图5b中使用的缩写与图4中的那些相同。
48.图6示例了使用pc3-psca-cbg-pdl1肿瘤模型进行实验的结果。对于慢病毒转导(lvv td)的t细胞,每只小鼠在肿瘤接种后第21天i.v.(静脉内)注射1e6个细胞。每组中测试5只小鼠。图7中使用的缩写与图4中的那些相同。
49.图7示例了用各种psca car皮下注射后肿瘤的平均发光(辐射率,radiance)。图7中使用的缩写与图4中的那些相同。
50.图8示例了用各种psca car皮下注射后的肿瘤尺寸。图8中使用的缩写与图4中的那些相同。
51.图9a是用于研究编码与gly4ser元件连接的靶向psma(具有2f5 scfv)和psca(具
有2b3 scfv)的car的双特异性car载体的示意图。图9a-9d中使用的缩写:非转导的(ntd);具有4-1bb和cd3z结构域的psma(2f5)car(2f5-bbz);具有4-1bb和cd3z结构域的psca(2b3)car(2b3-bbz);具有4-1bb和cd3z结构域的psma(2f5)和psca(2b3)双特异性car(2f5-s-2b3-bbz;gly4ser接头);具有4-1bb和cd3z结构域的psma(2f5)和psca(2b3)双特异性car(2f5-s-2b3-bbz;(gly4ser)4接头);具有4-1bb和cd3z结构域的psca(2b3)和psma(2f5)双特异性car(2b3-s-2f5-bbz;gly4ser接头);具有4-1bb和cd3z结构域的psca(2b3)和psma(2f5)双特异性car(2b3-l-2f5-bbz;(gly4ser)4接头)。
52.图9b示例了在初级扩增结束时car在慢病毒转导的car t细胞上的表面表达。
53.图9c示例了用人重组psma-fc和psca-his蛋白染色(staining)的表达psma或psca-car或psma-psca双特异性car的慢病毒转导的car t细胞的百分比,如通过流式细胞术测量的。
54.图9d示例了包含指定car的car t细胞与靶标共培养4小时,并且在cd8阳性细胞上量化cd107a表达百分比。
55.图10a示例了来自与pc3-psca细胞共培养的car t细胞的结果(效靶比(effector:target ratio)=1:1)。共培养后第24小时获得上清液,并通过elisa分析细胞因子的产生。图10a-10d使用的缩写与图9a-9d中使用的那些相同。
56.图10b示例了来自针对pc3-psca细胞以指定的e:t比测试t细胞的细胞溶解活性8小时的结果。
57.图10c示例了来自与pc3-psma细胞共培养的car t细胞的结果(效靶比=1:1)。共培养后第24小时获得上清液,并通过elisa分析细胞因子的产生。
58.图10d示例了来自针对pc3-psma细胞以指定的e:t比测试t细胞的细胞溶解活性8小时的结果。
59.图11a-11b示例了tgfbr-il12r开关受体可以增强(boost)t细胞功能的发现。图11a,右上图,显示了在培养物(cutures)中有或没有tgfb1的情况下,用与k562共培养的tgfbr-il12r转移的nk细胞的ifn-γ产生。图11a,右下图,显示了用tgfβ刺激后用tgfbr-il12r开关受体转移的t细胞的psmad染色。图11b显示了与tgfbr-il12r开关受体共同转移的,ny-eso-1阳性肿瘤刺激的ny-eso-1tcr转导的t细胞的细胞因子产生。
具体实施方式
60.本发明提供了用于修饰的免疫细胞或其前体(例如,修饰的t细胞)的组合物和方法,修饰的免疫细胞或其前体(例如,修饰t细胞)包含能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car)。在某些实施方式中,本发明提供了用于修饰免疫细胞或其前体的组合物和方法,修饰免疫细胞或其前体包含双特异性car(例如psca&psma)、具有显性负性受体(例如,tgfbrdn)的psca car、具有开关受体(例如,pd1/cd28或tgfbr/il12r)的psca car、和与双特异性抗体(例如,pd-l1/cd28)组合的psca car。所提供的组合物和方法可用于治疗癌症(例如,前列腺癌)。
61.应当理解,本公开中描述的方法不限于本文公开的具体方法和实验条件,因为这样的方法和条件可以变化。还应理解,本文使用的术语仅用于描述具体实施方式的目的,而不旨在限制性的。
62.此外,除非另有说明,否则本文所述的实验使用本领域技术内的常规分子和细胞生物学和免疫学技术。这样的技术对于熟练的技术人员来说是公知的,并且在文献中有充分的解释。参见例如,ausubel,et al.,ed.,current protocols in molecular biology,john wiley&sons,inc.,ny,n.y.(1987-2008),包括所有增刊(supplement),molecular cloning:a laboratory manual(fourth edition)by mr green and j.sambrook and harlow et al.,antibodies:a laboratory manual,chapter 14,cold spring harbor laboratory,cold spring harbor(2013,2nd edition)。
63.a.定义
64.除非另有定义,否则本文使用的科学和技术术语具有本领域普通技术人员通常理解的含义。如果发生任何潜在的歧义,本文提供的定义优先于任何字典或外部定义。除非上下文另有要求,否则单数术语应包括复数,并且复数术语应包括单数。除非另有说明,否则“或”的使用是指“和/或”。术语“包括(including)”以及诸如“包括(includes)”和“包含(included)”之类的其他形式的使用不是限制性的。
65.通常,与本文所述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学、和蛋白质和核酸化学以及杂交结合使用的命名法在本领域中是公知的和常用的。除非另有说明,否则本文提供的方法和技术通常根据本领域公知的常规方法执行,并且如在整个本说明书中引用和讨论的各种一般和更具体的参考文献中所述。酶促反应和纯化技术根据制造商的说明书执行,如本领域通常完成的或如本文所述。本文所述的与分析化学、合成有机化学以及药物和药物化学结合使用的命名法以及分析化学、合成有机化学以及药物和药物化学的实验室程序和技术是本领域公知的和常用的。标准技术被用于化学合成、化学分析、药物制备、制剂和递送、以及患者的治疗。
66.为了更容易理解本公开,选择的术语定义如下。
67.冠词“一(a)”和“一个(an)”在本文中用于指代冠词的语法对象中的一个或多于一个(即,至少一个)。举例来说,“一个要素”是指一个要素或多于一个要素。
68.如本文所用的“约”在提及诸如量、时距等的可测量值时,意在包括与指定值
±
20%或
±
10%、更优选地
±
5%、甚至更优选地
±
1%、并且更加优选地
±
0.1%的变化,因为这样的变化适合于执行所公开的方法。
69.如本文所用,“活化”是指已被充分刺激以诱导可检测的细胞增殖的t细胞的状态。活化也可能与诱导的细胞因子产生和可检测的效应子功能有关。术语“活化的t细胞”除其他外是指正在经历细胞分裂的t细胞。
70.如本文所用,“减轻”疾病意指降低疾病的一种或多种症状的严重程度。
71.如本文所用,术语“抗原”定义为激发免疫反应的分子。这种免疫反应可能涉及抗体的产生,或特定免疫活性细胞的活化,或两者兼而有之。熟练的技术人员将理解任何包括几乎所有的蛋白质或肽的大分子都可以用作抗原。
72.此外,抗原可以来源于重组或基因组dna。本领域技术人员将理解,任何包含编码引发免疫反应的蛋白质的核苷酸序列或部分核苷酸序列的dna都因此编码如本文所用的术语“抗原”。此外,本领域技术人员将理解抗原不需要仅由基因的全长核苷酸序列编码。很明显,本发明包括但不限于使用多于一种基因的部分核苷酸序列,并且这些核苷酸序列以各种组合排列以引发所期望的免疫反应。此外,技术人员将理解抗原根本不需要由“基因”编
码。很明显,抗原可以合成产生或可以衍生自生物样品。这样的生物样品可以包括但不限于组织样品、肿瘤样品、细胞或生物流体。
73.如本文所用,术语“自体的”意指源自同一个体的任何材料,随后将其重新引入该个体中。
[0074]“共刺激分子”是指t细胞上与共刺激配体特异性结合的同源结合配偶体(cognate binding partner),从而介导t细胞的共刺激反应,如但不限于增殖。共刺激分子包括但不限于mhc i类分子、btla和toll配体受体。
[0075]
如本文所用,“共刺激信号”是指与诸如tcr/cd3连接的初级信号组合导致t细胞增殖和/或关键分子的上调或下调的信号。
[0076]“疾病”是动物的一种健康状态,其中动物不能维持体内稳态,并且其中如果疾病没有减轻,那么动物的健康继续恶化。相比之下,动物的“病症”是一种健康状态,其中动物能够维持体内稳态,但其中动物的健康状态不如其处于无病症时的健康状态。如果不加以治疗,病症不一定会导致动物的健康状况进一步下降。
[0077]
如本文所用,术语“下调”是指减少或消除一种或多种基因的基因表达。
[0078]“有效量”或“治疗有效量”在本文中可互换使用,并且是指如本文所述有效实现特定生物学结果或提供治疗或预防益处的化合物、制剂、材料或组合物的量。这样的结果可以包括但不限于与在不存在本发明的组合物的情况下检测到的免疫反应相比,当施用于哺乳动物时引起可检测水平的免疫抑制或耐受的量。免疫反应可以很容易地通过大量本领域公认的方法进行评估。技术人员将理解本文所施用的组合物的量是变化的,并且可以基于许多因素容易地确定,许多因素如所治疗的疾病或状况、所治疗的哺乳动物的年龄和健康以及身体状况、疾病的严重程度、所施用的特定化合物等。
[0079]“编码”是指诸如基因、cdna或mrna的多核苷酸中特定核苷酸序列的固有特性,其在生物过程中用作合成具有限定的核苷酸序列(即,rrna、trna和mrna)或限定的氨基酸序列以及由此产生的生物学特性的其他聚合物和大分子的模板。因此,如果对应于基因的mrna的转录和翻译在细胞或其他生物系统中产生蛋白质,则该基因编码该蛋白质。编码链和非编码链都可以称为编码该基因或cdna的蛋白质或其他产物,编码链的核苷酸序列与mrna序列相同且通常在序列表中提供,非编码链用作基因或cdna转录的模板。
[0080]
如本文所用,“内源性”是指来自生物体、细胞、组织或系统的内部或在生物体、细胞、组织或系统的内部产生的任何物质。
[0081]
如本文所用,术语“表位”定义为抗原上可引发免疫反应、诱导b和/或t细胞反应的小化学分子。抗原可以具有一个或多个表位。大多数抗原有许多表位;即,它们是多价的。通常,一个表位的大小粗略地为约10个氨基酸和/或糖。优选地,表位为约4-18个氨基酸,更优选地约5-16个氨基酸,甚至更优选地6-14个氨基酸,更优选地约7-12个,且最优选地约8-10个氨基酸。本领域技术人员理解通常是整体的三维结构(而不是分子的特定线性序列)才是抗原特异性的主要标准,且因此区分一个表位与另一个表位。基于本公开,本发明中使用的肽可以是表位。
[0082]
如本文所用,术语“外源性”是指从生物体、细胞、组织或系统的外部引入或在生物体、细胞、组织或系统的外部产生的任何物质。
[0083]
如本文所用,术语“扩增”是指数量增加,如t细胞数量增加。在一个实施方式中,离
体扩增的t细胞的数量相对于培养物中最初存在的数量增加。在另一个实施方式中,离体扩增的t细胞的数量相对于培养物中的其他细胞类型增加。如本文所用,术语“离体”是指已从活的生物体(例如,人)中去除并在生物体外部(例如,在培养皿、试管或生物反应器中)繁殖的细胞。
[0084]
如本文所用,术语“表达”定义为由其启动子驱动的特定核苷酸序列的转录和/或翻译。
[0085]“表达载体”是指包含重组多核苷酸的载体,包括与待表达的核苷酸序列可操作地连接的表达控制序列。表达载体包含足够的用于表达的顺式作用元件;用于表达的其他元件可由宿主细胞或在体外表达系统中提供。表达载体包括本领域已知的所有那些,如掺入重组多核苷酸的粘粒、质粒(例如,裸露的或包含在脂质体中)和病毒(例如,仙台病毒、慢病毒、逆转录病毒、腺病毒和腺伴随病毒(腺相关病毒,adeno-associated virus)。
[0086]
如本文所用,“同一性”是指两个聚合分子之间特别是两个氨基酸分子之间,如两个多肽分子之间的亚基序列同一性。当两个氨基酸序列在相同位置具有相同残基时;例如,如果两个多肽分子的每一个中的一个位置被一个精氨酸占据,那么它们在那个位置上是相同的。在比对中,两个氨基酸序列在相同位置处具有相同残基的同一性或程度通常以百分比表示。两个氨基酸序列之间的同一性是匹配或相同位置的数量的直接函数;例如,如果两个序列中的一半位置(例如,长度为十个氨基酸的聚合物中的五个位置)相同,则两个序列是50%相同的;如果90%的位置(例如,10个中的9个)匹配或相同,则两个氨基酸序列是90%相同的。
[0087]
如本文所用,术语“免疫反应”被定义为当淋巴细胞将抗原分子鉴定为外来物并诱导抗体形成和/或活化淋巴细胞以去除抗原时发生的对抗原的细胞反应。
[0088]
本文使用的术语“免疫抑制”是指降低整体免疫反应。
[0089]“分离的”是指改变或脱离自然状态。例如,活体动物中天然存在的核酸或肽不是“分离的”,但与其天然状态的共存物质部分或完全分开的相同核酸或肽是“分离的”。分离的核酸或蛋白质可以以基本上纯化的形式存在,或者可以存在于非天然环境中,如例如宿主细胞中。
[0090]
如本文所用,“慢病毒”是指逆转录病毒科的一个属。慢病毒在逆转录病毒中的独特在于能够感染非分裂细胞;它们可以将显著量的遗传信息送递到宿主细胞的dna中,因此它们是最有效的基因送递载体方法之一。hiv、siv和fiv都是慢病毒的实例。源自慢病毒的载体提供了在体内实现显著水平的基因转移的方式。
[0091]
如本文所用,术语“修饰的”意指本发明的分子或细胞的改变的状态或结构。分子可以以多种方式进行修饰,多种方式包括化学、结构和功能。可以通过引入核酸来修饰细胞。
[0092]
如本文所用,术语“调节”意指与不存在治疗或化合物时受试者中的反应水平相比和/或与其他方面相同但未经治疗的受试者中的反应水平进行比较,介导受试者中的反应水平可检测的增加或减少。该术语包括扰乱(perturbing)和/或影响天然信号或反应,从而在受试者,优选地人中,介导有益的治疗反应。
[0093]
在本发明的上下文中,使用以下常见(commonly occurring)核酸碱基的缩写。“a”是指腺苷,“c”是指胞嘧啶,“g”是指鸟苷,“t”是指胸苷,“u”是指尿苷。
[0094]
术语“寡核苷酸”典型地是指短的多核苷酸。将理解,当核苷酸序列由dna序列(即,a、t、c、g)表示时,这也包括其中“u”取代“t”的rna序列(即a、u、c、g)。
[0095]
除非另有说明,否则“编码氨基酸序列的核苷酸序列”包括彼此为简并版本且编码相同氨基酸序列的所有核苷酸序列。编码蛋白质或rna的短语核苷酸序列也可以包括内含子,在这方面来说,编码蛋白质的核苷酸序列在某些版本中可以包含内含子(一个或多个)。
[0096]
免疫原性组合物的“肠胃外”施用包括例如皮下(s.c.)、静脉内(i.v.)、肌内(i.m.)或胸骨内注射或输注技术。
[0097]
如本文所用,术语“多核苷酸”被定义为核苷酸链。此外,核酸是核苷酸的聚合物。因此,本文使用的核酸和多核苷酸是可互换的。本领域技术人员具有一般知识,即核酸是多核苷酸,可以水解成单体“核苷酸”。单体核苷酸可以水解成核苷。如本文所用,多核苷酸包括但不限于,通过本领域可用的任何方式获得的所有核酸序列,任何方式包括但不限于重组方式,即,来自重组文库或细胞基因组的核酸序列的克隆,使用普通的克隆技术和pcr等,和通过合成方式。
[0098]
如本文所用,术语“肽”、“多肽”和“蛋白质”可互换使用,是指由通过肽键共价连接的氨基酸残基组成的化合物。蛋白质或肽必须包含至少两个氨基酸,并且对可以构成(comprise)蛋白质或肽序列的最大氨基酸数量没有限制。多肽包括包含通过肽键彼此连接的两个或更多个氨基酸的任何肽或蛋白质。如本文所用,该术语是指:短链,其在本领域中也常常称为例如肽、寡肽和寡聚体;以及指较长链,其在本领域中通常称为蛋白质,其中有有很多类型。“多肽”包括例如生物活性片段、基本上同源的多肽、寡肽、同源二聚体、异源二聚体、多肽的变体、修饰多肽、衍生物、类似物、融合蛋白等。多肽包括天然肽、重组肽、合成肽或它们的组合。
[0099]
如本文所用的关于抗体的术语“特异性结合”意指识别特定抗原但基本上不识别或结合样品中的其他分子的抗体。例如,特异性结合来自一个物种的抗原的抗体也可以结合来自一个或多个物种的抗原。但是,这种跨物种反应性本身并不会改变抗体的特异性分类。在另一个实例中,特异性结合抗原的抗体也可以结合抗原的不同等位基因形式。然而,这种交叉反应性本身并不会改变抗体的特异性分类。在一些情况下,术语“特异性结合”或“特异性地结合”可用于指抗体、蛋白质或肽与第二化学物种(chemical species)的相互作用,以意指该相互作用取决于存在化学物种上的特定结构(例如,抗原决定簇或表位);例如,抗体识别并结合特定的蛋白质结构,而不是一般的蛋白质。如果抗体对表位“a”具有特异性,则在含有标记的“a”和抗体的反应中,含有表位a(或游离、未标记的a)的分子的存在将减少与抗体结合的标记的a的量。
[0100]
术语“刺激”意指通过刺激分子(例如,tcr/cd3复合物)与其同源配体结合从而介导信号转导事件而引起的初级应答,信号转导事件如但不限于经由tcr/cd3复合物的信号转导。刺激可以介导某些分子的表达改变,如tgf-β的下调、和/或细胞骨架结构的再组织等。
[0101]
如本文所用,术语“刺激分子”意指t细胞上与抗原呈递细胞上存在的同源刺激配体特异性结合的分子。
[0102]
如本文所用,“刺激性配体”意指这样的配体:当存在于抗原呈递细胞(例如,aapc、树突细胞、b细胞等)上时可以与t细胞上的同源结合配偶体(称为在本文中称为“刺激分
子”)特异性结合,从而介导t细胞的初级应答,包括但不限于活化、免疫反应的启动、增殖等。刺激性配体是本领域公知的,并且尤其包括装载有肽的mhc i类分子、抗cd3抗体、超激动剂抗cd28抗体和超激动剂抗cd2抗体。
[0103]
术语“受试者”旨在包括其中可以引发免疫反应的活生物体(例如,哺乳动物)。如本文所用,“受试者”或“患者”可以是人类或非人类哺乳动物。非人类哺乳动物包括例如家畜和宠物,如绵羊、牛、猪、犬、猫和鼠科哺乳动物。优选地,受试者是人。
[0104]“靶位点”或“靶序列”是指核酸序列,其定义了在足以发生结合的条件下结合分子可以特异性结合的核酸的部分。在一些实施方式中,靶序列是指基因组核酸序列,其定义了在足以发生结合的条件下结合分子可以特异性结合的核酸的部分。
[0105]
如本文所用,术语“t细胞受体”或“tcr”是指响应于抗原呈递而参与t细胞活化的膜蛋白的复合物。tcr负责识别与主要组织相容性复合物分子结合的抗原。tcr由阿尔法(α)和贝塔(β)链的异源二聚体组成,但是在一些细胞中,tcr由伽马和德尔塔(γ/δ)链构成。tcr可以以α/β和γ/δ形式存在,它们在结构上相似,但具有不同的解剖学位置和功能。每条链由两个胞外结构域组成,一个可变结构域和一个恒定结构域。在一些实施方式中,tcr可以在包含tcr的任何细胞上被修饰,细胞包括例如辅助t细胞、细胞毒性t细胞、记忆t细胞、调节t细胞、天然杀伤t细胞和γδt细胞。
[0106]
如本文所用,术语“治疗”是指治疗和/或预防。治疗效果通过抑制、缓解或根除疾病状态来获得。
[0107]“移植物”是指待移植的生物相容性晶格(lattice)或供体组织、器官或细胞。移植物的实例可以包括但不限于皮肤细胞或组织、骨髓、和实质器官,如心、胰、肾、肺和肝。移植物也可以指待施用于宿主的任何物质。例如,移植物可以指核酸或蛋白质。
[0108]
如本文所用,术语“转染的”或“转化的”或“转导的”是指将外源核酸转移或引入宿主细胞中的过程。“转染的”或“转化的”或“转导的”细胞是已经用外源核酸转染、转化或转导的细胞。该细胞包括初级主题细胞(原代主题细胞,primary subject cell)及其后代。
[0109]
如本文所用术语“治疗”疾病是指降低受试者所经历的疾病或病症的至少一种体征或症状的频率或严重程度。
[0110]“载体”是包含分离的核酸的物质和可用于将分离的核酸递送至细胞内部的物质的组合物。许多载体是本领域已知的,包括但不限于,线性多核苷酸、与离子或两亲化合物相关的多核苷酸、质粒和病毒。因此,术语“载体”包括自主复制的质粒或病毒。该术语还应解释为包括促进核酸转移到细胞中的非质粒和非病毒化合物,如例如聚赖氨酸化合物、脂质体等。病毒载体的实例包括但不限于仙台病毒载体、腺病毒载体、腺伴随病毒载体、逆转录病毒载体、慢病毒载体等。
[0111]
范围:在整个本公开中,本发明的各个方面可以以范围格式呈现。应当理解,范围格式的描述仅仅是为了方便和简洁,不应理解为对本发明范围的不灵活限制。因此,范围的描述应该被认为已经具体公开了所有可能的子范围以及该范围内的各个数值。例如,对诸如1到6的范围的描述应该被认为具有具体公开的子范围,例如1到3、1到4、1到5、2到4、2到6、3到6等,以及该范围内的单个数字,例如1、2、2.7、3、4、5、5.3和6。无论范围的广度如何,这都适用。
[0112]
b.嵌合抗原受体
[0113]
本发明提供能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car)。在某些实施方式中,主题car包含能够结合psca的抗原结合结构域、跨膜结构域和胞内结构域。在另一个方面,本发明包括包含胞外结构域、跨膜结构域、和胞内结构域的双特异性car,胞外结构域包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域和能够结合前列腺特异性膜抗原(psma)的抗原结合结构域。
[0114]
还提供了用于修饰的免疫细胞或其前体的组合物和方法,修饰的免疫细胞或其前体例如修饰t细胞。因此,在一些实施方式中,免疫细胞已被遗传修饰以表达car。还提供了编码所述car的核酸、编码所述核酸的载体和包含所述car、载体或核酸的修饰细胞(例如修饰t细胞)。
[0115]
本发明的主题car包含能够结合psca的抗原结合结构域、跨膜结构域和胞内结构域。本发明的主题car可以任选地包含铰链结构域。因此,本发明的主题car包含能够结合psca的抗原结合结构域、铰链结构域、跨膜结构域和胞内结构域。本发明的主题双特异性car包含胞外结构域,该胞外结构域包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域和能够结合前列腺特异性膜抗原(psma)的抗原结合结构域。在car是双特异性car的实施方式中,能够结合psca的抗原结合结构域与能够结合psma的抗原结合结构域连接。在一些实施方式中,psca抗原结合域可以在psma抗原结合结构域的n端。在一些实施方式中,psma抗原结合结构域可以在psca抗原结合结构域的n端。本发明的双特异性car的c端抗原结合结构域可以与本文所述的car的另一个结构域可操作地连接。
[0116]
抗原结合结构域可以可操作地连接至car的另一个结构域,如跨膜结构域或胞内结构域,两者均在本文别处描述,以在细胞中表达。在一个实施方式中,编码抗原结合结构域的第一核酸序列与编码跨膜结构域的第二核酸可操作地连接,并且进一步与编码胞内结构域的第三核酸序列可操作地连接。
[0117]
本文所述的抗原结合结构域可与本文所述的任何跨膜结构域、本文所述的任何胞内结构域或胞质结构域、或本文所述的可包括在本发明的car中的任何其他结构域组合。本发明的主题car还可以包括如本文所述的铰链结构域。本发明的主题car还可以包括如本文所述的间隔区结构域。在一些实施方式中,抗原结合结构域、跨膜结构域和胞内结构域中的每一个通过接头分开。
[0118]
抗原结合结构域
[0119]
car的抗原结合结构域是car的胞外区域,用于结合特定的靶抗原,靶抗原包括蛋白质、碳水化合物和糖脂。本发明的主题car包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域。
[0120]
抗原结合结构域可以包括与抗原结合的任何结构域,并且可以包括但不限于,单克隆抗体、多克隆抗体、合成抗体、人抗体、人源化抗体、非人抗体和其任何片段。在一些实施方式中,抗原结合结构域部分包括哺乳动物抗体或其片段。抗原结合结构域的选择可能取决于靶细胞表面上存在的抗原的类型和数量。
[0121]
在一些实施方式中,抗原结合结构域选自抗体、抗原结合片段(fab)、和单链可变片段(scfv)。在一些实施方式中,本发明的psca结合结构域选自psca-特异性抗体、psca-特异性fab、和psca-特异性scfv。在一个实施方式中,psca结合域是psca-特异性抗体。在一个实施方式中,psca结合结构域是psca-特异性fab。在一个实施方式中,psca结合结构域是
psca-特异性scfv。
[0122]
如本文所用,术语“单链可变片段”或“scfv”是共价连接以形成vh::vl异源二聚体的免疫球蛋白(例如,小鼠或人)的重链(vh)和轻链(vl)的可变区的融合蛋白。重链(vh)和轻链(vl)直接连接或通过肽编码接头连接,该接头将vh的n端与vl的c端或vh的c端与vl的n端连接起来。在一些实施方式中,抗原结合结构域(例如,psca结合结构域)包括具有从n-端到c-端,vh-接头-vl的构型的scfv。在一些实施方式中,抗原结合结构域包括具有从n-端到c-端,vl-接头-vh的构型的scfv。本领域技术人员将能够选择用于本发明的适当构型。
[0123]
接头由于灵活性而通常富含甘氨酸,以及由于溶解度而富含丝氨酸或苏氨酸。接头可以连接胞外抗原结合结构域的重链可变区和轻链可变区。接头的非限制性实例公开于shen et al.,anal.chem.80(6):1910-1917(2008)和wo 2014/087010中,其内容通过引用以其整体并入本文。本领域已知各种接头序列,包括但不限于,甘氨酸丝氨酸(gs)接头,如(gs)n、(gsggs)n(seq id no:119)、(gggs)n(seq id no:120)、和(ggggs)n(seq id no:121),其中n表示至少为1的整数。示例性接头序列可包括这样的氨基酸序列:包括但不限于,ggsg(seq id no:122)、ggsgg(seq id no:123)、gsgsg(seq id no:124)、gsggg(seq id no:125)、gggsg(seq id no:126)、gsssg(seq id no:127)、ggggs(seq id no:128)、ggggsggggsggggs(seq id no:129)等。本领域技术人员将能够选择适当的接头序列用于本发明。在一个实施方式中,本发明的抗原结合结构域包含重链可变区(vh)和轻链可变区(vl),其中vh和vl被具有氨基酸序列ggggsggggsggggs(seq id no:id no:129)的接头序列分开,其可由核酸序列ggtggcggtggctcgggcggtggtgggtcgggtggcggcggatct(seq id no:130)编码。
[0124]
尽管去除了恒定区并引入了接头,但scfv蛋白仍保留了原始免疫球蛋白的特异性。如huston,et al.(proc.nat.acad.sci.usa,85:5879-5883,1988)所述,单链fv多肽抗体可以由包含vh-和vl-编码序列的核酸表达。另见美国专利号5,091,513、5,132,405和4,956,778;和美国专利公开号20050196754和20050196754。已经描述了具有抑制活性的拮抗性scfv(参见,例如,zhao et al.,hyrbidoma(larchmt)2008 27(6):455-51;peter et al.,j cachexia sarcopenia muscle 2012august 12;shieh et al.,j imunol 2009 183(4):2277-85;giomarelli et al.,thromb haemost 2007 97(6):955-63;fife eta.,j clin invst 2006 116(8):2252-61;brocks et al.,immunotechnology 1997 3(3):173-84;moosmayer et al.,ther immunol 1995 2(10:31-40)。已经描述了具有刺激活性的激动性scfv(参见,例如,peter et al.,j bioi chem 2003 25278(38):36740-7;xie et al.,nat biotech 1997 15(8):768-71;ledbetter et al.,crit rev immunol 1997 17(5-6):427-55;ho et al.,biochim biophys acta 2003 1638(3):257-66)。
[0125]
如本文所用,“fab”是指与抗原结合但为单价且不具有fc部分的抗体结构的片段,例如,被木瓜蛋白酶消化的抗体产生两个fab片段和一个fc片段(例如,重(h)链恒定区;不结合抗原的fc区)。
[0126]
如本文所用,“f(ab')2”是指通过胃蛋白酶消化完整igg抗体产生的抗体片段,其中该片段具有两个抗原结合(ab')(二价)区,其中每个(ab')区包含两条分开的氨基酸链,h链的一部分和一条轻(l)链通过s-s键连接以结合抗原,并且其中剩余的h链部分连接在一起。“f(ab')2”片段可以分成两个单独的fab'片段。
[0127]
在一些实施方式中,抗原结合结构域可源自其中将最终使用car的相同物种。例如,对于在人类中使用,car的抗原结合结构域可以包括人抗体或其片段。在一些实施方式中,抗原结合结构域可以源自其中最终使用car的不同物种。例如,对于在人类中使用,car的抗原结合结构域可以包含鼠抗体或其片段。
[0128]
在某些实施方式中,能够结合前列腺干细胞抗原(psca)的抗原结合结构域包含重链可变区,该重链可变区包含三个重链互补决定区(hcdr)。hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3)。能够结合前列腺干细胞抗原(psca)的抗原结合结构域还包含轻链可变区,该轻链可变区包含三个轻链互补决定区(lcdr)。在某些实施方式中,lcdr1包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6)。
[0129]
在某些实施方式中,能够结合前列腺干细胞抗原(psca)的抗原结合结构域的重链可变区(vh)包含与seq id no:7至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,和/或轻链可变区(vh)包含与seq id no:8至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0130]
在某些实施方式中,能够结合前列腺干细胞抗原(psca)的抗原结合结构域选自全长抗体或其抗原结合片段、fab、单链可变片段(scfv)、或单域抗体。在某些实施方式中,抗原结合结构域是单链可变片段(scfv),其包含与seq id no:9至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0131]
抗原结合结构域序列的可耐受变异对本领域技术人员来说将是已知的。例如,在一些实施方式中,能够结合前列腺干细胞抗原(psca)的抗原结合结构域包括与seq id no:1、2、3、4、5、6、7、8或9中所示的任何氨基酸序列具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0132]
在一些实施方式中,本公开的car可以对一种或多种靶细胞上的一种或多种靶抗原具有亲和力。在一些实施方式中,car可以对一种靶细胞上的一种或多种靶抗原具有亲和力。在这样的实施方式中,car是双特异性car或多特异性car。在一些实施方式中,car包含对一种或多种靶抗原赋予亲和力的一种或多种靶特异性结合结构域。在一些实施方式中,car包含对相同靶抗原赋予亲和力的一种或多种靶特异性结合结构域。例如,包含对相同靶抗原具有亲和力的一种或多种靶特异性结合结构域的car可以结合靶抗原的不同表位。当car中存在多种靶特异性结合结构域时,结合结构域可以串联排列并且可以被接头肽分开。例如,在包含两种靶特异性结合结构域的car中,结合结构域通过寡肽或多肽接头、fc铰链区或膜铰链区在单个多肽链上彼此共价连接。
[0133]
在某些方面,本发明包括双特异性car,所述双特异性car包含胞外结构域、跨膜结构域、和胞内结构域,所述胞外结构域包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域和能够结合前列腺特异性膜抗原(psma)的抗原结合结构域。
[0134]
在某些实施方式中,能够结合psca的抗原结合结构域包含第一重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包
含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及第一轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdrl包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6)。能够结合psma的抗原结合结构域包含第二重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列snwig(seq id no:28),hcdr2包含氨基酸序列iiypgdsdtryspsfqg(seq id no:29),并且hcdr3包含氨基酸序列qtgflwsfdl(seq id no:30);以及第二轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdr1包含氨基酸序列rasqdissala(seq id no:31),lcdr2包含氨基酸序列dassles(seq id no:32),并且lcdr3包含氨基酸序列qqfnsyplt(seq id no:33)。
[0135]
在某些实施方式中,能够结合psca的抗原结合结构域包含第一重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及第一轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdrl包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6),并且能够结合psma的抗原结合结构域包含第二重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列eytih(seq id no:68),hcdr2包含氨基酸序列ninpnnggttynqkfed(seq id no:69),hcdr3包含氨基酸序列gwnfdy(seq id no:70);以及第二轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdrl包含氨基酸序列kasqdvgtavd(seq id no:71),lcdr2包含氨基酸序列wastrht(seq id no:72),并且lcdr3包含氨基酸序列qqynsyplt(seq id no:73)。
[0136]
在某些实施方式中,双特异性car包含第一重链可变区,其包含与seq id no:7至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第一轻链可变区,其包含与seq id no:8至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或第二重链可变区,其包含与seq id no:34至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二轻链可变区,其包含与seq id no:35至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0137]
在某些实施方式中,双特异性car包含第一重链可变区,其包含与seq id no:7至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第一轻链可变区,其包含与seq id no:8至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或第二重链可变区,其包含与seq id no:75至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二轻链可变区,其包含与seq id no:77至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0138]
在某些实施方式中,能够结合psca的抗原结合结构域是单链可变片段(scfv),其包含与seq id no:9至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或能够结合psma的抗原结合结构域是单链可变片段
(scfv),其包含与seq id no:36、78、84或85至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0139]
在某些实施方式中,双特异性car包含胞外结构域,胞外结构域包含能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域,其中胞外结构域包含与seq id no:50或52中所示的氨基酸序列至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0140]
在某些实施方式中,能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域由接头分开。本领域已知的任何接头均可用于将能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域分开。在某些实施方式中,接头包含seq id no:37或38中所列的氨基酸序列。
[0141]
pct/us2019/020729中描述了另外的psma粘合剂(binder)和car,其内容通过引用以其整体并入本文。在某些实施方式中,能够结合psma的抗原结合结构域包含重链可变区,其包含与seq id no:75至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在某些实施方式中,能够结合psma的抗原结合结构域包含轻链可变区,其包含与seq id no:77至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在某些实施方式中,能够结合psma的抗原结合结构域是单链可变片段(scfv),其包含与seq id no:36、78或84至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0142]
在某些实施方式中,能够结合psma的抗原结合结构域包含pct公开号wo2017212250a1和wo2018033749a1中公开的任何重链可变区和轻链可变区,其公开内容通过引用以其整体并入本文。例如,能够结合psma的抗原结合域可以包括scfv,该scfv包含其中公开的任何重链可变区和轻链可变区。因此,本发明的双特异性car或psma-car包含能够结合psma的抗原结合结构域,其可以包含如wo2017212250a1和wo2018033749a1中公开的任何scfv和任何重链可变区和轻链可变区。
[0143]
在某些实施方式中,能够结合psma的抗原结合结构域可以包含表1中所列的任何那些的重链可变区和轻链可变区:
[0144]
表1:
[0145]
[0146]
[0147][0148]
跨膜结构域
[0149]
本发明的car(包括双特异性car)可以包含将car的抗原结合结构域连接到car的胞内结构域的跨膜结构域。主题car的跨膜结构域是能够跨越细胞(例如,免疫细胞或其前体)的质膜的区域。跨膜结构域用于插入细胞膜中,例如,真核细胞膜中。在一些实施方式中,跨膜结构域介于car的抗原结合结构域和胞内结构域之间。
[0150]
在一些实施方式中,跨膜结构域与car中的一个或多个结构域天然相关。在一些实施方式中,可以选择跨膜结构域或通过一个或多个氨基酸取代修饰跨膜结构域以避免此类结构域与相同或不同表面膜蛋白的跨膜结构域结合,从而使与受体复合物的其他成员的相互作用最小化。
[0151]
跨膜结构域可以源自天然或合成来源。在来源是天然的情况下,结构域可以衍生自任何膜结合或跨膜蛋白,例如,i型跨膜蛋白。在来源是合成的情况下,跨膜结构域可以是促进car插入细胞膜中的任何人工序列,例如,人工疏水序列。在本发明中特别使用的跨膜结构域的实例包括但不限于源自以下的跨膜结构域(即,至少包含其跨膜区(一个或多个)):t细胞受体的α、β或ζ链的跨膜结构域、cd28、cd3ε、cd45、cd4、cd5、cd7、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134(ox-40)、cd137(4-1bb)、cd154(cd40l)、icos(cd278)、toll样受体1(tlr1)、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9或衍生自杀伤性免疫球蛋白样受体(kir)的跨膜结构域。
[0152]
在某些实施方式中,跨膜结构域包含cd8的跨膜结构域。在某些实施方式中,cd8的跨膜结构域是cd8α的跨膜结构域。在某些实施方式中,cd8的跨膜结构域跨膜结构域包含seq id no:11中所列的氨基酸序列。在某些实施方式中,跨膜结构域包含cd28的跨膜结构域。在某些实施方式中,cd28的跨膜结构域包含在seq id no:12中所列的氨基酸序列。在某些实施方式中,跨膜结构域包含icos的跨膜结构域。在某些实施方式中,icos的跨膜结构域包含在seq id no:13中所列的氨基酸序列。
[0153]
在一些实施方式中,跨膜结构域可以是合成的,在这种情况下,它将主要包含疏水残基,如亮氨酸和缬氨酸。优选地,苯丙氨酸、色氨酸和缬氨酸的三联体将出现在合成跨膜结构域的每一端。
[0154]
本文所述的跨膜结构域可与本文所述的任何抗原结合结构域、本文所述的任何胞内结构域、或本文所述的可包括在主题car中的任何其他结构域组合。
[0155]
在一些实施方式中,跨膜结构域还包含铰链区。本发明的主题car还可以包括铰链
区。car的铰链区是位于抗原结合结构域和跨膜结构域之间的亲水区。在一些实施方式中,该结构域促进car的正确蛋白质折叠。铰链区是car的任选组件(component)。铰链区可以包括选自以下的结构域:抗体的fc片段、抗体的铰链区、抗体的ch2区、抗体的ch3区、人工铰链序列或其组合。铰链区的实例包括但不限于cd8a铰链、由可以小至三个甘氨酸(gly)的多肽制成的人工铰链、以及igg(如人igg4)的ch1和ch3结构域。
[0156]
在一些实施方式中,本公开的主题car(包括双特异性car)包括将抗原结合结构域与跨膜结构域连接的铰链区,该跨膜结构域进而连接至胞内结构域。铰链区优选地能够支持抗原结合结构域以识别并结合靶细胞上的靶抗原(参见,例如,hudecek et al.,cancer immunol.res.(2015)3(2):125-135)。在一些实施方式中,铰链区是柔性结构域,因此允许抗原结合结构域具有在诸如肿瘤细胞的细胞上最佳识别靶抗原的特定结构和密度的结构(hudecek等人,同上)。铰链区的灵活性允许铰链区采用许多不同的构象。
[0157]
在一些实施方式中,铰链区是免疫球蛋白重链铰链区。在一些实施方式中,铰链区是衍生自受体的铰链区多肽(例如,cd8衍生的铰链区)。
[0158]
铰链区可具有约4个氨基酸至约50个氨基酸的长度,例如约4个aa至约10个aa、约10个aa至约15个aa、约15个aa至约20个aa、约20aa至约25aa、约25aa至约30aa、约30aa至约40aa,或约40aa至约50aa。在一些实施例中,铰链区可以具有大于5aa、大于10aa、大于15aa、大于20aa、大于25aa、大于30aa、大于35aa、大于40aa、大于45aa、大于50aa、大于55aa或更多的长度。
[0159]
合适的铰链区可以容易地选择并且可以是许多合适长度中的任何一种,合适长度如1个氨基酸(例如,gly)至20个氨基酸、2个氨基酸至15个氨基酸、3个氨基酸至12个氨基酸氨基酸,包括4个氨基酸至10个氨基酸、5个氨基酸至9个氨基酸、6个氨基酸至8个氨基酸、或7个氨基酸至8个氨基酸,且可以是1、2、3、4、5、6或7个氨基酸。合适的铰链区可以具有大于20个氨基酸(例如,30、40、50、60或更多个氨基酸)的长度。
[0160]
例如,铰链区包括甘氨酸聚合物(g)n、甘氨酸-丝氨酸聚合物(包括,例如(gs)n、(gsggs)n(seq id no:119)和(gggs)n(seq id no:120),其中n是至少一的整数)、甘氨酸-丙氨酸聚合物、丙氨酸-丝氨酸聚合物和本领域已知的其他柔性接头。可以使用甘氨酸和甘氨酸-丝氨酸聚合物;gly和ser都是相对非结构化的,因此可以充当组件之间的中性系链(tether)。可以使用甘氨酸聚合物;甘氨酸甚至比丙氨酸进入(accesses)显著更多的phi-psi空间,并且比具有较长侧链的残基受到的限制要小得多(参见,例如,scheraga,rev.computational.chem.(1992)2:73-142)。示例性铰链区可包含氨基酸序列,该氨基酸序列包括但不限于ggsg(seq id no:122)、ggsgg(seq id no:123)、gsgsg(seq id no:124)、gsggg(seq id no:125)、gggsg(seq id no:126)、gsssg(seq id no:127)等。
[0161]
在一些实施方式中,铰链区是免疫球蛋白重链铰链区。免疫球蛋白铰链区氨基酸序列是本领域已知的;参见,例如,tan et al.,proc.natl.acad.sci.usa(1990)87(1):162-166;和huck et al.,nucleic acids res.(1986)14(4):1779-1789。作为非限制性实例,免疫球蛋白铰链区可包括以下氨基酸序列之一:dktht(seq id no:131);cppc(seq id no:132);cpepkscdtpppcpr(seq id no:133)(参见,例如,glaser et al.,j.biol.chem.(2005)280:41494-41503);elktplgdttht(seq id no:134);kscdkthtcp(seq id no:135);kccvdcp(seq id no:136);kygppcp(seq id no:137);epkscdkthtcppcp(seq id no:138)
(人igg1铰链);erkccvecppcp(seq id no:139)(人igg2铰链);elktplgdtthtcprcp(seq id no:140)(人igg3铰链);spnmvphahhaq(seq id no:141)(人igg4铰链);和类似物。
[0162]
铰链区可以包含人igg1、igg2、igg3或igg4、铰链区的氨基酸序列。在一个实施方式中,与野生型(天然存在的)铰链区相比,铰链区可以包括一个或多个氨基酸取代和/或插入和/或缺失。例如,人igg1铰链的his229可以被tyr取代,使得铰链区包含序列epkscdktytcppcp(seq id no:142);参见,例如,yan et al.,j.biol.chem.(2012)287:5891-5897。
[0163]
在某些实施方式中,铰链区可包含源自人cd8的氨基酸序列或其变体。在某些实施方式中,car包含cd8α铰链序列,其包含seq id no:10中所列的氨基酸序列。在某些实施方式中,car包含铰链序列,该铰链序列包含在seq id no:99中所列的氨基酸序列。在某些实施方式中,car包含铰链序列,该铰链序列包含在seq id no:100中所列的氨基酸序列。
[0164]
胞内结构域
[0165]
本发明的主题car(包括主题双特异性car)也包括胞内结构域。在某些实施方式中,胞内结构域包含共刺激信号传导结构域和胞内信号传导结构域。car的胞内结构域负责活化其中表达car的细胞(例如,免疫细胞)的至少一种效应子功能。胞内结构域转导效应子功能信号并指导细胞(例如,免疫细胞)执行其特化功能(specialized function),例如,伤害和/或破坏靶细胞。
[0166]
用于本发明的胞内结构域的实例包括但不限于表面受体的胞质部分、共刺激分子、和协同作用(共同作用,acts in concert)以启动t细胞中的信号转导的任何分子、以及这些元件的任何衍生物或变体和具有相同功能能力的任何合成序列。
[0167]
胞内结构域的实例包括但不限于,t细胞受体复合物的ζ链或其任何同系物,例如η链、fcsriγ和β链、mb 1(iga)链、b29(ig)链等、人cd3ζ链、cd3多肽(δ、δ和ε)、syk家族酪氨酸激酶(syk、zap 70等)、src家族酪氨酸激酶(lck、fyn、lyn等)和参与t细胞转导的其他分子,如cd2、cd5和cd28。在一个实施方式中,胞内信号传导结构域可以是人cd3ζ链、fcγriii、fcsri、fc受体的胞质尾区、带有胞质受体的基于免疫受体酪氨酸的活化基序(itam)、以及它们的组合。
[0168]
在某些实施方式中,car的胞内结构域包括一种或多种共刺激分子的任何部分,如来自cd2、cd3、cd8、cd27、cd28、icos(cd278)、4-1bb、pd-1的至少一个信号传导结构域、其任何衍生物或变体、其具有相同功能能力的任何合成序列、以及它们的任何组合。胞内结构域包含选自以下的蛋白质的共刺激结构域:tnfr超家族中的蛋白质、cd28、4-1bb(cd137)、ox40(cd134)、pd-1、cd7、light、cd83l、dap10、dap12、cd27、cd2、cd5、icam-1、lfa-1、lck、tnfr-i、tnfr-ii、fas、cd30、cd40、icos、nkg2c和b7-h3(cd276)或其变体,或源自杀伤性免疫球蛋白样受体(kir)的胞内结构域。
[0169]
此外,适用于主题car的变体胞内信号传导结构域是本领域已知的。ymfm基序发现于icos中,是一种sh2结合基序,其可募集pi3k的p85和p50α亚基,从而增强akt信号传导。参见,例如,simpson et al.(2010)curr.opin.immunol.,22:326-332。在一个实施方式中,可以生成cd28胞内结构域变体以包含ymfm基序。ymnm基序发现于cd28胞质结构域中,是磷脂酰肌醇3-激酶(pi3-k)和grb2的已知结合位点。参见,harada et al.(2003)j.exp.med.,197(2):257-262。在一个实施方式中,可以生成icos胞内结构域变体以包含ymnm基序。
[0170]
在某些实施方式中,胞内结构域包含4-1bb的共刺激结构域。在某些实施方式中,4-1bb的共刺激结构域包含seq id no:14中所示的氨基酸序列。在某些实施方式中,胞内结构域包含cd28的共刺激结构域。在某些实施方式中,cd28的共刺激结构域包含seq id no:15中所示的氨基酸序列。在某些实施方式中,胞内结构域包含icos的共刺激结构域。在某些实施方式中,icos共刺激结构域包含seq id no:16中所示的氨基酸序列。在某些实施方式中,胞内结构域包含icos(ymnm)的共刺激结构域。在某些实施方式中,icos(ymnm)的共刺激结构域包含seq id no:17中所示的氨基酸序列。
[0171]
胞内结构域的其他实例包括来自一种或多种分子或受体的片段或结构域,一种或多种分子或受体包括但不限于tcr、cd3ζ、cd3γ、cd3δ、cd3ε、cd86、共同fcrγ、fcrβ(fc epsilon(ε)rib)、cd79a、cd79b、fcγriia、dap10、dap12、t细胞受体(tcr)、cd8、cd27、cd28、4-1bb(cd137)、ox9、ox40、cd30、cd40、pd-1、icos、kir家族蛋白、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、与cd83特异性结合的配体、cds、icam-1、gitr、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、cd127、cd160、cd19、cd4、cd8α、cd8β、il2rβ、il2rγ、il7rα、itga4、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cdlib、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、trance/rankl、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(触觉的)、ceacam1、crt am、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、cd69、slam f6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、lat、gads、slp-76、pag/cbp、nkp44、nkp30、nkp46、nkg2d、toll样受体1(tlr1)、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、本文所述的其他共刺激分子、其任何衍生物、变体或片段、具有相同功能能力的共刺激分子的任何合成序列、以及其任意组合。
[0172]
胞内结构域的额外的实例包括但不限于几种类型的各种其他免疫信号受体的胞内信号传导结构域,包括但不限于,包括cd3、b7家族共刺激的第一代、第二代和第三代t细胞信号传导蛋白、和肿瘤坏死因子受体(tnfr)超家族受体(参见,例如,park and brentjens,j.clin.oncol.(2015)33(6):651-653)。此外,胞内信号传导结构域可以包括由nk和nkt细胞使用的信号传导结构域(参见,例如,hermanson and kaufman,front.immunol.(2015)6:195),如nkp30(b7-h6)的信号传导结构域(参见,例如,zhang et al.,j.immunol.(2012)189(5):2290-2299)、和dap 12(参见,例如,topfer et al.,j.immunol.(2015)194(7):3201-3212)、nkg2d、nkp44、nkp46、dap10和cd3z。
[0173]
在某些实施方式中,胞内结构域包含选自以下的胞内信号传导结构域:人cd3ζ链(cd3ζ)的胞质信号传导结构域、fcγriii、fcsri、fc受体的胞质尾区、带有细胞质受体的基于免疫受体酪氨酸的活化基序(itam)、tcrζ、fcrγ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d或其变体。在某些实施方式中,胞内结构域包含cd3ζ或其变体的胞内结构域。在某些实施方式中,cd3ζ的胞内结构域包含18或19中所列的氨基酸序列。
[0174]
适用于本发明主题car的胞内结构域包括响应于car的活化(即,被抗原和二聚化剂活化)而提供独特(不同,distinct)和可检测信号的任何所期望的信号传导结构域(例如,细胞产生一种或多种细胞因子的增加;靶基因转录的变化;蛋白质的活性的变化;细胞行为的变化,例如,细胞死亡;细胞增殖;细胞分化;细胞存活;细胞信号传导反应的调节等)。在一些实施方式中,胞内结构域包括如下所述的至少一个(例如,一、二、三、四、五、六
等)itam基序。在一些实施方式中,胞内结构域包括dap10/cd28型信号传导链。在一些实施方式中,胞内结构域不与膜结合的car共价连接,而是扩散在细胞质中。
[0175]
适用于本发明主题car的胞内结构域包括含有基于免疫受体酪氨酸的活化基序(itam)的胞内信号传导多肽。在一些实施方式中,itam基序在胞内结构域中重复两次,其中itam基序的第一和第二种情况(instance)通过6至8个氨基酸彼此分开。在一个实施方式中,主题car的胞内结构域包含3个itam基序。
[0176]
在一些实施方式中,胞内结构域包括人免疫球蛋白受体的信号传导结构域,其含有基于免疫受体酪氨酸的活化基序(itam),如但不限于,fcγri、fcγriia、fcγriic、fcγriiia、fcrl5(参见,例如,gillis et al.,front.immunol.(2014)5:254)。
[0177]
合适的胞内结构域可以是衍生自含itam基序的多肽的含itam基序的部分。例如,合适的胞内结构域可以是来自任何含itam基序的蛋白质的含itam基序的结构域。因此,合适的胞内结构域不需要含有由其衍生的整个蛋白质的完整序列。合适的含itam基序的多肽的实例包括但不限于:dap12、fcer1g(fcε受体iγ链)、cd3d(cd3δ)、cd3e(cd3ε)、cd3g(cd3γ)、cd3z(cd3ζ)和cd79a(抗原受体复合物相关蛋白α链)。
[0178]
在一个实施方式中,胞内结构域衍生自dap12(也称为tyrobp;tyro蛋白酪氨酸激酶结合蛋白;karap;plosl;dnax活化蛋白12;kar相关蛋白;tyro蛋白酪氨酸激酶结合蛋白;杀伤性活化受体相关蛋白;杀伤性-活化受体-相关蛋白等)。在一个实施方式中,胞内结构域衍生自fcer1g(也称为fcrg;fcε受体iγ链;fc受体γ链;fc-εri-γ;fcrγ;fcerlγ;高亲和力免疫球蛋白ε受体亚基γ;免疫球蛋白e受体、高亲和力、γ链等)。在一个实施方式中,胞内结构域衍生自t细胞表面糖蛋白cd3δ链(也称为cd3d;cd3-δ;t3d;cd3抗原,δ亚基;cd3δ;cd3d抗原,δ多肽(tit3复合物);okt3、δ链;t细胞受体t3δ链;t细胞表面糖蛋白cd3δ链等)。在一个实施方式中,胞内结构域衍生自t细胞表面糖蛋白cd3ε链(也称为cd3e、t细胞表面抗原t3/leu-4ε链、t细胞表面糖蛋白cd3ε链、ai504783、cd3、cd3ε、t3e等)。在一个实施方式中,胞内结构域衍生自t细胞表面糖蛋白cd3γ链(也称为cd3g、t细胞受体t3γ链、cd3-γ、t3g、γ多肽(tit3复合物)等)。在一个实施方式中,胞内结构域衍生自t细胞表面糖蛋白cd3ζ链(也称为cd3z、t细胞受体t3ζ链、cd247、cd3-z、cd3h、cd3q、t3z、tcrz等)。在一个实施方式中,胞内结构域衍生自cd79a(也称为b细胞抗原受体复合物相关蛋白α链;cd79a抗原(免疫球蛋白相关α);mb-1膜糖蛋白;ig-α;膜结合免疫球蛋白相关蛋白;表面igm相关蛋白等)。在一个实施方式中,适用于本公开的fn3 car的胞内结构域包括dap10/cd28型信号传导链。在一个实施方式中,适用于本公开的fn3 car的胞内结构域包括zap70多肽。在一些实施方式中,胞内结构域包括tcrζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b或cd66d的胞质信号传导结构域。在一个实施方式中,car中的胞内结构域包括人cd3ζ的胞质信号传导结构域。
[0179]
虽然通常可以使用整个胞内结构域,但在许多情况下不需要使用整个链。就使用胞内结构域的截短部分而言,该截短部分可用于代替完整链,只要它转导效应子功能信号即可。胞内结构域包括足以转导效应子功能信号的胞内结构域的任何截短部分。
[0180]
本文所述的胞内结构域可与本文所述的任何抗原结合结构域、本文所述的任何跨膜结构域、或本文所述的可包括在car中的任何其他结构域组合。
[0181]
单个car结构域序列(铰链、跨膜和胞内结构域)的可耐受变化将是本领域技术人
员已知的。例如,在一些实施方式中,car结构域包含与seq id no:10、11、12、13、14、15、16、17、18、19、99和100中所示的任何氨基酸序列具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0182]
在一个方面,本发明提供了能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car),其包含抗原结合结构域、跨膜结构域和胞内结构域,其中抗原结合结构域包含重链链可变区,其包含与seq id no:7至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及轻链可变区,其包含与seq id no:8至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0183]
在一个方面,本发明提供能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car),其包含与seq id no:9至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0184]
在一个方面,本发明提供能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car),其包含与seq id no:21、23、25或27至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。car序列的可耐受变化将是本领域技术人员已知的。例如,在一些实施方式中,car包含与seq id no:21、23、25或27中所示的任何氨基酸序列具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0185]
在一个方面,本发明提供了能够结合前列腺特异性膜抗原(psma)的嵌合抗原受体(car),其包含与seq id no:67、87、89、91、93、95或97至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。car序列的可耐受变化将是本领域技术人员已知的。例如,在一些实施方式中,car包含与seq id no:67、87、89、91、93、95或97中所示的氨基酸序列具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0186]
在一个方面,本发明提供了包含胞外结构域、跨膜结构域、和胞内结构域的双特异性嵌合抗原受体(car),所述胞外结构域包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域和能够结合前列腺特异性膜抗原(psma)的抗原结合结构域。
[0187]
在一个方面,本发明提供了双特异性car,其中胞外结构域包含能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域,其中双特异性car包含seq id no:40、42或80-82中所示的氨基酸序列。car序列的可耐受变化将是本领域技术人员已知的。例如,在一些实施方式中,car包含与seq id no:40、42或80-82中所示的任何氨基酸序列具有至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的序列同一性的氨基酸序列。
[0188]
在一个方面,本发明提供了能够结合前列腺干细胞抗原(psca)和前列腺特异性膜抗原(psma)的双特异性嵌合抗原受体(car),其中能够结合psma的抗原结合结构域是单链
可变片段(scfv),其包含与seq id no:78、84或85至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,和/或能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域包含seq id no:50或52所示的氨基酸序列。
[0189]
在一个方面,本发明提供了能够结合前列腺干细胞抗原(psca)和前列腺特异性膜抗原(psma)的双特异性嵌合抗原受体(car),其包含胞外结构域、跨膜结构域和胞内结构域,该胞外结构域包含能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域。能够结合psca的抗原结合结构域包含重链可变区,其包含与seq id no:7至少80%、85%、90%、95%、96%、97%、98%、99%、或100%相同的氨基酸序列;和/或轻链可变区,其包含与seq id no:8至少80%、85%、90%、95%、96%、97%、98%、99%、或100%相同的氨基酸序列。能够结合psma的抗原结合结构域包含重链可变区,其包含与seq id no:34至少80%、85%、90%、95%、96%、97%、98%、99%、或100%相同的氨基酸序列;和/或轻链可变区,其包含与seq id no:35至少80%、85%、90%、95%、96%、97%、98%、99%、或100%相同的氨基酸序列。
[0190]
在一个方面,本发明提供了能够结合前列腺干细胞抗原(psca)和前列腺特异性膜抗原(psma)的双特异性嵌合抗原受体(car),其中能够结合psca的抗原结合结构域是单链可变片段(scfv),其包含与seq id no:9至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或能够结合psma的抗原结合结构域是单链可变片段(scfv),其包含与seq id no:36至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0191]
在一个方面,本发明提供了能够结合前列腺干细胞抗原(psca)和前列腺特异性膜抗原(psma)的双特异性嵌合抗原受体(car),其包含胞外结构域、跨膜结构域、和胞内结构域,该胞外结构域包含能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域。能够结合psca的抗原结合结构域包含重链可变区,其包含与seq id no:7至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及轻链可变区,其包含与seq id no:8至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。能够结合psma的抗原结合结构域包含重链可变区,其包含与seq id no:75至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及轻链可变区,其包含与seq id no:77至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0192]
在一个方面,本发明提供了双特异性car,其中胞外结构域包含能够结合psca的抗原结合结构域,其包含包含三个重链互补决定区(hcdr)的第一重链可变区,其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);和/或包含三个轻链互补决定区(lcdr)的第一轻链可变区,其中lcdr1包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6);以及能够结合psma的抗原结合结构域,其包含包含三个重链互补决定区(hcdr)的第二重链可变区,其中hcdr1包含氨基酸序列snwig(seq id no:28),hcdr2包含氨基酸序列iiypgdsdtryspsfqg(seq id no:29),并且hcdr3包含氨基酸序列qtgflwsfdl(seq id no:30);和/或包含三个轻链互补决定区(lcdr)的第二轻链可变区,其中lcdr1包含氨基酸序列
rasqdissala(seq id no:31),lcdr2包含氨基酸序列dassles(seq id no:32),并且lcdr3包含氨基酸序列qqfnsyplt(seq id no:33)。
[0193]
在一个方面,本发明提供了双特异性car,其中胞外结构域包含能够结合psca的抗原结合结构域,其包含包含三个重链互补决定区(hcdr)的第一重链可变区,其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);和/或包含三个轻链互补决定区(lcdr)的第一轻链可变区,其中lcdr1包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6);以及能够结合psma的抗原结合结构域,其包含包含三个重链互补决定区(hcdr)的第二重链可变区,其中hcdr1包含氨基酸序列eytih(seq id no:68),hcdr2包含氨基酸序列ninpnnggttynqkfed(seq id no:69),并且hcdr3包含氨基酸序列gwnfdy(seq id no:70);和/或包含三个轻链互补决定区(lcdr)的第二轻链可变区,其中lcdr1包含氨基酸序列kasqdvgtavd(seq id no:71),lcdr2包含氨基酸序列wastrht(seq id no:72),并且lcdr3包含氨基酸序列qqynsyplt(seq id no:73)。
[0194]
表2:本发明中使用的序列
[0195]
[0196]
[0197]
[0198]
[0199]
[0200]
[0201]
[0202]
[0203]
[0204]
[0205]
[0206]
[0207]
[0208]
[0209]
[0210]
[0211]
[0212]
[0213][0214]
c.核酸和表达载体
[0215]
本公开提供了编码car的核酸。本公开的核酸可以包含编码本文公开的任何一种car(包括双特异性car)的多核苷酸序列。
[0216]
在某些方面,本发明包括包含多核苷酸序列的核酸,所述多核苷酸序列编码能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car),其包含抗原结合结构域、跨膜结构域和胞内结构域。在某些实施方式中,抗原结合结构域包含:包含三个重链互补决定区(hcdr)的重链可变区,其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及包含三个轻链互补决定区(lcdr)的轻链可变区,其中lcdr1包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6)。
[0217]
在某些实施方式中,抗原结合结构域包含由与seq id no:43至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码的重链可变区和/或由与seq id no:44至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码的轻链可变区。
[0218]
在某些实施方式中,抗原结合结构域是由与seq id no:45至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码的单链可变片段(scfv)。
[0219]
还提供了包含编码能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car)的多核苷酸序列的核酸,其包含抗原结合结构域、跨膜结构域和胞内结构域,其中抗原结合结构域包含重链可变区,其包含与seq id no:7至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、或100%相同的氨基酸序列;和/或轻链可变区,其包含与seq id no:8至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%、或100%相同的氨基酸序列。
[0220]
还提供了包含编码能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car)的多
核苷酸序列的核酸,其包含与seq id no:20至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列。
[0221]
本发明还提供了包含编码能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car)的多核苷酸序列的核酸,其包含与seq id no:20、22、24或26至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列。
[0222]
本发明还提供了包含编码能够结合前列腺特异性膜抗原(psma)的嵌合抗原受体(car)的多核苷酸序列的核酸,其中psma-car包含与seq id no:67、87、89、91、93、95或97中所示的氨基酸序列至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在某些实施方式中,psma-car由与seq id no:88、90、92、94、96或98至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码。
[0223]
还提供了一种核酸,其包含编码能够结合前列腺干细胞抗原(psca)和前列腺特异性膜抗原(psma)的双特异性嵌合抗原受体(car)的多核苷酸序列,其中双特异性car包含胞外结构域、跨膜结构域和胞内结构域,胞外结构域包含能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域。
[0224]
在某些实施方式中,胞外结构域包含能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域。能够结合psca的抗原结合结构域包含第一重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及第一轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdrl包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6)。能够结合psma的抗原结合结构域包含第二重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列snwig(seq id no:28),hcdr2包含氨基酸序列iiypgdsdtryspsfqg(seq id no:29),并且hcdr3包含氨基酸序列qtgflwsfdl(seq id no:30);以及第二轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdr1包含氨基酸序列rasqdissala(seq id no:31),lcdr2包含氨基酸序列dassles(seq id no:32),并且lcdr3包含氨基酸序列qqfnsyplt(seq id no:33)。
[0225]
在某些实施方式中,胞外结构域包含能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域,其中能够结合psca的抗原结合结构域包含第一重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及第一轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdrl包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6)。能够结合psma的抗原结合结构域包含第二重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列eytih(seq id no:68),hcdr2包含氨基酸序列ninpnnggttynqkfed(seq id no:69),并且hcdr3包含氨基酸序列gwnfdy(seq id no:70);以及第二轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdrl包含氨基酸序列kasqdvgtavd(seq id no:71),lcdr2包含氨基酸序列wastrht(seq id no:72),并且lcdr3包含氨基酸序列qqynsyplt(seq id no:73)。
[0226]
在某些实施方式中,第一重链可变区(能够结合psca)由与seq id no:43至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码;并且第一轻链可变区(能够结合psca)由与seq id no:44至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码;和/或第二重链可变区(能够结合psma)由与seq id no:46或74至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码;以及第二轻链可变区(能够结合psma)由与seq id no:47或76至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码。
[0227]
在某些实施方式中,能够结合psca的抗原结合结构域包含由与seq id no:45至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码的scfv。在某些实施方式中,能够结合psma的抗原结合结构域包含由与seq id no:48、83或86至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码的scfv。
[0228]
在某些实施方式中,胞外结构域由包含seq id no:49或51中所列的核酸序列的多核苷酸序列编码。
[0229]
在某些实施方式中,car(包括双特异性car)进一步包含铰链序列,该铰链序列包含seq id no:10、99或100中所列的氨基酸序列。在某些实施方式中,car或双特异性car的跨膜结构域包含cd8α的跨膜结构域,其包含seq id no:11中所列的氨基酸序列。在某些实施方式中,跨膜结构域包含cd28的跨膜结构域,其包含seq id no:12中所列的氨基酸序列。在某些实施方式中,跨膜结构域包含icos的跨膜结构域,其包含seq id no:13中所列的氨基酸序列。
[0230]
在某些实施方式中,胞内结构域包含共刺激信号传导结构域和胞内信号传导结构域。在某些实施方式中,共刺激信号传导结构域包含4-1bb的共刺激结构域,其包含seq id no:14中所列的氨基酸序列。在某些实施方式中,共刺激信号传导结构域包含cd28的共刺激结构域,其包含seq id no:15中所列的氨基酸序列。在某些实施方式中,共刺激信号传导结构域包含icos的共刺激结构域,其包含seq id no:16中所列的氨基酸序列。在某些实施方式中,共刺激信号传导结构域包含icos(ymnm)的共刺激结构域,其包含seq id no:17中所列的氨基酸序列。在某些实施方式中,胞内信号传导结构域包含cd3ζ或其变体的胞内结构域,其中cd3ζ的胞内结构域包含seq id no:18或19中所列的氨基酸序列。
[0231]
在某些实施方式中,双特异性car由与seq id no:39、41或79至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码。
[0232]
本发明的另一方面包括包含编码能够结合前列腺干细胞抗原的嵌合抗原受体(car)(psca-car)的第一多核苷酸序列和编码显性负性受体的第二多核苷酸序列的核酸,其中car包含抗原结合结构域、跨膜结构域和胞内结构域。
[0233]
在某些实施方式中,显性负性受体是与负信号相关的野生型蛋白质的截短变体。在某些实施方式中,与负信号相关的野生型蛋白质的截短变体包含与seq id no:56至少80%、85%、90%、95%、96%、97%、98%、99%、或100%相同的氨基酸序列和/或由与seq id no:55至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列
编码。
[0234]
还提供了一种核酸,其包含编码能够结合前列腺干细胞抗原的嵌合抗原受体(car)(psca-car)的第一多核苷酸序列和编码开关受体的第二多核苷酸序列,其中car包含抗原结合结构域、跨膜结构域和胞内结构域。
[0235]
在某些实施方式中,开关受体包含衍生自与负信号相关的第一开关多肽的第一结构域;以及衍生自与正信号相关的第二开关多肽的第二结构域。在某些实施方式中,第一结构域包含与负信号相关的第一开关多肽的胞外结构域的至少一部分,并且第二结构域包含与正信号相关的第二开关多肽的胞内结构域的至少一部分。
[0236]
在某些实施方式中,开关受体进一步包含开关受体跨膜结构域。在某些实施方式中,开关受体跨膜结构域包括:与负信号相关的第一开关多肽的跨膜结构域;或与正信号相关的第二开关多肽的跨膜结构域。
[0237]
在某些实施方式中,与负信号相关的第一开关多肽选自ctla4、pd-1、pd-l1、btla、tim-3、ifnγr和tgfβr。在某些实施方式中,其中与正信号相关的开关多肽选自cd28、icos和il-12r。
[0238]
在某些实施方式中,开关受体包含第一结构域,其包含pd1的胞外结构域的至少一部分;开关受体跨膜结构域,其包含cd28的跨膜结构域的至少一部分;以及第二结构域,其包含cd28的胞内结构域的至少一部分。pd1-cd28开关受体描述于liu x,et al.(2016)cancer research,76(6),1578-1590,其内容通过引用以其整体并入本文。在某些实施方式中,开关受体由与seq id no:57至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码,和/或包含与seq id no:58至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0239]
在某些实施方式中,开关受体包含第一结构域,其包含ifnγr的胞外结构域的至少一部分;和第二结构域,其包含il12rβ1的胞内结构域的至少一部分。在某些实施方式中,开关受体由与seq id no:59中所列的核苷酸序列至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码,和/或包含与seq id no:60至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0240]
在某些实施方式中,开关受体包含第一结构域,其包含ifnγr的胞外结构域的至少一部分;和第二结构域,其包含il12rβ2的胞内结构域的至少一部分。在某些实施方式中,开关受体由与seq id no:61中所列的序列至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码,和/或包含与seq id no:62至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0241]
额外的开关受体描述于pct/us2019/020729中,其内容通过引用以其整体并入本文。
[0242]
本发明的另一方面提供了一种核酸,其包含编码能够结合前列腺干细胞抗原的嵌合抗原受体(car)(psca-car)的第一多核苷酸序列和编码双特异性抗体的第二多核苷酸序列,其中car包含抗原结合结构域、跨膜结构域和胞内结构域。
[0243]
在某些实施方式中,双特异性抗体包含第一结合结构域和第二结合结构域。在某些实施方式中,第一结合结构域与选自ctla4、pd-1、pd-l1、btla、tim-3、和tgfβr的负信号结合。在某些实施方式中,第二结合域与共刺激分子结合。在某些实施方式中,共刺激分子
是cd28。
[0244]
在某些实施方式中,双特异性抗体包含能够结合pd-l1的第一结合结构域和能够结合cd28的第二结合结构域。在某些实施方式中,双特异性抗体由与seq id no:63至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码,和/或包含与seq id no:64至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0245]
在某些实施方式中,双特异性抗体包含能够结合tgfβr2的第一结合结构域和能够结合cd28的第二结合结构域。在某些实施方式中,双特异性抗体由与seq id no:65至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的多核苷酸序列编码,和/或包含与seq id no:66至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0246]
在某些实施方式中,本公开的核酸包含第一多核苷酸序列和第二多核苷酸序列。第一和第二多核苷酸序列可以通过接头分开。例如,在某些实施方式中,能够结合psca的抗原结合结构域和能够结合psma的抗原结合结构域通过接头隔开。在某些实施方式中,接头由包含seq id no:53或54中所列的核酸序列的多核苷酸序列编码。用于本公开的接头允许多个蛋白质由相同核酸序列(例如,多顺反子或双顺反子序列)编码,其被翻译为分离成单独蛋白质组分的多蛋白。例如,用于本公开的核酸中的接头包含psca car编码序列和psma car编码序列,允许psca car和psma car被翻译为分离成单独car的多蛋白。在某些实施方式中,核酸从5'到3'包含第一多核苷酸序列、接头、和第二多核苷酸序列。在某些实施方式中,核酸从5'到3'包含第二多核苷酸序列、接头、和第一多核苷酸序列。
[0247]
在一些实施方式中,接头包含编码内部核糖体进入位点(ires)的核酸序列。如本文所用,“内部核糖体进入位点”或“ires”是这样的元件,其促进直接内部核糖体进入到蛋白质编码区的诸如atg的起始密码子,从而导致基因的帽非依赖性翻译。本领域技术人员已知各种内部核糖体进入位点,包括但不限于可从病毒或细胞mrna来源获得的ires,例如,免疫球蛋白重链结合蛋白(bip);血管内皮生长因子(vegf);成纤维细胞生长因子2;胰岛素样生长因子;翻译起始因子eif4g;酵母转录因子tfiid和hap4;以及可从例如心脏病毒、鼻病毒、口疮病毒、hcv、弗兰德鼠白血病病毒(frmlv)和莫洛尼鼠白血病病毒(momlv)获得的ires。本领域技术人员将能够选择适当的ires用于本发明。
[0248]
在一些实施方式中,接头包含编码自切割肽的核酸序列。如本文所用,“自切割肽”或“2a肽”是指允许多个蛋白质被编码为在翻译时分离成组分蛋白质的多蛋白的寡肽。使用术语“自切割”并非旨在暗示蛋白水解切割反应。本领域技术人员已知各种自切割或2a肽,包括但不限于在小rna病毒科病毒家族成员中发现的那些,例如,口蹄疫病毒(fmdv)、马鼻炎a病毒(erav0、thesa asigna病毒(tav)和猪tescho病毒-1(ptv-1);以及carioviruses,如theilovirus和脑心肌炎病毒。衍生自fmdv、erav、ptv-1和tav的2a肽在本文中分别称为“f2a”、“e2a”、“p2a”和“t2a”。本领域技术人员将能够选择适当的自切割肽用于本发明。
[0249]
在一些实施方式中,接头还包含编码弗林(furin)蛋白酶切割位点的核酸序列。弗林蛋白酶(furin)是一种遍在表达的蛋白酶,它存在于反式高尔基体中,并在蛋白质前体分泌之前对其进行加工。弗林蛋白酶在其共有识别序列的cooh-端切割。本领域技术人员已知各种弗林蛋白酶共有识别序列(或“弗林蛋白酶切割位点”),包括但不限于arg-x1-lys-arg
101:3416。作为另一个实例,可以使用cd8基因启动子。nk细胞特异性表达可以通过使用ncri(p46)启动子来实现;参见,例如,eckelhart et al.blood(2011)117:1565。
[0255]
对于在酵母细胞中的表达,合适的启动子是组成型启动子,如adh1启动子、pgk1启动子、eno启动子、pyk1启动子等;或可调节的启动子,如gal1启动子、gal10启动子、adh2启动子、phos启动子、cup1启动子、galt启动子、met25启动子、met3启动子、cyc1启动子、his3启动子、adh1启动子、pgk启动子、gapdh启动子、adc1启动子、trp1启动子、ura3启动子、leu2启动子、eno启动子、tp1启动子和aox1(例如,用于毕赤酵母属(pichia))。适当的载体和启动子的选择完全在本领域普通技术的水平内。用于原核宿主细胞的合适启动子包括但不限于噬菌体t7 rna聚合酶启动子;trp启动子;lac操纵子启动子;杂合启动子,例如,lac/tac杂合启动子、tac/trc杂合启动子、trp/lac启动子、t7/lac启动子;trc启动子;tac启动子等;arabad启动子;体内调节的启动子,如ssag启动子或相关启动子(参见,例如,美国专利公开号20040131637)、pagc启动子(pulkkinen and miller,j.bacteriol.(1991)173(1):86-93;alpuche-aranda et al.,proc.natl.acad.sci.usa(1992)89(21):10079-83),nirb启动子(harborne et al.mol.micro.(1992)6:2805-2813)等(参见,例如,dunstan et al.,infect.immun.(1999)67:5133-5141;mckelvie et al.,vaccine(2004)22:3243-3255;and chatfield et al.,biotechnol.(1992)10:888-892);σ70启动子,例如,共有σ70启动子(参见,例如,genbank登录号ax798980、ax798961和ax798183);稳定期(stationary phase)启动子,例如,dps启动子、spv启动子等;源自致病岛(pathogenicity island)spi-2的启动子(参见,例如,wo96/17951);acta启动子(参见,例如,shetron-rama et al.,infect.immun.(2002)70:1087-1096);rpsm启动子(参见,例如,valdivia and falkow mol.microbiol.(1996).22:367);tet启动子(参见,例如,hillen,w.and wissmann,a.(1989)in saenger,w.and heinemann,u.(eds),topics in molecular and structural biology,protein
‑‑
nucleic acid interaction.macmillan,london,uk,vol.10,pp.143-162);sp6启动子(参见,例如,melton et al.,nucl.acids res.(1984)12:7035);之类的。用于诸如大肠埃希氏菌(escherichia coli)的原核生物的合适的强启动子包括但不限于trc、tac、t5、t7和plambda。用于细菌宿主细胞的操纵子的非限制性实例包括乳糖启动子操纵子(laci阻抑蛋白在与乳糖接触时改变构象,从而防止lad阻抑蛋白与操纵子结合)、色氨酸启动子操纵子(当与色氨酸复合时),trpr阻抑蛋白具有结合操纵子的构象;在色氨酸不存在时,trpr阻抑蛋白具有不与操纵子结合的构象)、和tac启动子操纵子(参见,例如,deboer et al.,proc.natl.acad.sci.u.s.a.(1983)80:21-25)。
[0256]
合适的启动子的其他实例包括立即早期巨细胞病毒(cmv)启动子序列。该启动子序列是强组成型启动子序列,能够驱动与其可操作地连接的任何多核苷酸序列的高水平表达。也可以使用其他组成型启动子序列,包括但不限于猿病毒40(sv40)早期启动子、小鼠乳腺肿瘤病毒(mmtv)或人类免疫缺陷病毒(hiv)长末端重复序列(ltr)启动子、momulv启动子、禽类白血病病毒启动子、爱-巴病毒立即早期启动子、劳斯肉瘤病毒启动子、ef-1α启动子、以及人类基因启动子,如但不限于肌动蛋白启动子、肌球蛋白启动子、血红蛋白启动子和肌酸激酶启动子。此外,本发明不应限于使用组成型启动子。诱导型启动子也被认为是本发明的一部分。诱导型启动子的使用提供了一种分子开关,该分子开关能够在期望这种表达时打开与其可操作地连接的多核苷酸序列的表达,或者在不期望表达时关闭表达。诱导
型启动子的实例包括但不限于金属硫蛋白(metallothionine)启动子、糖皮质激素启动子、孕酮启动子和四环素启动子。
[0257]
在一些实施方式中,含有合适启动子的基因座或构建体或转基因通过诱导型系统的诱导被不可逆地开关(切换,switched)。用于诱导不可逆开关的合适系统是本领域公知的,例如,不可逆开关的诱导可以利用cre-lox介导的重组(参见,例如,fuhrmann-benzakein,et al.,proc.natl.acad.sci.usa(2000)28:e99,其公开内容通过引用并入本文)。本领域已知的重组酶、内切核酸酶、连接酶、重组位点等的任何合适组合可用于生成不可逆可开关启动子。本文其他地方描述的进行位点特异性重组的方法、机制和要求可应用于生成不可逆开关的启动子并且是本领域公知的,参见,例如,grindley et al.annual review of biochemistry(2006)567-605;和tropp,molecular biology(2012)(jones&bartlett publishers,sudbury,mass.),其公开内容通过引用并入本文。
[0258]
在一些实施方式中,本公开的核酸进一步包含编码car诱导型表达盒的核酸序列。在一个实施方式中,car诱导型表达盒用于产生在car信号传导时释放的转基因多肽产物。参见,例如,chmielewski and abken,expert opin.biol.ther.(2015)15(8):1145-1154;and abken,immunotherapy(2015)7(5):535-544。在一些实施方式中,本公开的核酸进一步包含编码细胞因子的核酸序列,其可操作地连接至t细胞活化响应启动子。在一些实施方式中,与t细胞活化响应启动子可操作连接的细胞因子存在于单独的核酸序列上。在一个实施方式中,细胞因子是il-12。
[0259]
本公开的核酸可以存在于表达载体和/或克隆载体内。表达载体可以包括选择标志物、复制起点和提供载体复制和/或维持的其他特征。合适的表达载体包括,例如,质粒、病毒载体等。本领域技术人员已知大量合适的载体和启动子;许多可商购用于生成主题重组构建体。以下载体作为实例提供,并且无论如何不应被解释为限制性:细菌的:pbs、phagescript、psix174、pbluescript sk、pbs ks、pnh8a、pnh16a、pnh18a、pnh46a(stratagene,la jolla,calif.,usa);ptrc99a、pkk223-3、pkk233-3、pdr540、和prit5(pharmacia,uppsala,sweden)。真核的:pwlneo、psv2cat、pog44、pxr1、psg(stratagene)psvk3、pbpv、pmsg和psvl(pharmacia)。
[0260]
表达载体通常具有位于启动子序列附近的方便的限制性位点,以提供编码异源蛋白质的核酸序列的插入。可以存在在表达宿主中可操作的选择标志物。合适的表达载体包括但不限于病毒载体(例如,基于牛痘病毒的病毒载体;脊髓灰质炎病毒;腺病毒(参见,例如,li et al.,invest.opthalmol.vis.sci.(1994)35:2543-2549;borras et al.,gene ther.(1999)6:515-524;li and davidson,proc.natl.acad.sci.usa(1995)92:7700-7704;sakamoto et al.,h.gene ther.(1999)5:1088-1097;wo 94/12649,wo 93/03769;wo 93/19191;wo 94/28938;wo 95/11984和wo 95/00655);腺伴随病毒(参见,例如,ali et al.,hum.gene ther.(1998)9:81-86,flannery et al.,proc.natl.acad.sci.usa(1997)94:6916-6921;bennett et al.,invest.opthalmol.vis.sci.(1997)38:2857-2863;jomary et al.,gene ther.(1997)4:683 690,rolling et al.,hum.gene ther.(1999)10:641-648;ali et al.,hum.mol.genet.(1996)5:591-594;srivastava in wo 93/09239,samulski et al.,j.vir.(1989)63:3822-3828;mendelson et al.,virol.(1988)166:154-165;和flotte et al.,proc.natl.acad.sci.usa(1993)90:10613-10617);sv40;
单纯疱疹病毒;人类免疫缺陷病毒(参见,例如,miyoshi et al.,proc.natl.acad.sci.usa(1997)94:10319-23;takahashi et al.,j.virol.(1999)73:7812-7816);逆转录病毒载体(例如,鼠白血病病毒、脾坏死病毒,以及衍生自逆转录病毒的载体,如劳斯肉瘤病毒、harvey肉瘤病毒、禽类白血病病毒、人类免疫缺陷病毒、骨髓增殖性肉瘤病毒和乳腺肿瘤病毒);之类的。
[0261]
适用的额外的表达载体是例如但不限于慢病毒载体、γ逆转录病毒载体、泡沫病毒载体、腺伴随病毒载体、腺病毒载体、痘病毒载体、疱疹病毒载体、工程杂合病毒载体、转座子介导的载体等。病毒载体技术在本领域中是公知的,并且描述于,例如,sambrook et al.,2012,molecular cloning:a laboratory manual,volumes 1-4,cold spring harbor press,ny)和其他病毒学和分子生物学手册。可用作载体的病毒包括但不限于逆转录病毒、腺病毒、腺伴随病毒、疱疹病毒和慢病毒。
[0262]
一般而言,合适的载体包含在至少一种生物体中具有功能的复制起点、启动子序列、方便的限制性内切核酸酶位点和一种或多种选择标志物,(例如,wo 01/96584;wo 01/29058;和美国专利号6,326,193)。
[0263]
在一些实施方式中,表达载体(例如,慢病毒载体)可用于将car引入免疫细胞或其前体(例如,t细胞)中。因此,本发明的表达载体(例如,慢病毒载体)可以包含编码car的核酸。在一些实施方式中,表达载体(例如,慢病毒载体)将包含将有助于其中编码的car的功能性表达的附加元件。在一些实施方式中,包含编码car的核酸的表达载体进一步包含哺乳动物启动子。在一个实施方式中,载体进一步包含延伸因子-1-α启动子(ef-1α启动子)。使用ef-1α启动子可以提高下游转基因(例如,car编码核酸序列)的表达效率。生理启动子(例如,ef-1α启动子)可能不太可能诱导整合介导的基因毒性,并可能消除(abrogate)逆转录病毒载体转化干细胞的能力。适用于载体(例如,慢病毒载体)的其他生理启动子是本领域技术人员已知的并且可以并入本发明的载体中。在一些实施方式中,载体(例如,慢病毒载体)还包含可以提高滴度和基因表达的非必需的顺式作用序列。非必需的顺式作用序列的一个非限制性实例是中央多聚嘌呤束(central polypurine tract)和中央终止序列(cppt/cts),其对于有效的逆转录和核输入是重要的。其他非必需的顺式作用序列是本领域技术人员已知的并且可以并入本发明的载体(例如,慢病毒载体)中。在一些实施方式中,载体还包含转录后调节元件。转录后调节元件可以改善rna翻译、改善转基因表达和稳定rna转录物。转录后调节元件的一个实例是土拨鼠肝炎病毒转录后调节元件(wpre)。因此,在一些实施方式中,用于本发明的载体还包含wpre序列。各种转录后调节元件是本领域技术人员已知的并且可以并入本发明的载体(例如,慢病毒载体)中。本发明的载体还可以包含额外的元件,如用于rna转运的rev响应元件(rre)、包装序列、和5'和3'长末端重复序列(ltr)。术语“长末端重复序列”或“ltr”是指位于逆转录病毒dna末端的碱基对结构域,其包括u3、r和u5区。ltr通常提供逆转录病毒基因表达(例如,基因转录物的促进、起始和多聚腺苷酸化)和病毒复制所需的功能。在一个实施方式中,本发明的载体(例如,慢病毒载体)包括3'u3缺失的ltr。因此,本发明的载体(例如,慢病毒载体)可包含本文所述元件的任何组合以增强转基因功能性表达的效率。例如,本发明的载体(例如,慢病毒载体)除了编码car的核酸外,还可以包含wpre序列、cppt序列、rre序列、5'ltr、3'u3缺失的ltr'。
[0264]
本发明的载体可以是自失活载体。如本文所用,术语“自失活载体”是指其中3'ltr
增强子启动子区(u3区)已被修饰(例如,通过缺失或取代)的载体。自失活载体可以防止病毒转录超过第一轮病毒复制。因此,自失活载体可能只能够感染一次,然后整合到宿主基因组(例如,哺乳动物基因组)中,并且不能进一步传播。因此,自失活载体可以大大降低生成具有复制能力的病毒的风险。
[0265]
在一些实施方式中,本发明的核酸可以是rna,例如,体外合成的rna。rna的体外合成方法是本领域技术人员已知的;任何已知方法可用于合成包含编码本公开的car的序列的rna。将rna引入宿主细胞中的方法是本领域已知的。参见,例如,zhao et al.cancer res.(2010)15:9053。将包含编码本公开的car的核苷酸序列的rna引入宿主细胞中可以在体外、离体或体内进行。例如,宿主细胞(例如,nk细胞、细胞毒性t淋巴细胞等)可以在体外或离体用包含编码本公开的car的核苷酸序列的rna进行电穿孔。
[0266]
为了评估多肽或其部分的表达,待引入细胞中的表达载体还可以含有选择标志物基因或报告基因,或两者,以促进从试图通过病毒载体转染或感染的细胞群中鉴定和选择表达细胞。在一些实施方式中,选择标志物可以携带在一段单独的dna上并用于共转染程序。选择标志物和报告基因的两侧都可以有适当的调节序列,以使其能够在宿主细胞中表达。有用的选择标志物包括但不限于抗生素抗性基因。
[0267]
报告基因用于鉴定潜在地转染的细胞和评价调节序列的功能性。一般而言,报告基因是不存在于受体生物体或组织中或不由受体生物体或组织表达的基因,并且其编码多肽,该多肽的表达通过一些容易检测的特性(例如,酶活性)来证明。在已经将dna引入受体细胞后的合适时间评估报告基因的表达。合适的报道基因可以包括但不限于编码荧光素酶、β-半乳糖苷酶、氯霉素乙酰转移酶、分泌型碱性磷酸酶或绿色荧光蛋白基因的基因(例如,ui-tei et al.,2000febs letters 479:79-82)。
[0268]
在一些实施方式中,本公开的核酸被提供用于例如在哺乳动物细胞中产生如本文所述的car。在一些实施方式中,本公开的核酸提供了car编码核酸的扩增。
[0269]
d.修饰免疫细胞
[0270]
本发明提供了修饰的免疫细胞或其前体(例如,t细胞),其包含能够结合psca(例如人psca)的嵌合抗原受体(car)。还提供了修饰的免疫细胞或其前体,其包含双特异性car(例如psca和psma)、具有显性负性受体(例如,tgfbrdn)的psca car、具有开关受体(例如,pd1/cd28或tgfbr/il12r)的psca car、以及与双特异性抗体(例如,pd-l1/cd28)组合的psca car。本发明还包括修饰的免疫细胞或其前体,其包含本文公开的任何核酸或本文公开的任何载体。
[0271]
一方面,本发明包括修饰的免疫细胞或其前体细胞,其包含car,car包含能够结合psca的抗原结合结构域、跨膜结构域和胞内结构域。
[0272]
在某些示例性实施方式中,抗原结合结构域包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdr1包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6)。
[0273]
在另一个方面,本公开提供了修饰的免疫细胞或其前体细胞,其包含能够结合前
列腺干细胞抗原(psca)的嵌合抗原受体(car),嵌合抗原受体(car)包含抗原结合结构域、跨膜结构域和胞内结构域,其中抗原结合结构域包含:重链可变区,其包含与seq id no:7至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及轻链可变区,其包含与seq id no:8至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0274]
在另一个方面,本公开提供了修饰的免疫细胞或其前体细胞,其包含能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car),包含与seq id no:9至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0275]
在某些示例性实施方式中,跨膜结构域包含cd8α的跨膜结构域。
[0276]
在某些示例性实施方式中,胞内结构域包含共刺激信号传导结构域和胞内信号传导结构域。在某些示例性实施方式中,共刺激信号传导结构域包含4-1bb的共刺激结构域。在某些示例性实施方式中,共刺激信号传导结构域包含cd28的共刺激结构域。在某些示例性实施方式中,共刺激信号传导结构域包含icos的共刺激结构域。在某些示例性实施方式中,共刺激信号传导结构域包含icos(ymnm)的共刺激结构域。在某些示例性实施方式中,胞内信号传导结构域包含cd3ζ或其变体的胞内结构域。
[0277]
在另一个方面,本公开提供了修饰的免疫细胞或其前体细胞,其包含能够结合前列腺干细胞抗原(psca)的嵌合抗原受体(car),包含与seq id no:21、23、25或27至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0278]
在某些示例性实施方式中,修饰的细胞还包含psma-car,其中psma-car包含抗原结合结构域、跨膜结构域和胞内结构域。
[0279]
在一个方面,本发明包括修饰的免疫细胞或其前体细胞,其包含双特异性嵌合抗原受体(car),该双特异性嵌合抗原受体(car)包含胞外结构域,该胞外结构域包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域和能够结合前列腺特异性膜抗原(psma)的抗原结合结构域。
[0280]
在某些实施方式中,双特异性car的胞外结构域包含能够结合psca的抗原结合结构域,该抗原结合结构域包含:第一重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列dyyih(seq id no:id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及第一轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdrl包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6)。胞外结构域还包含能够结合psma的抗原结合结构域,其包含:包含三个重链互补决定区(hcdr)的第二重链可变区,其中hcdr1包含氨基酸序列snwig(seq id no:28),hcdr2包含氨基酸序列iiypgdsdtryspsfqg(seq id no:29),并且hcdr3包含氨基酸序列qtgflwsfdl(seq id no:30);以及包含三个轻链互补决定区(lcdr)的第二轻链可变区,其中lcdr1包含氨基酸序列rasqdissala(seq id no:31),lcdr2包含氨基酸序列dassles(seq id no:32),并且lcdr3包含氨基酸序列qqfnsyplt(seq id no:33)。
[0281]
在某些实施方式中,胞外结构域包括:能够结合psca的抗原结合结构域,其包含:第一重链可变区,包含与seq id no:7至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第一轻链可变区,包含与seq id no:8至少80%、85%、90%、
95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或能够结合psma的抗原结合结构域,其包含:第二重链可变区,其包含与seq id no:34至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二轻链可变区,其包含与seq id no:35至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0282]
在某些实施方式中,双特异性car的胞外结构域包括:能够结合psca的抗原结合结构域,其包含:包含三个重链互补决定区(hcdr)的第一重链可变区,其中hcdr1包含氨基酸序列dyyih(seq id no:id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及包含三个轻链互补决定区(lcdr)的第一轻链可变区,其中lcdrl包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6);和/或能够结合psma的抗原结合结构域,其包含:包含三个重链互补决定区(hcdr)的第二重链可变区,其中hcdr1包含氨基酸序列eytih(seq id no:68),hcdr2包含氨基酸序列ninpnnggttynqkfed(seq id no:69),并且hcdr3包含氨基酸序列gwnfdy(seq id no:70);以及包含三个轻链互补决定区(lcdr)的第二轻链可变区,其中lcdrl包含氨基酸序列kasqdvgtavd(seq id no:71),lcdr2包含氨基酸序列wastrht(seq id no:72),并且lcdr3包含氨基酸序列qqynsyplt(seq id no:73)。
[0283]
在某些实施方式中,双特异性car的胞外结构域包含:能够结合psca的抗原结合结构域,其包含:第一重链可变区,包含与seq id no:7至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第一轻链可变区,包含与seq id no:8至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或能够结合psma的抗原结合结构域,其包含:第二重链可变区,包含与seq id no:75至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二轻链可变区,包含与seq id no:77至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0284]
在某些示例性实施方式中,双特异性car能够结合人psca。在某些示例性实施方式中,双特异性car能够结合人psma。在某些示例性实施方式中,双特异性car能够结合人psca和人psma。
[0285]
在另一个方面,本发明包括修饰的免疫细胞或其前体细胞,其包含第一car和第二car,第一car包含能够结合前列腺干细胞抗原(psca)的第一抗原结合结构域,第二car包含能够结合前列腺特异性膜抗原(psma)的第二抗原结合结构域,其中第一car和第二car各自包含跨膜结构域和胞内结构域。
[0286]
在某些示例性实施方式中,第一抗原结合结构域包含:第一重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及第一轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdrl包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6)。第二抗原结合结构域包含:第二重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列snwig(seq id no:28),hcdr2包含氨基酸序列iiypgdsdtryspsfqg(seq id no:29),并且hcdr3包含氨基酸序列qtgflwsfdl
(seq id no:30);以及第二轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdr1包含氨基酸序列rasqdissala(seq id no:31),lcdr2包含氨基酸序列dassles(seq id no:32),并且lcdr3包含氨基酸序列qqfnsyplt(seq id no:33)。
[0287]
在某些示例性实施方式中,第一重链可变区包含与seq id no:7至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或第一轻链可变区包含与seq id no:8至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或第二重链可变区包含与seq id no:34至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或第二轻链可变区包含与seq id no:35至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0288]
在某些示例性实施方式中,第一抗原结合结构域包含:第一重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列dyyih(seq id no:1),hcdr2包含氨基酸序列widpengdtefvpkfqg(seq id no:2),并且hcdr3包含氨基酸序列tggf(seq id no:3);以及第一轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdrl包含氨基酸序列sasssvrfihw(seq id no:4),lcdr2包含氨基酸序列dtsklas(seq id no:5),并且lcdr3包含氨基酸序列qqwssspft(seq id no:6)。第二抗原结合结构域包含:第二重链可变区,其包含三个重链互补决定区(hcdr),其中hcdr1包含氨基酸序列eytih(seq id no:68),hcdr2包含氨基酸序列ninpnnggttynqkfed(seq id no:69),并且hcdr3包含氨基酸序列gwnfdy(seq id no:70);以及第二轻链可变区,其包含三个轻链互补决定区(lcdr),其中lcdrl包含氨基酸序列kasqdvgtavd(seq id no:71),lcdr2包含氨基酸序列wastrht(seq id no:72),并且lcdr3包含氨基酸序列qqynsyplt(seq id no:73)。
[0289]
在某些示例性实施方式中,第一重链可变区包含与seq id no:7至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或第一轻链可变区包含与seq id no:8至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或第二重链可变区包含与seq id no:75至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;和/或第二轻链可变区包含与seq id no:77至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0290]
在某些示例性实施方式中,第一car和第二car各自包含选自以下的跨膜结构域:人工疏水序列和i型跨膜蛋白的跨膜结构域、t细胞受体的α、β或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、ox40(cd134)、4-1bb(cd137)、icos和cd154、或源自杀伤性免疫球蛋白样受体(kir)的跨膜结构域。在某些示例性实施方式中,第一car和第二car各自包含cd8α的跨膜结构域。
[0291]
在某些示例性实施方式中,第一car和第二car的胞内结构域各自包含共刺激信号传导结构域和胞内信号传导结构域。
[0292]
在某些示例性实施方式中,第一car和第二car的胞内结构域各自包含选自以下的蛋白质的共刺激结构域:tnfr超家族中的蛋白质、cd28、4-1bb(cd137)、ox40(cd134)、pd-1、cd7、light、cd83l、dap10、dap12、cd27、cd2、cd5、icam-1、lfa-1、lck、tnfr-i、tnfr-ii、fas、cd30、cd40、icos、nkg2c和b7-h3(cd276)或其变体、或源自杀伤性免疫球蛋白样受体(kir)的胞内结构域。在某些示例性实施方式中,第一car和第二car的胞内结构域各自包含4-1bb的共刺激结构域。
[0293]
在某些示例性实施方式中,第一car和第二car的胞内信号传导结构域各自包含选自以下的胞内结构域:人cd3ζ链(cd3ζ)的胞质信号传导结构域、fcγriii、fcsri、fc受体的细胞质尾区、带有胞质受体的基于免疫受体酪氨酸的活化基序(itam)、tcrζ、fcrγ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d,或其变体。在某些示例性实施方式中,第一car和第二car的胞内信号传导结构域各自包含cd3ζ或其变体的胞内结构域。
[0294]
在某些示例性实施方式中,第一car包含与seq id no:21至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,和/或第二car包含与seq id no:67、87、89、91、93、95或97至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0295]
在某些实施方式中,修饰的细胞还包含显性负性受体。在某些实施方式中,显性负性受体是与负信号相关的野生型蛋白质的截短变体。在某些示例性实施方式中,与负信号相关的野生型蛋白质的截短变体包含与seq id no:56至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0296]
在某些实施方式中,修饰的细胞还包含开关受体。在某些实施方式中,开关受体包含衍生自与负信号相关的第一开关多肽的第一结构域;以及衍生自与正信号相关的第二开关多肽的第二结构域。在某些示例性实施方式中,开关受体包含与seq id no:58、60或62至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0297]
因此,在某些实施方式中,本发明包括修饰的免疫细胞或其前体细胞,其包含car,car包含能够结合psca的抗原结合结构域、跨膜结构域和胞内结构域,其中细胞进一步包含显性负性受体(例如,tgfbrdn)。
[0298]
因此,在某些实施方式中,本发明包括修饰的免疫细胞或其前体细胞,其包含car,car包含能够结合psca的抗原结合结构域、跨膜结构域和胞内结构域,其中细胞进一步包含开关受体(例如,pd1/cd28开关受体)。
[0299]
还提供了修饰的免疫细胞或其前体细胞,包含能够结合前列腺干细胞抗原的car(psca-car)和双特异性抗体,其中car包含抗原结合结构域、跨膜结构域和胞内结构域,并且其中修饰的细胞分泌双特异性抗体。
[0300]
在某些实施方式中,修饰的细胞进一步包含双特异性抗体,其中细胞分泌双特异性抗体。在某些实施方式中,双特异性抗体包含与seq id no:64或66至少80%、85%、90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。
[0301]
在某些实施方式中,修饰的细胞是修饰的免疫细胞。在某些实施方式中,修饰的细胞是修饰的t细胞。在某些实施方式中,修饰的细胞是自体细胞。在某些实施方式中,修饰的细胞是从人类受试者获得的自体细胞。
[0302]
e.免疫细胞的来源
[0303]
在某些实施方式中,免疫细胞(例如t细胞)的来源从受试者获得用于离体操作。用于离体操作的免疫细胞来源还可以包括,例如,自体或异源供体血、脐带血或骨髓。例如,免疫细胞的来源可以来自待用本发明的经修饰免疫细胞治疗的受试者,例如,受试者的血液、受试者的脐带血或受试者的骨髓。受试者的非限制性实例包括人、狗、猫、小鼠、大鼠及其转基因物种。优选地,受试者是人。
[0304]
免疫细胞可以从多种来源获得,包括血液、外周血单核细胞、骨髓、淋巴结组织、脾
组织、脐带、淋巴或淋巴样器官。免疫细胞是免疫系统的细胞,如先天性或适应性免疫的细胞,例如骨髓细胞或淋巴样细胞,包括淋巴细胞,通常是t细胞和/或nk细胞。其他示例性细胞包括干细胞,如多能干细胞和多潜能干细胞,包括诱导型多潜能干细胞(ipsc)。在一些方面,细胞是人类细胞。关于待治疗的受试者,细胞可以是同种异体的和/或自体的。细胞通常是原代细胞,如直接从受试者分离和/或从受试者分离并冷冻的那些细胞。
[0305]
在某些实施方式中,免疫细胞是t细胞,例如,cd8 t细胞(例如,cd8 幼稚t细胞、中枢记忆t细胞或效应记忆t细胞)、cd4 t细胞、天然杀伤t细胞(nkt细胞)、调节性t细胞(treg)、干细胞记忆t细胞、淋巴样祖细胞、造血干细胞、天然杀伤细胞(nk细胞)或树突细胞。在一些实施方式中,细胞是单核细胞或粒细胞,例如,骨髓细胞、巨噬细胞、嗜中性粒细胞、树突细胞、肥大细胞、嗜酸性粒细胞和/或嗜碱性粒细胞。在一个实施方式中,靶细胞是诱导型多潜能干(ips)细胞或衍生自ips细胞的细胞,例如,从受试者生成的ips细胞,其被操纵以改变(例如,诱导突变)或操纵一种或多种靶基因的表达,并分化成,例如,t细胞,例如,cd8 t细胞(例如,cd8 幼稚t细胞、中枢记忆t细胞或效应记忆t细胞)、cd4 t细胞、干细胞记忆t细胞、淋巴样祖细胞或造血干细胞。
[0306]
在一些实施方式中,细胞包括一种或多种t细胞或其他细胞类型的亚类(subset),例如全t细胞群、cd4 细胞、cd8 细胞及其亚群,如由以下限定的那些:功能、活化状态、成熟度、分化、扩增、再循环、定位和/或持久性能力的潜力、抗原特异性、抗原受体的类型、特定器官或区室中的存在、标志物或细胞因子分泌谱、和/或分化程度。在t细胞和/或cd4 和/或cd8 t细胞的亚型和亚群中,有幼稚t(tn)细胞、效应t细胞(teff)、记忆t细胞及其亚型,如干细胞记忆t(tscm)、中枢记忆t(tcm)、效应记忆t(tem)或终末分化效应记忆t细胞、肿瘤浸润淋巴细胞(til)、幼t细胞(immature t cell)、成熟t细胞、辅助性t细胞、细胞毒性t细胞、黏膜相关性不变t(mait)细胞、天然存在和适应性调节性t(treg)细胞、辅助性t细胞,如th1细胞、th2细胞、th3细胞、th17细胞、th9细胞、th22细胞、滤泡辅助性t细胞、α/βt细胞和δ/γt细胞。在某些实施方式中,可以使用本领域可用的任何数量的t细胞系。
[0307]
在一些实施方式中,方法包括从受试者中分离免疫细胞,制备、处理、培养和/或工程改造它们。在一些实施方式中,工程化细胞的制备包括一个或多个培养和/或制备步骤。如所述的用于工程改造的细胞可以从样品中分离,样品如生物样品,例如,从受试者获得或源自受试者的样品。在一些实施方式中,从中分离细胞的受试者是具有疾病或状况或需要细胞疗法或将对其施用细胞疗法的受试者。在一些实施方式中,受试者是需要特定治疗干预的人,特定治疗干预如细胞被分离、处理和/或工程改造的过继细胞疗法。因此,在一些实施方式中,细胞是原代细胞,例如,原代人细胞。样品包括直接取自受试者的组织、流体和其他样品、以及来自一个或多个处理步骤的样品,步骤如分离、离心、基因工程(例如,用病毒载体转导)、洗涤和/或孵育。生物样品可以是直接从生物来源获得的样品或被处理的样品。生物样品包括但不限于体液、组织和器官样品,体液如血液、血浆、血清、脑脊液、滑液、尿液和汗液,组织和器官样品包括源自其的加工样品。
[0308]
在一些方面,从中获取或分离细胞的样品是血液或血液来源的样品,或者是或来源于单采(apheresis)或白细胞单采产品。示例性样品包括全血、外周血单核细胞(pbmc)、白细胞、骨髓、胸腺、组织活检、肿瘤、白血病、淋巴瘤、淋巴结、肠相关性淋巴样组织、粘膜相关性淋巴样组织、脾脏、其他淋巴组织、肝、肺、胃、肠、结肠、肾、胰、乳房、骨、前列腺、宫颈、
睾丸、卵巢、扁桃体或其他器官,和/或源自其的细胞。在细胞疗法(例如,过继细胞疗法)的背景下,样品包括来自自体和同种异体来源的样品。
[0309]
在一些实施方式中,细胞来源于细胞系,例如t细胞系。在一些实施方式中,细胞获自异种来源,例如获自小鼠、大鼠、非人灵长类、和猪。在一些实施方式中,细胞的分离包括一个或多个制备和/或基于非亲和力的细胞分离步骤。在一些实例中,在一种或多种试剂的存在下洗涤、离心和/或孵育细胞,例如,以去除不需要的组分、富集所期望的组分、裂解或去除对特定试剂敏感的细胞。在一些实施例中,细胞基于一种或多种特性如密度、粘附特性、尺寸、敏感性和/或对特定组分的抗性而被分离。
[0310]
在一些实施例中,来自受试者的循环血液的细胞例如通过单采或白细胞单采获得。在一些方面,样品含有淋巴细胞,包括t细胞、单核细胞、粒细胞、b细胞、其他有核白细胞、红细胞和/或血小板,并且在一些方面含有除红细胞和血小板以外的细胞。在一些实施方式中,洗涤从受试者收集的血细胞,例如,以去除血浆级分(fraction)并将细胞置于适当的缓冲液或培养基中用于后续处理步骤。在一些实施方式中,细胞用磷酸盐缓冲盐水(pbs)洗涤。在一些方面,洗涤步骤根据制造商的说明通过切向流过滤(tff)来完成。在一些实施方式中,细胞在洗涤后重新悬浮在多种生物相容性缓冲液中。在某些实施方式中,血细胞样品的组分被去除并且细胞直接重悬于培养基中。在一些实施方式中,方法包括基于密度的细胞分离方法,如通过裂解红细胞和通过percoll或ficoll梯度离心从外周血制备白细胞。
[0311]
在一个实施方式中,从个体的循环血液中获得免疫细胞是通过单采或白细胞单采获得的。单采产品通常含有淋巴细胞,包括t细胞、单核细胞、粒细胞、b细胞、其他有核白细胞、红细胞和血小板。可以洗涤通过单采收集的细胞以去除血浆部分并将细胞置于适当的缓冲液或培养基中,缓冲液或培养基如磷酸盐缓冲盐水(pbs),或者洗涤溶液缺乏钙并且可能缺乏镁,或者可能缺乏许多(如果不是全部的话)二价的阳离子,用于后续处理步骤。洗涤后,可将细胞重悬于多种生物相容性缓冲液中,如不例如含ca、不含mg的pbs中。或者,可以去除单采样品中不期望的组分,并将细胞直接重悬于培养基中。
[0312]
在一些实施方式中,分离方法包括基于一种或多种特定分子(如表面标志物,例如表面蛋白、胞内标志物或核酸)在细胞中的表达或存在来分离不同的细胞类型。在一些实施例中,可以使用任何已知的基于此类标志物的分离方法。在一些实施方式中,分离是基于亲和或免疫亲和的分离。例如,在一些方面,分离包括基于细胞的一种或多种标志物(通常是细胞表面标志物)的表达或表达水平来分离细胞和细胞群,例如,通过与特异性结合此类标志物的抗体或结合配偶体孵育,通常随后是洗涤步骤并将已与抗体或结合配偶体结合的细胞与未结合抗体或结合配偶体的那些细胞分离。
[0313]
此类分离步骤可以基于正选择,其中保留已结合试剂的细胞以供进一步使用,和/或负选择,其中保留未与抗体或结合配偶体结合的细胞。在一些实例中,两个部分都被保留以供进一步使用。在一些方面,当没有特异性鉴定异质群体中的细胞类型的抗体可用时,阴性选择可能特别有用,使得最好基于由除所期望群体之外的细胞表达的标志物来进行分离。分离不需要导致特定细胞群或表达特定标志物的细胞的100%富集或去除。例如,对特定类型的细胞(如表达标志物的细胞)的正选择或富集是指增加此类细胞的数量或百分比,但不需要导致完全不存在不表达标志物的细胞。同样,特定类型细胞(如表达标志物的细胞)的负选择、去除或耗尽(depletion)是指减少此类细胞的数量或百分比,但不需要导致
完全去除所有此类细胞。
[0314]
在一些实施例中,进行多轮分离步骤,其中来自一个步骤的正选择或负选择的级分经受另一分离步骤,如随后的正选择或负选择。在一些实例中,单个分离步骤可以同时耗尽表达多个标志物的细胞,如通过将细胞与多种抗体或结合配偶体一起孵育,每种抗体或结合配偶体对靶向负选择的标志物具有特异性。同样,通过将细胞与多种抗体或在各种细胞类型上表达的结合配偶体一起孵育,可以同时正选择多种细胞类型。
[0315]
在一些实施方式中,一种或多种t细胞群富集或耗尽对一种或多种特定标志物(如表面标志物)呈阳性(标志物 )或表达高水平(标志物
高
)或对一种或多种标志物呈阴性(标志物-)或表达相对低水平(标志物
低
)的细胞。例如,在一些方面,通过正选择或负选择技术分离t细胞的特定亚群,如阳性细胞或表达高水平的一种或多种表面标志物的细胞,例如,cd28 、cd62l 、ccr7 、cd27 、cd127 、cd4 、cd8 、cd45ra 和/或cd45ro t细胞。在某些情况下,此类标志物是在某些t细胞群(如非记忆细胞)上不存在或以相对较低水平表达,但在某些其他t细胞群(如记忆细胞)上存在或相对较高水平表达的标志物。在一个实施方式中,细胞(如cd8 细胞或t细胞,例如,cd3 细胞)针对cd45ro、ccr7、cd28、cd27、cd44、cd 127和/或cd62l阳性或表达高表面水平的cd45ro、ccr7、cd28、cd27、cd44、cd 127和/或cd62l的细胞进行富集(即正选)和/或耗尽(例如,负选择)cd45ra阳性或表达高表面水平的cd45ra的细胞。在一些实施方式中,细胞富集或耗尽cd122、cd95、cd25、cd27和/或il7-ra(cd 127)阳性或表达高表面水平的cd122、cd95、cd25、cd27和/或il7-ra(cd 127)的细胞。在一些实例中,cd8 t细胞富集对cd45ro阳性(或对cd45ra呈阴性)和对cd62l呈阳性的细胞。例如,可以使用cd3/cd28共轭磁珠(例如,m-450cd3/cd28t细胞扩增剂)正选择cd3 、cd28 t细胞。
[0316]
在一些实施方式中,通过对在非t细胞(如b细胞、单核细胞、或其他白细胞,如cd 14)上表达的标志物进行负选择,将t细胞从pbmc样品中分离。在一些方面,cd4 或cd8 选择步骤用于分离cd4 辅助细胞和cd8 细胞毒性t细胞。这样的cd4 和cd8 群体可以通过针对在一个或多个幼稚、记忆和/或效应t细胞亚群上表达或表达程度相对较高的标志物进行正选择或负选择而进一步分类成亚群。在一些实施方式中,cd8 细胞进一步富集或耗尽幼稚、中枢记忆、效应记忆和/或中枢记忆干细胞,如通过基于与相应亚群相关的表面抗原的正选择或负选择。在一些实施方式中,进行对于中枢记忆t(tcm)细胞的富集以提高功效,如改善施用后的长期存活、扩增和/或植入(engraftment),在一些方面,这在此类亚群中特别稳健(robust)。在一些实施方式中,组合富集tcm的cd8 t细胞和cd4 t细胞进一步增强功效。
[0317]
在一些实施方式中,记忆t细胞存在于cd8 外周血淋巴细胞的cd62l 和cd62l-亚群中。pbmc可以富集或耗尽cd62l-cd8 和/或cd62l cd8 级分,如使用抗cd8和抗cd62l抗体。在一些实施方式中,cd4 t细胞群和cd8 t细胞亚群,例如,富集中枢记忆(tcm)细胞的亚群。在一些实施方式中,对于中枢记忆t(tcm)细胞的富集基于cd45ro、cd62l、ccr7、cd28、cd3和/或cd 127的阳性或高表面表达;在一些方面,它基于对表达或高度表达cd45ra和/或粒酶b的细胞的负选择。在一些方面,通过耗尽表达cd4、cd 14、cd45ra的细胞以及阳性选择或富集表达cd62l的细胞来进行对富集tcm细胞的cd8 群体的分离。在一方面,对中枢记忆t(tcm)细胞的富集是从基于cd4表达选择的细胞的负级分开始进行的,其基于cd 14和cd45ra表达的负选择,以及基于cd62l的正选择来进行。这种选择在一些方面是同时进行
的,而在其他方面是按任一顺序连续地进行的。在一些方面,用于制备cd8 细胞群或亚群的相同的基于cd4表达的选择步骤也用于生成cd4 细胞群或亚群,使得来自基于cd4的分离的正级分和负级分两者保留并在方法的后续步骤中使用,任选地在一个或多个进一步的正或负选择步骤之后。
[0318]
通过鉴定具有细胞表面抗原的细胞群,将cd4 t辅助细胞分为幼稚细胞、中枢记忆细胞和效应细胞。cd4 淋巴细胞可以通过标准方法获得。在一些实施方式中,幼稚cd4 t淋巴细胞是cd45ro-、cd45ra 、cd62l 、cd4 t细胞。在一些实施方式中,中枢记忆cd4 细胞是cd62l 和cd45ro 。在一些实施方式中,效应cd4 细胞是cd62l-和cd45ro。在一个实例中,为了通过负选择富集cd4 细胞,单克隆抗体混合物典型地包括针对cd14、cd20、cd11b、cd16、hla-dr和cd8的抗体。在一些实施方式中,抗体或结合配偶体结合至固体支持物或基质,如磁珠或顺磁珠,以允许分离细胞以进行正和/或负选择。
[0319]
在一些实施方式中,在基因工程之前或与基因工程相关地孵育和/或培养细胞。孵育步骤可以包括培养、培育(cultivation)、刺激、活化和/或繁殖。在一些实施方式中,组合物或细胞在刺激条件或刺激剂存在下孵育。此类条件包括这样的条件,其设计用于诱导群体中细胞的增殖、扩增、活化和/或存活,以模拟抗原暴露、和/或致敏(prime)细胞用于基因工程,如用于引入重组抗原受体。条件可以包括特定介质、温度、氧含量、二氧化碳含量、时间、试剂中的一种或多种,例如,营养物、氨基酸、抗生素、离子和/或刺激因子,如细胞因子、趋化因子、抗原、结合配偶体、融合蛋白、重组可溶性受体、和任何其他设计以活化细胞的试剂。在一些实施方式中,刺激条件或试剂包括一种或多种试剂,例如,配体,其能够活化tcr复合物的胞内信号传导结构域。在一些方面,试剂开启或启动t细胞中的tcr/cd3胞内信号级联放大。这样的试剂可以包括例如结合到诸如珠子的固体支持物上的抗体、和/或一种或多种细胞因子,抗体如对tcr组分和/或共刺激受体例如,抗cd3、抗cd28具有特异性的抗体。任选地,扩增方法可以进一步包括向培养基中添加抗cd3和/或抗cd28抗体的步骤(例如,以至少约0.5ng/ml的浓度)。在一些实施方式中,刺激剂包括il-2和/或il-15,例如至少约10单位/ml的il-2浓度。
[0320]
在另一个实施方式中,通过裂解红细胞和耗尽单核细胞,例如通过percoll
tm
梯度离心,从外周血中分离t细胞。或者,可以从脐带中分离t细胞。在任何情况下,可以通过正或负选择技术进一步分离特定的t细胞亚群。
[0321]
如此分离的脐带血单核细胞可以去除表达某些抗原的细胞,包括但不限于cd34、cd8、cd14、cd19和cd56。这些细胞的耗尽可以使用分离的抗体、包含抗体的生物样品如腹水、与物理支持物结合的抗体、和联胞抗体来完成。
[0322]
通过负选择富集t细胞群可以使用针对负选择细胞独有的表面标志物的抗体组合来完成。优选的方法是经由负磁免疫粘附或流式细胞术的细胞分选和/或选择,其使用针对存在于负选择的细胞上的细胞表面标志物的单克隆抗体的混合物。例如,为了通过负选择富集cd4 细胞,单克隆抗体混合物典型地包括针对cd14、cd20、cd11b、cd16、hla-dr和cd8的抗体。
[0323]
为了通过正或负选择分离所期望的细胞群,可以改变细胞和表面(例如,诸如珠子的颗粒)的浓度。在某些实施方式中,可能期望显著降低其中珠子和细胞混合在一起的体积(即,增加细胞浓度),以确保细胞和珠子的最大接触。例如,在一个实施例中,使用20亿个细
胞/ml的浓度。在一个实施方式中,使用10亿个细胞/ml的浓度。在进一步的实施方式中,使用大于1亿个细胞/ml。在进一步的实施方式中,使用1000、1500、2000、2500、3000、3500、4000、4500或5000万个细胞/ml的细胞浓度。在又一个实施方式中,使用0.75、0.80、0.85、0.90、0.95或1亿个细胞/ml的细胞浓度。在进一步的实施方式中,可以使用1.25或1.5亿个细胞/ml的浓度。使用高浓度可导致增加细胞产量、细胞活化、和细胞扩增。
[0324]
t细胞也可以在洗涤步骤后冷冻,这不需要单核细胞去除步骤。虽然不希望受理论束缚,但冷冻和随后的解冻步骤通过去除细胞群中的粒细胞和在一定程度上去除单核细胞来提供了更均匀的产品。在去除血浆和血小板的洗涤步骤之后,可以将细胞悬浮在冷冻溶液中。虽然许多冷冻溶液和参数在本领域中是已知的并且将在该上下文中有用的,但在非限制性实例中,一种方法涉及使用含有20%dmso和8%人血清白蛋白的pbs,或其他合适的细胞冷冻介质。然后将细胞以每分钟1℃的速度冷冻到-80℃,并储存在液氮储罐的蒸气相中。可以使用其他受控冷冻方法以及在-20℃或液氮中立即进行的不受控冷冻。
[0325]
在一个实施方式中,t细胞包含在细胞群内,细胞群如外周血单核细胞、脐带血细胞、纯化的t细胞群和t细胞系。在另一个实施方式中,外周血单核细胞包含t细胞群。在又一个实施方式中,纯化的t细胞包含t细胞群。
[0326]
在某些实施方式中,t调节细胞(tregs)可以从样品中分离。样品可以包括但不限于脐带血或外周血。在某些实施方式中,tregs通过流式细胞术分选来分离。可以在分离之前通过本领域已知的任何方式对样品富集tregs。分离的treg可以在使用前冷藏和/或扩增。用于分离treg的方法在美国专利号:7,754,482、8,722,400和9,555,105以及美国专利申请号13/639,927中进行了描述,其全部内容并入本文。
[0327]
f.治疗方法
[0328]
本文所述的修饰免疫细胞(例如,t细胞)可以包含在用于免疫疗法的组合物中。该组合物可以包括药物组合物并且进一步包括药学上可接受的载体。可以施用治疗有效量的包含修饰t细胞的药物组合物。
[0329]
在一个方面,本发明包括治疗受试者的疾病或病况的方法,该方法包括向对其有需要的受试者施用有效量的本发明的修饰细胞(例如t细胞)。在另一方面,本发明包括一种治疗受试者的疾病或病况的方法,该方法包括向对其有需要的受试者施用药物组合物,该药物组合物包含有效量的本发明的修饰细胞(例如t细胞)。另一方面,本发明包括用于过继细胞转移治疗的方法,该方法包括向对其有需要的受试者施用有效量的本发明的修饰细胞(例如t细胞)。
[0330]
用于过继细胞治疗的免疫细胞的施用方法是已知的并且可以与所提供的方法和组合物结合使用。例如,过继t细胞治疗方法在例如授予gruenberg等人的美国专利申请公开号2003/0170238;授予rosenberg的美国专利号4,690,915;rosenberg(2011)nat rev clin oncol.8(10):577-85)中有所描述。参见,例如,themeli et al.(2013)nat biotechnol.31(10):928-933;tsukahara et al.(2013)biochem biophys res commun 438(1):84-9;davila et al.(2013)plos one 8(4):e61338。在一些实施方式中,细胞疗法,例如过继t细胞治疗是通过自体转移进行的,其中细胞是从将接受细胞疗法的受试者或者从来源于这种受试者的样品中分离和/或以其他方式制备的。因此,在一些方面,细胞来源于需要治疗的受试者,例如患者,并且在分离和处理之后将细胞施用于同一受试者。
[0331]
在一些实施方式中,细胞疗法,例如过继t细胞治疗,通过同种异体转移进行,其中细胞从除了将要接受或最终接受细胞疗法的受试者之外的受试者(例如,第一个受试者)中分离和/或以其他方式制备细胞。在这样的实施方式中,然后将细胞施用于相同物种的不同受试者,例如第二个受试者。在一些实施方式中,第一和第二受试者在遗传上是相同的。在一些实施方式中,第一和第二受试者在遗传上是相似的。在一些实施方式中,第二受试者表达与第一受试者相同的hla类或超型。
[0332]
在一些实施方式中,在施用细胞或含有细胞的组合物之前,受试者已经用靶向疾病或病况(例如,肿瘤)的治疗剂治疗。在一些方面,受试者对其他治疗剂是难治的或无反应的。在一些实施方式中,受试者患有持续性或复发性疾病,例如,在用另一种治疗干涉治疗后,另一种治疗干涉包括化学疗法、放射疗法和/或造血干细胞移植(hsct),例如,同种异体hsct。在一些实施方式中,尽管受试者已经对另一种疗法产生抗性,但施用有效地治疗受试者。
[0333]
在一些实施方式中,受试者对其他治疗剂有反应,并且用治疗剂的治疗减轻了疾病负担。在一些方面,受试者最初对治疗剂有反应,但随着时间的推移表现出疾病或病况的复发。在一些实施方式中,受试者没有复发。在一些这样的实施方式中,确定受试者处于复发风险中,如处于高复发风险中,因此预防性地施用细胞,例如,以降低复发的可能性或防止复发。在一些方面,受试者之前没有接受过用另一种治疗剂的治疗。
[0334]
在一些实施方式中,受试者患有持续性或复发性疾病,例如,在用另一种治疗干涉治疗后,另一种治疗干涉包括化学疗法、放射疗法和/或造血干细胞移植(hsct),例如,同种异体hsct。在一些实施方式中,尽管受试者已经对另一种疗法产生抗性,但施用有效地治疗受试者。
[0335]
本发明的修饰的免疫细胞可以施用于动物,优选哺乳动物,甚至更优选人,以治疗癌症。此外,本发明的细胞可用于治疗与癌症相关的任何病况,尤其是针对肿瘤细胞(一个或多个)的细胞介导的免疫反应,其中需要治疗或减轻疾病。待用本发明的修饰细胞或药物组合物治疗的癌症类型包括癌、母细胞瘤和肉瘤,以及某些白血病或淋巴恶性肿瘤,良性和恶性瘤,以及恶性肿瘤(malignancies),例如肉瘤、癌和黑素瘤。其他示例性癌症包括但不限于乳腺癌、前列腺癌、卵巢癌、宫颈癌、皮肤癌、胰腺癌、结肠直肠癌、肾癌、肝癌、脑癌、淋巴瘤、白血病、肺癌、甲状腺癌等。癌症可以是非实体瘤(如血液肿瘤)或实体瘤。还包括成人肿瘤/癌症和儿童肿瘤/癌症。在一个实施方式中,癌症是实体瘤或血液肿瘤。在一个实施方式中,癌症是癌。在一个实施方式中,癌症是肉瘤。在一个实施方式中,癌症是白血病。在一个实施方式中,癌症是实体瘤。
[0336]
实体瘤是组织的异常丸块,通常不包含囊肿或液体区域。实体瘤可以是良性的或恶性的。不同类型的实体瘤以形成它们的细胞类型命名(如肉瘤、癌、和淋巴瘤)。诸如肉瘤和癌的实体瘤的实例包括纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨肉瘤和其他肉瘤、滑膜瘤、间皮瘤、尤因肉瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、淋巴恶性肿瘤、胰腺癌、乳腺癌、肺癌、卵巢癌、前列腺癌、肝细胞癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、甲状腺髓样癌、甲状腺乳头状癌、嗜铬细胞瘤皮脂腺癌、乳头状癌、乳头状腺癌、髓样癌、支气管源性癌、肾细胞癌、肝脏肿瘤、胆管癌、绒毛膜癌、维尔姆斯瘤、宫颈癌、睾丸肿瘤、精原细胞瘤、膀胱癌、黑色素瘤和cns肿瘤(如胶质瘤(如脑干胶质瘤和混合胶质瘤)、胶质母细胞瘤(也称为多形
性胶质母细胞瘤)星形细胞瘤、cns淋巴瘤、生殖细胞瘤、髓母细胞瘤、神经鞘瘤颅咽管瘤(schwannoma craniopharyogioma)、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质瘤、脑膜瘤(menangioma)、神经母细胞瘤、视网膜母细胞瘤和脑转移瘤(brain metastases))。在某些实施方式中,癌症是星形细胞瘤。在某些实施方式中,癌症是高级别星形细胞瘤。在某些实施方式中,癌症是前列腺癌。在某些实施方式中,癌症是转移性去势抵抗性前列腺癌。
[0337]
可以通过本文公开的方法进行治疗的癌包括但不限于食管癌、肝细胞癌、基底细胞癌(皮肤癌的一种形式)、鳞状细胞癌(各种组织)、膀胱癌,包括移行细胞癌(膀胱的恶性新生物(neoplasm))、支气管癌、结肠癌、结直肠癌、胃癌、肺癌,包括小细胞癌和非小细胞肺癌、肾上腺皮质癌、甲状腺癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、肾细胞癌、原位导管癌或胆管癌、绒毛膜癌、精原细胞瘤、胚胎癌、维尔姆斯瘤、宫颈癌、子宫癌、睾丸癌、成骨癌、上皮癌和鼻咽癌。
[0338]
可以通过本文公开的方法进行治疗的肉瘤包括但不限于纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、脊索瘤、成骨肉瘤、骨肉瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤因肉瘤、平滑肌肉瘤、横纹肌肉瘤和其他软组织肉瘤。
[0339]
在某些示例性实施方式中,本发明的经修饰的免疫细胞用于治疗骨髓瘤或与骨髓瘤相关的病况。骨髓瘤或与其相关的病况的实例包括但不限于轻链骨髓瘤、非分泌性骨髓瘤、意义未定的单克隆丙种球蛋白病(mgus)、浆细胞瘤(例如,孤立性、多发性孤立性、髓外浆细胞瘤)、淀粉样变性和多发性骨髓瘤。在一个实施方式中,本公开的方法用于治疗多发性骨髓瘤。在一个实施方式中,本公开的方法用于治疗难治性骨髓瘤。在一个实施方式中,本公开的方法用于治疗复发性骨髓瘤。
[0340]
在某些示例性实施方式中,本发明的经修饰免疫的细胞用于治疗黑色素瘤或与黑色素瘤相关的病况。黑素瘤或与其相关的病况的实例包括但不限于表面扩散黑素瘤、结节型黑素瘤、恶性色斑型黑色素瘤、肢端色斑性黑色素瘤、无黑色素性黑素瘤或皮肤的黑素瘤(例如,皮肤、眼、外阴、阴道、直肠黑素瘤)。在一个实施例中,本公开的方法用于治疗皮肤黑色素瘤。在一个实施例中,本公开的方法用于治疗难治性黑色素瘤。在一个实施例中,本公开的方法用于治疗复发性黑素瘤。
[0341]
在其他示例性实施方式中,本发明的经修饰的免疫细胞用于治疗肉瘤或与肉瘤相关的状况。肉瘤或其相关状况的实例包括但不限于血管肉瘤、软骨肉瘤、尤因肉瘤、纤维肉瘤、胃肠道间质瘤、平滑肌肉瘤、脂肪肉瘤、恶性外周神经鞘瘤、骨肉瘤、多形性肉瘤、横纹肌肉瘤和滑膜肉瘤。在一个实施例中,本公开的方法用于治疗滑膜肉瘤。在一个实施方式中,本公开的方法用于治疗脂肪肉瘤,如粘液样/圆形细胞脂肪肉瘤、分化/去分化脂肪肉瘤和多形性脂肪肉瘤。在一个实施例中,本公开的方法用于治疗粘液样/圆形细胞脂肪肉瘤。在一个实施例中,本公开的方法用于治疗难治性肉瘤。在一个实施例中,本公开的方法用于治疗复发的肉瘤。
[0342]
对于接受治疗的受试者而言,待施用的本发明细胞可以是自体的。
[0343]
本发明的细胞的施用可以本领域技术人员已知的任何方便的方式进行。本发明的细胞可以通过气溶胶吸入、注射、摄取、输血、植入或移植施用于受试者。本文所述的组合物可经动脉、皮下、皮内、瘤内、结内、髓内、肌内、通过静脉内(i.v.)注射或腹膜内施用于患
者。在其他情况下,将本发明的细胞直接注射到受试者的炎症部位、受试者中的局部疾病部位、淋巴结、器官、肿瘤等。
[0344]
在一些实施方式中,细胞以期望的剂量施用,这在一些方面包括细胞或细胞类型(一个或多个)的期望的剂量或数量和/或期望的细胞类型比例。因此,在一些实施方式中,细胞的剂量基于细胞总数(或每公斤体重的数量)和个体群体或亚型的所期望的比例,如cd4 与cd8 的比例。在一些实施方式中,细胞的剂量基于个体群体或个体细胞类型中所期望的总细胞数(或每公斤体重的数量)。在一些实施方式中,剂量基于这些特征的组合,如所期望的总细胞数、所期望的比例和所需的个体群体中的总细胞数。
[0345]
在一些实施方式中,细胞群或细胞亚型,如cd8 和cd4 t细胞,以所期望的总细胞剂量(如所期望的t细胞剂量)的耐受差异或在其耐受差异内施用。在一些方面,期望的剂量是期望的细胞数或被使用的受试者的每单位体重的期望的细胞数,例如,细胞/kg。在一些方面,所期望的剂量等于或高于最小细胞数或每单位体重的最小细胞数。在一些方面,在以所期望剂量施用的总细胞中,个体群体或亚型以或接近所期望输出比例(如cd4 与cd8 比例)存在,例如在这种比例的某种容许差异或误差范围内。
[0346]
在一些实施方式中,以一种或多种个体细胞群或细胞亚型的所期望剂量(如所期望剂量的cd4 细胞和/或所期望剂量的cd8 细胞)的耐受差异或在其耐受差异内施用细胞。在一些方面,所期望剂量是所期望的亚型或群体的细胞数,或被施用细胞的受试者的每单位体重的所期望的此类细胞数,例如,细胞/kg。在一些方面,所期望剂量等于或高于群体或亚型的最小细胞数,或每单位体重的群体或亚型的最小细胞数。因此,在一些实施方式中,剂量基于所期望的总细胞的固定剂量和所期望比率,和/或基于单个亚型或亚群中的一种或多种(例如,每种)的所期望固定剂量。因此,在一些实施方式中,剂量基于t细胞的所期望的固定或最小剂量和cd4 与cd8 细胞的所期望的比率,和/或基于cd4 和/或cd8 细胞的所期望的固定或最小剂量。
[0347]
在某些实施方式中,细胞、或细胞的单个群体或亚型在以下数值的范围施用于受试者:为或约100万至约1000亿个细胞,如,100万至约500亿个细胞(例如,约500万个细胞、约2500万个细胞、约5亿个细胞、约10亿个细胞、约50亿个细胞、约200亿个细胞、约300亿个细胞、约400亿个细胞,或由上述值中的任意两个定义的范围),如约1000万至约1000亿个细胞(例如,约2000万个细胞、约3000万个细胞、约4000万个细胞、约6000万个细胞、约7000万个细胞、约8000万个细胞、约9000万个细胞、约100亿个细胞、约250亿个细胞、约500亿个细胞、约750亿个细胞、约900亿个细胞或由上述值中的任意两个定义的范围),并且在一些情况下,约1亿个细胞至约500亿个细胞(例如,约1.2亿个细胞,约2.5亿个细胞、约3.5亿细胞、约4.5亿细胞、约6.5亿细胞、约8亿细胞、约9亿细胞、约30亿细胞、约300亿细胞、约450亿细胞)或这些范围之间的任何值。
[0348]
在一些实施方式中,总细胞的剂量和/或单个细胞亚群的剂量在为或约1x105个细胞/kg至约1x10
11
个细胞/kg、104和为或约10
11
个细胞/千克(kg)体重之间的范围内,如在105和106个细胞/kg体重之间,例如,为或约1x 105个细胞/kg、1.5x 105个细胞/kg、2x 105个细胞/kg、或1x 106个细胞/kg体重。例如,在一些实施方式中,在以下某个误差范围或某个误差范围内施用细胞:为或约104和为或约109个t细胞/千克(kg)体重之间,如105至106个t细胞/kg体重之间,例如,为或约1
×
105个t细胞/kg、1.5
×
105个t细胞/kg、2
×
105个t细胞/kg
或1
×
106个t细胞/kg体重。在其他示例性实施方式中,用于本公开的方法的修饰细胞的合适剂量范围包括但不限于约1
×
105个细胞/kg至约1
×
106个细胞/kg、约1
×
106个细胞/kg至约1
×
107个细胞/kg、约1x107个细胞/kg至约1
×
108个细胞/kg、约1
×
108细胞/kg至约1
×
109个细胞/kg、约1
×
109个细胞/kg至约1
×
10
10
个细胞/kg、约1
×
10
10
个细胞/kg至约1
×
10
11
个细胞/kg。在一个示例性实施方式中,用于本公开方法的合适剂量是约1x108个细胞/kg。在一个示例性实施方式中,用于本公开的方法的合适剂量是约1
×
107个细胞/kg。在其他实施方式中,合适的剂量是约1
×
107个总细胞至约5
×
107个总细胞。在一些实施方式中,合适的剂量是约1
×
108个总细胞至约5
×
108个总细胞。在一些实施方式中,合适的剂量是约1.4
×
107个总细胞至约1.1
×
109个总细胞。在一个示例性实施方式中,用于本公开的方法的合适剂量是约7
×
109个总细胞。
[0349]
在一些实施方式中,在以下的某个误差范围或以下的某个误差范围内施用细胞:为或约104至为或约109个cd4
和/或cd8
细胞/千克(kg)体重之间,如105和106个cd4
和/或cd8
细胞/kg体重之间,例如,为或约1
×
105个cd4
和/或cd8
细胞/kg、1.5
×
105个cd4
和/或cd8
细胞/kg、2
×
105个cd4
和/或cd8
细胞/kg、或1
×
106个cd4
和/或cd8
细胞/kg体重之间。在一些实施方式中,在大于和/或至少以下的某个误差范围或大于和/或至少以下的某个误差范围内施用细胞:约1
×
106、约2.5
×
106、约5
×
106、约7.5
×
106或约9
×
106个cd4
细胞,和/或约1
×
106、约2.5
×
106、约5
×
106、约7.5
×
106、或约9
×
106个cd8 细胞,和/或约1
×
106、约2.5
×
106、约5
×
106、约7.5
×
106或约9
×
106个t细胞。在一些实施方式中,在以下的某个误差范围或以下的某个误差范围内施用细胞:约108和10
12
或约10
10
和10
11
个t细胞之间、约108和10
12
或约10
10
和10
11
个cd4
细胞之间和/或约108和10
12
或约10
10
和10
11
个cd8
细胞之间。
[0350]
在一些实施方式中,在多个细胞群或亚型(如cd4 和cd8 细胞或亚型)的所期望的输出比例的在其耐受范围或其内施用细胞。在一些方面,所期望的比例可以是特定比例或可以是比例范围,例如,在一些实施方式中,所期望的比例(例如,cd4
与cd8
细胞的比例)在为或约5:1和为或约5:1之间(或大于约1:5且小于约5:1),在为或约1:3与约3:1之间(或大于约1:3且小于约3:1),如在为或约2:1和或为或约1:5之间(或大于约1:5且小于约2:1,如为或约5:1、4.5:1、4:1、3.5:1、3:1、2.5:1、2:1、1.9:1、1.8:1、1.7:1、1.6:1、1.5:1、1.4:1、1.3:1、1.2:1、1.1:1、1:1、1:1.1、1:1.2、1:1.3、1:1.4、1:1.5、1:1.6、1:1.7、1:1.8、1:1.9:1:2、1:2.5、1:3、1:3.5、1:4、1:4.5或1:5。在一些方面,耐受差异在所期望比例的约1%、约2%、约3%、约4%、约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%,包括介于这些范围之间的任何值。
[0351]
在一些实施方式中,以单次剂量或多次剂量向对其有需要的受试者施用一剂修饰细胞。在一些实施方式中,以多次剂量施用一剂修饰细胞,多次剂量例如每周一次或每7天一次、每2周一次或每14天一次、每3周一次或每21天一次、每4周一次或每28天一次。在一个示例性实施方式中,向对其有需要的受试者施用单次剂量的修饰细胞。在一个示例性实施方式中,通过快速静脉内输注将单次剂量的修饰细胞施用于对其有需要的受试者。
[0352]
对于疾病的预防或治疗,适当的剂量可能取决于待治疗的疾病类型、细胞或重组受体的类型、疾病的严重程度和病程、细胞是否用于预防或治疗目的而施用、以前的疗法、受试者的临床病史和对细胞的反应、以及主治医师的判断(discretion)。在一些实施方式
中,组合物和细胞在一次或经过一系列治疗合适地施用于受试者。
[0353]
在一些实施方式中,细胞作为联合治疗的一部分如与另一种治疗干涉同时或以任何顺序依次施用,另一种治疗干涉如抗体或工程改造的细胞或受体或试剂,如细胞毒剂或治疗剂。在一些实施方式中,细胞同时或以任何顺序依次与一种或多种另外的治疗剂共同施用或与另一种治疗干涉结合施用。在一些情况下,细胞与另一种疗法在时间上足够接近地共同施用,使得细胞群增强一种或多种另外的治疗剂的效果,或反之亦然。在一些实施方式中,在一种或多种另外的治疗剂之前施用细胞。在一些实施方式中,在一种或多种另外的治疗剂之后施用细胞。在一些实施方式中,一种或多种另外的试剂包括细胞因子,如il-2,例如以增强持久性。在一些实施方式中,方法包括化学治疗剂的施用。
[0354]
在某些实施方式中,本发明的修饰的细胞(例如,包含car的修饰的细胞)可以与免疫检查点的抑制剂组合施用于受试者。免疫检查点的实例包括但不限于ctla-4、pd-1和tim-3。抗体可用于抑制免疫检查点(例如,抗pd1、抗ctla-4或抗tim-3抗体)。例如,修饰细胞可以与靶向例如pd-1(程序性死亡1蛋白)抗体或抗体片段组合施用。抗pd-1抗体的实例包括但不限于pembrolizumab(以前的lambrolizumab,也称为mk-3475)和nivolumab(bms-936558、mdx-1106、ono-4538、)或其抗原结合片段。在某些实施方式中,修饰细胞可以与抗pd-l1抗体或其抗原结合片段组合施用。抗pd-l1抗体的实例包括但不限于bms-936559、mpdl3280a(atezolizumab)和medi4736(durvalumab,imfinzi)。在某些实施方式中,修饰细胞可以与抗ctla-4抗体或其抗原结合片段组合施用。抗ctla-4抗体的实例包括但不限于易普利姆玛(ipilimumab)(商品名yervoy)。也可以使用其他类型的免疫检查点调节剂,包括但不限于小分子、sirna、mirna和crispr系统。免疫检查点调节剂可以在包含car的修饰细胞之前、之后或与其同时施用。在某些实施方式中,包含免疫检查点调节剂的联合治疗可以增加包含本发明的修饰细胞的疗法的治疗功效。
[0355]
在施用细胞后,在一些实施方式中,例如,通过许多已知方法中的任一种测量工程改造的细胞群的生物活性。评估的参数包括工程改造的或天然的t细胞或其他免疫细胞与抗原的特异性结合,例如在体内通过成像,或例如离体通过elisa或流式细胞术。在某些实施方式中,工程改造的细胞破坏靶细胞的能力可以使用本领域已知的任何合适的方法来测量,任何合适的方法如在例如kochenderfer et al.,j.immunotherapy,32(7):689-702(2009)和herman et al.j.immunological methods,285(1):25-40(2004)。在某些实施方式中,细胞的生物活性通过测定一种或多种细胞因子如cd 107a、ifnγ、il-2和tnf的表达和/或分泌来测量。在一些方面,生物活性通过评估临床结果,如肿瘤负担或负荷的减少来测量。
[0356]
在某些实施方式中,向受试者提供次级治疗。次级治疗包括但不限于化疗、放疗、手术和药物治疗。
[0357]
在一些实施方式中,可以在car t细胞疗法之前对受试者施用条件反射疗法。在一些实施方式中,条件反射疗法包括向受试者施用有效量的环磷酰胺。在一些实施方式中,条件反射疗法包括向受试者施用有效量的氟达拉滨。在优选的实施方式中,条件反射疗法包括向受试者施用有效量的环磷酰胺和氟达拉滨的组合。在car t细胞疗法之前施用条件反射疗法可增加car t细胞疗法的功效。在美国专利号9,855,298中描述了调节患者进行t细
胞治疗的方法,该专利通过引用以其整体并入本文。
[0358]
在一些实施方式中,本公开的特定剂量方案包括在施用修饰t细胞之前的淋巴清除步骤。在一个示例性实施方式中,淋巴清除步骤包括施用环磷酰胺和/或氟达拉滨。
[0359]
在一些实施方式中,淋巴清除步骤包括以约200mg/m2/天和约2000mg/m2/天之间(例如,200mg/m2/天、300mg/m2/天或500mg/m2/天)的剂量施用环磷酰胺。在一个示例性实施方式中,环磷酰胺的剂量为约300mg/m2/天。在一些实施方式中,淋巴清除步骤包括以约20mg/m2/天和约900mg/m2/天之间(例如,20mg/m2/天、25mg/m2/天、30mg/m2/天、或60mg/m2/天)的剂量施用氟达拉滨。在一个示例性实施方式中,氟达拉滨的剂量为约30mg/m2/天。
[0360]
在一些实施方式中,淋巴清除步骤包括以约200mg/m2/天和约2000mg/m2/天之间(例如,200mg/m2/天、300mg/m2/天或500mg/m2/天)的剂量施用环磷酰胺和约20mg/m2/天和约900mg/m2/天之间(例如,20mg/m2/天、25mg/m2/天、30mg/m2/天、或60mg/m2/天)的剂量施用氟达拉滨。在一个示例性实施方式中,淋巴清除步骤包括以约300mg/m2/天的剂量施用环磷酰胺和以约30mg/m2/天的剂量施用氟达拉滨。
[0361]
在一个示例性的实施方式中,环磷酰胺的剂量是300mg/m2/天持续(over)三天,氟达拉滨的剂量是30mg/m2/天持续三天。
[0362]
相对于第0天的t细胞(例如,car-t、tcr-t、修饰t细胞等)输注,可以在第-6至-4天安排淋巴清除化疗的给药。
[0363]
在一个示例性实施方式中,对于患有癌症的受试者,受试者在施用修饰t细胞前3天通过静脉内输注接受包括300mg/m2的环磷酰胺的淋巴清除化疗。在一个示例性的实施方式中,对于患有癌症的受试者,受试者在施用修饰t细胞前3天通过静脉内输注接受包括300mg/m2的环磷酰胺的淋巴清除化疗。
[0364]
在一个示例性实施方式中,对于患有癌症的受试者,该受试者以约20mg/m2/天和约900mg/m2/天之间(例如,20mg/m2/天、25mg/m2/天、30mg/m2/天或60mg/m2/天)的剂量接受包括氟达拉滨的淋巴清除化疗。)在一个示例性的实施方式中,对于患有癌症的受试者,该受试者以30mg/m2的剂量接受包括氟达拉滨在内的淋巴清除化疗3天。
[0365]
在一个示例性实施方式中,对于患有癌症的受试者,该受试者以包括约200mg/m2/天和约2000mg/m2/天之间(例如,200mg/m2/天、300mg/m2/天、或500mg/m2/天)的剂量的环磷酰胺,和约20mg/m2/天和约900mg/m2/天之间(例如,20mg/m2/天,25mg/m2/天、30mg/m2/天或60mg/m2/天)的剂量的氟达拉滨的接受淋巴清除化疗。在一个示例性实施方式中,对于患有癌症的受试者,受试者接受淋巴清除化疗3天,淋巴清除化疗包括约300mg/m2/天的剂量的环磷酰胺和30mg/m2的剂量的氟达拉滨。
[0366]
本发明的细胞可以按剂量和途径施用,并且有时以适当的临床前和临床实验和试验来确定。可以以这些范围内的剂量多次施用细胞组合物。本发明的细胞的施用可以与本领域技术人员确定的可用于治疗所期望疾病或病况的其他方法组合。
[0367]
本领域已知,输注car t细胞后的不良作用之一是免疫活化的开始,称为细胞因子释放综合征(crs)。crs是导致炎症细胞因子升高的免疫活化。crs是一种已知的靶向毒性,其发展可能与功效相关。临床和实验室测量范围从轻度crs(全身症状和/或2级器官毒性)到严重crs(scrs;≥3级的器官毒性、积极的临床干涉和/或可能危及生命)。临床特征包括:高烧、不适、疲劳、肌痛、恶心、厌食症、心动过速/低血压、毛细血管渗漏、心功能不良、肾功
能不良、肝功能衰竭、和弥散性血管内凝血。包括干扰素-γ、粒细胞巨噬细胞集落刺激因子、il-10和il-6的细胞因子的显著升高已在car t细胞输注后显示。一个crs特征(signature)是细胞因子的升高,细胞因子包括il-6(严重升高)、ifn-γ、tnf-α(中度)和il-2(轻度)。还已观察到包括铁蛋白和c反应蛋白(crp)的临床可用炎症标志物的升高与crs综合征相关。crs的存在通常与过继转移细胞的扩增和进行性免疫活化相关。已经证明,crs的严重程度取决于输注时的疾病负担,因为肿瘤负担高的患者会经历更多的scrs。
[0368]
因此,本发明在crs诊断后提供了适当的crs管理策略,以缓和不受控制的炎症的生理症状,而不会减弱(dampening)工程改造的细胞(例如,car t细胞)的抗肿瘤功效。crs管理策略在本领域中是已知的。例如,可以施用全身性皮质类固醇以快速逆转scrs的症状(例如,3级crs),而不会影响(compromising)初始抗肿瘤反应。
[0369]
在一些实施方式中,可以施用抗il-6r抗体。抗il-6r抗体的一个实例是美国食品药品监督管理局(food and drug administration)批准的单克隆抗体tocilizumab,也称为atlizumab(以actemra或roactemra销售)。tocilizumab是一种针对白细胞介素-6受体(il-6r)的人源化单克隆抗体。tocilizumab的施用已证明了crs的几乎立即逆转。
[0370]
crs通常基于观察到的综合征的严重程度进行管理,并由此量身定制干涉。crs管理决策可能基于临床体征和症状以及对干涉的反应,而不仅仅只是实验室值。
[0371]
轻度至中度病例通常根据需要用液体疗法、非甾体抗炎药(nsaid)和抗组胺药进行症状管理,以充分缓解症状。更严重的病例包括有任何程度的血流动力学不稳定的患者;对于任何血流动力学不稳定,推荐施用tocilizumab。crs的第一线管理可以是tocilizumab,在一些实施方式中,以8mg/kg iv的标记剂量持续60分钟(不超过800mg/剂量);tocilizumab可重复q8小时。如果对第一剂tocilizumab的反应次优,可以考虑额外剂量的tocilizumab。tocilizumab可以单独施用或与皮质类固醇疗法联合施用。患有持续或进行性crs症状、12-18小时内临床改善不足或对tocilizumab反应不佳的患者,可以用高剂量皮质类固醇疗法治疗,一般为氢化可的松100mg iv或甲基强的松龙1-2mg/kg。在患有更严重的血流动力学不稳定或更严重的呼吸系统症状的患者中,可在crs病程早期向患者施用高剂量皮质类固醇疗法。crs管理指南可能基于已发布的标准(lee et al.(2019)biol blood marrow transplant,doi.org/10.1016/j.bbmt.2018.12.758;neelapu et al.(2018)nat rev clin oncology,15:47;teachey et al.(2016)cancer discov,6(6):664-679)。
[0372]
在用car-t疗法治疗的患者中观察到与巨噬细胞活化综合征(mas)或噬红细胞性淋巴组织细胞增生症(hlh)一致的特征(henter,2007),与crs的临床表现一致。mas似乎是对由crs发生的免疫活化的反应,因此应被视为crs的表现。mas类似于hlh(也是对免疫刺激的反应)。mas的临床综合征的特征在于高级别不缓解发热(non-remitting fever)、影响三个谱系中至少两个谱系的血细胞减少和肝脾大。它与高血清铁蛋白、可溶性白介素-2受体和甘油三酯以及循环天然杀伤(nk)活性降低有关联。
[0373]
本发明的包含car的修饰的免疫细胞可用于如本文所述的治疗的方法中。在一个方面,本发明包括一种在对其有需要的受试者中治疗癌症的方法,包括向受试者施用本文公开的修饰的免疫细胞或前体细胞中的任何一种。本发明的又一方面包括在对其有需要的受试者中治疗癌症的方法,包括向受试者施用由本文公开的任何一种方法产生的修饰的免
疫细胞或前体细胞。
[0374]
本发明的一个方面提供了在对其有需要的受试者中治疗前列腺癌的方法,包括向受试者施用有效量的修饰的t细胞,该修饰t细胞包含能够结合前列腺干细胞抗原的嵌合抗原受体(car)(psca-car)。
[0375]
在另一个方面,本发明提供了一种在对其有需要的受试者中治疗前列腺癌的方法,包括向受试者施用有效量的修饰的t细胞,该修饰的t细胞包含能够结合前列腺干细胞抗原的第一嵌合抗原受体(car)(psca-car)和能够结合前列腺特异性膜抗原的第二嵌合抗原受体(car)(psma-car),其中第一car和第二car各自包含抗原结合结构域、跨膜结构域和胞内结构域。
[0376]
本发明的另一个方面提供了一种在对其有需要的受试者中治疗前列腺癌的方法,包括向受试者施用有效量的修饰的t细胞,该修饰的t细胞包含双特异性嵌合抗原受体(car),该双特异性嵌合抗原受体(car)包含胞外结构域,该胞外结构域包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域和能够结合前列腺特异性膜抗原(psma)的抗原结合结构域、跨膜结构域和胞内结构域。
[0377]
本发明的另一方面提供了在对其有需要的受试者中治疗前列腺癌的方法,包括向受试者施用有效量的本文所考虑的任何修饰的t细胞。
[0378]
又一个方面包括一种在对其有需要的受试者中治疗转移性去势抵抗性前列腺癌的方法,包括向受试者施用有效量的修饰的t细胞,该修饰的t细胞包含能够结合前列腺干细胞抗原的第一嵌合抗原受体(car)(psca-car)和能够结合前列腺特异性膜抗原的第二嵌合抗原受体(car)(psma-car),其中第一car和第二car各自包含抗原结合结构域、跨膜结构域和胞内结构域。
[0379]
还提供了一种在对其有需要的受试者中治疗转移性去势抵抗性前列腺癌的方法,包括向受试者施用有效量的修饰的t细胞,该修饰的t细胞包含双特异性嵌合抗原受体(car),该双特异性嵌合抗原受体(car)包含胞外结构域,胞外结构域包含能够结合前列腺干细胞抗原(psca)的抗原结合结构域和能够结合前列腺特异性膜抗原(psma)的抗原结合结构域、跨膜结构域和胞内结构域。
[0380]
在另一个方面,本发明提供了治疗对其有需要的受试者中的转移性去势抵抗性前列腺癌的方法,包括向受试者施用有效量的修饰的t细胞,该修饰的t细胞包含能够结合前列腺干细胞抗原的嵌合抗原受体(car)(psca-car)和显性负性受体。
[0381]
在另一个方面,本发明提供了治疗对其有需要的受试者中的转移性去势抵抗性前列腺癌的方法,包括向受试者施用有效量的修饰的t细胞,该修饰的t细胞包含能够结合前列腺干细胞抗原的嵌合抗原受体(car)(psca-car)和开关受体。
[0382]
在另一个方面,本发明提供了治疗对其有需要的受试者中的转移性去势抵抗性前列腺癌的方法,包括向受试者施用有效量的修饰的t细胞,该修饰的t细胞包含能够结合前列腺干细胞抗原的嵌合抗原受体(car)(psca-car)和双特异性抗体,其中修饰t细胞分泌双特异性抗体。
[0383]
g.免疫细胞的扩增
[0384]
无论是在修饰细胞以表达car之前还是之后,可以使用例如美国专利号6,352,694;6,534,055;6,905,680;6,692,964;5,858,358;6,887,466;6,905,681;7,144,575;7,
067,318;7,172,869;7,232,566;7,175,843;5,883,223;6,905,874;6,797,514;6,867,041;和美国公开号20060121005中描述的方法来活化和扩增细胞数量。例如,本发明的t细胞可以通过与表面接触来扩增,该表面具有与其附着的刺激cd3/tcr复合物相关信号的试剂和刺激t细胞表面上的共刺激分子的配体。具体而言,可通过与抗cd3抗体或其抗原结合片段、或固定在表面上的抗cd2抗体接触,或通过与蛋白激酶c活化剂(例如,苔藓抑制素)接触与钙离子载体结合来刺激t细胞群。为了在t细胞的表面上共刺激辅助分子,使用结合辅助分子的配体。例如,t细胞可以在适合刺激t细胞增殖的条件下与抗cd3抗体和抗cd28抗体接触。抗cd28抗体的实例包括9.3、b-t3、xr-cd28(diaclone,besancon,france),并且这些可用于本发明,本领域已知的其他方法和试剂也可用于本发明(参见,例如,ten berge et al.,transplant proc.(1998)30(8):3975-3977;haanen et al.,j.exp.med.(1999)190(9):1319-1328;and garland et al.,j.immunol.methods(1999)227(1-2):53-63)。
[0385]
通过本文公开的方法扩增的t细胞可倍增约10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍、1000倍、2000倍、3000倍、4000倍、5000倍、6000倍、7000倍、8000倍、9000倍、10,000倍、100,000倍、1,000,000倍、10,000,000倍或更大,以及它们之间的任何和所有或部分整数。在一个实施方式中,t细胞在约20倍至约50倍的范围内扩增。
[0386]
培养后,t细胞可以在培养设备中的细胞培养基中孵育一段时间或直到细胞达到汇合(confluency)或高细胞密度以获得最佳传代,然后再将细胞传递到另一个培养设备。培养设备可以是任何常用于体外培养细胞的培养设备。优选地,在将细胞传递到另一个培养设备之前汇合水平为70%或更高。更优选地,汇合水平为90%或更高。一段时间可以是任何适合于体外培养细胞的时间。t细胞培养基可在t细胞培养过程中随时更换。优选地,t细胞培养基大约每2至3天更换。然后从培养设备中收获t细胞,接着t细胞可以立即使用或冷藏储存以备后用。在一个实施方式中,本发明包括冷藏扩增的t细胞。在将核酸引入t细胞中之前将冷藏的t细胞解冻。
[0387]
在另一个实施方式中,该方法包括分离t细胞和扩增t细胞。在另一个实施方式中,本发明进一步包括在扩增之前冷藏t细胞。在另一个实施方式中,将冷藏的t细胞解冻以用编码嵌合膜蛋白的rna进行电穿孔。
[0388]
用于离体扩增细胞的另一种程序描述于美国专利号5,199,942(通过引用并入本文)中。如美国专利号5,199,942所述的扩增可以是本文所述的其他扩增方法的替代或补充。简而言之,t细胞的离体培养和扩增包括添加细胞生长因子,如美国专利号5,199,942中描述的那些,或其他因子,如flt3-l、il-1、il-3和c-kit配体。在一个实施方式中,扩增t细胞包括用选自flt3-l、il-1、il-3和c-kit配体的因子培养t细胞。
[0389]
本文所述的培养步骤(与如本文所述的试剂接触或电穿孔后)可以非常短,例如少于24小时,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23小时。如本文进一步描述的培养步骤(与如本文所述的试剂接触)可以更长,例如1、2、3、4、5、6、7、8、9、10、11、12、13、14,或更多天。
[0390]
各种术语用于描述培养中的细胞。细胞培养物通常是指从活生物体中取出并在受控条件下生长的细胞。原代细胞培养物是在第一次继代培养之前直接取自生物体的细胞、组织或器官的培养物。当将细胞置于促进细胞生长和/或分裂的条件下的生长培养基中时,
细胞会在培养中扩增,从而产生更大的细胞群。当细胞在培养中扩增时,细胞增殖的速率通常通过细胞数量翻倍所需的时间量来衡量,也称为倍增时间。
[0391]
每一轮的继代培养被称为传代。当细胞被继代培养时,它们被称为已经传代。特定的细胞群或细胞系有时通过其已传代的次数来提及或表征。例如,已传代十次的培养细胞群可称为p10培养物。原代培养物,即从组织中分离细胞后的第一培养物,被指定为p0。在第一次继代培养后,细胞被描述为二级培养物(p1或传代1)。在第二次继代培养后,细胞成为三级培养物(p2或传代2),依此类推。本领域技术人员将理解,在传代期间可能存在许多群体倍增;因此,一种培养物的群体倍增数大于传代数。传代期间细胞的扩增(即,群体倍增数)取决于许多因素,包括但不限于接种密度、底物、培养基和传代之间的时间。
[0392]
在一个实施方式中,细胞可以培养数小时(约3小时)至约14天或其之间的任何小时整数值。适合t细胞培养的条件包括适合的培养基(例如,最低必须培养基(minimal essential media)或rpmi培养基1640或x-vivo 15,(lonza)),其可能含有增殖和生存所必需的因子,包括血清(例如,胎牛或人血清)、白细胞介素-2(il-2)、胰岛素、ifn-γ、il-4、il-7、gm-csf、il-10、il-12、il-15、tgf-β和tnf-α或本领域技术人员已知的用于细胞生长的任何其他添加剂。其他用于细胞生长的添加剂包括但不限于表面活性剂、普拉斯特和还原剂,如n-乙酰半胱氨酸和2-巯基乙醇。培养基可以包括rpmi 1640、aim-v、dmem、mem、α-mem、f-12、x-vivo 15和x-vivo 20、优化剂(optimizer),添加氨基酸、丙酮酸钠和维生素,或者无血清或补充有适量的血清(或血浆)或者一组明确的激素,和/或足以使t细胞生长和扩增的细胞因子(一种或多种)。抗生素,例如,青霉素和链霉素,仅包含在实验培养物中,而不包含在要输注到受试者中的细胞培养物中。将靶细胞维持在支持生长所必需的条件下,例如适当的温度(例如,37℃)和大气(例如,空气加5%co2)下。
[0393]
用于培养t细胞的培养基可以包括可以共刺激t细胞的试剂。例如,可以刺激cd3的试剂是针对cd3的抗体,并且可以刺激cd28的试剂是针对cd28的抗体。通过本文公开的方法分离的细胞可以扩增大约10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍、1000倍、2000倍、3000倍、4000倍、5000倍、6000倍、7000倍、8000倍、9000倍、10,000倍、100,000倍、1,000,000倍、10,000,000倍或更多倍。在一个实施方式中,t细胞在约20倍至约50倍或更多的范围内扩增。在一个实施方式中,人调节性t细胞通过抗cd3抗体包被的kt64.86人工抗原呈递细胞(aapc)扩增。用于扩增和活化t细胞的方法可见于美国专利号:7,754,482、8,722,400和9,555,105中,其内容以其整体并入本文。
[0394]
在一个实施方式中,扩增t细胞的方法可以进一步包括分离扩增的t细胞以供进一步应用。在另一个实施方式中,扩增的方法可以进一步包括扩增的t细胞的后续电穿孔,然后进行培养。后续电穿孔可以包括将编码试剂的核酸引入扩增的t细胞群中,如转导扩增的t细胞、转染扩增的t细胞或用核酸电穿孔扩增的t细胞,其中试剂进一步刺激t细胞。该试剂可以刺激t细胞,如通过刺激进一步的扩增、效应器功能或另一种t细胞功能。
[0395]
h.产生修饰的免疫细胞的方法
[0396]
本公开提供了产生或生成用于肿瘤免疫疗法,例如,过继免疫疗法,的本发明的经修饰的免疫细胞或其前体(例如t细胞)的方法。
[0397]
在一些实施方式中,通过表达载体将car引入细胞中。本文提供了包含编码本发明
的car的核酸序列的表达载体。合适的表达载体包括慢病毒载体、γ逆转录病毒载体、泡沫病毒载体、腺伴随病毒(aav)载体、腺病毒载体、工程杂合病毒、裸dna,包括但不限于转座子介导的载体,如sleeping beauty、piggybak和整合酶,如phi31。一些其他合适的表达载体包括单纯疱疹病毒(hsv)和逆转录病毒表达载体。
[0398]
在某些实施方式中,编码car的核酸通过病毒转导被引入细胞中。在某些实施方式中,病毒转导包括使免疫细胞或前体细胞与包含编码car的核酸的病毒载体接触。在某些实施方式中,病毒载体是腺伴随病毒(aav)载体。在某些实施方式中,aav载体包含源自aav6的5'itr和3'itr。在某些实施方式中,aav载体包含土拨鼠肝炎病毒转录后调节元件(wpre)。在某些实施方式中,aav载体包含多聚腺苷酸化(多聚a)序列。在某些实施方式中,多聚a序列是牛生长激素(bgh)多聚a序列。
[0399]
腺病毒表达载体基于腺病毒,其整合到基因组dna的能力低,但转染宿主细胞的效率高。腺病毒表达载体包含足以:(a)支持表达载体的包装和(b)最终在宿主细胞中表达car的腺病毒序列。在一些实施方式中,腺病毒基因组是36kb、线性、双链dna,其中可以插入外源dna序列(例如,编码car的核酸)以替代大片段的腺病毒dna以制作本发明的表达载体(参见,例如,danthinne and imperiale,gene therapy(2000)7(20):1707-1714)。
[0400]
另一种表达载体基于腺伴随病毒(aav),其利用了腺病毒偶合系统。这种aav表达载体整合到宿主基因组中的频率高。它可以感染非分裂细胞,因此使其可用于将基因递送到哺乳动物细胞中,例如在组织培养物中或体内。aav载体具有广泛的传染性宿主范围。美国专利号5,139,941和4,797,368中描述了aav载体的产生和使用的细节。
[0401]
逆转录病毒表达载体能够整合到宿主基因组中,递送大量外源遗传物质,感染广谱的物种和细胞类型,并被包装在特殊的细胞系中。逆转录病毒载体是通过在某个位置将核酸(例如,编码car的核酸)插入病毒基因组中以产生复制缺陷的病毒而构建的。尽管逆转录病毒载体能够感染种类繁多的细胞类型,但car的整合和稳定表达需要宿主细胞的分裂。
[0402]
慢病毒载体衍生自慢病毒,其是复杂的逆转录病毒,除了常见的逆转录病毒基因gag、pol和env之外,还含有其他具有调节或结构功能的基因(参见,例如,美国专利号6,013,516和5,994,136)。慢病毒的一些实例包括人类免疫缺陷病毒(hiv-1、hiv-2)和猿免疫缺陷病毒(siv)。慢病毒载体是通过多重减弱hiv毒力基因产生的,例如基因env、vif、vpr、vpu和nef被删除,使载体在生物学上是安全的。慢病毒载体能够感染非分裂细胞并且可以用于例如编码car的核酸的体内和离体基因转移和表达(参见,例如,美国专利号5,994,136)。
[0403]
可以通过本领域技术人员已知的任何方式将包括本公开的核酸的表达载体引入宿主细胞中。如果期望,表达载体可以包括用于转染的病毒序列。或者,可以通过融合、电穿孔、生物射弹、转染、脂转染等引入表达载体。在引入表达载体之前,宿主细胞可以在培养基中生长和扩增,然后进行适当的处理以引入和整合载体。然后宿主细胞被扩增并且可以通过载体中存在的标志物进行筛选。可以使用的各种标志物是本领域已知的,并且可以包括hprt、新霉素抗性、胸苷激酶、潮霉素抗性等。如本文所用,术语“细胞”、“细胞系”和“细胞培养物”可以是互换使用。在一些实施方式中,宿主细胞是免疫细胞或其前体,例如,t细胞、nk细胞或nkt细胞。
[0404]
本发明还提供了包含并稳定表达本公开的car的基因工程细胞。在一些实施方式
中,基因工程细胞是基因工程t淋巴细胞(t细胞)、幼稚t细胞(tn)、记忆t细胞(例如,中枢记忆t细胞(tcm)、效应记忆细胞(tem))、天然杀伤细胞(nk细胞)和能够产生治疗相关后代的巨噬细胞。在某些实施方式中,基因工程细胞是自体细胞。在某些实施方式中,修饰细胞对t细胞衰竭有抵抗力。
[0405]
修饰的细胞(例如,包含car)可以通过用包含本公开的核酸的表达载体稳定转染宿主细胞来产生。用于产生本公开的修饰细胞的其他方法包括但不限于化学转化方法(例如,使用磷酸钙、树状聚体、脂质体和/或阳离子聚合物)、非化学转化方法(例如,电穿孔、光学转化、基因电转移和/或流体动力递送)和/或基于粒子的方法(例如,使用基因枪和/或磁转染(magnetofection)的穿刺感染(impalefection))。可以离体扩增表达本公开的car的转染细胞。
[0406]
将表达载体引入宿主细胞中的物理方法包括磷酸钙沉淀、脂质转染、粒子轰击、显微注射、电穿孔等。用于产生包括载体和/或外源核酸的细胞的方法是本领域公知的。参见,例如,sambrook et al.(2001),molecular cloning:a laboratory manual,cold spring harbor laboratory,new york。将表达载体引入宿主细胞的化学方法包括胶体分散系统,如大分子复合物、纳米胶囊、微球体、珠子和基于脂质的系统,包括水包油乳液、微胶粒、混合微胶粒和脂质体。
[0407]
适用的脂质可以从商业来源获得。例如,二肉豆蔻基磷脂酰胆碱(“dmpc”)可以从sigma,st.louis,mo获得;磷酸二鲸蜡脂(“dcp”)可从k&k laboratories(plainview,ny)获得;胆固醇(“choi”)可以从calbiochem-behring获得;二肉豆蔻基磷脂酰甘油(“dmpg”)和其他脂质可以从avanti polar lipids,inc.(birmingham,al)获得。氯仿或氯仿/甲醇中的脂质储备溶液可储存在约-20℃。氯仿可以用作唯一的溶剂,因为它比甲醇更容易蒸发。“脂质体”是一个通用术语,包括由封闭的脂质双层或聚集体形成的各种单层和多层(multilamellar)脂质载体。脂质体可以表征为具有具有磷脂双层膜和内部水性介质的囊泡结构。多层脂质体具有由水性介质隔开的多个脂质层。当磷脂悬浮在过量的水溶液中时,它们会自发形成。脂质成分在形成封闭结构之前经历自我重排,并在脂质双层之间截留水和溶解的溶质(ghosh et al.,1991glycobiology 5:505-10)。还包括在溶液中具有不同于正常泡状结构的结构的组合物。例如,脂质可能呈现微胶粒结构或仅作为脂质分子的不均匀聚集体存在。还考虑脂质转染胺-核酸复合物。
[0408]
不管用于将外源核酸引入宿主细胞中或以其他方式使细胞暴露于本发明的抑制剂的方法如何,为了确认核酸在宿主细胞中的存在,可以进行多种测定。这样的测定包括例如本领域技术人员公知的分子生物学测定,例如southern和northern印迹、rt-pcr和pcr;生物化学测定,如检测特定肽的存在或不存在,例如,通过免疫学手段(elisa和蛋白质印迹)或通过本文描述的测定来鉴定落入本发明范围内的试剂。
[0409]
在一个实施方式中,引入宿主细胞中的核酸是rna。在另一个实施方式中,rna是包含体外转录的rna或合成的rna的mrna。rna可以通过使用聚合酶链式反应(pcr)生成模板进行体外转录来产生。来自任何来源的感兴趣的dna可以通过pcr直接转化为模板,该模板用于使用适当的引物和rna聚合酶进行体外mrna合成。dna的来源可以是例如基因组dna、质粒dna、噬菌体dna、cdna、合成dna序列或任何其他合适的dna来源。
[0410]
pcr可用于生成用于体外转录mrna的模板,然后将其引入细胞中。进行pcr的方法
是本领域公知的。用于pcr的引物设计为具有与用作pcr的模板的dna区域基本互补的区域。如本文所用,“基本上互补”是指引物序列中的大部分或所有碱基是互补的核苷酸序列。在用于pcr的退火条件下,基本上互补的序列能够与预期的dna靶标退火或杂交。可以将引物设计成与dna模板的任何部分基本上互补。例如,可以设计引物以扩增在细胞中正常转录的包括5'和3'utr的基因的部分(开放阅读框)。还可以设计引物以扩增编码感兴趣的特定结构域的基因的部分。在一个实施方式中,设计引物以扩增人cdna的编码区,包括5'和3'utr的全部或部分。可用于pcr的引物通过本领域公知的合成方法产生。“正向引物”是包含与作为待扩增的dna序列上游的dna模板上的核苷酸基本上互补的核苷酸区域的引物。“上游”在本文中用于指即相对于编码链待扩增的dna序列的5'位置。“反向引物”是包含与作为待扩增的dna序列下游的双链dna模板基本上互补的核苷酸区域的引物。“下游”在本文中用于指相对于编码链待扩增的dna序列的3'位置。
[0411]
也可以使用具有促进rna的稳定性和/或翻译效率的能力的化学结构。rna优选具有5'和3'utr。在一个实施方式中,5'utr的长度在0和3000个核苷酸之间。可通过不同方法改变待添加到编码区的5'和3'utr序列的长度,包括但不限于设计与utr不同区域退火的pcr的引物。使用这种方法,本领域的普通技术人员可以在转染转录的rna后修改实现最佳翻译效率所需的5'和3'utr长度。
[0412]
5'和3'utr可以是感兴趣基因的天然存在的内源性5'和3'utr。或者,可以通过将utr序列参入到正向和反向引物中或通过模板的任何其他修饰来添加对感兴趣的基因非内源的utr序列。使用对感兴趣的基因非内源的utr序列可用于修改rna的稳定性和/或翻译效率。例如,已知3'utr序列中富集au的元件可降低mrna的稳定性。因此,可以基于本领域公知的utr的特性选择或设计3'utr以增加转录的rna的稳定性。
[0413]
在一个实施方式中,5'utr可以包含内源基因的kozak序列。或者,当如上所述通过pcr添加对感兴趣基因非内源的5'utr时,可以通过添加5'utr序列来重新设计共有kozak序列。kozak序列可以增加一些rna转录物的翻译效率,但似乎并非所有rna都需要能够实现高效翻译。许多mrna对kozak序列的要求是本领域已知的。在其他实施方式中,5'utr可以源自rna病毒,其rna基因组在细胞中是稳定的。在其他实施方式中,可以在3'或5'utr中使用各种核苷酸类似物以阻止mrna的外切核酸酶降解。
[0414]
为了能够在不需要基因克隆的情况下从dna模板合成rna,转录启动子应附接到待转录序列上游的dna模板。当起rna聚合酶启动子作用的序列被添加到正向引物的5'端时,rna聚合酶启动子在待转录的开放阅读框上游参入pcr产物中。在一个实施方式中,启动子是t7聚合酶启动子,如本文别处所述。其他有用的启动子包括但不限于t3和sp6 rna聚合酶启动子。t7、t3和sp6启动子的共有核苷酸序列是本领域已知的。
[0415]
在一个实施方式中,mrna具有5'端上的帽和3'多聚(a)尾,其决定核糖体结合、翻译起始和细胞中mrna的稳定性。在环状dna模板上,例如,质粒dna、rna聚合酶产生不适合在真核细胞中表达的长串联(concatameric)产物。在3'utr端线性化的质粒dna的转录导致正常大小的mrna,即使它在转录后被多腺苷酸化,在真核转染中也无效。
[0416]
在线性dna模板上,噬菌体t7 rna聚合酶可以将转录物的3'端延伸到模板的最后一个碱基之外(schenborn and mierendorf,nuc acids res.,13:6223-36(1985);nacheva and berzal-herranz,eur.j.biochem.,270:1485-65(2003))。
[0417]
转录dna模板的多聚a/t片段可以在pcr期间通过使用含有多聚t尾的反向引物产生,多聚t尾如100t尾(大小可以是50-5000t),或在pcr之后通过任何其他方法产生,包括但不限于dna连接或体外重组。多聚(a)尾部还为rna提供稳定性并减少其降解。通常,多聚(a)尾的长度与转录rna的稳定性呈正相关。在一个实施方式中,聚(a)尾为100和5000个腺苷之间。
[0418]
在体外转录后,可以使用多聚(a)聚合酶,如大肠杆菌多聚a聚合酶(e-pap),进一步延伸rna的多聚(a)尾。在一个实施方式中,将多聚(a)尾的长度从100个核苷酸增加到300和400个核苷酸之间,导致rna的翻译效率增加约两倍。此外,将不同化学基团附接到3'端可以增加mrna稳定性。这种附接可以包含修饰/人工核苷酸、适配体和其他化合物。例如,可以使用多聚(a)聚合酶将atp类似物参入多聚(a)尾中。atp类似物可以进一步增加rna的稳定性。
[0419]
5'帽还为rna分子提供稳定性。在一个优选的实施方式中,通过本文公开的方法产生的rna包括5'帽。5'帽使用本领域已知和本文中所述的技术提供(cougot,et al.,trends in biochem.sci.,29:436-444(2001);stepinski,et al.,rna,7:1468-95(2001);elango,et al.,biochim.biophys.res.commun.,330:958-966(2005))。
[0420]
在一些实施方式中,将rna电穿孔到细胞中,如体外转录的rna。可以包括任何适合细胞电穿孔的溶质,其可以包含促进细胞渗透性和生存的因子,如糖、肽、脂质、蛋白质、抗氧化剂和表面活性剂。
[0421]
在一些实施方式中,编码本公开的car的核酸将是rna,例如体外合成的rna。rna的体外合成方法是本领域已知的;任何已知的方法都可以用于合成包含编码car的序列的rna。将rna引入宿主细胞中的方法是本领域已知的。参见,例如,zhao et al.cancer res.(2010)15:9053。将包含编码car的核苷酸序列的rna引入宿主细胞中可在体外、离体或体内进行。例如,宿主细胞(例如,nk细胞、细胞毒性t淋巴细胞等)可以用包含编码car的核苷酸序列的rna在体外或离体进行电穿孔。
[0422]
所公开的方法可应用于在癌症、干细胞、急性和慢性感染以及自身免疫性疾病领域中的基础研究和治疗中调节t细胞活性,包括评估遗传修饰t细胞杀伤目标癌细胞的能力。
[0423]
该方法还提供了通过改变例如启动子或输入rna的量来控制广泛范围内的表达水平的能力,从而使其可以单独调节表达水平。此外,基于pcr的mrna生产技术极大地促进了具有不同结构和其结构域组合的mrna的设计。
[0424]
本发明的rna转染方法的一个优点是rna转染基本上是瞬时的并且无载体。rna转基因可被递送至淋巴细胞并在短暂的体外细胞活化后在其中表达,作为最小表达盒而不需要任何额外的病毒序列。在这些条件下,不太可能将转基因整合到宿主细胞基因组中。由于rna的转染效率及其均匀修饰整个淋巴细胞群的能力,因此不需要克隆细胞。
[0425]
用体外转录的rna(ivt-rna)对t细胞进行遗传修饰利用了两种不同的策略,这两种策略都已在各种动物模型中连续进行了测试。通过脂转染或电穿孔,用体外转录的rna转染细胞。期望使用各种修饰来稳定ivt-rna,以实现转移的ivt-rna的延长表达。
[0426]
一些ivt载体在文献中是已知的,它们以标准化的方式用作体外转录的模板,并且已经以产生稳定的rna转录物的方式进行了遗传修饰。目前本领域使用的方案基于具有以
下结构的质粒载体:能够使rna转录的5'rna聚合酶启动子,随后是其3'和/或5'两侧为非翻译区(utr)的感兴趣的基因,以及一个含有50-70个a核苷酸的3'多腺苷酸盒。在体外转录之前,环状质粒通过ii型限制酶在多腺苷酸盒下游被线性化(识别序列对应于切割位点)。因此,多腺苷酸盒对应于转录物中较后面的多聚(a)序列。作为该过程的结果,一些核苷酸在线性化后保留为酶切割位点的部分,并在3'端延伸或掩蔽多聚(a)序列。尚不清楚,这种非生理性突出端是否会影响由这种构建体在胞内产生的蛋白质量。
[0427]
在另一方面,通过电穿孔将rna构建体递送到细胞中。参见,例如,us 2004/0014645、us 2005/0052630a1、us 2005/0070841a1、us 2004/0059285a1、us 2004/0092907a1中教导的将核酸构建体电穿孔进入哺乳动物细胞的制剂和方法。包括对任何已知细胞类型进行电穿孔所需的电场强度的各种参数在相关研究文献以及该领域的众多专利和申请中通常是已知的。参见,例如,美国专利号6,678,556、美国专利号7,171,264和美国专利号7,173,116。用于电穿孔治疗应用的设备可商购获得,例如,medpulsertmdna电穿孔治疗系统(inovio/genetronics,san diego,calif.),并在诸如美国专利号6,567,694、美国专利号6,516,223、美国专利号5,993,434、美国专利号6,181,964、美国专利号6,241,701、和美国专利号6,233,482的专利中描述;电穿孔也可用于体外转染细胞,如在us20070128708a1中所述的。电穿孔也可用于在体外将核酸递送到细胞中。因此,利用本领域技术人员已知的许多可用装置和电穿孔系统中的任何一种,将包括表达构建体的核酸电穿孔介导地施用到细胞中提出了一种用于将感兴趣的rna递送至靶细胞的令人兴奋的新方法。
[0428]
i.药物组合物和制剂
[0429]
在另一个方面,本公开内容提供了药物组合物,其包含治疗有效量的本文所考虑的任何修饰细胞。还提供了本发明的免疫细胞群、包含此类细胞和/或富集此类细胞的组合物,如其中表达car的细胞至少占组合物中的总细胞或某种类型的细胞的50%、60%、70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多,某种类型的细胞如t细胞或cd8 或cd4 细胞。在组合物中,有用于施用的药物组合物和制剂,如用于过继细胞疗法。还提供了将细胞和组合物施用于受试者(例如,患者)的治疗方法。
[0430]
还提供了包含用于施用的细胞的组合物,包括药物组合物和制剂,如包含用于给定剂量或其级分施用的细胞数的单位剂型组合物。药物组合物和制剂通常包括一种或多种任选的药学上可接受的载体或赋形剂。在一些实施方式中,该组合物包括至少一种额外的治疗剂。
[0431]
术语“药物制剂”是指这样的制剂,其形式允许其中所含活性成分的生物活性是有效的,并且不包含对制剂将被施用的受试者具有不可接受毒性的附加组分。“药学上可接受的载体”是指药物制剂中除活性成分外的对受试者无毒的成分。药学上可接受的载体包括但不限于缓冲剂、赋形剂、稳定剂或防腐剂。在一些方面,载体的选择部分地由特定细胞和/或由施用方法决定。因此,有多种合适的配方。例如,药物组合物可以含有防腐剂。合适的防腐剂可以包括例如羟苯甲酸甲酯、对羟苯甲酸丙酯、苯甲酸钠和苯扎氯铵。在一些方面,使用两种或更多种防腐剂的混合物。防腐剂或其混合物典型地以总组合物重量的约0.0001%至约2%的量存在。载体描述于例如remington's pharmaceutical sciences 16th edition,osol,a.ed.(1980)。药学上可接受的载体在所采用的剂量和浓度下通常对受者无
毒,包括但不限于:缓冲剂,如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(如氯化十八烷基二甲基苄基铵;氯化六烃季铵;苯扎氯铵;氯化苄乙氧铵;苯酚、丁醇或苯甲醇;对羟基苯甲酸烷基酯,如羟苯甲酸甲酯或对羟苯甲酸丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如edta;糖,如蔗糖、甘露糖醇、海藻糖或山梨糖醇;形成盐的反离子,如钠;金属络合物(例如锌-蛋白质络合物);和/或非离子表面活性剂,如聚乙二醇(peg)。
[0432]
在一些方面,组合物中包含缓冲剂。合适的缓冲剂包括例如柠檬酸、柠檬酸钠、磷酸、磷酸钾和各种其他酸和盐。在一些方面,使用两种或更多种缓冲剂的混合物。缓冲剂或其混合物典型地以总组合物重量的约0.001%至约4%的量存在。制备可施用的药物组合物的方法是已知的。示例性方法更详细地描述于例如remington:the science and practice of pharmacy,lippincott williams&wilkins;21st ed.(2005年5约1日)。
[0433]
制剂可以包括水溶液。制剂或组合物还可以包含多于一种活性成分,该活性成分可用于用细胞治疗的特定适应症、疾病或病况,优选具有与细胞互补的活性的活性成分,其中各自的活性不会对彼此产生不利影响。此类活性成分合适地以对预期目的有效的量组合存在。因此,在一些实施方式中,药物组合物还包含其他药物活性剂或药物,如化学治疗剂,例如,天冬酰胺酶、白消安、卡铂、顺铂、柔红霉素、阿霉素、氟尿嘧啶、耶西塔宾、羟基脲、甲氨蝶呤、紫杉醇、利妥昔单抗(rituximab)、长春碱和/或长春新碱。在一些实施方式中,药物组合物含有治疗或预防疾病或病况有效量的细胞,如治疗有效量或预防有效量。在一些实施方式中,治疗或预防功效通过对治疗对象的定期评估来监测。所期望的剂量可以通过细胞的单次推注施用、通过细胞的多次推注施用或通过细胞的连续输注施用来递送。
[0434]
制剂包括用于口服、静脉内、腹膜内、皮下、肺部、透皮、肌肉内、鼻内、含服、舌下或栓剂施用的那些。在一些实施方式中,细胞群被肠胃外施用。如本文所用,术语“肠胃外”包括静脉内、肌肉内、皮下、直肠、阴道和腹膜内施用。在一些实施方式中,细胞通过静脉内、腹膜内或皮下注射使用外周全身递送来施用于受试者。在一些实施方式中,组合物作为无菌液体制剂提供,例如,等渗水溶液、悬浮液、乳液、分散体或粘性组合物,其在一些方面可以缓冲至选定的ph。液体制剂通常比凝胶、其他粘性组合物和固体组合物更容易制备。此外,液体组合物施用更方便一些,尤其是通过注射施用。另一方面,粘性组合物可以在适当的粘度范围内配制,以提供与特定组织的更长接触时间。液体或粘性组合物可以包含载体,其可以是溶剂或分散介质,其包含例如水、盐水、磷酸盐缓冲盐水、多元醇(polyoi)(例如甘油、丙二醇、液体聚乙二醇)及其合适的混合物。
[0435]
无菌可注射溶液可以通过将细胞参入溶剂中来制备,如与合适的载体、稀释剂或赋形剂(如无菌水、生理盐水、葡萄糖、右旋糖等)混合。,组合物可以包含辅助物质,如润湿剂、分散剂或乳化剂(例如,甲基纤维素)、ph缓冲剂、胶凝或增粘添加剂、防腐剂、调味剂和/或色素(colors),这取决于施用途径和期望的制剂。在一些方面,可以参考标准文本以制备合适的制剂。
[0436]
可以添加增强组合物稳定性和无菌性的各种添加剂,包括抗微生物防腐剂、抗氧化剂、螯合剂和缓冲剂。可以通过各种抗细菌剂和抗真菌剂来确保防止微生物的作用,各种
抗细菌剂和抗真菌剂例如对羟基苯甲酸酯、氯丁醇、苯酚和山梨酸。可通过使用延迟吸收的试剂,例如单硬脂酸铝和明胶来延长可注射药物形式的吸收。
[0437]
用于体内施用的制剂通常是无菌的。无菌可以容易地实现,例如通过无菌过滤膜来过滤。
[0438]
本文提及或引用的文章、专利和专利申请以及所有其他文件和电子可获得信息的内容在此以引用以其整体并入,就好像每个单独的出版物被特别和单独地表明要被并入一样引用。申请人保留将来自任何此类文章、专利、专利申请或其他物理和电子文件的任何和所有材料和信息物理并入到本技术中的权利。
[0439]
虽然已经参照其具体实施方式描述了本发明,但是本领域技术人员应该理解,在不背离本发明的真实精神和范围的情况下,可以进行各种改变和用等同物替换。对于本领域技术人员而言显而易见的是,在不脱离本文所公开的实施方式的范围的情况下,可以使用合适的等同物对本文描述的方法进行其他合适的修改和改编。此外,可以进行许多修改以使特定情况、材料、物质组成、工艺、一个或多个工序适应本发明的目的、精神和范围。所有这些修改都旨在落入所附权利要求的范围内。现在已经详细描述了某些实施方式,通过参考以下实施例将更清楚地理解它们,这些实施例仅出于说明的目的而不旨在限制。
[0440]
实验实施例
[0441]
现在参考以下实施例描述本发明。提供这些实施例仅用于说明的目的,并且本发明不限于这些实施例,而是涵盖由于本文提供的教导而显而易见的所有变化。
[0442]
材料和方法
[0443]
细胞系和原代人t淋巴细胞培养物:使用rosettesep试剂盒(stem cell technologies)通过负选择从白细胞单采后的健康志愿者供者中分离出原代人cd4和cd8 t细胞。所有样品均根据大学机构审查委员会(university institutional review board)批准的协议收集,并获得每位供者的书面知情同意。用抗cd3/cd28 dynabeads(life technologies)刺激混合的原代人cd4和cd8t细胞(1:1)。
[0444]
car构建体和慢病毒转导:构建了由来自人源化抗psca ab(2b3)的scfv组成的psca car,并将其克隆到逆转录病毒载体msgv中。针对psca的scfv结构域通过pcr合成和/或扩增,与cd8跨膜结构域和4-1bb、cd28、icos或icos.ymnm和cd3ζ胞内信号传导结构域连接,并亚克隆到ptrpe慢病毒载体中。用慢病毒载体以5的moi转导t细胞。
[0445]
流式细胞术:使用流式细胞术来确定用生物素标记的多克隆抗小鼠f(ab)2抗体(jackson immunoresearch)染色后转导细胞的转导效率。以下抗体用于流式细胞术实验:pe缀合的链霉亲和素。在facscalibur(bc biosciences)上进行数据采集并通过flowjo进行分析。
[0446]
cd107a测定:将细胞以1:2(1
×
105效应器:2
×
105)的e:t平铺在96孔板中的160μl的r10培养基中。值得注意的是,添加20μl藻红蛋白标记的抗cd107a ab并将板在37℃下孵育1小时,然后添加golgi stop(3ml r10培养基中2ml golgi stop,20ml/孔;bd biosciences,51
–
2092kz)并再孵育2.5小时。然后添加5ml fitc-抗-cd8和5ml链霉亲和素-别藻蓝蛋白(apc)-抗-cd3,并在37℃下孵育30分钟。孵育后,用facs缓冲液洗涤样品并通过流式细胞术进行分析。
[0447]
酶联免疫吸附测定(elisa):将靶细胞洗涤并以1
×
106个细胞/ml悬浮在r10培养
基中。值得注意的是,将100μl每种靶细胞类型一式三份添加到96孔圆底板(corning)中。将效应t细胞洗涤并以1
×
106个细胞/ml重新悬浮在r10细胞中,然后将100μl的t细胞与指定孔中的靶细胞结合。将板在37℃下孵育18至24小时。孵育后,收获上清液并进行elisa测定(ebioscience)。
[0448]
基于萤光素酶的溶细胞t细胞(ctl)测定:简而言之,叩头虫绿色萤光素酶(cbg)-t2a-egfp被慢病毒转导到psca肿瘤细胞中,并针对gfp表达进行分选。肿瘤细胞与不同比例的t细胞在37℃下孵育8小时。值得注意的是,将100ml的混合物转移到96孔白色发光计板上,添加100ml的底物,并立即测定发光。结果报告为基于具有肿瘤但没有t细胞的孔中的荧光素酶活性的杀伤百分比。(%杀伤=100-((来自具有效应和靶细胞共培养物的孔的rlu)/(来自具有靶细胞的孔的rlu)x100)。
[0449]
实施例1:
[0450]
本文产生了各种前列腺干细胞抗原(psca)特异性car。抗原结合结构域源自人源化抗-psca抗体(2b3)(美国专利公开号us2010/0297004,其内容通过引用以其整体并入本文)(图1)。使用2b3 scfv与各种胞内结构域组合,包括4-1bb和cd3ζ(2b3.bbz car)、cd28和cd3ζ(2b3.28z car)、icos和cd3ζ(2b3.icosz car)以及突变的icos(icos.ymnm car)和cd3ζ(2b3.icos.ymnm car)。还产生了包含pd1-cd28开关受体、tgfbr/il12r开关受体和显性负性受体(tgfbrdn)的psca car。还开发了包含针对psca和psma具有特异性的双car。psca car也与双特异性抗体(例如apd-l1/cd28或atgfbrii-cd28)组合使用。
[0451]
在与psca car(2b3.bbz)和pmsa car(j591.bbz)的体外转录rna共电穿孔的t细胞中测量car表达(图2上图)。与双特异性抗体10a5-1412(apdl1-acd28双特异性ab)或tgfb3-1412(atgfbrii-acd28双特异性ab)共电穿孔的psca car的pd-l1-fc染色显示在图2的下图中。
[0452]
测量用pc3-psca-psma或k562刺激的rna共电穿孔的t细胞中的cd107a(图3)。
[0453]
用具有突变icos信号传导结构域的psca(2b3)car(icos.ymnm)慢病毒转导的t细胞表现出提高的裂解能力、降低的体外细胞因子产生和与4-1bb信号传导psca car等同的体内抗肿瘤活性(图4和图6)。具有icos或icos.ymnm信号传导结构域的psca car被构建并克隆到慢病毒载体中。car表达水平与4-1bb或cd28信号传导结构域car相当(图4上)。在用psca阳性细胞系pc3.psca.pmsa.cbg或pc3.psca.pmsa.cbg.pd-l1刺激后,测量细胞因子产生(ifn-γ)(图4下图)。
[0454]
对表达具有icos或icos.ymnm信号传导结构域的psca car的t细胞的cd107a测定的结果显示在图5a图中。图5b示例了表达具有icos或icos.ymnm信号传导结构域的psca car的t细胞针对肿瘤系pc3-psca的杀伤测定的结果。
[0455]
图6示例了来自pc3-psca-cbg-pdl1肿瘤模型的bli结果。对于慢病毒转导(lvv td)的t细胞,每只小鼠在肿瘤接种后第21天静脉内(i.v.)转导1e6个细胞。在皮下注射各种psca car后,测量肿瘤的bli(平均发光(平均辐射,average radiace))(图7)和肿瘤大小(图8)。
[0456]
本文还产生了双特异性car。用于编码psma(2f5 scfv)和psca靶向car的研究的与gly4ser元件连接的载体在图9a中描绘。在初级扩增结束时,慢病毒转导的car t细胞上car的表面表达在图9b中描绘。通过用人重组psma-fc和psca-his蛋白染色测量并通过流式细
胞术分析表达psma或psca-car或双特异性car的慢病毒转导的car t细胞的百分比(图9c)。将表达所示scfv的car t细胞与靶标共培养4小时,并定量在cd8阳性细胞上的cd107a表达百分比(图9d)。
[0457]
双特异性car t细胞与pc3-psca细胞共培养(效:靶=1:1)。共培养后第24小时获得上清液,并通过elisa分析细胞因子的产生(图10a)。测试双特异性car t细胞在各种e:t比例下8小时针对pc3-psca细胞的溶细胞活性(图10b)。双特异性car t细胞与pc3-psma细胞共培养(效:靶=1:1)。共培养后第24小时获得上清液,并通过elisa分析细胞因子的产生(图10c)。测试双特异性car t细胞在各种e:t比例下8小时针对pc3-psma细胞的溶细胞活性(图10d)。
[0458]
图11a-11b示例了tgfbr-il12r开关受体可以增强t细胞功能的发现。图11a,右上图,显示了在培养物中有或没有tgfb1的情况下,用与k562共培养的tgfbr-il12r转移的nk细胞的ifn-γ产生。图11a,右下图,显示在用tgfβ刺激后用tgfbr-il12r开关受体转移的t细胞的psmad染色。图11b显示了ny-eso-1阳性肿瘤刺激的ny-eso-1tcr转导的与tgfbr-il12r开关受体共同转移的t细胞的细胞因子产生。
[0459]
其他实施方式
[0460]
本文对变量的任何定义中的元素列表的引用包括将该变量定义为任何单个元素或所列元素的组合(或子组合)。本文对实施方式的叙述包括作为任何单个实施方式或与任何其他实施方式或其部分组合的实施方式。
[0461]
本文引用的每个专利、专利申请和出版物的公开内容均通过引用以其整体并入本文。虽然本发明已经参照特定实施方式进行了公开,但显然本领域的其他技术人员可以在不背离本发明的真实精神和范围的情况下设计出本发明的其他实施方式和变体。所附权利要求旨在被解释为包括所有这样的实施方式和等同变体。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
