1.本发明总体上涉及用于递送抗病毒剂的粉末制剂及其制备和使用方法。
背景技术:
2.呼吸道病毒感染对全球公共卫生构成重大威胁并且是沉重的经济负担。由于开发特异性抗病毒剂或疫苗的长期滞后,在这些流行病开始时对其进行快速有效的控制具有挑战性。早期给予广谱抗病毒剂可能是一种有效的策略,有助于在早期或者甚至在病原体被确定之前控制流行病。然而,目前可用的大多数抗病毒剂都是通过口服或静脉内给药给予,由于口服或静脉内给药后肺部分布不充分,难以在呼吸道中获得强大的抗病毒活性。当给予高剂量以补偿肺分布不足时,由于广泛的全身暴露,预期产生毒副作用。
3.仍然需要用于肺部或鼻内递送的广谱抗病毒剂的制剂。
4.因此,本发明的目的是提供用于通过吸入或鼻内给药递送抗病毒剂的干粉制剂。
5.本发明的另一个目的是提供制备干粉制剂的方法。
6.本发明的又一个目的是提供使用干粉制剂的方法。
技术实现要素:
7.已经开发了用于肺部和鼻内药物递送的干粉制剂、用于干粉制剂的递送系统以及其制备和使用方法。
8.所述干粉制剂包含含有以下的颗粒:(1)类视黄醇或类视黄醇衍生物或其组合,诸如他米巴罗汀;(2)β-环糊精或β-环糊精衍生物或其组合,其中β-环糊精或β-环糊精衍生物的量,或者β-环糊精和β-环糊精衍生物的总量为类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物的总量的至少20重量%。颗粒一般是多孔的和球形的。类视黄醇和/或类视黄醇衍生物可以经由疏水性相互作用与β-环糊精和/或β-环糊精衍生物形成复合物(complex)。复合物中的类视黄醇和/或类视黄醇衍生物是无定形形式。
9.干粉制剂的颗粒具有有利于有效呼吸道沉积和滞留的空气动力学性质。例如,干粉制剂的颗粒具有<5μm、<4μm、<3.5μm、<3μm、<2.5μm或<2μm的质量中值空气动力学直径(“mmad”);大于mmad,诸如>4μm、>5μm、>8μm、>10μm、>12μm、>15μm、4μm至20μm、4μm至15μm,或4μm至15μm的体积平均直径;和/或在级联冲击器研究中>40%、>45%、>50%、>55%、>60%或≥65%的细颗粒分数,实现有效的肺沉积和滞留。例如,干粉制剂的颗粒具有>9μm、>9.5μm、>10μm或>10.5μm的mmad;>50μm、>55μm、>60μm、>65μm、50μm至80μm、50μm至75μm或50μm至70μm的体积平均直径;和/或在安德森级联冲击器(andersen cascade impactor)(“aci”)研究中为>40%、>45%、>50%、>55%或>60%的>9μm的颗粒的分数,实现在上呼吸道中有效沉积和滞留。
10.在一些方面,干粉制剂包含含有类视黄醇衍生物,诸如维甲酸、异维甲酸、阿利维甲酸、依曲替酯、阿维a酸、阿达帕林、贝沙罗汀、他扎罗汀或他米巴罗汀和β-环糊精衍生物的颗粒,并且β-环糊精衍生物的取代度可以为1至21、1至12、2至15、2至12、2至10、4至10、5
至8、6至9或6至8。在一些方面,包含在干粉制剂的颗粒中的类视黄醇衍生物可以是他米巴罗汀。在一些方面,包含在干粉制剂颗粒中的β-环糊精衍生物可以是2-羟丙基-β-环糊精、甲基-β-环糊精或磺丁基醚β-环糊精,或其组合。在一些方面,包含在干粉制剂颗粒中的唯一β-环糊精衍生物是2-羟丙基-β-环糊精。
11.干粉制剂还可包含药学上可接受的赋形剂或另外的活性剂,或其组合。药学上可接受的赋形剂可以是氨基酸、肽、脂质、蛋白质、螯合剂、盐、掩味剂、阳离子或聚合物,或其组合。干粉制剂中药学上可接受的赋形剂的量可以为干粉制剂的0.1重量%至20重量%、0.1重量%至15重量%或1重量%至10重量%。另外的活性剂可以是抗炎剂或抗病毒剂,或其组合。在一些方面,干粉制剂不含任何药学上可接受的赋形剂。
12.提供了包含吸入器或鼻用装置和干粉制剂的递送系统。在一些方面,使用合适的溶剂将干粉制剂配制成溶液或悬浮液,用于以滴或喷雾的形式鼻内给药。使用所公开的递送系统的颗粒的排放分数可以是>65%、>70%、>75%、>80%、>85%、>90%、>92%或>95%。
13.还提供了制备干粉制剂的方法。通常,所述方法包括(i)在溶剂中混合类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物,以及任选的药学上可接受的赋形剂和/或另外的活性剂以形成液体供给料;(ii)将液体供给料喷雾干燥或喷雾冷冻干燥以形成含有类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物,以及任选的药学上可接受的赋形剂和/或另外的活性剂的颗粒。通常,在步骤(ii)之后,颗粒的产率为至少40重量%,诸如约40重量%至约95重量%或约65重量%至约95重量%。
14.进一步提供了预防、治疗或改善与受试者的呼吸道病毒感染相关的(多种)症状的方法。待治疗的受试者可以是患有或有患有呼吸道病毒感染风险的哺乳动物,呼吸道病毒感染诸如严重急性呼吸综合征、中东呼吸综合征、冠状病毒疾病或由流感病毒引起的流感,或其组合。通常,所述方法包括(i)向受试者给予干粉制剂。给药步骤可以重复一次或多次。例如,每小时、每2小时、每5小时、每8小时、每天、每2天、每3天、每5天、每7天、每10天、每两周或每个月重复给药步骤。重复给予干粉制剂的时间可以是1天至6个月、1天至3个月、1至30天、1至10天、1至3天、1至2天,或一天之内。
15.通常,在单个给药步骤或所有给药步骤之后,将有效量的类视黄醇和/或类视黄醇衍生物递送至受试者的下呼吸道和/或上呼吸道。
附图说明
16.图1a是显示由疏水性药物和环糊精形成的复合物的示意图。图1b和1c是喷雾冷冻干燥中涉及的两个步骤的示意图:喷雾冷冻、通过喷嘴将液体雾化到冷冻剂中形成冷冻颗粒(图1b)和冷冻干燥、溶剂升华和干燥多孔颗粒的形成(图1c)。图1d是说明通过喷雾冷冻干燥制造的球形多孔干粉的示意图。图1e是通过喷雾冷冻干燥制造的球形多孔干粉在5000倍放大率下的扫描电子显微镜(“sem”)图像。图1f是说明口服吸入多孔颗粒以将药物递送至肺深部区域的示意图。
17.图2a-2h是显示喷雾冷冻干燥的他米巴罗汀粉末(a2-tfn)的物理化学和气溶胶性质的图。图2a-2d是在1.0k(图2a)和5.0k(图2c)下的未配制的他米巴罗汀的sem图像,以及在1.0k(图2b)和5.0k(图2d)下的a2-tfn。图2e是显示通过在90l/min下运行的下一代冲击
rank测试(mantel-cox)比较各组的存活率。与pbs组相比,**p<0.01。图8c是显示受感染小鼠体重的图。存活小鼠的每日体重表示为基线水平的百分比(n=5)。图8d是显示在sfd他米巴罗汀粉末制剂(a2-tfn)和hpbcd的毒性研究中小鼠体重的图。图8e是显示受感染小鼠肺组织中病毒载量的图。在感染后第3天收集肺组织用于病毒载量测定(n=4)。通过单因素anova和事后多重比较来比较差异。与pbs组相比,**p<0.01,ns不显著。
24.图9a是说明在balb/c小鼠中用于测试他米巴罗汀制剂的抗h1n1病毒的体内抗病毒活性以用于治疗性鼻内(i.n.)治疗的实验方案的示意图。图9b是显示受感染小鼠存活率的图。监测存活14天或直至达到人道终点(n=7)。使用log-rank测试(mantel-cox)比较各组的存活率。与pbs组相比,***p<0.001,**p<0.01。图9c是显示受感染小鼠体重的图。存活小鼠的每日体重表示为基线水平的百分比(n=7)。图9d是显示受感染小鼠肺组织中病毒载量的图。在感染后第3天收集肺组织用于病毒载量测定(n=4)。通过单因素anova和事后多重比较来比较差异。与pbs组相比,*p<0.05,ns不显著。
具体实施方式
25.i.定义
26.如本文所用,术语“活性剂”是指在体内局部和/或全身作用的生理学或药理学活性物质。活性剂是给予患者用于治疗(例如治疗剂)、预防(例如预防剂)或诊断(例如诊断剂)疾病或病症的物质。
27.如本文所用,如本文所用的术语“药学上可接受的”是指在合理的医学判断范围内,适合用于与人类和动物的组织接触而没有过度毒性、刺激、过敏反应或其他与合理的收益/风险比相称的问题或并发症的那些化合物、材料和/或组合物。
28.如本文所用,术语“烷基”是指通过从任何碳原子上除去氢原子而衍生自烷烃的单价基团。烷烃代表饱和烃,包括直链、支链或环状(单环或多环)的那些。烷基可以是直链c
1-c
30
烷基、支链c
4-c
30
烷基、环状c
3-c
30
烷基、直链c
1-c
30
烷基或支链c
4-c
30
烷基、直链c
1-c
30
烷基或环状c
3-c
30
烷基、支链c
4-c
30
烷基或环状c
3-c
30
烷基。任选地,烷基基团具有最多20个碳原子。烷基可以是直链c
1-c
20
烷基、支链c
4-c
20
烷基、环状c
3-c
20
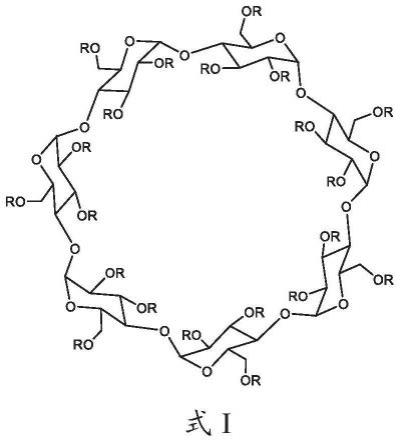
烷基、直链c
1-c
20
烷基或支链c
4-c
20
烷基、支链c
4-c
20
烷基或环状c
3-c
20
烷基、直链c
1-c
20
烷基或环状c
3-c
20
烷基。任选地,烷基基团具有最多10个碳原子。烷基可以是直链c
1-c
10
烷基、支链c
4-c
10
烷基、环状c
3-c
10
烷基、直链c
1-c
10
烷基或支链c
4-c
10
烷基、支链c
4-c
10
烷基或环状c
3-c
10
烷基、直链c
1-c
10
烷基或环状c
3-c
10
烷基。任选地,烷基基团具有最多6个碳原子。烷基可以是直链c
1-c6烷基、支链c
4-c6烷基、环状c
3-c6烷基、直链c
1-c6烷基或支链c
4-c6烷基、支链c
4-c6烷基或环状c
3-c6烷基,或直链c
1-c6烷基或环状c
3-c6烷基。任选地,烷基基团具有最多四个碳。烷基可以是直链c
1-c4烷基、环状c
3-c4烷基、直链c
1-c4烷基或环状c
3-c4烷基。优选地,烷基基团是未取代的烷基基团。优选地,烷基基团为直链c
1-c5、c
1-c4、c
1-c3、c
1-c2烷基基团,例如甲基基团。
29.如本文所用,术语“杂烷基”是指其中一个或多个碳原子被诸如o、n或s的杂原子取代的烷基基团。杂烷基基团可以是直链的、支链的或环状的。杂烷基可以是直链c
1-c
30
杂烷基、支链c
3-c
30
杂烷基、环状c
2-c
30
杂烷基、直链c
1-c
30
杂烷基或支链c
3-c
30
杂烷基、直链c
1-c
30
杂烷基或环状c
2-c
30
杂烷基、支链c
3-c
30
杂烷基或环状c
2-c
30
杂烷基。任选地,杂烷基基团具有最多20个碳原子。杂烷基可以是直链c
1-c
20
杂烷基、支链c
3-c
20
杂烷基、环状c
2-c
20
杂烷基、
nr
t2
′
c(=p)nr
t3
′-、-c(=s)-、-c(=s)s-、-sc(=s)-、-sc(=s)s-、-c(=nr
t2
′
)-、-c(=nr
t2
′
)p-、-c(=nr
t2
′
)nr
t3
′-、-pc(=nr
t2
′
)-、-nr
t2
′
c(=nr
t3
′
)-、-nr
t2
′
so
2-、-c(=nr
t2
′
)nr
t3
′-、-oc(=nr
t2
′
)-、-nr
t2
′
c(=nr
t3
′
)-、-nr
t2
′
so
2-、-nr
t2
′
so2nr
t3
′-、-nr
t2
′
c(=s)-、-sc(=s)nr
t2
′-、-nr
t2
′
c(=s)s-、-nr
t2
′
c(=s)nr
t3
′-、-sc(=nr
t2
′
)-、-c(=s)nr
t2
′-、-oc(=s)nr
t2
′-、-nr
t2
′
c(=s)o-、-sc(=o)nr
t2
′-、-nr
t2
′
c(=o)s-、-c(=o)s-、-sc(=o)-、-sc(=o)s-、-c(=s)o-、-oc(=s)-、-oc(=s)o-、-so2nr
t2
′-、-br
t2
′-、或-pr
t2
′-;其中r
t1
′
、r
t2
′
和r
t3
′
的每次出现独立地是氢原子、卤素原子、烷基基团、杂烷基基团、烯基基团、杂烯基基团、炔基基团、杂炔基基团、芳基基团,或杂芳基基团。
34.除非在本文中另有说明,否则本文中数值范围的列举仅旨在用作单独引用落入该范围内的每个单独值的速记方法,并且每个单独的数值被并入说明书中,就好像它在本文中单独列举一样。
35.使用术语“约”旨在描述在约 /-10%范围内高于或低于规定值的值。
36.ii.干粉制剂
37.本文公开了用于吸入或气管内给药和/或用于鼻内给药至受试者的下气道和/或上气道的类视黄醇和/或类视黄醇衍生物的干粉制剂。类视黄醇和/或类视黄醇衍生物的干粉制剂可用作抗各种呼吸道病毒感染的肺部或鼻内可递送的广谱抗病毒疗法。呼吸道是引起呼吸道感染的病毒进入的入口,期望将抗病毒剂直接递送到感染的原发部位。用于肺部和/或鼻内递送的干粉制剂可以改善药物在下气道和/或上气道,诸如肺中的分布,同时使全身暴露最小化,使得可以实现抗不同类别病毒的有效抗病毒活性而无需高剂量药物。
38.干粉制剂包含含有类视黄醇或类视黄醇衍生物或其组合和β-环糊精或β-环糊精衍生物或其组合的颗粒。颗粒一般是多孔的和/或球形的。例如,颗粒是多孔的和球形的。
39.类视黄醇和/或类视黄醇衍生物是疏水性的。通常,干粉制剂中β-环糊精或β-环糊精衍生物的量,或β-环糊精和β-环糊精衍生物的总量对于提高疏水性类视黄醇和/或类视黄醇衍生物的溶解度和溶解速率有效。不受任何理论的束缚,β-环糊精和/或β-环糊精衍生物可以通过形成包合复合物提高疏水性类视黄醇和/或类视黄醇衍生物的溶解度。β-环糊精和/或β-环糊精衍生物含有疏水性内腔和亲水性外表面。类视黄醇和/或类视黄醇衍生物可以插入β-环糊精和/或β-环糊精衍生物的疏水性腔,从而经由疏水性相互作用与β-环糊精和/或β-环糊精衍生物形成复合物,从而提高疏水性类视黄醇和/或类视黄醇衍生物的溶解度。另外,复合物中的类视黄醇和/或类视黄醇衍生物可以是无定形形式,而不是未配制的类视黄醇和/或类视黄醇衍生物的结晶形式。类视黄醇和/或类视黄醇衍生物的无定形形式可有助于药物的更快的溶解速率。图1a中显示了说明通过疏水性类视黄醇或疏水性类视黄醇衍生物和β-环糊精或β-环糊精衍生物经由疏水性相互作用形成的复合物的示例性示意图。
40.通常,β-环糊精或β-环糊精衍生物的量,或者β-环糊精和β-环糊精衍生物的总量为干粉制剂中类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物总量的至少20重量%。通常,可以使用20至80重量%的环糊精。优选低于50重量%的环糊精的量,低至20重量%的较低量的环糊精通常是更期望的。通常,可以根据所用药物的分子量、水溶性和效力调整用量。可以使用其他类型的环糊精,诸如α-环糊精和γ-环糊精及它们的衍生物,只要它们与所用药物相容即可。
41.例如,β-环糊精和/或β-环糊精衍生物与类视黄醇和/或类视黄醇衍生物的重量比为1∶4至9∶1、1∶4至8.5∶1、1:4至8∶1、1∶4至7.5∶1、1∶4至7∶1、1∶4至6.5∶1、1∶4至6∶1、1∶4至5.5∶1、1∶4至5∶1、1∶4至4.5∶1、1∶4至4∶1、1∶4至3.5∶1、1∶4至3∶1、1∶4至2.5∶1、1∶4至2∶1、1∶4至1.5∶1、1∶4至1∶1、1∶3至9∶1、1∶3至8.5∶1、1∶3至8∶1、1∶3至7.5∶1、1∶3至7∶1、1∶3至6.5∶1、1∶3至6∶1、1∶3至5.5∶1、1∶3至5∶1、1∶3至4.5∶1、1∶3至4∶1、1∶3至3.5∶1、1∶3至3∶1、1∶3至2.5∶1、1∶3至2∶1、1∶3至1.5∶1、1∶3至1∶1、2∶3至9∶1、2∶3至8.5∶1、2∶3至8∶1、2∶3至7.5∶1、2∶3至7∶1、2∶3至6.5∶1、2∶3至6∶1、2∶3至5.5∶1、2∶3至5∶1、2∶3至4.5∶1、2∶3至4∶1、2∶3至3.5∶1、2∶3至3∶1、2∶3至2.5∶1、2∶3至2∶1、2∶3至1.5∶1、或2∶3至1∶1。
42.在一些方面,干粉制剂的颗粒具有有利于有效的肺沉积和滞留以及改善的药物溶解速率的空气动力学性质(例如,质量中值空气动力学直径(“mmad”)<5μm,体积平均直径>4μm并且大于mmad,以及在级联冲击器研究中细颗粒分数>40%),这导致在给予干粉制剂的受试者的肺和血浆中更高的生物利用度和受试者中更快的药物吸收。
43.例如,在将干粉制剂吸入或气管内给予哺乳动物后,递送至受试者肺的类视黄醇和/或类视黄醇衍生物的最大浓度比递送至对照肺的类视黄醇和/或类视黄醇衍生物的最大浓度高至少10倍、高至少15倍、高至少20倍、高至少25倍、高至少30倍,或高至少35倍。另外或供选择地,在受试者的肺中达到类视黄醇和/或类视黄醇衍生物的最大浓度的时间比在对照中达到类视黄醇和/或类视黄醇衍生物的最大浓度的时间短至少2倍、短至少3倍、短至少4倍、短至少5倍,或短至少6倍。对照是与受试者相同的物种,其以与干粉制剂中相同量的类视黄醇和/或类视黄醇衍生物给药,但以非配制形式通过腹膜内给药。
44.在一些方面,干粉制剂的颗粒具有空气动力学性质,例如,mmad>9μm,体积平均直径>50μm并且大于mmad,并且在用于鼻内给药的aci研究中>9μm的颗粒分数>40%,以及改善的药物溶解速率。一般来说,10μm以上的mmad在雾化后对鼻腔内的沉积和滞留有效。在配备玻璃膨胀室(用于鼻腔沉积)的aci中,通常具有9μm的mmad截止值,因此,具有mmad>9μm或mmad>10μm的颗粒通常被认为适合鼻内给药。通常,体积直径与鼻内给药的适用性之间的直接相关性较低。然而,一般而言,体积直径越大,mmad越大,mmad也取决于颗粒的形状和密度,因此,选择的mmad通常会设定颗粒的体积直径范围。
45.用于吸入、气管内和鼻内给药的干粉制剂的改善的溶解速率可归因于颗粒的多孔结构和疏水性药物(即类视黄醇和/或类视黄醇衍生物)与β-环糊精和/或β-环糊精衍生物之间的复合作用的效果。另外,具有小空气动力学直径但大体积尺寸的颗粒可有助于有效的肺沉积,还通过避免快速清除可有助于延长在气道中的滞留。
46.干粉制剂还可以包含药学上可接受的载体和/或另外的活性剂。
47.还公开了用于递送干粉制剂的系统。在一些方面,所述系统包括吸入器和干粉制剂。粉末制剂颗粒的排放分数,即离开吸入器的粉末分数,>65%。在一些方面,所述系统包括鼻用装置和由干粉制剂和合适的溶剂形成的溶液或悬浮液。溶液或悬浮液颗粒的排放分数,即离开鼻用装置的粉末分数,>85%。排放分数可以通过例如在收集溶解的粉末(以溶液形式)之后使用hplc方法量化药物含量测量。排放分数计算为离开装置的药物回收量占总收集量的百分比(即,鼻用装置中排除的分数)。
48.a.类视黄醇和类视黄醇衍生物
49.干粉制剂包含类视黄醇或类视黄醇衍生物,或其组合。通常,适合在干粉制剂中使
用的类视黄醇和类视黄醇衍生物可通过中断宿主细胞中的脂质代谢重编程而用作广谱抗病毒剂。例如,类视黄醇衍生物之一,他米巴罗汀,具有抗各种病毒,包括流感病毒和冠状病毒,诸如严重急性呼吸综合征冠状病毒(例如,sars-cov-2)、中东呼吸综合征冠状病毒(“mers-cov”)和甲型流感病毒(例如h1n1病毒)及其组合的广谱抗病毒活性。
50.适合在干粉制剂中使用的类视黄醇和类视黄醇衍生物的实例包括但不限于视黄醇、维甲酸、异维甲酸、阿利维甲酸、依曲替酯、阿维a酸、阿达帕林、贝沙罗汀、他扎罗汀和他米巴罗汀及其组合。例如,干粉制剂包含用于吸入或气管内给药和/或用于鼻内给药至受试者的下气道和/或上气道中的他米巴罗汀。
51.通常,干粉制剂中类视黄醇或类视黄醇衍生物的量,或类视黄醇和类视黄醇衍生物的总量为类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物的总重量的约10重量%至约80重量%、约15重量%至约80重量%、约20重量%至约80重量%、约25重量%至约80重量%、约30重量%至约80重量%、约35重量%至约80重量%、约40重量%至约80重量%、约45重量%至约80重量%、约50重量%至约80重量%、约10重量%至约70重量%、约15重量%至约70重量%、约20重量%至约70重量%、约25重量%至约70重量%、约30重量%至约70重量%、约35重量%至约70重量%、约40重量%至约70重量%、约45重量%至约70重量%、约50重量%至约70重量%、约10重量%至约60重量%、约15重量%至约60重量%、约20重量%至约60重量%、约25重量%至约60重量%、约30重量%至约60重量%、约35重量%至约60重量%、约40重量%至约60重量%、约45重量%至约60重量%、或约50重量%至约60重量%。例如,干粉制剂中类视黄醇或类视黄醇衍生物的量,或类视黄醇和类视黄醇衍生物的总量为类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物的总重量的约10重量%至约50重量%。通常,干粉制剂中类视黄醇和类视黄醇衍生物的量可以取决于基于药物的分子量、水溶性和效力所需的环糊精的量。即,当需要超过20重量%的环糊精时,在干粉制剂中的类视黄醇和类视黄醇衍生物的量的最大重量百分比将小于80。术语“类视黄醇和类视黄醇衍生物的总量”是指干粉制剂中相对于类视黄醇和类视黄醇衍生物以及β-环糊精和/或β-环糊精衍生物的重量总和的类视黄醇和类视黄醇衍生物的重量总和。
52.在一些方面,干粉制剂包含类视黄醇衍生物并且类视黄醇衍生物的量为类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物的总重量的约10重量%至约80重量%、约15重量%至约80重量%、约20重量%至约80重量%、约25重量%至约80重量%、约30重量%至约80重量%、约35重量%至约80重量%、约40重量%至约80重量%、约45重量%至约80重量%、约50重量%至约80重量%、约10重量%至约70重量%、约15重量%至约70重量%、约20重量%至约70重量%、约25重量%至约70重量%、约30重量%至约70重量%、约35重量%至约70重量%、约40重量%至约70重量%、约45重量%至约70重量%、约50重量%至约70重量%、约10重量%至约60重量%、约15重量%至约60重量%、约20重量%至约60重量%、约25重量%至约60重量%、约30重量%至约60重量%、约35重量%至约60重量%、约40重量%至约60重量%、约45重量%至约60重量%、或约50重量%至约60重量%。
53.在一些方面,干粉制剂包含两种或更多种类视黄醇衍生物并且每种类视黄醇衍生物的量可以在合适的范围内以提供类视黄醇衍生物的总量为类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物总重量的约10重量%至约80重量%、约15重量%至约80重量%、约20
重量%至约80重量%、约25重量%至约80重量%、约30重量%至约80重量%、约35重量%至约80重量%、约40重量%至约80重量%、约45重量%至约80重量%、约50重量%至约80重量%、约10重量%至约70重量%、约15重量%至约70重量%、约20重量%至约70重量%、约25重量%至约70重量%、约30重量%至约70重量%、约35重量%至约70重量%、约40重量%至约70重量%、约45重量%至约70重量%、约50重量%至约70重量%、约10重量%至约60重量%、约15重量%至约60重量%、约20重量%至约60重量%、约25重量%至约60重量%、约30重量%至约60重量%、约35重量%至约60重量%、约40重量%至约60重量%、约45重量%至约60重量%、或约50重量%至约60重量%。
54.在一些方面,干粉制剂包含他米巴罗汀并且他米巴罗汀的量为他米巴罗汀和β-环糊精和/或β-环糊精衍生物的总重量的约10重量%至约80重量%、约15重量%至约80重量%、约20重量%至约80重量%、约25重量%至约80重量%、约30重量%至约80重量%、约35重量%至约80重量%、约40重量%至约80重量%、约45重量%至约80重量%、约50重量%至约80重量%、约10重量%至约70重量%、约15重量%至约70重量%、约20重量%至约70重量%、约25重量%至约70重量%、约30重量%至约70重量%、约35重量%至约70重量%、约40重量%至约70重量%、约45重量%至约70重量%、约50重量%至约70重量%、约10重量%至约60重量%、约15重量%至约60重量%、约20重量%至约60重量%、约25重量%至约60重量%、约30重量%至约60重量%、约35重量%至约60重量%、约40重量%至约60重量%、约45重量%至约60重量%、或约50重量%至约60重量%。
55.b.β-环糊精及其衍生物
56.干粉制剂包含β-环糊精或β-环糊精衍生物,或其组合。β-环糊精和β-环糊精衍生物对肺部给药具有良好的安全分布,在干粉制剂中可起到药物的增溶剂和稳定剂的作用。
57.在一些方面,干粉制剂包含β-环糊精。在一些方面,干粉制剂包含β-环糊精衍生物,例如2-羟丙基-β-环糊精(“hpβcd”)、甲基-β-环糊精(“mβcd”)或磺丁基醚β-环糊精(“sbeβcd”),或其组合。例如,干粉制剂包含hpβcd。在一些方面,干粉制剂包含β-环糊精和β-环糊精衍生物的组合。可以使用其他类型的环糊精,诸如α-环糊精和γ-环糊精以及它们的衍生物,只要它们与所用药物相容即可。
58.干粉制剂中的β-环糊精和/或β-环糊精衍生物可以改善类视黄醇和/或类视黄醇衍生物的药物溶解速率,这可以导致更快的体内药物吸收。例如,在将干粉制剂吸入或气管内给予受试者诸如哺乳动物后,达到受试者肺中类视黄醇和/或类视黄醇衍生物的最大浓度的时间比在对照中达到类视黄醇和/或类视黄醇衍生物的最大浓度的时间短至少2倍、短至少3倍、短至少4倍、短至少5倍或短至少6倍。对照是与受试者相同的物种,其以与干粉制剂中相同量的类视黄醇和/或类视黄醇衍生物给药,但以非配制形式通过腹膜内给药。
59.通常,β-环糊精衍生物可以通过用有机官能团对β-环糊精的(多个)羟基基团进行化学修饰获得,即通过用有机官能团取代(多个)羟基基团的(多个)氢获得。例如,β-环糊精上有21个羟基基团,其是与有机官能团反应的21个取代位点。β-环糊精衍生物可以具有不同的取代度。术语“取代度”是指被有机官能团修饰的羟基基团的数目。例如,6的取代度意味着β-环糊精上的6个羟基基团被有机基团修饰。
60.用于干粉制剂的β-环糊精衍生物的取代度可以为1至21、1至20、1至19、1至18、1至17、1至16、1至15、1至14、1至13、1至12、1至11、1至10、1至9、1至8、1至7、1至6、2至21、2至20、
2至19、2至18、2至17、2至16、2至15、2至14、2至13、2至12、2至11、2至10、2至9、2至8、2至7、2至6、3至21、3至20、3至19、3至18、3至17、3至16、3至15、3至14、3至13、3至12、3至11、3至10、3至9、3至8、3至7、3至6、4至21、4至20、4至19、4至18、4至17、4至16、4至15、4至14、4至13、4至12、4至11、4至10、4至9、4至8、4至7、5至21、5至20、5至19、5至18、5至17、5至16、5至15、5至14、5至13、5至12、5至11、5至10、5至9、5至8、或5至7、诸如6至7。
61.用于干粉制剂的β-环糊精衍生物的分子量可以为约1000g/mol至约2500g/mol,诸如约1500g/mol至约2500g/mol或约1000g/mol至约2000g/mol。例如,用于干粉制剂的β-环糊精衍生物是hpβcd、mβcd或sbeβcd,或其组合,并且hpβcd、mβcd和sbeβcd各自的分子量为约1000g/mol至约2500g/mol,诸如约1500g/mol至约2500g/mol或约1000g/mol至约2000g/mol。β-环糊精衍生物可以是阴离子、阳离子或非离子分子。
62.1.示例性β-环糊精衍生物
63.适合用于干粉制剂的示例性β-环糊精衍生物可以具有式i的结构。
[0064][0065]
其中每个r独立地为氢、未取代的烷基基团、取代的烷基基团、未取代的杂烷基基团、取代的杂烷基基团、醛基团或任选地包含未取代的烷基基团、取代的烷基基团、未取代的杂烷基基团、取代的杂烷基基团、卤素、未取代的烯基基团、取代的烯基基团、羟基基团、醚基团、氨基基团、羧酸酯基团或酰胺基团的酰基基团,其中取代度可以是上述范围中的任意一个,诸如1至21、2至20、3至19、4至18、5至15、2至10、3至9、5至8、6至9、或6至8。
[0066]
在式i的一些方面,每个取代的r的取代基独立地为磺基基团、羟基基团、未取代的烷基基团、取代的烷基基团、未取代的杂烷基基团、取代的杂烷基基团、卤素、未取代的亚烷基基团、未取代的烯基基团、取代的烯基基团、醚基团、氨基基团、羧酸酯基团或酰胺基团。
[0067]
在式i的一些方面,每个r独立地是氢、未取代的烷基基团、取代的烷基基团或任选地包含未取代的烷基基团或取代的烷基基团的酰基基团,并且其中取代的烷基基团的取代基独立地为磺基基团、羟基基团、羧酸酯基团、氨基基团或酰胺团基。
[0068]
在式i的一些方面,每个r独立地为氢、未取代的烷基基团、取代的烷基基团或任选地包含未取代的烷基基团或取代的烷基基团的酰基基团(例如甲酰基基团、乙酰基基团、丙酰基基团等),其中取代的烷基基团的取代基独立地为磺基基团、羟基基团、羧酸酯基团、氨基基团或酰胺基团,和
[0069]
其中烷基基团(即未取代的烷基基团或取代的烷基基团)是直链c
1-c
30
烷基、支链c
4-c
30
烷基、环状c
3-c
30
烷基、直链c
1-c
30
烷基或支链c
4-c
30
烷基、直链c
1-c
30
烷基或环状c
3-c
30
烷基、支链c
4-c
30
烷基或环状c
3-c
30
烷基、直链c
1-c
20
烷基、支链c
4-c
20
烷基、环状c
3-c
20
烷基、直链c
1-c
20
烷基或支链c
4-c
20
烷基、支链c
4-c
20
烷基或环状c
3-c
20
烷基、直链c
1-c
20
烷基或环状c
3-c
20
烷基、直链c
1-c
10
烷基、支链c
4-c
10
烷基、环状c
3-c
10
烷基、直链c
1-c
10
烷基或支链c
4-c
10
烷基、支链c
4-c
10
烷基或环状c
3-c
10
烷基、直链c
1-c
10
烷基或环状c
3-c
10
烷基、直链c
1-c6烷基、支链c
4-c6烷基、环状c
3-c6烷基、直链c
1-c6烷基或支链c
4-c6烷基、支链c
4-c6烷基或环状c
3-c6烷基、直链c
1-c6烷基或环状c
3-c6烷基、直链c
1-c5烷基、支链c
4-c5烷基、环状c
3-c5烷基、直链c
1-c5烷基或支链c
4-c5烷基、支链c
4-c5烷基或环状c
3-c5烷基、直链c
1-c5烷基或环状c
3-c5烷基、直链c
1-c4烷基、支链c4烷基、环状c
3-c4烷基、直链c
1-c4烷基或环状c
3-c4烷基,诸如直链c
1-c5烷基基团、c
1-c4烷基基团、c
1-c3烷基基团或c
1-c2烷基基团(例如甲基基团、乙基基团、丙基基团或丁基基团)。
[0070]
在式i的一些方面,每个r独立地为氢、甲基基团、乙基基团、丙基基团、丁基基团、羟烷基基团(例如,羟甲基基团、1-羟乙基基团、2-羟乙基基团、1-羟丙基基团、2-羟丙基基团、3-羟丙基基团、1-羟丁基基团、2-羟丁基基团、3-羟丁基基团、4-羟丁基基团等)、磺烷基基团(例如,磺甲基基团、1-磺乙基基团、2-磺乙基基团、1-磺丙基基团、2-磺丙基基团、3-磺丙基基团、1-磺丁基基团、2-磺丁基基团、3-磺丁基基团、4-磺丁基基团等)、甲酰基基团、乙酰基基团或丙酰基基团,其中取代度为1至12、2至15、2至12、2至10、4至10、5至8、6至9或6至8。
[0071]
在式i的一些方面,β-环糊精衍生物是hpβcd、mβcd或sbeβcd,并且其中取代度为2至15、2至12、2至10、4至10、5至8、6至9、6至8或6至7,诸如以及albers和muller,“cyclodextrin derivatives in pharmaceutics,”critical reviews in therapeutic drug carriersystemns,12(4):311-337(1995)中描述的那些。
[0072]
在一些方面,干粉制剂可以包含两种或更多种不同种类的β-环糊精衍生物。不同的种类可以是用相同(多个)官能团以不同取代度修饰的β-环糊精衍生物,用不同(多个)官能团以相同取代度修饰的β-环糊精衍生物,或用不同(多个)官能团和以不同取代度修饰的β-环糊精衍生物。
[0073]
例如,干粉制剂可以包含两种或更多种β-环糊精衍生物,其中两种或更多种β-环糊精衍生物中的每一种都用相同的官能团以不同于其他的取代度修饰。例如,干粉制剂可以包含两种或更多种β-环糊精衍生物,其中两种或更多种β-环糊精衍生物中的每一种都被与其他不同的官能团修饰,并且取代度与其他的相同或不同。
[0074]
2.β-环糊精及其衍生物的量
[0075]
通常,制剂中β-环糊精或β-环糊精衍生物的量,或β-环糊精和β-环糊精衍生物的总量为类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物的总重量的至少20重量%,诸如20重量%至90重量%、20重量%至85重量%、20重量%至80重量%、20重量%至75重量%、20重量%至70重量%、20重量%至65重量%、20重量%至60重量%、20重量%至55重量%、20重量%至50重量%、25重量%至90重量%、25重量%至85重量%、25重量%至80重量%、25重量%至75重量%、25重量%至70重量%、25重量%至65重量%、25重量%至60重量%、25重量%至55重量%、25重量%至50重量%、30重量%至90重量%、30重
量%至85重量%、30重量%至80重量%、30重量%至75重量%、30重量%至70重量%、30重量%至65重量%、30重量%至60重量%、30重量%至55重量%、30重量%至50重量%、35重量%至90重量%、35重量%至85重量%、35重量%至80重量%、35重量%至75重量%、35重量%至70重量%、35重量%至65重量%、35重量%至60重量%、35重量%至55重量%、35重量%至50重量%、40重量%至90重量%、40重量%至85重量%、40重量%至80重量%、40重量%至75重量%、40重量%至70重量%、40重量%至65重量%、40重量%至60重量%、40重量%至55重量%、40重量%至50重量%、45重量%至90重量%、45重量%至85重量%、45重量%至80重量%、45重量%至75重量%、45重量%至70重量%、45重量%至65重量%、45重量%至60重量%、45重量%至55重量%、50重量%至90重量%、50重量%至85重量%、50重量%至80重量%、50重量%至75重量%、50重量%至70重量%、50重量%至65重量%、或50重量%至60重量%。例如,制剂中β-环糊精或β-环糊精衍生物的量,或β-环糊精和β-环糊精衍生物的总量可以为类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物的总重量的20重量%至90重量%。术语“β-环糊精和β-环糊精衍生物的总量”是指干粉制剂中相对于类视黄醇和/或类视黄醇衍生物以及β-环糊精和β-环糊精衍生物的重量总和的β-环糊精和β-环糊精衍生物的重量总和。
[0076]
在一些方面,干粉制剂包含具有单取代度或不同取代度的hpβcd,且具有单取代度的hpβcd的量或具有不同取代度的hpβcd的总量为类视黄醇和/或类视黄醇衍生物和hpβcd的总重量的至少20重量%,20重量%至90重量%、20重量%至85重量%、20重量%至80重量%、20重量%至75重量%、20重量%至70重量%、20重量%至65重量%、20重量%至60重量%、20重量%至55重量%、20重量%至50重量%、25重量%至90重量%、25重量%至85重量%、25重量%至80重量%、25重量%至75重量%、25重量%至70重量%、25重量%至65重量%、25重量%至60重量%、25重量%至55重量%、25重量%至50重量%、30重量%至90重量%、30重量%至85重量%、30重量%至80重量%、30重量%至75重量%、30重量%至70重量%、30重量%至65重量%、30重量%至60重量%、30重量%至55重量%、30重量%至50重量%、35重量%至90重量%、35重量%至85重量%、35重量%至80重量%、35重量%至75重量%、35重量%至70重量%、35重量%至65重量%、35重量%至60重量%、35重量%至55重量%、35重量%至50重量%、40重量%至90重量%、40重量%至85重量%、40重量%至80重量%、40重量%至75重量%、40重量%至70重量%、40重量%至65重量%、40重量%至60重量%、40重量%至55重量%、40重量%至50重量%、45重量%至90重量%、45重量%至85重量%、45重量%至80重量%、45重量%至75重量%、45重量%至70重量%、45重量%至65重量%、45重量%至60重量%、45重量%至55重量%、50重量%至90重量%、50重量%至85重量%、50重量%至80重量%、50重量%至75重量%、50重量%至70重量%、50重量%至65重量%、或50重量%至60重量%。当干粉制剂包含不同取代度的hpβcd时,每种物质的量可以在合适的范围内以提供上述范围。
[0077]
在一些方面,干粉制剂包含具有单取代度或不同取代度的mβcd,并且具有单取代度的mβcd的量或具有不同取代度的mβcd的总量可以在任何上述hpβcd的浓度范围内。当干粉制剂包含不同取代度的mβcd时,每种物质的量可以在合适的范围内以提供上述范围。
[0078]
在一些方面,干粉制剂包含具有单取代度或不同取代度的sbeβcd,并且具有单取代度的sbeβcd的量或具有不同取代度的sbeβcd的总量可以在任何上述hpβcd的范围内。当
干粉制剂包含不同取代度的sbeβcd时,每种物质的量可以在合适的范围内以提供上述范围。
[0079]
c.药学上可接受的赋形剂
[0080]
干粉制剂可以包含药学上可接受的赋形剂,任选地包含多于一种药学上可接受的赋形剂。在一些方面,干粉制剂不包含任何另外的药学上可接受的赋形剂。
[0081]
可用于干粉制剂的示例性药学上可接受的赋形剂包括但不限于氨基酸、肽、脂质(例如,脂肪酸、脂肪酸酯、类固醇)、蛋白质、螯合剂(例如,edta)、盐、掩味剂、阳离子、非生物或生物聚合物和另外的糖及其组合。优选的赋形剂包括糖或糖醇,诸如乳糖、海藻糖、甘露醇。kibbe等人,“药物赋形剂手册(handbook ofpharmaceutical excipients)”,第3版,2000年中描述了可用于干粉制剂的合适的药学上可接受的赋形剂的实例。在一些方面,干粉制剂不包含任何另外的糖。
[0082]
可包含在干粉制剂中的合适氨基酸的实例包括但不限于丙氨酸、甘氨酸、精氨酸、组氨酸、谷氨酸、天冬酰胺、半胱氨酸、亮氨酸、赖氨酸、异亮氨酸、缬氨酸、色氨酸、蛋氨酸、脯氨酸、苯丙氨酸、酪氨酸、瓜氨酸、l-天冬氨酰-l-苯丙氨酸甲酯(阿斯巴甜)、三甲基乙酸铵(甜菜碱)等。
[0083]
可包含在干粉制剂中的合适蛋白质赋形剂的实例包括但不限于白蛋白(人或重组来源的)、明胶、酪蛋白、血红蛋白等。
[0084]
可包含在干粉制剂中的合适聚合物的实例包括但不限于聚乙烯吡咯烷酮、衍生纤维素,诸如羟甲基乙基纤维素、羟乙基乙基纤维素、羟丙基乙基纤维素、聚乙二醇和聚丙二醇。
[0085]
可包含在干粉制剂中的另外的糖的实例可以是单糖、二糖、寡糖或多糖,或其组合。单糖的实例是果糖、麦芽糖、半乳糖、葡萄糖、d-甘露糖、山梨糖等。二糖的实例是乳糖、蔗糖、海藻糖、纤维二糖等。糖醇的实例是甘露糖醇、木糖醇、麦芽糖醇、半乳糖醇、阿拉伯糖醇、阿东糖醇、乳糖醇、山梨糖醇(葡萄糖醇)、吡喃山梨糖醇、纤维醇、肌醇等。寡糖的实例是其他类型的环糊精(例如,α-环糊精、γ-环糊精及其衍生物)、麦芽糖糊精和果胶。
[0086]
在一些方面,干粉制剂不包含任何另外的糖,诸如甘露醇、海藻糖、1,4o-连接的蔗糖或1,4o-连接的蔗糖衍生物,或右旋糖酐,或其组合。在一些方面,干粉制剂不包含甘露醇或海藻糖,或甘露醇和海藻糖的组合。在一些方面,干粉制剂不包含1,4o-连接的蔗糖或1,4o-连接的蔗糖衍生物,或其组合。在一些方面,干粉制剂不含右旋糖酐。在一些方面,干粉制剂不包含甘露醇、海藻糖、1,4o-连接的蔗糖、1,4o\连接的蔗糖衍生物和右旋糖酐中的任何一种。
[0087]
可包含在干粉制剂中的盐的实例是无机盐,诸如氯化物、硫酸盐、磷酸盐、二磷酸盐、氢溴酸盐和硝酸盐,以及有机盐,诸如苹果酸盐、马来酸盐、富马酸盐、酒石酸盐。琥珀酸盐、乙基琥珀酸盐、柠檬酸盐、醋酸盐、乳酸盐、甲磺酸盐、苯甲酸盐、抗坏血酸盐、对甲苯磺酸盐、棕榈酸盐、水杨酸盐、硬脂酸盐、依托酸盐(estolate)、葡庚糖酸盐和乳糖醛酸盐。这些盐可以同时包含药学上可接受的阳离子,诸如钠、钾、钙、铝、锂和铵。
[0088]
药学上可接受的赋形剂的量或两种或更多种药学上可接受的赋形剂的总量可以为干粉制剂的0.1重量%至20重量%、0.1重量%至15重量%、1重量%至12重量%、1重量%至10重量%、1重量%至15重量%、2重量%至20重量%、2重量%至15重量%、2重量%至10
重量%、3重量%至20重量%、3重量%至15重量%、或3重量%至10重量%。术语“两种或更多种药学上可接受的赋形剂的总量”是指相对于干粉制剂的总重量的两种或更多种药学上可接受的赋形剂的重量之和。
[0089]
d.另外的活性剂
[0090]
干粉制剂可以包含另外的活性剂,任选地包含多于一种另外的活性剂。可包含在干粉制剂中的另外的活性剂可以是治疗剂、营养剂、预防剂或诊断剂,或其组合,诸如抗炎剂和抗病毒剂。
[0091]
可包含在干粉制剂中的抗炎剂和抗病毒剂的实例包括但不限于曲安奈德、氟轻松、泼尼松龙、地塞米松、氯替泼诺(loteprendol)、氟米龙、酮咯酸、奈帕芬胺、双氯芬酸、利巴韦林、法匹拉韦、瑞德西韦、氯法齐明、n\(对戊基肉桂酰基)邻氨基苯甲酸及其组合。
[0092]
所需的另外的活性剂的量将根据受试者的需要因受试者而异。
[0093]
e.递送系统
[0094]
公开了用于递送干粉制剂的系统。
[0095]
在一些方面,所述系统包括吸入器和干粉制剂。干粉制剂可以是包含单个单位剂量的类视黄醇和/或类视黄醇衍生物的单位剂型。供选择地,干粉制剂可包含多个剂量的类视黄醇和/或类视黄醇衍生物。
[0096]
在一些方面,所述系统包括鼻用装置和由干粉制剂和合适的溶剂形成的溶液或悬浮液。用于形成溶液或悬浮液的干粉制剂可以是单位剂型,其包含单个单位剂量的类视黄醇和/或类视黄醇衍生物。供选择地,用于形成溶液或悬浮液的干粉制剂可包含多个剂量的类视黄醇和/或类视黄醇衍生物。
[0097]
1.单位剂型
[0098]
在一些方面,将干粉制剂预先包装在胶囊或可更换套件中,然后装载至吸入器的是单位剂型,即,所述单位剂型包含待递送至受试者的(多个)肺的单个单位剂量的类视黄醇和/或类视黄醇衍生物。
[0099]
在一些方面,对于鼻内使用,可以在使用前使用合适的溶剂将干粉制剂配制成水溶液或悬浮液,然后可以将水溶液或悬浮液装载至鼻用装置中作为单位剂型,即,所述单位剂型包含待递送至受试者的上呼吸道的单个单位剂量的类视黄醇和/或类视黄醇衍生物。适合用于形成作为滴剂或作为喷雾用于鼻内给药的水溶液或悬浮液的溶剂的实例包括但不限于蒸馏水、去离子水、纯水或超纯水、盐水、磷酸盐缓冲盐水(pbs)、林格氏液溶液和等渗氯化钠,及其组合。通常,溶剂的选择取决于用于给药的装置。例如,常用的粘膜雾化装置适合水溶液和悬浮液。超纯水是低浓度的优选溶剂。当浓度高于其溶解度时,可能会形成悬浮液。
[0100]
这样的水溶液或悬浮液相对于鼻分泌物可以是等渗的并且具有大约相同的ph,例如约ph 4.0至约ph 7.4或ph 6.0至ph 7.0。缓冲液应该是生理相容的,并且简单地举例来说,包括磷酸盐缓冲液。本领域技术人员可以容易地确定用于鼻和/或上呼吸道给药的无害水溶液的合适的盐含量和ph。水性悬浮液可包括悬浮剂,诸如纤维素衍生物、海藻酸钠、聚乙烯吡咯烷酮和黄蓍胶,以及润湿剂,诸如卵磷脂。适合水性悬浮液的防腐剂包括对羟基苯甲酸乙酯和对羟基苯甲酸正丙酯。
[0101]
干粉制剂的单位剂型中的类视黄醇和/或类视黄醇衍生物的合适的单位剂量可以
为约0.1mg至约50mg、约0.5至约50mg或约1至约50mg。例如,预先包装在胶囊中的类视黄醇和/或类视黄醇衍生物的合适单位剂量为约0.1mg至约50mg、约0.5至约50mg或约1至约50mg。
[0102]
供选择地,干粉制剂或由干粉制剂形成的溶液或悬浮液可以包含多个单位剂量的类视黄醇和/或类视黄醇衍生物,其可以装载至计量吸入器或鼻用装置的储器中,使得每次给药可以向受试者递送单个剂量。
[0103]
使用类视黄醇和/或类视黄醇衍生物的治疗方案可包括以单个单位剂量或多个单位剂量(诸如在一天中的适当时间间隔给予两个、三个、四个、五个或六个或更多个单位剂量)每天每千克接受者体重给予约0.1mg至约100mg的类视黄醇和/或类视黄醇衍生物。
[0104]
2.吸入器
[0105]
a.干粉吸入器
[0106]
通常,可与干粉制剂一起使用的合适吸入器是干粉吸入器(“dpi”)。可以将干粉制剂预先包装在胶囊或可更换套件中,然后装载至吸入器中。供选择地,可将干粉制剂直接装载至吸入器的储器中。
[0107]
dpi是呼吸致动的,因此避免了如在pmdi的情况下吸气与致动协调的问题。示例性干粉吸入器类型包括吸入器中的单个胶囊单位剂量、吸入器中的单个一次性单位剂量、吸入器中的可更换套件中的多个单位剂量和吸入器中的储器中的多个单位剂量。
[0108]
干粉吸入器可以携带一个或多个胶囊,每个胶囊含有单位剂量的单位剂型的干粉制剂。例如,dpi可以是单个单位剂量dpi,其包含一个胶囊,该胶囊装载有一个单位剂量的单位剂型的干粉制剂,其中该胶囊可以是重复装载的或一次性使用的。供选择地,dpi可以是包含两个或更多个胶囊的多个单位剂量dpi,其中两个或更多个胶囊中的每一个都装载有一个单位剂量的单位剂型的干粉制剂,并且胶囊可以是重复装载的或一次性使用的。
[0109]
干粉吸入器可包含具有多个剂量的单位剂型的干粉制剂的可更换套件,诸如可更换的泡罩包装、筒、条或轮。例如,dpi可以是多个单位剂量dpi,其包含预先包装有几个单位剂量的单位剂型的干粉制剂的箔-箔泡罩,其中每个单位剂量在空间上与其他单位剂量分开(即,离散的单位剂量)。
[0110]
干粉吸入器可包含储器,该储器具有容纳多个单位剂量的单位剂型的干粉制剂的容积。例如,dpi可以是多个单位剂量dpi,其包含预先计量的筒,该筒包含多个单位剂量的单位剂型的干粉制剂。在一些方面,dpi可以是多个单位剂量dpi,其包含在储器中含有多个单位剂量的类视黄醇和/或类视黄醇衍生物的干粉制剂。对于这些dpi,它可以包括预先计量的阀,使得每次给药可以将一个单位剂量递送至受试者。
[0111]
适用于干粉制剂的dpi可以是第7,305,986号美国专利和第2004/0182387号美国专利申请公开文件中描述的那些。适用于干粉制剂的示例性市售多个剂量dpi包括但不限于(glaxo group limited corp,brentford,middlesex united kingdom)、(glaxo group limited corp,brentford,middlesex united kingdom)、(gsk,也描述于wo05/14089)、(vectura,也描述于wo05/37353)、(valois,也描述于wo03/77979)和(merck,也描述于wo93/00123,wo94/14492和wo97/30743)。适用于干粉制剂的示例性市售
单个剂量dpi包括但不限于(novartis ag corporation switzerland,basel,switzerland)和(novartis ag corporation switzerland,basel,switzerland)。适用于干粉制剂的其他示例性dpi包括但不限于高阻力osmohale
tm
吸入器、(boehringer ingelheim pharma kg,ingelheim am rhein,fed rep germany)、direct(direct-haler a/s corp denmark,odense sv denmark)、(glaxo group limited corp,brentford,middlesex united kingdom)、(astra aktiebolag corp.,sodertalie sweden)、(orion corporation,espoo finland)和nexthaler(lavorini等人.multidisciplinary respiratory medicine,12:11(2017))。
[0112]
3.鼻用装置
[0113]
可与由干粉制剂形成的溶液或悬浮液一起使用以滴剂或喷雾形式递送类视黄醇和/或类视黄醇衍生物的合适鼻用装置包括但不限于计量剂量喷雾泵、雾化器、注射器、球、罐、加压容器、喷雾罐或喷雾器。干粉制剂和溶剂可以预先包装在单独的容器中,在使用前混合以制备溶液或悬浮液,然后装载至鼻用装置中。供选择地,干粉制剂可以作为预先包装在容器中的溶液或悬浮液直接提供,用于装载至鼻用装置和预先装载至鼻用装置。
[0114]
f.颗粒性质
[0115]
干粉制剂的雾化性能可以通过干粉制剂颗粒的性质,诸如质量中值空气动力学直径(“mmad”)、体积平均直径(“vmd”)、细颗粒分数(“fpf”)、>9μm的颗粒分数(用于鼻内给药)和排放分数(“ef”)来评估。术语“细颗粒分数”或“fpf”是指mmad小于5μm的颗粒相对于制剂中颗粒总重量的重量百分比。术语“>9μm的颗粒分数”或“fp9”是指mmad大于9μm的颗粒相对于制剂中颗粒总重量的重量百分比。术语“ef”是指在分散事件后离开吸入器的粉末分数,表示为吸入器递送的剂量与标称剂量的比值,所述标称剂量即分散前放入吸入器的每单位剂量粉末的质量。术语“体积平均直径”或“vmd”是指在颗粒的90%累积体积处的等效球形体积直径。
[0116]
可以使用本领域已知的方法测定干粉制剂中颗粒的mmad、vmd和fpf。这些包括动态光散射、空气动力学粒径测量、光学显微镜、激光衍射仪、扫描电子显微镜(“sem”)、简化的安德森级联冲击器(“aci”)和/或低温透射电子显微镜(“cryo-tem”)。例如,vmd可以通过激光衍射仪和/或sem测量。例如,mmad和fpf可以通过由高电阻osmohale
tm
吸入器分散粉末测量,并且粉末通过下一代冲击器(ngi)评估,例如冲击器以45l/min运行5.4s,60l/min运行4s,或90l/min运行2.7s。例如,mmad和fpf可以通过由分散粉末测量,并且粉末通过以90l/min运行约2.7s的下一代冲击器(ngi)评估。通常,ngi和时间应根据接受的体积进行调整。ph.eur建议4升空气;fda和usp建议2升空气,因此2至4升是可接受和优选的。
[0117]
在一些方面,干粉制剂的颗粒具有有利于有效肺沉积和滞留的空气动力学性质。例如,干粉制剂颗粒的mmad<5μm、<4μm、<3.5μm、<3μm、<2.5μm或<2μm;级联冲击器研究中的fpf>40%、>45%、>50%、>55%、>60%或≥65%;和/或ef>65%、>70%、>75%、>80%、>85%、>90%、>92%或>95%。
[0118]
在一些方面,干粉制剂的颗粒具有有利于通过鼻内给药在上呼吸道中的有效沉积
和滞留的空气动力学性质。例如,干粉制剂颗粒的mmad>9μm、>9.5μm、>10μm或>10.5μm;aci研究中的fp9>40%、>45%、>50%、>55%或>60%;和/或ef>85%、>90%或>95%。
[0119]
另外的颗粒性质,诸如在肺和血浆中的溶解速率和生物利用度,可以分别通过溶解研究和药代动力学研究测定。具体的示例性测量条件在以下实施例中进行了描述。
[0120]
g.示例性制剂
[0121]
示例性干粉制剂包含喷雾干燥或喷雾冷冻干燥的颗粒,该颗粒包含hpβcd和他米巴罗汀(结构如下所示),其中hpβcd与他米巴罗汀的重量比为1∶4至9∶1、1∶3至9∶1、1∶2至9∶1或1∶1至9∶1。
[0122]
对于这些干粉制剂,hpβcd的取代度可以为2至15、2至12、2至10、4至10、5至8、6至9、6至8或6至7。例如,hpβcd具有以下结构。
[0123][0124]
这些干粉制剂可以在预先包装在胶囊或可更换套件中的单位剂型中,然后装载至干粉吸入器中,或者在使用前配制成水溶液或悬浮液,然后装载至鼻用装置中。供选择地,这些干粉制剂或由这些干粉制剂形成的溶液或悬浮液可包含多个剂量的他米巴罗汀并且
可装载至干粉吸入器或鼻用装置的储器中。
[0125]
这些干粉制剂颗粒的mmad可以为<5μm、<4μm、<3.5μm、<3μm、<2.5μm或<2μm;级联冲击器研究中的fpf>40%、>45%、>50%、>55%、>60%或≥65%;和/或ef>65%、>70%、>75%、>80%、>85%、>90%、>92%或>95%。
[0126]
供选择地,这些干粉制剂颗粒的mmad可以为>9μm、>9.5μm、>10μm或>10.5μm;aci研究中的fp9>40%、>45%、>50%、>55%或>60%;和/或ef>85%、>90%或>95%。
[0127]
这些干粉制剂表现出更快的他米巴罗汀吸收和改善的他米巴罗汀体内生物利用度。例如,在将干粉制剂吸入或气管内给予受试者诸如哺乳动物后,递送至受试者肺的他米巴罗汀的最大浓度(“c
max”)比递送至对照的肺的他米巴罗汀的最大浓度高至少10倍、高至少15倍、高至少20倍、高至少25倍、高至少30倍或高至少35倍;受试者的肺中他米巴罗汀的c
max
比sars-cov-2的ec
50
高至少40倍或高至少45倍,比mers-cov的ec
50
高至少800倍,和/或比h1n1的ec
50
高至少150倍。另外,在受试者的肺中达到他米巴罗汀最大浓度的时间(“t
max”)比对照中达到他米巴罗汀最大浓度的时间短至少2倍、短至少3倍、短至少4倍、短至少5倍或短至少6倍。对照是与受试者相同的物种,其以与干粉制剂中相同量的他米巴罗汀给药,但以非配制形式通过腹膜内给药。通过体内药代动力学研究测量的更具体的示例性c
max
和t
max
值在以下实施例中描述。
[0128]
实施例中描述了更具体的示例性干粉制剂。
[0129]
iii.制备干粉制剂的方法
[0130]
公开了制备干粉制剂的方法。通常,所述方法包括(i)在溶剂中混合类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物,以及任选的药学上可接受的赋形剂和/或另外的活性剂以形成液体供给料;(ii)将液体供给料喷雾干燥或喷雾冷冻干燥以形成含有类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物,以及任选的药学上可接受的赋形剂和/或另外的活性剂的颗粒。
[0131]
通常,步骤(ii)之后的颗粒的产率是至少40重量%、至少50重量%、至少60重量%、至少65重量%、至少70重量%、至少75重量%、至少80重量%、至少85重量%、至少90重量%、约40重量%至约95重量%、约55重量%至约95重量%、约55重量%至约95重量%、约60重量%至约95重量%、或约65重量%至约95重量%。颗粒的产率是相对于液体供给料中成分的总重量所制造的颗粒的重量。“成分的总重量”是指类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物的总重量,并且任选地还包括溶剂中药学上可接受的赋形剂、另外的活性剂和/或盐的重量。
[0132]
如上所述,通过喷雾干燥或喷雾冷冻干燥在步骤(ii)中形成的颗粒具有有利于有效的肺或上呼吸道沉积和滞留的空气动力学性质。另外,当溶剂在冷冻干燥过程中升华时,冷冻晶体从固态转变为气相,在所得固体颗粒中留下孔隙。多孔结构可以增加颗粒的表面积以实现药物的快速溶解。
[0133]
a.形成液体供给料
[0134]
通常,在喷雾干燥或喷雾冷冻干燥之前,通过在溶剂中混合类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物以及任选的药学上可接受的赋形剂和/或的另外的活性剂制备液体供给料。通常,溶剂是水性溶剂。在一些方面,液体供给料仅包含水性
溶剂中的类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物。
[0135]
由类视黄醇和/或类视黄醇衍生物与β-环糊精和/或β-环糊精衍生物形成的复合物可溶于水性溶剂。例如,由类视黄醇和/或类视黄醇衍生物与β-环糊精和/或β-环糊精衍生物形成的复合物在室温(r.t.),即在大气压下温度为约20℃至约25℃下具有至少约1.5g/100ml的水性溶剂的溶解度。对于在水溶液中溶解度较低的类视黄醇和类视黄醇衍生物(诸如他米巴罗汀),并且环糊精不能对其提供足够的增溶效果,可以使用不同的溶剂。例如,可以使用叔丁醇(tba)(它很有用,因为它在25℃时具有高凝固点,易于升华)。tba可作为溶剂以首先溶解他米巴罗汀。然后可以将他米巴罗汀/tba溶液与环糊精水溶液混合,在喷雾冷冻干燥之前可以将混合溶液搅拌4小时以实现充分相互作用。在喷雾干燥中,tba可以用乙醇(它的沸点低,易于蒸发)代替。有机溶剂只要在干燥后可以完全去除(或去除至ich规定的毒性限度以下),就可以用于供给料溶液。当药学上可接受的赋形剂和/或另外的活性剂在溶剂中混合时,它们可以溶解或悬浮在溶剂中。例如,药学上可接受的赋形剂和/或另外的活性剂可以至少与类视黄醇和/或类视黄醇衍生物一样可溶于溶剂中或不溶于溶剂中。
[0136]
用于制备液体供给料的合适溶剂包括但不限于水和水性缓冲剂,诸如磷酸钠、磷酸钾、乙酸钠、乙酸钾、柠檬酸钠、柠檬酸钾、琥珀酸钠、琥珀酸钾和碳酸氢铵和碳酸盐及其组合。通常,适合制备液体供给料的水性缓冲液的摩尔浓度为约1mm至约2m、约2mm至约1m、约10mm至约0.5m或50至200mm并且ph为约1至约10、约3至约8或约5至约7。
[0137]
溶剂中溶质的浓度,即溶剂中类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物的总量可以为约0.5mg/ml至约200mg/ml、约1mg/ml至约200mg/ml、约5mg/ml至约200mg/ml、约10mg/ml至约200mg/ml、约1mg/ml至约200mg/ml、约1mg/ml至约200mg/ml、约1mg/ml至约200mg/ml、约1mg/ml至约100mg/ml或约10mg/ml至约100mg/ml,诸如约50mg/ml,用于喷雾干燥或喷雾冷冻干燥。
[0138]
然后使步骤(i)中制备的液体供给料经受喷雾干燥或喷雾冷冻干燥过程。
[0139]
b.喷雾干燥
[0140]
喷雾干燥是通过用热气体快速干燥从液体或液体中的分散体制造含有颗粒的干粉的过程。该过程可以快速产生(即毫秒级)具有可控粒度、形态、密度和表面组成的吸入颗粒。
[0141]
通常,在步骤(ii)中,可将步骤(i)中制备的液体供给料喷雾干燥以形成本文公开的干粉制剂。喷雾干燥过程可以使用用于制备用于通过吸入给药的药物的喷雾干燥颗粒的常规设备进行。示例性的市售喷雾干燥器包括由buchi ltd.、niro corp、bichi、niro yamato、okawara、kakoki制造的那些。
[0142]
通常,液体供给料通过喷嘴,诸如双流体喷嘴或超声喷嘴喷雾至使溶剂蒸发并将干燥的产品输送至收集器的过滤的暖空气流中。然后用溶剂净化废空气。可以调节喷雾干燥器的操作条件,诸如进口温度和出口温度、供给速率、雾化压力、干燥空气流动速率和喷嘴配置,以产生所得到的干颗粒的所需的粒度、水分含量和产率。鉴于本文的教导,适当设备和处理条件的选择在本领域技术人员的能力范围内。
[0143]
喷雾干燥步骤的示例性设置如下:空气入口温度为约60℃至约220℃、约80℃至约220℃、约60℃至约200℃、约60℃至约180℃、约80℃至约200℃、约80℃至约180℃、约80℃
至150℃或约90℃至120℃;空气出口温度为约40℃至约120℃、约50℃至100℃或约50℃至80℃;供给速率为约0.1ml/min至约30ml/min、约0.1ml/min至约25ml/min、约0.1ml/min至约20ml/min、约0.1ml/min至约15ml/min、约0.5ml/min至约30ml/min、约0.5ml/min至约25ml/min、约0.5ml/min至约20ml/min、约0.5ml/min至约15ml/min、约1ml/min至约30ml/min、约1ml/min至约25ml/min、约1ml/min至约20ml/min、约1ml/min至约15ml/min、约1.5ml/min至约15ml/min、约1ml/min至约10ml/min或约1ml/min至约5ml/min;空气流动速率为约100l/h至约1000l/h、约200l/h至约1000l/h、约300l/h至约1000l/h、约400l/h至约1000l/h、约500l/h至约1000l/h、约500l/h至约900l/h、约600l/h至约800l/h或约650l/h至约800l/h;以及任选地,抽吸率高达50%、高达60%、高达70%、高达80%、高达90%或高达100%,例如,100%的抽吸率,即约35m3/h,使用buchi b290喷雾干燥器。然而,这些设置将根据所用设备的类型和所用溶剂系统的性质而变化。在任何情况下,这些和类似方法的使用实现具有适合气溶胶沉积到呼吸道诸如肺或上呼吸道的直径的颗粒的形成。
[0144]
示例性喷雾干燥过程使用b
ü
chib-290喷雾干燥器并具有以下设置:空气入口温度为约90℃至120℃,诸如约100℃;空气出口温度为约50℃至80℃,诸如62℃至67℃;供给速率为约0.1ml/min至30ml/min,诸如约1.5ml/min,空气流动速率为约550l/h至约700l/h,诸如约601l/h,以及抽吸率为100%,即约35m3/h,其中喷雾干燥后颗粒的产率为至少40重量%,诸如约40重量%至约95重量%。
[0145]
c.喷雾冷冻干燥
[0146]
喷雾冷冻干燥是一种类似于喷雾干燥的方法,其中含有类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物,以及任选的药学上可接受的赋形剂和/或另外的活性剂的液体供给料经由喷嘴(例如,双流体喷嘴或超声喷嘴)或旋转盘被引入冷流体中以雾化液体供给料以形成细小液滴。液体或气体的冷流体的温度低于液体供给料的溶剂的冰点。将液体供给料喷雾至冷流体中导致雾化的液滴快速冻结以形成固体颗粒。收集颗粒,然后除去溶剂,通常通过在真空中升华(冻干)除去溶剂。任何已知的技术,诸如mumenthaler等人,int.j.pharmaceutics(1991)72:97-110(1991)和maa等人,phar.res.,16:249(1999)描述的那些,可用于进行喷雾冷冻干燥步骤。可用于喷雾冷冻干燥过程的示例性市售冷冻干燥器包括由labconco corporation、biolab scientific和aapptec制造的那些。
[0147]
例如,喷雾冷冻干燥过程以类似于喷雾干燥的方式进行,不同之处在于不是将液体供给料喷雾至热空气或气体中,而是将液体供给料喷雾至冷液体或冷气体中以形成液体细小液滴。图1b和1c中描绘了示例性设置。通常,使用已知技术将液体供给料雾化成冷流体,例如使用过滤的加压空气经由双流体喷嘴或超声喷嘴进行。冷流体可以是液体,诸如液氮、液氩或导致液体供给料的雾化液滴立即冷冻的任何其他气体。冷流体的温度可以为约\200℃至-100℃、约-200℃至约-80℃,诸如约-200℃(在-196℃的液氮)。在一些方面,当雾化过程发生时,冷液体可以处于搅拌下。图1d显示了说明通过喷雾冷冻干燥制造的球形多孔干粉的示意图。通过喷雾冷冻干燥制造的球形多孔干粉在5000倍放大倍率下的扫描电子显微镜(“sem”)图像如图1e所示。
[0148]
雾化条件,包括雾化空气流动速率、液体流动速率、进料速率、雾化压力和喷嘴配置,可以如上所述进行控制以产生具有合适尺寸的液滴。
[0149]
然后冷冻干燥液体供给料的冷冻液滴以除去冷冻水,留下含有类视黄醇和/或类
视黄醇衍生物和β-环糊精和/或β-环糊精衍生物,以及任选的药学上可接受的赋形剂和/或另外的活性剂的颗粒。这可以使用已知的冻干技术完成,即冷冻为块而不是液滴。在第二个干燥步骤期间可以施加真空。例如,冷冻液滴通过两阶段真空干燥(即初级干燥阶段和次级干燥阶段)任选地在约20mt至约500mt(即约2.666pa至约66.65pa)的压力下进行冷冻干燥。初级干燥阶段可在约\50℃至0℃、约-40℃至0℃或约-40℃至-10℃,诸如-25℃的温度下进行,持续约4小时至约40小时。通过冰升华除去冷冻水。在次级干燥阶段,干燥通常在约5℃至50℃、约10℃至约40℃、约10℃至约30℃,诸如约20℃的温度下,在小于100mt或小于0.15毫巴,诸如约1mt至约100mt、约5mt至约100mt、或约0.001毫巴至约0.15毫巴、约0.01毫巴至约0.1毫巴或约0.005毫巴至约0.5毫巴的压力下进行,持续约5小时至约24小时。所使用的具体喷雾冷冻干燥条件可以根据要制造的颗粒的期望性质进行调整。然后可以使用常规技术和任选地使用填充剂收集所得颗粒。
[0150]
示例性喷雾冷冻干燥过程使用具有两个流体喷嘴的labconco冷冻干燥器并具有以下设置:初级干燥温度为约-40℃至-10℃,诸如-25℃;次级干燥温度为约10℃至40℃,诸如20℃;进料速率为约0.1ml/min至30ml/min,诸如约1.5ml/min;空气流动速率为约550l/h至约700l/h,诸如约601l/h;和干燥压力为约0.001毫巴至约0.15毫巴,诸如约0.14毫巴,其中喷雾干燥后颗粒的产率为至少65重量%,诸如约65重量%至约95重量%。
[0151]
iv.使用干粉制剂的方法
[0152]
a.预防、治疗或改善与呼吸道病毒感染相关的(多种)症状
[0153]
公开了使用干粉制剂或包含装载至吸入器或鼻用装置中的干粉制剂的递送系统用于预防、治疗或改善与受试者的呼吸道病毒感染相关的症状的方法。类视黄醇和类视黄醇衍生物具有广谱抗病毒活性,因此可用于治疗多种呼吸道病毒感染,例如下文描述的那些。
[0154]
通常,所述方法包括(i)向受试者给予本文公开的干粉制剂。通常,在步骤(i)之后,将单位剂量的类视黄醇和/或类视黄醇衍生物递送至受试者的呼吸道,诸如受试者的(多个)肺和/或上呼吸道,以预防、治疗或改善受试者的与呼吸道病毒感染相关的一种或多种症状。
[0155]
干粉制剂可以通过吸入或气管内给药给予。例如,干粉制剂由医学专业人员或待治疗的受试者(即,自我给予)使用吸入器,诸如干粉吸入器给予。在一些方面,干粉制剂可以通过鼻内给药给予。对于干粉制剂的鼻内给药,可在使用前通过将干粉制剂溶解或悬浮于合适的溶剂,诸如上述那些溶剂中将粉末制剂配制成水溶液或悬浮液,然后由医学专业人员或待治疗的受试者使用鼻用装置作为喷雾或滴剂给予。
[0156]
1.待治疗的受试者
[0157]
使用所公开的方法治疗的受试者可以是哺乳动物。待治疗的受试者一般患有或有患有呼吸道病毒感染,诸如严重急性呼吸综合征、中东呼吸综合征、冠状病毒病和由流感病毒引起的流感,及其组合的风险。例如,待治疗的受试者患有或有感染严重急性呼吸综合征冠状病毒(例如sars-cov-2)、中东呼吸综合征冠状病毒(例如mers-cov)和/或流感病毒(例如甲型流感病毒,例如h1n1)的风险。
[0158]
2.重复给药
[0159]
通常,进行给药步骤(i)以将单位剂量的类视黄醇和/或类视黄醇衍生物递送至受
试者的呼吸道。可以重复给药步骤(i)以将多个单位剂量的类视黄醇和/或类视黄醇衍生物递送至受试者。
[0160]
给药步骤(i)可以重复至少一次、至少两次、至少三次、至少五次、至少十次、至少二十次、多达三十次或超过三十次。例如,给药步骤(i)重复一次、两次、三次、五次、十次、十五次、二十次或三十次。
[0161]
重复给予干粉制剂的时间可以是一天至6个月、一天至3个月、一至三十天、一至十天、一至三天、一至两天,或在一天之内。
[0162]
例如,给药步骤(i)重复一次、两次、三次、五次、十次、十五次、二十次或三十次或更多次,持续一天至6个月、一天至3个月、一至三十天、一至十天、一至三天、一至两天,或在一天之内。
[0163]
给药步骤(i)可在前次给药后连续重复。例如,在前一次给药后10分钟内、8分钟内、5分钟内、3分钟内、2分钟内、1分钟内或30秒内重复给药。
[0164]
任选地,给药步骤在不同时间有规律地重复。例如,可以以诸如每小时、每2小时、每5小时、每8小时、每天、每2天、每3天、每5天、每7天、每10天、每两周或每月的频率进行给药。例如,每小时、每2小时、每5小时、每8小时、每天、每2天、每3天、每5天、每7天、每10天、每两周或每月重复给药步骤(i),持续一天至6个月、一天至3个月、一至三十天、一至十天、一至三天、一至两天,或在一天之内。
[0165]
供选择地,可以不规律地重复给药,例如,在第一次给药后1天,然后在第二次给药后2天,然后在第三次给药后5天,然后在第四次给药后7天,然后在第五次给药后30天重复给药。给药之间的时间间隔根据患者的需要确定。
[0166]
3.有效量
[0167]
通常,在单个给药步骤或所有给药步骤之后,将有效量的类视黄醇和/或类视黄醇衍生物递送至受试者的呼吸道,诸如下呼吸道和/或上呼吸道以预防、治疗或改善与受试者的任何一种或多种上述呼吸道病毒感染相关的症状。
[0168]
在一些方面,在单个给药步骤或所有给药步骤之后,递送至受试者呼吸道的有效量的类视黄醇和/或类视黄醇衍生物对于显示受试者抗多种病毒感染,诸如上面描述的那些的预防性保护是有效的。
[0169]
例如,在单个给药步骤或所有给药步骤之后,受试者被严重急性呼吸综合征冠状病毒(例如,sars-cov-2)、中东呼吸综合征冠状病毒(例如,mers-cov)和/或流感病毒(例如,甲型流感病毒,例如h1n1)感染,并且递送至受试者呼吸道的有效量的类视黄醇和/或类视黄醇衍生物对于与对照的肺中的病毒载量相比降低受试者的肺中的病毒载量、与对照的肺损伤程度相比降低肺损伤程度,和/或与对照的病毒蛋白表达相比降低病毒蛋白表达是有效的。对照与受试者为同一物种,其通过与受试者相同给药途径给予未配制的类视黄醇和/或类视黄醇衍生物或溶媒对照,诸如缓冲液,并被与受试者相同的病毒感染。
[0170]
例如,在单个给药步骤或所有给药步骤之后,受试者被严重急性呼吸综合征冠状病毒(例如,sars-cov-2)、中东呼吸综合征冠状病毒(例如,mers-cov)和/或流感病毒(例如,甲型流感病毒,例如h1n1)感染,并且递送至受试者呼吸道的有效量的类视黄醇和/或类视黄醇衍生物对于与对照的肺中的病毒载量相比降低受试者的肺中的病毒载量至少50%,与对照的肺损伤程度相比降低肺损伤程度,诸如降低组织病理学形态学所显示的细支气管
和肺泡细胞浸润的程度,和/或与对照的肺中病毒蛋白的表达相比降低受试者的肺中病毒蛋白,诸如sars-cov-2核衣壳蛋白和/或流感病毒pa蛋白的表达水平至少20%是有效的。用于测量肺中病毒蛋白的病毒载量和表达水平的方法是已知的,例如使用yuan等人,nature communications 2019,10,120中所描述的qrt-pcr、噬菌斑测定和蛋白质印迹。
[0171]
在一些方面,在单个给药步骤或所有给药步骤之后,递送至受试者呼吸道的有效量的类视黄醇和/或类视黄醇衍生物对于在具有病毒感染,诸如如上述任何一种或多种病毒感染的受试者中显示治疗效果是有效的。
[0172]
例如,在单个给药步骤或所有给药步骤之前,受试者被严重急性呼吸综合征冠状病毒(例如,sars-cov-2)、中东呼吸综合征冠状病毒(例如,mers-cov)和/或流感病毒(例如,甲型流感病毒,例如h1n1)感染,并且递送至受试者呼吸道的有效量的类视黄醇和/或类视黄醇衍生物对于与对照的肺中的存活率和/或病毒载量相比提高存活率和/或降低受试者的肺中的病毒载量是有效的。对照与受试者为同一物种,其通过与受试者相同给药途径给予未配制的类视黄醇和/或类视黄醇衍生物或溶媒对照,诸如缓冲液,并被与受试者相同的病毒感染。术语“存活率”是指受试者在被病毒感染后的规定时间段结束时存活的机会。
[0173]
例如,在单个给药步骤或所有给药步骤之前,受试者被严重急性呼吸综合征冠状病毒(例如,sars-cov-2)、中东呼吸综合征冠状病毒(例如,mers-cov)和/或流感病毒(例如,甲型流感病毒,例如h1n1)感染,并且递送至受试者呼吸道的有效量的类视黄醇和/或类视黄醇衍生物对于与对照的存活率相比提高存活率至少50%,和/或与对照的肺中的病毒载量相比降低受试者的肺中的病毒载量至少50%是有效的。
[0174]
在一些方面,在单个给药步骤或所有给药步骤之后,递送至受试者呼吸道的有效量的类视黄醇和/或类视黄醇衍生物对于显示出受试者对病毒感染的预防性保护是有效的,所述病毒感染为诸如严重急性呼吸综合征、中东呼吸综合征和/或由流感病毒引起的流感,所述预防性保护相当于或优于市售治疗选择,诸如瑞德西韦和扎那米韦。
[0175]
例如,在单个给药步骤或所有给药步骤之后,受试者被严重急性呼吸综合征冠状病毒诸如sars-cov-2感染,并且递送至受试者呼吸道的有效量的类视黄醇和/或类视黄醇衍生物对于达到受试者的肺中的病毒载量、肺损伤程度和/或病毒蛋白表达水平是有效的,其与对照的肺中的病毒载量、肺损伤程度和/或病毒蛋白表达水平相当,所述对照以与类视黄醇和/或类视黄醇衍生物相同的剂量给予瑞德西韦,然后被sars-cov-2感染,两者在与受试者相同的时间点进行。“相当的”是指通过qrt-pcr测量的在肺中的病毒载量和病毒蛋白的表达水平在
±
10%以内,并且通过组织病理学形态学所显示的细支气管和肺泡细胞浸润的程度没有可观察到的差异。
[0176]
例如,在单个给药步骤或所有给药步骤之后,受试者被甲型流感病毒诸如h1n1感染,并且递送至受试者呼吸道的有效量的类视黄醇和/或类视黄醇衍生物对于与对照的肺中的病毒载量相比降低受试者的肺中的病毒载量至少50%是有效的,所述对照以与类视黄醇和/或类视黄醇衍生物相同的剂量给予扎那米韦并被h1n1感染,两者在与受试者相同的时间点进行。
[0177]
在一些方面,在单个给药步骤或所有给药步骤之后,递送至受试者呼吸道的有效量的类视黄醇和/或类视黄醇衍生物对于在患有病毒感染的受试者中显示治疗效果是有效的,所述病毒感染为诸如严重急性呼吸综合征、中东呼吸综合征和/或由流感病毒引起的流
感,所述治疗效果相当于或优于市售治疗选择,例如瑞德西韦和扎那米韦。
[0178]
例如,在单个给药步骤或所有给药步骤之前,受试者被甲型流感病毒如h1n1感染,并且递送至受试者呼吸道的有效量的类视黄醇和/或类视黄醇衍生物对于与以类视黄醇和/或类视黄醇衍生物相同剂量或更低的剂量给予扎那米韦并感染了h1n1的受试者的存活率相比提高受试者的存活率至少20%,和/或与以类视黄醇和/或类视黄醇衍生物相同剂量或更低的剂量给予扎那米韦并感染了h1n1的对照的肺中的病毒载量相比降低受试者的肺中的病毒载量至少50%是有效的,两者在与受试者相同的时间点进行。
[0179]
在一些方面,在每个给药步骤(i)中,干粉制剂或由干粉制剂形成的溶液或悬浮液中类视黄醇和/或类视黄醇衍生物的剂量可以为约1mg至约3000mg、约1mg至约1500mg、约10mg至约1500mg、约10mg至约1000mg、约20mg至约1000mg、约50mg至约1500mg、约50mg至约1000mg或约20mg至约500mg。
[0180]
在一些方面,在每个给药步骤(i)中,干粉制剂或由干粉制剂形成的溶液或悬浮液中类视黄醇和/或类视黄醇衍生物的剂量可以为每千克待治疗的受试者约0.1mg至约100mg、约0.1mg至约50mg、约0.1mg至约10mg、约0.1mg至约5mg、约0.5mg至约100mg、约0.5克至约50mg、约0.5mg至约20mg、约0.5mg至约10mg、约1mg至约100mg、约1mg至约50mg、约1μg至约20mg、约1mg至约10mg、约5mg至约100mg或约5mg至约50mg。
[0181]
4.任选的步骤
[0182]
除了上述将干粉制剂给予受试者的步骤(i)之外,所述方法可以包括在步骤(i)之前将干粉制剂装载至吸入器的步骤。
[0183]
在一些方面,使用者,诸如医学专业人员或待治疗的受试者,可以将干粉制剂装载至用于将干粉制剂递送至受试者的吸入器的储器中。装载至吸入器储器中的干粉制剂可以包含一个单位剂量的类视黄醇和/或类视黄醇衍生物(即单位剂型中的干粉制剂)或多个单位剂量的类视黄醇和/或类视黄醇衍生物。当含有多个单位剂量的类视黄醇和/或类视黄醇衍生物的干制剂被装载至吸入器的储器中时,吸入器中一般包括计量阀,使得每次给药递送一个单位剂量的类视黄醇和/或类视黄醇衍生物。
[0184]
任选地,提供预先包装有干粉制剂的胶囊或可更换套件。通常,预先包装在胶囊或可更换套件中的干粉制剂是单位剂型,即含有单位剂量的类视黄醇和/或类视黄醇衍生物。例如,胶囊预先包装有一种单位剂型的干粉制剂。使用者可以将一个预先包装的胶囊或两个或多个预先包装的胶囊装载至吸入器中。
[0185]
例如,可更换套件是预先包装有几个单位剂量的单位剂型的干粉制剂的箔-箔泡罩,其中每个单位剂量在空间上与其他单位剂量分开(即,离散的单位剂量)。使用者可以将预先包装的箔-箔泡罩装载至吸入器中,并且任选地在所有剂量递送至受试者后,用另一个预先包装的箔-箔泡罩替换。
[0186]
在一些方面,干粉制剂以滴剂或喷雾的形式鼻内给予。在这些情况下,使用者可以通过将干粉制剂溶解或悬浮在合适的溶剂中制备溶液或悬浮液,所述溶剂为诸如蒸馏水、去离子水、纯水或超纯水、盐水、磷酸盐缓冲盐水(pbs)、林格氏溶液和等渗氯化钠,及其组合,然后将由干粉制剂形成的溶液或悬浮液装载至用于将干粉制剂递送至受试者的鼻用装置的储器中。任选地,将预先包装有由干粉制剂形成的溶液或悬浮液的容器提供给使用者。
[0187]
形成溶液或悬浮液的干粉制剂可以包含一个单位剂量的类视黄醇和/或类视黄醇
衍生物(即单位剂型的干粉制剂)或多个单位剂量的类视黄醇和/或类视黄醇衍生物。当将由含有多个单位剂量的类视黄醇和/或类视黄醇衍生物的干制剂形成的溶液或悬浮液装载至鼻用装置的储器中时,装置中可包括计量阀,使得每次给药递送一个单位剂量的类视黄醇和/或类视黄醇衍生物。
[0188]
通过以下编号的段落可以进一步理解所公开的组合物和方法。
[0189]
1.一种用于吸入或气管内给药和/或用于鼻内给药的干粉制剂,其包含颗粒,所述颗粒包含
[0190]
类视黄醇或类视黄醇衍生物,或其组合;和
[0191]
β-环糊精或β-环糊精衍生物,或其组合,
[0192]
其中所述β-环糊精或β-环糊精衍生物的量,或所述β-环糊精和β-环糊精衍生物的总量为所述类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物总量的至少20重量%。
[0193]
2.段落1所述的干粉制剂,其中所述颗粒是多孔的和球形的。
[0194]
3.段落1或段落2所述的干粉制剂,其中所述类视黄醇和/或类视黄醇衍生物通过疏水性相互作用与所述β-环糊精和/或β-环糊精衍生物形成复合物。
[0195]
4.段落1-3中任一项所述的干粉制剂,其中所述类视黄醇和/或类视黄醇衍生物为无定形形式。
[0196]
5.段落1-4中任一项所述的干粉制剂,其中所述颗粒包含视黄醇、维甲酸、异维甲酸、阿利维甲酸、依曲替酯、阿维a酸、阿达帕林、贝沙罗汀、他扎罗汀或他米巴罗汀,或其组合。
[0197]
6.段落1-5中任一项所述的干粉制剂,其中所述颗粒包含β-环糊精衍生物,并且其中所述β-环糊精衍生物是2-羟丙基-β-环糊精、甲基-β-环糊精或磺丁基醚β-环糊精,或其组合。
[0198]
7.段落1-6中任一项所述的干粉制剂,其中所述颗粒包含他米巴罗汀和2-羟丙基-β-环糊精。
[0199]
8.段落1-7中任一项所述的干粉制剂,其还包含药学上可接受的赋形剂、另外的活性剂或其组合。
[0200]
9.段落8所述的干粉制剂,其中所述药学上可接受的赋形剂是氨基酸、肽、脂质、蛋白质、螯合剂、盐、掩味剂、阳离子或聚合物,或其组合。
[0201]
10.段落8或段落9所述的干粉制剂,其中所述药学上可接受的赋形剂的量为干粉制剂的0.1重量%至20重量%、0.1重量%至15重量%、1重量%至12重量%、1重量%至10重量%、1重量%至15重量%、2重量%至20重量%、2重量%至15重量%、2重量%至10重量%、3重量%至20重量%、3重量%至15重量%或3重量%至10重量%。
[0202]
11.段落8-10中任一项所述的干粉制剂,其中所述另外的活性剂是抗病毒剂或抗炎剂,或其组合。
[0203]
12.段落1-11中任一项所述的干粉制剂,其中所述干粉制剂用于吸入,并且其中所述颗粒具有<5μm、<4μm、<3.5μm、<3μm、<2.5μm或<2μm的质量中值空气动力学直径(“mmad”)。
[0204]
13.段落12所述的干粉制剂,其中所述颗粒具有大于所述颗粒的mmad的体积平均
直径,并且其中所述颗粒的体积平均直径为>4μm、>5μm、>8μm、>10μm、>12μm、>15μm、4μm至20μm、4μm至15μm或4μm至15μm。
[0205]
14.段落12或段落13所述的干粉制剂,其中在级联冲击器研究中,所述颗粒具有>40%、>45%、>50%、>55%、>60%或≥65%的细颗粒分数。
[0206]
15.段落1-11中任一项所述的干粉制剂,其中所述干粉制剂用于鼻内给药,并且其中所述颗粒具有>9μm、>9.5μm、>10μm或>10.5μm的质量中值空气动力学直径。
[0207]
16.段落15所述的干粉制剂,其中所述颗粒具有>50μm、>55μm、>60μm、>65μm、50μm至80μm、50μm至75μm或50μm至70μm的体积平均直径。
[0208]
17.段落15或段落16所述的干粉制剂,其中在安德森级联冲击器(“aci”)研究中,所述颗粒具有>40%、>45%、>50%、>55%或>60%的>9μm的颗粒的分数。
[0209]
18.一种递送系统,其包含吸入器和单位剂型的段落1-14中任一项所述的干粉制剂。
[0210]
19.段落18所述的递送系统,其中所述吸入器是干粉吸入器或加压计量剂量吸入器。
[0211]
20.段落18或19所述的递送系统,其中所述单位剂型中的类视黄醇和/或类视黄醇衍生物的总量为约0.1mg至约50mg、约0.5至约50mg或约1至约50mg。
[0212]
21.段落18-20中任一项所述的递送系统,其中所述颗粒的排放分数是>65%、>70%、>75%、>80%、>85%、>90%、>92%或>95%。
[0213]
22.一种递送系统,其包括鼻用装置和由单位剂型的段落1-11和15-17中任一项所述的干粉制剂和溶剂形成的溶液或悬浮液,其中所述干粉制剂的颗粒溶解或悬浮于溶剂中。
[0214]
23.段落22所述的递送系统,其中所述鼻用装置是计量剂量喷雾泵、雾化器、注射器、球、罐、加压容器、喷雾罐或喷雾器。
[0215]
24.段落22或段落23所述的递送系统,其中所述单位剂型中的类视黄醇和/或类视黄醇衍生物的总量为约0.1mg至约50mg、约0.5至约50mg、或约1至约50mg。
[0216]
25.段落22-24中任一项所述的递送系统,其中所述颗粒的排放分数为>85%、>90%或>95%。
[0217]
26.一种制备段落1-17中任一项所述的干粉制剂的方法,其包括
[0218]
(i)将类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物以及任选的药学上可接受的赋形剂和/或另外的活性剂在溶剂中混合以形成液体供给料;和
[0219]
(ii)将液体供给料喷雾干燥或喷雾冷冻干燥以形成含有类视黄醇和/或类视黄醇衍生物和β-环糊精和/或β-环糊精衍生物以及任选的药学上可接受的赋形剂和/或另外的活性剂的颗粒。
[0220]
27.段落26所述的方法,其中在步骤(ii)之后,所述颗粒的产率是至少40重量%、至少50重量%、至少60重量%、至少65重量%、至少70重量%、至少75重量%、至少80重量%、至少85重量%、至少90重量%、约40重量%至约95重量%、约55重量%至约95重量%、约55重量%至约95重量%、约60重量%至约95重量%或约65重量%至约95重量%。
[0221]
28.段落26或段落27所述的方法,其中在步骤(ii)期间,通过双流体喷嘴使液体供给料喷雾。
[0222]
29.一种预防、治疗或改善受试者的与呼吸道病毒感染相关的(多种)症状的方法,所述方法包括(i)向受试者给予段落1-17中任一项所述的干粉制剂。
[0223]
30.段落29所述的方法,其中所述受试者是患有或有患有严重急性呼吸综合征、中东呼吸综合征、冠状病毒病或由流感病毒引起的流感或其组合的风险的哺乳动物。
[0224]
31.段落29或段落30所述的方法,其中在步骤(i)中,所述干粉制剂通过吸入或气管内给药给予。
[0225]
32.段落29或30所述的方法,其中在步骤(i)之前,将干粉制剂与溶剂混合以形成溶液或悬浮液,并且其中在步骤(i)中,所述溶液或悬浮液通过鼻内给药给予。
[0226]
33.段落29-32中任一项所述的方法,其还包括每小时、每2小时、每5小时、每8小时、每天、每2天、每3天、每5天、每7天、每10天、每两周或每月重复步骤(i)。
[0227]
34.段落33所述的方法,其中持续一天至6个月、一天至3个月、一至三十天、一至十天、一至三天或在一天之内重复步骤(i)。
[0228]
35.段落29-34中任一项所述的方法,其中在单个给药步骤或所有给药步骤之后,将有效量的类视黄醇和/或类视黄醇衍生物递送至受试者的下呼吸道和/或上呼吸道。
[0229]
36.段落35所述的方法,其中在单个给药步骤或所有给药步骤后,受试者被严重急性呼吸综合征冠状病毒、中东呼吸综合征冠状病毒和/或流感病毒感染,并且其中有效量的类视黄醇和/或类视黄醇衍生物对于与对照的肺中的病毒载量相比降低受试者的肺中的病毒载量、与对照的肺损伤程度相比降低肺损伤程度和/或与对照中病毒蛋白的表达相比降低病毒蛋白的表达水平是有效的。
[0230]
37.段落35所述的方法,其中在单个给药步骤或所有给药步骤之前,受试者被严重急性呼吸综合征冠状病毒、中东呼吸综合征冠状病毒和/或流感病毒感染,并且其中有效量的类视黄醇和/或类视黄醇衍生物对于与对照的肺中的存活率和/或病毒载量相比提高受试者的肺中的存活率和/或降低病毒载量是有效的。
[0231]
38.段落29-37中任一项所述的方法,其中在步骤(i)期间,干粉制剂或由干粉制剂形成的溶液或悬浮液中的类视黄醇和/或类视黄醇衍生物的剂量为每千克受试者约0.1mg至约100mg、约0.1mg至约50mg、约0.1mg至约10mg、约0.1mg至约5mg、约0.5mg至约100mg、约0.5μg至约50mg、约0.5mg至约20mg、约0.5mg至约10mg、约1mg至约100mg、约1mg至约50mg、约1μg至约20mg、约1mg至约10mg、约5mg至约100mg或约5mg至约50mg。
[0232]
通过参考以下非限制性实施例将进一步理解本发明。
[0233]
实施例
[0234]
实施例1.他米巴罗汀的干粉制剂显示出用于肺部和/或鼻内递送的性质。
[0235]
材料和方法
[0236]
材料
[0237]
他米巴罗汀购自cayman chemical(michigan,usa)。2-羟丙基-β-环糊精(hpβcd)购自sigma-aldrich(美国圣路易斯)。叔丁醇(tba)获自meryer chemical technology(中国上海)。甲醇和乙腈(hplc级)购自anaqua chemicals supply(美国克利夫兰)。乙酸(hplc级)获自fisher scientific(英国拉夫堡)。除非另有说明,所有溶剂和试剂均为分析级或更高级。
[0238]
他米巴罗汀的喷雾冷冻干燥
[0239]
首先通过将1∶2的他米巴罗汀:hpβcd摩尔比的他米巴罗汀(tba中10mg/ml)和hpβcd(水中100mg/ml)的储备溶液混合至最终总溶质浓度为52.1mg/ml制备sfd的供给料溶液。在喷雾前,将溶液混合并保持在37℃(以防止冰点为25.4℃的tba冻结)。使用以601l/h的气体流动速率运行的双流体喷嘴(b
ü
chi,不锈钢双流体喷嘴,内径为0.7mm,瑞士)用于雾化。将供给料溶液装载至连接到喷嘴的注射器中,并通过注射泵(210syringe pump,kd scientific,ma,usa)将液体供给料速率控制在1.5ml/min。雾化的液滴被收集在含有液氮的不锈钢收集器中,以实现立即冷冻。将冷冻的液滴转移到冷冻干燥器(6升台式冷冻干燥系统,带加塞托盘干燥器,labconco corporation,missouri,usa),该冷冻干燥器被编程为将初级干燥温度保持在-25℃达40小时,随后进行次级干燥,其中温度在4小时内逐渐升高至20℃,并且该温度保持至少20小时。在整个冷冻干燥过程中,样品保持在低于0.14毫巴的压力下。在环境温度下收集干燥的产物并储存在具有硅胶的干燥器中,直到进一步分析。产率计算为在初始溶质质量输入中收集的粉末总质量的百分比。示意图显示了喷雾冷冻干燥涉及的两个步骤:(i)喷雾冷冻,通过喷嘴将液体雾化到冷冻剂中,形成冷冻颗粒;(ii)冷冻干燥、溶剂升华和干燥多孔颗粒的形成,如图1b和1c所示。图1d和1e分别显示通过喷雾冷冻干燥制造的球形多孔干粉的示意图和扫描电子显微镜图像。
[0240]
高效液相色谱法定量药物
[0241]
使用带有光电二极管阵列检测器(agilent 1260infinity;santa clara,usa)的高效液相色谱法(hplc)对他米巴罗汀进行定量。使用c-18色谱柱(agilent prep-c18,4.6
×
250mm,5μm),流动相由乙腈和5%乙酸80/20(体积/体积)组成。注入25μl的体积,运行流动速率设置为1ml/min。在280nm处检测他米巴罗汀,保留时间为6.2分钟。根据1.57至200μg/ml范围的标准曲线对他米巴罗汀进行定量。为了确定载药量,将他米巴罗汀的sfd粉末称重并溶解在甲醇中至最终体积为5ml。样品通过0.45-μm尼龙膜过滤器过滤,然后如上所述通过hplc进行定量。每种制剂中药物含量的测量一式三份进行。载药量定义为制剂中检测到的他米巴罗汀与粉末总量的比值。
[0242]
扫描电子显微镜(sem)
[0243]
a2-tfn粉末和未配制药物的形态通过场发射sem(日立s-4800n,东京,日本)在5kv下可视化。将粉末洒在安装在sem短柱上的碳棒带上,并通过清洁空气去除多余的粉末。使用溅射涂布机(q150t plus turbomolecular pumped coater,quorum,uk)在90秒内用大约13nm金钯合金对粉末进行溅射涂布,以避免在sem成像期间带电。
[0244]
通过级联冲击器评估气溶胶性能
[0245]
如前所述,使用下一代冲击器(ngi,copley,nottingham,uk)评估用于肺部递送的a2-tfn粉末的气溶胶性能。简而言之,称重约3mg的a2-tfn粉末并将其装载至被置于中的3号胶囊中。操作气流速率设置为90l/min,压降为3.4kpa。在每次分散之前,将一薄层的硅脂(lps实验室,伊利诺伊州,乔治亚州,美国)涂在ngi的载物台上以减少颗粒反弹。两个胶囊分散后,用甲醇冲洗和溶解沉积在胶囊、吸入器、适配器和ngi的各载物台上的粉末。回收剂量定义为在单次冲击中通过hplc在所有载物台上测定的他米巴罗汀的总质量。排放分数(ef)是指相对于回收剂量离开吸入器的粉末的分数。细颗粒剂量(fpd)是
在ngi实验中使用从hplc获得的测定的他米巴罗汀计算的空气动力学直径小于5.0μm的颗粒质量。细颗粒分数(fpf)定义为fpd相对于回收剂量的百分比分数。
[0246]
溶解研究
[0247]
使用含有100ml模拟肺液作为溶解介质的夹套烧杯研究a2-tfn粉末的溶解曲线。根据marques等人(文章中的slf3)的方法制备模拟肺液。将温度保持在37℃,并用磁棒以75rpm的速度搅拌介质。由于细颗粒剂量(fpd,空气动力学直径<5μm)被认为是可以沉积在深肺区域中的粉末分数,因此如前所述用于溶解研究,a2-tfn制剂的fpd由快速筛选冲击器(fsi,copley scientific,uk)结合收集。通过fsi分散约8.5
±
0.5mg a2-tfn粉末以分离fpd(其中含有估计量为0.5mg的他米巴罗汀)。将粉末置于玻璃纤维滤纸上,然后将其转移到夹套烧杯中。在预定的时间间隔内,抽取1ml溶解介质并通过0.45μm膜过滤器过滤。立即重新填充等体积的预热新鲜介质。包括未配制的他米巴罗汀粉末作为对照用于比较。如上所述通过hplc定量他米巴罗汀的浓度。溶解研究一式三份进行。
[0248]
傅里叶变换红外(ft-ir)光谱
[0249]
a2-tfn粉末和原材料的傅里叶变换红外光谱(ft-ir)光谱是使用带有uatr附件的spectrum two ft-ir光谱仪(perkinelmer,usa)获得的。将适量粉末(小于1mg)置于uatr晶体表面,压制形成丸粒。对于每个样品,光谱的扫描范围为400-4000cm-1
。
[0250]
差示扫描量热法(dsc)
[0251]
差示扫描量热法(dsc)(dsc 250,ta instruments,newcastle,de,usa)用于研究原材料及它们的物理混合物以及a2-tfn粉末的热响应。称取约1mg粉末并装载至铝坩埚中,以10℃/min的恒定速率从50℃加热至280℃。
[0252]
结果
[0253]
用不同的干燥条件制备了三种他米巴罗汀干粉制剂(表1)。该制剂显示出有利的吸入气溶胶性质。特别是a2-tfn制剂,其含有通过使用双流体喷嘴进行雾化的sfd制备的摩尔比为2∶1的hpβcd和他米巴罗汀,已用于进一步研究。a2-tfn的产率为66.3%,测得的载药量接近10.2%重量/重量的理论值。通过扫描电子显微镜(sem)观察到sfd之前和之后他米巴罗汀粉末的形态(图2a-2d)。与显示具有不同长度的棒状晶体结构的未配制的他米巴罗汀相比,a2-tfn粉末表现出多孔和球形结构。a2-tfn制剂的颗粒尺寸小(<10μm),并且颗粒似乎略微聚集。用激光衍射仪测量的体积粒度分布与sem图像一致,中值直径为5.75
±
0.11μm(表1)。对于吸入制剂,空气动力学直径可以确定粉末分散后肺沉积的部位。1至5μm之间的空气动力学直径被认为是对于肺沉积可接受的。通过与以90l/min操作的结合的下一代冲击器(ngi)测量a2-tfn制剂的空气动力学直径(图2e)。质量中值空气动力学直径(mmad)计算为1.86
±
0.44μm,其在有效肺沉积的粒度范围内。排放分数(ef)和细颗粒分数(fpf)分别约为95%和65%,表明a2-tfn粉末可以离开吸入器并有效地雾化,具有优异的肺沉积。sfd粉末的mmad小于其体积尺寸。这可归因于促进粉末雾化并降低颗粒间吸引力的多孔颗粒的低密度。此外,具有小空气动力学直径但大几何尺寸的颗粒具有有效肺沉积还通过避免快速清除而延长的在气道中的保留的另外优点。粉末的气溶胶性能也可受到用于粉末分散的吸入器装置的选择的影响。结果显示,是与用于有效雾化的粉末制剂相容的吸入器装置。物理化学和气溶胶表征的结果表明a2-tfn制剂实现在与呼吸
道感染的主要部位一致的下部气道处有效的粉末沉积。
[0254]
需要良好的水溶性,因此药物可以在强抗病毒作用所需的浓度下被吸收。由于他米巴罗汀具有差的溶解度,其溶解度和溶解速率需要改善。用a2-tfn制剂的细颗粒剂量(其反映沉积在下部气道中的剂量)进行溶解研究。与未配制的他米巴罗汀相比,已观察到具有更快溶解速率的突释曲线(图2f)。在a2-tfn制剂中,大约50%的他米巴罗汀在第一个5分钟内释放到介质中,累积药物浓度在接下来的4小时内保持稳定。在实验结束时(24小时),大约60%的药物已经溶解。当他米巴罗汀在溶解的初始阶段从药物-环糊精复合物中释放时,由于过饱和,可能存在他米巴罗汀的重结晶。相比之下,未配制的他米巴罗汀以缓慢而稳定的速度溶解,大约20%的药物在第一个小时内溶解。24小时后,来自未配制的他米巴罗汀的累积溶解药物显著低于来自a2-tfn粉末的累积溶解药物(学生t-检验,p<0.01),表明复合物中的hpβcd可以提高他米巴罗汀在溶解介质中的溶解度。
[0255]
hpβcd和他米巴罗汀之间的复合作用通过傅立叶变换红外(ft-ir)光谱反映(图2g)。他米巴罗汀的特征峰(823,1630,1695,3038cm-1
)可在未配制的他米巴罗汀和物理混合物的光谱中观察到,但在a2-tfn的光谱中不存在,表明两种组分之间成功形成复合物,从而促进与水形成氢键。在差示扫描量热法(dsc)热谱图(图2h)中,在未配制的他米巴罗汀和物理混合物中观察到对应于他米巴罗汀熔点的231℃处的吸热峰,表明他米巴罗汀在喷雾冷冻干燥之前呈结晶形式。hpβcd和a2-tfn粉末是无定形的,因为没有记录到明显的热事件。在sfd后他米巴罗汀从结晶形式到无定形形式的转化也有助于更快的溶解速率。在通过吞噬清除作用将未溶解的粉末从气道除去之前,提高的溶解速率可导致快速的药物吸收。
[0256]
可吸入他米巴罗汀粉末也已通过其他干燥方法(例如,喷雾干燥)制备并制成鼻用粉末以促进上部气道中的抗病毒作用(表1和图3a-3d)。
[0257][0258]
实施例2他米巴罗汀的粉末制剂的肺部递送显示出增强的药物吸收和生物利用度。
[0259]
材料和方法
[0260]
将小鼠随机分配到两个治疗组,每组45只小鼠。第一组在麻醉下通过气管内给药接受1mg a2-tfn粉末制剂。通过体内荧光成像证实了气管内吹入后的粉末雾化。a2-tfn-荧光素粉末在气管内给药后0.5和1小时的体内生物分布如下测量:在麻醉下向健康balb/c小鼠气管内给予1毫克a2-tfn-荧光素粉末。在每个时间点处死4只小鼠,切除肺、肝、脾和肾。用ivis spectrum体内成像系统采集荧光图像,激发和发射波长分别为465和540nm。第二组通过腹膜内(i.p.)给药接受200μl未配制的他米巴罗汀(0.5mg/ml溶于0.1%dmso/pbs)。两组中的每只小鼠接受100μg的他米巴罗汀。在给药后的特定时间点,通过腹膜内注射戊巴比妥(90mg/kg)使每组中的5只小鼠安乐死。收集血样,收集肺组织。通过固相提取柱(sola sax,thermo scientific,usa)提取血浆和肺匀浆中的他米巴罗汀,在温和的氮气流下干燥洗脱液。通过hplc流动相(5%乙酸/乙腈20/80)重构干燥残余物,离心,并通过hplc分析上清液。用空白血浆或肺匀浆作为背景,相对于0.157至25μg/ml的标准曲线定量他米巴罗汀的浓度。用phoenix winnonlin 7.0软件使用非房室分析(nca)模型分析两组的药代动力学参数。
[0261]
结果
[0262]
体内荧光成像结果显示气管内给药后0.5和1小时小鼠肺和肾中的a2-tfn-荧光素粉末,表明气管内吹入后粉末雾化(图4a和4b)。在健康的balb/c小鼠中,已经将通过气管内(i.t.)吹入递送的a2-tfn粉末制剂的药代动力学曲线与通过腹膜内(i.p.)注射给予的未配制的他米巴罗汀悬浮液进行了比较(图5a-5e)。表2显示了气管内和腹膜内组的药代动力学参数。对于气管内组,血浆和肺组织中的他米巴罗汀浓度在5分钟内达到最高水平(t
max
=5分钟)。这一观察结果与a2-tfn粉末的快速溶解以及因此肺部沉积后药物的快速吸收相一致。血浆和肺组织中的药物浓度下降,消除半衰期分别为1.7小时和0.5小时。尽管血浆中的他米巴罗汀维持在高于可检测水平高达8小时,但在给药后4小时,其在肺组织中变得不可检测。对于腹膜内组,在给药后的第一个30分钟内已经看到吸收阶段。血浆和肺组织的t
max
均为30分钟。腹膜内注射后血浆中的c
max
(5.0
±
0.3μg/ml,相当于~14μm)低于气管内给药后血浆中的c
max
(8.8
±
1.7μg/ml,相当于~25μm)。这可能是由于腹膜内注射后的药物吸收速率比气管内吹入更慢。气管内给药后肺组织中的c
max
比腹膜内给药后高36倍(p<0.001,学生t检验)。气管内给药后,他米巴罗汀在肺部的c
max
分别比其抗病毒ec
50
高46倍(对于sars-cov-2)、高838倍(对于mers-cov)和高159倍(对于h1n1)(表2),这表明在肺部具有用于有效抑制病毒复制的有利的高局部浓度。气管内给药后肺组织中的auc
0-8h
显著高于(15倍)腹膜内注射后肺组织中的auc
0-8h
(p<0.001,学生t-检验)。气管内给药后血浆中的auc
0-8h
也高于腹膜内注射后血浆中的auc
0-8h
(p<0.01,学生t-检验)。
[0263]
药代动力学研究表明,a2-tfn制剂的肺部递送表现出快速的药物吸收,其优于未配制的药物悬浮液的腹膜内给药。a2-tfn干粉的肺部递送已经实现了更高的生物利用度,而他米巴罗汀的全身给药表现出较差的肺分布。结果表明,a2-tfn粉末的肺部递送可以递送他米巴罗汀,用于呼吸道的局部抗病毒作用。
[0264][0265]
实施例3.他米巴罗汀的吸入干粉制剂显示出抗冠状病毒和甲型流感病毒的体内抗病毒功效
[0266]
材料和方法
[0267]
动物和伦理批准
[0268]
使用7~9周龄(体重~20g)的健康雌性balb/c小鼠研究肺部递送后他米巴罗汀在动物中的药代动力学曲线和抗流感作用。hdpp4转基因c57bl/6小鼠和金黄叙利亚仓鼠分别用于研究他米巴罗汀肺部给药后抗mers-cov和sars-cov-2的抗病毒作用。小鼠和仓鼠从香港大学(hku)的比较医学研究中心(centre for comparative medicine research of the university of hong kong(hku))获得,并被饲养在12小时的光/暗循环中,可随意获得食物和水。所有动物实验都是在(hku)教学和研究中使用活体动物委员会(committee on the use of live animals in teaching and research)(culatr)的批准下进行的,并遵循生物安全2级和3级动物设施的标准操作程序。
[0269]
抗sars-cov-2
[0270]
金黄叙利亚仓鼠被用于研究a2-tfn制剂抗sars-cov-2体内预防活性。将仓鼠分成三组(每组四只仓鼠)。在前两组中,在麻醉下进行气管内给药:(i)200μl瑞德西韦溶液(2.5mg/ml);(ii)5mg的a2-tfn粉末。将瑞德西韦在dmso中制备成100mg/ml储备液,并使用12%磺丁基醚-β-环糊精(sbe-β-cd)进一步稀释。第三组仓鼠经由气管内给药接受200μl pbs作为阴性对照。瑞德西韦或他米巴罗汀的剂量为每只仓鼠5mg/kg。气管内给药两小时后,通过腹膜内注射氯胺酮(200mg/kg)和甲苯噻嗪(10mg/kg)麻醉下,用20μl含有105噬菌斑形成单位(p.f.u.)的sars-cov-2的病毒悬浮液对仓鼠进行鼻内接种。所有仓鼠在感染后第4天进行安乐死,收集肺组织用于进一步分析。通过qrt-pcr方法测量肺匀浆中的病毒载量。如前所述,通过h&e和免疫荧光染色检查感染的仓鼠的肺组织的组织病理学。该实验在一个独立实验中进行(每组n=4)。
[0271]
抗mers-cov
[0272]
人二肽基肽酶(hdpp4)转基因c57bl/6小鼠用于研究a2-tfn制剂抗mers-cov的体内预防活性。将小鼠分成三组(每组五只小鼠)在麻醉下用于气管内给药:(i)20μl未配制的他米巴罗汀悬浮液(1mg/ml);(ii)1mg a2-tfn粉末;和(iii)20μl pbs(阴性对照)。前两组中他米巴罗汀的剂量为每只小鼠5mg/kg。气管内给药后2小时,在麻醉下用20μl含有100p.f.u.mers-cov的病毒悬液对hdpp4小鼠进行鼻内接种。所有小鼠在感染后第3天进行安乐死,收集肺组织用于进一步分析。通过qrt-pcr方法测量肺组织匀浆中的病毒载量。该实验在一个独立实验中进行(每组n=5)。
[0273]
抗h1n1病毒-预防性保护
[0274]
使用balb/c小鼠研究a2-tfn制剂抗甲型h1n1流感病毒的体内活性。将小鼠分成四组进行评估(每组九只小鼠)。在接种病毒之前,每组在麻醉下进行气管内给药:(i)20μl扎那米韦溶液(5mg/ml);(ii)50μl未配制的他米巴罗汀悬浮液(2mg/ml);和(iii)1mg的a2-tfn粉末。扎那米韦或他米巴罗汀的剂量为每只小鼠5mg/kg。在第四组小鼠中,气管内给予50μl pbs作为阴性对照。给药后2小时,在麻醉下用20μl含有100p.f.u.的h1n1病毒的病毒悬浮液对所有小鼠进行鼻内接种。每组中的四只小鼠在感染后第3天随机安乐死,收集肺组织,通过qrt-pcr方法检测病毒载量。监测动物存活、临床症状和体重14天,或者直到达到人道终点(体重损失20%以上)。通过苏木精-伊红(h&e)染色和免疫荧光染色检查感染的小鼠的肺组织的组织病理学。该实验在两个独立的实验中进行(每组n=9)。
[0275]
抗h1n1病毒-治疗效果
[0276]
为了评估他米巴罗汀制剂抗h1n1病毒的治疗效果,在麻醉下用20μl含有10p.f.u.的h1n1病毒的病毒悬浮液对balb/c小鼠进行鼻内接种。在病毒攻击后4小时,开始第一个治疗剂量,将小鼠分成四组(每组11只小鼠),以经由鼻内给药接受20μl的每种治疗:(i)扎那米韦溶液(2mg/ml);(ii)未配制的他米巴罗汀悬浮液(100μg/ml);(iii)重构的a2-tfn溶液(100μg/ml);和(iv)pbs(作为阴性对照)。他米巴罗汀的剂量为0.1mg/kg,扎那米韦的剂量为2mg/kg。在感染后第1天和第2天,每天给予两次治疗剂量。感染后第3天,每组中的四只小鼠随机安乐死,收集肺组织,通过qrt-pcr方法检测病毒载量。监测动物存活、临床症状和体重14天,或者直到达到人道终点(体重损失20%以上)。该实验在两个独立的实验中进行(每组n=11)。
[0277]
用于确定抗病毒ec
50
的噬菌斑减少测定
[0278]
进行噬菌斑减少测定以绘制50%抗病毒有效剂量(ec
50
)。vero e6细胞用于sars-cov-2,mdck细胞用于甲型流感病毒。简而言之,在进行测定的前一天,将细胞以4
×
105细胞/孔接种在12孔组织培养板中。孵育24小时后,在添加或不添加药物化合物的情况下,将50p.f.u.的sars-cov-2或h1n1病毒添加到细胞单层中,并将平板在37℃下在5%co2中进一步孵育1小时,然后通过抽吸培养基和用dmem洗涤一次去除未结合的病毒颗粒。然后用含有1%的在dmem中的低熔点琼脂糖(cambrex corporation,new jersey,usa)和适当浓度的单个化合物的培养基覆盖单层,倒置并如上所述再孵育72小时。然后用10%甲醛(bdh,merck,darmstadt,germany)将孔固定过夜。移除琼脂糖塞后,用0.7%结晶紫(bdh,merck)对单层进行染色,并对噬菌斑进行计数。对于每种药物化合物浓度,测定相对于对照(即没有添加化合物)孔的噬菌斑抑制百分比。使用excel插件ed50v10中的sigmaplot(spss)计算ec
50
。噬菌斑减少测定实验一式三份进行,并重复两次进行确认。
[0279]
毒性研究
[0280]
根据与a2-tfn相同的方案制备仅hpbcd粉末,但不添加他米巴罗汀和叔丁醇。将1毫克a2-tfn粉末或hpbcd粉末或50μl磷酸盐缓冲盐水(pbs)在麻醉下气管内给予健康的balb/c小鼠。
[0281]
统计分析
[0282]
使用graphpad prism 8.0进行统计分析,用于学生t-检验、anova和log-rank(mantel-cox)检验,如文本或附图标题所示。每个实验的样本量(n)都在文本或附图标题中标明。在整个研究中,p值<0.05被认为具有统计学显著性。
[0283]
结果
[0284]
为了开发一种安全和有效的广谱抗病毒的吸入疗法,以应对由呼吸道病毒感染引起的出现和再次出现的流行病和疫情病毒的威胁,已经在气管内给予a2-tfn粉末后的动物模型中研究了抗冠状病毒和甲型流感病毒的体内预防性保护。
[0285]
抗sars-cov-2
[0286]
a2-tfn粉末抗sars-cov-2的体内抗病毒作用已经使用在金黄叙利亚仓鼠中建立的疾病模型进行了研究(图6a)。已经经由气管内给药向前两组仓鼠递送了单个剂量的a2-tfn粉末或瑞德西韦溶液,而第三组已经通过磷酸盐缓冲盐水(pbs)的气管内给药作为溶媒对照进行了处理。他米巴罗汀和瑞德西韦的剂量为5mg/kg。给药后2小时,当根据药代动力
学研究估计肺中的残留他米巴罗汀浓度高于ec
50
时,所有仓鼠鼻内(i.n.)接受105噬菌斑形成单位(p.f.u.)sars-cov-2的攻击(图6a)。从感染后第2天,用溶媒处理的对照仓鼠出现嗜睡、驼背姿势和呼吸急促的临床症状,而用a2-tfn或瑞德西韦处理的仓鼠没有出现临床症状。在该模型中,最高病毒载量和最显著的组织病理学变化预期在感染后第4天。已经收集仓鼠的肺组织以检测a2-tfn粉末和瑞德西韦是否能保护动物免受sars-cov-2感染。如图6b和6c所示,接受a2-tfn和瑞德西韦气管内给药的仓鼠肺组织中的病毒rna载量和病毒滴度显著低于pbs处理的仓鼠肺组织中的病毒rna载量和病毒滴度(p<0.05,具有事后多重比较的单因素anova)。在a2-tfn粉末和瑞德西韦处理之间,仓鼠肺组织中的病毒载量和病毒滴度没有差异(p>0.05,单因素anova)。对感染后第4天的肺组织进行了组织病理学研究,以检查疾病的严重程度(数据未显示)。在用pbs处理的仓鼠的肺组织中观察到弥漫性肺损伤、肺泡萎陷和大量炎性细胞浸润和渗出。相反,用a2-tfn粉末和瑞德西韦处理的仓鼠肺组织显示出改善的组织病理学形态,具有轻度的细支气管和肺泡细胞浸润。免疫荧光染色结果显示,尽管在a2-tfn粉末处理和瑞德西韦处理的仓鼠的局灶性细支气管上皮细胞中观察到sars-cov-2核衣壳蛋白(np)表达,但与pbs对照组相比,这两组中肺泡区np的表达显著降低,显示了药物处理时sars-cov-2扩散的限制(数据未显示)。这些结果表明,在仓鼠中肺部递送a2-tfn粉末可以提供针对sars-cov-2的抗病毒保护并改善病毒感染相关症状,其保护效果与fda批准的用于治疗covid-19的抗病毒剂瑞德西韦的保护效果相当。
[0287]
已经在人二肽基肽酶4(hdpp4)转基因c57bl/6小鼠模型中研究了吸入的他米巴罗汀粉末的泛冠状病毒抗病毒潜力。结果显示,在病毒攻击前通过气管内吹入给予的单个剂量a2-tfn粉末可赋予小鼠免受mers-cov感染的某种保护,这可通过肺中显著降低的病毒载量证明(图7a和7b)。
[0288]
抗h1n1病毒
[0289]
已经评估了他米巴罗汀制剂在balb/c模型中的预防性抗流感活性(图8a)。在病毒接种之前,已经通过气管内给药向小鼠的肺部递送了单个剂量的a2-tfn粉末、未配制的他米巴罗汀悬浮液、扎那米韦溶液或pbs。他米巴罗汀和扎那米韦的剂量为5mg/kg。给药后2小时,给动物鼻内接种100p.f.u h1n1病毒,并监测14天(图8a)。如图8b所示,在感染后第14天(d.p.i.),a2-tfn组和扎那米韦组的存活率分别为80%和60%,而pbs组和未配制的他米巴罗汀组中的所有小鼠分别在感染后7天和9天前达到人道终点。a2-tfn组、扎那米韦组和未配制的他米巴罗汀组的存活率显著高于pbs组的存活率(p<0.01,log-rank检验)。从感染后第1天至第3天,在用a2-tfn粉末处理的小鼠中观察到体重下降(~10%)(图8c),这被认为是向小鼠肺部吹入粉末的副作用。鉴于该粉末制剂具有适合于在人体内有效肺沉积的空气动力学尺寸,由于人和啮齿动物之间相当大的解剖学差异,在小鼠体内气管内给药后的副作用是可以预料的。从感染后第4天开始,用a2-tfn粉末处理的小鼠的体重已经回升到基线水平的大约95%,显示出动物的恢复。
[0290]
在气管内给予喷雾冷冻干燥的hpβcd和a2-tfn粉末后,监测未感染小鼠的体重(图8d)。在给药后第1天,两组都观察到相似水平的体重损失,这可能是因为气溶胶颗粒是为人而不是小鼠设计的。在感染后第2天,a2-tfn处理的小鼠体重已经持续下降,而hpbcd处理的小鼠已经开始恢复。从感染后第3天,a2-tfn处理的小鼠逐渐恢复,并最终恢复到与hpbcd处理的小鼠相当的水平。hpβcd组比a2-tfn组恢复更快。与体重趋势一致,尽管在感染后第3天
观察到两组的肺组织中有炎性细胞浸润,但在感染后第7天观察到肺组织中组织病理学形态改善,证明了动物的恢复(数据未显示)。在未感染小鼠的肺组织病理学中未观察到明显的毒性(数据未显示)。如图8e所示,在攻击后的第3天,从用a2-tfn粉末和未配制的他米巴罗汀处理的小鼠收集的肺组织中的病毒rna载量显著低于用pbs处理的小鼠的肺组织中的病毒rna载量(p<0.01,单因素anova)。pbs组和扎那米韦组的病毒载量没有显著差异。
[0291]
苏木精和伊红(h&e)染色的肺组织的组织病理学检查在感染后第3天进行(数据未显示)。在用pbs和未配制的他米巴罗汀处理的小鼠的肺组织中观察到严重的肺泡损伤和间质性炎症浸润,尽管后者的程度较轻。相反,在用a2-tfn粉末和扎那米韦处理的小鼠的肺组织中,肺泡损伤和间质浸润已经减轻。免疫荧光染色显示,在用pbs处理的小鼠的弥漫性肺泡区和局灶性细支气管上皮细胞中观察到大量的病毒pa蛋白表达(数据未显示)。在用未配制的他米巴罗汀和扎那米韦处理的小鼠的肺组织中,弥漫性肺泡区的病毒pa蛋白表达已经减少,但在细支气管上皮细胞中仍然明显。在a2-tfn处理的小鼠的肺组织中,在肺泡和细支气管区域pa蛋白的表达都被大大抑制。这些结果表明,经由气管内给药的单个预防剂量的a2-tfn可以保护小鼠免受高致病性h1n1病毒的攻击,其功效相当于或优于市售抗流感药物扎那米韦。
[0292]
由于吸入的他米巴罗汀粉末的单个预防剂量提供了抗h1n1病毒的优异保护,因此已经研究了通过鼻内给予重构他米巴罗汀粉末的治疗效果(图9a)。在用10p.f.u.的h1n1病毒进行鼻内接种后,小鼠经由鼻内给药接受重构的a2-tfn溶液、未配制的他米巴罗汀悬浮液或扎那米韦溶液。他米巴罗汀和扎那米韦的剂量分别为0.1mg/kg和2mg/kg。第四组小鼠通过鼻内给药接受20μl pbs溶液作为阴性对照。已经递送了总共五个治疗剂量。如图9b所示,在感染后第14天,a2-tfn重构组的存活率达到100%,而扎那米韦组和未配制的他米巴罗汀组的存活率分别为86%和71%。pbs组的所有小鼠在感染后第10天达到人道终点时,a2-tfn组、扎那米韦组和未配制的他米巴罗汀组的小鼠存活率显著高于pbs组的小鼠存活率(p<0.01,log-rank检验)。在整个14天的监测中,用a2-tfn重构物处理的小鼠没有记录到显著的体重损失和疾病症状(图9c)。在感染后第3天,收集每组小鼠的肺组织进行病毒rna载量测定(图9d)。a2-tfn重构组和未配制的他米巴罗汀组的病毒载量显著低于pbs组的病毒载量(p<0.05,单因素anova),而扎那米韦组和pbs组的病毒载量没有显著差异(p>0.05,单因素anova)。上述结果表明,除了经由气管内途径递送的单个预防剂量的他米巴罗汀粉末外,鼻内给予重构的他米巴罗汀粉末溶液和未配制的他米巴罗汀悬浮液也可以保护小鼠免受h1n1病毒感染。
[0293]
总之,已经证明了在体内经由肺部途径给予单个预防性剂量后,a2-tfn粉末制剂抗sars-cov-2、mers-cov和h1n1病毒的广谱保护性抗病毒功效,以及经由鼻内途径抗h1n1的治疗效果。sfd他米巴罗汀制剂及其重构物的功效优于未配制的他米巴罗汀,并与市售抗病毒剂瑞德西韦(抗sars-cov-2)和扎那米韦(抗h1n1病毒)相当或更好。
[0294]
参考文献
[0295]
cheng,et al.,clin microbiol rev 2012,25,223.
[0296]
cheng,et al.,clin microbiol rev 2007,20,660.
[0297]
chan,et al.,clin microbiol rev 2015,28,465.
[0298]
chan,et al.,lancet 2020,395,514.
[0299]
peiris,et al.,nat med 2004,10,s88.
[0300]
zumla,et al.,lancet 2015,386,995.
[0301]
wang,et al.,3rd,aaps pharmscitech 2020,21,225.
[0302]
zhao,et al.,front immunol 2020,11,602256.
[0303]
t.r.c.group,new england journal of medicine 2020,384,693.
[0304]
weinreich,et al.,n engl j med 2021,384,238.
[0305]
pan,et al.,n engl j med 2021,384,497.
[0306]
altan-bonnet,trends cell biol 2017,27,201.
[0307]
munger,et al.,nat biotechnol 2008,26,1179.
[0308]
yuan,et al.,nature communications 2019,10,120.
[0309]
heaton,et al.,pnas 2010,107,17345.
[0310]
mayer,et al.,front immunol 2019,10,1533.
[0311]
kleinfelter,et al.,mbio 2015,6,e00801.
[0312]
petersen,et al.,plos pathog 2014,10,e1003911.
[0313]
yuan,et al.,viruses 2020,12,628.
[0314]
miwako,et al.,drugs oftoday(barcelona,spain:1998)2007,43,563.
[0315]
zhou,et al.,adv drug deliv rev 2015,85,83.
[0316]
reychler,et al.,respir med res 2020,78,100778.
[0317]
davis,et al.,nat rev drug discov 2004,3,1023.
[0318]
vishali,et al.,j control release 2019,300,93.
[0319]
liang,et al.,international journal of pharmaceutics 2018,552,67.
[0320]
liao,et al.,int j pharm 2020,584,119444.
[0321]
wanning,et al.,int j pharm 2015,488,136.
[0322]
chan,journal of aerosol medicine 2006,19,21.
[0323]
chaurasiya and zhao,pharmaceutics 2021,13,31.
[0324]
hoppentocht,et al.,advanced drug delivery reviews 2014,75,18.
[0325]
levy,et al.,adv ther 2019,36,2547.
[0326]
rogliani,et al.,respir med 2017,124,6.
[0327]
esclusa-diaz,et al.,international journal of pharmaceutics 1996,143,203.
[0328]
rodier,et al.,european journal of pharmaceutical sciences 2005,26,184.
[0329]
schittny,et al.,drug deliv 2020,27,110.
[0330]
chan,et al.,clin infect dis 2020,71,2428.
[0331]
yuan,et al.,nat microbiol 2020,5,1439.
[0332]
ghaebi,et al.,j cell physiol 2020,235,9098.
[0333]
haynes,et al.,sci transl med 2020,12,eabe0948.
[0334]
colombo,et al.,in inhalation drug delivery,2013,169.
[0335]
de boer,et al.,expert opinion on drug delivery 2017,14,499.
[0336]
andrade,et al.,adv drug deliv rev 2013,65,1816.
[0337]
chennakesavulu,et al.,asian j pharm sci 2018,13,91.
[0338]
gaspar,et al.,int j pharm 2019,556,117.
[0339]
nemati,et al.,aaps pharmscitech 2019,20,120.
[0340]
parumasivam,et al.,eur j pharm sci 2016,88,1.
[0341]
thomas,et al.,mol pharm 2011,8,405.
[0342]
beck-broichsitter,et al.,j control release 2012,161,214.
[0343]
pilcer and amighi,int j pharm 2010,392,1.
[0344]
dufour,et al.,int j pharm 2015,495,869.
[0345]
evrard,et al.,j control release 2004,96,403.
[0346]
guan,et al.,molecules 2020,25.
[0347]
loftsson,et al.,expert opinion on drug delivery 2005,2,335.
[0348]
matilainen,et al.,j control release 2008,126,10.
[0349]
zhang,et al.,clinical infectious diseases 2020.
[0350]
marques,et al.,dissolution technol 2011,18,15.
[0351]
yuan,et al.,sci adv 2020,6,eaba7910.
[0352]
chan,et al.,clin infect dis 2020,71,2139.
[0353]
qiu,et al.,j vis exp 2020,161,e61469.
[0354]
liao,et al.,international journal of pharmaceutics 2019,560,144.
[0355]
yuan,et al.,pharmacol res 2020,159,104960.
[0356]
yuan,et al.,j antimicrob chemother 2016,71,2489.
[0357]
yuan,et al.,antiviral res 2017,137,58.
[0358]
riva,et al.,nature 2020,586,113.
[0359]
除非另有定义,否则本文使用的所有技术和科学术语具有与所公开的发明所属领域的技术人员通常理解的含义相同的含义。
[0360]
本领域技术人员将认识到或能够仅使用常规实验确定本文所述的本发明的具体实施方案的许多等同方案。这些等同方案旨在包括在以下权利要求中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。