1.本发明涉及生物医学工程技术领域,特别是涉及一种器官芯片。
背景技术:
2.肝脏作为行使体内代谢功能最重要的器官,承担着代谢解毒、免疫凝血、蛋白质合成等诸多重要的生理功能。肝小叶被认为是肝脏最小的功能单位,其形状为一个六边形,每个肝小叶由中央静脉放射的肝细胞组成,并由血管内皮细胞分隔。在每个六边形的中心,都有一条中央静脉。六边形的周围含有肝门静脉和肝动脉,血液从肝门静脉和肝动脉进入肝脏,然后通过中央静脉流出。因此,在体外构建肝小叶的血液流动模型对于肝脏疾病的药物开发、药物安全测试以及肝脏疾病研究等具有重要意义。
3.传统的二维细胞培养难以构建复杂的三维结构,动物模型也存在着成本高和伦理学方面的问题。近年来,器官芯片作为一种在人体外对细胞进行三维培养以模拟人体内的器官功能的技术得到了蓬勃发展。器官芯片在药物研发筛选、疾病模型评价、个性化医疗等领域有着很好的应用前景。
4.基于灌注模式的器官芯片基本结构主要包括中间为灌注有细胞水凝胶的组织腔室,两边为细胞培养液流动的微流控通道,其可以促进营养物质和氧气的持续供应以及代谢产物的清除,进而有利于细胞或组织的长时间培养。但同时,利用这种结构制作的肝小叶芯片需要避免含有细胞的水凝胶从组织腔室泄露到微流控通道,进而导致细胞培养液的流动障碍。
5.目前,在组织腔室和培养液通道中构建微柱阵列等物理屏障是解决上述问题的一种主要方法,其效果由微结构参数和界面润湿性相关的表面张力,以及含有细胞的水凝胶加载过程中所施加的外部压力决定。但是,这些物理障碍的存在也会使细胞培养液与细胞外基质之间的有效接触面积减小,从而影响所培养的细胞或组织不能受到均匀刺激。因此,需要一种新的策略来构建临时屏障,进而使肝小叶组织腔室中培养的细胞或组织获得更加均匀和充分的刺激。
技术实现要素:
6.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种器官芯片,其不仅能通过调控培养液中的氧浓度使其更加贴近人体中真实的生理环境,而且能够同时实现多个细胞模型培养。
7.本发明的另一个目的在于解决现有器官芯片中微柱阵列等临时屏障使得组织腔室中细胞培养液与细胞外基质之间有效接触面积小、接触不够充分的问题。
8.为实现上述目的及其他相关目的,本发明是通过包括如下技术方案实现的。
9.本发明提供一种器官芯片,所述器官芯片由上至下依次包括集液层、压印层、注胶层、组织层、薄膜层和氧控制层。
10.根据本发明上述技术方案,在使用时,所述集液层与所述压印层相对固定,所述注
胶层、组织层、薄膜层和氧控制层相对固定。
11.根据本发明上述技术方案,在使用时,所述集液层与所述压印层贴合以密封。
12.根据本发明上述技术方案,在使用时,所述集液层与所述压印层可流体连通。
13.根据本发明上述技术方案,在使用时,所述注胶层、组织层、薄膜层和氧控制层层叠贴合以密封。
14.根据本发明上述技术方案,在使用时,所述注胶层和所述组织层可流体连通。
15.根据本发明上述技术方案,所述集液层的下表面形成有集液槽,所述集液槽的槽底还开设有贯穿所述集液层的集液孔。
16.根据本发明上述技术方案,所述压印层的下表面形成有凸出的模具。
17.在一个优选的实施方式中,所述模具包括若干个模具槽。
18.根据本发明上述技术方案,所述模具槽中还设有垂直于所述压印层的液流柱,在所述液流柱上设有贯穿于所述压印层的第一导流孔;在使用时,所述集液槽覆盖所述第一导流孔。
19.根据本技术上述技术方案,所述模具槽的横截面呈正六边形。
20.根据本技术上述技术方案,若干个所述模具槽呈连续阵列分布。
21.根据本技术上述技术方案,所述第一导流孔的直径小于100μm。
22.根据本技术上述技术方案,所述注胶层形成有贯穿的模具孔。
23.根据本技术上述技术方案,所述注胶层还形成有若干个贯穿的第二导流孔和/或若干个第三导流孔。
24.根据本技术上述技术方案,所述组织层形成有贯穿的组织孔,且在所述组织层的上表面还形成有若干第一流道槽,所述第一流道槽与所述组织孔流体连通。
25.根据本技术上述技术方案,所述模具的外轮廓与所述模具孔相匹配;在使用时,所述模具依次贯穿所述模具孔和所述组织孔,且其下表面与所述组织层齐平。
26.根据本技术上述技术方案,所述第二导流孔与所述第一流道槽对应设置,且,在使用时,所述第二导流孔与对应的第一流道槽可流体流通。
27.根据本技术上述技术方案,所述组织层上形成有若干个与第三导流孔相对应的贯穿设置的第四导流孔。
28.根据本技术上述技术方案,所述第二导流孔和所述第三导流孔裸露于所述器官芯片的外表面。
29.根据本技术上述技术方案,所述薄膜层上还设有与所述第四导流孔相对应的贯穿设置的第五导流孔。
30.根据本技术上述技术方案,所述氧控制层的上表面形成有若干第二流道槽;在使用时,所述第二流道槽的一端与对应的所述第五导流孔连通。
31.根据本技术上述技术方案,在使用时,所述第二流道槽中充设有氧消除剂。
32.根据本技术上述技术方案,所述第二流道槽和/或所述氧消除剂的分布与组织层中器官的生理代谢特点相匹配。
33.根据本技术上述技术方案,还包括垫板,所述垫板的厚度与组织层的厚度相同;在使用时,所述垫板设于所述压印层和所述注胶层之间,用于解除模具的压印状态。
34.根据本技术上述技术方案,所述组织层的厚度为1~2mm。
35.根据本技术上述技术方案,所述注胶层的厚度为1~2mm。
36.根据本技术上述技术方案,所述薄膜层的厚度为30~200μm。
37.根据本技术上述技术方案,所述薄膜层为气体能够通过且液体不能够通过的薄膜。
38.如上所述,本发明的器官芯片,具有以下有益效果:
39.本技术中提供一种新型器官芯片,其含有薄膜层和氧控制层,用于使得氧气通过薄膜层并被氧控制层中的氧吸收剂消除,而液体不能够通过薄膜层,从而液体在微流控通道中循环或补充,并基于各层叠合密封形成的腔体和贯通结构,使得组织层中的培养液的氧浓度分布情况更加贴近人体中真实的生理环境。另外,模具设置有多个,能够同时实现多个细胞模型同时培养,实现了高通量的培养效果。
附图说明
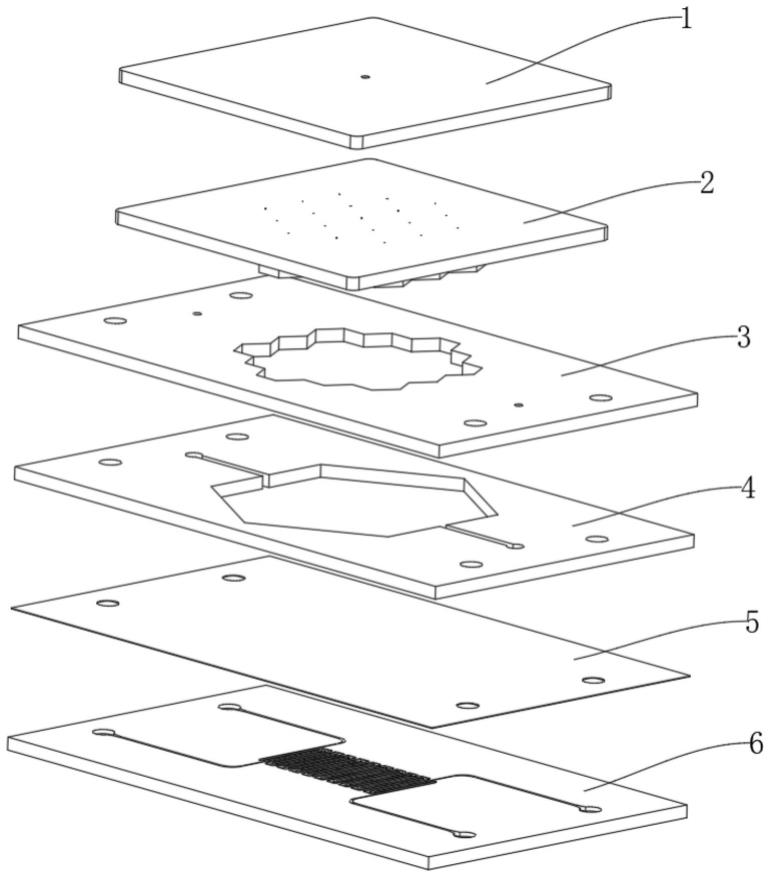
40.图1显示为本发明的器官芯片的爆炸结构示意图。
41.图2显示为本发明的器官芯片的集液层的结构示意图。
42.图3显示为本发明的器官芯片的压印层的结构示意图。
43.图4显示为本发明的器官芯片的注胶层的结构示意图。
44.图5显示为本发明的器官芯片的组织层的结构示意图。
45.图6显示为本发明的器官芯片的薄膜层的结构示意图。
46.图7显示为本发明的器官芯片的氧控制层的结构示意图。
47.图8显示为本发明的器官芯片的整体结构示意图。
48.图9显示为本发明的器官芯片中的组织层中形成的固化水凝胶的结构示意图。
49.图1~图9中附图标记如下:
[0050]1ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
集液层
[0051]
11
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
集液槽
[0052]
12
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
集液孔
[0053]2ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
压印层
[0054]
21
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
模具
[0055]
22
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一导流孔
[0056]3ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
注胶层
[0057]
31
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
注胶槽
[0058]
32、33
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第二导流孔
[0059]
34、35、36、37
ꢀꢀꢀꢀꢀꢀꢀ
第三导流孔
[0060]4ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
组织层
[0061]
41、42
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一流道槽
[0062]
43
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
组织孔
[0063]5ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
薄膜层
[0064]6ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
氧控制层
[0065]
61、62
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第二流道槽
[0066]7ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
垫板
具体实施方式
[0067]
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效。
[0068]
请参阅图1至图9。须知,本说明书所附图式所绘示的结构、比例、大小等,均仅用以配合说明书所揭示的内容,以供熟悉此技术的人士了解与阅读,并非用以限定本发明可实施的限定条件,故不具技术上的实质意义,任何结构的修饰、比例关系的改变或大小的调整,在不影响本发明所能产生的功效及所能达成的目的下,均应仍落在本发明所揭示的技术内容得能涵盖的范围内。同时,本说明书中所引用的如“上”、“下”、“左”、“右”、“中间”及“一”等的用语,亦仅为便于叙述的明了,而非用以限定本发明可实施的范围,其相对关系的改变或调整,在无实质变更技术内容下,当亦视为本发明可实施的范畴。
[0069]
如图1所示,本发明提供一种器官芯片,所述器官芯片由上至下依次包括集液层1、压印层2、注胶层3、组织层4、薄膜层5和氧控制层6。
[0070]
本技术中通过这种层与层之间的叠置配合,使得氧控制层6能够通过薄膜层5作用于细胞培养空间中,从而消除这一空间中的氧气,从而能够更好的模拟人体内部氧气环境。
[0071]
在一个如图1和图2所示的具体实施例中,所述集液层1的下表面形成有集液槽11,所述集液槽11的槽底还开设有贯穿所述集液层1的集液孔12。
[0072]
在一个如图1和图3所示的具体实施例中,所述压印层2的下表面形成有凸出的模具21;所述模具21包括若干个模具槽,所述模具槽中还设有垂直于所述压印层2的液流柱,在所述液流柱上设有贯穿于所述压印层2的第一导流孔22。
[0073]
在一个如图1、图2和图3所示的具体实施例中,在使用时,所述集液槽11覆盖所述第一导流孔22。
[0074]
通过上述结构的设置和配合,在使用时,所述压印层2中的第二导流孔22流出液体可以通过集液层1上的集液槽11汇集,然后通过集液孔12流出芯片外。
[0075]
在一个如图1和图4所示的具体实施例中,所述注胶层3形成有贯穿的模具孔31。
[0076]
在一个如图1和图4所示的具体实施例中,所述注胶层3形成有若干个贯穿的第二导流孔32、33。在一个如图4所示的具体的实施例中,所述第二导流孔为两个。
[0077]
在一个如图1和图4所示的具体的实施例中,所述注胶层3形成有若干个贯穿的第三导流孔34、35、36、37。在一个如图4所示的具体的实施例中,所述第三导流孔为4个。
[0078]
在一个如图1和图5所示的具体的实施例中,所述组织层4形成有贯穿的组织孔43,且在所述组织层4的上表面还形成有若干第一流道槽41、42,所述第一流道槽41、42与所述组织孔43流体连通;所述第二导流孔与所述第一流道槽对应设置,且,在使用时,所述第二导流孔与对应的第一流道槽流体流通。
[0079]
在一个如图1和图5所以的具体的实施例中,所述组织层4上形成有与第三导流孔相对应的贯穿设置的第四导流孔。
[0080]
在一个如图1和图8所示的具体实施例中,所述模具21的外轮廓与所述模具孔31相匹配;在使用时,所述模具21依次贯穿所述模具孔31和所述组织孔43,且其下表面与所述组织层4齐平。
[0081]
在一个如图1和图6所示的具体实施例中,所述薄膜层5上还设有与所述第四导流孔相对应的贯穿设置的第五导流孔。
[0082]
在一个如图1和图7所示的具体实施例中,所述氧控制层6的上表面形成有若干第二流道槽,具体为两个,如61、62所示;在使用时,所述第二流道槽的一端与对应的所述第五导流孔连通。
[0083]
在一个如图8所示的具体的实施例中,所述器官芯片还包括垫板7,所述垫板7的厚度与组织层4的厚度相同。如图8所示,在使用时,所述垫板7设于所述压印层2和所述注胶层3之间,用于解除模具21的压印状态。模具21的压印状态是指模具21压印于组织孔43中的含有细胞的水凝胶。
[0084]
在一个如图3所示的具体的实施例中,所述模具槽的横截面呈正六边形。从而能够很好的构建体内真实肝小叶的血液流动模型。
[0085]
在一个如图3所示的具体的实施例中,若干个所述模具槽呈连续阵列分布,优选地,如图3所示,若干个所述模具槽呈蜂窝结构。
[0086]
在一个具体的实施例中,所述第一导流孔22的直径小于100μm。由此,本技术中的器官芯片在受到水凝胶表面张力的作用,在压印过程中,水凝胶不会堵塞第一导流孔22。
[0087]
在一个具体的实施例中,所述组织层4的厚度为1~2mm。如可以为1mm、1.5mm或2mm。
[0088]
在一个优选的实施例中,所述注胶层3的厚度为1~2mm。如可以为1mm、1.5mm或2mm。
[0089]
在一个优选的实施例中,所述薄膜层5的厚度为50~200μm。如可以为50μm、60μm、70μm、80μm、90μm、100μm、110μm、120μm、130μm、140μm、150μm、160μm、170μm、180μm、190μm或200μm。
[0090]
在一个优选的实施方式中,所述薄膜层5为气体能够通过和液体不能够通过的薄膜。在一个优选的实施例中,所述薄膜层5可选用pdms薄膜。pdms薄膜是由pdms硅橡胶交联固化制成的一种全透明、高精度的薄膜材料。其具有疏水性、生物相容性,并具有透气性,水在薄膜上形成水珠滑落,但水汽和氧气等可以透过薄膜。
[0091]
在一个如图4所示的具体的实施例中,所述注胶层3的第二导流孔32、33和所述第三导流孔34、35、36、37裸露于所述器官芯片外表面。
[0092]
在一个优选的实施例中,第二流道槽和/或所述氧消除剂的分布与组织层中器官的生理代谢特点相匹配。这是由于不同的器官其要求氧含量分布不同,此为仿生结构设计,如此设置可以更好的模拟真实的人体代谢环境。在一个具体的实施例中,所述第二流道槽的尺寸和排布可以根据控制实际过程中氧气的浓度相匹配,为了更好的消除器官芯片培养体系中的氧气可以针对性布置。排布有如图7所示,提供一种更具体的第二流道槽的排布,其有61和62两个流道,并且两个流道交错且按照s型密布。
[0093]
在使用时,培养液可从第二导流孔32和33进,从集液孔12出,以模拟肝小叶模型在体内实际的血液流动。或者,在使用时,培养液从集液孔12进,从第二导流孔32和33出。或者,在使用时,培养液从集液孔其中一个第二导流孔如32进,从集液孔12或另外一个第二导流孔33出。
[0094]
在一个具体的实施例中,在使用时,所述第二流道槽中充设有氧消除剂。
[0095]
在一个具体的实施例中,在使用时,含有细胞的水凝胶从第二导流孔注入并灌满组织层中的组织孔43,然后压印层2的模具21下行完成压印;再从第二导流孔注入培养液以
将多余的水凝胶排出所述器官芯片;待水凝胶凝固后,去除压印层压印并从所述第二导流孔和/或集液孔中灌注培养液以对细胞进行培养;在培养时从第三导流孔灌注氧消除剂以消除并控制器官芯片中的氧浓度。
[0096]
培养液及氧消除剂scavenger可通过重力驱动,也可通过外部泵送,本发明对此不做具体限定。所述氧消除剂可以为用于控制氧浓度的液体scavenger。
[0097]
在一个更具体的实施例中,采用本技术中的器官芯片进行细胞培养过程如下:
[0098]
在注入含有细胞的水凝胶之前,压印层2和注胶层3之间用垫板7隔开,含有细胞的水凝胶从第二导流孔32注入,待水凝胶灌满组织孔43后立即撤去垫板7,以使得压印层2的底端紧贴薄膜层5完成压印;接着从其中一个第二导流孔32中注入培养液将多余的水凝胶沿着模具21和组织孔43之间流动并从另一第二导流孔33排出;待水凝胶凝固后将压印层2提起一定距离并用垫板7与注胶层3隔开,并继续从第二导流孔32和33或集液孔12灌注培养液对细胞进行培养;从第三导流孔34和35灌注液体scavenger以吸收氧来控制周围环境的氧浓度。最后形成在组织孔43的固化水凝胶8外形如图9的阴影部分所示。
[0099]
与现有技术相比,本发明的有益效果在于:
[0100]
(1)实现了多个细胞模型的同时大规模培养,具有高通量的特点;
[0101]
(2)氧控制层的设置可以使得培养液中的氧浓度分布更贴近人体的生理环境;
[0102]
(3)特定结构的模具等临时屏障的设置可以使得培养液充分均匀的刺激细胞生长;
[0103]
(4)多种培养液的进出口设计以及组织孔等正六边形的构造可以很好的构建体内真实肝小叶的血液流动模型以及根据实验要求按需调整进出液的设置。
[0104]
所以,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
[0105]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。