1.本发明涉及生物技术领域,尤其涉及抗肝纤维化的细胞制剂及其制备方法和应用。
背景技术:
2.肝星状细胞(hepatic stellate cells,hscs)位于disse间隙内,紧贴着肝窦内皮细胞和肝细胞。正常肝脏中的肝星状细胞处于静止状态;当肝脏受到炎症或机械刺激等损伤时,肝星状细胞被激活并转分化为肌成纤维细胞样细胞 (mfc)。肝星状细胞的持续激活是肝纤维化发生发展过程中的关键环节,能够加重肝损伤。
3.因此,有必要开发新型的抗肝纤维化的细胞制剂以解决现有技术中存在的以上问题。
技术实现要素:
4.本发明的目的在于提供抗肝纤维化的细胞制剂及其制备方法和应用,以实现对肝纤维化的抑制作用。
5.为实现上述目的,本发明的抗肝纤维化的细胞制剂包括肝源细胞,所述肝源细胞通过旁分泌作用抑制肝星状细胞活化或诱导所述肝星状细胞死亡。
6.优选的,所述细胞制剂还包括重悬成分,所述重悬成分包括生理盐水、复方电解质溶液、缓冲溶液和基础培养基的至少一种。
7.优选的,所述细胞制剂还包含辅助成分,所述辅助成分包括免疫抑制成分。
8.优选的,所述肝源细胞具有前体细胞特征。
9.优选的,所述肝源细胞在体外培养基诱导下分泌能够作用于jak-stat通路的起效成分,以抑制肝星状细胞活化或诱导所述肝星状细胞死亡。
10.进一步优选的,所述起效成分包含白血病抑制因子、内皮素、集落刺激因子、双调蛋白和成纤维细胞生长因子的至少一种。
11.进一步优选的,所述体外培养基包括基础培养基,所述基础培养基为 dmem/f12细胞培养基、hepx培养基、william’s e细胞培养基、neurobasalmedium细胞培养基、mem细胞培养基、dmem细胞培养基、1640rpmi细胞培养基和f12细胞培养基的至少一种。
12.本发明将所述细胞制剂与肝星状细胞在共培养基中进行非接触共培养,以抑制肝星状细胞活化或诱导所述肝星状细胞死亡。
13.优选的,所述共培养基包含肝星状细胞活化剂。
14.本发明的所述细胞制剂在制备抗肝纤维化药物方面的应用包括:
15.使用所述细胞制剂干预肝纤维化体内模型后获取离体样本;
16.通过所述离体样本考察所述细胞制剂对肝纤维化的抑制作用。
17.优选的,所述肝纤维化体内模型为硫代乙酰胺诱导或四氯化碳诱导的哺乳动物肝硬化模型。
附图说明
18.图1为实施例1的人原代肝细胞的基因表达情况示意图;
19.图2为实施例1的人肝前体样细胞的基因表达情况示意图;
20.图3为实施例2的鼠原代细胞和鼠肝前体样细胞的肝祖细胞基因和肝实质细胞标志物的表达情况对比图;
21.图4为实施例3的lx-2组、lx-2添加组和共培养组共培养48小时后得到的 lx-2细胞的胶原相关基因和纤维化相关基因表达情况对比图;
22.图5为实施例4的正常组、假手术组和细胞移植组取肝组织进行h&e染色、 picro-sirius天狼星红染色、masson三色染色和纤维粘连蛋白(fn)免疫染色后得到的照片对比图;
23.图6为实施例4的正常组、假手术组和细胞移植组取肝组织进行picro-sirius天狼星红染色、masson三色染色和纤维粘连蛋白(fn)免疫染色后统计的肝纤维化区域和纤维连接蛋白阳性染色区域的相对定量情况对比图;
24.图7为实施例4的正常组、假手术组和细胞移植组进行羟脯氨酸含量测定的分析结果;
25.图8为实施例4的假手术组和细胞移植组取肝组织进行肝纤维化评分的分析结果;
26.图9为实施例4的正常组、假手术组和细胞移植组取肝组织进行ki67免疫组化染色得到的照片对比图;
27.图10为根据图9所示的照片统计阳性染色细胞的量化结果;
28.图11为实施例5的正常组、假手术组和细胞移植组取肝组织进行h&e染色、 picro-sirius天狼星红染色、masson三色染色和纤维粘连蛋白(fn)免疫染色后得到的照片对比图;
29.图12为实施例5的正常组、假手术组和细胞移植组取肝组织进行picro-sirius天狼星红染色、masson三色染色和纤维粘连蛋白(fn)免疫染色后统计的肝纤维化区域和纤维连接蛋白阳性染色区域的相对定量情况对比图;
30.图13为实施例5的正常组、假手术组和细胞移植组取肝组织进行羟脯氨酸含量测定的分析结果;
31.图14为实施例5的假手术组和细胞移植组取肝组织进行肝纤维化评分的分析结果;
32.图15为实施例5的正常组、假手术组和细胞移植组血液的促纤维化、细胞外基质、信号转导相关的肝纤维化发生相关的基因表达水平进行分析后得到的热图;
33.图16为实施例6中jak-stat通路与分泌上清中参与生长因子活性、细胞因子活性和受体-配体活性的蛋白质之间的可视化网络示意图;
34.图17为实施例7的各组进行蛋白质印记分析后得到的pstat1信号的表达情况对比图。
具体实施方式
35.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是
全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。除非另外定义,此处使用的技术术语或者科学术语应当为本发明所属领域内具有一般技能的人士所理解的通常意义。本文中使用的“包括”等类似的词语意指出现该词前面的元件或者物件涵盖出现在该词后面列举的元件或者物件及其等同,而不排除其他元件或者物件。
36.本发明实施例的抗肝纤维化的细胞制剂包括肝源细胞,所述肝源细胞通过旁分泌作用抑制肝星状细胞活化或诱导所述肝星状细胞死亡。
37.一些实施例中,所述细胞制剂还包括重悬成分,所述重悬成分包括生理盐水、复方电解质溶液、缓冲溶液和基础培养基的至少一种。
38.一些实施例中,所述细胞制剂还包含辅助成分,所述辅助成分包括免疫抑制成分。
39.一些实施例中,所述肝源细胞具有前体细胞特征。
40.一些实施例中,具有前体细胞特征的肝源细胞为肝前体细胞。
41.一些实施例中,有前体细胞特征的肝源细胞为肝前体样细胞。
42.一些实施例中,所述肝前体细胞为人肝前体细胞。
43.一些实施例中,所述肝前体样细胞为人肝前体样细胞。
44.一些实施例中,所述肝源细胞在体外培养基诱导下分泌能够作用于 jak-stat通路的起效成分,以抑制肝星状细胞活化或诱导所述肝星状细胞死亡。
45.一些实施例中,所述体外培养基包括基础培养基,所述基础培养基为 dmem/f12细胞培养基、hepx培养基、william’s e细胞培养基、neurobasalmedium细胞培养基、mem细胞培养基、dmem细胞培养基、1640rpmi细胞培养基和f12细胞培养基的至少一种。
46.一些实施例中,所体外培养基由所述基础培养基,以及血清类物质和双抗的至少一种组成。
47.一些实施例中,所述体外培养基由所述基础培养基、血清类物质和双抗组成。其中,以占所述基础培养基的体积含量计,血清类物质的含量不超过20%,双抗的含量不超过2%。
48.一些实施例中,所述肝源细胞经肝细胞扩增转化培养基(tem培养基)对原代肝细胞进行体外培养得到。
49.一些实施例中,tem培养基包括基础培养基、无血清添加物、血清类物质、生长因子、tgf-β信号抑制剂、wnt信号通路激动剂和rock激酶抑制剂;
50.以占所述基础培养基的含量计,所述生长因子的含量为0.1-100纳克/毫升,所述rock激酶抑制剂的含量为0.1-100微摩尔,所述wnt信号通路激动剂的含量为0.1-50微摩尔,所述tgf-β信号抑制剂的含量为0.1-100微摩尔,所述血清类物质的含量不超过20%,所述无血清添加物的体积含量不超过2%。
51.一些实施例中,所述肝细胞增殖培养基还包括n-乙酰-l-半胱氨酸、抗坏血酸的至少一种。
52.一些实施例中,所述生长因子为表皮生长因子、成纤维细胞生长因子2、血管内皮生长因子、血小板衍生生长因子、肝细胞生长因子、白介素-6和抑瘤素的至少一种。
53.一些实施例中,所述rock激酶抑制剂为fasudil、y-27632、thiazovivin和 sb-772077-b的至少一种。
54.一些实施例中,所述wnt信号通路激动剂为重组wnt蛋白、重组r-spondin 蛋白和糖原合成酶激酶3β抑制剂的至少一种。
55.一些实施例中,所述tgf-β信号抑制剂为repsox、sb431542和a83-01的至少一种。
56.一些实施例中,tem培养基由血清和血清替代物的任意一种、基础培养基、 n2添加剂、b27添加剂、丙酮酸钠、抗坏血酸、表皮细胞生长因子、肝细胞生长因子、rock激酶抑制剂、wnt信号通路激动剂和tgf-β信号抑制剂组成。
57.一些实施例中,所述体外培养基和所述tem培养基中任意一种的血清类物质为动物源血清。
58.一些实施例中,所述体外培养基和所述tem培养基中任意一种中的动物源血清可以用血清替代物替换。
59.一些实施例中,所述血清替代物为无动物源成份的血小板及其衍生物。
60.一些实施例中,所述血清替代物为一磷酸鞘氨酸和吲哚乙酸。
61.一些实施例中,所述动物源血清为胎牛血清。
62.一些实施例的tem培养基中,以占基础培养基的含量计,所述丙酮酸钠的含量为0.5-1.5毫摩尔/升,所述抗坏血酸的含量为5-50微克/毫升,所述表皮细胞生长因子的含量为5-25纳克/毫升,所述肝细胞生长因子的含量为5-25纳克/ 毫升,所述rock激酶抑制剂的含量为5-20微摩尔/升,所述wnt信号通路激动剂的含量为1-5微摩尔/升,所述tgf-β信号抑制剂的含量为0.5-2微摩尔/升,所述一磷酸鞘氨酸的含量为0.5-2微摩尔/升,所述吲哚乙酸的含量为2-10微摩尔/升,所述n2添加剂和所述b27添加剂的体积百分比不超过1%。另一些实施例的tem培养基中,使用胎牛血清替代一磷酸鞘氨酸和吲哚乙酸。
63.一些实施例中,所述起效成分包含白血病抑制因子、内皮素、集落刺激因子、双调蛋白和成纤维细胞生长因子的至少一种。
64.一些实施例中,所述成纤维生长因子为fgf19。
65.本发明实施例还将所述细胞制剂与肝星状细胞在共培养基中进行非接触共培养,以抑制肝星状细胞活化或诱导所述肝星状细胞死亡。
66.一些实施例中,将所述细胞制剂与肝星状细胞在共培养基中进行非接触共培养的步骤包括,控制所述细胞制剂与所述肝星状细胞不同比例非接触混合。
67.一些实施例中,所述共培养基包含肝星状细胞活化剂。
68.一些实施例中,所述肝星状细胞活化剂为肝星状细胞活化因子。
69.一些实施例中,所述肝星状细胞活化因子为tgf-β。
70.本发明实施例提供了所述细胞制剂在制备抗肝纤维化药物方面的应用,包括:
71.使用所述细胞制剂干预肝纤维化体内模型后获取离体样本;
72.通过所述离体样本考察所述细胞制剂对肝纤维化的抑制作用。
73.一些实施例中,所述肝纤维化体内模型为硫代乙酰胺诱导或四氯化碳诱导的哺乳动物肝硬化模型。
74.本发明各实施例中,如无特别说明,细胞培养均在37摄氏度环境下且二氧化碳浓度为5%的细胞培养箱中进行。细胞培养使用的培养基以及处理细胞所使用的各类试剂,例如缓冲液使用前均经无菌化处理以及0.22微米滤器过滤以去除杂质。
75.本发明各实施例中涉及统计学分析的数据,每组实验至少重复3次,实验结果数据
利用graphpad prism 8.0软件进行统计学分析。两组数据间比较使用双尾非配对t检验来计算统计学差异,多组数据间差异的比较使用anova方差分析计算统计学差异。p《0.05被认为具有统计学差异,说明书附图中:*代表p《0.05; **代表p《0.005;***代表p《0.001;****代表p《0.0001。
76.以下通过具体的实施例进行详细说明:
77.实施例1
78.本实施例提供了第一种细胞制剂,所述第一种细胞制剂包含人肝前体样细胞 human-heplpcs作为具有前体特征的肝源细胞。具体的,所述人肝前体样细胞由人原代肝细胞human-primary hepatocytes经tem培养基体外培养得到。
79.具体的,人原代肝细胞human-primary hepatocytes经tem培养基进行7-9 天的转化扩增培养后,再进行1:(3-6)的传代培养至第2-5代得到 human-heplpcs。tem培养基由以下成分组成:dmem/f12基础培养基,以及以占dmem/f12基础培养基的含量计:含量为1%的n2营养补充剂(100x),含量为1%的b27营养补充剂(50x),1mm的丙酮酸钠,10μg/ml的抗坏血酸, 20ng/ml的肝细胞生长因子hgf,20ng/ml的上皮细胞生长因子egf,10μm 的rock激酶抑制剂y27632,3μm的wnt信号通路激动剂chir99021,1μm 的tgf-β信号抑制剂a8301,1μm的鞘氨醇-1-磷酸s1p and 5μm的吲哚乙酸 lpa。其中的dmem/f12、n2营养补充剂、b27营养补充剂和丙酮酸钠来源于 invitrogen;抗坏血酸来源于sigma-aldrich;hgf和egf来源于novoprotein; y27632、chir99021、a8301、s1p和lpa均来源于targetmol。
80.本实施例分别使用qpcr和流式细胞术分析了human-primary hepatocytes和 human-heplpcs的基因表达情况,结果如图1和图2所示。参照图1, human-primary hepatocytes在tem培养基作用下,肝祖细胞基因ck7、ck19和 sox9的表达显著增加,而alb、cyp3a4和hnf4α这类肝实质细胞标志物表达显著下降,可见。参照图2,human-heplpcs的肝细胞标志物hnf4α以及肝干细胞/肝祖细胞标志物cd24 and ck19显著表达,造血干细胞抗原cd34、白细胞共同抗原cd45以及肝胎儿细胞标志物afp的表达水平均小于2%。human-heplpcs不表达mhc ii类抗原hla-dp,hla-dq和hla-dr,表现出低免疫原性。
81.一些实施例中,对tem培养基体外培养完毕后得到的细胞进行消化洗涤后,以dmem完全培养基作为重悬成分,对人肝前体细胞进行重悬后得到第一种细胞制剂。
82.实施例2
83.本实施例提供了第二种细胞制剂,所述第二种细胞制剂包含鼠肝前体样细胞 rat-heplpcs作为具有前体特征的肝源细胞。具体的,所述鼠肝前体样细胞由鼠原代肝细胞rat-primary hepatocytes经tem培养基体外培养得到。
84.具体的,从成年sprague-dawley雌性大鼠的肝脏中分离得到大鼠原代肝细胞,具体的分离方法为本领域技术人员的常规技术手段,在此不做赘述。将大鼠原代肝细胞以2
×
104个/cm2的密度接种于t175培养皿后,在tem培养基中培养7-9天直至细胞生长密度达到90%以上;以1
×
104个/cm2的密度,1:3-6的比例进行2-5代的传代培养,并控制隔一天更换一次转化扩增培养基。
85.本实施例使用qpcr分析了rat-primary hepatocytes和rat-heplpcs的基因表达情况,结果如图3所示。参照图3,在使用tem培养基培养的过程中,肝祖细胞基因ck7、ck19和sox9的表达显著增加,而alb、cyp3a4和hnf4α这类肝实质细胞标志物表达显著下降,可见
rat-heplpcs也具有前体细胞特征。
86.实施例3
87.本实施例对实施例1的第一种细胞制剂与人永生化肝星状细胞系lx-2进行共培养,考察细胞制剂对lx-2的促死亡作用。本实施例的lx-2购自procell。
88.为实验观察方便起见,首先使用亲脂性膜染料dio及dii分别对 human-heplpcs和lx-2进行染色,然后再将染色后的细胞重悬于dmem完全培养基中得到不同的细胞制剂。具体的,将实施例1中经tem培养基体外培养得到的human-heplpcs进行消化和洗涤后,分别重悬于含5um dio(来源于 beyotime)或dii(来源于beyotime)的去血清的dmem完全培养基中,放培养箱中孵育10分钟,之后采用pbs缓冲液进行洗涤,去除未结合的染色,最后将染色细胞重新重悬于dmem完全培养基中,得到实施例3所使用的标记细胞制剂。dio进入细胞膜后可以侧向扩散逐渐使整个细胞的细胞膜被染成绿色; dii进入细胞膜后可以侧向扩散逐渐使整个细胞的细胞膜被染成红色。
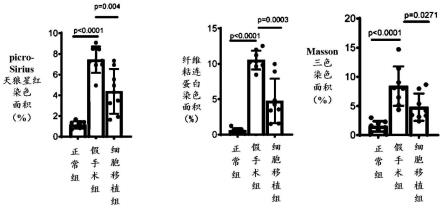
89.实施例3将含dii标记的lx-2的细胞制剂和含dio标记的heplpcs的细胞制剂按照1:1的比例混合后添加2.5ng/ml的tgf-β,然后按3000个细胞/孔接种至低黏附的96孔板中作为共培养组;将含dii标记的lx-2的细胞制剂按 3000个细胞/孔接种至低黏附的96孔板中作为lx-2组;将含dii标记的lx-2 的细胞制剂添加2.5ng/ml的tgf-β后按3000个细胞/孔接种至低黏附的96孔板中作为lx-2添加组。对lx-2组、lx-2添加组和共培养组共培养48小时后,吸弃培养基,在镜下进行观察拍照后,分别收集lx-2组和lx-2添加组的rna;对于共培养组,采用流式细胞仪将带有红色dii荧光标记的lx2细胞分选出,之后收集该细胞的rna。
90.采用rna提取试剂盒(购自promaga公司)分别提取3组中lx2的总rna;使用sybr green pcr kit(购自诺维赞公司)在pcr仪器上(购自roche公司)中进行。验证基因包括胶原相关基因col3a1、col1a1;纤维化相关基因a-sma、 vimentin、timp1。
91.本实施例对lx-2组、lx-2添加组和共培养组共培养48小时后使用定量荧光pcr(real-time pcr)对各组lx-2细胞的胶原相关基因和纤维化相关基因进行测定,得到图4所示的各组lx-2细胞的胶原相关基因和纤维化相关基因表达情况对比图。参照图4,经过tgf-β1活化的肝星状细胞,纤维化相关基因 col3a1、col1a1、a-sma、vimentin、timp1和desimin水平均明显上调,而经tgf-β1活化的肝星状细胞与肝前体细胞共培养后,上述基因均明显下调,证明肝前体细胞能显著抑制肝星状细胞在体外的活化。
92.实施例4
93.本实施例提供了由实施例1的human-heplpcs作为具有前体特征的肝源细胞制备的第二细胞制剂在制备抗肝纤维化药物方面的应用。
94.其中,所述第二细胞制剂为human-heplpcs经pbs重悬得到的细胞悬液。具体的,在500μl pbs中重悬5x106个human-heplpcs。
95.所述肝纤维化体外类器官模型为硫代乙酰胺(taa)诱导的哺乳动物肝硬化模型。建模方法如下:对5~6周龄的雌性sprague-dawley大鼠(来源于vitalriver) 每周用生理盐水稀释的taa以200mg/kg的注射剂量进行诱导,每周注射两次,诱导时间为13周以完成建模。
96.本实施例中:对建模成功的8只大鼠进行任何处理,作为正常组;对建模成功的8只大鼠脾脏注射500μl pbs,作为假手术组;以首次诱导作为初始时间节点,对建模成功的8只
大鼠在第13周和第15周按0.2mg/kg的注射剂量每天脾脏注射免疫抑制药物他克莫司(fk506),在首次注射fk506后的第二天开始每周两次脾脏注射第二细胞制剂,并在第17周的第三天处死大鼠。
97.本实施例取各实验组大鼠的肝脏进行进一步染色分析、羟脯氨酸含量分析和肝纤维化评分,具体参照图5至图10可知,注射第二细胞制剂可减少细胞外基质(ecm)的积累,降低大鼠的羟脯氨酸水平,对大鼠的肝硬化有所缓解。
98.图6为正常组、假手术组和细胞移植组取肝组织进行h&e染色、picro-sirius 天狼星红染色、masson三色染色和纤维粘连蛋白(fn)免疫染色后得到的照片对比图,图中比例尺为100μm。
99.图7为正常组、假手术组和细胞移植组取肝组织进行picro-sirius天狼星红染色、masson三色染色和纤维粘连蛋白(fn)免疫染色后统计的肝纤维化区域和纤维连接蛋白阳性染色区域的相对定量情况对比图。
100.图8为正常组、假手术组和细胞移植组进行羟脯氨酸含量测定的分析结果。图9为假手术组和细胞移植组取肝组织进行肝纤维化评分的分析结果。
101.图10和图11分别为正常组、假手术组和细胞移植组取肝组织进行ki67免疫组化染色得到的照片对比图以及根据图10所示的照片统计阳性染色细胞的量化结果。
102.实施例5
103.本实施例提供了由实施例2的rat-heplpcs作为具有前体特征的肝源细胞制备的第三细胞制剂在制备抗肝纤维化药物方面的应用。
104.本实施例的第三细胞制剂与实施例4的第二细胞制剂的区别在于:肝源细胞为rat-heplpcs。
105.所述肝纤维化体外类器官模型为四氯化碳诱导的哺乳动物肝硬化模型。建模方法如下:对5~6周龄的雌性sprague-dawley大鼠(来源于vitalriver)每周用含量为40%ccl4的ccl4和橄榄油混合注射液以1ml/kg的注射剂量进行诱导,诱导时间为13周以完成建模。
106.本实施例的正常组和假手术组与实施例4的处理情况一致,细胞移植组的处理情况与实施例4的区别在于:不使用免疫抑制药物他克莫司进行干预,且第 13周注射第三细胞制剂后,于第17周处死大鼠。
107.本实施例对各组大鼠取肝脏和血液进行进一步染色分析、羟脯氨酸含量分析和肝纤维化评分,具体参照图12至图16可知,注射第二细胞制剂可减少细胞外基质(ecm)的积累,降低大鼠的羟脯氨酸水平,使纤维化组织中纤维化细胞因子tgf-β及其细胞内信号分子的产生受到抑制,对大鼠的肝硬化有所缓解。
108.图12为正常组、假手术组和细胞移植组取肝组织进行h&e染色、picro-sirius 天狼星红染色、masson三色染色和纤维粘连蛋白(fn)免疫染色后得到的照片对比图,图中比例尺为100μm。
109.图13为正常组、假手术组和细胞移植组取肝组织进行picro-sirius天狼星红染色、masson三色染色和纤维粘连蛋白(fn)免疫染色后统计的肝纤维化区域和纤维连接蛋白阳性染色区域的相对定量情况对比图。
110.图14为正常组、假手术组和细胞移植组取肝组织进行羟脯氨酸含量测定的分析结果。图15为假手术组和细胞移植组取肝组织进行肝纤维化评分的分析结果。
111.图16为正常组、假手术组和细胞移植组血液的促纤维化、细胞外基质、信号转导相关的肝纤维化发生相关的基因表达水平进行分析后得到的热图。
112.实施例6
113.jak/stat通路在肝纤维化的形成进程中具有重要的调控作用。本实施例对实施例1的人肝前体细胞human-heplpcs经无血清的dmem培养基进行24小时的体外培养后,收集体外培养上清,去除体外培养上清中的细胞碎片后进行 25倍的过滤浓缩,得到分泌上清。对分泌上清使用串联质谱标签(tmt)分析蛋白质组学组成,通过蛋白质-蛋白质相互作用(ppi)分析构建得到图17所示的第一种抗肝纤维化制剂中jak-stat通路与第一种抗肝纤维化制剂中参与生长因子活性、细胞因子活性和受体-配体活性的蛋白质之间的可视化网络示意图。
114.参照图17,白血病抑制因子(lif)、内皮素1(edn1)、集落刺激因子1 (csf1)、双调蛋白(areg)、成纤维细胞生长因子19(fgf19)直接或间接与jak-stat通路的中间分子相互作用。
115.实施例7
116.本实施例将重组人fgf19(rhfgf19)和重组人areg(rhareg)与lx-2 共培养,考察实施例1的肝源细胞的旁分泌作用。
117.共培养的过程如下:lx-2培养于含10%fbs、100u/ml的青霉素和100 mg/ml的链霉素的dmem培养基中,加入2.5ng/ml的tgf-β1活化lx-2;再加入实施例6的rhfgf19、rhareg和分泌上清混匀后共培养48小时。共培养混合物中,分泌上清的质量百分比含量均为1%,rhfgf19的浓度分别为0.1ng/ml、 1ng/ml、10ng/ml、100ng/ml和1000ng/ml,rhareg的浓度分别为0.1ng/ml、 1ng/ml、10ng/ml、100ng/ml和1000ng/ml。不同实验组的rhfgf19浓度和 rhareg浓度不同。其中,分泌上清在使用前先加入10μg/ml的抗fgf19抗体 (兔单克隆抗体,来源于r&d systems)和10μg/ml的抗areg抗体(兔多克隆抗体,来源于r&d systems)孵育2小时。
118.作为公知的是,p-stat1在肝纤维化过程中发挥重要作用,主要通过抑制肝星状细胞的功能实现抗纤维化作用。本实施例控制组、对照组和不同实验组进行蛋白质印记分析(westernblot),得到图17所示的各组细胞的pstat1信号的表达情况对比图。参照图17可知,每种重组蛋白的浓度不低于10ng/ml时, p-stat1水平增加,可见本发明实施例的肝源细胞通过旁分泌作用抑制肝星状细胞活化或诱导所述肝星状细胞死亡。
119.本发明实施例中:
120.将肝组织固定在4%多聚甲醛(pfa)中,并包埋在石蜡中,随后切割成4μm 厚的切片。肝脏切片常规用苏木精和伊红(h&e)染色、picro-sirius天狼星红染色和masson三色(mt)染色进行胶原沉积染色。在偏振光下使用显微镜 (olympus bx50)分析i型和iii型胶原定量。使用极化过滤器,天狼星红染色切片中的i型胶原纤维将呈现橙色到红色,iii型胶原纤维将呈现黄色到绿色。用天狼星红染色的切片用于ishak评分系统下的肝纤维化评分。对于免疫组织化学(ihc),组织切片用抗纤维连接蛋白、gfp、ki67、hlai类、ck18、alb 的一级抗体染色。两名独立个体采用双盲法计算肝纤维化评分和ki67 细胞,并将结果平均值用于分析。h&e、picro天狼星红、mt染色和ihc的代表性图像由徕卡aperio在turbo拍摄。通过使用image j软件将阳性染色面积除以总采样面积进行量化。
121.在低温恒温器肝脏切片(5μm厚)或细胞球体上进行免疫荧光。在抗体染色之前,将肝切片或细胞球固定在4%多聚甲醛(pfa)中,然后用0.3%tritonx-100 渗透并用3%牛血清白蛋白(bsa)封闭,然后将切片孵育以获得针对α-sma 的一级抗体,在4℃下过夜切割半胱天冬酶3(详见补充表1),并在4℃下过夜培养细胞球体以获得针对alb、cyp3a4、ttr、ck19、sox9、afp(详见补充表1)的一级抗体。然后用pbs清洗样本,并用荧光标记的二级抗体染色。对照样品在未与第一抗体孵育的情况下进行类似处理。用共焦显微镜(徕卡tcssp8)拍摄免疫荧光染色的代表性图像。
122.根据制造商的方案(solarbio,bc0250)进行羟脯氨酸测定。简单地说,将肝组织(200mg)在提取液中均质化,在110℃的烘箱中煮沸2至6小时,直到没有可见的大质量,然后在16000rpm下离心20分钟,并用10mol/lnaoh(约 1ml)将ph值调节至6至8。用蒸馏水将水解样品的体积设置为4ml,将上清液转移到96孔板上,并按照制造商的方案进行测量。
123.本发明实施例的qpcr测试过程如下:使用eastep super rna提取试剂盒(货号为ls1040,来源于promega)提取总mrna。使用ii第一链cdna 合成试剂盒(货号为r211-01,来源于vazyme)进行反转录。然后,使用aceqqpcr sybr green master mix(货号为q131-02,来源于vazyme)和lifetechnologyabi 7500系统开发实时pcr。gapdh表达用作内部对照,确定阈值周期(ct),并使用δ(δct)方法计算基因表达的相对变化。本发明实施例使用透射电子显微镜(型号为jem 1200ex ii,来源于jeol)观察细胞的形态。将细胞用2.5%戊二醛和2%锇酸固定,然后脱水并包埋在环氧树脂中,切成80nm 厚的切片,然后用醋酸铀酰和醋酸铅双重染色后观察。
124.本发明实施例的rna测序和生物信息学分析使用试剂从肝组织中分离总rna;使用dna酶i(来源于takara)去除基因组dna;rna样品的浓度和纯度由2100生物分析仪(来源于安捷伦)测定,并使用nd-2000进行定量。文库制备和illumina hiseqxten/nova seq 6000测序rna seq转录组文库按照来自illumina的truseqtm rna样品制备试剂盒制备,使用1μg总rna;根据illumina的文库构建方案的说明,片段rna经过第一链和第二链cdna合成,然后以低周期进行接头连接和富集;量化后,使用illumina hiseqxten/novaseq6000测序仪在广州ribobio有限公司对配对末端rnaseq测序文库进行测序。
125.本发明实施例的基因表达通过edaseq标准化。使用版本1.10.1的deseq2 获得差异表达基因,q值的截止值《0.05和log2(折叠变化)》1用于识别差异表达基因。选择所有差异表达的mrna进行go分析clusterprofiler。使用glbase 进行其他分析。
126.本发明实施例使用含有蛋白酶抑制剂混合物(p1010,来源于beyotime)的 ripa缓冲液(p0013b,来源于beyotime)提取细胞的总蛋白。样品在冰上超声处理30秒,然后在4℃下以12000xg离心15分钟。收集上清液并用bca蛋白质分析试剂盒(zj101,来源于epizyme)定量。定量蛋白质样品通过5x sds-page (p0015,来源于beyotime)进行解析,并转移至疏水性pvdf转移膜(ipvh00010,来源于默克密理博)。将膜在tbst中的5%bsa中封闭1.5小时,并在4℃下与一级抗体孵育过夜。然后用tbst洗涤膜三次,并在室温下与二级抗体孵育2小时。使用增强ecl化学发光检测试剂盒(e411-04,来源于vazyme和数字发光图像分析仪(biorad)检测印迹。使用imagej软件或qingxiang软件确定每个波段的密度分析。使用的一级和二级抗体见表1。
127.表1
[0128][0129]
本发明实施例使用来源于beyotime的膜联蛋白v-fitc凋亡检测试剂盒以及来源于biogems的膜联蛋白v-apc凋亡检测试剂盒通过膜联蛋白v/碘化丙啶(pi)或膜联蛋白v/7-aad分析检测lx-2中的凋亡。具体的,收集细胞并重新悬浮在结合缓冲液中,然后根据试剂盒说明用膜联蛋白v和pi或7-aad染色。0.5μm的蛋白激酶抑制剂staurosporine用作促凋亡对照(阳性对照)。采用bd-facverse流式细胞仪检测荧光,并用flowjo软件进行数据分析。
[0130]
本发明实施例用bca蛋白质分析试剂盒(zj101,epizyme)对蛋白质进行定量。用丙酮沉淀每个样品中约100μg的蛋白质,并在碘乙酰胺缓冲液中烷基化。用序列级修饰的胰蛋白酶(promega,madison,wi)进一步消化这些肽,并用tmt标签(美国赛默飞世尔科技公司)标记。对于每个样品,用纳米uplc (easynlc1200)分离并分析1μg总肽,该纳米uplc与带有纳米电喷雾离子源的q exactive hfx orbitrap仪器(thermo fisher scientific)耦合。根据以下标准选择差异表达蛋白:(1)p《0.05;(2)折叠变化《0.5或折叠变化》2。
[0131]
原始质谱(ms)数据文件使用蛋白质组发现(pd)软件(版本2.4.0.305) 和内置的sequest ht搜索引擎进行处理。根据智人uniprot fasta数据库 (uniprot-human-9606-2020-10.fasta)搜索ms光谱列表,其中氨基甲基[c]、 tmt 6复合物(k)和tmt 6复合物(n-术语)作为固定修饰,氧化(m)和乙酰基(蛋白质n-术语)作为可变修饰。用于鉴定肽的参数为:10ppm前体离子质量耐受性,0.02da片段质量耐受性,最多2次缺失裂解。psm和肽水平的错误发现率(fdr)均设置为0.01。通过基因本体(go)注释对蛋白质的功能进行了注释(http://www.geneontology.org/).京都基因和基因组百科全书(kegg) 数据库用于分析富集途径。go-kegg富集分析中使用了双尾fisher精确检验。 p《0.05被认为是显著的。cytoscape 2.6版(www.cytoscape.org)用于可视化和分析分子和蛋白质相互作用网络。差异表达的蛋白质通过层次聚类进行排列,并以热图表示。热图由r软件生成(http://www.r-project.org).。
[0132]
本发明实施例使用细胞因子抗体阵列(aah-inf-g3,g系列)测量培养上清液中40种细胞因子的表达。用激光扫描仪检测阳性信号。用于显著性分析的基本统计数据是折叠变化。差异表达蛋白(dep)被定义为折叠变化超过1.2或小于0.83(绝对对数fc》0.263)的蛋白质。细胞因子的功能通过基因本体(go)注释进行注释。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。