1.本公开涉及从至少溶解有钴及杂质金属的被处理液中回收钴的钴回收方法、特别是从废锂离子电池中回收钴时使用的钴回收方法。
背景技术:
2.锂离子电池作为质量轻且高能量密度的电池受到瞩目,作为各种便携设备、电动汽车、电动助力自行车等的电池而大量使用。在该锂离子电池的正极中,使用例如钴酸锂等锂过渡金属氧化物作为正极活性物质,从资源的有效利用的观点出发,从废锂离子电池中回收有价金属钴极为重要。
3.作为从废锂离子电池中回收钴的方法,一直以来进行的是如下方法:用酸对废锂离子电池进行浸出而溶解钴,从溶解有钴的被处理液中分离回收钴。
4.但是,废锂离子电池中包含铁、铝、铜等杂质金属,这些杂质金属也通过酸浸出而溶解于被处理液,由此,使作为目标回收物的钴中混入杂质金属,使品质下降。
技术实现要素:
5.发明要解决的问题
6.本公开的目的在于,提供能够从至少溶解有钴及杂质金属的被处理液中以高纯度回收钴的钴回收方法。
7.用于解决问题的方案
8.本公开的一方式的钴回收方法的特征在于,其包括下述工序:一次低ph调节工序,向至少溶解有钴及杂质金属的酸性被处理液中添加碱,将ph调节为4以上且7以下;一次杂质金属分离工序,从被处理液中使用固液分离装置分离在上述一次低ph调节工序中析出的包含杂质金属的盐的晶体的析出物;一次高ph调节工序,向上述一次杂质金属分离工序后的被处理液中添加碱而将ph调节为7以上;一次钴分离工序,从被处理液中使用固液分离装置分离在上述一次高ph调节工序中析出的包含钴盐的晶体的析出物;再溶解工序,通过添加无机酸而溶解在上述一次钴分离工序中分离出的析出物,生成再溶解液;二次低ph调节工序,向上述再溶解液中添加碱而将ph调节为4以上且7以下;二次杂质金属分离工序,使在上述二次低ph调节工序中析出的包含杂质金属的盐的晶体的析出物通过自重或离心分离而沉淀,分离为上清液和包含该析出物的浆料;二次高ph调节工序,向上述二次杂质金属分离工序后的作为上清液的再溶解液中添加碱而将ph调节为7以上;以及,二次钴分离工序,从再溶解液中使用固液分离装置回收在上述二次高ph调节工序中析出的包含钴盐的晶体的析出物。
9.根据本公开的一方式的钴回收方法,对于至少溶解有钴及杂质金属的被处理液,首先在一次低ph调节工序中添加碱而将ph调节为4以上且7以下,由此,从被处理液中去除杂质金属,在一次高ph调节工序中添加碱而将ph调节为7以上,由此,使被处理液中所含的钴以钴盐形态析出。然后,在再溶解工序中利用无机酸将析出的钴盐溶解,对于该再溶解
液,在二次低ph调节工序中添加碱而将ph调节为4以上且7以下,由此,即使一次高ph调节工序中析出的钴盐中同时析出、混入了被处理液中残留的杂质金属的盐,也能够将残留的杂质金属从再溶解液中去除。并且,通过在二次高ph调节工序中向去除了杂质金属的再溶解液中添加碱而将ph调节为7以上,以钴盐形态析出,由此,能够以高纯度回收被处理液中所含的钴。
10.发明的效果
11.根据本公开的钴回收方法,能够从溶解有钴及杂质金属的被处理液中以高纯度回收钴。
附图说明
12.图1为示出第一方式的钴回收方法的步骤的流程图。
13.图2为示出回收被处理液中所含的锂的方法的步骤的流程图。
14.图3为示出图1所示的钴回收方法中使用的处理装置的简要构成的示意图。
15.图4为示出图2所示的锂回收方法中使用的处理装置的简要构成的示意图。
16.图5为示出双极膜电渗析装置的简要构成的示意图。
17.图6为拍摄实施例1的过滤残渣的表面状态而成的照片。
18.图7为拍摄实施例2的过滤残渣的表面状态的照片。
19.图8为拍摄实施例3的过滤残渣的表面状态的照片。
20.图9为简要示出第一方式的钴回收方法的变形例的步骤的流程图。
21.图10为示出图9所示的钴回收方法中使用的处理装置的简要构成的示意图。
22.图11为简要示出第一方式的钴回收方法的变形例的步骤的流程图。
23.图12为示出图11所示的钴回收方法中使用的处理装置的简要构成的示意图。
24.图13为简要示出第一方式的钴回收方法的变形例的步骤的流程图。
25.图14为示出图13所示的钴回收方法中使用的处理装置的简要构成的示意图。
26.图15为简要示出第一方式的钴回收方法的变形例的步骤的流程图。
27.图16为示出图15所示的钴回收方法中使用的处理装置的简要构成的示意图。
28.图17为示出第二方式的钴回收方法的步骤的流程图。
29.图18为示出回收被处理液中所含的锂的方法的步骤的流程图。
30.图19示出图17的钴回收方法中使用的处理装置的简要构成的示意图。
31.图20为示出双极膜电渗析装置的简要构成的示意图。
32.图21为简要示出第二方式的钴回收方法的变形例的步骤的流程图。
33.图22为示出图21的钴回收方法中使用的处理装置的简要构成的示意图。
34.图23为简要示出第二方式的钴回收方法的变形例的钴回收方法的步骤的流程图。
35.图24为示出图23的钴回收方法中使用的处理装置的简要构成的示意图。
具体实施方式
36.以下参照附图对本公开的钴回收方法的实施方式进行说明。
37.[第一方式的钴回收方法]
[0038]
作为从废锂离子电池中回收钴的方法,专利文献1记载了通过进行下述工序来回
收钴的方法,所述工序为:酸浸出工序,用硫酸对废锂离子电池进行浸出而溶解钴;低ph调节工序,通过向溶解有钴的被处理液中添加碱而将ph调节为4以上且5以下,使与钴一起溶解的铝等杂质金属的盐以晶体形态析出;以及,高ph调节工序,在去除析出物后向被处理液中进一步添加碱而将ph调节为7以上且10以下,使钴盐以晶体形态析出。但是,专利文献1中记载的方法有在低ph调节工序后的被处理液中残留铝等杂质金属之虞,若被处理液中残留杂质金属,则杂质金属会混入作为目标回收物的钴中而使钴的纯度下降。第一方式的钴回收方法是为了解决上述课题而作出的,目的在于,提供能够从至少溶解有钴及杂质金属的被处理液中以高纯度回收钴的钴回收方法。
[0039]
专利文献1:日本专利第5077788号公报
[0040]
本公开的第一方式的钴回收方法的特征在于,其包括下述工序:一次低ph调节工序,向至少溶解有钴及杂质金属的酸性被处理液中添加碱,将ph调节为4以上且7以下;一次杂质金属分离工序,从被处理液中使用固液分离装置分离在上述一次低ph调节工序中析出的包含杂质金属的盐的晶体的析出物;一次高ph调节工序,向上述一次杂质金属分离工序后的被处理液中添加碱而将ph调节为7以上;一次钴分离工序,从被处理液中使用固液分离装置分离在上述一次高ph调节工序中析出的包含钴盐的晶体的析出物;再溶解工序,通过添加无机酸而将在上述一次钴分离工序中分离出的析出物溶解,生成再溶解液;二次低ph调节工序,向上述再溶解液中添加碱而将ph调节为4以上且7以下;二次杂质金属分离工序,使在上述二次低ph调节工序中析出的包含杂质金属的盐的晶体的析出物通过自重或离心分离而沉淀,分离为上清液和包含该析出物的浆料;二次高ph调节工序,向上述二次杂质金属分离工序后的作为上清液的再溶解液中添加碱而将ph调节为7以上;以及,二次钴分离工序从再溶解液中使用固液分离装置回收在上述二次高ph调节工序中析出的包含钴盐的晶体的析出物。
[0041]
段落0012中记载的钴回收方法可以以下述方式构成:将在上述二次杂质金属分离工序中分离出的包含析出物的浆料供给至上述一次低ph调节工序前的被处理液、上述一次低ph调节工序中的被处理液、及一次杂质金属分离工序前的被处理液中的至少任一者中。
[0042]
另外,段落0012或段落0013中记载的钴回收方法可以以下述方式构成:进一步包括溶剂提取工序,该工序对于上述再溶解工序中生成的再溶解液进行使用提取剂的溶剂提取,由此,从该再溶解液中分离杂质金属,在上述二次低ph调节工序中,向上述溶剂提取工序后的再溶解液中添加碱而将ph调节为4以上且7以下。
[0043]
另外,段落0012或段落0013中记载的钴回收方法可以以下述方式构成:进一步包括溶剂提取工序,该工序对于上述二次杂质金属分离工序后的作为上清液的再溶解液进行使用提取剂的溶剂提取,由此,从该再溶解液中分离杂质金属,在上述二次高ph调节工序中,向上述溶剂提取工序后的再溶解液中添加碱而将ph调节为7以上。
[0044]
另外,段落0012或段落0013中记载的钴回收方法可以以下述方式构成:进一步包括下述工序:再再溶解工序,通过添加无机酸而将上述二次钴分离工序中分离出的析出物溶解,生成再再溶解液;溶剂提取工序,对于上述再再溶解液进行使用提取剂的溶剂提取,从该再再溶解液中分离杂质金属;三次高ph调节工序,向上述溶剂提取工序后的再再溶解液中添加碱而将ph调节为7以上;以及,三次钴分离工序,从上述再再溶解液中分离上述三次高ph调节工序中析出的包含钴盐的晶体的析出物。
[0045]
另外,段落0012至段落0015中的任一段落所述的钴回收方法可以以下述方式构成:进一步包括酸浸出工序,所述酸浸出工序用无机酸对废锂离子电池进行浸出而溶解钴及杂质金属,得到上述被处理液。
[0046]
另外,段落0012至段落0016中的任一段落所述的钴回收方法可以以下述方式构成:在被处理液中溶解有锂,所述钴回收方法还包括下述工序:浓缩工序,对上述一次钴分离工序后的被处理液进行蒸发浓缩;碳酸化工序,向上述浓缩工序后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐;以及,锂分离工序,从上述被处理液中分离在上述碳酸化工序中析出的包含碳酸锂的晶体的析出物。
[0047]
另外,段落0018中记载的钴回收方法可以以下述方式构成:在上述浓缩工序中对上述二次钴分离工序后的再溶解液进行蒸发浓缩。
[0048]
根据本公开的第一方式的钴回收方法,对于至少溶解有钴及杂质金属的被处理液,首先在一次低ph调节工序中添加碱而将ph调节为4以上且7以下,由此,从被处理液中去除杂质金属,在一次高ph调节工序中添加碱而将ph调节为7以上,由此,使被处理液中所含的钴以钴盐形态析出。然后,在再溶解工序中利用无机酸将析出的钴盐溶解,在二次低ph调节工序中对于该再溶解液添加碱而将ph调节为4以上且7以下,由此,即使在一次高ph调节工序中残留于被处理液的杂质金属的盐一起析出并混入所析出的钴盐中,也能够从再溶解液中去除残留的杂质金属。并且,在二次高ph调节工序中向去除了杂质金属的再溶解液中添加碱而将ph调节为7以上,以钴盐形式析出,由此,能够以高纯度回收被处理液中所含的钴。
[0049]
图1及图2针对本公开的第一方式的钴回收方法的实施方式示出了各工序的步骤,图3及图4示出实施本实施方式的钴回收方法的处理装置的简要构成。本实施方式的钴回收方法可以适宜用于从至少包含钴及杂质金属的酸性被处理液中回收钴,尤其可以适宜用于从废锂离子电池中回收钴。以下以从废锂离子电池中回收钴、进一步回收锂的情况为例进行说明。
[0050]
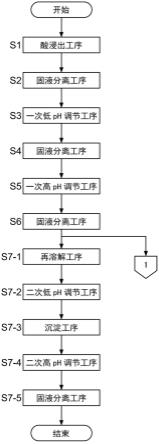
本实施方式的钴回收方法包括下述工序:
[0051]-用无机酸对废锂离子电池进行浸出而溶解钴及杂质金属、进而至少溶解锂的酸浸出工序s1;
[0052]-从酸浸出工序s1中得到的至少溶解有钴、杂质金属及锂的酸性被处理液中分离不溶残渣的固液分离工序s2;
[0053]-向固液分离工序s2后的去除了不溶残渣的被处理液中添加碱而将ph调节为4以上且7以下的一次低ph调节工序s3;
[0054]-从被处理液中分离在一次低ph调节工序s3中析出的包含杂质金属的盐的晶体的析出物的固液分离工序s4(一次杂质金属分离工序);
[0055]-向固液分离工序s4后的去除了析出物的被处理液中添加碱水溶液而将ph调节为7以上的一次高ph调节工序s5;
[0056]-从被处理液中分离在一次高ph调节工序s5中析出的包含钴盐的晶体的析出物的固液分离工序s6(一次钴分离工序);
[0057]-通过添加无机酸而将固液分离工序s6中分离出的析出物溶解,生成再溶解液的再溶解工序s7-1;
[0058]-向再溶解液中添加碱而将ph调节为4以上且7以下的二次低ph调节工序s7-2;
[0059]-使二次低ph调节工序s7-2中析出的包含杂质金属的盐的晶体的析出物通过自重或离心分离而沉淀,分离为上清液和包含该析出物的浆料的沉淀工序s7-3(二次杂质金属分离工序);
[0060]-向沉淀工序s7-3后的作为上清液的再溶解液中添加碱而将ph调节为7以上的二次高ph调节工序s7-4;以及,
[0061]-从再溶解液中使用固液分离装置回收在第二次高ph调节工序s7-4中析出的包含钴盐的晶体的析出物的固液分离工序s7-5(二次钴分离工序)。
[0062]
本实施方式的钴回收方法中,为了进一步回收锂,进一步包括下述工序:
[0063]-对于固液分离工序s6后的去除了析出物且溶解有锂及无机盐的被处理液进行螯合处理的杂质去除工序s8-1;
[0064]-对杂质去除工序s8-1后的被处理液进行蒸发浓缩的浓缩工序s8-2;
[0065]-对于浓缩工序s8-2后的被处理液进行冷却析晶,使无机盐以晶体形态析出的析晶工序s8-3;
[0066]-从被处理液中分离在析晶工序s8-3中析出的包含无机盐的晶体的析出物的固液分离工序s8-4;
[0067]-向固液分离工序s8-4后的去除了析出物的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐的碳酸化工序s8-5;
[0068]-从被处理液中分离在碳酸化工序s8-5中析出的包含碳酸锂的晶体的析出物的固液分离工序s8-6(锂分离工序);
[0069]-通过添加无机酸而溶解在固液分离工序s8-4中分离出的包含无机盐的晶体的析出物的溶解工序s8-7;以及,
[0070]-对于在溶解工序s8-7中得到的溶解无机盐而成的无机盐溶液进行双极膜电渗析,从无机盐溶液中分离碱及无机酸的电渗析工序s8-8。
[0071]
回收钴的对象即废锂离子电池除了包括由于使用过规定充放电次数而充电容量下降的使用后锂离子电池以外,还包括由于电池制造工序中的不良情况等而产生的半成品、随着制品规格变更而发生的原型号库存品等。废锂离子电池可以进行了焙烧处理,也可以是经过简单的粉碎处理、或经过粉碎处理和焙烧处理而得到的粉末。
[0072]
首先,在酸浸出工序s1中,用无机酸对上述废锂离子电池进行浸出。由此而溶解废锂离子电池中包含的钴、锂等有价金属。在该酸浸出时,除了有价金属以外,杂质金属也会溶解。作为杂质金属,没有特别限定,可例示出例如铜、铝、铁,至少会溶解铜、铝及铁中的至少1种。作为无机酸,可以实验例如硫酸、盐酸、硝酸、磷酸等,本实施方式中,从低成本且易于处理角度而使用硫酸。
[0073]
酸浸出工序s1中,对于用无机酸对废锂离子电池进行浸出的方法没有特别限定,可以使用通常所进行的方法。例如,酸浸出槽1中,将废锂离子电池浸渍于例如硫酸水溶液等无机酸水溶液中,搅拌规定时间,由此,生成溶解有上述钴、锂、杂质金属的被处理液。酸浸出工序s1中,水溶液中的无机酸的浓度优选为1mol/l以上且5mol/l以下,水溶液的温度优选为60℃以上。
[0074]
酸浸出工序s1中得到的被处理液被供给至固液分离工序s2。固液分离工序s2中,
使用固液分离装置2从被处理液中分离不溶残渣。不溶残渣为废锂离子电池中包含的主要不溶于无机酸的碳材料、金属材料、有机材料。作为进行固液分离的方法,可以使用例如加压过滤(压滤,filter press)、真空过滤、离心过滤等各种过滤装置、倾析型之类的离心分离装置等公知的固液分离装置。需要说明的是,在以下的固液分离工序s4、s6、s7-5、s8-4、s8-6等中也同样。
[0075]
固液分离工序s2后的被处理液被供给至一次低ph调节工序s3。一次低ph调节工序s3中,向被处理液中添加碱,将被处理液的ph调节为4以上且7以下、优选4以上且6以下、更优选4以上且5以下。由此,被处理液中的杂质金属(例如铜、铝、铁)以氢氧化物等无机盐的晶体形态析出,从被处理液中去除。作为ph调节中使用的碱,可以使用例如氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中,从低成本且易于处理的角度而使用氢氧化钠。
[0076]
一次低ph调节工序s3中,调节被处理液的ph的方法没有特别限定,可以使用通常所进行的方法。可列举例如:在一次低ph调节槽3内一边搅拌被处理液一边添加例如氢氧化钠水溶液等碱水溶液的方法。优选一边将被处理液升温到例如30℃至80℃范围内的恒定温度一边进行一次低ph调节工序s3。
[0077]
一次低ph调节工序s3中添加的碱水溶液优选为稀至碱浓度低于1.0mol/l。由此,可以抑制在一次低ph调节工序s3中被处理液中的钴与杂质金属一起以钴盐形式的晶体析出、并且从被处理液中被去除。但是若碱浓度过低,则在一次低ph调节工序s3中需要使用大量的碱水溶液来调节ph调节,而且ph调节后的被处理液的量也变多,因此优选碱浓度的下限为0.1mol/l以上。另外,为了有效抑制在一次低ph调节工序s3中从被处理液中去除被处理液中的钴,一次低ph调节工序s3中添加的碱水溶液的碱浓度优选为0.5mol/l以下,更优选为0.2mol/l以下。
[0078]
需要说明的是,在该一次低ph调节工序s3中,为了减少ph调节中使用的碱水溶液量,也可以将具有1.0mol/l以上的碱浓度高的碱水溶液添加于被处理液,直至被处理液的ph达到小于4的规定值,在被处理液的ph达到规定值后,将具有低于1.0mol/l的稀碱浓度的碱水溶液添加于被处理液,由此,将被处理液的ph调节为4以上且7以下。作为上述被处理液的ph的规定值,可以在2以上且3以下的范围内进行设定。
[0079]
一次低ph调节工序s3后的被处理液被供给至固液分离工序s4。固液分离工序s4中,使用固液分离装置4,从被处理液中分离在一次低ph调节工序s3中析出的包含杂质金属的盐的晶体的析出物。固液分离工序s4中回收的析出物用洗涤液进行洗涤。洗涤后的洗涤废液优选与被处理液一起供给至后的一次高ph调节工序s5。由此,能够回收洗涤废液中所含的钴,同时也能够将锂与被处理液中所含的锂一起从一次高ph调节工序s5供给至碳酸化工序s8-5,通过在碳酸化工序s8-5中进行碳酸化而能够以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用在浓缩工序s8-2中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够有效利用冷凝水。
[0080]
固液分离工序s4后的被处理液被供给至一次高ph调节工序s5。一次高ph调节工序s5中,向被处理液中添加碱而将ph调节为7以上、优选7以上且13以下、更优选7以上且11以下、进一步优选8以上且10以下的范围。由此,被处理液中的钴以氢氧化钴等钴盐的晶体形态析出。需要说明的是,一次高ph调节工序s5中,除了钴以外,镍、锰等有价金属、被处理液中残留的杂质金属以氢氧化物等无机盐的晶体形态析出,可以从被处理液中去除。作为ph
调节中使用的碱,可以使用例如氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中,从低成本且易于处理的角度而使用氢氧化钠。
[0081]
一次高ph调节工序s5中调整被处理液的ph的方法没有特别限定,可以使用通常所进行的方法。可列举例如:一边在一次高ph调节槽5内搅拌被处理液一边添加例如氢氧化钠水溶液等碱水溶液的方法。ph调节时,优选将被处理液升温到例如30℃至80℃范围内的恒定温度。一次高ph调节工序s5中添加的碱水溶液的碱浓度没有特别限定,优选为一次低ph调节工序s4中使用的碱水溶液的碱浓度以上,进一步优选碱浓度为0.2mol/l以上。
[0082]
一次高ph调节工序s5后的被处理液被供给至固液分离工序s6。固液分离工序s6中,使用固液分离装置6从被处理液中分离在一次高ph调节工序s5中析出的包含钴盐的晶体的析出物。固液分离工序s6中回收的析出物用洗涤液进行洗涤。洗涤后的洗涤废液优选与被处理液一起供给至杂质去除工序s8-1。由此,洗涤废液中所含的锂可以与被处理液中所含的锂一起从杂质去除工序s8-1供给至碳酸化工序s8-5,通过在碳酸化工序s8-5中碳酸化而能够以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用浓缩工序s8-2中产生的冷凝水,由此能够有效利用冷凝水。
[0083]
固液分离工序s6中回收的析出物中,除了钴以外还混入有杂质金属。因此,为了去除残留的杂质金属,固液分离工序s6中回收的析出物被供给至再溶解工序s7-1。
[0084]
再溶解工序s7-1中,通过添加无机酸而溶解包含钴盐的晶体及杂质金属的盐的晶体的析出物。作为无机酸,可以使用例如硫酸、盐酸、硝酸、磷酸等,本实施方式中,从低成本且易于处理的角度而使用硫酸。作为溶解析出物的方法,没有特别限定,例如,在再溶解槽7内以达到期望浓度的方式使用例如硫酸水溶液等无机酸水溶液溶解析出物,由此,生成溶解有钴、杂质金属的再溶解液。再溶解工序s7-1中,水溶液中的无机酸的浓度优选为1mol/l以上且5mol/l以下,水溶液的温度优选为30℃以上。
[0085]
再溶解工序s7-1中得到的再溶解液被供给至二次低ph调节工序s7-2。二次低ph调节工序s7-2中,与一次低ph调节工序s3同样地向再溶解液添加碱而将再溶解液的ph调节为4以上且7以下、优选4以上且6以下、更优选4以上且5以下。由此,再溶解液中残留的杂质金属以氢氧化物等无机盐的晶体形态析出,可以从再溶解液中去除再溶解液中残留的杂质金属。作为ph调节中使用的碱,可以使用例如氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中,从低成本且易于处理的角度而使用氢氧化钠。
[0086]
二次低ph调节工序s7-1中调节再溶解液的ph的方法没有特别限定,可以使用通常所进行的方法。可列举例如:一边在二次低ph调节槽8内搅拌再溶解液一边添加例如氢氧化钠水溶液等碱水溶液的方法。优选一边将再溶解液升温到例如30℃至80℃范围内的恒定温度一边进行二次低ph调节工序s7-2。
[0087]
二次低ph调节工序s7-2中添加的碱水溶液优选为稀至碱浓度低于1.0mol/l。由此,可以抑制在二次低ph调节工序s7-2中再溶解液中的钴与杂质金属一起以钴盐形式的晶体析出、并且从再溶解液中被去除。但是若碱浓度过低,则在二次低ph调节工序s7-2中需要使用大量的碱水溶液来调节ph调节,而且ph调节后的再溶解液的量也变多,因此优选碱浓度的下限为0.1mol/l以上。另外,为了有效抑制在二次低ph调节工序s7-2中从再溶解液中去除再溶解液中的钴,二次低ph调节工序s7-2中添加的碱水溶液的碱浓度优选为0.5mol/l以下,更优选为0.2mol/l以下。
[0088]
需要说明的是,在该二次低ph调节工序s7-2中,为了减少ph调节中使用的碱水溶液量,也可以将具有1.0mol/l以上的碱浓度高的碱水溶液添加于再溶解液,直至再溶解液的ph达到小于4的规定值,在再溶解液的ph达到规定值后,将具有低于1.0mol/l的稀碱浓度的碱水溶液添加于再溶解液,由此,将再溶解液的ph调节为4以上且7以下。作为上述再溶解液的ph的规定值,可以在2以上且3以下的范围内进行设定。
[0089]
二次低ph调节工序s7-2后的再溶解液被供给至沉淀工序s7-3。沉淀工序s7-3没有特别限定,例如在沉淀槽9内使二次低ph调节工序s7-2中析出的包含杂质金属的盐的晶体的析出物由于自重而自然沉降,由此,进行沉淀,分离为上清液和包含析出物的浆料。通过回收上清液而得到的包含析出物的浆料优选供给至一次低ph调节工序s3前的被处理液、一次低ph调节工序s3中的被处理液、被供给至固液分离工序s4的被处理液中的至少任一者。沉淀工序s7-3中得到的浆料中包含钴,因此将该浆料直接作为杂质回收时,会使钴回收产生损失。通过将浆料供给至一次低ph调节工序s3前的被处理液、一次低ph调节工序s3中的被处理液、被供给至固液分离工序s4的被处理液中的至少任一者,由此,可以将浆料中所含的钴供给至一次高ph调节工序s5,由此能够使钴在一次高ph调节工序s5中以钴盐形式的晶体而再次析出,可以以钴盐形式回到再溶解工序s7-1以后的回收钴的工序中,因此能够以高回收率回收钴。
[0090]
需要说明的是,沉淀工序s7-3中,也可以通过离心分离使二次低ph调节工序s7-2中析出的包含杂质金属的盐的晶体的析出物由于离心力而沉降,由此,进行沉淀,并分离为上清液和包含析出物的浆料。离心分离中,可以使用公知的离心分离装置。
[0091]
沉淀工序s7-3后的作为上清液的溶解有钴且去除了杂质金属的再溶解液被供给至二次高ph调节工序s7-4。二次高ph调节工序s7-4中,与一次高ph调节工序s5同样地向再溶解液中添加碱而将ph调节为7以上、优选7以上且13以下、更优选7以上且11以下、进一步优选8以上且10以下的范围。由此,再溶解液中的钴以氢氧化钴等钴盐的晶体形态析出。需要说明的是,在二次高ph调节工序s7-4中,除了钴以外,镍、锰等有价金属也以氢氧化物等无机盐的晶体形态析出,可以从再溶解液中去除。作为ph调节中使用的碱,可以使用例如氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中,从低成本且易于处理的角度而使用氢氧化钠。
[0092]
二次高ph调节工序s7-4中调整再溶解液的ph的方法没有特别限定,可以使用通常所进行的方法。可列举例如:一边在二次高ph调节槽10内搅拌再溶解液一边添加例如氢氧化钠水溶液等碱水溶液的方法。ph调节时,优选将再溶解液升温到例如30℃至80℃范围内的恒定温度。二次高ph调节工序s7-4中添加的碱水溶液的碱浓度没有特别限定,优选为二次低ph调节工序s7-2中使用的碱水溶液的碱浓度以上,进一步优选碱浓度为0.2mol/l以上。
[0093]
二次高ph调节工序s7-4后的再溶解液被供给至固液分离工序s7-5。固液分离工序s7-5中,使用固液分离装置11从再溶解液中分离在二次高ph调节工序s7-4中析出的包含钴盐的晶体的析出物。由此,可以使被处理液中溶解的钴以钴盐形式析出并将其回收。
[0094]
固液分离工序s7-5中回收的析出物用洗涤液进行洗涤。洗涤后的洗涤废液优选与再溶解液一起供给至杂质去除工序s8-1。由此,再溶解液、洗涤废液中所含的锂可以从杂质去除工序s8-1供给至碳酸化工序s8-5,通过在碳酸化工序s8-5中碳酸化而能够以高回收率
回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用浓缩工序s8-2中产生的冷凝水,由此能够有效利用冷凝水。需要说明的是,在本实施方式中将洗涤后的洗涤废液与再溶解液一起供给至杂质去除工序s8-1,由此当洗涤废液、再溶解液中包含钙和/或镁时,在杂质去除工序s8-1中将它们去除,而在洗涤废液、再溶解液不含钙和/或镁的情况下,可以将该液体供给至浓缩工序s8-2。另外,洗涤废液、再溶解液可以被供给至一次低ph调节工序s3。由此,在二次高ph调节工序s7-4中未析出、再溶解液中残留钴的情况下,可以提高钴的回收率。
[0095]
然后,上述固液分离工序s6后的被处理液中除了溶解有锂以外,还由于酸浸出工序s1、一次低ph调节工序s3及一次高ph调节工序5等中添加的无机酸(本实施方式中为硫酸)及碱(本实施方式中为氢氧化钠)而溶解有无机盐(本实施方式中为硫酸钠)。另外,被处理液中通常还溶解有钙、镁、硅等杂质。以下参照图2及图4来说明回收被处理液中的锂的方法。
[0096]
固液分离工序s6后的被处理液被供给至杂质去除工序s8-1。杂质去除工序s8-1中,至少去除被处理液中所含的钙和/或镁等多价阳离子。通过去除在被处理液作为杂质而包含的钙、镁等,能够抑制在接下来的浓缩工序s8-2中在蒸发浓缩装置13的换热器的导热面上产生、附着氧化皮,能够使热交换效率维持为较高。另外,若被处理液中包含钙、镁等,电渗析工序s8-8中,无机溶液中所含的钙、镁等多价阳离子会在双极膜电渗析装置19的阳离子交换膜内析出,有导致膜性能下降之虞。因此,通过预先从被处理液中去除钙、镁等在电渗析运转中引起结垢等问题的物质,由此,能够防止对双极膜电渗析装置19的阳离子交换膜的不良影响,能够使电渗析的性能维持为较高。
[0097]
杂质去除工序s8-1中从被处理液中去除钙、镁的方法没有特别限定,可以使用例如多价阳离子去除装置12。多价阳离子去除装置12是去除钙离子、镁离子等2价以上的多价阳离子的装置,例如可以例示出在内部具备离子交换树脂、能够在被处理液接触离子交换树脂时吸附钙离子、镁离子的构成的装置。作为多价阳离子去除装置12,此外可以例示出能够向填充有螯合树脂的柱中通入被处理液的构成的装置。作为螯合树脂,可以使用能够选择性捕捉钙离子、镁离子的树脂,例如可以例示出亚氨基二乙酸型、氨基磷酸型等。另外,作为多价阳离子去除装置12,可列举添加有螯合剂的装置等。需要说明的是,在杂质去除工序s8-1中,从被处理液中去除的杂质除了钙、镁以外还包括硅(硅酸根离子)。
[0098]
杂质去除工序s8-1后的被处理液被供给至浓缩工序s8-2。在浓缩工序s8-2中,加热被处理液来进行蒸发浓缩,即使被处理液中的水分蒸发,由此对被处理液进行浓缩。由此,被处理液的液体量减少、被处理液中的锂浓度增加。由此,在后述的碳酸化工序s8-5中能够提高碳酸锂的回收率。
[0099]
浓缩工序s8-2中,优选将被处理液蒸发浓缩至如下浓度,所述浓度为锂在浓缩后的被处理液中例如不会以硫酸锂等锂盐的晶体形态析出的程度。由此,能够提高浓缩后的被处理液中的锂浓度,在碳酸化工序s8-5中能够提高碳酸锂的回收率。
[0100]
需要说明的是,在浓缩工序s8-2中析出了析出物的情况下,可以进行将其从被处理液中分离的固液分离工序。
[0101]
浓缩工序s8-2中,对被处理液进行蒸发浓缩的方法没有特别限定,可以使用例如蒸发浓缩装置13。作为蒸发浓缩装置13,只要能够通过蒸发而将被处理液浓缩就没有特别
限定,可以使用例如热泵型、喷射器(eductor)驱动型、蒸汽型、闪蒸型等公知的蒸发浓缩装置,优选热泵型的蒸发浓缩装置。使用热泵型的蒸发浓缩装置的情况下,能够显著抑制所用的能量。
[0102]
蒸发浓缩装置13通过连接有未图示的真空泵而使内部维持为低压,浓缩工序s8-2中优选通过在压力低于大气压的低压下加热被处理液来进行蒸发浓缩。与大气压下相比,低压下被处理液的蒸发温度(被处理液中所含的水的沸点)降低,因此通过在低压下进行蒸发浓缩,能够使被处理液的蒸发浓缩所需的能量被抑制为较低而实现节能。
[0103]
需要说明的是,浓缩工序s8-2中并非必须通过在压力低于大气压的低压下加热被处理液来进行蒸发浓缩,例如,也可以在大气压下加热被处理液来进行蒸发浓缩。
[0104]
浓缩工序s8-2后的被处理液被供给至析晶工序s8-3。析晶工序s8-3中,对被处理液进行冷却析晶。析晶工序s8-3中降低被处理液的温度,使溶解度降低至被处理液中所含的无机盐发生结晶化为止,由此能够降低被处理液中的无机盐(本实施方式中为硫酸钠)的浓度。因此,在碳酸化工序s8-5中回收碳酸锂时能够提高碳酸锂的纯度。
[0105]
析晶工序s8-3中,对被处理液进行冷却析晶的方法没有特别限定,可以使用例如冷却析晶装置14。冷却析晶装置14是使供给的被处理液在析晶槽内冷却、使作为目标的无机盐的晶体析出的装置。作为冷却析晶装置14,可以使用例如冷却方式为利用夹套、内部盘管的析晶装置、外部循环冷却式的析晶装置等公知的冷却析晶装置,没有特别限定。
[0106]
析晶工序s8-3中,利用饱和溶解度、溶解度的温度依赖性根据无机盐而不同这一点,仅使目标无机盐的晶体析出。本实施方式中,利用了硫酸锂等锂盐的溶解度的温度依赖性小于硫酸钠等除锂盐以外的无机盐这一点。即,通过冷却至供给浓度下的锂盐的析出温度以上且除锂盐以外的无机盐的析出温度以下,由此,使锂盐以外的无机盐以晶体的形态析出。具体而言,作为用于使硫酸钠的晶体析出的冷却温度,为30℃以下,优选为5℃以上且20℃以下。此时,硫酸钠以硫酸钠十水合物(na2so4·
10h2o)的形态析出。
[0107]
析晶工序s8-3后的被处理液被供给至固液分离工序s8-4。固液分离工序s8-4中,使用固液分离装置15从被处理液中分离包含无机盐(本实施方式中为硫酸钠)的晶体的析出物。
[0108]
固液分离工序s8-4后的被处理液被供给至碳酸化工序s8-5。在碳酸化工序s8-5中,向去除了包含无机盐的晶体的析出物后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐,由此使被处理液中的锂以碳酸锂的晶体形态析出。由此,能够以碳酸锂的形态回收被处理液中的锂。作为碳酸盐,可以使用例如碳酸钠、碳酸铵、碳酸钾等。
[0109]
碳酸化工序s8-5中,优选通过向被处理液中混合二氧化碳而使碳酸锂的晶体析出。由此,在碳酸化工序s8-5中使用例如不含钠等碱金属的材料,能够抑制除锂以外的碱金属混入所析出的碳酸锂的晶体中。由此,能够回收纯度高的碳酸锂。
[0110]
但是存在如下情况:若持续混合二氧化碳,则被处理液的ph降低,因此碳酸锂的析出量减少。因此,优选在被处理液的ph达到7以下之前停止二氧化碳的混合。另外,可以通过向被处理液中添加碱来避免ph降低的情况。此时,优选通过添加碱而使ph维持在9以上。作为添加的碱,可以使用氢氧化钠、氢氧化钾、氢氧化锂等。
[0111]
碳酸化工序s8-5中,向被处理液中混合二氧化碳的方法没有特别限定,可以使用通常进行的方法。例如,可以一边在碳酸化槽16内搅拌被处理液一边用喷嘴以微细气泡的
状态向被处理液中供给二氧化碳,由此能够向被处理液中均匀地混合二氧化碳,能够使被处理液中的锂与二氧化碳高效地进行反应。另外,也可以通过在二氧化碳气氛下对被处理液进行喷雾而与二氧化碳进行反应。
[0112]
碳酸锂的溶解度会随着温度升高而降低,因此在碳酸化工序s8-5中优选使被处理液升温。由此,被处理液中的通过锂与二氧化碳的反应而产生的碳酸锂的溶解度降低,由此,能够增加碳酸锂晶体的析出量。另外,通过使被处理液升温,由此能够增大残留于被处理液的无机盐(本实施方式中为硫酸钠)的溶解度、抑制无机盐的结晶。由此,能够抑制无机盐的晶体与碳酸锂的晶体一起析出,因此在碳酸化工序s8-5中回收碳酸锂时能够提高碳酸锂的纯度。
[0113]
作为碳酸化工序s8-5中使被处理液升温的方法,没有特别限定,可以使用例如利用加热器等公知的加热装置加热碳酸化槽16内的被处理液的方法。需要说明的是,也可以构成为:在向碳酸化槽16供给被处理液之前,预先使用换热器等预热手段使被处理液升温。
[0114]
碳酸化工序s8-5后的被处理液被供给至固液分离工序s8-6。固液分离工序s8-6中,使用固液分离装置17从被处理液中分离包含碳酸锂的晶体的析出物。从被处理液中回收的析出物通过用水等进行洗涤而去除杂质,可以提高碳酸锂的纯度。该析出物的洗涤中使用的水没有特别限定,优选利用浓缩工序s8-2中的冷凝水,由此能够有效利用冷凝水。
[0115]
固液分离工序s8-6后的被处理液没有特别限定,由于包含杂质而优选一部分以排出液形式排出、一部分再次在体系内循环。由此能够回收被处理液中残留的锂,因此能够以高回收率回收锂。需要说明的是,对于洗涤上述包含碳酸锂的晶体的析出物后的洗涤废液,也优选与固液分离工序s8-6后的被处理液一起再次在体系内循环。
[0116]
使固液分离工序s8-6后的被处理液再次在体系内循环时,可以供给至浓缩工序s8-2(蒸发浓缩装置13)进行蒸发浓缩,优选供给至一次低ph调节工序s3(一次低ph调节槽3)和/或一次高ph调节工序s5(一次高ph调节槽5)。固液分离工序s8-6后的被处理液为碱性,因此可以作为一次低ph调节工序s3及一次高ph调节工序s5中添加的碱来利用。进而,若固液分离工序s8-6后的被处理液含有大量的碳酸根离子(co
32-),则在浓缩工序s8-2中蒸发浓缩时会在蒸发浓缩装置13的换热器的导热面析出碳酸盐的晶体。在此,供给至一次低ph调节工序s3及一次高ph调节工序s5的被处理液为酸性,由此,用该酸性被处理液中和固液分离工序s8-6后的被处理液,使碳酸根离子形成二氧化碳而逸出,能够防止浓缩工序s8-2中在蒸发浓缩装置13的换热器的导热面析出碳酸盐的晶体。
[0117]
另一方面,在浓缩工序s8-2中析出且在固液分离工序s8-4中回收的析出物中所含的无机盐(本实施方式中为硫酸钠)的晶体被供给至溶解工序s8-7。溶解工序s8-7没有特别限定,例如,在溶解槽18内以形成期望浓度的方式用例如水来溶解无机盐的晶体,由此,生成无机盐溶液。此时的温度没有特别限定,只要为能够溶解无机盐的晶体的温度即可。另外,无机盐的溶解中使用的水没有特别限定,优选利用浓缩工序s8-2中产生的冷凝水,由此能够有效利用冷凝水。
[0118]
溶解工序s8-7中得到的无机盐溶液被供给至电渗析工序s8-8。电渗析工序s8-8没有特别限定,例如利用双极膜电渗析装置19从无机盐溶液中分离并回收碱和无机酸。作为双极膜电渗析装置19,例如,可以适宜使用图5所示的三室电池单元方式的双极膜电渗析装置,所述三室电池单元方式的双极膜电渗析装置是多个单元190层叠而成的,所述单元190
在阳极195与阴极196之间具备阴离子交换膜191、阳离子交换膜192和2个双极膜193、194。本实施方式的双极膜电渗析装置19中,由阴离子交换膜191和阳离子交换膜192形成脱盐室r1,在阴离子交换膜191和一片双极膜193之间形成酸室r2,在阳离子交换膜192与另一片双极膜194之间形成碱室r3。在各双极膜193、194的外侧形成有阳极室r4和阴极室r5,阳极室r4中配置有阳极195,阴极室r5中配置有阴极196。
[0119]
在电渗析工序s8-8中,向脱盐室r1中导入无机盐溶液,向酸室r2和碱室r3中分别导入纯水。由此,在无机盐溶液包含例如硫酸钠的情况下,在脱盐室r1中,钠离子(na
)通过阳离子交换膜192,硫酸根离子(so
42-)通过阴离子交换膜191。另一方面,在酸室r2和碱室r3中,所供给的纯水在双极膜193、194中解离为氢离子(h
)和氢氧根离子(oh-),在酸室r2中氢离子(h
)与硫酸根离子(so
42-)结合而生成硫酸(h2so4),在碱室r3中氢氧根离子(oh-)与钠离子(na
)结合而生成氢氧化钠(naoh)。由此,从酸室r2中回收作为无机酸的硫酸(h2so4),从碱室r3回收作为碱的氢氧化钠(naoh)。需要说明的是,导入到酸室r2和碱室r3中的纯水可以利用浓缩工序s8-2中产生的冷凝水。
[0120]
脱盐室r1所排出的脱盐后的稀无机盐溶液(脱盐液)虽然没有特别限定,但是由于包含少量的锂而优选供给至浓缩工序s8-2(蒸发浓缩装置13)并在再次浓缩后在碳酸化工序s8-5中进行碳酸化。由此,能够以高回收率回收锂。需要说明的是,脱盐液在本实施方式中被供给至浓缩工序s8-2,但是当脱盐液中残留有钙和/或镁时,也可以将脱盐液供给至杂质去除工序s8-1。由此,可以在从脱盐液中去除钙、镁后供给至浓缩工序s8-2。另外,脱盐液也可以供给至一次低ph调节工序s3。由此,当脱盐液中残留有钴时,能够提高钴的回收率。
[0121]
另外,从酸室r2中回收的无机酸(本实施方式中为硫酸)虽然没有特别限定,但是优选供给至酸浸出工序s1(酸浸出槽1)和/或再溶解工序s7-1(再溶解槽7)而作为用于废锂离子电池的酸浸出、钴盐等的再溶解的无机酸进行再利用。进而,优选供给至杂质处理工序s8-1(多价阳离子去除装置12)而作为螯合树脂或离子交换树脂的再生液进行再利用。
[0122]
另外,从碱室r3中回收的碱(本实施方式中为氢氧化钠)虽然没有特别限定,但是优选供给至一次低ph调节工序s3(一次低ph调节槽2)和/或一次高ph调节工序s5(一次高ph调节槽5)和/或二次低ph调节工序s7-2(二次低ph调节槽8)和/或二次高ph调节工序s7-4(二次高ph调节槽10)而作为用于调节被处理液、再溶解液的ph的碱进行再利用。进而,优选供给至杂质处理工序s8-1(多价阳离子去除装置12)而作为螯合树脂或离子交换树脂的再生液进行再利用。
[0123]
上述本实施方式的钴回收方法中,对于至少溶解有钴及杂质金属的被处理液,首先在一次低ph调节工序s3中添加碱而将ph调节为4以上且7以下,由此从被处理液中去除杂质金属,在一次高ph调节工序s5中添加碱而将ph调节为7以上,由此使被处理液中所含的钴以钴盐形态析出。接着在再溶解工序s7-1中利用无机酸将析出的钴盐溶解,对于该再溶解液,在二次低ph调节工序s7-2中添加碱而将ph调节为4以上且7以下,由此即使被处理液中残留的杂质金属的盐一起析出并混入一次高ph调节工序s5中析出的钴盐中,也能够从再溶解液中将残留的杂质金属去除。然后,在二次高ph调节工序s7-4中向去除了杂质金属的再溶解液中添加碱而将ph调节为7以上;以钴盐形态析出,由此,能够以高纯度回收被处理液中所含的钴。
[0124]
另外,根据本实施方式的钴回收方法,使二次低ph调节工序s7-2中析出的包含杂
质金属的盐的晶体的析出物在沉淀工序s7-3中通过自重而沉淀,由此分离为上清液和包含析出物的浆料,回收作为上清液的再溶解液并供给至二次高ph调节工序s7-4。由此,无需如其它固液分离工序那样设置固液分离装置,通过重力使析出物沉淀并以浆料形式分离,因此不再需要分离所需的能量、过滤器的洗涤等。因此,能够降低成本。需要说明的是,通过在沉淀工序s7-3中利用离心分离来沉淀而分离为上清液和包含析出物的浆料的情况下,分离所需的能量稍有增加但是不需要过滤器的洗涤,能够缩短沉淀所需要的时间。
[0125]
需要说明的是,沉淀工序s7-3中得到的浆料中包含钴,若不回收该钴,则钴的回收率下降。因此,本实施方式的钴回收方法中,将沉淀工序s7-3中得到的浆料供给至一次低ph调节工序s3前的被处理液、一次低ph调节工序s3中的被处理液、被供给至固液分离工序s4的被处理液中的至少任一者。由此,能够在固液分离工序s4中分离浆料中所含的析出物,因此不需要为了从浆料中分离析出物而另外设置固液分离装置。另外,浆料中所含的钴在一次高ph调节工序s5中可以以钴盐形态再次析出且可以使析出的钴盐返回到再溶解工序s7-1以后的回收钴的工序中,因此能使钴的回收率维持为较高。
[0126]
综上,本实施方式的钴回收方法能够以高纯度和低成本从被处理液中回收钴。
[0127]
另外,根据本实施方式的钴回收方法,对于溶解有钴及杂质金属的被处理液及再溶解液,在第一低ph调节工序s3及第二次低ph调节工序s7-2中从被处理液及再溶解液中去除杂质金属时,用碱浓度低于1.0mol/l的稀碱水溶液进行被处理液及再溶解液的ph调节,由此,能够抑制钴与杂质金属从被处理液及再溶解液中被去除。因此,能够使供给至第一次高ph调节工序5及第二次高ph调节工序s7-4的被处理液及再溶解液中的钴的量维持为较高,因此在第一次高ph调节工序5及第二次高ph调节工序s7-4中能够以高回收率回收钴。
[0128]
进而,根据本实施方式的钴回收方法,在第一低ph调节工序s3及第二次低ph调节工序s7-2中使用了碱浓度低于1.0mol/l的稀碱水溶液,因此虽然供给至后的用于回收锂的碳酸化工序s8-5的被处理液及再溶解液的量变多,但是通过在碳酸化工序s8-5前在浓缩工序s8-2中对被处理液及再溶解液进行蒸发浓缩而减少了被处理液及再溶解液的量,被处理液及再溶解液中的锂浓度增加。因此,在碳酸化工序s8-5中能够很好地提高碳酸锂的回收率。
[0129]
需要说明的是,本发明人对第一低ph调节工序s3及第二次低ph调节工序s7-2中添加的碱水溶液的碱浓度进行了以下试验。具体而言,对具有以下的表1所示的成分的酸性溶液200ml添加碱水溶液,由此,进行调节酸性溶液的ph的处理。作为添加的碱水溶液,使用氢氧化锂水溶液。氢氧化锂水溶液的碱浓度设为0.2mol/l(实施例1)、0.5mol/l(实施例2)、1.0mol/l(实施例3),以酸性溶液的ph达到4.7的方式调整氢氧化锂水溶液的添加量。氢氧化锂水溶液的添加量在实施例1中为418.6ml、在实施例2中为168.5ml、在实施例3中为86.3ml。需要说明的是,通过添加氢氧化锂水溶液,酸性溶液中的锂含量在实施例1中为582mg、在实施例2中为585mg、在实施例3中为599mg,在逐渐增加。
[0130]
[表1]
[0131]
5、s8-4、s8-6得到的晶体,由此能够更好地提高各结晶的回收率。
[0141]
以上对第一方式的钴回收方法的一实施方式进行了说明,但是第一方式的钴回收方法不限于上述实施方式,可在不脱离本公开的主旨的限度内进行各种变更。
[0142]
作为一个变更例,例如在图1至图4的实施方式中为了去除溶解于再溶解工序s7-1所得到的再溶解液中的残留杂质金属,可以如图9及图10所示那样将再溶解液在供给至二次低ph调节工序s7-3之前供给至溶剂提取工序s7-2。
[0143]
在图9及图10的实施方式中,再溶解工序s7-1中,虽然没有特别限定,但是优选将再溶解液的ph调节为2.0以上且5.0以下。这是由于,再溶解液的ph如果过低,则在接下来的溶剂提取工序s7-2的溶剂提取中杂质金属的提取率下降,而如果过高,则有溶剂提取中连钴也被提取之虞。再溶解液的ph可以根据需要通过添加氢氧化钠等碱来进行调整。
[0144]
溶剂提取工序s7-2中,通过对再溶解液进行使用提取剂的溶剂提取,杂质金属移动到提取剂侧而分离为包含杂质金属的提取剂(有机相)和包含钴的再溶解液(水相)。由此能够从再溶解液中去除杂质金属。
[0145]
作为溶剂提取中使用的提取剂,没有特别限定,可列举例如9,9-二甲基癸酸(shell公司制造的“versatic acid 10”)等羧酸等,可以使用将这样的提取剂预先用烃系溶剂稀释而成者。作为烃系溶剂,没有特别限定,可列举例如exxon mobil公司制造的“isopar m”、exxon mobil公司制造的“solvesso 150”等。
[0146]
溶剂提取的方法没有特别限定,可以使用通常所进行的方法。例如,使再溶解液和提取剂在提取槽20内接触,用混合机等搅拌规定时间而混合,使杂质金属的离子与提取剂反应。提取剂相对于再溶解液的体积比(提取剂的体积/再溶解液的体积)没有特别限定,优选设定在1.0至10.0的范围内。溶剂提取时的平衡ph没有特别限定,优选通过添加氢氧化钠等碱而调节为2.0以上且5.0以下。通过将平衡ph设为5.0以下,由此,能够减少钴被提取到提取剂的情况,通过将平衡ph设为2.0以上,由此,能够提高提取剂的杂质金属提取率。
[0147]
在通过溶剂提取而将杂质金属提取到提取剂时,例如利用沉降器通过比重差将混合在一起的提取剂和再溶解液分离。溶剂提取可以重复进行,可根据残留的杂质金属的浓度来设定提取次数。另外,例如还可以设为使提取剂与再溶解液进行对流接触的多级方式。
[0148]
溶剂提取工序s7-2后的溶解有钴且去除了杂质金属的再溶解液被供给至二次低ph调节工序s7-3。二次低ph调节工序s7-3至固液分离工序s7-6的工序与图1至图4的实施方式的二次低ph调节工序s7-2至固液分离工序s7-5的工序相同。
[0149]
另一方面,溶剂提取工序s7-2后的包含杂质金属的提取剂被供给至逆提取工序s7-7,以回收杂质金属。逆提取工序s7-7中对提取剂进行使用无机酸的逆提取,由此,杂质金属移动到无机酸侧。由此,能够从提取剂中逆提取被提取剂提取的杂质金属。
[0150]
作为逆提取中使用的无机酸,没有特别限定,可以使用例如硫酸、盐酸等,本实施方式中,从低成本且易于处理的角度而使用硫酸。逆提取的方法没有特别限定,可以使用通常所进行的方法。例如,使提取剂和例如硫酸水溶液等无机酸水溶液在逆提取槽21内接触,用混合机等搅拌规定时间而进行混合。无机酸水溶液的ph没有特别限定,优选为2.0以下。
[0151]
通过逆提取而从提取剂中逆提取杂质金属时,例如利用沉降器通过比重差将混合在一起的提取剂和无机酸水溶液分离。对于逆提取工序s7-7后的溶解有杂质金属的无机酸水溶液,例如可以一边在中和槽22内搅拌一边添加例如氢氧化钠水溶液等碱水溶液而进行
中和处理,中和处理后通过例如过滤、离心分离等进行固液分离,以例如氢氧化物等无机盐的晶体形式回收杂质金属。
[0152]
逆提取工序s9后的去除了杂质金属的提取剂供给至溶剂提取工序s6(提取槽20),作为溶剂提取工序s6中使用的提取剂进行再利用。
[0153]
根据图9及图10的实施方式,对于再溶解工序s7-1后的溶解有钴及残留的杂质金属的再溶解液,在溶剂提取工序s7-2中从再溶解液中提取杂质金属后,在第二次低ph调节工序s7-3中从再溶解液中去除杂质金属,因此能够尽可能地减少再溶解液中残留的杂质金属。因此,在接下来的用于回收钴的二次高ph调节工序s7-5中,能够以高纯度回收钴。
[0154]
需要说明的是,在图9及图10的实施方式中,在再溶解工序s7-1后进行了溶剂提取工序s7-2,但是也可以如图11及图12所示那样在沉淀工序s7-3后进行溶剂提取工序s7-4。在图11及图12的实施方式中,沉淀工序s7-3后的作为上清液的再溶解液被供给至溶剂提取工序s7-4,通过与图9及图10的实施方式的溶剂提取工序s7-2同样的方法从再溶解液中提取残留的杂质金属。另外,溶剂提取工序s7-4后的包含杂质金属的提取剂被供给至逆提取工序s7-7以回收杂质金属,通过与图9及图10的实施方式的逆提取工序s7-7同样的方法从提取有杂质金属的提取剂中逆提取杂质金属。溶剂提取工序s7-4后的溶解有钴且去除了杂质金属的再溶解液被供给至二次高ph调节工序s7-5。二次高ph调节工序s7-5至固液分离工序s7-6的工序与上述实施方式的二次高ph调节工序s7-4至固液分离工序s7-5的工序相同。
[0155]
根据图11及图12的实施方式,对于再溶解工序s7-1后的溶解有钴及残留的杂质金属的再溶解液,在第二次低ph调节工序s7-2中从再溶解液中去除杂质金属后,在溶剂提取工序s7-2中从再溶解液中提取杂质金属,因此能够尽可能地减少再溶解液中残留的杂质金属。因此,在接下来的用于回收钴的二次高ph调节工序s7-5中,能够以高纯度回收钴。
[0156]
作为另一变更例,在图1至图4的实施方式中为了进一步提高在固液分离工序s7-5中回收的析出物中的钴盐晶体的纯度,可以如图13及图14所示那样将固液分离工序s7-5中回收的析出物供给至再再溶解工序s7-6。
[0157]
再再溶解工序s7-6中,通过添加无机酸而溶解包含钴盐的晶体的析出物。作为无机酸,可以使用例如硫酸、盐酸、硝酸、磷酸等,本实施方式中,从低成本且易于处理的角度而使用硫酸。作为溶解析出物的方法,没有特别限定,例如在再再溶解槽23内以达到期望浓度的方式用例如硫酸水溶液等无机酸水溶液来溶解析出物,由此,生成溶解有钴、析出物中可能包含的少量杂质金属的再再溶解液。再再溶解工序s7-6中,水溶液中的无机酸的浓度优选为1mol/l以上且5mol/l以下,水溶液的温度优选为60℃以上。
[0158]
再再溶解工序s7-6中得到的再溶解液被供给至溶剂提取工序s7-7,通过与图9及图10的实施方式的溶剂提取工序s7-2同样的方法从再再溶解液中提取残留的杂质金属。另外,溶剂提取工序s7-7后的包含杂质金属的提取剂被供给至逆提取工序s7-10以回收杂质金属,通过与图9及图10的实施方式的逆提取工序s7-7同样的方法从提取有杂质金属的提取剂中逆提取杂质金属。
[0159]
溶剂提取工序s7-7后的溶解有钴且去除了杂质金属的再再溶解液被供给至三次高ph调节工序s7-8。三次高ph调节工序s7-8中,向再再溶解液中添加碱而与一次高ph调节工序s5同样地将ph调节为7以上且11以下、优选8以上且10以下的范围。由此,再再溶解液中的钴以氢氧化钴等钴盐的晶体形态析出。需要说明的是,三次高ph调节工序s7-8中,除了钴
以外,镍、锰等有价金属也可以以氢氧化物等无机盐的晶体形态析出。作为ph调节中使用的碱,可以使用例如氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中,从低成本且易于处理的角度而使用氢氧化钠。
[0160]
三次高ph调节工序s7-8中调节再再溶解液的ph的方法没有特别限定,可以使用通常所进行的方法。可列举例如:一边在三次高ph调节槽23内搅拌再再溶解液一边添加例如氢氧化钠水溶液等碱水溶液的方法。调节ph时,优选将再再溶解液升温到例如30℃至60℃范围内的恒定温度。添加于再再溶解液的碱水溶液没有特别限定,优选碱浓度为1.0mol/l以上。
[0161]
三次高ph调节工序s7-8后的再溶解液被供给至固液分离工序s7-9(相当于权利要求书所记载的“三次钴分离工序”)。固液分离工序s7-9中,使用固液分离装置24从再再溶解液中分离在三次高ph调节工序s7-8中析出的包含钴盐的晶体等的析出物。由此,能够以钴盐形态回收溶解于再再溶解液的钴。
[0162]
固液分离工序s7-9中回收的析出物用洗涤液进行洗涤。洗涤后的洗涤废液优选与再再溶解液一起供给至杂质去除工序s8-1。由此,能够将再再溶解液、洗涤废液中所含的锂供给至碳酸化工序s8-5,通过在碳酸化工序s8-5中碳酸化而能够以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用浓缩工序s8-2中产生的冷凝水,由此能够有效利用冷凝水。
[0163]
作为另一变更例,在图1至图4的实施方式中对于浓缩工序s8-2前的被处理液进行了至少去除钙和/或镁的杂质去除工序s8-1,但是也可以代替该工序或在该工序的基础上对电渗析工序s8-8前的无机盐溶液同样地进行至少去除钙和/或镁的杂质去除工序。需要说明的是,对于上述任意实施方式都可以进行同样的变更。
[0164]
作为另一变更例,在图1至图4的实施方式中在溶解工序s8-7后且电渗析工序s8-8前可以进行用于去除无机盐溶液中所含的例如硅等杂质的处理工序。该处理工序可以代替杂质去除工序s8-1或在杂质去除工序s8-1的基础上进行。作为该处理工序的一例,将无机盐溶液中所含的无机盐(本实施方式中为硫酸钠)通过蒸发析晶、蒸发浓缩等重结晶后,对无机盐的晶体进行固液分离而包含无机盐的晶体的水溶液中回收。然后例如用水将回收的无机盐的晶体溶解,再次生成无机盐溶液。再次生成的无机盐溶液被供给至电渗析工序s8-8。
[0165]
该实施方式中,通过在电渗析工序s8-8前去除无机盐溶液中所含的硅,由此,在电渗析工序s8-8中进行电渗析的无机溶液中的杂质量也减少,因此能够使双极膜的性能维持为较高。进而,在将电渗析工序s8-8后的稀无机盐溶液(脱盐液)供给至蒸发浓缩装置13而在浓缩工序s8-2中再次进行蒸发浓缩时,脱盐液的杂质量减少,由此,能够抑制浓缩工序s8-2中在蒸发浓缩装置13的换热器的导热面产生、附着氧化皮。而且,由于由碳酸化工序s8-5后的固液分离工序s8-6得到的被处理液中的杂质量减少,能够使固液分离工序s8-6后的被处理液的大部分再次在体系内循环。因此,能够更充分地回收固液分离工序s8-6后的被处理液中残留的锂,因此能够以高回收率回收锂。需要说明的是,对于上述任意实施方式,均能够进行同样的变更。
[0166]
作为另一变更例,在图1至图4的实施方式中可以如图15及图16所示在酸浸出工序s1前进一步包括对废锂离子电池进行焙烧的焙烧工序s0。焙烧工序s0中对废锂离子电池进
行焙烧的方法没有特别限定,可以使用公知的焙烧装置25。
[0167]
图15及图16的实施方式中,将焙烧装置25(焙烧工序s0)中产生的排放气体供给至碳酸化工序s8-5(碳酸化槽16),在碳酸化工序s8-5中使排放气体形成二氧化碳混合到被处理液中。由此,能够减少碳酸化工序s8-5中使用的二氧化碳的量。另外,碳酸化工序s8-5中可以将被处理液升温。需要说明的是,对于上述任意实施方式,均能够进行同样的变更。
[0168]
作为另一变更例,在图1至图4的实施方式中,杂质去除工序s8-1及之后的工序中的锂回收方法没有特别限定,可以使用各种方法。需要说明的是,对于上述任意实施方式,均能够进行同样的变更。
[0169]
作为另一变更例,在图1至图4的实施方式中以从废锂离子电池中回收钴的情况为例,但是本公开不限于用于从废锂离子电池中回收钴的方法。需要说明的是,对于上述任意实施方式,均能够进行同样的变更。
[0170]
[第二方式的钴回收方法]
[0171]
从废锂离子电池中回收钴时,废锂离子电池中如果包含铁、铝、铜等杂质金属,则这些杂质金属也会通过酸浸出而溶解于被处理液。由此,使作为目标回收物的钴中混入杂质金属,使品质下降,因此当被处理液中包含杂质金属时,需要将其去除。作为去除杂质金属中的铜的方法,例如专利文献2中通过对将废锂离子电池用酸进行浸出而得的被处理液进行溶剂提取,从而从被处理液中分离铜。但是,专利文献2中记载的方法是对全部的将废锂离子电池用酸进行浸出而得的被处理液进行溶剂提取。因此,需要大量的用于对被处理液进行溶剂提取的提取剂,当提取剂的量随着废锂离子电池的量及酸浸出中使用的酸量而增加时,提取剂的成本非常高,不经济。第二方式的钴回收方法是为了解决上述课题而作出的,目的在于,提供能够从至少溶解有钴及铜的被处理液中以高纯度和低成本回收钴的钴回收方法。
[0172]
专利文献2:日本特开2014-162982号公报
[0173]
本公开的第二方式的钴回收方法的特征在于,其包括下述工序:一次ph调节工序,向至少溶解有钴及铜的酸性被处理液中添加碱而将ph调节为7以上;一次钴分离工序,从上述被处理液中分离在上述一次ph调节工序中析出的包含钴盐的晶体及铜盐的晶体的析出物;再溶解工序,通过添加无机酸而溶解在上述一次钴分离工序中分离出的析出物;溶剂提取工序,对于上述再溶解工序中得到的再溶解液进行使用提取剂的溶剂提取,从该再溶解液中分离铜;二次ph调节工序,向上述溶剂提取工序后的再溶解液中添加碱而将ph调节为7以上;以及,二次钴分离工序,从上述再溶解液中分离在上述二次ph调节工序中析出的包含钴盐的晶体的析出物。
[0174]
段落0122中记载的钴回收方法可以以下述方式构成:进一步包括逆提取工序,该工序对于上述溶剂提取工序后的提取有铜的提取剂进行使用无机酸的逆提取,从该提取剂中分离铜,将上述逆提取工序后的提取剂作为用于上述溶剂提取工序的提取剂进行再利用。
[0175]
另外,段落0122或段落0123中记载的钴回收方法可以以下述方式构成:进一步包括酸浸出工序,所述工序通过用无机酸对废锂离子电池进行浸出而溶解钴及铜,从而得到上述被处理液。
[0176]
另外,段落0122至段落0124中的任一段落所述的钴回收方法可以以下述方式构
成:在上述一次ph调节工序中,向上述被处理液及中添加碱而将ph调节为4以上且7以下,向分离由此而析出的析出物后的上述被处理液中添加碱而将ph调节为7以上。
[0177]
另外,段落0122至段落0125中的任一段落所述的钴回收方法可以以在被处理液中溶解有锂、且还包括下述工序的方式构成,所述工序为:浓缩工序,对上述一次钴分离工序后的被处理液进行蒸发浓缩;碳酸化工序,向上述浓缩工序后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐;以及,锂分离工序,从上述被处理液中分离在上述碳酸化工序中析出的包含碳酸锂的晶体的析出物。
[0178]
根据本公开的第二方式的钴回收方法,对于至少溶解有钴及铜的被处理液,首先在一次ph调节工序中添加碱而将ph调节为7以上,由此从被处理液中以钴盐形态回收钴,然后在再溶解工序中利用无机酸溶解所回收的钴盐,在溶剂提取工序中对再溶解钴而成的再溶解液进行溶剂提取,由此从再溶解液中分离再溶解液中所含的铜。再溶解液中使用的无机酸为足以溶解在一次ph调节工序从被处理液中回收的钴盐、且少于最初为了溶解钴等金属而用于被处理液的无机酸量的量。特别是被处理液为对废锂离子电池进行酸浸出而得的液体时,由于作为溶解对象的废锂离子电池量较多,因此用于酸浸出的无机酸也需要较多的量,被处理液的量也成为较多的量。因此,通过如本公开的第二方式的钴回收方法那样在暂时从被处理液中去除钴后再次用无机酸溶解钴,从而与最初的被处理液量相比,能够使溶解有钴的再溶解液量大幅减少。再溶解液的量减少,则进行用于分离铜等杂质金属的溶剂提取时所用的提取剂的量也能够减少,因此能够降低提取剂成本。进而,由于从再溶解液中通过溶剂提取而去除铜等杂质金属,因此能够以高纯度回收钴。综上,本公开的第二方式的钴回收方法能够以高纯度和低成本从溶解有钴及铜的被处理液中回收钴。
[0179]
图17针对本公开的第二方式的钴回收方法的实施方式示出了各工序的步骤,图18示出实施本实施方式的钴回收方法的处理装置的简要构成。本实施方式的钴回收方法可以适宜用于从至少包含钴及作为杂质金属的铜的酸性被处理液中回收钴,尤其可以适宜用于从废锂离子电池中回收钴。以下以从废锂离子电池中回收钴、进一步回收锂的情况为例进行说明。
[0180]
本实施方式的钴回收方法包括下述工序:
[0181]-用无机酸对废锂离子电池进行浸出而溶解钴及铜、进而至少溶解锂的酸浸出工序s1;
[0182]-从酸浸出工序s1中得到的至少溶解有钴、铜及锂的酸性的被处理液中分离不溶残渣的固液分离工序s2;
[0183]-向固液分离工序s2后的去除了不溶残渣的被处理液中添加碱而将ph调节为7以上的一次ph调节工序s3;
[0184]-从被处理液中分离在一次ph调节工序s3中析出的包含钴盐及铜盐的晶体的析出物的固液分离工序s4(一次钴分离工序);
[0185]-通过添加无机酸而将固液分离工序s4中分离出的析出物溶解的再溶解工序s5;
[0186]-对于再溶解工序s5中得到的至少溶解有钴及铜的再溶解液进行使用提取剂的溶剂提取,从再溶解液中分离铜的溶剂提取工序s6;
[0187]-向溶剂提取工序s6后的去除了铜的再溶解液中添加碱而将ph调节为7以上的二次ph调节工序s7;
[0188]-从再溶解液中分离在二次ph调节工序s7中析出的包含钴盐的晶体的析出物的固液分离工序s8(二次钴分离工序);以及,
[0189]-对于溶剂提取工序s6后的提取有铜的提取剂进行使用无机酸的逆提取,从提取剂中分离铜的逆提取工序s9。
[0190]
本实施方式的钴回收方法中,为了进一步回收锂,进一步包括下述工序:
[0191]-对于固液分离工序s4后的去除了析出物且溶解有锂及无机盐的被处理液进行螯合处理的杂质去除工序s10;
[0192]-对杂质去除工序s10后的被处理液进行蒸发浓缩的浓缩工序s11;
[0193]-对于浓缩工序s11后的被处理液进行冷却析晶,使无机盐以晶体形态析出的析晶工序s12;
[0194]-从被处理液中分离在析晶工序s12中析出的包含无机盐的晶体的析出物的固液分离工序s13;
[0195]-向固液分离工序s13后的去除了析出物的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐的碳酸化工序s14;
[0196]-从被处理液中分离在碳酸化工序s14中析出的包含碳酸锂的晶体的析出物的固液分离工序s15(相当于权利要求书中记载的“锂分离工序”);
[0197]-使用水溶解在固液分离工序s13中分离出的包含无机盐的晶体的析出物的溶解工序s16;以及,
[0198]-对于在溶解工序s16中得到的溶解无机盐而成的无机盐溶液进行双极膜电渗析,从无机盐溶液中分离碱及无机酸的电渗析工序s17。
[0199]
回收钴的对象的废锂离子电池与上述第一方式的钴回收方法中相同,这里省略了详细说明。
[0200]
首先,在酸浸出工序s1中,用无机酸对上述废锂离子电池进行浸出。由此而溶解废锂离子电池中包含的钴、锂等有价金属。在该酸浸出时,除了有价金属以外,铜等杂质金属也会溶解。作为无机酸,可以实验例如硫酸、盐酸、硝酸、磷酸等,本实施方式中,从低成本且易于处理角度而使用硫酸。
[0201]
酸浸出工序s1中,对于用无机酸对废锂离子电池进行浸出的方法没有特别限定,可以使用通常所进行的方法。例如,酸浸出槽1中,将废锂离子电池浸渍于例如硫酸水溶液等无机酸水溶液中,搅拌规定时间,由此得到溶解有上述钴、锂、铜等金属的被处理液。酸浸出工序s1中,水溶液中的无机酸的浓度优选为1mol/l以上且5mol/l以下,水溶液的温度优选为60℃以上。
[0202]
酸浸出工序s1中得到的被处理液被供给至固液分离工序s2。固液分离工序s2中,使用固液分离装置从被处理液中分离不溶残渣。不溶残渣为废锂离子电池中包含的主要不溶于无机酸的碳材料、金属材料、有机材料。作为进行固液分离的方法,可以使用例如加压过滤(压滤,filter press)、真空过滤、离心过滤等各种过滤装置、倾析型之类的离心分离装置等公知的固液分离装置。需要说明的是,在以下的固液分离工序s4、s8、s13、s15等中也同样。
[0203]
固液分离工序s2后的被处理液被供给至一次ph调节工序s3。一次ph调节工序s3中,向被处理液中添加碱而将ph调节为7以上、优选7以上且13以下、更优选7以上且11以下、
进一步优选8以上且10以下的范围。由此,被处理液中的钴以氢氧化钴等钴盐的晶体形态析出,并且铜以氢氧化铜等铜盐的晶体形态析出,从被处理液中去除。需要说明的是,一次ph调节工序s3中,除了钴、铜以外,镍、锰等有价金属和/或铁、铝等杂质金属也以氢氧化物等无机盐的晶体形态析出,可以从被处理液中去除。作为ph调节中使用的碱,可以使用例如氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中,从低成本且易于处理的角度而使用氢氧化钠。
[0204]
一次ph调节工序s3中调整被处理液的ph的方法没有特别限定,可以使用通常所进行的方法。可列举例如:一边在一次ph调节槽2内搅拌被处理液一边添加例如氢氧化钠水溶液等碱水溶液的方法。ph调节时,优选将被处理液升温到例如30℃至80℃范围内的恒定温度。添加于被处理液的碱水溶液没有特别限定,优选碱浓度为0.2mol/l以上。
[0205]
一次ph调节工序s3后的被处理液被供给至固液分离工序s4。固液分离工序s4中,使用固液分离装置从被处理液中分离在一次ph调节工序s3中析出的包含钴盐的晶体及铜盐的晶体等的析出物。固液分离工序s4中回收的析出物用洗涤液进行洗涤。洗涤后的洗涤废液优选与被处理液一起供给至杂质去除工序s10。由此,洗涤废液中所含的锂可以与被处理液中所含的锂一起从杂质去除工序s10供给至碳酸化工序s14,通过在碳酸化工序s14中碳酸化而能够以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用浓缩工序s11中对被处理液进行蒸发浓缩时产生的冷凝水,由此能够有效利用冷凝水。
[0206]
固液分离工序s4中回收的析出物中,除了钴以外还混入有铜等杂质金属。因此,为了去除铜等杂质金属,固液分离工序s4中回收的析出物被供给至再溶解工序s5。
[0207]
再溶解工序s5中,通过添加无机酸而溶解包含钴盐的晶体及铜盐的晶体的析出物。作为无机酸,可以使用例如硫酸、盐酸、硝酸、磷酸等,本实施方式中,从低成本且易于处理的角度而使用硫酸。作为溶解该析出物的方法,没有特别限定,例如,在再溶解槽3内以达到期望浓度的方式使用例如硫酸水溶液等无机酸水溶液溶解该析出物,由此,得到溶解有钴、铜等的再溶解液。再溶解工序s5中,水溶液中的无机酸的浓度优选为1mol/l以上且5mol/l以下,水溶液的温度优选为30℃以上。再溶解液的ph如果过低,则在接下来的溶剂提取工序s6的溶剂提取中铜等杂质金属的提取率下降,而如果过高则有溶剂提取中连钴也被提取之虞。因此,优选根据需要添加氢氧化钠等碱而将再溶解液的ph调节为2.0以上且5.0以下。
[0208]
再溶解工序s5中得到的再溶解液被供给至溶剂提取工序s6。溶剂提取工序s6中,对再溶解液进行使用提取剂的溶剂提取,由此铜等杂质金属移动到提取剂侧,分离为包含铜等杂质金属的提取剂(有机相)与包含钴的再溶解液(水相)。由此,能够从再溶解液中去除铜等杂质金属。
[0209]
作为溶剂提取中使用的提取剂,没有特别限定,可列举例如9,9-二甲基癸酸(shell公司制造的“versatic acid 10”)等羧酸等,可以使用将这样的提取剂预先用烃系溶剂稀释而成者。作为烃系溶剂,没有特别限定,可列举例如exxon mobil公司制造的“isopar m”、exxon mobil公司制造的“solvesso 150”等。
[0210]
溶剂提取的方法没有特别限定,可以使用通常所进行的方法。例如,使再溶解液和提取剂在提取槽4内接触,用混合机等搅拌规定时间而进行混合,使铜等杂质金属的离子与提取剂反应。提取剂相对于再溶解液的体积比(提取剂的体积/再溶解液的体积)没有特别
限定,优选设定在1.0至10.0的范围内。溶剂提取时的平衡ph没有特别限定,优选通过添加氢氧化钠等碱而调节为2.0以上且5.0以下。通过将平衡ph设为5.0以下,由此,能够减少钴被提取到提取剂的情况,通过将平衡ph设为2.0以上,由此,能够提高提取剂的铜等杂质金属的提取率。
[0211]
在通过溶剂提取而将铜等杂质金属提取到提取剂时,例如利用沉降器通过比重差将混合在一起的提取剂和再溶解液分离。溶剂提取可以重复进行,可根据残留的铜等杂质金属的浓度来确定提取次数。另外,例如还可以设为使提取剂与再溶解液进行对流接触的多级方式。
[0212]
溶剂提取工序s6后的溶解有钴且去除了铜等杂质金属的再溶解液被供给至二次ph调节工序s7。二次ph调节工序s7中,与一次ph调节工序s3同样地向再溶解液中添加碱而将ph调节为7以上、优选7以上且13以下、更优选7以上且11以下、进一步优选8以上且10以下的范围。由此,再溶解液中的钴以氢氧化钴等钴盐的晶体形态析出。需要说明的是,在二次ph调节工序s7中,除了钴以外,镍、锰等有价金属也可以以氢氧化物等无机盐的晶体形态析出。作为ph调节中使用的碱,可以与一次ph调节工序s3同样地使用例如氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中,从低成本且易于处理的角度而使用氢氧化钠。
[0213]
二次ph调节工序s7中调整再溶解液的ph的方法没有特别限定,可以使用通常所进行的方法。可列举例如:一边在二次ph调节槽5内搅拌再溶解液一边添加例如氢氧化钠水溶液等碱水溶液的方法。ph调节时,优选将再溶解液升温到例如30℃至80℃范围内的恒定温度。添加于再溶解液的碱水溶液没有特别限定,优选碱浓度为0.2mol/l以上。
[0214]
二次高ph调节工序s7后的再溶解液被供给至固液分离工序s8。固液分离工序s8中,使用固液分离装置从再溶解液中分离在二次ph调节工序s7中析出的包含钴盐的晶体等的析出物。由此,可以使再溶解液中溶解的钴以钴盐形式析出并将其回收。
[0215]
固液分离工序s8中回收的析出物用洗涤液进行洗涤。洗涤后的洗涤废液优选与再溶解液一起供给至杂质去除工序s10。由此,再溶解液、洗涤废液中所含的锂可以在浓缩工序s11中浓缩后供给至碳酸化工序s14,通过在碳酸化工序s14中碳酸化而能够以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选利用浓缩工序s11中产生的冷凝水,由此能够有效利用冷凝水。需要说明的是,在本实施方式中将洗涤后的洗涤废液与再溶解液一起供给至杂质去除工序s10,由此当洗涤废液、再溶解液中包含钙和/或镁时,在杂质去除工序s10中将它们去除,而在洗涤废液、再溶解液不含钙和/或镁的情况下,可以将该液体供给至浓缩工序s11。另外,洗涤废液、再溶解液可以被供给至一次ph调节工序s3。由此,在二次ph调节工序s7中未析出、再溶解液中残留钴的情况下,可以提高钴的回收率。
[0216]
另一方面,溶剂提取工序s6后包含铜等杂质金属的提取剂被供给至逆提取工序s9,以回收铜等杂质金属。逆提取工序s9中,对于提取剂进行使用无机酸的逆提取,由此铜等杂质金属移动到无机酸侧。由此,能够从提取剂中逆提取被提取剂提取的铜等杂质金属。
[0217]
作为逆提取中使用的无机酸,没有特别限定,可以使用例如硫酸、盐酸等,本实施方式中,从低成本且易于处理的角度而使用硫酸。逆提取的方法没有特别限定,可以使用通常所进行的方法。例如,使提取剂和例如硫酸水溶液等无机酸水溶液在逆提取槽6内接触,用混合机等搅拌规定时间而进行混合。无机酸水溶液的ph没有特别限定,优选为2.0以下。
[0218]
通过逆提取而从提取剂中逆提取铜等杂质金属时,例如利用沉降器通过比重差将
混合在一起的提取剂和无机酸水溶液分离。对于逆提取工序s9后的溶解有铜等杂质金属的无机酸水溶液,例如可以一边在中和槽7内搅拌一边添加例如氢氧化钠水溶液等碱水溶液而进行中和处理,中和处理后通过例如过滤、离心分离等进行固液分离,以例如氢氧化物等无机盐的晶体形式回收铜等杂质金属。
[0219]
逆提取工序s9后的去除了铜等杂质金属的提取剂供给至溶剂提取工序s6(提取槽4),作为溶剂提取工序s6中使用的提取剂进行再利用。
[0220]
然后,上述固液分离工序s4后的被处理液中除了溶解有锂以外,还由于酸浸出工序s1及一次ph调节工序s3中添加的无机酸(本实施方式中为硫酸)及碱(本实施方式中为氢氧化钠)而溶解有无机盐(本实施方式中为硫酸钠)。另外,被处理液中通常还溶解有钙、镁、硅等杂质。以下说明回收被处理液中的锂的方法。
[0221]
固液分离工序s4后的被处理液被供给至杂质去除工序s10。杂质去除工序s10中,至少去除被处理液中所含的钙和/或镁等多价阳离子。通过去除在被处理液作为杂质而包含的钙、镁等,能够抑制在接下来的浓缩工序s11中在蒸发浓缩装置9的换热器的导热面上产生、附着氧化皮,能够使热交换效率维持为较高。另外,若被处理液中包含钙、镁等,电渗析工序s17中,无机溶液中所含的钙、镁等多价阳离子会在双极膜电渗析装置13的阳离子交换膜内析出,有导致膜性能下降之虞。因此,通过预先从被处理液中去除钙、镁等在电渗析运转中引起结垢等问题的物质,由此,能够防止对双极膜电渗析装置13的阳离子交换膜的不良影响,能够使电渗析的性能维持为较高。
[0222]
杂质去除工序s10中从被处理液中去除钙、镁的方法没有特别限定,可以使用例如多价阳离子去除装置8。多价阳离子去除装置8是去除钙离子、镁离子等2价以上的多价阳离子的装置,例如可以例示出在内部具备离子交换树脂、能够在被处理液接触离子交换树脂时吸附钙离子、镁离子的构成的装置。作为多价阳离子去除装置8,此外可以例示出能够向填充有螯合树脂的柱中通入被处理液的构成的装置。作为螯合树脂,可以使用能够选择性捕捉钙离子、镁离子的树脂,例如可以例示出亚氨基二乙酸型、氨基磷酸型等。另外,作为多价阳离子去除装置8,可列举添加有螯合剂的装置等。需要说明的是,在杂质去除工序s10中,从被处理液中去除的杂质除了钙、镁以外还包括硅(硅酸根离子)。
[0223]
杂质去除工序s10后的被处理液被供给至浓缩工序s11。在浓缩工序s11中,加热被处理液来进行蒸发浓缩,即使被处理液中的水分蒸发,由此对被处理液进行浓缩。由此,被处理液的液体量减少、被处理液中的锂浓度增加。由此,在后述的碳酸化工序s14中能够提高碳酸锂的回收率。
[0224]
浓缩工序s11中,优选将被处理液蒸发浓缩至如下浓度,所述浓度为锂在浓缩后的被处理液中例如不会以硫酸锂等锂盐的晶体形态析出的程度。由此,能够提高浓缩后的被处理液中的锂浓度,在碳酸化工序s14中能够提高碳酸锂的回收率。
[0225]
需要说明的是,在浓缩工序s11中析出了析出物的情况下,可以进行将其从被处理液中分离的固液分离工序。
[0226]
浓缩工序s11中,对被处理液进行蒸发浓缩的方法没有特别限定,可以使用例如蒸发浓缩装置9。蒸发浓缩装置9只要能够通过蒸发而将被处理液浓缩就没有特别限定,可以使用例如热泵型、喷射器(eductor)驱动型、蒸汽型、闪蒸型等公知的蒸发浓缩装置,优选热泵型的蒸发浓缩装置。使用热泵型的蒸发浓缩装置的情况下,能够显著抑制所用的能量。
[0227]
蒸发浓缩装置9通过连接有未图示的真空泵而使内部维持为低压,浓缩工序s11中优选通过在压力低于大气压的低压下加热被处理液来进行蒸发浓缩。与大气压下相比,低压下被处理液的蒸发温度(被处理液中所含的水的沸点)降低,因此通过在低压下进行蒸发浓缩,能够使被处理液的蒸发浓缩所需的能量被抑制为较低而实现节能。
[0228]
需要说明的是,浓缩工序s11中并非必须通过在压力低于大气压的低压下加热被处理液来进行蒸发浓缩,例如,也可以在大气压下加热被处理液来进行蒸发浓缩。
[0229]
浓缩工序s11后的被处理液被供给至析晶工序s12。析晶工序s12中,对被处理液进行冷却析晶。析晶工序s12中降低被处理液的温度,使溶解度降低至被处理液中所含的无机盐发生结晶化为止,由此能够降低被处理液中的无机盐(本实施方式中为硫酸钠)的浓度。因此,在碳酸化工序s14中回收碳酸锂时能够提高碳酸锂的纯度。
[0230]
析晶工序s12中,对被处理液进行冷却析晶的方法没有特别限定,可以使用例如冷却析晶装置10。冷却析晶装置10是使供给的被处理液在析晶槽内冷却、使作为目标的无机盐的晶体析出的装置。作为冷却析晶装置10,可以使用例如冷却方式为利用夹套、内部盘管的析晶装置、外部循环冷却式的析晶装置等公知的冷却析晶装置,没有特别限定。
[0231]
析晶工序s12中,利用饱和溶解度、溶解度的温度依赖性根据无机盐而不同这一点,仅使目标无机盐的晶体析出。本实施方式中,利用了硫酸锂等锂盐的溶解度的温度依赖性小于硫酸钠等除锂盐以外的无机盐这一点。即,通过冷却至供给浓度下的锂盐的析出温度以上且除锂盐以外的无机盐的析出温度以下,由此,使锂盐以外的无机盐以晶体的形态析出。具体而言,作为用于使硫酸钠的晶体析出的冷却温度,为30℃以下,优选为5℃以上且20℃以下。此时,硫酸钠以硫酸钠十水合物(na2so4·
10h2o)的形态析出。
[0232]
析晶工序s12后的被处理液被供给至固液分离工序s13。固液分离工序s13中,使用固液分离装置从被处理液中分离包含无机盐(本实施方式中为硫酸钠)的晶体的析出物。
[0233]
固液分离工序s13后的被处理液被供给至碳酸化工序s14。在碳酸化工序s14中,向去除了包含无机盐的晶体的析出物后的被处理液中混合二氧化碳和/或添加水溶性的碳酸盐,由此使被处理液中的锂以碳酸锂的晶体形态析出。由此,能够以碳酸锂的形态回收被处理液中的锂。作为碳酸盐,可以使用例如碳酸钠、碳酸铵、碳酸钾等。
[0234]
碳酸化工序s14中,优选通过向被处理液中混合二氧化碳而使碳酸锂的晶体析出。由此,在碳酸化工序s14中使用例如不含钠等碱金属的材料,能够抑制除锂以外的碱金属混入所析出的碳酸锂的晶体中。由此,能够回收纯度高的碳酸锂。
[0235]
但是存在如下情况:若持续混合二氧化碳,则被处理液的ph降低,因此碳酸锂的析出量减少。因此,优选在被处理液的ph达到7以下之前停止二氧化碳的混合。另外,可以通过向被处理液中添加碱来避免ph降低的情况。此时,优选通过添加碱而使ph维持在9以上。作为添加的碱,可以使用氢氧化钠、氢氧化钾、氢氧化锂等。
[0236]
碳酸化工序s14中,向被处理液中混合二氧化碳的方法没有特别限定,可以使用通常进行的方法。例如,可以一边在碳酸化槽11内搅拌被处理液一边用喷嘴以微细气泡的状态向被处理液中供给二氧化碳,由此能够向被处理液中均匀地混合二氧化碳,能够使被处理液中的锂与二氧化碳高效地进行反应。另外,也可以通过在二氧化碳气氛下对被处理液进行喷雾而与二氧化碳进行反应。
[0237]
碳酸锂的溶解度会随着温度升高而降低,因此在碳酸化工序s14中优选使被处理
液升温。由此,被处理液中的通过锂与二氧化碳的反应而产生的碳酸锂的溶解度降低,由此,能够增加碳酸锂晶体的析出量。另外,通过使被处理液升温,由此能够增大残留于被处理液的无机盐(本实施方式中为硫酸钠)的溶解度、抑制无机盐的结晶。由此,能够抑制无机盐的晶体与碳酸锂的晶体一起析出,因此在碳酸化工序s14中回收碳酸锂时能够提高碳酸锂的纯度。
[0238]
作为碳酸化工序s14中使被处理液升温的方法,没有特别限定,可以使用例如利用加热器等公知的加热装置加热碳酸化槽11内的被处理液的方法。需要说明的是,也可以构成为:在向碳酸化槽11供给被处理液之前,预先使用换热器等预热手段使被处理液升温。
[0239]
碳酸化工序s14后的被处理液被供给至固液分离工序s15。固液分离工序s15中,使用固液分离装置从被处理液中分离包含碳酸锂的晶体的析出物。从被处理液中回收的析出物通过用水等进行洗涤而去除杂质,可以提高碳酸锂的纯度。该析出物的洗涤中使用的水没有特别限定,优选利用浓缩工序s11中产生的冷凝水,由此能够有效利用冷凝水。
[0240]
固液分离工序s15后的被处理液没有特别限定,由于包含杂质而优选一部分以排出液形式排出、一部分再次在体系内循环。由此能够回收被处理液中残留的锂,因此能够以高回收率回收锂。需要说明的是,对于洗涤上述包含碳酸锂的晶体的析出物后的洗涤废液,也优选与固液分离工序s15后的被处理液一起再次在体系内循环。
[0241]
使固液分离工序s15后的被处理液再次在体系内循环时,可以供给至浓缩工序s11(蒸发浓缩装置9)进行蒸发浓缩,优选供给至一次ph调节工序s3(一次ph调节槽2)。固液分离工序s15后的被处理液为碱性,因此可以作为一次ph调节工序s3中添加的碱来利用。进而,若固液分离工序s15后的被处理液含有大量的碳酸根离子(co
32-),则在浓缩工序s11中蒸发浓缩时会在蒸发浓缩装置9的换热器的导热面析出碳酸盐的晶体。在此,供给至固液分离工序s2后的一次ph调节工序s3的被处理液为酸性,由此,用该酸性的被处理液中和固液分离工序s15后的被处理液,使碳酸根离子形成二氧化碳而逸出,能够防止浓缩工序s11中在蒸发浓缩装置9的换热器的导热面析出碳酸盐的晶体。
[0242]
另一方面,在浓缩工序s11中析出且在固液分离工序s13中回收的析出物中所含的无机盐(本实施方式中为硫酸钠)的晶体被供给至溶解工序s16。溶解工序s16没有特别限定,例如,在溶解槽18内以形成期望浓度的方式用例如水来溶解无机盐的晶体,由此,得到无机盐溶液。此时的温度没有特别限定,只要为能够溶解无机盐的晶体的温度即可。另外,无机盐的溶解中使用的水没有特别限定,优选利用浓缩工序s11中产生的冷凝水,由此能够有效利用冷凝水。
[0243]
溶解工序s16中得到的无机盐溶液被供给至电渗析工序s17。电渗析工序s17没有特别限定,例如利用双极膜电渗析装置13从无机盐溶液中分离并回收碱和无机酸。作为双极膜电渗析装置13,例如,可以适宜使用图20所示的三室电池单元方式的双极膜电渗析装置,所述三室电池单元方式的双极膜电渗析装置是多个单元130层叠而成的,所述单元130在阳极135与阴极136之间具备阴离子交换膜131、阳离子交换膜132和2个双极膜133、134。本实施方式的双极膜电渗析装置13中,由阴离子交换膜131和阳离子交换膜132形成脱盐室r1,在阴离子交换膜131和一片双极膜133之间形成酸室r2,在阳离子交换膜132与另一片双极膜134之间形成碱室r3。在各双极膜133、134的外侧形成有阳极室r4和阴极室r5,阳极室r4中配置有阳极135,阴极室r5中配置有阴极136。
[0244]
在电渗析工序s17中,向脱盐室r1中导入无机盐溶液,向酸室r2和碱室r3中分别导入纯水。由此,在无机盐溶液包含例如硫酸钠的情况下,在脱盐室r1中,钠离子(na
)通过阳离子交换膜132,硫酸根离子(so
42-)通过阴离子交换膜131。另一方面,在酸室r2和碱室r3中,所供给的纯水在双极膜133、134中解离为氢离子(h
)和氢氧根离子(oh-),在酸室r2中氢离子(h
)与硫酸根离子(so
42-)结合而生成硫酸(h2so4),在碱室r3中氢氧根离子(oh-)与钠离子(na
)结合而生成氢氧化钠(naoh)。由此,从酸室r2中回收作为无机酸的硫酸(h2so4),从碱室r3回收作为碱的氢氧化钠(naoh)。需要说明的是,导入到酸室r2和碱室r3中的纯水可以利用浓缩工序s11中产生的冷凝水。
[0245]
脱盐室r1所排出的脱盐后的稀无机盐溶液(脱盐液)虽然没有特别限定,但是由于包含少量的锂而优选供给至浓缩工序s11(蒸发浓缩装置9)并在再次浓缩后在碳酸化工序s14中进行碳酸化。由此,能够以高回收率回收锂。需要说明的是,脱盐液在本实施方式中被供给至浓缩工序s11,但是当脱盐液中残留有钙和/或镁时,也可以将脱盐液供给到杂质去除工序s10。由此,可以在从脱盐液中去除钙、镁后供给至浓缩工序s11。另外,脱盐液也可以供给至一次ph调节工序s3。由此,当脱盐液中残留有钴时,能够提高钴的回收率。
[0246]
另外,从酸室r2中回收的无机酸(本实施方式中为硫酸)虽然没有特别限定,但是优选供给至酸浸出工序s1(酸浸出槽1)和/或再溶解工序s5(再溶解槽3)而作为用于废锂离子电池的酸浸出、钴盐等的再溶解的无机酸进行再利用。进而,优选供给至杂质处理工序s10(多价阳离子去除装置8)而作为螯合树脂或离子交换树脂的再生液进行再利用。
[0247]
另外,从碱室r3中回收的碱(本实施方式中为氢氧化钠)虽然没有特别限定,但是优选供给至一次ph调节工序s3(一次低ph调节槽2)和/或二次ph调节工序s7(二次ph调节槽5)而作为用于调节被处理液、再溶解液的ph的碱进行再利用。进而,优选供给至杂质处理工序s10(多价阳离子去除装置8)而作为螯合树脂或离子交换树脂的再生液进行再利用。
[0248]
上述本实施方式的钴回收方法中,对于至少溶解有钴及铜的被处理液,首先在一次ph调节工序s3中添加碱而将ph调节为7以上,由此以钴盐形态从被处理液中回收钴,然后在再溶解工序s5中利用无机酸溶解回收的钴盐,在溶剂提取工序s6中对再溶解钴而成的再溶解液进行溶剂提取,由此从再溶解液中分离再溶解液中所含的铜。
[0249]
再溶解液中使用的无机酸为足以溶解在一次ph调节工序s3中从被处理液中回收的钴盐、且少于最初为了溶解钴等金属而用于被处理液的无机酸的量的量即可。特别是被处理液为对废锂离子电池进行酸浸出而得的液体时,由于作为溶解对象的废锂离子电池的量较多,用于酸浸出的无机酸也需要为较多量,被处理液的量也成为较多的量。因此,通过如本实施方式的钴回收方法那样在暂时从被处理液中去除钴后再次用无机酸溶解钴,由此与最初的被处理液的量相比,能够使溶解有钴的再溶解液的量大幅减少。再溶解液的量减少,则进行用于分离铜等杂质金属的溶剂提取时所用的提取剂的量也能够减少,因此能够降低提取剂成本。进而,由于从再溶解液中通过溶剂提取而去除铜等杂质金属,因此能够以高纯度回收钴。综上,本实施方式的钴回收方法能够以高纯度和低成本从被处理液中回收钴。
[0250]
另外,根据本实施方式的钴回收方法,通过在逆提取工序s9中对对于溶剂提取工序s6中使用的提取剂进行逆提取,从而从提取有铜等杂质金属的提取剂中逆提取铜等杂质金属。然后将进行了逆提取的提取剂供给于溶剂提取工序s6进行再利用,因此能够减少溶
剂提取工序s6中使用的提取剂的量。
[0251]
另外,根据本实施方式的钴回收方法,在溶解工序s16中,将固液分离工序s13中从被处理液中分离出的析出物所含的无机盐(本实施方式中为硫酸钠)的晶体溶解而制成无机盐溶液后,在电渗析工序s17中进行双极膜电渗析,由此从无机盐溶液中回收无机酸及碱。然后将回收的无机酸及碱供给至酸浸出工序s1、一次ph调节工序s3、再溶解工序s5、二次ph调节工序s7等进行再利用,因此能够减少各工序中使用的无机酸、碱的量。
[0252]
根据本实施方式的钴回收方法,将浓缩工序s11中产生的冷凝水用于各种处理中,因此能够有效利用冷凝水。进而,使用冷凝水洗涤通过各固液分离工序s4、s8、s13、s15得到的晶体,由此能够更好地提高各结晶的回收率。
[0253]
以上对第二方式的钴回收方法的一实施方式进行了说明,但是第二方式的钴回收方法不限于上述实施方式,可在不脱离本公开的主旨的限度内进行各种变更。
[0254]
作为一变更例,例如在图17至图19的实施方式中可以构成为:一次ph调节工序s3如图21及图22所示那样包括第一ph调节工序s3-1和第二ph调节工序s3-3。
[0255]
第一ph调节工序s3-1中,通过添加碱而将被处理液的ph调节为4以上且7以下、优选4以上且6以下、更优选4以上且5以下。由此,除了被处理液中的铜以外,铁、铝等杂质金属也大部分以氢氧化物等无机盐的晶体形态析出,从被处理液中去除。作为ph调节中使用的碱,可以使用例如氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中,从低成本且易于处理的角度而使用氢氧化钠。第一ph调节工序s3-1中,调节被处理液的ph的方法没有特别限定,可以使用通常所进行的方法。可列举例如:一边在第一ph调节槽2a内搅拌被处理液一边添加例如氢氧化钠水溶液等碱水溶液的方法。优选一边将被处理液升温到例如30℃至80℃范围内的恒定温度一边进行第一ph调节工序s3-1。
[0256]
第一ph调节工序s3-1中添加的碱水溶液优选稀至碱浓度低于1.0mol/l。由此,在第一ph调节工序s3-1中,能够抑制被处理液中的钴与铜等杂质金属一起以钴盐的晶体形态析出而从被处理液中去除。但是若碱浓度过低,则第一ph调节工序s3-1中需要使用大量的碱水溶液来调节ph调节,而且ph调节后的被处理液的量也变多,因此优选碱浓度的下限为0.1mol/l以上。另外,为了有效抑制在第一ph调节工序s3-1中从被处理液中去除被处理液中的钴,第一ph调节工序s3-1中添加的碱水溶液的碱浓度优选为0.5mol/l以下,更优选为0.2mol/l以下。
[0257]
需要说明的是,在该第一ph调节工序s3-1中,为了减少ph调节中使用的碱水溶液量,也可以将具有1.0mol/l以上的碱浓度高的碱水溶液添加于被处理液,直至被处理液的ph达到小于4的规定值,在被处理液的ph达到规定值后,将具有低于1.0mol/l的稀碱浓度的碱水溶液添加于被处理液,由此,将被处理液的ph调节为4以上且7以下。作为上述被处理液的ph的规定值,可以在2以上且3以下的范围内进行设定。
[0258]
第一ph调节工序s3-1后的被处理液被供给至固液分离工序s3-2。固液分离工序s3-2中,使用固液分离装置分离在固液分离工序s3-2中析出的包含铜等杂质金属的盐的晶体的析出物。固液分离工序s3-2中回收的析出物用洗涤液进行洗涤。洗涤后的洗涤废液优选与被处理液一起供给至之后的第二ph调节工序s3-3。由此,可以将洗涤废液中所含的锂与被处理液中所含的锂一起从第二ph调节工序s3-3供给至碳酸化工序s14,通过在碳酸化工序s14碳酸化,可以以高回收率回收锂。该析出物的洗涤中使用的水没有特别限定,优选
利用浓缩工序s11中产生的冷凝水,由此能够有效利用冷凝水。
[0259]
第二ph调节工序s3-3中,通过添加碱而将被处理液的ph调节为7以上、优选7以上且13以下、更优选7以上且11以下、进一步优选8以上且10以下的范围。由此,被处理液中的钴以氢氧化钴等钴盐的晶体形态析出。需要说明的是,第二ph调节工序s3-3中,除了钴以外,镍、锰等有价金属、被处理液中残留的铜等杂质金属也可以以氢氧化物等无机盐的晶体形态析出并从被处理液中去除。作为ph调节中使用的碱,可以使用例如氢氧化钠、氢氧化钾、氢氧化锂等,本实施方式中,从低成本且易于处理的角度而使用氢氧化钠。
[0260]
第二ph调节工序s3-2中调节被处理液的ph的方法没有特别限定,可以使用通常所进行的方法。可列举例如一边在第二ph调节槽2b内搅拌被处理液一边添加例如氢氧化钠水溶液等碱水溶液的方法。调节ph时,优选将被处理液升温至例如30℃至80℃范围内的恒定温度。第二ph调节工序s3-3中添加的碱水溶液的碱浓度没有特别限定,优选为第一ph调节工序s3-1中使用的碱水溶液的碱浓度以上,进一步优选碱浓度为0.2mol/l以上。第二ph调节工序s3-3后的被处理液被供给至固液分离工序s4。
[0261]
根据图21及图22的实施方式,对于溶解有钴及铜等杂质金属的被处理液,可以在第一ph调节工序s3-1中从被处理液中去除大部分的铜、铝、铁等杂质金属。而且,通过用碱浓度低于1.0mol/l的稀碱水溶液进行被处理液的ph调节,从而与上述第一方式的钴回收方法同样地可以抑制钴与铜等杂质金属从被处理液中去除,因此能够使供给至第二ph调节工序s3-3的被处理液中的钴的量维持为较高。因此,在之后的用于回收钴的二次ph调节工序s7中,能够以高纯度和高回收率回收钴。
[0262]
进而,根据图21及图22的实施方式,在第一ph调节工序s3-1中使用碱浓度低于1.0mol/l的稀碱水溶液,因此虽然供给至之后的用于回收锂的碳酸化工序s14的被处理液的量变多,但是通过在碳酸化工序s14前在浓缩工序s11中对被处理液进行蒸发浓缩,由此能够减少被处理液的量,增大被处理液中的锂浓度。因此,在碳酸化工序s14中能够很好地提高碳酸锂的回收率。
[0263]
一次ph调节工序s3可以根据废锂离子电池中所含的成分而构成为包括3个以上工序。
[0264]
作为另一变更例,在图17至图19的实施方式中对于浓缩工序s11前的被处理液进行了至少去除钙和/或镁的杂质去除工序s10,但是也可以代替该工序或在该工序的基础上对电渗析工序s17前的无机盐溶液同样地进行至少去除钙和/或镁的杂质去除工序。需要说明的是,对于图21及图22的实施方式都可以进行同样的变更。
[0265]
作为另一变更例,在图17至图19的实施方式中在溶解工序s16后且电渗析工序s17前可以进行用于去除无机盐溶液中所含的例如硅等杂质的处理工序。该处理工序可以代替杂质去除工序s10或在杂质去除工序s10的基础上进行。作为该处理工序的一例,将无机盐溶液中所含的无机盐(本实施方式中为硫酸钠)通过蒸发析晶、蒸发浓缩等重结晶后,对该无机盐的晶体进行固液分离而包含无机盐的晶体的水溶液中回收。然后例如用水将回收的无机盐的晶体溶解,再次生成无机盐溶液。再次生成的无机盐溶液被供给至电渗析工序s17。
[0266]
该实施方式中,通过在电渗析工序s17前去除无机盐溶液中所含的硅,由此,在电渗析工序s17中进行电渗析的无机溶液中的杂质量也减少,因此能够使双极膜的性能维持
为较高。进而,在将电渗析工序s17后的稀无机盐溶液(脱盐液)供给至蒸发浓缩装置9而在浓缩工序s11中再次进行蒸发浓缩时,脱盐液的杂质量减少,由此,能够抑制浓缩工序s11中在蒸发浓缩装置9的换热器的导热面产生、附着氧化皮。而且,由于由碳酸化工序s14后的固液分离工序s15得到的被处理液中的杂质量减少,能够使固液分离工序s15后的被处理液的大部分再次在体系内循环。因此,能够更充分地回收固液分离工序s15后的被处理液中残留的锂,因此能够以高回收率回收锂。需要说明的是,对于上述任意实施方式,均能够进行同样的变更。
[0267]
作为另一变更例,在图17至图19的实施方式中可以如图23及图24所示在酸浸出工序s1前进一步包括对废锂离子电池进行焙烧的焙烧工序s0。焙烧工序s0中对废锂离子电池进行焙烧的方法没有特别限定,可以使用公知的焙烧装置14。
[0268]
图23及图24的实施方式中,将焙烧装置14(焙烧工序s0)中产生的排放气体供给至碳酸化工序s14(碳酸化槽11),在碳酸化工序s14中使排放气体形成二氧化碳混合到被处理液中。由此,能够减少碳酸化工序s14中使用的二氧化碳的量。另外,碳酸化工序s14中可以将被处理液升温。需要说明的是,对于上述任意实施方式,均能够进行同样的变更。
[0269]
作为另一变更例,在图17至图19的实施方式中,杂质去除工序s10及之后的工序中的锂回收方法没有特别限定,可以使用各种方法。需要说明的是,对于上述任意实施方式,均能够进行同样的变更。
[0270]
作为另一变更例,在图17至图19的实施方式中以从废锂离子电池中回收钴的情况为例,但是本公开不限于用于从废锂离子电池中回收钴的方法。需要说明的是,对于上述任意实施方式,均能够进行同样的变更。
[0271]
附图标记说明
[0272]
s0(图15)焙烧工序
[0273]
s1(图1、图9、图11、图13及图15)酸浸出工序
[0274]
s3(图1、图9、图11、图13及图15)一次低ph调节工序
[0275]
s4(图1、图9、图11、图13及图15)固液分离工序(一次杂质金属分离工序)
[0276]
s5(图1、图9、图11、图13及图15)一次高ph调节工序
[0277]
s6(图1、图9、图11、图13及图15)固液分离工序(一次钴分离工序)
[0278]
s7-1(图1、图9、图11、图13及图15)再溶解工序
[0279]
s7-2(图1、图11、图13及图15)、s7-3(图9)二次低ph调节工序
[0280]
s7-2(图9)、s7-4(图11)、s7-7(图13)溶剂提取工序
[0281]
s7-3(图1、图11、图13及图15)、s7-4(图9)沉淀工序(二次杂质金属分离工序)
[0282]
s7-4(图1、图13及图15)、s7-5(图9、图11)二次高ph调节工序
[0283]
s7-5(图1、图13及图15)、s7-6(图9、图11)固液分离工序(二次钴分离工序)
[0284]
s7-7(图9及图11)、s7-10逆提取工序
[0285]
s7-8(图13)三次高ph调节工序
[0286]
s7-9(图13)固液分离工序(三次钴分离工序)
[0287]
s8-2(图2)浓缩工序
[0288]
s8-5(图2)碳酸化工序
[0289]
s8-6(图2)固液分离工序(锂分离工序)
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。