1.本发明属于基因工程技术领域,具体涉及一种高热稳定性和高活性的胃蛋白酶突变体设计方法。
背景技术:
2.胃蛋白酶是一种胃肠系统的消化蛋白酶,由胃蛋白酶原制成,由消化器官中的胃粘膜祖细胞分泌,然后由胃蛋白酶促进。其主要目的是将膳食蛋白质分解成肽。胃蛋白酶作为一种酸性蛋白酶现在可用于生物制药和食品加工行业。胃蛋白酶可用于治疗胃肠道疾病,是生物制药领域的常用药物。在食品加工业中,它通常用于酸奶酿造和饮料澄清。胃蛋白酶,主要来源于微生物分泌物和动物器官,是一种适用于将动植物蛋白质水解成氨基酸和小分子肽的酶,ph为2.0~5.0,分子量为30~40kda,由两个天冬氨酸残基组成活性中心。由于胃蛋白酶具有良好的耐酸性,在水解过程中不易发生因细菌繁殖引起的蛋白质变质,所以在生产生活中有广泛的应用前景。如今报道的胃蛋白酶大多酶学性质不稳定,酶活性低,在一定程度上限制了酸性蛋白酶的后续应用。工业生产中使用的大多数胃蛋白酶都是分枝杆菌来源的,这些酶中的大多数不耐热。当温度高于50℃时,酶活性会急剧下降或失活。此外,这些酶的最适ph一般在3左右。当ph升高时,酶活性显着降低,这也限制了酸性蛋白酶的应用。
3.近年来,基因工程技术发展迅速,酵母菌作为表达外源蛋白的工程菌越来越受到关注。酵母作为一种单细胞真核生物,不仅具有原核生物生长快、实验操作简单可行的特点,而且具有真核表达系统特有的基因表达调控和蛋白质修饰等功能,克服了原核生物生长速度慢的缺点。原核表达系统产物的活性以及包涵体易变性强、难以复制。酵母的分泌产物与天然蛋白质相似,可通过高密度发酵培养,生产成本显着降低。因此,毕赤酵母现在被广泛应用于外源蛋白的表达。基于对酶蛋白结构和操作的透彻了解,合理设计是一种改变酶分子的技术,主要通过靶向突变技术和靶向饱和突变技术。随着研究的进行,新的稳定的酶的发现以及我们对这些酶如何保持其稳定性的理解使得通过合理设计改变酶分子以增加稳定性变得具有理论意义。此外,增加胃蛋白酶活性和热稳定性具有重要的工业应用,因为缺乏高活性菌株和低热稳定性限制阻碍了其在生产中爆发式的应用。选择具有优良酶学特性的胃蛋白酶,然后对其进行合理修饰以提高其胃蛋白酶活性和热稳定性,是食品加工和医药领域的关键步骤。
技术实现要素:
4.本发明的目的是为了解决胃蛋白酶热稳定性及活性的问题,提供了一种高热稳定性和高活性的胃蛋白酶突变体设计方法。主要从计算机理论计算快速虚拟筛选突变体,然后使用多重实验验证酶催化结果两方面进行。选取具有高温活性、稳定性和广泛ph稳定性的胃蛋白酶进行一系列理性计算,筛选出潜在的热稳定性和高活性的突变体;利用毕赤酵母表达系统进行异源表达,利用纯化后的重组胃蛋白酶测定热稳定性和酶活性,最终筛选
出具有最高热稳定性和活性的胃蛋白酶突变体。
5.本发明是通过以下技术方案实现的:
6.一种高热稳定性和高活性的胃蛋白酶突变体设计方法,包括以下步骤:
7.(1)选择特定来源的目标胃蛋白酶,获取其核苷酸序列和对应的氨基酸序列,然后构建目标胃蛋白酶的三维结构,使用动力学模拟软件进一步对目标胃蛋白酶三维结构进行足够长时间尺度的动力学模拟,以弛豫该蛋白质结构,直至体系结构(rmsd)达到稳定,选取模拟过程中稳定阶段的结构,作为下一步设计改造的初始结构;
8.(2)基于步骤(1)确定的胃蛋白酶三维结构对目标胃蛋白酶进行结构特征分析,结合胃蛋白酶催化机制确定潜在的能够提高热稳定性和活性的区域;
9.(3)对步骤(2)中分析确定的胃蛋白酶潜在影响区域进行饱和突变,获取大量单氨基酸突变体,计算预测所有突变体相对于野生型胃蛋白酶在能量、相互作用以及溶剂可及表面积(solvent accessibility surface area,sasa)这些方面的变化,进行初步快速筛选,得到一定数量的候选突变体;
10.(4)对步骤(2)中分析确定的胃蛋白酶潜在影响区域进行定向突变预测,获取一定数量的胃蛋白酶潜在有利突变体;
11.(5)对步骤(3)和步骤(4)筛选出的胃蛋白酶潜在有利突变体进行表达,通过测量不同胃蛋白酶突变体的粗酶热稳定性进行进一步筛选;
12.(6)对步骤(5)筛选出的胃蛋白酶突变体进行进一步纯化,并以血红蛋白为底物测量纯化后的胃蛋白酶突变体在高温条件下的半衰期,用以衡量热稳定性变化,同时对其蛋白水解活性进行测量评估,最终得到最优胃蛋白酶突变体。
13.进一步地,步骤(1)中所述的目标胃蛋白酶三维结构可以通过在蛋白质结构数据库搜索下载,如果所选目标胃蛋白酶不存在已解析的结构信息,则可以基于其氨基酸序列,利用同源建模软件或在线服务网站进行同源建模,参照高相似性(一般大于30%)的蛋白质结构构建其三维结构信息;所述的动力学模拟可以采用amber、gromacs、namd等软件,模拟过程包括结构预处理、能量最小化、升温、恒压弛豫、预平衡以及正式动力学模拟等过程,模拟过程中胃蛋白酶体系可以放置于隐式溶剂或者显式溶剂中,并加入抗衡离子保持体系的电中性。
14.进一步地,步骤(2)中所述的潜在的能够提高热稳定性和活性的区域包括蛋白质内部中可能出现的由疏水氨基酸构成的疏水空隙,以及α-螺旋(α-helices)或环区(loop)可能的柔性区域,疏水区域或柔性区域可以通过rosetta-vip等在线网站或者软件进行搜索分析。
15.进一步地,步骤(3)中所述的饱和突变方法是指特定区域单点氨基酸突变体通过传统软件实现。
16.进一步地,步骤(3)中所述的评估蛋白质突变能量和相互作用变化的算法包括popmusic、基于神经网络的deepddg算法;所述的溶剂可及表面积(sasa)可以通过软件或在线网站进行计算,然后通过对比野生型和突变体溶剂可及表面积的变化进行筛选。
17.进一步地,步骤(4)中所述的分析确定的胃蛋白酶潜在影响区域进行定向突变预测是利用基于进化方法的蛋白质突变预测算法来实现的,所述基于进化方法的胃蛋白酶特定区域单点突变体的预测算法是指融合包括基于能量、相互作用、机器学习、进化方法等不
同的蛋白质突变影响预测算法,实现多角度充分地挖掘潜在有利突变。比如fireprot等软件和在线平台。
18.进一步地,步骤(4)中所述的分析确定的胃蛋白酶潜在影响区域进行定向突变预测是利用软件来实现的。
19.进一步地,步骤(5)中所述的热稳定性通过测量突变体的粗酶在中高温条件下孵育后活性的变化来表征,胃蛋白酶测定温度范围为50~80℃,ph为2.0~6.0,粗酶的孵育时间为3min。
20.进一步地,步骤(6)中所述的胃蛋白酶突变体的半衰期是在50~80℃温度条件下测量,通过半衰期的变化来衡量突变体相对于野生型胃蛋白酶的热稳定性变化;蛋白水解活性的测量是最终筛选过程,是通过测量水解过程中底物酪氨酸残留量来评估。
21.进一步地,所述步骤(5)和步骤(6)中所述的表达、纯化、活性测量,这些实验过程都采用通用标准流程。
22.本发明相比现有技术具有以下优点:
23.1、本发明结合了多种先进理论方法,例如多软件同源建模、结构弱点分析、氨基酸饱和突变筛选和定向突变设计、约束分子动力学模拟,提出了一种高效提高胃蛋白酶热稳定性和酶活性的方法,与传统实验方法相比,该方法能够快速处理大量数据,为实验制备提供了可靠的参考。
24.2、本发明考虑了多种蛋白质突变改性方法,充分挖掘原生胃蛋白质酶的潜力,能够在大量已有结构上进行设计,得到符合目标应用环境的多种胃蛋白酶,推动了胃蛋白酶的工业应用的发展。
25.3、本发明提出的方法能够拓展到其他酶设计中,可以衍生到其他蛋白酶的热稳定性提升的应用,具有良好的广适性。
26.4、本发明主要从计算机理论计算快速虚拟筛选突变体,然后使用多重实验验证酶催化结果两方面进行。选取具有高温活性、稳定性和广泛ph稳定性的胃蛋白酶进行一系列理性计算,筛选出潜在的热稳定性和高活性的突变体;利用毕赤酵母表达系统进行异源表达,利用纯化后的重组胃蛋白酶测定热稳定性和酶活性,最终筛选出具有最高热稳定性和活性的胃蛋白酶突变体。
27.5、本发明所设计的胃蛋白酶突变设计流程,可以在理论方面快速、合理设计新型的热稳定胃蛋白酶。通过疏水性突变,保守性比对测试,以及冲突残基测试等筛选、设计流程,可以确保突变胃蛋白酶的性能得到提升,为实验提供了有力参考。与一般实验试错方法相比,该方法节约了大量时间、人力物力,更为高效。本发明所提出的设计模式还可以拓展到其他胃蛋白酶的设计开发中,例如针对不同应用环境ph值的高性能胃蛋白酶的设计。上面的具体实施案例是对本发明的进一步的说明,但不局限于此。上述提到的未详述的试剂原料、软件方法、机器学习模型等均为本领域的常规物品和操作。
28.6、本发明开发了一种针对高热稳定性和高活性的胃蛋白酶分子改造理性设计方法,根据稳定性设计软件测试,确定胃蛋白酶内部疏水集团和表面柔性区域等潜在影响酶热稳定性和活性的区域,以定点突变方式进行疏水区域改造和柔性位点的固化,从而实现理性设计获得优秀的胃蛋白酶突变体。对为未来胃蛋白酶的工业化生产和应用具有重要的指导意义。
附图说明
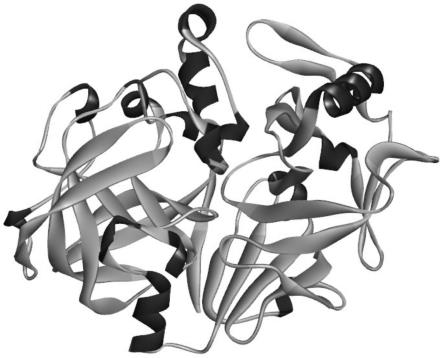
29.图1为胃蛋白酶的三维结构;
30.图2为动力学模拟过程中胃蛋白酶结构的rmsd变化;
31.图3为野生型胃蛋白酶和20种初筛产生的突变体的相对酶活性(65℃温度条件下);
32.图4为野生型和4种筛选出的突变体重组蛋白在65℃温度条件下的半衰期。
具体实施方式
33.本发明提出了一种高热稳定性和高活性的胃蛋白酶突变体设计方法,下面根据具体操作实例对本发明进行进一步的说明,该方法不局限于以下示例,可以拓展到其他应用条件下的胃蛋白酶设计的操作中。
34.一种高热稳定性和高活性的胃蛋白酶突变体设计方法,包括如下步骤:
35.(1)选择特定来源的目标胃蛋白酶:选择成年猪胃蛋白酶作为理论设计的基础酶,成年猪胃蛋白酶的核苷酸序列为seq id no.1和对应的氨基酸序列为seq id no.2。将成年猪胃蛋白酶的序列在ncbi非冗杂蛋白质数据库中进行相似性搜索。根据搜索结果并结合蛋白质结构数据库(pdb),确定成年猪胃蛋白酶存在已解析的三维结构信息,成功解析的序列为seq id no.3所示,三维结构如图1所示。从pdb数据库中下载该胃蛋白酶结构文件(pdb文件),利用amber对pdb文件进行处理,去除蛋白结构之外的原子,添加抗衡离子(na
,cl-)以保持体系整体的电中性,然后将蛋白体系置于水溶液中(tip3p模型),先对体系进行能量最小化优化,然后将体系温度逐渐从0℃提高到300℃,升温过程中对蛋白骨架原子进行束缚,保证整体结构的不变性。然后在ntp系综下对整个溶液体系进行1ns预平衡,之后在nvt系综下进行40ns的动力学模拟,将蛋白质结构充分弛豫。模拟结束后分析蛋白质结构的rmsd变化,确定体系平衡稳定时间,结果如图2所示。最终从模拟轨迹中选择稳定阶段的蛋白酶结构作为下一步设计改造的初始结构。
36.(2)通过rosetta-vip在线服务器(https://rosie.graylab.jhu.edu/vip)对序列进行计算分析,rosetta holes功能可实现蛋白质内部疏水空隙的搜索,确定空隙周围的具体氨基酸组成,确定空隙周围的具体氨基酸组成。结构分析确定胃蛋白酶结构可以分为n-叶、c-叶和连接区域三个主要部分。n-叶中存在由三个β-sheet组成的疏水区域,该疏水区域被相邻α-螺旋和连接区域覆盖,形成一个内部松散的疏水区域。同时该疏水区域外部表面的α-螺旋则是高柔性结构。因此,对针对该胃蛋白酶结构的设计可以从确定的内部疏水区域和表面高柔性α-螺旋区域出发,进行定向残基突变。
37.(3)通过amber软件对胃蛋白酶内部疏水区域和表面高柔性α-螺旋区域进行饱和突变预测。然后通过accessible surface area and accessibility calculation for protein(ver.1.2)在线服务器(http://cib.cf.ocha.ac.jp/bitool/asa/)对突变前后的氨基酸进行理论计算,得到突变后氨基酸和野生胃蛋白酶的溶剂可及表面积(sasa)之差作为结果,初步筛选胃蛋白酶的潜在有利突变体(突变体集合1)。然后分别通过popmusic和deepddg对突变前后胃蛋白酶能量和相互作用变化进行预测,筛选出潜在有利突变体(突变体集合2,3)
38.(4)选择基于能量和进化方法的fireprot软件对目标胃蛋白酶的内部疏水区域和
表面高柔性α-螺旋区域进行定向突变预测。fireprot软件集成了clustalω、rosetta和foldx等软件算法,实现对有利突变体的预测,获得突变体集合4。综合突变体集体1-4,总计得到20个胃蛋白酶潜在有利突变体。
39.(5)对20种突变体和野生型胃蛋白酶进行表达。以胃蛋白酶原质粒为模板构建突变体并转化到巴斯德毕赤酵母中进行表达。将培养物在4℃温度下离心10分钟,然后通过缓慢加入硫酸铵进行粗提纯,达到80%饱和度。将粗酶在65℃温度条件和ph 2.5的酸性条件下孵育3分钟,然后通过测量每分钟分解血红蛋白产生1μg酪氨酸所需的酶量,以表征其酶活性。通过测量孵育前后酶活性的变化来表征重组蛋白的热稳定性。野生型以及20种突变体的热稳定性(孵育前后酶活性变化的相对值)结果如图3所示。野生型胃蛋白酶孵育后酶活性剩余33%。通过对粗酶进行热稳定性测量筛选得到了4种最有利突变体,分别为a24p、d52n、q55r和s129a,剩余相对酶活性分别为42%、75%、46%和62%。
40.(6)然后将上述筛选出的4种突变体和野生型胃蛋白酶进行纯化后进行半衰期和酶活性测量。对te缓冲液进行过夜透析后使用histrap hp亲和柱进行纯化,随后在25℃温度下孵育10分钟。使用具有10kda截留分子量的centricon过滤装置去除前段。所有样品都储存在20mm乙酸钠(ph 5.3)中,并使用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳进行分析。测量65℃温度条件下重组蛋白的半衰期(t1/2)。结果如图4所示。野生型胃蛋白酶半衰期为3.20分钟,a24p和q55r突变体半衰期略有提高,均为3.42分钟。而d52n和s129a突变体半衰期显著增加,分别为13.06和4.98分钟,分别增加了308%和56%。最终可以选择d52n和s129a突变体作为高热稳定性和高酶活性的新型胃蛋白酶结构。
41.本发明所设计的胃蛋白酶突变设计流程,可以在理论方面快速、合理设计新型的热稳定胃蛋白酶。通过疏水性突变,保守性比对测试,以及冲突残基测试等筛选、设计流程,可以确保突变胃蛋白酶的性能得到提升,为实验提供了有力参考。与一般实验试错方法相比,该方法节约了大量时间、人力物力,更为高效。本发明所提出的设计模式还可以拓展到其他胃蛋白酶的设计开发中,例如针对不同应用环境ph值的高性能胃蛋白酶的设计。上面的具体实施案例是对本发明的进一步的说明,但不局限于此。上述提到的未详述的试剂原料、软件方法、机器学习模型等均为本领域的常规物品和操作。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
