1.本发明属于柑橘病原检测技术领域,具体涉及一种同步检测多种柑橘嫁接传染病原的多重pcr检测引物组合物、试剂盒及方法。
背景技术:
2.柑橘重要嫁接传染病原主要包括柑橘黄龙病菌(candidatus liberibacter asiaticus,clas),柑橘衰退病毒(citrus tristeza virus,ctv)、柑橘裂皮病类病毒(citrus exocortis viroid,cevd)、柑橘碎叶病毒(citrus tatter leaf virus,ctlv),柑橘叶斑驳病毒(citrus leaf blotch virus,clbv)和柑橘黄化脉明病毒(citrus yellow vein clearing virus,cyvcv)。柑橘黄龙病(huanglongbing,hlb)是世界范围内柑橘生产上的毁灭性病害,由韧皮部杆菌柑橘黄龙病菌(candidatus liberibacter asiaticus,clas)引起,染病植株叶片表现为斑驳黄化均匀黄化、缺素型黄化、脉凸加黄化等黄化症状,果实则表现为红鼻果。主要通过嫁接、虫媒柑橘木虱和菟丝子(garnier et al.,1983)传播。柑橘衰退病也是柑橘生产上危害极其严重的病害,对柑橘产业构成严重威胁。可引起幼苗黄化,幼树或成年树出现树体衰退、茎陷点等症状,破坏砧木的树皮,严重阻碍养分的运输,严重者引起根系的腐烂,导致果实产量急剧下降(bar-joseph et al.,2003)。柑橘裂皮病是由柑橘裂皮病类病毒(citrus exocortis viroid,cevd)引起的重要柑橘病害(semancik et al.,1972),可引起砧木部位树皮纵向开裂症状,树体无法正常运输营养物质而影响柑橘植株长势,树冠矮化,主要通过有病苗木或接穗运输(murcia et al.2015)。柑橘碎叶病毒(citrus tatter leaf virus,ctlv)是威胁柑橘生产的重要病原之一,可引起嫁接部位肿大,导致树势衰弱,甚至枯死(liu et al.,2003)。柑橘叶斑驳病毒(citrus leaf blotch virus,clbv)是β线性病毒科(betaflexiviridae)柑橘病毒属(citrivirus)的正义单链rna病毒(rubinol et al.,2012),是柑橘病毒属的代表种。该病毒侵染几乎所有柑橘属植物及其近缘种,多为隐症,引起橘橙叶片斑驳变色症状(zhu et al.,2016)。柑橘黄脉病是由柑橘黄化脉明病毒(citrus yellow vein clearing virus,cyvcv)引起的一种新发虫传病害(zhang et al.,2018),主要引起柠檬、酸橙类脉明及叶片畸形症状,造成大量减产(grimaldi et al.,1996),该病毒可通过嫁接、虫媒柑桔粉虱传播,还可通过蚜虫传播到豆科植物(如豇豆)和茄科植物(如辣椒)上(n
ꢀüꢀ
ket et al.2011,zhou et al.2016)。
3.传统的柑橘重要嫁接传染病原的检测方法之一是指示植物鉴定法,颇为耗时。目前针对上述病原已建立了针对单一病原的快速检测方法,包括血清学、rt-pcr/qpcr及基于环介导等温核酸扩增技术的检测方法等(atta et al.,2012;宾羽等,2015;金鑫等,2016;张艳慧等,2017;赵恒燕等,2017)。其中血清学检测是柑橘常见病毒检验常用的方法,但不能实现多种病毒的同步检测。目前已报道了ctv、ctlv、cyvcv的elisa检测方法,虽然检出速度快,但特异性和灵敏度相对较差。目前已报道了clas、ctv、ctlv、cevd、clbv和cyvcv的单一病原的pcr/rt-pcr分子检测技术,若待测样品中同时含有多种病原物,则需要进行多次
pcr扩增,不但操作复杂而且费用较高。
4.多重pcr(multiplex pcr)是在同一反应体系中同时加入多对引物,实现多个基因、多种病原同时扩增的技术,具有高效快捷、高度特异敏感、降低实验成本、加速实验进程等优点。目前尚未见上述6种柑橘重要嫁接传染病原的一步法多重pcr检测技术的报道。建立稳定、可靠的同步检测6种柑橘重要嫁接传染病原一步法多重pcr检测技术体系,对于田间病情调查、苗圃病原快速鉴定及无毒苗木快速检测具有重要的意义。
技术实现要素:
5.有鉴于此,本发明的目的在于建立稳定、灵敏且同时检测柑橘6种重要嫁接传播病原的一步法多重pcr检测技术体系,以利于摸清田间上述病原危害状况,实现柑橘多种病原的高效快速检测。
6.为了实现上述目的,本发明的技术方案具体如下:
7.本发明第一方面提供了一种同步检测多种柑橘病原的多重pcr检测引物组合物,具体包括以下6个引物对中的至少5对:
8.用于柑橘黄龙病菌clas检测的引物对:
9.上游引物:5
’‑
tgaattcttcgaggttggtgagc-3’,
10.下游引物:5
’‑
agaattcgacttaatccccacct-3’;
11.用于柑橘衰退病毒ctv检测的引物对:
12.上游引物:5
’‑
gcttcttaacctacgcgat-3’,
13.下游引物:5
’‑
acaaatccacttcaacacc-3’;
14.用于柑橘碎叶病毒ctlv检测的引物对:
15.上游引物:5
’‑
ccctctcagctagaattgaa-3’,
16.下游引物:5
’‑
caggcatgtcaacctgcaag-3’;
17.用于柑橘裂皮病类病毒cevd检测的引物对:
18.上游引物:5
’‑
ggaaacctggaggaagtcgag-3’,
19.下游引物:5
’‑
ccggggatccctgaaggactt-3’;
20.用于柑橘叶斑驳病毒clbv检测的引物对:
21.上游引物:5
’‑
ccaatgataatgccgcgac-3’,
22.下游引物:5
’‑
cccgaggttcttattgcat-3’;
23.用于柑橘黄化脉明病毒cyvcv检测的引物对:
24.上游引物:5
’‑
ctccaactcacaaacccag-3’,
25.下游引物:5
’‑
atgggctcttggttttcct-3’。
26.优选地,在上述组合物中,分别用于检测柑橘黄龙病菌、柑橘衰退病毒、柑橘碎叶病毒、柑橘裂皮病类病毒、柑橘叶斑驳病毒、柑橘黄化脉明病毒的引物对的最佳摩尔比为3∶2.5∶4∶2∶1.5∶2。可以理解的是,若是引物组合物中只包含该6对引物中的5个引物对,不影响相应各引物间的最佳比例关系。
27.另外,在实际使用过程中,根据检测目的不同,既可以单独使用上述引物也可以任意组合使用。
28.本发明第二方面提供了一种同步检测多种柑橘病毒的多重pcr检测试剂盒,包括
用于上述柑橘病原检测的引物对,以及用于pcr扩增的其他试剂。在该检测试剂盒可以包括6个引物对中的任意5个或者全部,而且引物对可以独立包装也可以按比例混装。
29.本发明第三方面提供了一种同步检测多种柑橘病原的多重pcr检测方法,具体包括以下步骤:
30.(1)待测植物样品的核酸提取;
31.(2)对步骤(1)所得核酸提取液进行逆转录;
32.(3)使用上述引物组合物对步骤(2)所得逆转录待测样品进行pcr扩增,产物进行琼脂糖凝胶电泳检测。
33.优选地,步骤(3)中pcr扩增的程序为:94℃,3min;94℃30s,55℃30s,72℃30s,30个循环;72℃,5min。
34.优选地,步骤(3)中pcr扩增的反应体系为:共20μl,2
×
master mix 10μl,0.2μl~0.40μl的各引物对(10μmol/μl),逆转录待测样品1μl,ddh2o余量。
35.优选地,步骤(1)具体为:将植物染病叶片研磨后与trizol试剂混匀,离心取上清,加入氯仿抽提;离心取上清,加入异丙醇混匀,沉降后离心弃上清;采用乙醇洗涤沉淀,再在沉淀中加入depc水使沉淀溶解,即为核酸提取液。在此过程中,可根据实际需要,采用氯仿多次抽提。
36.优选地,步骤(2)具体为:取步骤(1)制备的核酸提取液,加入随机引物,先沸水浴再迅速冷却后,加入反转录试剂,混匀后37℃水浴1.0~1.5h后,先沸水浴再迅速冷却,得到逆转录待测样品。
37.更加优选地,反转录试剂具体为:按10μl计,5
×
m-mlv buffer4μl,2.5μm dntp 1.0μl,m-mlv 0.5μl,rna in 0.5μl,depc水4.0μl。
38.优选地,所述琼脂糖凝胶电泳检测得到的特异性片段大小为:柑橘黄龙病菌为535bp,柑橘衰退病毒为474bp,柑橘碎叶病毒为801bp,柑橘裂皮病类病毒为371bp,柑橘叶斑驳病毒为724bp,柑橘黄化脉明病毒为175bp。
39.更加优选地,pcr产物在2.0%琼脂糖凝胶电泳上进行电泳检测。
40.本发明的有益效果为:本发明能实现柑橘6种重要嫁接传播病原的快速、准确检测,且检测稳定性好,特异性强,一致性高,适用于推广应用。
附图说明
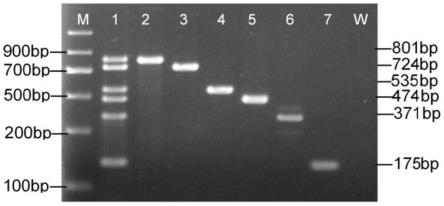
41.图1为多重rt-pcr电泳图谱,其中m泳道为dna markerⅱ,1泳道为6种病原质粒混合模板,2泳道为柑橘碎叶病毒ctlv,3泳道为柑橘叶斑驳病毒clbv,4泳道为柑橘黄龙病菌clas,5泳道为柑橘衰退病毒ctv,6泳道为柑橘裂皮病类病毒cevd,7泳道为柑橘黄化脉明病毒cyvcv,w泳道为水对照;
42.图2为多重rt-pcr灵敏度测试电泳图谱,其中m泳道为dna markerⅱ,1-6泳道依次10倍梯度稀释,w泳道为水对照;
43.图3为田间样品多重rt-pcr电泳图谱,其中 为阳性对照,-为健康对照,1-15为云南沃柑田间待检测样品,w泳道为水对照。
具体实施方式
44.下面将结合本发明中的实施例,对本发明的技术方案进行清楚、完整地描述。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
45.实施例1
46.一步法多重pcr体系的建立,具体为:
47.(1)根据柑橘黄龙病菌(clas)、柑橘衰退病毒(ctv)、柑橘碎叶病毒(ctlv)、柑橘裂皮病类病毒(cevd)、柑橘叶斑驳病毒(clbv)和柑橘黄化脉明病毒(cyvcv)的genbank登录基因组信息,选取保守基因,设计特异引物序列,引物详细信息见下表:
[0048][0049]
(2)以上述病原的阳性cdna样品为模板,用上述6对引物分别对clas、cevd、ctv、ctlv、clbv和cyvcv病原进行扩增,得到的pcr产物与pmd18-t载体连接,大肠杆菌转化后,挑取阳性转化子交付测序公司进行序列测定,经测序确认正确的转化子进行质粒提取,从而得到上述病原的重组质粒。
[0050]
(3)多重检测技术体系参数优化,具体参数如下:
[0051]
核酸提取:
①
在待测样品中加入800μl trizol试剂,剧烈震荡摇匀,4℃离心12000rmp、5min;
②
将上清液转移至一新离心管中,加入等体积(约700μl)氯仿,剧烈震荡摇匀,4℃离心12000rmp、5min;
③
将上层水相液体(约400μl)小心转移至一新离心管中,加入等体积氯仿,剧烈震荡摇匀,4℃离心12000rmp、5min;
④
将上层水相液体(约350μl)小心转移至一新离心管中,加入等体积预冷的异丙醇,轻轻混匀后,-20℃沉降30min,4℃离心12000rmp、15min;
⑤
弃去上清液,使用75%乙醇溶液将沉淀洗两次,瞬离后弃去上清,吹干余下酒精,加适量depc水悬浮核酸,-20℃保存备用。
[0052]
cdna合成:将9.0μl核酸提取液与1.0μl random primer混匀,沸水浴3min变性,冰浴3min后加入反转录体系:5
×
m-mlv buffer4.0μl,2.5μm dntp 1.0μl,m-mlv 0.5μl,rna in 0.5μl,depc水4.0μl,共20.0μl体系。混匀后37℃水浴1h,沸水浴3min停止反应,冰浴3min后将得到的cdna保存于-20℃备用。
[0053]
多重pcr扩增:总体积为20μl,2
×
master mix 10μl,10μmol/μl的柑橘黄龙病菌引
物对、柑橘衰退病毒的引物对、柑橘碎叶病毒的引物对、柑橘裂皮病类病毒的引物对、柑橘叶斑驳病毒的引物对、柑橘黄化脉明的病毒引物对分别为0.3μl、0.25μl、0.4μl、0.2μl、0.15μl、0.2μl,前述方法得到的cdna1.0μl,余量的ddh2o;反应条件为:94℃3min,94℃30s,55℃30s,72℃30s,30个循环,72℃5min。
[0054]
pcr产物电泳检测:配置2.0%琼脂糖凝胶,将上步pcr反应体系取5.0μl点样,同时点4μldna markerⅱ,电泳电压170v,30min;电泳完毕后eb染色10min,在凝胶成像系统中获取电泳图谱。
[0055]
如对6种病原质粒样品进行检测,其电泳图谱如图1所示:m为dna markerⅱ,1为混合质粒扩增产物,2为柑橘碎叶病毒扩增产物(801bp)、3为柑橘叶斑驳病毒扩增产物(724bp),4为柑橘黄龙病菌扩增产物(535bp)、5为柑橘衰退病毒扩增产物(474bp)、6为柑橘裂皮病类病毒扩增产物(371bp)、7为柑橘黄化脉明病毒扩增产物(175bp)。混合质粒扩增结果与特定病原质粒单独扩增的靶标序列大小一致。上述pcr产物经纯化、回收、ta克隆,阳性转化子菌液经测序公司测定,获得的序列通过ncbi blast进行同源性比对鉴定,证实所获得的序列为上述病原的特异性靶向基因序列。
[0056]
由此可见,上述引物组合物在恰当的检测参数下能够实现6种嫁接传染病原的同步、特异、准确检测。
[0057]
(4)多重检测体系的灵敏度测试
[0058]
将模板初始浓度定为10ng/μl,分别用超纯水进行10倍梯度稀释,各取1.0μl模板进行灵敏度检测,结果如图2所示:可以从稀释104倍的质粒中扩增出ctlv、clbv、clas、ctv、cyvcv,从稀释103倍的质粒中扩增出cevd。即多重pcr对ctlv、clbv、clas、ctv、cyvcv病原的检测下限为1.0x10-3
ng/μl;对cevd的检测下限为1.0x10-2
ng/μl。
[0059]
实施例2
[0060]
取云南沃柑田间染病叶片样品,利用实施例1建立的多重rt-pcr检测体系进行检测(叶片样品先于液氮中充分研磨后再进行核酸提取步骤)。
[0061]
检测结果如图3所示:6种病原在待检测样品中的检出频率因样品而异,11号样品除了clbv未检测到,其余5种病原存在复合侵染;1、2、5、11、13号样品中存在ctv、ctlv、cyvcv三种病原的复合侵染;3、4、8号样品中存在ctv和cyvcv两种病原的复合侵染;6号样品中仅存在ctv一种病原,7、15号样品中存在clas、ctv、cyvcv三种病原的复合侵染,9号样品中存在ctv、cevd、cyvcv三种病原的复合侵染,10号样品中存在ctv、clbv、cyvcv三种病原复合侵染,12号样品中存在ctv、ctlv两种病原的复合侵染,14号样品中存在ctv、clbv、cyvcv三种病原复合侵染,15号样品中存在clas、ctv、cyvcv三种病原复合侵染。
[0062]
对上述样品同时采用单一pcr/rt-pcr检测,显示多重pcr检测结果与单一pcr/rt-pcr检测结果一致,说明检测准确度高。
[0063]
综上所述,本发明提供的6对特异性引物兼容性好,能够在同一反应体系中同步检测到上述6种病原,且条带清晰、容易区分,实现了6种柑橘重要嫁接传染病原的同步快速检测,为生产上柑橘嫁接传染病原特别是复合侵染病原的快速诊断和鉴定提供了重要的技术保障。
[0064]
以上所述是本发明的优选实施方式,不能以此来限定本发明之权利范围,应当指出,对于本技术领域的普通技术人员来说,凡在本发明的精神和原则之内所作的任何修改、
等同替换和改进等,均应包含在本发明的保护范围之内。
[0065]
[0066]
[0067]
[0068]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
