1.本发明属于黄曲霉素产毒真菌检测技术领域,具体涉及一种用于快速检测黄曲霉素产毒菌的引物和试剂盒及检测方法。
背景技术:
2.除了重金属、有害元素、农药残留以外,黄曲霉素污染已经成为食品安全的主要威胁。黄曲霉素的毒性和致癌力极高,比砒霜、氰化钾、三聚氰胺的毒性分别高出68倍、10倍、416倍,其致癌力分别是二甲基亚硝胺、奶油黄的75倍、900倍,诱发肝癌能力是苯并芘的4000倍,世界卫生组织(who)的癌症研究机构(iarc)于1993年将黄曲霉毒素划分为ⅰ类致癌物。2020年版《中国药典》将黄曲霉素指标纳入19种中药材的质量控制内容中,其中大枣、薏苡仁、胖大海、桃仁等10种中药为药食同源药材,既可作为中药材又可作为食品服用,说明加强黄曲霉素的监测已经成为保证食品和中药安全性的重要内容。
3.黄曲霉(aspergillus flavus)和寄生曲霉(a.parasiticus)是2种主要的黄曲霉毒素产生菌,有报道米曲霉(a.oryzae)也可产生黄曲霉素;此类真菌在自然界中的分布极为广泛,湿热的环境、不适当储存方式均可导致;黄曲霉毒素有良好的热稳定性,熔点为200-300℃,常规的烹饪、高压灭菌、有机溶剂、强酸等都不能使黄曲霉毒素降解,也就是说黄曲霉素一旦产生,就很难被消除。
4.由于一旦食品被黄曲霉素产毒真菌污染,即存在极大的安全风险,因此对源头的准确鉴定是防控黄曲霉素污染的关键。过去对产黄曲霉毒素真菌的检测通常采用形态学方法、免疫学方法等传统检测方法,这些方法主要基于真菌形态、生理特征、抗原特异性等特征进行分类鉴别,通常需要经过纯化培养、形态观察、生理生化鉴定等过程,存在检测周期长、操作程序繁琐、专业知识要求高、鉴别水平不够准确等缺点。现在发展起来的免疫分析和高效液相色谱-质谱联用技术可以准确对黄曲霉素进行定量鉴定,但是存在试剂昂贵、操作复杂、需要样本量大、难以进行菌株品种溯源等缺点。
5.为解决上述问题,公告号为cn106318938b的中国发明专利公开了一种产黄曲霉毒素真菌的单重pcr检测用引物对组合、检测方法及用途,其中,该单重pcr检测用引物对组合由特异性针对真菌内部转录间隔区序列its的its引物对、特异性针对产黄曲霉毒素调节基因aflr的aflr引物对、特异性针对柄曲霉素转甲氧基酶基因omt-1的omt-1引物对及特异性针对杂色曲霉素a脱氢酶基因ver-1的ver-1引物对组成。
6.该引物对组合虽然能够快速地检测产黄曲霉毒素真菌,但仍存在以下不足:(1)需要四对引物组合使用,只有检测样品中its、aflr、omt-1和ver-1四个基因扩增片段均没有检出时才能判定为阳性;(2)灵敏度偏低。
技术实现要素:
7.本发明的发明目的是提供一种用于快速检测黄曲霉素产毒菌的引物和试剂盒及检测方法,该引物灵敏度高。
8.为达到上述发明目的,本发明的技术方案为:
9.一种用于快速检测黄曲霉素产毒菌的引物,包括:
10.上游引物:5'-cttttcgacgcgtttttgga-3';
11.下游引物:5'-tgggtcagtgtttgtagtgc-3'。
12.本发明针对黄曲霉、寄生曲霉、米曲霉的aflr基因序列设计了上述引物,该引物不仅能够特异性地扩增黄曲霉、寄生曲霉、米曲霉中aflr基因的保守区片段,而且检测灵敏度高,当采用常规pcr进行检测时,其检测下限为4.0
×
10-1
ng/μl,当采用实时荧光定量pcr进行检测时,其检测下限为4.0
×
10-4
ng/μl。
13.基于此,本发明还提供了一种用于快速检测黄曲霉素产毒菌的试剂盒,该试剂盒中含有上述的用于快速检测黄曲霉素产毒菌的引物;以及采用上述试剂盒快速检测黄曲霉素产毒菌的方法。
14.本发明的试剂盒可以是常规pcr试剂盒,也可以是实时荧光定量pcr试剂盒。
15.当采用常规pcr试剂盒时,该检测方法可以包括以下步骤:
16.(1)提取待测样品的总dna,作为模板dna;
17.(2)采用所述的用于快速检测黄曲霉素产毒菌的试剂盒对所述的模板dna进行常规pcr扩增;
18.其中,pcr体系为:10
×
ex taq buffer(mg
2
free)5μl,浓度为2.5mm的dntp mixture 4μl,浓度为25mm的mgcl
2 4μl,引物各2μl,模板dna 1μl,ex taq 0.5μl,灭菌水补足至50μl。
19.pcr扩增程序为:94℃预变性5min;98℃变性10s,58℃退火30s,72℃延伸1min,35个循环;72℃延伸10min。
20.(3)对扩增产物进行检测,并根据检测结果判断待测样品中是否含有黄曲霉素产毒菌。
21.当采用实时荧光定量pcr试剂盒时,该检测方法可以包括以下步骤:
22.(1)提取待测样品的总dna,作为模板dna;
23.(2)采用所述的用于快速检测黄曲霉素产毒菌的试剂盒对所述的模板dna进行荧光定量pcr扩增;
24.其中,pcr体系为:2
×
sybr abstart master mix 12.5μl,浓度为200nmol/l的引物各1μl,浓度为20ng/μl的模板dna1.5μl,灭菌水补足至25μl;
25.pcr扩增程序为:94℃预变性5min;94℃变性10s,59℃退火30s,72℃延伸1min,40个循环;
26.(3)对扩增产物进行检测,并根据检测结果判断待测样品中是否含有黄曲霉素产毒菌。
27.与现有技术相比,本发明的有益效果为:
28.本发明采用一对特异性扩增aflr基因保守区片段的引物即可实现对黄曲霉素产毒菌(包括黄曲霉、寄生曲霉、米曲霉)的快速准确检测,并且检测灵敏度高,当采用常规pcr进行检测时,其检测下限为4.0
×
10-1
ng/μl,当采用实时荧光定量pcr进行检测时,其检测下限为4.0
×
10-4
ng/μl。
附图说明
29.图1为本发明用于快速检测黄曲霉素产毒菌的引物对12种受测菌株的常规pcr扩增结果图;
30.其中,marker为标准,n为阴性对照;下同;
31.图2为本发明用于快速检测黄曲霉素产毒菌的引物的常规pcr灵敏度测试结果图;
32.其中,泳道1-6对应的模板dna浓度依次为4.0ng/μl、4.0
×
10-1
ng/μl、4.0
×
10-2
ng/μl、4.0
×
10-3
ng/μl、4.0
×
10-4
ng/μl、4.0
×
10-5
ng/μl,泳道7为阴性对照;
33.图3为采用本发明用于快速检测黄曲霉素产毒菌的引物进行实时荧光定量pcr时循环次数30次下的荧光增长曲线图;
34.其中,amplification表示荧光增长曲线,cycles表示循环次数,rfu表示相对荧光单位;下同;
35.图4为采用本发明用于快速检测黄曲霉素产毒菌的引物进行实时荧光定量pcr时循环次数30次下的溶解曲线图;
36.其中,melt peak表示溶解曲线图,temperature,celsius表示温度/摄氏度,-d(rfu)/dt表示相对荧光单位的对数值;下同;
37.图5为采用本发明用于快速检测黄曲霉素产毒菌的引物进行实时荧光定量pcr时循环次数35次下的荧光增长曲线图;
38.图6为采用本发明用于快速检测黄曲霉素产毒菌的引物进行实时荧光定量pcr时循环次数35次下的溶解曲线图;
39.图7为采用本发明用于快速检测黄曲霉素产毒菌的引物进行实时荧光定量pcr时循环次数40次下的荧光增长曲线图;
40.图8为采用本发明用于快速检测黄曲霉素产毒菌的引物进行实时荧光定量pcr时循环次数40次下的溶解曲线图;
41.图9为采用本发明用于快速检测黄曲霉素产毒菌的引物进行实时荧光定量pcr时不同sybr用量下的荧光增长曲线图;
42.图10为采用本发明用于快速检测黄曲霉素产毒菌的引物进行实时荧光定量pcr时不同模板dna用量下的荧光增长曲线图;
43.图11为采用本发明用于快速检测黄曲霉素产毒菌的引物进行实时荧光定量pcr时不同退火温度下的荧光增长曲线图;
44.图12为采用本发明用于快速检测黄曲霉素产毒菌的引物进行实时荧光定量pcr时不同引物浓度下的荧光增长曲线图;
45.图13为本发明用于快速检测黄曲霉素产毒菌的引物的荧光定量pcr特异性测试结果图(荧光增长曲线);
46.其中,a.flavus表示黄曲霉,a.parasiticus表示寄生曲霉,a.oryzae表示米曲霉;
47.图14为本发明用于快速检测黄曲霉素产毒菌的引物的荧光定量pcr特异性测试结果图(溶解曲线);
48.图15为本发明用于快速检测黄曲霉素产毒菌的引物的荧光定量pcr灵敏度测试结果图(荧光增长曲线);
49.其中,a表示模板dna浓度为4.0ng/μl,b表示模板dna浓度为4.0
×
10-1
ng/μl,c表示
模板dna浓度为4.0
×
10-2
ng/μl,d表示模板dna浓度为4.0
×
10-3
ng/μl,e表示模板dna浓度为4.0
×
10-4
ng/μl,f表示模板dna浓度为4.0
×
10-5
ng/μl,g表示阴性对照;
50.图16为本发明用于快速检测黄曲霉素产毒菌的引物的荧光定量pcr灵敏度测试结果图(溶解曲线);
51.图17为本发明用于快速检测黄曲霉素产毒菌的引物的荧光定量pcr灵敏度测试结果图(标准曲线);
52.其中,standard curve表示标注曲线,ct值表示每隔反应管内的荧光信号到达设定阈值时所精力的循环数,log starting quantity表示起始浓度的对数值;
53.图18为本发明用于快速检测黄曲霉素产毒菌的引物的重复性测试结果图(荧光增长曲线);
54.图19为本发明用于快速检测黄曲霉素产毒菌的引物的重复性测试结果图(溶解曲线)。
具体实施方式
55.下面结合具体实施方和附图对本发明的技术方案作进一步详细说明。
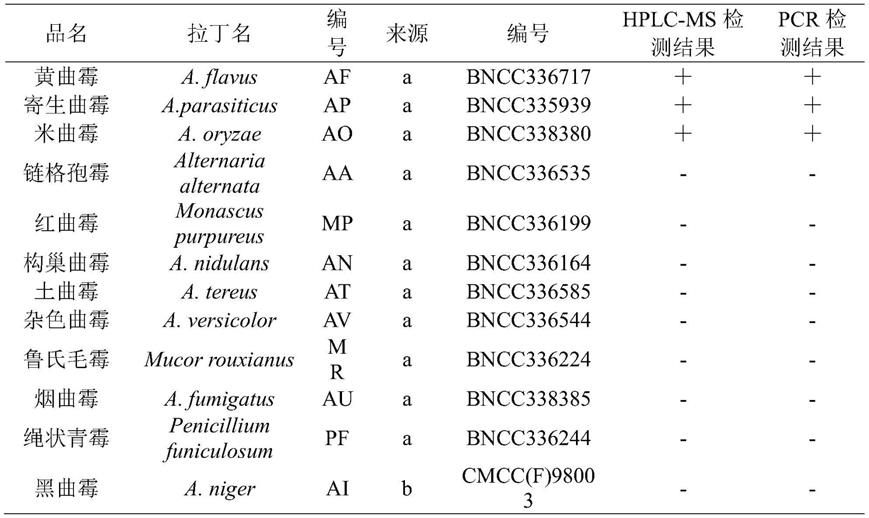
56.本发明的具体实施方式中采用的菌株信息如表1所示。
57.表1试验用标准菌株信息及其是否产黄曲霉素的hplc-ms检测和pcr检测结果
[0058][0059]
注:a表示北京北纳创联生物技术研究院,b表示中国食品药品检定研究院, 表示检出阳性;-表示检出阴性。
[0060]
实施例1用于快速检测黄曲霉素产毒菌的引物
[0061]
在ncbi上下载黄曲霉、寄生曲霉、米曲霉的aflr基因序列,根据3种产毒真菌具有特异性的保守区设计扩增引物对pp6,并由上海生工生物技术有限公司合成;引物序列信息及pcr扩增条件见表2。
[0062]
表2引物信息
[0063][0064]
实施例2用于快速检测黄曲霉素产毒菌的常规pcr试剂盒
[0065]
本实施例的用于快速检测黄曲霉素产毒菌的常规pcr试剂盒中即含有实施例1中的引物对pp6,采用该常规pcr试剂盒对引物对pp6的特异性和灵敏度进行测试。
[0066]
1、引物特异性测试
[0067]
引物特异性的测试方法为:
[0068]
(1)菌株培养及dna提取
[0069]
具体地,以表1中列举的12种菌株为检测对象,将各菌株分别接种于马铃薯-葡萄糖琼脂培养基(pda)上,在28℃下活化培养5-7天,而后挑取菌丝体于液氮中研磨,并采用真菌基因组dna抽提试剂盒(购自上海生工生物技术有限公司)进行dna提取,获得模板dna;
[0070]
(2)采用引物对pp6对模板dna进行pcr扩增;
[0071]
其中,pcr体系为:10
×
ex taq buffer(mg
2
free)5μl,dntp mixture(各2.5mm)4μl,mgcl2(25mm)4μl,引物各2μl,模板dna 1μl,ex taq 0.5μl,灭菌水补足至50μl;
[0072]
pcr扩增程序为:94℃预变性5min;98℃变性10s,58℃退火30s,72℃延伸1min,35个循环;72℃延伸10min;
[0073]
(3)对扩增产物进行检测,检测结果见图1。
[0074]
由图1可见,采用引物对pp6对黄曲霉、寄生曲霉、米曲霉进行常规pcr扩增,能够获得250bp的目标aflr基因片段;而对其他九种霉菌进行扩增的不能得到目标片段;表明引物对pp6对黄曲霉、寄生曲霉、米曲霉这三种黄曲霉素产毒菌具有较高的特异性。
[0075]
对pcr产物进行测序并在ncbi核酸数据库进行序列比对,发现pp6对黄曲霉、寄生曲霉和米曲霉的扩增产物序列与同一物种的相似度均大于99%,表明引物对pp6具有良好的特异性和正确性。
[0076]
2、引物灵敏度测试
[0077]
以标准菌株黄曲霉的dna(40ng/μl)为标准品,分别进行10-1
、10-2
、10-3
、10-4
、10-5
、10-6
的6个梯度稀释,并换算得到系列拷贝数的阳性标准品扩增模板,采用与“1、引物特异性测试”部分中相同的方法进行常规pcr扩增,根据扩增片段的有无评价体系灵敏度,扩增结果见图2。
[0078]
如图2可见,引物pp6对黄曲霉、寄生曲霉、米曲霉这三种黄曲霉素产毒菌的常规pcr检测下限为4.0
×
10-1
ng/μl。
[0079]
实施例3用于快速检测黄曲霉素产毒菌的实时荧光定量pcr试剂盒
[0080]
本实施例的用于快速检测黄曲霉素产毒菌的实时荧光定量pcr试剂盒中即含有实施例1中的引物对pp6,采用该实时荧光定量pcr试剂盒对引物对pp6的特异性和灵敏度进行测试。
[0081]
1、荧光定量pcr体系及程序优化
[0082]
以表1中所列的12种菌株为检测对象,对循环次数、sybr用量、模板dna用量、退火温度、引物浓度等因素,分别进行单因素试验,根据扩增曲线和溶解曲线图以最高荧光值、最小ct值且在溶解曲线分析中不产生非特异性峰值为优化标准评估选择最佳条件,每确定一个条件就作为后续研究的条件。
[0083]
25μl反应体系中各因素与水平见表3。
[0084]
表3 real-time pcr条件优化因素与水平
[0085][0086]
①
循环次数的优化
[0087]
由图3-8可见,引物对pp6在对黄曲霉、寄生曲霉、米曲霉这三种黄曲霉素产毒菌进行扩增时均获得了较高荧光累积,并且,随着循环次数增加,荧光累积的倍数逐渐提高,因此选择40次循环;同时,溶解曲线图显示单一的色谱峰,无引物二聚体等非特异性峰,说明引物的特异性良好;而对其他受测霉菌进行扩增时则无荧光累积。
[0088]
②
sybr用量优化
[0089]
由图9可见,随着sybr用量的增加,引物对pp6在对黄曲霉、寄生曲霉、米曲霉这三种黄曲霉素产毒菌进行扩增时荧光累积的倍数逐渐提高,因此选择添加12.5μl的sybr abstart master mix。
[0090]
③
模板dna用量优化
[0091]
由图10可见,随着模板dna用量增加,引物对pp6在对黄曲霉、寄生曲霉、米曲霉这三种黄曲霉素产毒菌进行扩增时荧光累积的倍数逐渐提高,但3ng的模板dna与5ng的模板dna时所获得的荧光累积相当,因此选择添加3ng的模板dna。
[0092]
④
退火温度优化
[0093]
由图11可见,随着退火温度升高,引物对pp6在对黄曲霉、寄生曲霉、米曲霉这三种黄曲霉素产毒菌进行扩增时荧光累积的倍数逐渐提高,因此选择59℃作为退火温度。
[0094]
⑤
引物浓度优化
[0095]
由图12可见,随着引物浓度升高,引物对pp6在对黄曲霉、寄生曲霉、米曲霉这三种黄曲霉素产毒菌进行扩增时荧光累积的倍数逐渐提高,因此确定pcr体系中添加的引物浓度为200nmol/l。
[0096]
综上所述,本实施例优化的pcr体系为:2
×
sybr abstart master mix 12.5μl,引物(200nmol/l)各1μl,模板dna(20ng/μl)1.5μl,灭菌水补足至25μl;
[0097]
pcr扩增程序为:94℃预变性5min;94℃变性10s,59℃退火30s,72℃延伸1min,40个循环。
[0098]
2、引物特异性测试
[0099]
①
菌株培养及dna提取
[0100]
同实施例1;
[0101]
②
采用引物对pp6对模板dna进行荧光定量pcr扩增;
[0102]
③
对扩增产物进行检测,检测结果见图13和图14。
[0103]
由图13可见,实时荧光定量pcr扩增结果显示,只有黄曲霉、寄生曲霉、米曲霉这3种黄曲霉素产毒菌的dna模板扩增时出现阳性反应,采集获得荧光增长曲线,而其它所有的供试菌株扩增时均未获得荧光累积;表明引物对pp6的特异性极佳。
[0104]
由图14可见,溶解曲线图显示出单一的色谱峰,无引物二聚体等非特异性峰,进一步说明引物对pp6的特异性良好。
[0105]
(3)引物灵敏度测试
[0106]
以标准菌株黄曲霉的dna(40ng/μl)为标准品,分别进行10-1
、10-2
、10-3
、10-4
、10-5
、10-6
的6个梯度稀释,并换算得到系列拷贝数的阳性标准品扩增模板,采用与
“②
引物特异性测试”部分中相同的方法进行荧光定量pcr扩增,根据荧光值的大小评价体系灵敏度,扩增结果见图15和图16;而后以起始浓度的对数值为x轴,以ct值为y轴构建标准曲线(如图17所示),标准曲线由荧光定量软件(biomed connect)自动生成,标准曲线方程为:y=55.370-3.486x(r2=0.986)
[0107]
由图15和图16和图17可见,含引物pp6的荧光定量体系对黄曲霉、寄生曲霉、米曲霉这三种黄曲霉素产毒菌的检测下限为4.0
×
10-4
ng/μl。
[0108]
(4)引物重复性测试
[0109]
以黄曲霉dna(40ng/μl)标准品为模板,选择中间3个浓度梯度(10-2
、10-3
、10-4
倍稀释)进行重复性试验,每个浓度梯度进行20个重复,确定灵敏度的重复性;测试结果见图18和图19。
[0110]
由图18和图19可见,引物对pp6的灵敏度重复性良好,扩增曲线平缓正常,荧光强度有明显基线期、指数增长期和平台期,溶解曲线未出现非特异性峰值。
[0111]
(5)引物稳定性测试
[0112]
以黄曲霉dna(40ng/μl)标准品为模板,选择中间3个浓度梯度(10-2
、10-3
、10-4
倍稀释)进行批内批间重复性试验,计算批内及批间变异系数,考察引物的稳定性,试验结果见表4和表5。
[0113]
表4引物对pp6的批内重复试验结果
[0114][0115]
表5引物对pp6的批间重复试验结果
[0116][0117]
由表4和表5可见,引物对pp6的批内变异系数(cv1)在0.833%~1.631%,批间变异系数(cv2)在1.751%~3.655%,表明引物对pp6具有较好的稳定性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
