一种利用榴红曲霉a2制备化合物的用途和方法
技术领域
1.本发明涉及海洋微生物药物领域,涉及具有一种利用榴红曲霉a2制备化合物的用途和方法。
背景技术:
2.通过对极端环境条件的适应,深海微生物具有独特的生理代谢过程,进而表现出其代谢产物化学结构的多样性,新颖性和显著的生物活性。海洋微生物目前是药理活性天然产物的最丰富来源之一,这些生物活性化合物不仅可以帮助深海真菌防御自然生态系统中的天敌,而且还具有成为治疗人类疾病和寻找新的生物靶标的潜力,为海洋药物研发提供重要支撑。
3.现有技术中,由于海洋微生物种类极为繁多,据估计其数量可达0.1亿~2亿种。迄今为止,人类发现的微生物大约有150多万种,除了7.2万种存在于陆地外,其余都存在于海洋之中。虽然一些海洋微生物的代谢产物存在药理活性物质,但并非所有的海洋微生物均可以发酵培养获得活性物质,采用何种海洋微生物进行发酵,如何发酵培养,如何分离纯化,才能获得产量高,纯度高的活性物质仍是一个的难题。
4.因此,仍亟需一种操作简单,产物丰富,能制备多种有药理活性的化合物的制备方法。
技术实现要素:
5.为解决上述问题,本发明提供一种化合物的制备方法。本发明利用固体发酵方法对一株榴红曲霉a2(aspergillus puniceus a2)大规模发酵培养,采用多种色谱学分离纯化方法从其发酵产物中分离得到化合物。之后通过细胞活力,炎症介质等指标测试了单体化合物的抗炎活性,为探究活性化合物在医药行业中的应用提供参考。
6.本发明详细阐述采用大米固体培养基对一株榴红曲霉a2(aspergillus puniceus a2)进行发酵培养,综合运用硅胶柱层析、葡聚糖凝胶柱层析和高效液相色谱等多种色谱分离技术,对其发酵产物进行分离纯化,之后利用nmr和质谱等现代波谱技术,并结合文献资料报道,鉴定出11个单体化合物,包括2个新化合物;通过抗炎活性实验检测到此11个化合物具有抗炎活性。研究结果预期为新颖活性天然产物应用于医药和食品领域提供重要参考。
7.第一方面,本发明提供一种榴红曲霉a2(aspergillus puniceus a2)在制备化合物中的用途。
8.在一些实施方式中,一种榴红曲霉a2(aspergillus puniceus a2)在制备以下至少一种化合物中的用途,
[0009][0010][0011]
所述榴红曲霉a2(aspergillus puniceus)是已公开的任何榴红曲霉菌a2。在一些实施方式中,所述榴红曲霉a2(aspergillus puniceus a2)可以为分离自太平洋(156
°
31'20"e,12
°
27'7"n)4841m深处的沉积物的榴红曲霉a2(aspergillus puniceus a2)。所述分离自太平洋(156
°
31'20"e,12
°
27'7"n)4841m深处的沉积物的榴红曲霉a2(aspergillus puniceus a2)的its基因序列分析结果显示与aspergillus puniceus strain srrc 2155相似度为99.83%,鉴定该菌为aspergillus puniceus a2;所述分离自太平洋(156
°
31'20"e,12
°
27'7"n)4841m深处的沉积物的榴红曲霉a2(aspergillus puniceus a2)的测序结果提交genbank,登录号为om063154。所述分离自太平洋(156
°
31'20"e,12
°
27'7"n)4841m深处的沉积物的榴红曲霉a2(aspergillus puniceus a2)保藏于自然资源部第三海洋研究所海洋生物资源开发利用工程技术创新中心。
[0012]
第二方面,本发明提供一种化合物的制备方法。
[0013]
在一些实施方式中,一种化合物的制备方法,其包括:
[0014]
步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得
到发酵产物;然后,
[0015]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物。采用本发明所提供榴红曲霉a2(aspergillus puniceus a2)进行生物合成,有利于制备得到多种具有抗炎效果的化合物,且所述方法操作简单,所得化合物产量高。
[0016]
在一些实施方式中,所述化合物包括以下化合物中的至少一种:
[0017][0018]
在一些实施方式中,所述化合物包括化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10和化合物11。
[0019]
在一些实施方式中,所述粗提物在分离纯化前可以先进行浓缩。
[0020]
在一些实施方式中,所述浓缩可以为旋蒸浓缩或减压浓缩。
[0021]
在一些实施方式中,所述培养基可以包括大米、氯化钠和水。
[0022]
在一些实施例中,所述氯化钠为海盐。
[0023]
在一些实施方式中,以所述培养基的总质量计算,所述大米的含量可以为40.0wt%-45.0wt%,所述氯化钠的含量可以为1.5wt%-2.0wt%,余量可以为水。在一些实
施例中,以所述培养基的总质量计算,所述大米的含量为42.5wt%,所述氯化钠的含量为1.8wt%,余量为水。
[0024]
在一些实施方式中,所述发酵培养的温度为25℃-28℃。在一些实施例中,所述发酵培养的培养温度为25℃
[0025]
在一些实施方式中,所述发酵培养的时间为42天-55天。在一些实施例中,所述发酵培养的培养时间为50天。
[0026]
在一些实施方式中,所述萃取可以包括采用乙酸乙酯进行萃取。
[0027]
在一些实施方式中,所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2。
[0028]
在一些实施方式中,所述组分fr.1可以经反相硅胶柱进行梯度洗脱b,所述梯度洗脱b可以为使用5-8倍柱体积的体积比9:11-1:0的甲醇:水混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1和组分fr.1.2。
[0029]
在一些实施方式中,所述组分fr.1.1可以经正相硅胶柱层析等度洗脱c,所述等度洗脱c可以为使用8-10倍柱体积的体积比3:1的石油醚:乙酸乙酯混合液进行洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1、组分fr.1.1.2和组分fr.1.1.3。
[0030]
在一些实施方式中,所述组分fr.1.1.1可以经正相硅胶柱层析等度洗脱d,所述等度洗脱d可以为,使用10-15倍柱体积的体积比50:1的二氯甲烷:丙酮混合液进行洗脱,得到4种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1.1、组分fr.1.1.1.2、组分fr.1.1.1.3和组分fr.1.1.1.4。
[0031]
在一些实施方式中,所述组分fr.1.1.1.3可以经纯化得到化合物9。
[0032]
在一些实施方式中,所述组分fr.1.1.1.4可以经纯化得到化合物8。
[0033]
在一些实施方式中,所述组分fr.1.1.2可以经正相硅胶柱层析等度洗脱e,所述等度洗脱e可以为使用10-15倍柱体积的二氯甲烷进行洗脱,得到1种组分,命名为组分fr.1.1.2.1;所述组分fr.1.1.2.1经纯化得到化合物5和化合物6。
[0034]
在一些实施方式中,所述组分fr.1.1.3可以经正相硅胶柱层析等度洗脱f,所述等度洗脱f可以为使用10-15倍柱体积的二氯甲烷进行洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.3.1和组分fr.1.1.3.2;所述组分fr.1.1.3.1经纯化得到化合物3和化合物4。
[0035]
在一些实施方式中,所述组分fr.1.2可以经正相硅胶柱层析梯度洗脱g,所述梯度洗脱g可以为使用8-10倍柱体积的体积比400:1-1:1的二氯甲烷:甲醇混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.2.1和组分fr.1.2.2;所述组分fr.1.2.2可以经纯化得到化合物7。
[0036]
在一些实施方式中,所述组分fr.2可以经反相硅胶柱梯度洗脱h,所述梯度洗脱h可以为使用5-8倍柱体积的体积比3:7-1:0的甲醇:水混合液进行梯度洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.2.1、组分fr.2.2和组分fr.2.3。
[0037]
在一些实施方式中,所述组分fr.2.1可以经葡聚糖凝胶柱等度洗脱i,所述等度洗
脱i可以为使用6-9倍柱体积的甲醇进行洗脱,得到1种组分,命名为组分fr.2.1.1;所述组分fr.2.1.1经纯化得到化合物10和化合物11。
[0038]
在一些实施方式中,所述组分fr.2.2可以经纯化得到化合物2。
[0039]
在一些实施方式中,所述组分fr.2.3可以经葡聚糖凝胶柱等度洗脱j,所述等度洗脱j可以为使用6-9倍柱体积的甲醇进行洗脱,得到组分fr.2.3.1,所述组分fr.2.3.1经纯化得到化合物1。
[0040]
在一些实施方式中,在得到各化合物前的所述“经纯化得到”可以包括经制备型高效液相色谱法或半制备型高效液相色谱法纯化得到。
[0041]
在一些实施方式中,一种化合物1的制备方法,其包括:步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得到发酵产物;然后,
[0042]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;
[0043]
所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2,所述组分fr.2可以经反相硅胶柱梯度洗脱h,所述梯度洗脱h可以为使用5-8倍柱体积的体积比3:7-1:0的甲醇:水混合液进行梯度洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.2.1、组分fr.2.2和组分fr.2.3,所述组分fr.2.3可以经葡聚糖凝胶柱等度洗脱j,所述等度洗脱j可以为使用6-9倍柱体积的甲醇进行洗脱,得到1种组分,命名为组分fr.2.3.1,所述组分fr.2.3.1经纯化得到化合物1。
[0044]
在一些实施方式中,一种化合物2的制备方法,其包括:步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得到发酵产物;然后,
[0045]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;
[0046]
所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2,所述组分fr.2可以经反相硅胶柱梯度洗脱h,所述梯度洗脱h可以为使用5-8倍柱体积的体积比3:7-1:0的甲醇:水混合液进行梯度洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.2.1、组分fr.2.2和组分fr.2.3,所述组分fr.2.2可以经纯化得到化合物2。
[0047]
在一些实施方式中,一种化合物3的制备方法,其包括:步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得到发酵产物;然后,
[0048]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;
[0049]
所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2,所述组分fr.1可以经反相硅胶柱进行梯度洗脱b,所述梯度洗
脱b可以为使用5-8倍柱体积的体积比9:11-1:0的甲醇:水混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1和组分fr.1.2;所述组分fr.1.1可以经正相硅胶柱层析等度洗脱c,所述等度洗脱c可以为使用8-10倍柱体积的体积比3:1的石油醚:乙酸乙酯混合液进行洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1、组分fr.1.1.2和组分fr.1.1.3;所述组分fr.1.1.3可以经正相硅胶柱层析等度洗脱f,所述等度洗脱f可以为使用10-15倍柱体积的二氯甲烷进行洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.3.1和组分fr.1.1.3.2;所述组分fr.1.1.3.1经纯化得到化合物3。
[0050]
在一些实施方式中,一种化合物4的制备方法,其包括:步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得到发酵产物;然后,
[0051]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;
[0052]
所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2,所述组分fr.1可以经反相硅胶柱进行梯度洗脱b,所述梯度洗脱b可以为使用5-8倍柱体积的体积比9:11-1:0的甲醇:水混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1和组分fr.1.2;所述组分fr.1.1可以经正相硅胶柱层析等度洗脱c,所述等度洗脱c可以为使用8-10倍柱体积的体积比3:1的石油醚:乙酸乙酯混合液进行洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1、组分fr.1.1.2和组分fr.1.1.3;所述组分fr.1.1.3可以经正相硅胶柱层析等度洗脱f,所述等度洗脱f可以为使用10-15倍柱体积的二氯甲烷进行洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.3.1和组分fr.1.1.3.2;所述组分fr.1.1.3.1经纯化得到化合物4。
[0053]
在一些实施方式中,一种化合物5的制备方法,其包括:步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得到发酵产物;然后,
[0054]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;
[0055]
所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2,所述组分fr.1可以经反相硅胶柱进行梯度洗脱b,所述梯度洗脱b可以为使用5-8倍柱体积的体积比9:11-1:0的甲醇:水混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1和组分fr.1.2;所述组分fr.1.1可以经正相硅胶柱层析等度洗脱c,所述等度洗脱c可以为使用8-10倍柱体积的体积比3:1的石油醚:乙酸乙酯混合液进行洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1、组分fr.1.1.2和组分fr.1.1.3;所述组分fr.1.1.2可以经正相硅胶柱层析等度洗脱e,所述等度洗脱e可以为使用10-15倍柱体积的二氯甲烷进行洗脱,得到1种组分,命名为组分fr.1.1.2.1;所述组分fr.1.1.2.1经纯化得到化合物5。
[0056]
在一些实施方式中,一种化合物6的制备方法,其包括:步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得到发酵产物;然后,
[0057]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;
[0058]
所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2,所述组分fr.1可以经反相硅胶柱进行梯度洗脱b,所述梯度洗脱b可以为使用5-8倍柱体积的体积比9:11-1:0的甲醇:水混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1和组分fr.1.2;所述组分fr.1.1可以经正相硅胶柱层析等度洗脱c,所述等度洗脱c可以为使用8-10倍柱体积的体积比3:1的石油醚:乙酸乙酯混合液进行洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1、组分fr.1.1.2和组分fr.1.1.3;所述组分fr.1.1.2可以经正相硅胶柱层析等度洗脱e,所述等度洗脱e可以为使用10-15倍柱体积的二氯甲烷进行洗脱,得到1种组分,命名为组分fr.1.1.2.1;所述组分fr.1.1.2.1经纯化得到化合物6。
[0059]
在一些实施方式中,一种化合物7的制备方法,其包括:步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得到发酵产物;然后,
[0060]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;
[0061]
所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2,所述组分fr.1可以经反相硅胶柱进行梯度洗脱b,所述梯度洗脱b可以为使用5-8倍柱体积的体积比9:11-1:0的甲醇:水混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1和组分fr.1.2;所述组分fr.1.2可以经正相硅胶柱层析梯度洗脱g,所述梯度洗脱g可以为使用8-10倍柱体积的体积比400:1-1:1的二氯甲烷:甲醇混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.2.1和组分fr.1.2.2;所述组分fr.1.2.2可以经纯化得到化合物7。
[0062]
在一些实施方式中,一种化合物8的制备方法,其包括:步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得到发酵产物;然后,
[0063]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;
[0064]
所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2,所述组分fr.1可以经反相硅胶柱进行梯度洗脱b,所述梯度洗脱b可以为使用5-8倍柱体积的体积比9:11-1:0的甲醇:水混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1和组分fr.1.2;所述组分fr.1.1可以经正相硅胶柱层析等度洗脱c,所述等度洗脱c可以为使用8-10倍柱体积的体积比3:1的石
油醚:乙酸乙酯混合液进行洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1、组分fr.1.1.2和组分fr.1.1.3;所述组分fr.1.1.1可以经正相硅胶柱层析等度洗脱d,所述等度洗脱d可以为使用10-15倍柱体积的体积比50:1的二氯甲烷:丙酮混合液进行洗脱,得到4种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1.1、组分fr.1.1.1.2、组分fr.1.1.1.3和组分fr.1.1.1.4;所述组分fr.1.1.1.4可以经纯化得到化合物8。
[0065]
在一些实施方式中,一种化合物9的制备方法,其包括:步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得到发酵产物;然后,
[0066]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;
[0067]
所述步骤s2中的可以分离纯化包括:所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2,所述组分fr.1可以经反相硅胶柱进行梯度洗脱b,所述梯度洗脱b可以为使用5-8倍柱体积的体积比9:11-1:0的甲醇:水混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1和组分fr.1.2;所述组分fr.1.1可以经正相硅胶柱层析等度洗脱c,所述等度洗脱c可以为使用8-10倍柱体积的体积比3:1的石油醚:乙酸乙酯混合液进行洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1、组分fr.1.1.2和组分fr.1.1.3;所述组分fr.1.1.1可以经正相硅胶柱层析等度洗脱d,所述等度洗脱d可以为使用10-15倍柱体积的体积比50:1的二氯甲烷:丙酮混合液进行洗脱,得到4种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1.1、组分fr.1.1.1.2、组分fr.1.1.1.3和组分fr.1.1.1.4;所述组分fr.1.1.1.3可以经纯化得到化合物9。
[0068]
在一些实施例中,一种化合物10的制备方法,其包括:步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得到发酵产物;然后,
[0069]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;
[0070]
所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2;所述组分fr.2可以经反相硅胶柱梯度洗脱h,所述梯度洗脱h可以为使用5-8倍柱体积的体积比3:7-1:0的甲醇:水混合液进行梯度洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.2.1、组分fr.2.2和组分fr.2.3;所述组分fr.2.1可以经葡聚糖凝胶柱等度洗脱i,所述等度洗脱i可以为使用6-9倍柱体积的甲醇进行洗脱,得到1种组分,命名为组分fr.2.1.1;所述组分fr.2.1.1经纯化得到化合物10。
[0071]
在一些实施例中,一种化合物11的制备方法,其包括:步骤s1:将榴红曲霉a2(aspergillus puniceus a2)在培养基中进行发酵培养,得到发酵产物;然后,
[0072]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;
[0073]
所述步骤s2中的可以分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2;所述组分fr.2可以经反相硅胶柱梯度洗脱h,所述梯度洗脱h可以为使用5-8倍柱体积的体积比3:7-1:0的甲醇:水混合液进行梯度洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.2.1、组分fr.2.2和组分fr.2.3;所述组分fr.2.1可以经葡聚糖凝胶柱等度洗脱i,所述等度洗脱i可以为使用6-9倍柱体积的甲醇进行洗脱,得到1种组分,命名为组分fr.2.1.1;所述组分fr.2.1.1经纯化得到化合物11。
[0074]
在一种实施方式中,一种化合物的制备方法,其包括:
[0075]
步骤s1:将榴红曲霉a2在培养基中进行发酵培养,得到发酵产物;然后,
[0076]
步骤s2:对步骤s1所得发酵产物进行萃取得到粗提物,粗提物经分离纯化得到化合物;所述化合物包括以下化合物中的至少一种:
[0077]077]
所述步骤s2中的分离纯化包括:用正相硅胶柱层析进行梯度洗脱a,所述梯度洗脱a为使用8-10倍柱体积的体积比1:0-3:1的石油醚:乙酸乙酯混合液进行梯度洗脱,并且使
用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和组分fr.2;
[0078]
所述组分fr.1经反相硅胶柱进行梯度洗脱b,所述梯度洗脱b为使用5-8倍柱体积的体积比9:11-1:0的甲醇:水混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1和组分fr.1.2;
[0079]
所述组分fr.1.1经正相硅胶柱层析等度洗脱c,所述等度洗脱c为使用8-10倍柱体积的体积比3:1的石油醚:乙酸乙酯混合液进行洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1、组分fr.1.1.2和组分fr.1.1.3;
[0080]
所述组分fr.1.1.1经正相硅胶柱层析等度洗脱d,所述等度洗脱d为,使用10-15倍柱体积的体积比50:1的二氯甲烷:丙酮混合液进行洗脱,得到4种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1.1、组分fr.1.1.1.2、组分fr.1.1.1.3和组分fr.1.1.1.4;
[0081]
所述组分fr.1.1.1.3经纯化得到化合物9;
[0082]
所述组分fr.1.1.1.4经纯化得到化合物8;
[0083]
所述组分fr.1.1.2经正相硅胶柱层析等度洗脱e,所述等度洗脱e为使用10-15倍柱体积的二氯甲烷进行洗脱,得到1种组分,命名为组分fr.1.1.2.1;所述组分fr.1.1.2.1经纯化得到化合物5和化合物6;
[0084]
所述组分fr.1.1.3经正相硅胶柱层析等度洗脱f,所述等度洗脱f为使用10-15倍柱体积的二氯甲烷进行洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.3.1和组分fr.1.1.3.2;所述组分fr.1.1.3.1经纯化得到化合物3和化合物4;
[0085]
所述组分fr.1.2经正相硅胶柱层析梯度洗脱g,所述梯度洗脱g为使用8-10倍柱体积的体积比400:1-1:1的二氯甲烷:甲醇混合液进行梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.2.1和组分fr.1.2.2;所述组分fr.1.2.2经纯化得到化合物7;
[0086]
所述组分fr.2经反相硅胶柱梯度洗脱h,所述梯度洗脱h为使用5-8倍柱体积的体积比3:7-1:0的甲醇:水混合液进行梯度洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.2.1、组分fr.2.2和组分fr.2.3;
[0087]
所述组分fr.2.1经葡聚糖凝胶柱等度洗脱i,所述等度洗脱i为使用6-9倍柱体积的甲醇进行洗脱,得到1种组分,命名为组分fr.2.1.1;所述组分fr.2.1.1经纯化得到化合物10和化合物11;
[0088]
所述组分fr.2.2经纯化得到化合物2;
[0089]
所述组分fr.2.3经葡聚糖凝胶柱等度洗脱j,所述等度洗脱j为使用6-9倍柱体积的甲醇进行洗脱,得到组分fr.2.3.1,所述组分fr.2.3.1经纯化得到化合物1。
[0090]
第三方面,本发明提供一种化合物,其为化合物1或其药学上可接受的盐或化合物2或其药学上可接受的盐,
[0091][0092]
第四方面,本发明提供一种上述化合物或其药学上可接受的盐的应用。
[0093]
在一些实施方式中,一种以下任意一种化合物或其药学上可接受的盐在制备抑制巨噬细胞释放一氧化氮的药物中的应用,
[0094][0095]
在一些实施方式中,一种以下任意一种化合物或其药学上可接受的盐在制备治疗或缓解炎症的药物中的应用,
[0096][0097][0098]
有益效果
[0099]
相比现有技术,本发明的某一个实施例包括以下至少一个有益效果:
[0100]
(1)采用本发明所提供榴红曲霉a2(aspergillus puniceus a2)进行生物合成,有利于制备得到多种具有抗炎效果的化合物,为开发治疗炎症性疾病提供新的化合物来源,且所述方法操作简单,所得化合物产量高。
[0101]
(2)采用本发明所提供榴红曲霉a2(aspergillus puniceus a2)和发酵培养温度和发酵培养时间进行生物合成,有利于制备得到多种具有抗炎效果的化合物,为开发治疗炎症性疾病提供新的化合物来源,且所述方法操作简单,所得化合物产量高。
[0102]
(3)相比其他培养基(如马铃薯葡萄糖液体培养基),采用本发明所提供的培养基进行培养,有利于获得产量高,化合物种类丰富的活性物质。
[0103]
(4)通过本发明所提供的分离纯化方法,有利于获得多种纯度高的化合物。
附图说明
[0104]
图1为本发明实施例2中各化合物对raw264.7细胞活力的影响统计图。
[0105]
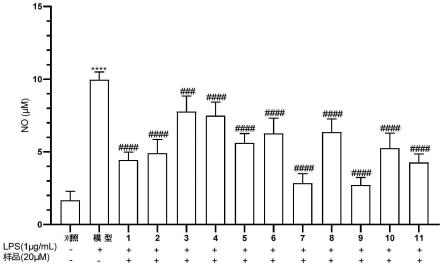
图2为本发明实施例2中各化合物对raw264.7细胞释放no的影响统计图。注:****p《0.0001;###p《0.001,####p《0.0001。
[0106]
附图中,横坐标中的1、2、3、4等代表化合物1、化合物2、化合物3、化合物4等化合物,
“‑”
表示不添加,“ ”表示添加,例如化合物1下的lps“ ”表示化合物1组添加lps。
[0107]
术语说明
[0108]
在本发明的上文中,无论是否使用“大约”或“约”等字眼,所有在此公开了的数字均为近似值。基于公开的数字,每一个数字的数值有可能会出现
±
10%以下的差异或者本领域人员认为的合理的差异,如
±
1%、
±
2%、
±
3%、
±
4%或
±
5%的差异。
[0109]
术语“和/或”应理解为意指可选项中的任一项或可选项中的任意两项或多项的组合。
[0110]
术语“hplc”表示高效液相色谱法。
具体实施例
[0111]
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
[0112]
为描述本发明,以下列出了实施例。但需要理解,本发明不限于这些实施例,只是提供实践本发明的方法。
[0113]
lps表示脂多糖;no表示一氧化氮;mol表示摩尔;μmol/l表示微摩尔每升;m表示摩尔每升;μm表示微摩尔每升;l表示升;mg/ml表示毫克每毫升。od
548
表示548nm处的吸光度值。
[0114]
实施例1:11种化合物的制备
[0115]
(1)将榴红曲霉a2(aspergillus puniceus a2)种子液培养基3.2-3.5ml加入到装有培养基的1l三角瓶中(其中,1l三角瓶中培养基组成为:大米130g,海盐5.6g和水170ml),于25℃条件下发酵培养50天,共发酵培养230瓶。发酵完成后,用乙酸乙酯进行萃取,减压浓缩发酵粗提物;
[0116]
(2)将步骤(1)中乙酸乙酯提取液合并之后减压浓缩得到粗提物(305.3g),使用正相硅胶柱层析(100-200目,石油醚-乙酸乙酯体积比1:0-3:1)进行梯度洗脱,并且使用薄层色谱检测(tlc);合并相似组分,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1和所述组分fr.2。
[0117]
(3)将步骤(2)中组分fr.1经反相硅胶柱(甲醇-水,体积比9:11-1:0)梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1和组分fr.1.2。所述组分fr.1.1使用正相硅胶柱层析(200-300目,石油醚-乙酸乙酯体积比3:1)等度洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1、组分fr.1.1.2和组分fr.1.1.3。所述组分fr.1.1.1使用正相硅胶柱层析(200-300目,二氯甲烷-丙酮50:1)等度洗脱,得到4种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.1.1、组分
fr.1.1.1.2、组分fr.1.1.1.3和组分fr.1.1.1.4。所述组分fr.1.1.1.3经半制备hplc[5c18-ms-ii色谱柱(250mm
×
10mm,5μm)](乙腈-水体积比11:9,2ml/min)分离纯化得到化合物9(84.8mg),保留时间为30min。
[0118]
所述组分fr.1.1.1.4经半制备hplc[5c18-ms-ii色谱柱(250mm
×
10mm,5μm)](乙腈-水体积比13:7,2ml/min)分离纯化得到化合物8(29.1mg),保留时间为35min。
[0119]
所述组分fr.1.1.2使用正相硅胶柱层析(200-300目,二氯甲烷)等度洗脱,得到1种组分,命名为组分fr.1.1.2.1。所述组分fr.1.1.2.1经半制备hplc[5c18-ms-ii色谱柱(250mm
×
10mm,5μm)](乙腈-水体积比7:3,2ml/min)分离纯化得到化合物5(9.7mg)和化合物6(23.1mg),保留时间分别为30min和45min。
[0120]
所述组分fr.1.1.3使用正相硅胶柱层析(200-300目,二氯甲烷)等度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.1.3.1和组分fr.1.1.3.2。所述组分fr.1.1.3.1经半制备hplc[5c18-ms-ii色谱柱(250mm
×
10mm,5μm)](乙腈-水体积比11:9,2ml/min)分离纯化得到化合物3(16mg)和化合物4(24.2mg),保留时间分别为25min和40min。
[0121]
所述组分fr.1.2使用正相硅胶柱层析(200-300目,二氯甲烷-甲醇400:1-1:1)梯度洗脱,得到2种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.1.2.1和组分fr.1.2.2。
[0122]
所述组分fr.1.2.2经半制备hplc[5c18-ms-ii色谱柱(250mm
×
10mm,5μm)](乙腈-水体积比39:11,2ml/min)分离纯化得到化合物7(19.5mg)保留时间为38min。
[0123]
(4)将步骤(2)中所得组分fr.2经反相硅胶柱(甲醇-水,体积比3:7-1:0)梯度洗脱,得到3种组分,按照洗脱液出峰先后顺序,分别命名为组分fr.2.1组分fr.2.2和组分fr.2.3。
[0124]
所述组分fr.2.1使用葡聚糖凝胶柱(甲醇)等度洗脱,得到1种组分,命名为组分fr.2.1.1。
[0125]
所述组分fr.2.1.1经半制备hplc[5c18-ms-ii色谱柱(250mm
×
10mm,5μm)](乙腈-水体积比1:9,2ml/min)分离纯化得到化合物10(5.9mg)和化合物11(23.7mg),保留时间分别为15min和25min。
[0126]
所述组分fr.2.2经半制备hplc[5c18-ms-ii色谱柱(250mm
×
10mm,5μm)](甲醇-水体积比1:4,2ml/min)分离纯化得到化合物2(65mg,保留时间为25min)。
[0127]
所述组分fr.2.3使用葡聚糖凝胶柱(甲醇)等度洗脱,得到1种组分,命名为组分fr.2.3.1,所述组分fr.2.3.1经半制备hplc[5c18-ms-ii色谱柱(250mm
×
10mm,5μm)](甲醇-水体积比4:21,2ml/min)分离纯化得到化合物1(186mg,保留时间为22min)。
[0128]
(5)将步骤(3)和(4)得到的各化合物进行nmr及hresims分析。
[0129]
化合物1:深红色固体,根据高分辨质谱hresims(m/z 237.0727,[m na]
)结合nmr数据推测该化合物分子式为c
10h14
o5,不饱和度为4。在1h nmr谱(600mhz,dmso-d6)中,提示两个甲基[δ
h 0.87(3h,d,j=6.4hz),3.62(3h,s)],两个烯烃氢[δ
h 6.20(1h,s)]以及两个ar-oh[δ
h 8.86(1h,s)和δh9.07(1h,s)]的存在。其
13
c nmr(600mhz,dmso-d6)给出10个碳信号,包括2个甲基(δ
c 19.8,60.4),4个次甲基(δ
c 71.2,72.3,103.0,104.7)及4个季碳(δ
c 137.1,138.3,150.3,153.5)。结合1dnmr和hsqc谱数据可以推断化合物中存在不对称的四
26.0以及1个甲氧基碳信号δ
c 60.6。从hmbc谱可知,c-7(δ
c 74.7)与芳香质子h-6、c-7-oh、h
3-9远程相关,h-7(δ
h 5.10)与δc134.2,δc138.5,δc105.2,c-8(δc208.3)远程相关,而甲氧基质子δ
h
3.63仅与δc138.5远程相关,因此可以确定苯环1位的邻位分别有1个甲氧基取代和1个未被取代的芳香质子,同时存在间位取代的芳香质子。综上,鉴定化合物2为结构新颖的1-(2-甲氧基-3,5-二羟基)苯基-1-羟基-丙酮。化合物2结构及主要1h-1
h cosy和hmbc相关信号如下:
[0135][0136]
表2:化合物2的1h(600mhz)和
13
c(600mhz)核磁数据(dmso-d6)
[0137][0138]
化合物3:
[0139][0140]
淡黄色粉末;分子式c
18h11
clo7。1h nmr(600mhz,dmso-d6):δ
h 13.38(s,1-oh),7.94(dd,j=9.1,3.7hz,h-6),7.41(dd,j=9.1,4.0hz,h-5),6.77(d,j=2.8hz,h-4'),6.64(d,j=3.6hz,,h-4),6.40(d,j=10.4hz,h-1'),5.62(d,j=2.8hz,h-3'),3.88(s,8-och3).
13
c nmr(150mhz,dmso-d6):δ
c 61.5(8-och3,ch3),88.4(c-4,ch),89.6(c-2',c),104.5(c-9a,c),106.7(c-3',ch),111.7(c-2,c),115.0(c-5,ch),115.6(c-8a,c),117.3(c-1',ch),123.3(c-7,c),136.0(c-6,ch),148.2(c-4',ch),154.9(c-8,c),155.5(c-10a,c),157.0(c-4a,c),158.1(c-1,c),165.7(c-3,c),180.1(c-9,c)。
[0141]
化合物4:
7),2.25(q,j=7.8hz,h-8),1.98(m,h-13),1.34(m,h-14),0.84(t,j=7.4hz,h-15).
13
c nmr(150mhz,dmso-d6):δ
c 13.6(c-16,c),22.2(c-15,ch3),34.2(c-14,ch2),34.4(c-8,ch2),35.6(c-9,ch),100.9(c-3,c),104.9(c-1,c),110.3(c-5,c),130.5(c-12,ch),130.6(c-11,ch),131.5(c-13,ch2),132.2(c-10,ch),146.6(c-6,c),161.9(c-2,ch),164.2(c-4,ch),172.9(c-7,ch2)。
[0159]
化合物10:
[0160][0161]
无色油状;分子式c9h
14
o3。1h nmr(600mhz,dmso-d6):δ
h 4.99(d,j=4.2hz,h-5),3.66(m,h-4a),3.34(d,j=1.6hz,h-4b),1.88(s,h-9),1.66(s,h-8),1.05(s,h-7).
13
c nmr(150mhz,dmso-d6):δ
c 11.2(c-8,ch3),18.3(c-7,ch3),21.1(c-9,ch3),38.8(c-4,ch2),71.2(c-5,ch),75.9(c-6,c),127.2(c-2,c),152.0(c-3,c),201.1(c-1,c)。
[0162]
化合物11:
[0163][0164]
白色粉末;分子式c6h
10
o3。1h nmr(600mhz,dmso-d6):δ
h 4.37(td,j=10.7,4.2hz,h-6a),4.24(ddd,j=10.9,5.4,4.0hz,h-6b),2.49(m,h-5)1.84(m,h-3a),1.69(m,h-3b),1.20(s,h-7).
13
c nmr(150mhz,dmso-d6):δ
c 29.3(c-7,ch3),35.3(c-5,ch2),44.5(c-3,ch2),65.7(c-6,ch2),66.8(c-4,c),170.6(c-2,c)。
[0165]
实施例2:实施例1制备得到11个化合物的体外抗炎活性评价
[0166]
(1)raw264.7细胞培养与给药
[0167]
取对数生长期的对raw264.7细胞,以2
×
104个/孔的密度接种于96孔板中(每组设6个复孔),细胞培养24h后给药。实验设对照组(control)、模型组(1μg/ml lps刺激)、和化合物1至化合物11的给药组(1μg/ml lps刺激 浓度为20μm的化合物(分别为化合物1、化合物2、化合物3、化合物4、化合物5、化合物6、化合物7、化合物8、化合物9、化合物10、化合物11)),于37℃二氧化碳培养箱中培养24h,收集各孔内上清液,按以下步骤(2)测定no含量。
[0168]
(2)no含量的测定
[0169]
取试剂盒中1mmol/l的亚硝酸盐(nano2)标准溶液,稀释成no
2-浓度分别为3.125μmol/l、6.25μmol/l、12.5μmol/l、25μmol/l、50μmol/l的溶液。
[0170]
根据实验用量,以等体积的试剂a和试剂b混合配制griess试剂。试剂a:1mg/ml n-1-萘乙二胺盐酸盐溶液。试剂b:10mg/ml的磺胺酸溶液。
[0171]
取75μl亚硝酸盐标准溶液或待测样品加入96孔板中,向各孔加入10μl的griess试剂以及65μl的去离子水,振荡96孔板令孔内溶液充分混匀,在室温的条件下反应30min后,测试反应液于548nm处的吸光度。以od
548
值对标准样品的系列浓度进行回归,得到标准曲
线。待测样品的浓度通过标准曲线法计算。
[0172]
(3)检测样品对raw264.7细胞的细胞活力作用
[0173]
给药之后在37℃、5%co2条件下的培养箱中培养1d,去除上清液,加入比例为1:9的cck8:dmem培养基100μl继续培养2h,之后使用酶标仪在450nm波长处测定其吸光度值,计算细胞活力。
[0174]
(4)结果处理
[0175]
按以下公式计算样品对raw264.7细胞的细胞活力影响。
[0176]
细胞活力(%)=(模型组/实验组-空白组)/(对照组-空白组)
×
100%。
[0177]
空白组——具有培养基和cck8溶液,没有细胞的孔的吸光度
[0178]
模型组——具有细胞,cck8溶液和lps的孔的吸光度
[0179]
实验组——具有细胞,cck8溶液,lps和药物的孔的吸光度
[0180]
对照组——具有细胞,cck8溶液的孔的吸光度
[0181]
(5)实验结果
[0182]
如图1所示,实验结果显示11个化合物对raw264.7细胞增殖没有抑制作用,表明化合物没有毒性作用,可以保证抗炎实验在样品对细胞的生长无明显影响的情况下进行。
[0183]
如图2所示,no含量的测定结果显示11个化合物具有显著抗炎活性。
[0184]
本发明的方法已经通过较佳实施例进行了描述,相关人员明显能在本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。