l-天冬氨酸-α-脱羧酶突变体及其应用
技术领域
1.本发明属于基因工程技术领域,具体涉及l-天冬氨酸-α-脱羧酶突变体及其应用。
背景技术:
2.β-丙氨酸,又称3-氨基丙酸,在制药工业中是一种重要的前体,例如用于骨质疏松症抑制剂帕米膦酸钠和消炎药巴沙拉嗪;也是运动员改善身体机能的重要营养补充。β-丙氨酸还是生产聚β-丙氨酸(尼龙-3)的基本单位,可用于化妆品生产、水净化和建筑材料。
3.l-天冬氨酸-α-脱羧酶(l-aspartate-α-decarboxylase,ec4.1.1.11,adc)能够催化l-天冬氨酸cα位的羧基进行脱羧生成β-丙氨酸和co2,是一种非常有竞争力的β-丙氨酸生产方法。
4.l-天冬氨酸-α-脱羧酶根据其来源主要分为两类:一类来源于原核生物,另一类来源于真核生物。原核生物来源的adc需要进行自剪切修饰,才能获得催化功能,存在基于机理的不可逆失活,且催化活性较真核生物来源adc的弱,真核生物来源的adc不存在机理失活,工业应用潜力大。目前已报道的真核生物来源的adc有来源于昆虫赤拟谷盗、埃及伊蚊和桃蚜(专利申请号cn201911088195.9),其中桃蚜来源的adc(mpadc)表现出较强的底物亲和性及酶活性,具有较大的工业化应用潜力,但其在异源表达过程中不易正确折叠而形成包涵体,放大发酵培养时,存在培养条件苛刻,可溶表达少等困难,限制了mpadc的应用。进一步提高mpadc的催化活性及增加可溶性表达,对扩大其应用价值具有重要意义。
技术实现要素:
5.为了改良mpadc的性能,提高其工业应用潜力,本发明的目的在于提供l-天冬氨酸-α-脱羧酶突变体及其应用,通过对桃蚜来源的l-天冬氨酸-α-脱羧酶基因进行突变,去除蛋白n末端部分无规卷曲肽段,得到了两种催化活性和可溶表达均显著提高的突变体。
6.本发明通过以下技术方案实现上述目的:将野生型l-天冬氨酸-α-脱羧酶基因(seq id no.1,来源于申请号为cn201911088195.9的专利)采用常规方式克隆到表达载体pet28a上,获得能够表达野生型mpadc(氨基酸序列为seq id no.2)的表达载体;通过基因工程技术分别去掉野生型mpadc氨基端前4位或前39位氨基酸残基,得到两种截短的mpadc突变体,分别命名为mpadc
‑△
4(氨基酸序列为seq id no.4)和mpadc
‑△
39(氨基酸序列为seq id no.6)。
7.编码上述两种l-天冬氨酸-α-脱羧酶及突变体的基因,其核苷酸序列如seq id no.3或seq id no.5所示。
8.本发明提供了含上述基因的载体。
9.本发明还提供了含上述基因或上述载体的宿主细胞。
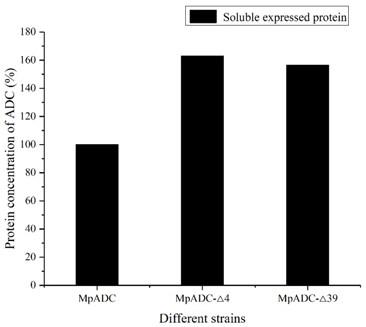
10.将上述含野生型和两种截断型突变体基因的表达载体转入大肠杆菌bl21(de3)中,得到三株基因工程菌。
11.将三株基因工程菌分别进行发酵培养,于发酵罐37℃培养至od
600
为15,并用iptg于20℃诱导20-22h,诱导蛋白表达,sds-page检测蛋白的表达情况,用image-j软件评估三种蛋白可溶性表达量,表明mpadc
‑△
4和mpadc
‑△
39两种突变体的蛋白可溶性表达分别是野生型蛋白表达的162%和156%。
12.纯化蛋白,得纯的l-天冬氨酸-α-脱羧酶突变体,活性检测表明,mpadc
‑△
4和mpadc
‑△
39两种突变体的催化活性分别是野生型活性的164%和262%。
13.本发明还提供了所述l-天冬氨酸-α-脱羧酶突变体及所述基因工程菌在制备含有β-丙氨酸的产品中的应用,所述方法以上述工程菌株进行全细胞催化,反应体系包含湿菌体50g/l,0.5 mm磷酸吡哆醛(plp),通过补加底物l-天冬氨酸的方式控制反应ph在6.0-6.5范围内,反应温度37 ℃,以l-天冬氨酸为底物催化产生β-丙氨酸。
14.本发明的有益效果在于:1)相比野生型的l-天冬氨酸-α-脱羧酶,突变体的可溶性蛋白表达分别增加了62%和56%,催化活性分别提高了64%和162%。
15.2)构建表达l-天冬氨酸-α-脱羧酶突变体的基因工程菌,用于制备β-丙氨酸,反应13.5小时后,β-丙氨酸的产物浓度为 232.36g/l,底物残余浓度为 23.83g/l,底物转化率 94.68%,时空产率为 17.21 g
·
l ‑1·hꢀ‑1。
附图说明
16.图1:mpadc、mpadc
‑△
4和mpadc
‑△
39三种工程菌表达的蛋白质sds-page图。
17.图2:用image-j评估mpadc、mpadc
‑△
4和mpadc
‑△
39可溶性表达量结果。
18.图3:mpadc、mpadc
‑△
4和mpadc
‑△
39三种酶的纯化结果。
19.图4:mpadc全细胞催化反应液的hplc出峰图谱。
20.图5:mpadc、mpadc
‑△
4和mpadc
‑△
39的三种酶的相对酶活。
21.图6:mpadc
‑△
39工程菌全细胞催化合成β-丙氨酸的结果。
具体实施方式
22.下面结合说明书附图和具体实施例对本发明进一步说明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明所用试剂、方法和设备为本技术领域常规试剂、方法和设备。
23.材料和方法实施例中所用lb 液体培养基、tb液体培养基(g/l)皆为常规方法配制。
24.实施例中引物合成及测序皆委托杭州擎科生物技术有限公司完成。
25.实施例中的分子生物学实验包括质粒构建,感受态细胞制备、转化等,主要参照《基因工程原理》(第二版)吴乃虎编著、《分子克隆实验指南》(第三版)j.萨姆布鲁克,d.w.拉塞尔(美)编著进行。质粒提取、pcr扩增实验、胶回收及重组实验根据所用试剂盒供应商提供的说明书进行。
26.实施例1:mpadc、mpadc
‑△
4和mpadc
‑△
39表达载体的构建将野生型l-天冬氨酸-α-脱羧酶基因(seq id no.1,来源于申请号为cn201911088195.9的专利)采用常规方式克隆到载体质粒pet28a上,获得能够表达野生型
mpadc(氨基酸序列为seq id no.2)的重组基因载体,命名为pet-28a-mpadc。
27.以pet-28a-mpadc序列为模板,通过snapgene4.3.6 设计引物,扩增引物如表1。以f-cut4和r-cut引物对扩增pet-28a-mpadc
‑△
4重组质粒,以f-cut39和r-cut引物对扩增获得pet-28a-mpadc
‑△‑
39重组质粒。
28.表1构建突变体所用引物pcr产物用琼脂糖凝胶核酸电泳鉴定,随后用dpni消化模板,根据纯化试剂盒说明书纯化后,两种pcr纯化产物使用擎科公司的trelief
™ꢀ
sosoo cloning kit ver.1试剂盒进行重组反应,再将重组反应产物全部化转到e. coli dh5α感受态细胞内,挑取单菌落测序验证,最终获得引入含有pet-28a-mpadc
‑△
4和pet-28a-mpadc
‑△
39重组质粒的克隆菌株。
29.实施例2:mpadc、mpadc
‑△
4和mpadc
‑△
39表达菌株的构建。
30.提取实施例1中获得的克隆菌株中的三种质粒,转化至含有pgro7(分子伴侣质粒)的e. coli bl21(de3)表达载体中,挑取单菌落接种于含有卡那霉素50 μg/ml、氯霉素25 μg/ml的5ml lb培养基试管中,37℃、220rpm震荡培养10 h,获得表达基因工程菌。
31.实施例3:mpadc、mpadc
‑△
4和mpadc
‑△
39的外源诱导表达。
32.取500μl实施例2所述三个菌株,转接至含有卡那霉素50 μg/ml、氯霉素25μg/ml的50ml tb 摇瓶中,培养约2 h(od
600
为2.5左右),加入终浓度为 0.2 mmol/liptg,20℃、180rpm诱导培养20 h 左右,6000 rpm,5min,离心收集菌体,超声破碎,sds-page检测蛋白表达,结果如图1所示,图中1:mpadc上清;2:mpadc沉淀;3:mpadc
‑△
4上清;4:mpadc
‑△
4沉淀;5:mpadc
‑△
39上清;6:mpadc
‑△
39沉淀;m:蛋白marker ,可见相比野生型的mpadc,两种突变体在上清中的可溶表达都得到了增加。
33.进一步用image-j软件评估原始菌株和突变菌株的蛋白可溶性表达量,如说明书附图2所示,突变菌株mpadc
‑△
4、mpadc
‑△
39的目的蛋白可溶性表达量分别是原始菌株表达量的162%和156%。
34.实施例4:mpadc、mpadc
‑△
4和mpadc
‑△
39的纯化(1)破碎细胞:将收集的三种菌体,先用破胞液重悬清洗一次,再按照1 g菌体加5 ml破胞液的比例重悬,在涡旋仪上混悬至无块状后,调节超高压低温细胞破碎仪压力为1500 mpa,破碎6-8次至菌体完全破碎、液体呈半透明状,4 ℃、10000 rpm离心20 min,取上清液,过0.45 μm滤膜,置于冰上备用。
35.(2)上样及洗脱:利用蠕动泵将样品泵入预先用破胞液平衡好的镍柱上(histrap
tm
ff 1 ml),缓慢上样5倍柱体积,然后先用5倍柱体积的破胞液洗脱除去没有和镍柱结合的蛋白,随后依次用25mm的咪唑缓冲液除杂蛋白,200 mm的咪唑缓冲液洗脱目的蛋白,将含有目的蛋白的洗脱收集液用10 kda孔径的超滤离心管浓缩目的蛋白(4000g、4 ℃),直至洗脱液体积浓缩至2.5 ml为止。
36.(3)浓缩液的脱盐:用脱盐凝胶柱除去蛋白浓缩液中含有的咪唑等盐离子,将得到的脱盐蛋白,每100 μl分装成一管,置于-80 ℃保存备用。
37.(4)sds-page检测目的蛋白的纯度,结果如图3所示,图中m:蛋白marker ; 1:mpadc纯酶;2:mpadc
‑△
4纯酶;3:mpadc
‑△
39纯酶。结果表明,三种蛋白都达到了较高的纯度。
38.实施例5:mpadc、mpadc
‑△
4和mpadc
‑△
39三种酶的催化活性测定本发明通过测试单位时间内、等量酶产生的β-丙氨酸量来评估l-天冬氨酸-α-脱羧酶的活性,定义野生型酶的活性为100%。反应体系1ml:底物2mm,plp 0.5mm,酶10.7μg/ml, pbs维持反应体系 ph6.5,在37℃的条件下,反应5 min,100℃灭活。12000g离心2min,取上清。
39.用hplc法测l-天冬氨酸和β-丙氨酸浓度,具体检测方法为opa柱前衍生反向hplc测氨基酸的方法:(1)样品预处理:反应液100 ℃灭活5min,12000 rpm离心2 min,取上清检测。
40.(2)衍生操作:吸取0.1 m ph=9.5硼酸溶液300 μl,加入200 μl样品和200 μl衍生剂震荡混合,避光衍生2 min,经0.45 μm的滤膜过滤,进样10 μl。
41.(3)色谱方法:采用色谱柱为月旭lp-c18(250 mm
×
4.6 mm, 5 μm),柱温35 ℃,流动相为甲醇:50 mm醋酸钠 (ph 3.5)=55:45洗脱,检测波长为334 nm,流速为0.8 ml/min,进样 10 μl,保留时间约为8 min,柱压约13 mpa,l-天冬氨酸和β-丙氨酸的保留时间如附图4所示。
42.纯酶的相对活性测试结果如附图5所示:定义野生型mpadc的相对活性为100%,则mpadc
‑△
4的相对活性约164%,mpadc
‑△
39的相对活性约262%,均得到了大幅提升。
43.实施例6:mpadc
‑△
39工程菌全细胞催化产生β-丙氨酸为了评估最优选突变体mpadc
‑△
39在β-丙氨酸生产中的应用潜力,本发明做1l体系的催化反应,体系中初始底物l-天冬氨酸为55 g/l,重组大肠杆菌湿菌体50g/l(od约30),plp 0.5 mm,用氢氧化钠调ph至6.5,反应过程中ph上升,可通过补加底物l-天冬氨酸的方式控制反应ph在6.0-6.5之间;在磁力搅拌器(ika
®
c-mag hs 7)控制温度37 ℃、转速800 rpm,反应ph上升速度变慢后加20% h2so4控制ph至不再上升,停止反应。
44.反应过程中,每间隔1 h取样用hplc测β-丙氨酸的产量。结果如图6所示:经13.5小时反应后,ph基本不再变化,意味着反应终止,此时最终产物β-丙氨酸浓度为 232.36g/l,底物残余浓度为 23.83g/l,底物转化率 94.68%,时空产率为 17.21 g
·
l ‑1·hꢀ‑1。
45.本发明的l-天冬氨酸-α-脱羧酶突变体,蛋白可溶性表达提高,催化活性增加,工业应用潜力大。
46.以上实施例的说明只是用于帮助理解本发明方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。