circstx6在制备鼻咽癌诊断和/或预后、治疗制剂中的应用和诊断、治疗制剂
技术领域
1.本发明属于肿瘤分子生物学技术领域,具体涉及一种circstx6在制备鼻咽癌诊断和/或预后、治疗制剂中的应用和诊断、治疗制剂。
背景技术:
2.鼻咽癌(nasopharyngeal carcinoma,npc)是我国南方常见的头颈部恶性肿瘤,有明显的区域聚集性和人种好发性。鼻咽癌的发病因素主要包括遗传因素、eb病毒感染和环境因素等。鼻咽癌多为非角化型鳞癌,恶性程度较高,早期即可出现颈部淋巴结转移。目前,鼻咽癌的治疗方法主要是放疗、联合化疗和手术治疗等,虽然早期npc患者的5年总生存率高达95%,但鼻咽和颈淋巴结复发率为8.6%~23.7%。这是由于npc的发生和发展涉及复杂的基因调控和多阶段过程,其分子机制尚不清楚,加之肿瘤异质性和放疗抵抗引起的个体差异,传统放疗的治疗效果不是非常的理想。因此,研究治疗鼻咽癌的治疗靶标和诊断分子标记物至关重要。
3.环状rna(circular rna,circrna)主要来源于蛋白质编码基因的外显子区,也可以由内含子区、utr区、基因间区、非编码rna位点及已知转录物的反义位点形成。circrna是由前体(mrna precursor messenger rna,pre-mrna)反向拼接而形成的一类不具有5'末端帽子和3'末端poly(a)尾巴并以共价键形成环状套索结构的非编码rna分子。
4.circrna形成过程可以分为两大类,即外显子环化(exon circularization)和内含子环化(intron circularization)两大机制。jeck等提出外显子来源的circrna(exonic circrna,ecircrna)可以分为套索驱动环化(lariat-driven circularization)和内含子配对驱动环化(intron-pairing-driven circularization)两种形成方式,套索驱动环化是外显子3'端作为剪接供体(splice donor)攻击5'端剪接受体(splice receptor),alu区共价结合而形成套索结构,套索结构进行内部拼接后切除内含子形成circrna;内含子配对驱动环化是两个内含子碱基互补配对形成环状结构后,剪除内含子形成circrna。其实内含子本身也可以环化,可以形成内含子来源circrna(circular intronic rna,cirna)。circrna是由前体mrna反向拼接而形成的一类不具有5'末端帽子和3'末端poly(a)尾巴并以共价键形式形成的封闭环形结构的非编码rna分子。有着高度的稳定性、保守性、特异性,并且含量高的特点。
5.circrna最早在1976年于rna病毒中首次发现,随后hsu mt等人使用电子显微镜技术在猴的肾细胞质中发现了circrna的存在。近年来越来越多的circrna被发现,目前为止已知的circrna数目已经达到三万多个。circrna也不再被认为是错误的rna转录本,而是作为非编码rna研究中的耀眼之星冉冉升起。发现更多的新型circrna作为肿瘤诊断和预后的生物标志物及其应用,并能尽早在专利领域得到好的保护,能显著提升我国在该技术领域的国际竞争力。
6.本发明检测到一个长度为391bp的环状rna circstx6。通过实验发现该环状rna在
鼻咽癌中高表达且能促进鼻咽癌的侵袭转移,有可能作为鼻咽癌诊断或预后标记物及治疗靶点。
技术实现要素:
7.本发明发现了一个大小391bp的环状rnacircstx6,并发现了它与鼻咽癌之间存在的关系,有可能作为鼻咽癌诊断或预后标记物和治疗靶点。
8.本发明的第一个目的是提供circstx6在制备鼻咽癌诊断和/或预后制剂中的应用,所述的circstx6序列如seq id no.1所示。
9.进一步地,所述的鼻咽癌诊断和/或预后制剂包括pcr或者原位杂交检测circstx6表达量的试剂。
10.更进一步地,所述的pcr或原位杂交检测circstx6表达量的试剂中包含:
11.环状rna circstx6实时定量pcr引物
12.上游引物:5'-ggctggacaatgtgatgaag-3',如seq id no.2所示;
13.下游引物:5'-agttctggctgccactgtct-3',如seq id no.3所示;
14.或者扩增circstx6全长引物
15.上游引物:5'-ccatcgatgacatgaaagatcagatgtcaacttcat-3',如seq id no.4所示;
16.下游引物:5'-tccccgcggcactggtcatatgagatacttttgcaag-3',如seq id no.5所示。
17.circstx6原位杂交探针序列:5'-tgatctttcatgtccactggtcatatgag-3',如seq id no.6所示。
18.本发明诊断和/或预后试剂包括但不限于上述引物和探针序列。
19.本发明第二个目的是提供一种鼻咽癌诊断和/或预后制剂,包含pcr或者原位杂交检测circstx6表达量的试剂,所述的circstx6序列如seq id no.1所示。
20.进一步地,所述的鼻咽癌诊断制剂,包含上述的引物或者原位杂交探针。
21.本发明通过qrt-rcr检测鼻咽癌临床组织中circstx6的表达水平,发现其在鼻咽癌组织中相较于非肿瘤鼻咽上皮组织显著上调,且与患者预后生存期相关,结果具有统计学意义,可见circstx6可以作为鼻咽癌辅助诊断或者预后的标记物,为鼻咽癌诊断、预后提供了新的检测途径。
22.本发明的第三个目的是提供抑制circstx6表达的试剂在制备治疗鼻咽癌制剂中的应用,所述的circstx6序列如seq id no.1所示。
23.进一步地,所述的抑制circstx6表达的试剂包括反义寡核苷酸。
24.更进一步地,所述的反义寡核苷酸aso(antisense oligonucleotide):
25.正义链(5'-3')cauaugaccaguggacaugatt,如seq id no.7所示;
26.反义链(5'-3')ucauguccacuggucauaugtt,如seq id no.8所示。
27.本发明的第四个目的是提供一种治疗鼻咽癌的制剂,包括抑制circstx6表达的试剂,所述的circstx6序列如seq id no.1所示。
28.进一步地,所述的抑制circstx6表达的试剂包括反义寡核苷酸,优选所述的反义寡核苷酸:
29.正义链(5'-3')cauaugaccaguggacaugatt
30.反义链(5'-3')ucauguccacuggucauaugtt。
31.本发明不限于上述具体的aso。
32.进一步的,所述的抑制circstx6表达的试剂还包括阴性对照:
33.正义链(5'-3')gagaacgggauagcaucgactt,如seq id no.9所示;
34.反义链(5'-3')gucgaugcuaucccguucuctt,如seq id no.10所示;
35.但不限于上述具体的阴性对照。
36.目前,aso已发展成为基因功能研究的重要工具。为了探究circstx6在肿瘤发生发展中的作用,本发明根据circstx6的拼接位点设计了一对aso,利用hiperfect试剂将aso和sinc(对照)瞬时转染到hne2、cne2和hone1细胞系中沉默circstx6的表达。转染后继续培养36小时收集细胞,利用实时荧光定量pcr技术检测circstx6的表达水平以检测aso的转染效率,发现设计的aso能显著抑制circstx6的表达水平。
37.本发明通过大量的试验证实上述结论:即抑制circstx6表达的试剂能够用于制备鼻咽癌治疗制剂。这些试验包括:体外过表达circstx6试验发现能促进鼻咽癌细胞侵袭和迁移,体外沉默circstx6则抑制鼻咽癌细胞的侵袭和迁移。
38.由于aso具有良好的沉默效果,本发明采用针对环状rna头尾相接处的拼接位点设计aso对circstx6进行干扰(只沉默circrna,对线性的rna无影响),在鼻咽癌细胞系hne2、cne2和hone1中进行划痕愈合实验、基质胶侵袭实验,相对于nc(对照)组,aso组细胞的侵袭和迁移能力明显减弱,即沉默circstx6抑制了鼻咽癌细胞的侵袭转移。即抑制circstx6能治疗鼻咽癌,具有深远的临床意义和重要的推广应用前景。
附图说明
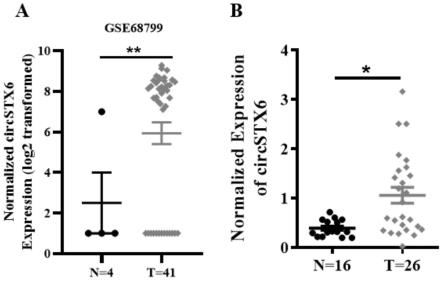
39.图1.circstx6的筛选鉴定及qrt-rcr检测鼻咽癌临床组织中circstx6的表达水平;a.生信分析geo数据库中gse68799的鼻咽癌组织测序数据发现circstx6在鼻咽癌组织中的表达显著上调;b.n为非肿瘤鼻咽上皮组织,样本数为16例;t为鼻咽癌组织,样本数为26例,n为样本数量,均采用t检验,p《0.05具有统计学意义。
40.图2.通过数据库比对和sanger测序法验证circstx6是由stx6基因第4-7号外显子反向拼接形成,大小391nt;a.circstx6由stx6的4-7号外显子首尾拼接形成,e表示exon(外显子),下划线序列表示首尾的接头序列;b.circstx6形成的示意图;c.测序结果的峰图,黑色箭头表示从此处头尾相接;
41.图3.检测circstx6在鼻咽癌细胞系中的表达。np69是永生化的正常鼻咽上皮细胞,作为参照,其余均为鼻咽癌细胞系。
42.图4.检测circstx6对rnase r的耐受性。rnase r处理后,利用qrt-pcr检测鼻咽癌细胞内circstx6和stx6的相对rna水平。
43.图5.检测circstx6的稳定性。放线菌素d处理后,利用qrt-pcr检测鼻咽癌细胞内circstx6和stx6在不同时间点的相对rna水平。
44.图6.rna-fish实验检测circstx6的亚细胞定位。circstx6大部分定位在细胞质中。
45.图7.circstx6过表达载体的重组质粒图谱。
46.图8.qrt-pcr技术检测鼻咽癌细胞系中circstx6过表达质粒的过表达效率和circstx6 aso的沉默效率。a.qrt-pcr检测在鼻咽癌细胞系hone1、hne2和cne2中circstx6质粒的过表达效率,circstx6表达水平分析以β-actin作为参照;b.qrt-pcr检测在鼻咽癌细胞系hone1、hne2和cne2中circstx6 aso的沉默效率,circstx6表达水平分析以β-actin作为参照。c.在鼻咽癌细胞系hone1、hne2和cne2中转染aso后,检测线性rna stx6的表达,ns代表无意义,*p《0.05,**p《0.01,***p《0.001。
47.图9.体外过表达/沉默circstx6对鼻咽癌细胞增殖的影响。a.在鼻咽癌细胞系hone1、hne2和cne2用neofect瞬时转染pcdna3.1( )circrna mini vector、circstx6过表达质粒,继续培养24小时后进行mtt实验检测细胞增殖能力,将pcdna3.1( )circrna mini vector组标准化为1,ns代表没有意义,*p《0.05,**p《0.01,***p《0.001。b.在鼻咽癌细胞系hone1、hne2和cne2用hiperfect瞬时转染sinc、circstx6 aso,继续培养24小时后进行mtt实验检测细胞增殖能力,将sinc组标准化为1,ns代表没有意义,*p《0.05,**p《0.01,***p《0.001。
48.图10.过表达/沉默circstx6对鼻咽癌细胞侵袭的影响。a.用基质胶侵袭实验模拟细胞穿过基质屏障,在hone1、hne2和cne2细胞中转染pcdna3.1( )circrna mini vector、circstx6过表达质粒24小时后,用基质胶侵袭实验检测过表达circstx6对鼻咽癌细胞侵袭的影响,其中下图为细胞个数的统计图(b),将pcdna3.1( )circrna mini vector标化为1,*p《0.05,**p《0.01,***p《0.001。c.用基质胶侵袭实验模拟细胞穿过基质屏障,在hone1、hne2和cne2细胞中转染sinc、circstx6 aso 24小时后,用基质胶侵袭实验检测沉默circstx6对鼻咽癌细胞侵袭的影响,其中右图为细胞个数的统计图(d),将sinc标化为1,*p《0.05,**p《0.01,***p《0.001。
49.图11.过表达/沉默circstx6对鼻咽癌细胞hone1、hne2和cne2划痕愈合能力的影响。a.在hone1、hne2和cne2细胞中转染pcdna3.1( )circrna mini vector、circstx6后,待细胞密度达到100%后划痕,根据细胞愈合速度在不同的时间点拍照,下方为划痕宽度的统计图(b),将pcdna3.1( )circrna mini vector标化为1,*p《0.05,**p《0.01,***p《0.001。a.在hone1、hne2和cne2细胞中转染sinc、circstx6 aso后,待细胞密度达到100%后划痕,根据细胞愈合速度在不同的时间点拍照,下方为划痕宽度的统计图(c),将sinc标化为1,*p《0.05,**p《0.01,***p《0.001。
50.图12.circstx6在鼻咽癌组织中高表达并与患者的不良预后相关。a-b.circstx6表达在来自95名npc患者和25例正常组织(鼻咽上皮,npe)的石蜡包埋组织切片中通过原位杂交实验得到验证。b.circstx6高表达与鼻咽癌患者的总体生存期缩短相关。
具体实施方式
51.以下结合具体实施方式旨在进一步说明本发明,而非限制本发明。
52.本发明所用hne2、cne2和hone1等鼻咽癌细胞系均为中南大学肿瘤研究所分子遗传实验室所保存。细胞培养条件为:10%胎牛血清(fbs)和1%双抗(青霉素、链霉素)的rpmi1640液体培养基,37℃、95%湿度、5%co2浓度的恒温培养箱内贴壁生长。
53.本发明环状rna的引物与线性rna引物的设计不同,其是根据拼接位点两侧设计,primer3.0网站上在线设计,最终的引物合成工作,委托擎科生物公司长沙合成部合成。
54.(1)β-actin
55.上游引物:5'-tcaccaactgggacgacatg-3';如seq id no.11所示;
56.下游引物:5'-gtcaccggagtccatcacgat-3';如seq id no.12所示;
57.(2)环状rna circstx6实时定量pcr引物
58.上游引物:5'-ggctggacaatgtgatgaag-3'
59.下游引物:5'-agttctggctgccactgtct-3'
60.(3)扩增circstx6全长引物
61.上游引物:5'-ccatcgatgacatgaaagatcagatgtcaacttcat-3'
62.下游引物:5'-tccccgcggcactggtcatatgagatacttttgcaag-3'
63.本发明为了特定的敲低环状rna而不影响它的线性基因表达,根据拼接位点设计aso,靶向沉默circstx6。
64.circstx6 aso序列:
65.正义链(5'-3')cauaugaccaguggacaugatt
66.反义链(5'-3')ucauguccacuggucauaugtt。
67.阴性对照:
68.正义链(5'-3')gagaacgggauagcaucgactt
69.反义链(5'-3')gucgaugcuaucccguucuctt。
70.本发明试验结果均采用统计学分析:t检验用来评价两组之间的差异。卡方检验用来评估基因表达或不表达在性别、年龄、肿瘤阶段、临床分期和转移情况等临床参数方面的差异。p《0.05用于表示统计学显著性,所有p值均使用双侧检验。统计分析采用spss 13.0和graphpad 7.0软件进行。
71.实施例1:circstx6的筛选鉴定
72.本发明从geo数据库中,下载了一套包含4个正常鼻咽组织样本和41个鼻咽癌组织样本,共计45个临床样本的rna-seq数据,编号为gse68799。通过对这套鼻咽癌组织rna-seq数据分析,鉴定出了8884个circrna,随后使用sam软件对数据进行差异分析,得到178个在正常鼻咽组织和鼻咽癌组织间存在显著差异的circrna分子,其中在鼻咽癌组织中上调的环状rna分子中发现了hsa_circ_23135(circstx6)(图1)。
73.实施例2:sanger测序证明形成的是环状rna
74.为了证明circstx6形成的是环状rna而非线性的,将图1b中的qrt-pcr产物回收,送公司进行sanger测序(擎科公司)。将公司返回的序列用dnastar软件进行比对,chromas软件看峰图,判断测序的质量。结果显示,circstx6确实是由母基因stx6的4-7号外显子头尾相接环化形成。a.circstx6由stx6的4-7号外显子首尾拼接形成,e表示exon(外显子),下划线序列表示首尾的接头序列;b.circrna形成的示意图;c.测序结果的峰图,黑色箭头表示从此处头尾相接(见图2)。
75.实施例3:circstx6在鼻咽癌细胞中的表达
76.1、细胞总rna提取
77.准备工作:灭菌后的无rnase水、75%乙醇(无rnase配制)、氯仿、异丙醇、1
×
pbs、无酶tip头和ep管,高速低温离心机预冷至4℃,实验开始前先将实验台面及移液枪用75%酒精擦拭。
78.1)取待提取rna的细胞,用1
×
pbs或d-hanks清洗两次;
79.2)12孔板中每孔加500μl trizol裂解液,室温裂解1-2分钟,用移液枪轻轻吹下细胞,上下轻柔颠倒10次,室温静置5分钟;
80.3)加入100μl的氯仿(按1mltrizol:0.2ml氯仿:0.5ml异丙醇),用力震荡15-30s,冰上放置5分钟;
81.4)4℃,12000rpm/20min;
82.5)取上层水相于预冷的tube管中,加入250μl异丙醇,用漩涡混合器或移液枪混匀(-20℃》1h);
83.6)4℃,12000rpm/30min,弃上清;
84.7)加入75%乙醇(预冷)1ml,混匀;
85.8)4℃,7600rpm/5min;弃上清,重复步骤8,9;
86.9)闪离10s,尽量吸尽上清,倒置干燥10分钟;
87.10)加入20-30μl depc,测rna浓度和od值。
88.2、circrna逆转录pcr反应
89.(依据abm公司5
×
all-in-onertmastermix(withaccurtgenomicdnaremovalkit)(#g492)的实验说明手册操作)
90.配置如下反应体系:
[0091][0092]
逆转录pcr上机反应程序如下:
[0093]
25℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10min,
[0094]
42℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
15min,
[0095]
85℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5min。
[0096]
待反应结束后,-20℃保存产物备用。
[0097]
3、实时荧光定量pcr
[0098]
先将逆转录反应产物稀释5倍,然后依据abm公司evagreen qpcr mastermix(mastermix-r)的实验说明手册操作,配置如下反应体系:
[0099][0100]
实时荧光定量pcr机上反应程序如下:(cycle
×
39)
[0101][0102]
bio-radiq5实时荧光定量pcr仪进行上述反应完成后,与内参基因β-actin标化,以2
‑△△
ct值显示目标基因的相对表达量,判定基因的表达差异。采用unpaired t-test检验计算p值。
[0103]
结果:鼻咽癌细胞中circstx6的表达明显高于正常鼻咽上皮细胞np69(图3)。因此,circstx6在鼻咽癌细胞系中高表达,circstx6对鼻咽癌的发生发展可能具有重要的生物学功能,可以据此使用反义寡核苷酸对进行鼻咽癌治疗。
[0104]
实施例4:rnase r消化实验
[0105]
1反应体系
[0106]
rnase r消化反应体系
[0107][0108]
2反应条件
[0109]
37℃,10-30min。
[0110]
注:1)可随rna增加适当延长消化时间,一般10-30min即可消化掉大部分的线性rna,pcr检测线性rna丰度有几百倍的降低。消化1h以上是非必要的,因为时间过长可能导致少数耐受力弱的circrna被消化。2)孵育后可先纯化回收,或者70℃10min使酶灭活后直接进行下游实验。
[0111]
3纯化回收
[0112]
消化后的rna可使用苯酚:氯仿:异戊醇(25:24:1,v:v)溶液抽提,再使用乙醇沉淀回收;或者使用rna纯化柱和磁珠进行纯化回收。qrt-pcr检测circstx6和线性mrna stx6(见图4)。
[0113]
注:苯酚:氯仿:异戊醇(25:24:1,v:v)溶液最好现配现用,没有试剂也可以trizol reagent代替。
[0114]
实施例5:放线菌素d处理实验
[0115]
为了检测circrna与线性rna的稳定性,将鼻咽癌细胞以50%左右密度接种至12孔板中,待细胞贴壁后加入终浓度为1μg/ml的放线菌素d,分别处理0,8,16,24小时,抽提细胞的rna,逆转录成cdna,并用qrt-pcr检测circstx6和stx6 mrna的表达,以18s为内参(图5)。
[0116]
实施例6:rna-fish实验检测circstx6在细胞内的定位
[0117]
由于aso发挥作用主要是在细胞质中,因此检测circstx6的定位可判断能否很好地干扰circstx6的表达。利用rna-fish检测circstx6在核、质中表达所占的比重,发现circstx6主要定位于细胞质。(见图6)。
[0118]
rna-fish步骤:
[0119]
1)爬片:按1000个细胞/孔将贴壁细胞接种于24孔板(孔内提前防置玻片),放置于培养箱中培养过夜;
[0120]
2)吸弃培养基,37℃预热pbs洗两次,每次5min;
[0121]
3)固定:每孔加入200μl 4%多聚甲醛,室温固定15min;
[0122]
4)破膜:吸弃固定液,每孔加入200μl 0.25%tritonx-100(现配现用,溶于pbs),室温处理15min;
[0123]
5)pbs洗两次,每次5min;
[0124]
6)预杂交:湿盒准备,杂交盒底部加20%甘油20ml以保持温度,按每张切片20μl加入预杂交液,恒温箱37℃孵育2-4h,吸取多余液体,不洗;
[0125]
7)用杂交液稀释地高辛标记的circstx6 rna探针,按每张切片20μl加入杂交液(浓度一般为4μm/8μm,体积15-20μl),恒温箱37℃孵育过夜(大于16h);
[0126]
8)杂交片洗涤:30-37℃左右水温的2xssc洗涤两次,每次5min;0.5xssc洗涤一次,5min;0.2xssc洗涤一次,5min,必要时可用0.2xssc复洗一次,5min;
[0127]
9)滴加封闭液:37℃30min,吸取多余液体,不洗;
[0128]
10)滴加生物素化鼠抗地高辛抗体,37℃60min或室温2h,0.5mx pbs洗四次,每次5min;
[0129]
11)滴加荧光二抗(1:200),37℃60min,0.5m x pbs洗三次,每次5min;
[0130]
12)加入dapi工作液,避光染色10min;
[0131]
13)0.5m x pbs洗三次,每次5min;
[0132]
14)封片,拍摄。
[0133]
实施例7:在鼻咽癌细胞系中circstx6过表达效果检测
[0134]
首先我们选择酶切位点,将circstx6全长序列放入neb cutter 2.0在线网站分析,显示clai和sacii酶切位点为circstx6全长序列中不存在的位点,同时在pcdna3.1( )circrna mini vector质粒载体(购于生工生物工程公司)中单一存在的dna限制性内切酶。将circstx6全长序列克隆进pcdna3.1( )circrna mini vector质粒空载,图7为绘制的过
表达载体图谱。
[0135]
为了检测circstx6的成环效率,首先我们将构建的pcdna3.1( )circrna mini vector/circstx6真核过表达载体在鼻咽癌细胞中进行过表达。把生长状况良好的第三、四代鼻咽癌细胞hone1、hne2和cne2种到12孔板中,待细胞融合度达到60%-80%时,用neofect把无内毒素质粒pcdna3.1( )circrna mini vector空载体和circstx6过表达载体瞬时转染鼻咽癌细胞hone1、hne2和cne2,继续培养至36h收集细胞,利用实时荧光定量pcr技术检测circstx6的表达水平及成环效率。qpcr结果显示,与pcdna3.1( )circrna mini vector空质粒组细胞相比,转染circstx6过表达质粒组的细胞中circstx6的表达水平显著升高,结果具有统计学意义(见图8a)。
[0136]
实施例8:在鼻咽癌细胞系中沉默circstx6表达的效果检测
[0137]
反义寡核苷酸(aso)是一类通过序列特异地与靶基因dna或mrna结合而抑制该基因表达的分子。aso是单链dna和rna的杂合体,通过rnase-h起作用,这个酶在核内也有,因此可以同时干扰核内和胞质中的基因。aso针对拼接位点设计和靶序列互补的序列,从而避免干扰线性rna的表达。目前,aso已发展成为基因功能研究的重要工具。为了探究circstx6在肿瘤发生发展中的作用,我们根据circstx6的拼接位点设计了aso,利用hiperfect试剂将aso和sinc(空白对照)瞬时转染到hone1、hne2和cne2细胞系中沉默circstx6的表达。转染后继续培养36小时收集细胞,利用实时荧光定量pcr技术检测circstx6的表达水平以检测aso的转染效率,确认circstx6敲低效果(见图8b)。然而以circstx6的序列设计线性引物时,实时荧光定量pcr检测发现aso并未敲低线性rna的表达,说明aso是特异性沉默circstx6的表达(见图8c)。
[0138]
本实施例中反义寡核苷酸:
[0139]
正义链(5'-3')cauaugaccaguggacaugatt
[0140]
反义链(5'-3')ucauguccacuggucauaugtt。
[0141]
空白对照:
[0142]
正义链(5'-3')gagaacgggauagcaucgactt
[0143]
反义链(5'-3')gucgaugcuaucccguucuctt。
[0144]
实施例9:mtt实验检测细胞增殖
[0145]
我们首先用hiperfect转染sinc、aso circstx6,或相应的用neofect把无内毒素质粒pcdna3.1( )circrna mini vector和circstx6过表达载体瞬时转染鼻咽癌细胞hone1、hne2和cne2,继续培养24h后,进行mtt实验,验证其对细胞增殖的影响。结果发现aso circstx6能显著抑制三株细胞系的增殖,而过表达circstx6显著促进三株细胞系的增殖(图9)
[0146]
1)准备:tip头、高温高压灭菌的d-hanks;移液枪、marker笔、15ml离心管等酒精消毒后再放置在生物安全柜内紫外照射30min,通风10min。
[0147]
2)种板和转染:前一天将25cm2细胞瓶中的状态良好的细胞消化下来种入6孔板,待细胞密度长至70%左右转染aso circstx6,或者待细胞长至80~90%左右转染过表达载体。
[0148]
3)转染12小时后,吸弃细胞上清,d-hanks洗3遍,6孔板每孔加入100μl胰酶,消化细胞呈圆形后,将细胞吹打下来转移至15ml离心管,1000rpm离心5min,弃上清,加入1~2ml
培基,混匀,取10μl加入细胞计数板进行细胞计数。根据细胞计数结果,将细胞稀释至5000个细胞/ml。
[0149]
4)将稀释好的细胞悬液加入96孔板,每孔加入细胞悬液200μl,96孔板最外一圈孔中加200μl dank’s缓冲液,放入培养箱继续培养。
[0150]
5)待6~8h左右细胞贴壁后,每孔加入20μl mtt,继续培养4小时,小心吸弃孔内的培养上清液,每孔加入200μl dmso,置于摇床上摇晃10min,在酶联免疫检测仪上选择490nm波长检测dmso加样孔的吸光值,记录结果。之后每天在相同的时间点加mtt和dmso进行吸光值检测,连续检测6天后进行统计学分析。
[0151]
实施例10:细胞transwell侵袭实验:
[0152]
1)基质胶准备:提前一天把冻存于-20℃的bd matrigel胶置于4℃冰箱融化成液态,把稀释胶用的tip头、ep管置于-20℃过夜,这样第二天操作时matrigel胶在铺胶时不会过快凝固;
[0153]
2)基质胶稀释:bd matrigel胶:无血清培基=1:8,即20μl基质胶加160μl 1640培基轻吹混匀;
[0154]
3)将稀释好的基质胶加入transwell小室100μl,再沿边吸出80μl,依次铺好放入37℃培养箱里孵育2-3小时,当看到铺胶层为白色时,表明液体matrigel胶已呈固态;
[0155]
4)消化转染24h后的细胞,用无血清培基洗2遍,然后使用无血清的培基重悬细胞,进行细胞计数,调整细胞浓度为每200μl中2万个细胞;
[0156]
5)向下层小室添加800μl含有20%fbs的1640培养基,放入小室时将24孔板倾斜45
°
角,以避免放入小室过程中在小室和液面之间产生气泡;
[0157]
6)每室加200μl计好数的细胞悬液到transwell上室内,将24孔板放回37℃培养箱中,根据细胞状态和细胞侵袭速度,孵育约24~48h。
[0158]
7)取出24孔板,用pbs或者d-hanks洗两遍,4%多聚甲醛浸洗10min,用清水洗3遍。
[0159]
8)染色:用0.1%的结晶紫滴加到transwell小室的底部,室温静置5-10min,用pbs清洗2-3遍,用棉签小心擦掉小室上面的基质胶;
[0160]
9)在24孔板中加入蒸馏水800μl,transwell上室中加入蒸馏水约200μl,然后在倒置显微镜下,任选5个不同的视野拍照,用image j软件进行计数和统计学分析差异的显著性。
[0161]
体外沉默circstx6的表达抑制鼻咽癌的侵袭
[0162]
为了探究沉默circstx6后是否能够影响鼻咽癌的侵袭,我们又在三株细胞系中进行了transwell小室基质胶侵袭实验,利用hiperfect试剂将circstx6 aso和sinc瞬时转染到hone1、hne2和cne2细胞系中沉默circstx6的表达。在沉默了circstx6的鼻咽癌细胞系hone1、hne2和cne2中进行transwell小室基质胶侵袭实验,结果显示,aso组可在transwell小室下表面观察到的肿瘤细胞数目明显少于nc组,且三株细胞系结果的趋势一致。随机拍摄5张照片并记录细胞数目,每一细胞系中两组别数据间均有明显差异,且具有统计学意义。以上结果表明,沉默鼻咽癌细胞系中circstx6的表达,能够抑制鼻咽癌细胞hone1、hne2和cne2在体外的侵袭能力(图10)。
[0163]
体外过表达circstx6促进鼻咽癌细胞的侵袭
[0164]
我们在鼻咽癌细胞系hone1、hne2和cne2进行了transwell小室基质胶侵袭实验,
已观察沉默circstx6对细胞侵袭能力的影响。我们同样利用neofect把无内毒素质粒pcdna3.1( )circrna mini vector和circstx6过表达载体瞬时转染鼻咽癌细胞hone1、hne2和cne2,继续培养到48小时后。收集细胞,利用实时荧光定量pcr技术检测circstx6的表达水平及成环效率。在确定了circstx6过表达质粒的过表达良好效果后,我们将细胞接种到铺基质胶的transwell小室中,发现过表达质粒组的细胞侵袭到小室下表面的数目明显比空载组多,且三株细胞系结果的趋势一致。随机拍摄3张照片并记录细胞数目,每一细胞系中两组别数据间均有明显差异,且具有统计学意义(结果见图10)。以上结果表明,过表达鼻咽癌细胞系中circstx6促进鼻咽癌细胞hone1、hne2和cne2在体外的侵袭能力。通过正反两个方向证明,环状rna circstx6能够促进鼻咽癌细胞的侵袭(结果见图10)。
[0165]
实施例11:细胞划痕愈合迁移实验
[0166]
1)照细胞台:1000μl/10μl tip头、高温高压灭菌的d-hank’s,直尺、1000μl/10μl移液枪、marker笔等,用酒精消毒后再放置在超净台内紫外照射30分钟;
[0167]
2)待细胞长至50%~70%左右分别转染aso和nc组或者转染质粒;
[0168]
3)待细胞长满平铺板底后第二天开始划痕:将10μl枪头比着直尺垂直于6孔板底部干脆快速进行十字或井字划痕,不要倾斜,力度大小一致,以确保划痕宽度尽可能一致;
[0169]
4)吸弃培养液,用d-hanks轻轻洗涤3次,尽可能洗掉由于划痕引起的碎片细胞;
[0170]
5)加入1%双抗2%胎牛血清的1640培养基;
[0171]
6)拍照记录此时的十字旁边划痕宽度,记为0h;
[0172]
7)将6孔板放回培养箱培养,间隔12h拍摄同一位置,记为12h;
[0173]
8)间隔24h时再拍相同位置,直到划痕愈合,整理所有的图片,并进行统计分析。
[0174]
体外沉默circstx6抑制鼻咽癌细胞的迁移
[0175]
利用hiperfect试剂将aso和sinc瞬时转染到hone1、hne2和cne2细胞系中沉默circstx6的表达。在沉默了circstx6的鼻咽癌细胞系hone1、hne2和cne2中进行划痕实验,验证其对细胞迁移的影响。划痕愈合实验在这些细胞中的多个时间点均证实:相对于nc组,aso组细胞的迁移能力明显减弱。划痕宽度差异明显,且具有统计学意义。以上结果显示,沉默鼻咽癌细胞系中circstx6的表达,能够抑制鼻咽癌细胞hone1、hne2和cne2在体外的迁移能力(图11)。
[0176]
体外过表达circstx6促进鼻咽癌细胞的迁移
[0177]
利用neofect把无内毒素质粒pcdna3.1( )circrna mini vector和circstx6过表达载体瞬时转染鼻咽癌细胞hone1、hne2和cne2。在确定了circstx6过表达质粒的过表达良好效果后,我们在鼻咽癌细胞系hone1、hne2和cne2进行了细胞划痕愈合实验。划痕愈合实验在这些细胞中的多个时间点均证实:相对于空载pcdna3.1( )circrna mini vector质粒组,circstx6过表达质粒组细胞的迁移能力明显增强。划痕宽度差异较大,且具有统计学意义。以上结果显示,过表达鼻咽癌细胞系中circstx6的表达,能够促进鼻咽癌细胞hone1、hne2和cne2在体外的迁移能力。通过正反两个方向验证证明,circstx6可以促进鼻咽癌细胞的迁移(图11)。
[0178]
实施例12:原位杂交实验
[0179]
本发明中收集了95例鼻咽癌临床组织样本,npe(癌旁组织)=25,npc(鼻咽癌组织)=95。利用原位杂交试剂盒(boster,武汉,中国)检测石蜡包埋的鼻咽癌组织和癌旁组
织中circstx6的表达。探针序列(5'-tgatctttcatgtccactggtcatatgag-3')设计为跨越circstx6剪接位点(~30nt)。使用半定量评分标准评估染色密度和深度。双盲评分是由两位经验丰富的病理学家打分。(1)染色强度:0,未染色;1,浅褐色;2,棕色无底色或深棕色带光棕色背景(中度阳性);3,深棕色无非特定背景(强阳性)。(2)基于比例的分数阳性信号占总细胞数:0,无阳性细胞;1,0
–
25%;2,阳性率25-50%;3,50-70%阳性率;4,阳性率70-100%。本发明用原位杂交的方法检测鼻咽癌组织和癌旁非肿瘤组织中circstx6的表达,发现circstx6在鼻咽癌组织中高表达(图12a)。在同时分析npe(癌旁组织)和npc(鼻咽癌组织)中circstx6高低表达时,circstx6的阳性率大于25%定义为高表达,得到circstx6在npe和npc中的高低表达的分布情况(图12b)。此外,用kaplan-meier生存分析生成了总体生存(os)曲线,发现鼻咽组织中circstx6水平较高的患者总体生存期显著缩短(图12c)。在分析统计鼻咽癌患者总体生存率时,本发明中把鼻咽癌中circstx6阳性率低于50%的定义为circstx6低表达,大于50%的定义为circstx6高表达。在circstx6低表达组中,死亡41例,存活22例,鼻咽癌患者总体生存率为35%。在circstx6高表达组中,死亡28例,存活4例,鼻咽癌患者的总体生存率为12.5%(图12c)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。