1.本技术总体上涉及生物医学领域。具体来说,本技术涉及结直肠进展期腺瘤的筛查、风险评估及预后方法和试剂盒。
背景技术:
2.在癌变前的腺瘤晚期或癌症早期对结直肠瘤进行早期检测表明可以显著降低患者的死亡率。当前的结直肠瘤筛查手段包括结肠镜检查或对粪便、血液样品的分子检查,这些筛查手段都是侵入性的或只有极少的标记物,限制了患者对癌症筛查的配合度或检测灵敏度。
3.然而,虽然通过检测血浆游离dna的高甲基化已被证实可用于结直肠肿瘤的筛查,但现有检测方法对进展期腺瘤的检出率较低。
4.因此,亟需开发一种方法和/或试剂盒,其可以从生物样品中数量极为有限的细胞外游离dna高效地读取表观遗传学信息,而且可以在医院检验科里很容易地配置并可以可靠地应用。
技术实现要素:
5.本发明通过不同检测靶点,联合血浆游离dna高甲基化和低甲基化的方法,提高对结直肠进展期腺瘤的检测灵敏度。
6.在一个方面,本技术提供了一种在个体中诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后的方法,所述方法包括如下步骤:
7.从所述个体获取含有dna的生物样品;
8.用试剂处理所述生物样品中的dna,所述试剂能够区分所述dna中的甲基化和未甲基化的cpg位点,从而获得经处理的dna;
9.定量分析目标标记物(target marker)的甲基化水平;其中,所述目标标记物包括以下两组目标标记物中每一组目标标记物中的至少一种目标标记物:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a;
10.分别比较所述目标标记物的甲基化水平和相应的参考水平,其中:组(i)所述的目标标记物相对于其相应的参考水平具有更高的甲基化水平,且组(ii)所述的目标标记物相对于其相应的参考水平具有较低的甲基化水平表明所述个体患有结直肠进展期腺瘤,或者所述个体有结直肠进展期腺瘤形成或形成的风险,或者所述个体有结直肠进展期腺瘤发展或发展的可能性增加,或者所述个体有结直肠进展期腺瘤预后不良或预后不良的风险。
11.在一些实施方式中,所述方法包括:
12.(a)从所述个体获取含有dna的生物样品;
13.(b)用试剂处理步骤(a)中获取的所述生物样品中的dna,所述试剂能够区分所述dna中的甲基化和未甲基化的cpg位点,从而获得经处理的dna;
14.(c)用预扩增引物池预扩增从步骤(b)获取的所述经处理的dna中的以下两组目标标记物(target marker)中每一组目标标记物中的至少一种目标标记物:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a;其中所述目标标记物的至少一部分被预扩增以获得预扩增产物;
15.(d)基于步骤(c)获取的预扩增产物来分别定量分析所述被扩增的目标标记物的甲基化水平;
16.(e)分别比较步骤(d)中的所述被扩增的目标标记物的甲基化水平和相应的参考水平,其中:组(i)所述的目标标记物相对于其相应的参考水平具有更高的甲基化水平,且组(ii)所述的目标标记物相对于其相应的参考水平具有较低的甲基化水平表明所述个体患有结直肠进展期腺瘤,或者所述个体有结直肠进展期腺瘤形成或形成的风险,或者所述个体有结直肠进展期腺瘤发展或发展的可能性增加,或者所述个体有结直肠进展期腺瘤预后不良或预后不良的风险。
17.在一些实施方式中,上述方法的步骤(c)中,所述组(i)中的至少2个或全部3个目标标记物被扩增。
18.在一些实施方式中,上述方法的步骤(c)中,所述组(i)中的septin9与bcat1,bcat1与ikzf1,或septin9与ikzf1被扩增。
19.在一些实施方案中,上述方法的步骤(c)中,所述组(ii)中的至少2个、至少3个或全部4个目标标记物被扩增。
20.在一些实施方案中,上述方法的步骤(c)中,所述组(ii)中,pknox2与crhbp,pknox2与sox1,pknox2与基因间隔区a,crhbp与基因间隔区a,或sox1与基因间隔区a被扩增。
21.在一些实施方案中,上述方法的步骤(c)中,所述组(ii)中,pknox2、crhbp和sox1,pknox2、crhbp和基因间隔区a,pknox2、sox1和基因间隔区a或crhbp、sox1和基因间隔区a被扩增。
22.在一些实施方案中,上述方法的步骤(c)中,用预扩增引物池预扩增从步骤(b)获取的所述经处理的dna中的以下目标标记物:septin9、bcat1和ikzf1、pknox2、crhbp、sox1和基因间隔区a;其中所述目标标记物的至少一部分被预扩增以获得预扩增产物。
23.在一些实施方式中,所述各个目标标记物包含或是:
24.a)如下所示的通过hg19坐标定义的各个区域:septin9,chr17:75276651-75496678;bcat1,chr12:24964295-25102393;ikzf1,chr7:50343720-50472799;pknox2,chr11:125034583-125303285;crhbp,chr5:76248538-76276983;sox1,chr13:112721913-112726020;基因间隔区a,chr10:130082033-130087148;以及上述每个区域的各个起始位点的上游5kb和各个末端位点的下游5kb;或
25.b)亚硫酸氢盐转化后的a)的对应区域;或
26.c)甲基化敏感限制酶(msre)处理后的a)的对应区域。
27.在一些实施方式中,从步骤(a)中获取的所述生物样本中的所述dna包括基因组dna或细胞外游离dna。在一些实施方式中,所述细胞外游离dna包括循环肿瘤dna。在一些实施方式中,所述细胞外游离dna中的所述目标标记物在所述生物样品中的数量不超过1ng、0.8ng、0.6ng、0.4ng、0.2ng、0.1ng、0.08ng或不超过0.04ng。在一些实施方式中,所述细胞
外游离dna中的所述目标标记物在所述生物样品中的浓度低于用于所述目标标记物的检测分析的灵敏度水平。
28.在一些实施方式中,步骤(c)中所述预扩增产物在步骤(d)之前使用稀释剂稀释。
29.在一些实施方式中,所述生物样品选自下组:组织学切片、组织活检、石蜡包埋的组织、体液、结肠流出物、手术切除样本、分离的血细胞、分离自血液的细胞,及其任意组合。在一些实施方式中,所述体液选自下组:全血、血清、血浆、尿液、粘液、唾液、腹膜液、胸腔液、胸膜积液、滑液、脑脊髓液、胸腔穿刺液、腹腔积液,及其任意组合。在一些实施方式中,从所述个体的血浆中获得所述生物样品。在一些实施方式中,所述结肠流出物选自下组:粪便样品和灌肠洗涤样品。
30.在一些实施方式中,步骤(b)的所述试剂在cpg位点选择性地修饰未甲基化的胞嘧啶残基以产生修饰的残基,但并不显著性地修饰甲基化的胞嘧啶残基。在一些实施方式中,步骤(b)的所述试剂包括亚硫酸氢盐试剂。在一些实施方式中,所述亚硫酸氢盐试剂选自下组:亚硫酸氢铵、亚硫酸氢钠、亚硫酸氢钾、亚硫酸氢钙、亚硫酸氢镁、亚硫酸氢铝、亚硫酸氢根离子,及其任意组合。
31.在一些实施方式中,步骤(b)的所述试剂选择性地切割未甲基化的残基但不切割甲基化的残基,或者选择性地切割甲基化的残基但不切割未甲基化的残基。在一些实施方式中,步骤(b)的所述试剂是甲基化敏感限制酶(msre)。在一些实施方式中,所述msre选自下组:hpaii酶、sali酶、酶、scrfi酶、bbei酶、noti酶、smai酶、xmai酶、mboi酶、bstbi酶、clai酶、mlui酶、naei酶、nari酶、pvui酶、sacii酶、hhai酶及其任意组合。
32.在一些实施方式中,所述预扩增引物池包含甲基化特异性引物对。在一些实施方式中,其中所述甲基化特异性引物对包含一个正向引物和一个反向引物,所述引物均包含寡核苷酸序列,所述寡核苷酸序列与相应的目标标记物的至少9个连续核苷酸在严紧条件下、中等严紧条件下或高度严紧条件下杂交,其中所述至少9个连续核苷酸包含至少一个cpg位点。
33.在一些实施方式中,所述预扩增引物池进一步包含用于扩增对照标记物的对照引物对。在一些实施方式中,所述对照标记物选自下组:actb、gapdh、微管蛋白(tubulin)、aldoa、pgk1、ldha、rps27a、rpl19、rpl11、arhgdia、rpl32、c1orf43、chmp2a、emc7、gpi、psmb2、psmb4、rab7a、reep5、snrpd3、vcp和vps29。
34.在一些实施方案中,用于扩增septin9的引物对为seq id no:22/23;用于扩增bcat1的引物对为seq id no:24/25;用于扩增ikzf1的引物对为seq id no:26/27;用于扩增pknox2的引物对为seq id no:28/29;用于扩增crhbp的引物对为seq id no:30/31;用于扩增sox1的引物对为seq id no:32/33;用于扩增基因间隔区a的引物对为seq id no:34/35。
35.在一些实施方式中,所述甲基化特异性引物对至少包含选自以下的引物对中的一对或多对:seq id no:22/23、24/25、26/27、28/29、30/31、32/33和34/35。优选地,所述甲基化特异性引物对包含选自下组(i)的至少一对、至少两对或全部三对引物对和下组(ii)的至少一对、至少两对、至少三对引物对:(i)seq id no:22/23、24/25和26/27;(ii)seq id no:28/29、30/31、32/33和34/35。优选地,所述甲基化特异性引物对包含seq id no:22/23、24/25、26/27、28/29、30/31、32/33和34/35。
36.在一些实施方式中,在步骤(c)中,所述目标标记物在一个或多个封闭寡核苷酸存在的情况下被扩增。
37.在一些实施方式中,步骤(d)的所述定量分析是通过以下方式进行:聚合酶链式反应(例如实时聚合酶链式反应、数字聚合酶链式反应)、核酸测序、基于质量的分离(例如电泳法、质谱法)或靶标捕获(例如杂交、微阵列)。在一些实施方式中,步骤(d)的所述定量分析是通过实时聚合酶链式反应进行的,任选地所述实时聚合酶链式反应是多重实时聚合酶链式反应。
38.在一些实施方式中,步骤(d)的所述定量分析包含使用定量引物对和dna聚合酶对步骤(c)的预扩增产物进行扩增,其中所述预扩增产物通过扩增产生扩增产物。
39.在一些实施方式中,步骤(d)使用的所述定量引物对能够与步骤(c)的所述预扩增产物的至少9个连续核苷酸在严紧条件下、中等严紧条件下或高度严紧条件下杂交。
40.在一些实施方式中,步骤(d)使用的至少一个所述定量引物对和步骤(c)的所述预扩增引物池的至少一个所述甲基化特异性引物对相同。
41.在一些实施方式中,步骤(d)使用的所述定量引物对被设计为用于扩增步骤(c)的所述至少一个预扩增产物内的至少一部分。
42.在一些实施方式中,所述步骤(d)在检测试剂存在的情况下进行。在一些实施方式中,所述检测试剂选自下组:荧光探针、嵌入染料、生色团标记的探针、放射性同位素标记的探针和生物素标记的探针。优选地,用于检测septin9的探针为seq id no:36;检测bcat1的探针为seq id no:37;用于检测ikzf1的探针为seq id no:38;用于检测pknox2的探针为seq id no:39和40;用于检测crhbp的探针为seq id no:41;用于检测sox1的探针为seq id no:42;用于检测基因间隔区a的探针为seq id no:43。在一些实施方式中,所述探针至少包括选自下组的一条或多条核苷酸序列:seq id no:36-43。优选地,所述探针包括seq id no:36-38中的至少一条、至少两条或全部三条核苷酸序列和seq id no:39和/或40以及seq id no:41-43中的至少一条、至少两条或至少三条核苷酸序列。在一些实施方式中,所述探针包括seq id no:36-38和41-43所示的核苷酸序列,以及seq id no:39和/或40所示的核苷酸序列。
43.在一些实施方式中,所述荧光探针的5’端标记有荧光染料(例如fam、hex/vic、tamra、texas red或cy5),3’端标记有猝灭剂(例如bhq1、bhq2、bhq3、dabcyl或tamra)。
44.在一些实施方式中,步骤(e)包括比较步骤(d)的所述目标标记物的ct值和参考ct值,其中所述组(i)的目标标记物的ct值高于其相应的参考ct值、且组(ii)的目标标记物的ct值低于其相应的参考ct值表明所述个体患有结直肠进展期腺瘤,或者所述个体有结直肠进展期腺瘤形成或形成的风险,或者所述个体有结直肠进展期腺瘤发展或发展的可能性增加,或者所述个体有结直肠进展期腺瘤预后不良或预后不良的风险。
45.在一些实施方式中,步骤(c)的所述预扩增包括5到30个反应循环,其中每个循环包括在40~80℃下反应5秒-5分钟,之后在85~99℃下反应5秒-5分钟。
46.在一些实施方式中,步骤(d)的所述定量分析包括基于所述预扩增产物中多个cpg二核苷酸、tpg二核苷酸或cpa二核苷酸的存在或水平来确定其甲基化水平。在一些实施方式中,步骤(d)的所述定量分析包括基于所述预扩增产物中一个或多个cpg二核苷酸的存在或水平来确定胞嘧啶残基的甲基化水平。在一些实施方式中,步骤(d)的所述定量分析是通
过将步骤(c)所述预扩增产物分割为多个组分来进行的。
47.在一些实施方式中,步骤(e)中的所述参考水平是基于从患有结直肠瘤或具有患结直肠瘤风险的一组个体中获取的临床样本和从未患结直肠瘤或不具有患结直肠瘤风险的一组个体中获取的临床样本来确定的。
48.在另一方面,本技术提供了一种用于诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后的试剂盒,其包含:
49.(a)处理dna的第一试剂,其中所述第一试剂能够区分dna中的甲基化和未甲基化的cpg位点;
50.(b)第一引物池,所述第一引物池包含用于预扩增以下两组目标标记物中每一组目标标记物中的至少一种目标标记物的引物对:(i)septin9、bcat1和ikzf1,和(ii)pknox2、crhbp、sox1和基因间隔区a,其中所述引物对可与被所述第一试剂处理后的所述目标标记物的目标序列的至少9个连续核苷酸在严紧条件下、中等严紧条件下或高度严紧条件下杂交,其中所述目标序列包含至少一个cpg位点;
51.(c)第二试剂,所述第二试剂用于定量分析被所述第一引物池预扩增的所述目标标记物中每个目标标记物的甲基化水平。
52.在一些实施方式中,所述第二试剂包含第二引物池,所述第二引物池包含多个定量引物对,所述定量引物对能够与被所述第一引物池预扩增的所述目标序列的至少9个连续核苷酸在严紧条件下、中等严紧条件下或高度严紧条件下杂交。
53.在一些实施方式中,所述第二引物池中的定量引物对和所述第一引物池中的引物对相同。在一些实施方式中,所述第二引物池中的定量引物对被设计为用于扩增被所述第一引物池预扩增的所述目标序列内的至少一部分。
54.在一些实施方式中,所述第一引物池包含至少一个甲基化特异性引物对。
55.在一些实施方式中,所述第一引物池和所述第二引物池被包装在单一容器内或被包装在独立容器内。
56.在一些实施方式中,所述试剂盒进一步包含一个或多个封闭寡核苷酸。
57.在一些实施方式中,所述试剂盒进一步包含检测试剂。在一些实施方式中,所述检测试剂选自下组:荧光探针、嵌入染料、生色团标记的探针、放射性同位素标记的探针和生物素标记的探针。所述探针至少包括选自下组的一条或多条核苷酸序列:seq id no:36-43。优选地,所述探针包括下组(i)的至少一条、至少两条或全部三条核苷酸序列和下组(ii)的至少一条、至少两条或至少三条核苷酸序列:(i)seq id no:36-38,(ii)seq id no:39或40以及41-43。在一些实施方式中,所述探针包括:seq id no:36-38和41-43所示的核苷酸序列,以及seq id no:39和/或40所示的核苷酸序列。在一些实施方式中,所述荧光探针的5’端标记有荧光染料(例如fam、hex/vic、tamra、texas red或cy5),3’端标记有猝灭剂(例如bhq1、bhq2、bhq3、dabcyl、tamra或lowa black dark quenchers)。
58.在一些实施方式中,所述试剂盒进一步包含dna聚合酶和/或一个适合存放从所述个体中获取的所述生物样品的容器。在一些实施方式中,所述试剂盒进一步包含使用说明书和/或对试剂盒检测结果的解释。
59.在一些实施方式中,所述第一试剂包括亚硫酸氢盐试剂或甲基化敏感限制酶(msre)。在一些实施方式中,所述亚硫酸氢盐试剂选自下组:亚硫酸氢铵、亚硫酸氢钠、亚硫
酸氢钾、亚硫酸氢钙、亚硫酸氢镁、亚硫酸氢铝、亚硫酸氢根离子,及其任意组合。在一些实施方式中,所述msre选自下组:hpaii酶、sali酶、酶、scrfi酶、bbei酶、noti酶、smai酶、xmai酶、mboi酶、bstbi酶、clai酶、mlui酶、naei酶、nari酶、pvui酶、sacii酶、hhai酶及其任意组合。
60.在一些实施方式中,所述第一引物池中包括用于扩增所述组(i)中的至少2个或全部3个目标标记物的引物对。
61.在一些实施方式中,所述第一引物池中包括用于扩增所述组(i)中的septin9与bcat1,bcat1与ikzf1,或septin9与ikzf1的引物对。
62.在一些实施方案中,所述第一引物池中包括用于扩增所述组(ii)中的至少2个、至少3个或全部4个目标标记物的引物对。
63.在一些实施方案中,所述第一引物池中包括用于扩增组(ii)中的pknox2与crhbp,pknox2与sox1,pknox2与基因间隔区a,crhbp与基因间隔区a,或sox1与基因间隔区a的引物对。
64.在一些实施方案中,所述第一引物池中包括用于扩增组(ii)中的pknox2、crhbp和sox1,pknox2、crhbp和基因间隔区a,pknox2、sox1和基因间隔区a或crhbp、sox1和基因间隔区a的引物对。
65.在一些实施方案中,所述第一引物池中包括用于扩增septin9、bcat1和ikzf1、pknox2、crhbp、sox1和基因间隔区a的引物对;其中所述目标标记物的至少一部分被预扩增以获得预扩增产物。
66.在一些实施方案中,用于扩增septin9的引物对为seq id no:22/23;用于扩增bcat1的引物对为seq id no:24/25;用于扩增ikzf1的引物对为seq id no:26/27;用于扩增pknox2的引物对为seq id no:28/29;用于扩增crhbp的引物对为seq id no:30/31;用于扩增sox1的引物对为seq id no:32/33;用于扩增基因间隔区a的引物对为seq id no:34/35。
67.在一些实施方式中,所述各个目标标记物包含或是:
68.a)如下所示的通过hg19坐标定义的各个区域:septin9,chr17:75276651-75496678;bcat1,chr12:24964295-25102393;ikzf1,chr7:50343720-50472799;pknox2,chr11:125034583-125303285;crhbp,chr5:76248538-76276983;sox1,chr13:112721913-112726020;基因间隔区a,chr10:130082033-130087148;以及上述每个区域的各个起始位点的上游5kb和各个末端位点的下游5kb;或
69.b)亚硫酸氢盐转化后的a)的对应区域;或
70.c)甲基化敏感限制酶(msre)处理后的a)的对应区域。
71.在一些实施方式中,所述第一引物池包含的引物对包含选自下组的核苷酸序列,或由选自下组的苷酸序列组成:seq id no:22/23、24/25、26/27、28/29、30/31、32/33和34/35,任选地其中所述第二引物池包含至少一个与所述第一引物池中的至少一个引物对相同的引物对。
72.在一些实施方式中,所述第一引物池和所述第二引物池进一步包含用于扩增对照标记物的引物对。在一些实施方式中,所述对照标记物选自下组:actb、gapdh、微管蛋白、aldoa、pgk1、ldha、rps27a、rpl19、rpl11、arhgdia、rpl32、c1orf43、chmp2a、emc7、gpi、
psmb2、psmb4、rab7a、reep5、snrpd3、vcp和vps29。
73.在一些实施方式中,所述试剂盒进一步包含多个容器,每个容器均用于接收所述第二引物池的组分。
74.在另一方面,本技术提供了根据本技术所述的试剂盒在制造用于在个体中诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后的诊断试剂盒中的用途。
75.在另一方面,本技术提供了用于定量分析目标标记物的甲基化水平的试剂在制造试剂盒中的用途,所述试剂盒被用于在个体中诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后的方法中,其中所述方法包括如下步骤:
76.(a)从所述个体获取含有dna的生物样品;
77.(b)用试剂处理步骤(a)中获取的所述生物样品中的dna,所述试剂能够区分所述dna中的甲基化和未甲基化的cpg位点,从而获得经处理的dna;
78.(c)用预扩增引物池预扩增从步骤(b)获取的所述经处理的dna中的以下两组目标标记物(target marker)中每一组目标标记物中的至少一种目标标记物:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a;其中所述目标标记物的至少一部分被预扩增以获得预扩增产物;
79.(d)基于步骤(c)获取的预扩增产物来分别定量分析所述被扩增的目标标记物的甲基化水平;
80.(e)分别比较步骤(d)中的所述被扩增的目标标记物的甲基化水平和相应的参考水平,其中:组(i)所述的目标标记物相对于其相应的参考水平具有更高的甲基化水平,且组(ii)所述的目标标记物相对于其相应的参考水平具有较低的甲基化水平表明所述个体患有结直肠进展期腺瘤,或者所述个体有结直肠进展期腺瘤形成或形成的风险,或者所述个体有结直肠进展期腺瘤发展或发展的可能性增加,或者所述个体有结直肠进展期腺瘤预后不良或预后不良的风险。
81.在一些实施方式中,上述方法的步骤(c)中,所述组(i)中的至少2个或全部3个目标标记物被扩增。
82.在一些实施方式中,上述方法的步骤(c)中,所述组(i)中的septin9与bcat1,bcat1与ikzf1,或septin9与ikzf1被扩增。
83.在一些实施方案中,上述方法的步骤(c)中,所述组(ii)中的至少2个、至少3个或全部4个目标标记物被扩增。
84.在一些实施方案中,上述方法的步骤(c)中,pknox2与crhbp,pknox2与sox1,pknox2与基因间隔区a,crhbp与基因间隔区a,或sox1与基因间隔区a被扩增。
85.在一些实施方案中,上述方法的步骤(c)中,pknox2、crhbp和sox1,pknox2、crhbp和基因间隔区a,pknox2、sox1和基因间隔区a或crhbp、sox1和基因间隔区a被扩增。
86.在一些实施方案中,上述方法的步骤(c)中,用预扩增引物池预扩增从步骤(b)获取的所述经处理的dna中的以下目标标记物:septin9、bcat1和ikzf1、pknox2、crhbp、sox1和基因间隔区a;其中所述目标标记物的至少一部分被预扩增以获得预扩增产物。
87.在一些实施方式中,所述各个目标标记物包含或是:
88.a)如下所示的通过hg19坐标定义的各个区域:septin9,chr17:75276651-75496678;bcat1,chr12:24964295-25102393;ikzf1,chr7:50343720-50472799;pknox2,chr11:125034583-125303285;crhbp,chr5:76248538-76276983;sox1,chr13:112721913-112726020;基因间隔区a,chr10:130082033-130087148;以及上述每个区域的各个起始位点的上游5kb和各个末端位点的下游5kb;或
89.b)亚硫酸氢盐转化后的a)的对应区域;或
90.c)甲基化敏感限制酶(msre)处理后的a)的对应区域。
附图说明
91.图1:肠镜未发现异常与进展期腺瘤患者血浆游离dna中septin9、bcat1和ikzf1甲基化检测结果。
92.图2:肠镜未发现异常与进展期腺瘤患者血浆游离dna中pknox2、crhbp、sox1、基因间隔区a的甲基化检测结果。
93.图3显示了目标标记物的示例性亚区域(subregion)的核苷酸序列。
具体实施方式
94.虽然本技术公开了本技术的各个方面和各种实施方式,但是本领域技术人员
95.可以在不脱离本技术的精神和范围的前提下做出各种等同改变或修改。本技术公开的各个方面和各种实施方式均是示例性的,并不旨在限制本技术的范围,本技术的实际保护范围以权利要求书为准。除非另有说明,否则本技术中使用的所有技术和科学术语均是本领域技术人员通常理解的含义。本技术引用的所有参考文献、专利和专利申请均通过引用并入本技术。
96.需注意的是,在本技术的说明书和权利要求书中,单数形式的“一个”、“一种”和“所述”均包括其复数形式,除非上下文另有说明。因此,例如,“一种试剂”包括多种试剂。
97.在本技术的说明书和权利要求书,除非另有说明,否则术语“包含”、“包括”或“含有”是指含有所列出的数值、步骤或成分,但也不排除还含有其他数值、步骤或成分。
98.传统上,对癌症的诊断依赖于对单个标记物(例如,基因突变)的检测,但是很可惜的是,通常很难通过检测单个标记物来检测癌症,或者很难通过检测单个标记物来区分多种类型的癌症。此外,在生物样品中单个标记物的水平通常是极为有限的,这进一步降低了对癌症的诊断特异性和/或诊断灵敏度。因此,仅识别单个标记物的分析法被证明具有有限的预测价值。
99.在一个方面,本技术预扩增本文所述的目标标记物来获得预扩增产物,之后基于其各自的预扩增产物来分别定量分析每个目标标记物的甲基化水平。这样的预扩增步骤可以提高目标标记物的数量/水平,并可以显著提高对结直肠进展期腺瘤的诊断特异性和/或诊断灵敏度。在另一方面,本技术同时定量分析生物样品中的多个目标标记物的甲基化水平,以提高对结直肠进展期腺瘤的诊断特异性和/或诊断灵敏度。在一些实施方式中,所述多个目标标记物在定量分析之前先预扩增。特别地,本技术的发明人出人意料地发现将预扩增步骤和定量分析步骤结合在一起可以显著提高对结直肠进展期腺瘤的诊断特异性和/或诊断灵敏度,使得对结直肠进展期腺瘤的早期检测成为可能,例如在癌变前的腺瘤期或
癌症早期。本领域技术人员可以理解的是,在上下文中的诊断“灵敏度”定义的是被正确鉴定为阳性结果的比例,也就是被正确鉴定出患病的个体的百分比。而“特异性”定义的是被正确鉴定为阴性结果的比例,也就是被正确鉴定出不患病的个体的百分比。
100.1.方法
101.在一个方面,本技术提供了一种在个体中诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后的方法,所述方法包括如下步骤:
102.(a)从所述个体获取含有dna的生物样品;
103.(b)用试剂处理所述生物样品中的dna,所述试剂能够区分所述dna中的甲基化和未甲基化的cpg位点,从而获得经处理的dna;
104.(d)定量分析目标标记物(target marker)的甲基化水平;其中,所述目标标记物包括以下两组目标标记物中每一组目标标记物中的至少一种目标标记物:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a;
105.(e)分别比较所述目标标记物的甲基化水平和相应的参考水平,其中:组(i)所述的目标标记物相对于其相应的参考水平具有更高的甲基化水平,且组(ii)所述的目标标记物相对于其相应的参考水平具有较低的甲基化水平表明所述个体患有结直肠进展期腺瘤,或者所述个体有结直肠进展期腺瘤形成或形成的风险,或者所述个体有结直肠进展期腺瘤发展或发展的可能性增加,或者所述个体有结直肠进展期腺瘤预后不良或预后不良的风险;
106.其中,所述方法包括任选的步骤(c):用预扩增引物池预扩增从步骤(b)获取的所述经处理的dna中的以下两组目标标记物中每一组目标标记物中的至少一种目标标记物:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a;其中所述目标标记物的至少一部分被预扩增以获得预扩增产物。
107.优选地,所述方法包括:
108.(a)从所述个体获取含有dna的生物样品;
109.(b)用试剂处理步骤(a)中获取的所述生物样品中的dna,所述试剂能够区分所述dna中的甲基化和未甲基化的cpg位点,从而获得经处理的dna;
110.(c)用预扩增引物池预扩增从步骤(b)获取的所述经处理的dna中的以下两组目标标记物(target marker)中每一组目标标记物中的至少一种目标标记物:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a;其中所述目标标记物的至少一部分被预扩增以获得预扩增产物;
111.(d)基于步骤(c)获取的预扩增产物来分别定量分析所述被扩增的目标标记物的甲基化水平;
112.(e)分别比较步骤(d)中的所述被扩增的目标标记物的甲基化水平和相应的参考水平,其中:组(i)所述的目标标记物相对于其相应的参考水平具有更高的甲基化水平,且组(ii)所述的目标标记物相对于其相应的参考水平具有较低的甲基化水平表明所述个体患有结直肠进展期腺瘤,或者所述个体有结直肠进展期腺瘤形成或形成的风险,或者所述个体有结直肠进展期腺瘤发展或发展的可能性增加,或者所述个体有结直肠进展期腺瘤预后不良或预后不良的风险。
113.本文中所使用的术语“筛查”是指对病理状态、疾病或病况进行鉴定,例如对结直肠进展期腺瘤的鉴定,或对患有结直肠进展期腺瘤但可能从特定的治疗方案中获益的个体进行鉴定。在本技术中,术语“筛查”和术语“诊断”可能互换使用。
114.本文中所使用的术语“瘤”或“肿瘤”应当理解为是指包含肿瘤细胞的病灶、肿瘤或其他包囊化或未包囊化的块体或其他形式的生长物。“肿瘤细胞”应当理解为是指显示出异常生长的细胞。术语“生长”应当以最广泛的意义理解并且包括增殖。于此而言,细胞异常生长的一个实例是细胞失控的增殖。另一个实例是
115.细胞因凋亡失败而延长其通常的寿命。肿瘤细胞可以是良性细胞或恶性细胞。在一些实施方式中,肿瘤是腺瘤或腺癌。不使本发明限于任一理论或作用模式,腺瘤通常是源自上皮的良性肿瘤,其源自上皮组织或显示出清晰界定的上皮结构。这些结构物可以具有腺状外观。它可能在腺瘤内部包含恶性细胞群体,例如,随着良性腺瘤或良性肿瘤病灶进展成恶性腺癌而发生。在一些实施方式中,瘤是恶性的,例如癌。在一些实施方式中,瘤不是恶性的,例如腺瘤。
116.本文中所使用的术语“结直肠瘤”是指存在于结肠、直肠和/或阑尾的瘤。在一些实施方式中,结直肠瘤是结直肠癌、结直肠腺瘤和/或无蒂锯齿状息肉。在一些实施方式中,结直肠瘤是癌前的。
117.本文所述术语“结直肠进展期腺瘤”是指肿瘤大于1cm、或含高级别上皮内瘤变、或含绒毛成分的腺瘤。
118.本文中所使用的术语“癌前”指的是展示出与癌症进展风险升高相关的一些组织学变化的瘤。就结直肠细胞增殖性病症来说,这类状况的实例包括高度发育异常的细胞增殖性疾病,例如结肠的腺瘤状息肉。
119.本文中在描述瘤(例如,腺瘤或腺癌)时所用的术语“形成”被理解为是指表现出发育异常的个体的一个或多个细胞。对这一点而言,腺瘤或腺癌可能已形成发展,因为已形成非正常增长的细胞团块,也可以是腺瘤或腺癌处在极早期,在诊断时只有相比数量极少的细胞出现非正常分裂。本技术也延伸至评估个体的结直肠进展期腺瘤(例如,结直肠癌)形成风险。
120.本文中所用的术语“评估”指的是区分来自患有结直肠进展期腺瘤的个体和未患有结直肠进展期腺瘤的个体的样本的能力,或者区分来自处于结直肠瘤进展不同阶段的个体的样本的能力。在一些实施方式中,该评估涉及确定个体的肿瘤是否进入进展阶段或是否具有较高可能性进入进展阶段。在一些实施方式中,该评估涉及对个体的肿瘤进行分类,例如i期、ii期、iii期、iv期等。在一些实施方式中,该评估涉及确定个体的肿瘤是否减轻或加重。在一些实施方式中,该评估可以协助评价一种治疗具有临床受益的可能性。在一些实施方式中,该评估可能涉及患者在接受治疗(例如,用特定的药物进行治疗)后是否好转和/或好转的可能性。通过为任何特定患者选择最合适的治疗方式,本技术的评估方法可以被用于在临床上做出治疗决定。在施用治疗方案(例如,给定的治疗方案,包括例如给定的治疗药剂或组合的施用,手术干预、类固醇治疗等)后,本技术的评估方法在评价该患者能否长期存活的可能性上是有价值的工具。
121.本领域技术人员所理解的“区分”不能达到对所分析的样品100%正确。但是,依然要求对具有统计学意义的数量的样品能够正确分类。具有统计学意义的数量可以由本领域
技术人员通过使用不同的统计工具来确定,例如但不限于确定置信区间、确定p值,学生氏t检验或fisher区分方程。有关详细信息,请参见dowdy and wearden,statistics for research,john wiley&sons,new york 1983。在一些实施方式中,置信区间为至少90%、至少95%、至少96%、至少97%、至少98%或至少99%。在一些实施方式中,p值小于0.1、0.05、0.01、0.005或0.0001。
122.本文所用的术语“进展”是指细胞的形态和生理沿着遗传确定的途径改变,例如,从先前、较低或早期到后来的、更复杂或更高级阶段的生理成熟中的自然发展过程。
123.本文所用的术语“预后”是指预测疾病(例如,癌症)的疾病症状(包括例如复发、加剧、耐药性)结果的可能性。该术语还指对治疗的临床获益可能性的预测。在一些实施方式中,使用统计算法为个体提供疾病的预后。例如,预后可以是手术、癌症(例如,实体瘤,例如结直肠癌、黑素瘤和肾细胞癌)的临床亚型的进展、一种或多种临床因素的进展或从疾病中恢复。预后可以是预后不良(例如可能复发或产生耐药性)或预后良好。
124.在本技术中,以下关于步骤(a)、步骤(b)、步骤(c)、步骤(d)和步骤(e)的详细描述适用于在个体中诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后的方法。
125.步骤(a)
126.在根据本技术的方法的步骤(a)中,从所述个体中获取包含dna的生物学样本。
127.本文所用的术语“生物样品”是指获自或衍生自目标个体的生物组合物,其包含基于物理、生化、化学和/或生理特征待表征或待识别的细胞和/或其他分子实体(例如dna)。生物样品包括但不限于通过本领域技术人员已知的任何方法获得的个体的细胞、组织、器官和/或生物体液。在一些实施方式中,所述生物样品选自下组:组织学切片、组织活检、石蜡包埋的组织、体液、结肠流出物、手术切除样本、分离的血细胞、分离自血液的细胞,及其任意组合。在一些实施方式中,所述体液选自下组:全血、血清、血浆、尿液、粘液、唾液、腹膜液、胸腔液、胸膜积液、滑液、脑脊髓液、胸腔穿刺液、腹腔积液,及其任意组合。在一些实施方式中,所述结肠流出物选自下组:粪便样品和灌肠洗涤样品。选择最适合根据本文申请的方法的检测的样品将取决于情境的性质。在一些实施方式中,所述生物样品获自个体的全血。在一些实施方式中,所述生物样品获自个体的血浆。本领域技术人员知道从全血制备血浆的各种方法。例如,在一些实施方式中,血浆通过将来自个体的全血离心一次、两次、三次、四次、五次或更多次来获得。
128.本文所用的术语“个体”包括人类和非人类的动物。非人类动物包括所有脊椎动物,例如哺乳动物和非哺乳动物。“个体”也可以是家畜,例如牛、猪、绵羊、家禽和马;或啮齿动物,例如大鼠、小鼠;或非人类灵长类动物,例如猿、猴、恒河猴;或家养的动物,例如狗或猫。在一些实施方式中,个体是人类或非人类灵长类动物。在一些实施方式中,个体是人类。在本技术中,“个体”和“受试者”可能互换使用。
129.在一些实施方式中,所述dna是从所述生物样本中分离的。从生物样品中分离和纯化dna可以通过使用本领域已知的各种方法来实施,包括使用可商购的试剂盒。例如,通过以下方式从细胞和组织中分离dna:在高度变性和还原条件下裂解原材料、部分使用蛋白质降解酶、纯化通过苯酚/氯仿提取工艺获得的核酸组分,并通过渗析或乙醇沉淀从水相中回收核酸(参见例如sambrook,j.,fritsch,e.f.in t.maniatis,c s h,molecular cloning,
1989)。又例如,现在有许多试剂体系特别适用于从琼脂糖凝胶中纯化dna片段、从细菌裂解物中分离质粒dna,以及从血液、组织或细胞培养物中分离较长链的核酸(基因组dna、总细胞rna)。许多这些可商购的纯化体系中是基于相当众所周知的原理,即,在不同离液盐的溶液的存在下将核酸与矿物载体相结合。在这些体系中,细磨的玻璃粉、硅藻土或硅胶的悬浮液被用作载体材料。在例如us7888006b2和ep1626085a1中描述了从生物样品中分离和纯化dna的一些其他方法。在方法之间进行选择将受到几个因素的影响,包括时间、费用和所需的dna数量。
130.在一些实施方式中,生物样品中包含的dna包括基因组dna。本文所用的术语“基因组dna”是指包含细胞或生物体的完整基因组及其片段或部分的dna。基因组dna是来源于个体的大段dna(例如长于大约10、20、30、40、50、60、70、80、90、100、200或300kb),并且可以具有天然修饰,例如dna甲基化。
131.在一些实施方式中,生物样品中包含的dna包括细胞dna。本文所用的术语“细胞dna”是指存在于细胞内的dna,或从体内细胞中获取dna并在体外分离、或以其他方式在体外操作,只要该dna未从体内细胞中移除。
132.在一些实施方式中,生物样品中包含的dna包括细胞外游离dna。本文所用的术语“细胞外游离dna”是指在体内的细胞外存在的dna片段。该术语也可以被用于指代获取自体内的细胞外来源并在体外分离、或操作的dna片段。细胞外游离dna中的dna片段通常具有约100到200bp的长度,推测与被包裹于核小体的dna片段的长度有关。细胞外游离dna包括例如细胞外游离胎儿dna和循环肿瘤dna。细胞外游离胎儿dna在孕妇的体内(例如血液)中循环,代表胎儿基因组,而循环肿瘤dna在癌症患者的体内(例如血液)中循环。在一些实施方式中,细胞外游离dna可基本上不含个体的细胞dna。例如,所述细胞外游离dna可包含小于约1,000ng/ml、小于约100ng/ml、小于约10ng/ml、小于约1ng/ml的细胞dna。
133.可以通过使用本领域已知的常规技术来制备细胞外游离dna。例如,可以通过以约200-20,000g、约200-10,000g、约200-5,000g、约300-4000g等的速度离心血液样品约3-30分钟、约3-15分钟、约3-10分钟、约3-5分钟来获得血液样品的细胞外游离dna。例如,在一些实施方式中,可以通过将个体的血浆或血清离心一、二、三、四、五次或更多次来获得血液样本的细胞外游离dna。在一些实施方式中,为了从包含可溶性dna的无细胞组分中分离细胞及其片段,可以通过微滤来获得所述生物样品。通常来说,微滤可以通过使用过滤器来进行,例如,0.1微米~0.45微米的膜过滤器,诸如0.22微米的膜过滤器。
134.在一些实施方式中,使用商购的dna提取产品从全血、血清或血浆中提取细胞外游离dna用于分析。这种提取方法据称对循环dna的回收率高(》50%),某些产品(例如qiagen生产的qiaamp circulating nucleic acid kit)据称可提取小尺寸的dna片段。所使用的典型样品量为1-5ml血清或血浆。
135.在一些实施方式中,细胞外游离dna包括循环肿瘤dna。循环肿瘤dna(“ctdna”)是与细胞无关的体液(例如血液、尿液、唾液、痰、粪便、胸膜液、脑脊液等)中肿瘤来源的片段化dna。通常,ctdna高度片段化,平均长度约为150个碱基对。ctdna通常包括体液(例如血浆)中细胞外游离dna的极小部分,例如ctdna可能构成血浆dna的不到约10%。通常,该百分比小于约1%,例如小于约0.5%或小于约0.01%。另外,血浆dna的总量通常非常低,例如约10ng/ml血浆。ctdna的数量因人而异,并且取决于肿瘤的类型、位置,对于癌性肿瘤,则取决
于癌症的阶段。但是,ctdna通常在体液中非常罕见,只能通过极其敏感和特异性的技术进行检测。检测ctdna可能有助于检测和诊断肿瘤、指导肿瘤特异性治疗、监测治疗以及监测癌症的缓解。
136.步骤(b)
137.在根据本技术的方法的步骤(b)中,用能够区分dna中的未甲基化和甲基化cpg位点的试剂处理步骤(a)中获取的生物样品中的dna,从而获得经处理的dna。
138.dna甲基化是(例如,通过dna甲基转移酶的作用)将甲基添加到dna分子上(例如,添加至dna分子的一个或多个胞嘧啶碱基)的生物学过程。在哺乳动物中,dna甲基化出现于胞嘧啶-磷酸-鸟嘌呤(cpg)二核苷酸(即“cpg位点”)的5’位置,当其出现在基因的启动子或第一个外显子中的5
’‑
cpg-3’二核苷酸中时,会导致基因的表观遗传失活。充分证明dna甲基化在调节基因表达、肿瘤发生、以及其他遗传和表观遗传疾病中起重要作用。
139.如本文所用,术语“甲基化的胞嘧啶残基”是指胞嘧啶残基的衍生物,其中一个甲基连接至胞嘧啶环的碳原子上(例如c5)。术语“未甲基化的胞嘧啶残基”是指未衍生化的胞嘧啶残基,其中与“甲基化的胞嘧啶残基”相反,在胞嘧啶环的碳原子(例如c5)上没有甲基连接。其内的胞嘧啶残基被甲基化的cpg位点就是甲基化的cpg位点,而其内的胞嘧啶残基未被甲基化的cpg位点是未甲基化的cpg位点。
140.在一些实施方式中,步骤(b)中使用的试剂能够区分dna中的未甲基化和甲基化的cpg位点,从而获得经处理的dna。该试剂可以选择性地作用于未甲基化的胞嘧啶残基,但不能显著地作用于甲基化的胞嘧啶残基。或者该试剂可以选择性地作用于甲基化的胞嘧啶残基,而不显著地作用于未甲基化的胞嘧啶残基。因此,原始dna以取决于是否被甲基化的方式转化为经处理的dna,从而可以通过其杂交行为将经处理的dna与原始dna区分开。
141.例如,一些试剂可以选择性地将未甲基化的胞嘧啶残基转化为尿嘧啶、胸腺嘧啶或杂交上与胞嘧啶不同的另一碱基,而甲基化的胞嘧啶残基依然处于未转化状态。又例如,一些试剂可以选择性地切割甲基化的残基,或者选择性地切割未甲基化的残基。
142.如本文所用,“经处理的dna”是指已经用能够区分dna中的未甲基化和甲基化的cpg位点的试剂处理后的dna,即dna中的dna甲基化状态已经改变。
143.在一些实施方式中,步骤(b)的所述试剂在cpg位点选择性地修饰未甲基化的胞嘧啶残基以产生修饰的残基,但并不显著性地修饰甲基化的胞嘧啶残基。
144.在一些实施方式中,步骤(b)的所述试剂包括亚硫酸氢盐试剂。如本文所用,术语“亚硫酸氢盐试剂”是指,例如本技术所公开的可用于区分甲基化和未甲基化的cpg二核苷酸序列的包括亚硫酸氢盐、亚硫酸氢根离子或其任意组合的试剂。在本技术中,用亚硫酸氢盐试剂处理dna也被描述为“亚硫酸氢盐反应”或“亚硫酸氢盐处理”,指的是转化未甲基化的胞嘧啶残基的反应,特别是在亚硫酸氢根离子存在的情况下,核酸中未甲基化的胞嘧啶残基被转化为尿嘧啶碱基、胸腺嘧啶碱基或在杂交行为上与胞嘧啶不同的其他碱基,而其中甲基化的胞嘧啶残基未被显著地转化。换言之,亚硫酸氢盐处理可用于区分甲基化的cpg二核苷酸和未甲基化的cpg二核苷酸。frommer,m.,et al.,proc natl acad sci usa 89(1992)1827-31和grigg,g.,clark,s.,bioessays 16(1994)431-6中详细描述了用于检测甲基化的胞嘧啶残基的亚硫酸氢盐反应。亚硫酸氢盐反应包括脱氨基步骤和脱磺酸基步骤(参见grigg and clark,同上)。“甲基化的胞嘧啶残基未被显著地转化”这一陈述,不排除
非常小的百分比(例如,小于0.1%、小于0.2%、小于0.3%、小于0.4%、小于0.5%、小于0.6%、小于0.7%、小于0.8%、小于0.9%、小于1%、小于2%、小于3%、小于4%、小于5%、小于6%、小于7%、小于8%、小于9%、小于10%、小于11%、小于12%、小于13%、小于14%、小于15%、小于16%、小于17%、小于18%、小于19%、小于20%)的甲基化的胞嘧啶残基被转化为尿嘧啶、胸腺嘧啶或在杂交行为上与胞嘧啶不同的其他碱基,尽管其意在仅仅转化未甲基化的胞嘧啶残基。
145.在例如参考frommer m.,et al.(同上)或grigg and clark(同上)的情况下(它们公开了亚硫酸氢盐处理的基本参数),本领域技术人员知道如何进行亚硫酸氢盐处理,特别是脱氨基步骤和脱磺酸基步骤。孵育时间和温度对脱氨基效率的影响、以及影响dna降解的参数都已公开。
146.在一些实施方式中,所述亚硫酸氢盐试剂选自下组:亚硫酸氢铵、亚硫酸氢钠、亚硫酸氢钾、亚硫酸氢钙、亚硫酸氢镁、亚硫酸氢铝、亚硫酸氢根离子,及其任意组合。在一些实施方式中,所述亚硫酸氢盐试剂是亚硫酸氢钠。在一些实施方式中,亚硫酸氢盐试剂是可商购的,例如,methylcode
tm bisulfite conversion kit、epimark
tm bisulfite conversion kit、epijet
tm bisulfite conversion kit、ezdnamethylation-gold
tm kit等。在一些实施方式中,根据试剂盒的使用说明书进行亚硫酸氢盐反应。
147.在一些实施方式中,步骤(b)的所述试剂选择性地切割未甲基化的残基但不切割甲基化的残基,或者选择性地切割甲基化的残基但不切割未甲基化的残基。
148.在一些实施方式中,步骤(b)的所述试剂是甲基化敏感限制酶(msre)。
149.术语“甲基化敏感限制酶”是指根据其识别位点的甲基化状态而选择性地消化核酸的酶。对于当识别位点未被甲基化或半甲基化时才特异剪切的限制酶来说,当识别位点被甲基化时,不会发生剪切,或以显著降低的效率剪切。对于当识别位点被甲基化时才特异剪切的限制酶来说,当识别位点未被甲基化时,不会发生剪切,或以显著降低的效率剪切。在一些实施方式中,甲基化敏感限制酶的识别序列含有cg二核苷酸(例如cgcg或cccggg)。在一些实施方式中,当该cg二核苷酸中的胞嘧啶在c5碳原子处被甲基化时,甲基化敏感限制酶不进行剪切。
150.在一些实施方式中,所述msre选自下组:hpaii酶、sali酶、酶、scrfi酶、bbei酶、noti酶、smai酶、xmai酶、mboi酶、bstbi酶、clai酶、mlui酶、naei酶、nari酶、pvui酶、sacii酶、hhai酶及其任意组合。
151.使用本领域已知的方法,使用能区分目标区域内的甲基化的cpg二核苷酸和未甲基化的cpg二核苷酸的甲基化敏感限制酶或包含甲基化敏感限制酶的一系列限制酶试剂来确定甲基化,例如但不限于,差异性甲基化杂交(“dmh”)。
152.在一些实施方式中,步骤(a)的dna可以在用甲基化敏感限制酶处理之前被切割。这样的方法是本领域已知的,并且可以既包括物理方式也包括酶促方式。特别优选的是使用一种或多种对甲基化不敏感的并且其识别位点富含at并且不包含cg二核苷酸的限制酶。使用此类酶使得dna片段中的cpg位点和cpg富集区域得以保存。在一些实施方式中,此类限制酶选自msei酶、bfai酶、csp6i15酶、tru1i酶、tru9i酶、maei酶、xspi酶及其任意组合。
153.步骤(c)
154.在根据本技术的方法的步骤(c)中,用预扩增引物池对从步骤(b)获得的经处理的
dna中的目标标记物进行预扩增,其中每个目标标记物的至少一部分被预扩增以获得至少一个预扩增产物。在本技术中,步骤(c)也可以被称为预扩增步骤。
155.对目标标记物进行预扩增的目的之一是增加经处理的dna中的目标标记物的数量。如本文所用,术语“扩增”大体上是指任何能够导致分子或一组相关分子的拷贝数增加的过程。当“扩增”被用于多核苷酸分子时,是指通常从少量多核苷酸开始产生多拷贝的多核苷酸分子或多核苷酸分子的一部分的多份拷贝,其中被扩增的物质(扩增子,pcr扩增子)通常是可被检测到的。多核苷酸的扩增涵盖多个化学和酶促过程。扩增的形式包括通过聚合酶链式反应(逆转录pcr、pcr)、链置换扩增(sda)反应、转录介导扩增(tma)反应、基于核酸序列的扩增(nasba)反应或连接酶链反应(lcr),从一个或几个拷贝的模板rna或dna分子生成多个dna拷贝。
156.如本文所用,术语“目标标记物”是指这样的目的核酸或基因区域:其甲基化水平指示着结直肠瘤(例如,结直肠进展期腺瘤),或指示着结直肠瘤(例如,结直肠进展期腺瘤)形成或形成的风险,或指示着结直肠瘤(例如,结直肠进展期腺瘤)的进展或预后。在本技术中,术语“标记物”和“基因”可以互换使用。术语“标记物”或“基因”应被认为包括其所有转录变体及其所有启动子和调控元件。如本领域技术人员所理解的,已知某些基因在个体之间表现出等位基因变异或单核苷酸多态性(“snp”)。snp包括不同长度的简单的重复序列(例如二核苷酸和三核苷酸重复)的插入和缺失。因此,本技术应被理解为扩展到由任何其他突变、多态性或等位基因变异产生的标记物/基因的所有形式。另外,应当理解,术语“标记物”和“基因”应既包括标记物或基因的正义链序列,也包括标记物或基因的反义链序列。
157.本文所用的术语“目标标记物”被宽泛地解释为既包括1)在生物样品或基因组dna中发现的原始标记物(处于特定的甲基化状态),也包括2)其经过处理的序列(例如亚硫酸氢盐转化后的对应区域或msre处理后的对应区域)。亚硫酸氢盐转化后的对应区域与基因组序列中的目标标记物不同之处在于,一个或多个未甲基化的胞嘧啶残基被转化为尿嘧啶碱基、胸腺嘧啶碱基或在杂交行为上与胞嘧啶不同的其他碱基。经msre处理的对应区域与基因组序列中的目标标记物不同之处在于,该序列在一个或多个msre切割位点处被切割。
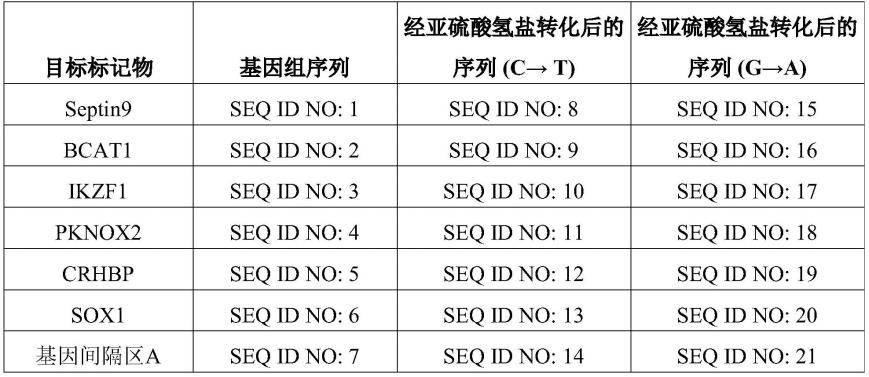
158.在本文所述的方法和试剂盒中,所述目标标记物分为以下两组:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a。其中,每一组中至少预扩增一种目标标记物或每组中至少一种目标标记物的至少一部分被预扩增。
159.在一些实施方式中,所述组(i)中的至少2个或全部3个目标标记物被扩增,和/或,所述组(ii)中的至少2个、至少3个或全部4个目标标记物被扩增。
160.在一些实施方式中,所述组(i)中的septin9与bcat1,bcat1与ikzf1,或septin9与ikzf1被扩增。
161.在一些实施方案中,组(ii)中的pknox2与crhbp,pknox2与sox1,pknox2与基因间隔区a,crhbp与基因间隔区a,或sox1与基因间隔区a被扩增。在一些实施方案中,组(ii)中的pknox2、crhbp和sox1,pknox2、crhbp和基因间隔区a,pknox2、sox1和基因间隔区a或crhbp、sox1和基因间隔区a被扩增。
162.在一些实施方中,用预扩增引物池预扩增从步骤(b)获取的所述经处理的dna中的以下目标标记物:septin9、bcat1和ikzf1、pknox2、crhbp、sox1和基因间隔区a;其中所述目标标记物的至少一部分被预扩增以获得预扩增产物。
163.在本技术中,应该理解的是,标记物/基因既通过引用其名称又通过其染色体坐标来进行描述。所述染色体坐标与2009年2月发布的人类基因组数据库hg19版本一致(在本文中称为“hg19坐标”)。
164.在一些实施方式中,所述的各个目标标记物包括或是:
165.a)如下所示的通过hg19坐标定义的各个区域:septin9,chr17:75276651-75496678;bcat1,chr12:24964295-25102393;ikzf1,chr7:50343720-50472799;pknox2,chr11:125034583-125303285;crhbp,chr5:76248538-76276983;sox1,chr13:112721913-112726020;基因间隔区a,chr10:130082033-130087148;以及上述每个区域的各个起始位点的上游5kb和各个末端位点的下游5kb;或
166.b)亚硫酸氢盐转化后的a)的对应区域;或
167.c)甲基化敏感限制酶(msre)处理后的a)的对应区域。
168.在公共数据库(例如ucsc genome browser、ensemble和ncbi网站)中可以获得如上所述的hg19坐标的特定核苷酸序列,以及每个区域的各个起始位点的上游5kb和各个末端位点的下游5kb。
169.在一些实施方式中,所述各个目标标记物也包括其所有变体。变体包括来自相同区域的、与本文所述的标记物/基因区域具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性(即,具有一个或多个缺失、插入、取代、反向序列等)的核酸序列。因此,本技术内容应理解为延伸至实现相同结果的此类变体,尽管事实上个体间的实际核酸序列具有微小的遗传变异。
170.如本文所用,术语“序列同一性的百分比(%)”是指候选序列的氨基酸(或核酸)残基和参考序列的氨基酸(或核酸)残基进行序列比对后的相同百分比,比对时可以引入间隔(如有必要)以使得相同的氨基酸(或核酸)数目达到最多。
171.换句话说,氨基酸序列(或核酸序列)的序列同一性百分比(%)可以通过用与参考序列相同的氨基酸残基(或碱基)的数目除以候选序列或参考序列中氨基酸残基(或碱基)的总数(以较短者为准)来计算。氨基酸残基的保守取代可以被认为或可以不被认为是相同的残基。可以通过以下方式来确定氨基酸(或核酸)序列同一性的百分比,例如,可以使用公开的工具如blastn、blastp(可在美国国家生物技术信息中心(ncbi)的网站上获得,也可参见altschul s.f.et al.,j.mol.biol.,215:403
–
410(1990);stephen f.et al.,nucleic acids res.,25:3389
–
3402(1997))、clustalw2(可在欧洲生物信息研究所的网站上找到),也可参见higgins d.g.et al.,methods in enzymology,266:383-402(1996);larkin m.a.et al.,bioinformatics(oxford,england),23(21):2947-8(2007))和align或megalign(dnastar)软件。本领域技术人员可以使用所述工具提供的默认参数,或者可以(例如,通过选择合适的算法)定制适合比对的参数。
172.在本文提供的步骤c)中,每个目标标记物的至少一部分被预扩增以获得至少一个预扩增产物。在一些实施方式中,目标标记物的预扩增部分在目标标记物的亚区域内。
173.在不使本技术限于任一理论或作用模式的情况下,据信测量目标标记物的亚区域内的甲基化水平尤其有用,所述亚区域包含在结直肠瘤(例如,结直肠进展期腺瘤)中经常被超甲基化(hypermethylated)的高密度cpg二核苷酸。这一发现使得亚区域成为分析的一个特别有用的目标,因为它既可以简化筛查过程(因为需要分析的dna区域更短且界定更为
清晰),而且进一步地,相比于对目标标记物的整个hg19区域进行分析所获得的结果,从这些亚区域所获得的结果会在超甲基化的存在或不存在这方面提供显著地更为明确的结果。因此,该发现既简化了诊断、筛查/监测过程,又增加了结直肠进展期腺瘤诊断的敏感度和特异性。在一些实施方式中,各个目标标记物的亚区域包含或是:
174.a)如下所示的通过hg19坐标定义的各个区域:
175.目标标记物hg19坐标的亚区域septin9chr17:75369603-75369693bcat1chr12:25102016-25102110ikzf1chr7:50343793-50343896pknox2chr11:125036431-125036547crhbpchr5:76249633-76249729sox1chr13:112758808-112758890基因间隔区achr10:130085033-130085148
176.以及上述每个区域的各个起始位点的上游5kb和各个末端位点的下游5kb;或b)亚硫酸氢盐转化后的a)的对应区域;或c)msre处理后的a)的对应区域。
177.在一些实施方式中,各个目标标记物的亚区域包含或是选自下组的多核苷酸序列:seq id no:1-7、或其亚硫酸氢盐转化后的对应区域、或其msre处理的对应区域。在一些实施方式中,各目标标记物的亚区域的经亚硫酸氢盐转化后的对应区域包含或是选自下组的多核苷酸序列:seq id no:8-21。每个目标标记物的亚区域及经亚硫酸氢盐转化后的对应区域的seq id no列在下表1中,图3中提供了具体序列。
178.表1:各个目标标记物的示例性亚区域
[0179][0180]
在一些实施方式中,septin9的亚区域包含选自下组的序列:seq id no:1、8、15;bcat1的亚区域包含选自下组的序列:seq id no:2、9、16;ikzf1的亚区域包含选自下组的序列:seq id no:3、10、17。
[0181]
在一些实施方式中,pknox2的亚区域包含选自下组的序列:seq id no:4、11、18;sox1的亚区域包含选自下组的序列:seq id no:5、12、19;crhbp的亚区域包含选自下组的序列:seq id no:6、13、20;基因间隔区a的亚区域包含选自下组的序列:seq id no:7、14、21。
[0182]
在一些实施方式中,细胞外游离dna中的目标标记物以不超过1ng、不超过0.9ng、不超过0.8ng、不超过0.7ng、不超过0.6ng、不超过0.5ng、不超过0.4ng、不超过0.3ng、不超过0.2ng、不超过0.1ng、不超过0.09ng、不超过0.08ng、不超过0.07ng、不超过0.06ng、不超过0.05ng、不超过0.04ng、不超过0.03ng、不超过0.02ng或不超过0.01ng的量存在于生物样品中。在一些实施方式中,细胞外游离dna中的目标标记物以不超过0.1%、不超过0.2%、不超过0.3%、不超过0.4%、不超过0.5%、不超过0.6%、不超过0.7%、不超过0.8%、不超过0.9%、不超过1%的百分比存在于生物样品中。在一些实施方式中,细胞外游离dna中的所述目标标记物在生物样品中的浓度低于用于目标标记物的检测分析的灵敏度水平。“检测分析的灵敏度”是对检测分析在分析浓度/量的微小差异之间进行区分的能力的度量。如果存在于生物样品中的细胞外游离dna中的目标标记物低于检测分析的灵敏度水平,那么将无法使用常规方法来定量分析样品中每个目标标记物的甲基化水平。相反,本技术公开的方法在检测样品中极少量的目标标记物方面是实用并优越的。在一些实施方式中,细胞外游离dna中的目标标记物以不超过0.08ng或不超过0.04ng的量存在于生物样品中。
[0183]
在一些实施方式中,步骤(c)的所述至少一个预扩增产物在下一步骤(即步骤(d))之前用稀释剂稀释。在一些实施方式中,稀释剂选自下组:不含核酸酶的水、tris-edta缓冲液和没有pcr抑制作用的任何其他缓冲液。在一些实施方式中,将步骤(c)的所述预扩增的dna直接添加至下一步骤(即步骤(d)),而无需事先稀释。
[0184]
用预扩增引物池预扩增经处理的dna中的所述目标标记物。如本文所用,术语“引物”是指这样的单链寡核苷酸,其能够在合适的条件(例如缓冲液和温度)下,在四种不同的三磷酸核苷和用于聚合的试剂(例如dna聚合酶)的存在下,作为模板指导的dna合成的起始点。在任何给定的情况下,引物的长度取决于例如引物的预期用途,并且通常在15至30个核苷酸的范围内。短的引物分子通常需要较低的温度才能与模板形成足够稳定的杂交复合物。引物不必反映模板的确切序列,但必须足够互补以能与该模板杂交。引物位点是模板上与引物杂交的区域。引物对是一组引物,其包括与待扩增的序列的5’末端杂交的5’正向引物和与待扩增的序列的3’末端的互补链杂交的3’反向引物。本领域技术人员可以基于本领域的公知常识根据待扩增的标记物设计引物(参见,例如pcr primer:a laboratory manual,cold spring harbor laboratories,ny,1995)。此外,一些用于设计在各种各样分析中使用的最佳探针和/或引物的软件包是公开的,例如可从美国马萨诸塞州剑桥市的基因组研究中心(the center for genome research,cambridge,mass.,usa)获得的primer 3。显然,在设计探针或引物时其潜在用途也应考虑在内。例如,设计用于本发明目的的引物可以包括至少一个cpg位点,或者从该引物获得的扩增产物可以包括至少一个cpg位点。用于设计检测dna甲基化状态的引物的工具也是本领域已知的,例如methprimer(li lc and dahiya r.methprimer:designing primers for methylation pcrs.bioinformatics.2002nov;18(11):1427-31)。在本技术中,通过将预扩增引物作为引物池,经处理的dna中的任何目标标记物(目标标记物的每至少一部分或目标标记物的一个亚区域)均可以被预扩增。
[0185]
本文所用的术语“寡核苷酸”定义为包含两个或更多个核苷酸(例如,脱氧核糖核苷酸或核糖核苷酸)的分子,优选为至少5个核苷酸,更优选为至少约10-15个核苷酸,更优选为至少约15至30个核苷酸或更长(例如,寡核苷酸的长度通常少于200个残基(例如,在15
至100个核苷酸之间),但是,如本文所用,该术语也意在覆盖更长的多核苷酸链)。确切的大小将取决于许多因素,而这些因素又取决于寡核苷酸的最终功能或用途。寡核苷酸通常用其长度来指代。例如,具有24个残基的寡核苷酸被称为“24聚体”(24-mer)。寡核苷酸可通过自身杂交或与其他多核苷酸杂交形成二级和三级结构。这样的结构可以包括但不限于双链体、发夹、十字形、弯折和三链体。可以以任何方式产生寡核苷酸,包括化学合成、dna复制、反转录、pcr或其任意组合。
[0186]
如本文所用,术语“互补”是指核苷酸或核酸之间的杂交或碱基配对,例如,双链dna分子的两条链之间,或待测序或扩增的单链核酸上的引物结合位点和寡核苷酸引物之间。互补核苷酸通常是a和t(或a和u),或c和g。当一条链的核苷酸以最佳的方式对齐、并比较、并有适当的核苷酸插入或缺失后,与另一链的至少约80%(通常至少约90%至95%,更优选地为约98%至100%)的核苷酸配对,两条单链rna或dna分子就被称为是互补的。或者,当rna链或dna链在选择性杂交条件下与其互补序列杂交时,互补存在。通常,当在至少14至25个核苷酸的一段上具有至少约65%(优选至少约75%、更优选至少约90%)的互补性时,将发生选择性杂交。参见m.kanehisa,nucleic acids res.12:203(1984),作为参考并入本文。
[0187]
在一些实施方式中,预扩增引物池包含至少一个甲基化特异性引物对。在一些实施方式中,预扩增引物池包含多个甲基化特异性引物对。在一些实施方式中,预扩增步骤通过甲基化特异性pcr(“msp”)进行,甲基化特异性pcr是使用甲基化特异性引物的pcr。herman et al.,methylation-specific pcr:a novelpcrassay for methylation status ofcpgislands.proc natl acad sci usa.1996september 3;93(18):9821-6和united states patent no.6,265,171中已描述了该技术(即msp)。
[0188]
如本文所用,术语“甲基化特异性引物对”是指经特异性设计以识别cpg位点以利用甲基化的差异来扩增经处理的dna中的特定目标标记物的引物对。引物仅作用于具有特定甲基化状态或没有特定甲基化状态的分子。例如,引物可以是寡核苷酸,在严紧条件、中等严紧条件或高度严紧条件下,其可以以甲基化特异性方式与具有甲基化的特定cpg位点特异性杂交,但不能与没有甲基化的特定cpg位点杂交。因此,引物将特异性扩增在特定cpg位点具有甲基化的目标标记物。又例如,引物可以是寡核苷酸,在严紧条件、中等严紧条件或高度严紧条件下,其可以以甲基化特异性的方式与未甲基化的特定的cpg位点特异性杂交,但是不能与甲基化的特定的cpg位点杂交。因此,引物将特异性扩增在特定cpg位点没有甲基化的目标标记物。因此,在本技术中,对在经处理的dna内的至少一个目标标记物的预扩增中使用甲基化特异性引物,可以区分甲基化的和未甲基化的cpg位点。本技术的甲基化特异性引物对包含至少一个与亚硫酸氢盐处理的cpg二核苷酸杂交的引物。因此,所述特异性针对甲基化dna的引物的序列包含至少一个cpg二核苷酸,并且所述特异性针对未甲基化dna的引物的序列在cpg的c位置上包含“t”,和/或在cpg中g位置上包含“a”。
[0189]
在一些实施方式中,所述至少一个甲基化特异性引物对包含一个正向引物和一个反向引物,所述引物均包含寡核苷酸序列,所述寡核苷酸序列与所述目标标记物之一(或目标标记物的亚区域)的至少9个连续核苷酸在严紧条件下、中等严紧条件下或高度严紧条件下杂交,其中所述目标标记物之一(或目标标记物的亚区域)的至少9个连续核苷酸包含至少一个(例如1、2、3、4、5、6、7、8、9、10或更多个)cpg位点。
[0190]
如本文所用,术语“杂交”可以指其中两条单链多核苷酸非共价形式结合以形成稳定的双链多核苷酸的过程。在一个方面,所得的双链多核苷酸可以是“杂交物”或“双链”。“杂交条件”中的盐浓度通常约小于1m,经常小于约500mm并且可以小于约200mm。“杂交缓冲液”包括缓冲盐溶液,例如5%sspe,或本领域已知的其他此类缓冲液。杂交温度可以低至5℃,但是通常高于22℃,并且更为通常地高于约30℃,并且通常超过37℃。杂交通常在严紧条件下进行,即,在该条件下序列将与其目标序列杂交但不与其他非互补序列杂交。严紧条件是取决于序列的,并且在不同情况下有所不同。例如,更长的片段可能需要比短片段更高的杂交温度才能进行特异性杂交。由于其他因素可能会影响杂交的严紧性,包括碱基组成和互补链的长度,有机溶剂的存在以及碱基错配的程度,因此参数组合比单独使用任何一个参数的绝对测量更为重要。通常严紧条件被选定为比特定序列在特定的离子强度和ph下的解链温度(tm)低约5℃。tm可以是双链核酸分子群体中的一半被分离成单链的温度。用于计算核酸的tm的几个方程式是本领域众所周知的。如标准参考文献所示,当核酸在1m nacl水溶液中时,可以通过公式tm=81.5 0.41(%g c)计算出简单估算的tm值(参见例如anderson and young,quantitative filter hybridization,in nucleic acid hybridization(1985))。其他参考文献(例如allawi and santalucia,jr.,biochemistry,36:10581-94(1997))包括替代的计算方法,其计算tm时将结构和环境以及序列特征等考虑在内。
[0191]
通常,杂交物的稳定性是关于离子浓度和温度的函数。通常,杂交反应在较低严紧条件下进行,然后在具有不同但较高严紧性的洗涤液中洗涤。示例性的严紧条件包括ph约7.0至约8.3、温度至少25℃、钠离子(或其他盐)浓度为至少0.01m至不超过1m。例如,5x sspe(750mm nacl,50mm磷酸钠,5mm edta,ph 7.4)和约30℃的温度适合于等位基因特异性杂交,尽管合适的温度取决于杂交区域的长度和/或gc含量。在一个方面,确定错配百分比的“杂交严紧性”可以如下:1)高度严紧性:0.1x sspe,0.1%sds,65℃;2)中等严紧性(也称为中度严紧性):0.2x sspe,0.1%sds,50℃;3)低严紧性:1.0x sspe,0.1%sds,50℃。应当理解,使用替代的缓冲剂、盐和温度可以达到相同的严紧性。例如,中等严紧杂交可以是指允许核酸分子(例如探针)结合互补核酸分子的条件。杂交的核酸分子通常具有至少60%的同一性,包括例如至少70%、75%、80%、85%、90%或95%的同一性。中等严紧条件可以是与下述条件达到同等效果的条件:42℃,50%甲酰胺,5x denhardt溶液,5x sspe,0.2%sds杂交,然后用42℃,0.2x sspe,0.2%sds进行洗涤。高度严紧条件可以通过如下条件提供,例如,42℃,50%甲酰胺,5x denhardt溶液,5x sspe,0.2%sds杂交,然后65℃,0.1x sspe和0.1%sds中洗涤。低严紧性杂交可以是与下述条件达到同等效果的条件:22℃,10%甲酰胺,5x denhardt溶液,6x sspe,0.2%sds杂交,然后在1x sspe,0.2%sds中于37℃洗涤。denhardt的溶液包含1%聚蔗糖,1%聚乙烯吡咯烷酮和1%牛血清白蛋白(bsa)。20x sspe(氯化钠,磷酸钠,edta)包含3m氯化钠、0.2m磷酸钠和0.025m edta。其他合适的中等严紧性和高度严紧性杂交缓冲液和条件是本领域技术人员众所周知的,并且描述于例如sambrook et al.,molecular cloning:a laboratory manual,2nd ed.,cold spring harbor press,plainview,n.y.(1989)和ausubel et al.,short protocols in molecular biology,4th ed.,john wiley&sons(1999)。
[0192]
在一些实施方式中,预扩增引物池还包含用于扩增对照标记物的对照引物对。通
常,对照标记物是具有已知特征(例如,序列已知,每个细胞的拷贝数已知)的核酸,用于与实验目标(例如,浓度未知的核酸)进行比较。对照可以是内源的,优选为不变的基因,可以将分析中的实验核酸或目标核酸相对其进行标准化。此类因为样品间差异而标准化的对照可能发生在例如样品处理,分析效率等,并且允许精确的样品间数据比较,定量分析扩增效率和偏差。
[0193]
在一些实施方式中,所述对照标记物选自下组:actb、gapdh、微管蛋白、aldoa、pgk1、ldha、rps27a、rpl19、rpl11、arhgdia、rpl32、c1orf43、chmp2a、emc7、gpi、psmb2、psmb4、rab7a、reep5、snrpd3、vcp和vps29。在一些实施方式中,对照引物对的序列如下表2的seq id no:44和45所示。
[0194]
在一些实施方式中,septin9的甲基化特异性引物对为seq id no:22/23;bcat1的甲基化特异性引物对为seq id no:24/25;ikzf1的甲基化特异性引物对为seq id no:26/27;pknox2的甲基化特异性引物对为seq id no:28/29;crhbp的甲基化特异性引物对为seq id no:30/31;sox1的甲基化特异性引物对为seq id no:32/33;基因间隔区a的甲基化特异性引物对为seq id no:34/35。在一些实施方案中,所述甲基化特异性引物对包含如下表2所示的选自下组的至少一对核苷酸序列:seq id no:22/23,24/25,26/27,28/29,30/31,32/33和34/35。优选地,所述甲基化特异性引物对包括seq id no:22/23,24/25和26/27中的至少一对引物对,以及seq id no:28/29,30/31,32/33和34/35中的至少一对引物对。优选地,所述甲基化特异性引物对包含:seq id no:22/23,24/25,26/27,28/29,30/31,32/33和34/35。本技术中使用的引物对的序列号以“seq id no:n/m”的形式表示。例如,seq id no:22/23是指分别具有如下表2所示的seq id no:22和seq id no:23所示的核酸序列的引物对。
[0195]
表2
[0196]
[0197][0198]
在一些实施方式中,在步骤(c)中,所述目标标记物在一个或多个封闭寡核苷酸的存在下被扩增。此类封闭寡核苷酸的用途已经被描述于yu et al.,biotechniques 23:714-720,1997。封闭序列与预扩增引物对同时与经处理的dna杂交。目标标记物的预扩增终止于封闭序列的5’位置,使得目标标记物的预扩增在与封闭序列互补的序列存在的情况下被抑制。封闭序列可以被设计为以甲基化状态特异性方式与经处理的dna杂交。例如,为了检测未甲基化核酸群体中的甲基化核酸,可以通过使用在相关位置包含“cpa”或“tpa”的封闭序列来抑制在所述位置未甲基化的核酸的扩增,与之对应,如果需要抑制甲基化核酸扩增,则使用“cpg”。
[0199]
对于使用了封闭寡核苷酸的pcr方法,对聚合酶介导的扩增的有效干扰要求封闭寡核苷酸不能被聚合酶延长。优选地,这是通过使用封闭物来实现的,所述封闭物为3'-脱氧寡核苷酸或在3'位置衍生的具有“游离”羟基以外的寡核苷酸。例如,3'-o-乙酰基寡核苷酸是优选的封闭物分子类别的代表。
[0200]
另外,聚合酶介导的封闭寡核苷酸的分解应当被阻止。优选地,此类阻止包括使用缺乏5'-3'核酸外切酶活性的聚合酶,或使用例如在其5'-末端具有硫醇盐桥的修饰的封闭寡核苷酸,使封闭物分子抗核酸酶。特定的应用可能不需要对封闭物进行5'修饰。例如,如果封闭物结合位点和引物结合位点重叠,因而阻止了引物的结合(例如使用过量的封闭物),封闭寡核苷酸的降解将被基本上阻止。这是因为聚合酶不会将引物延伸至、并超过封闭物(沿5'-3'方向),该过程通常会导致杂交的封闭寡核苷酸降解。
[0201]
出于本技术的目的并且也如本文所实施,特别优选的封闭物/pcr实施方式包括使用肽核酸(pna)寡聚物作为封闭寡核苷酸。此类pna封闭低聚物是理想的,因为它们既不会被分解也不会被聚合酶延伸。
[0202]
在一些实施方式中,所述至少一个目标标记物是用dna聚合酶预扩增的。
[0203]
如本文所用,术语“dna聚合酶”是指催化三磷酸单脱氧核糖核苷酸(dntp)合成多聚脱氧核糖核苷酸的酶,其完成在dna复制、修复以及在某些情况下细胞分化中的最基本功能。
[0204]
原核生物中的dna聚合酶的实例包括dna聚合酶i、dna聚合酶ii、dna聚合酶iii、dna聚合酶iv和dna聚合酶v。已知在大肠杆菌(e.coli)中有dna聚合酶i、ii和iii。dna聚合酶iii在基因组复制中似乎是最重要的。dna聚合酶i的重要性在于其可以在增长的链的末端删除掉未配对的碱基。逆转录病毒具有独特的dna聚合酶,即,逆转录酶,它使用rna模板合成dna。对于真核生物,dna聚合酶的实例是聚合酶α、β、λ、γ、σ、μ、δ、ε、η、ι、κ、ζ、θ和rev1。动物细胞的dna聚合酶负责dna在细胞核和线粒体中的复制。
[0205]
在预扩增步骤中使用的pcr试剂可以是任何可商购的pcr混合物(例如kapa2g fast multiplexpcrkit,universal probe qpcr master mix,epitect methylightpcrkit等),其用于扩增经处理的dna。或者,本领域技术人员可以在实验室中制备包括mg
2
、dntp、dna聚合酶等的pcr试剂。本领域技术人员还可以根据实际需要选择合适的pcr反应体系和pcr反应条件。在一些实施方式中,步骤(c)的预扩增包括5至30个反应循环,其中每个循环包括在85~99℃下反应5秒到5分钟,然后在40~80℃下反应5秒到5分钟。在一些实施方式中,步骤(c)的预扩增包括10至20个反应循环,其中每个循环包括在90~99℃下反应15秒到2分钟,然后在45~60℃下反应30秒到3分钟。在一些实施方式中,步骤(c)的预扩增包括15个反应循环,其中每个循环包括在95℃下反应30秒,然后在56℃下反应60秒。
[0206]
步骤(d)
[0207]
在根据本技术的方法的步骤(d)中,每个目标标记物的甲基化水平分别基于其在步骤(c)中获得的各个预扩增产物而进行定量分析。在本技术中,步骤也可以被命名为定量分析步骤。
[0208]
如本文所用,术语“甲基化状态”指的是dna区域内的一个特定的核苷酸或多个核苷酸的甲基化的存在、不存在和/或甲基化的数量。特定dna序列的甲基化状态(例如,本文所述的目标标记物)可以指示序列中每个碱基的甲基化状态,或者可以指示序列中的碱基对的子集的甲基化状态(例如,胞嘧啶残基的甲基化状态或一个或多个特定的限制酶识别序列的甲基化状态),或者可以指示序列中区域甲基化密度的信息,虽然不能提供甲基化发生在序列中何处的精确信息。甲基化状态可以任选地由“甲基化水平”来表示或指示。甲基化水平可以通过例如定量分析在用甲基化敏感性限制性酶进行限制性消化后存在的完整dna的量来确定。在该例中,如果使用定量pcr对dna中的特定序列进行定量分析,模板dna的量大约等于模拟处理的对照则表明该序列未高度甲基化,而模板量明显少于模拟处理的样品中的模板量则表明该序列中存在甲基化dna。因此,如上述例子中的甲基化水平代表着甲基化状态,并且因此可以用作甲基化状态的定量指标。当需要将样品中序列的甲基化状态与阈值水平进行比较时,这尤其有用。
[0209]
在dna序列内一个或多个特定的cpg甲基化位点(每个具有两个cpg二核苷酸序列)的甲基化状态包括“未甲基化”、“完全甲基化”和“半甲基化”。术语“半甲基化”是指双链dna其中仅其一条链被甲基化的甲基化状态。术语“超甲基化”是指,相对于正常对照dna样品中的相应的cpg二核苷酸处5-甲基胞嘧啶的数量,在检测的dna样品的dna序列中一个或多个cpg二核苷酸处5-甲基胞嘧啶的数量增加所对应的平均甲基化状态。一个残基的甲基化状态可以是定性读数或定量读数,例如通过甲基化水平来表示的。在本技术中,术语“甲基化状态”和“甲基化水平”可以互换使用。根据本技术,可以同时确定一个以上的不同甲基化水
平。
[0210]
如本文所述,每个目标标记物的甲基化水平分别基于步骤(c)获得的其各自的预扩增产物而进行定量分析。dna序列(例如目标标记物)内的一个或多个cpg二核苷酸序列的甲基化水平/状态可以通过本领域中已知的各种分析方法来确定。
[0211]
在一些实施方式中,步骤(d)的所述定量分析是通过以下方式进行:聚合酶链式反应(例如实时聚合酶链式反应、数字聚合酶链式反应)、核酸测序、基于质量的分离(例如电泳法、质谱法)或靶标捕获(例如杂交、微阵列)。
[0212]
在一些实施方式中,基于预扩增的dna通过使用msp(参见herman,同上)分别定量分析每个目标标记物的甲基化水平。例如,通过使用在中等和/或高度严紧条件下与未转化序列特异性杂交的一种或多种引物,仅当模板在cpg位点包含甲基化胞嘧啶时才产生扩增产物。
[0213]
在一些实施方式中,步骤(d)的定量分析通过实时pcr进行。实时pcr的非限制性实例包括cottrell et al.,nucl.acids res.32:e10,2003描述的heavymethyl
tm
pcr;eads et al.,cancer res.59:2302-2306,1999描述的methylight
tm
pcr;rand et al.,nucl.acids res.33:e 127,2005描述的headloop pcr。
[0214]
如本文所用,术语“heavymethyl
tm pcr”是指本领域公认的一种实时pcr技术,其中一个或多个不可延伸性核酸(例如,寡核苷酸)封闭物以甲基化特异性方式与亚硫酸氢盐处理的核酸结合(即,封闭物在中等至高等严紧条件下与未突变的dna特异性结合)。使用一种或多种引物进行扩增反应,所述引物可以任选地是甲基化特异性的,但旁侧分布一个或多个封闭物。在未甲基化的核酸(即突变的dna)存在的情况下,封闭物结合并且无pcr产物产生。使用基本上像例如holland et al.,proc.natl.acad.sci.usa,88:7276-7280,1991所述的taqman
tm
分析方法,样品中核酸的甲基化水平得以确定。
[0215]
如本文所用,术语“methylight
tm
pcr”是指基于本领域公认的一种基于荧光的实时pcr技术,其中采用了称为taqman
tm
探针的双标记荧光寡核苷酸探针,并且被设计为可同位于正向和反向扩增引物之间的富含cpg的序列杂交。所述的taqman
tm
探针包含一个荧光“报告因子部分”和“淬灭剂部分”共价结合到与taqman
tm
寡核苷酸的核苷酸相连的接头部分(例如,亚磷酰胺)。在pcr扩增过程中,与富含cpg的序列杂交的taqman
tm
探针被taq聚合酶的5’核酸酶活性切割,从而在pcr反应过程中产生以实时方式检测的信号。在该方法中,可以将分子信标用作可检测的探针,并且该系统不依赖于所使用的dna聚合酶的5
’‑3’
核酸外切酶活性(参见mhlanga and malmberg,methods 25:463-471,2001)。
[0216]
如本文所用,术语“headloop pcr”是指本领域公认的一种实时pcr,其选择性地扩增目标核酸,但是通过将3’茎环延伸形成不能进一步提供扩增模板的发卡结构来抑制非扩增目标变体的扩增。
[0217]
在一些实施方式中,所述实时pcr是多重实时pcr。
[0218]
如本文所用,术语“多重”可指,通过使用一个以上的标记物,每个标记物具有至少一个不同的检测特征,例如荧光特征(例如,激发波长、发射波长、发射强度、fwhm(半峰高处的全宽度)或荧光寿命)或独特的核酸或蛋白序列特征,可以同时对多个标记物(例如多个核酸序列)的存在和/或量进行测定的分析或其他分析方法。
[0219]
在一些实施方式中,步骤(d)的定量分析通过核酸测序进行。核酸测序的示例性方
法是本领域已知的,参见,例如frommer et al.,proc.natl.acad.sci.usa 89:1827-1831,1992;clark et al.,nucl.acids res.22:2990-2997,1994。例如,通过将未使用亚硫酸氢盐处理的样品获得的序列或目标区域的已知核苷酸序列与使用亚硫酸氢盐处理的样品获得的序列进行比较,有助于鉴定dna序列中甲基化胞嘧啶。与未处理的样品相比,在亚硫酸氢盐处理的样品中的任意胞嘧啶位点检测到的胸腺嘧啶残基都可以认为是由亚硫酸氢盐处理而引起的突变,即该位点存在甲基化的胞嘧啶。
[0220]
用于测序dna的方法是本领域已知的,并且包括例如双脱氧链终止法或maxam-gilbert法(参见sambrook et al.,molecular cloning,a laboratory manual(2
nd ed.,cshp,new york 1989))、焦磷酸测序(参见uhlmann et al.,electrophoresis,23:4072-4079,2002)、固相焦磷酸测序(参见landegren et al.,genome res.,8(8):769-776,1998)、固相微测序(参见例如,southern et al.,genomics,13:1008-1017,1992)、采用fret的微测序(参见例如,chen and kwok,nucleic acids res.25:347-353,1997)、连接法测序或超深度测序(参见marguiles et al.,nature 437(7057):376-80(2005))。
[0221]
在一些实施方式中,步骤(d)的所述定量分析通过基于质量的分离(例如电泳、质谱法)进行。
[0222]
例如,甲基化胞嘧啶残基的存在可以通过联合亚硫酸氢盐限制分析法(cobra)进行检测,基本如xiong and laird,nucl.acids res.,25:2532-2534,2001所述。这种方法利用了在使用可以选择性地突变未甲基化的胞嘧啶残基的化合物(例如,亚硫酸氢盐)处理之后,在甲基化和未甲基化的核酸之间的限制酶识别位点的差异。例如,限制性核酸内切酶taq1切割序列tcga,在对未甲基化核酸进行亚硫酸氢盐处理后该序列将是ttga,因此将不被切割。然后使用本领域已知的检测手段例如电泳和/或质谱法,检测消化的和/或未消化的核酸。
[0223]
又例如,在用选择性突变未甲基化胞嘧啶残基的化合物处理后,基于核苷酸序列和/或二级结构的差异,使用不同的技术来检测扩增产物中核酸差异,例如甲基化特异性单链构象分析(ms-ssca)(bianco et al.,hum.mutat.,14:289-293,1999)、甲基化特异性变性梯度凝胶电泳(ms-dgge)(abrams and stanton,methods enzymol.,212:71-74,1992)和甲基化特异性变性高效液相色谱(ms-dhplc)(deng et al.,chin.j.cancer res.,12:171-191,2000)。
[0224]
在一些实施方式中,步骤(d)的定量分析是通过靶标捕获(例如杂交、微阵列)来进行的。
[0225]
通过杂交的合适的检测方法是本领域已知的,例如southern、斑点印迹、狭缝印迹或其他核酸杂交方式(kawai et al.,mol.cell.biol.14:7421-7427,1994;gonzalgo et al.,cancer res.57:594-599,1997)。在一些实施方式中,用于杂交分析的探针被可检测地标记。在一些实施方式中,用于杂交分析的基于核酸的探针是未标记的。这种未标记的探针可以固定在固体载体如微阵列上,并且可以与被可检测地标记的目标核酸分子杂交。
[0226]
微阵列的一个实例是甲基化特异性微阵列,其可用于区分具有转化的胞嘧啶残基的序列和具有未转化的胞嘧啶残基的序列(参见adorjan et al.,nucl.acids res.,30:e21,2002)。基于杂交的分析还可被用于用甲基化敏感的限制酶处理后的核酸。
[0227]
又例如,可通过寡核苷酸探针确定dna序列内cpg二核苷酸序列的甲基化状态,所
述寡核苷酸探针与pcr扩增引物同时与亚硫酸氢盐处理的dna杂交(其中所述引物可以是甲基化特异性引物或标准引物)。
[0228]
在一些实施方式中,步骤(d)在检测试剂的存在下进行。如本文所用,术语“检测试剂”是在定量分析步骤中用于检测核酸的存在、不存在或量的试剂。
[0229]
本领域已知的各种检测试剂在本技术中都可使用。在一些实施方式中,检测试剂选自下组:荧光探针、嵌入染料、生色团标记的探针、放射性同位素标记的探针和生物素标记的探针。
[0230]
优选地,用于检测septin9的探针为seq id no:36;检测bcat1的探针为seq id no:37;用于检测ikzf1的探针为seq id no:38;用于检测pknox2的探针为seq id no:39和40;用于检测crhbp的探针为seq id no:41;用于检测sox1的探针为seq id no:42;用于检测基因间隔区a的探针为seq id no:43。
[0231]
在一些实施方式中,所述探针至少包括选自下组的一条或多条核苷酸序列:seq id no:36-38、seq id no:41-43、以及seq id no:39和/或seq id no:40。优选地,所述探针包括seq id no:36-38中的至少一条、至少两条或全部三条核苷酸序列和seq id no:39和/或40以及seq id no:41-43中的至少一条、至少两条或至少三条核苷酸序列。在一些实施方式中,所述探针包括seq id no:36-38和41-43所示的核苷酸序列,以及seq id no:39和/或40所示的核苷酸序列。
[0232]
在一些实施方式中,对照标记物为actb,其示例性的探针的核苷酸序列如seq id no:58所述。
[0233]
在一些实施方式中,荧光探针的5’端标记有荧光染料(例如fam、hex/vic、tamra、texas red或cy5),3’端标记有猝灭剂(例如bhq1、bhq2、bhq3、dabcyl或tamra)。
[0234]
标记可以通过直接或间接方法来完成。直接标记涉及将标记直接(共价或非共价)偶联至试剂上。间接标记涉及第二试剂与第一试剂的结合(共价或非共价)。第二试剂应与第一试剂特异性结合。所述第二试剂可以与合适的标记偶联和/或第二试剂是可与第二试剂结合的第三试剂的目标(受体)。使用二级、三级甚至更高阶的试剂通常会增加信号强度。合适的二级和高级试剂可以包括抗体、二级抗体和众所周知的链霉亲和素-生物素系统(vector laboratories,inc.)。试剂或底物也可以被本领域中已知的一个或多个标签“标记”。
[0235]
在一些实施方式中,步骤(d)的所述定量分析包含使用定量引物对和dna聚合酶对步骤(c)的预扩增产物进行扩增,其中所述预扩增产物通过扩增产生扩增产物。
[0236]
如本文所用,术语“定量引物对”是指在定量分析步骤中使用的一个或多个引物对。
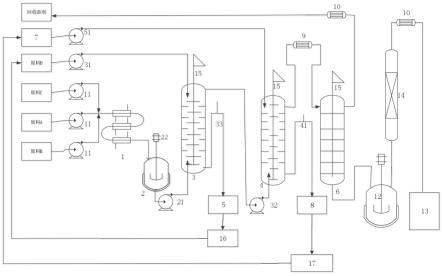
[0237]
在一些实施方式中,步骤(d)使用的所述定量引物对能够与步骤(c)的所述预扩增产物的至少9个连续核苷酸在严紧条件下、中等严紧条件下或高度严紧条件下杂交。在一些实施方式中,步骤(d)中所使用的定量引物对与在步骤(c)的预扩增引物池中的甲基化特异性引物对相同。
[0238]
在一些实施方式中,步骤(d)中使用的定量引物对被设计为扩增步骤(c)的所述预扩增产物内的至少一部分,即步骤(c)和步骤(d)被设计为巢式pcr。
[0239]
巢式pcr是pcr的一种改进,旨在提高灵敏度和特异性。巢式pcr涉及使用两个引物
组和两个连续的pcr反应。进行第一轮扩增以产生第一扩增子,并使用一个引物对进行第二轮扩增,其中一个或两个引物与由初始引物对界定的区域内的位点退火,即第二个引物对被认为是“嵌套”在第一对引物中。以这种方式,不包含正确内部序列的来自第一次pcr反应的背景扩增产物在第二次pcr反应中不再被进一步扩增。
[0240]
在一些实施方式中,步骤(d)的定量分析包括基于所述预扩增产物中的多个cpg二核苷酸、tpg二核苷酸或cpa二核苷酸的存在或水平,确定每个目标标记物的甲基化水平。在一些实施方式中,步骤(d)的所述定量分析包括基于所述预扩增产物中一个或多个cpg二核苷酸的存在或水平来确定胞嘧啶残基的甲基化水平。在一些实施方式中,步骤(d)的所述定量分析包括基于所述预扩增产物中一个或多个tpg二核苷酸的存在或水平来确定胞嘧啶残基的甲基化水平。在一些实施方式中,步骤(d)的所述定量分析包括基于所述预扩增产物中cpa二核苷酸的存在来确定胞嘧啶残基的甲基化水平。
[0241]
在一些实施方式中,定量分析步骤是通过将步骤(c)的所述预扩增产物分为多个组分来进行的。在一些实施方式中,对多个组分进行多个不同的定量分析实验,其中在多个组分之一中定量分析所述预扩增产物(如果存在于所述组分中的话)的不同组合。在一些实施方式中,定量分析每个组分中的对照标记物。
[0242]
步骤(e)
[0243]
在个体中诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后的方法的步骤(e)中,由步骤(d)的获得的目标标记物的甲基化水平分别与相应的参考水平进行比较,其中,组(i)所述的目标标记物相对于其相应的参考水平具有更高的甲基化水平、且组(ii)所述的目标标记物相对于其相应的参考水平具有较低的甲基化水平表明所述个体患有结直肠进展期腺瘤,或者所述个体有结直肠进展期腺瘤形成或形成的风险,或者所述个体有结直肠进展期腺瘤发展或发展的可能性增加,或者所述个体有结直肠进展期腺瘤预后不良或预后不良的风险。
[0244]
根据本技术的方法的步骤(e)也可以被称为比较步骤。
[0245]
本文所用的术语“比较”是指分别对检测的生物样本所含有的通过定量分析步骤获取的目标标记物的甲基化水平与其相应的参考水平进行对比。应当理解,本文所用的术语是指相应参数或值的比较,例如,将绝对量与绝对参考量进行比较,将浓度与参考浓度进行比较,或从检测的样本中获得的强度信号同参考样本的同类型的强度信号进行比较。可以通过手动或计算机辅助进行比较。对于计算机辅助进行的比较,可以将所确定的量的值与通过计算机程序存储在数据库中的合适参考的值进行比较。该计算机程序可以进一步评估比较的结果,并以合适的输出格式自动提供期望的评估。基于定量分析步骤中每个目标标记物的甲基化水平与相应参考水平的比较,可以识别出患有结直肠进展期腺瘤、或者有结直肠进展期腺瘤形成或形成的风险、或者有结直肠进展期腺瘤发展或发展的可能性增加、或者有结直肠进展期腺瘤预后不良或预后不良的风险的个体。
[0246]
如本文所用,术语“参考水平”是指将个体纳入或排除结肠直肠进展期腺瘤或结肠直肠进展期腺瘤的形成或形成的风险的阈值水平。
[0247]
本文所述的“相对于其相应的参考水平具有更高的甲基化水平”指组(i)中所检测的目标标记物的甲基化水平至少是其相应参考水平的1.1、1.2、1.3、1.4、1.5、2、3、4、5、6、7、8、9、10倍或更多倍。本文所述的“相对于其相应的参考水平具有较低的甲基化水平”指组
(ii)所检测的目标标记物的甲基化水平是其相应参考水平的98%、95%、93%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%甚至更低。在本技术中,为了在个体中诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后,不需要组(i)的每个目标标记物的甲基化水平均高于其相应的参考水平以及组(ii)的每个目标标记物的甲基化水平均低于其相应的参考水平。准确的说,如果在定量分析步骤中进行定量分析的每一组中至少有一种目标标记物的甲基化水平等于或高于其相应的参考水平就足够了。
[0248]
目标标记物的甲基化的参考水平可以源自一个或多个参考样品,其中参考水平获自与检测目的样品的实验平行进行的实验。或者,可以在数据库中获得参考水平,该数据库包括来自一个或多个参考样品或疾病参考样品的数据、标准或水平的集合。在一些实施方式中,此类数据、标准或水平的集合被标准化,以便可用于与来自一个或多个样品的数据进行比较的目的。“标准化”是将测量原始数据转换为可以直接与其他标准化数据进行比较的数据的过程。标准化被用于克服因不同的分析方法里因素不同而导致的、分析方法特异性的误差,例如上样量的不同、结合效率的不同、检测灵敏度的不同和其他各类的误差。
[0249]
在一些实施方式中,参考数据库包括来自一个或多个参考样品的目标标记物和/或其他实验室和临床数据的甲基化水平。在一些实施方式中,参考数据库包括目标标记物的甲基化水平,其各自被标准化为在与参考样品相同的条件下检测的对照标志物的甲基化水平的百分比。为了与目标标记物的如此标准化甲基化水平进行比较,测试样品的目标标记物的甲基化水平也被测量并计算为在与测试样品相同的条件下检测的对照标记物的甲基化水平的百分比。
[0250]
在一些实施方式中,通过汇总获自健康个体和/或非肿瘤个体(即已知没有肿瘤的个体)的参考样品的参考水平数据来建立参考数据库。在一些实施方式中,通过汇总获自正在接受结直肠瘤治疗的个体的参考样品的参考水平数据来建立参考数据库。在一些实施方式中,通过汇总获自结直肠瘤不同阶段的个体的参考样品的数据来建立参考数据库,所述结直肠瘤不同阶段是通过例如目标标记物的不同的甲基化水平来证明的。
[0251]
本领域技术人员可以根据期望的灵敏度和特异性来选择参考水平。确定合适的参考水平的手段是本领域技术人员已知的,例如参考水平可以从临床研究中收集的数据来确定。
[0252]
在一些实施方式中,步骤(e)的参考水平是基于从患有结直肠进展期腺瘤或具有患结直肠进展期腺瘤风险的一组个体中获取的临床样本和从未患结直肠进展期腺瘤或不具有患结直肠进展期腺瘤风险的一组个体中获取的临床样本来确定的。
[0253]
本领域技术人员可以基于各种因素,例如年龄、性别、病史、家族史、症状等,来确定个体是否患结直肠进展期腺瘤或具有患结直肠进展期腺瘤的风险。
[0254]
在一些实施方式中,用循环阈值(即ct值)来表示目标标记物的甲基化水平和参考水平。如本文所用,术语“ct值”是指在背景信号以上可以检测到pcr产物的荧光的循环数。ct值与样品中目标标记物的数量成反比,即ct值越低,样品中目标标记物的数量就越大。
[0255]
例如,在个体中诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后的方法的步骤(e)中,组(i)所述目标标记物中至少一个目标标记物的ct值相对于其相应的参考ct值低,且组(ii)所述目标标记物中至少一
个目标标记物的ct值相对于其相应的参考ct值高,表明所述个体患有结直肠进展期腺瘤,或者所述个体有结直肠进展期腺瘤形成或形成的风险,或者所述个体有结直肠进展期腺瘤发展或发展的可能性增加,或者所述个体有结直肠进展期腺瘤预后不良或预后不良的风险。在一些实施方式中,如果组(i)所述目标标记物中至少一个目标标记物ct值比其对应的参考ct值低2-10个循环(例如2、3、4、5、6、7、8、9、10个循环)且组(ii)所述目标标记物中至少一个目标标记物的ct值相对于其相应的参考ct值高2-10个循环(例如2、3、4、5、6、7、8、9、10个循环),则确定所述个体患有结直肠进展期腺瘤,或者所述个体有结直肠进展期腺瘤形成或形成的风险,或者所述个体有结直肠进展期腺瘤发展或发展的可能性增加,或者所述个体有结直肠进展期腺瘤预后不良或预后不良的风险。
[0256]
如本文所用,术语“可能性增加”,是指与从中获得参考样品的个体相比,在个体发展结直肠进展期腺瘤或有结直肠进展期腺瘤预后不良的可能性水平方面总体增加5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、85%、90%、95%、96%、97%、98%、99%或更高。
[0257]
2.试剂盒
[0258]
在另一方面,本技术还提供了一种用于诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后的试剂盒,其包含:
[0259]
(a)处理dna的第一试剂,其中所述第一试剂能够区分dna中的甲基化和未甲基化的cpg位点;
[0260]
(b)第二试剂,所述第二试剂用于定量分析目标标记物中每个目标标记物的甲基化水平;其中,所述目标标记物包括以下两组目标标记物中每一组目标标记物中的至少一种:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a;和任选的
[0261]
(c)第一引物池,所述第一引物池包含用于预扩增以下两组目标标记物中每一组目标标记物中的至少一种目标标记物的引物对:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a,其中所述引物对可与被所述第一试剂处理后的所述目标标记物的目标序列的至少9个连续核苷酸在严紧条件下、中等严紧条件下或高度严紧条件下杂交,其中所述目标序列包含至少一个cpg位点。
[0262]
优选地,所述试剂盒包含:
[0263]
(a)处理dna的第一试剂,其中所述第一试剂能够区分dna中的甲基化和未甲基化的cpg位点;
[0264]
(b)第一引物池,所述第一引物池包含用于预扩增以下两组目标标记物中每一组目标标记物中的至少一种目标标记物的引物对:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a,其中所述引物对可与被所述第一试剂处理后的所述目标标记物的目标序列的至少9个连续核苷酸在严紧条件下、中等严紧条件下或高度严紧条件下杂交,其中所述目标序列包含至少一个cpg位点;
[0265]
(c)第二试剂,所述第二试剂用于定量分析被所述第一引物池预扩增的所述目标标记物中每个目标标记物的甲基化水平。
[0266]
在一些实施方式中,所述第二试剂包含第二引物池,所述第二引物池包含多个定量引物对,所述定量引物对能够与被所述第一引物池预扩增的所述目标序列的至少9个连续核苷酸在严紧条件下、中等严紧条件下或高度严紧条件下杂交。
[0267]
在一些实施方式中,所述第二引物池中的至少一个定量引物对和所述第一引物池中的至少一个引物对相同。在一些实施方式中,所述第二引物池中的定量引物对被设计为用于扩增被所述第一引物池预扩增的所述目标序列内的至少一部分。在一些实施方式中,所述第一引物池包含至少一个甲基化特异性引物对。
[0268]
在一些实施方式中,所述第一引物池和所述第二引物池被包装在单一容器内或被包装在独立容器内。在一些实施方式中,所述试剂盒进一步包含一个或多个封闭寡核苷酸。
[0269]
在一些实施方式中,所述试剂盒进一步包含检测试剂。在一些实施方式中,所述检测试剂选自下组:荧光探针、嵌入染料、生色团标记的探针、放射性同位素标记的探针和生物素标记的探针。在一些实施方式中,所述探针至少包括选自下组的一条或多条核苷酸序列:seq id no:36-38、seq id no:41-43、以及seq id no:39和/或seq id no:40。优选地,所述探针包括seq id no:36-38中的至少一条、至少两条或全部三条核苷酸序列和seq id no:39和/或40以及seq id no:41-43中的至少一条、至少两条或至少三条核苷酸序列。在一些实施方式中,所述探针包括seq id no:36-38和41-43所示的核苷酸序列,以及seq id no:39和/或40所示的核苷酸序列。在一些实施方式中,所述荧光探针的5’端标记有荧光染料(例如fam、hex/vic、tamra、texas red或cy5),3’端标记有猝灭剂(例如bhq1、bhq2、bhq3、dabcyl、tamra或lowa black dark quenchers)。
[0270]
在一些实施方式中,所述试剂盒进一步包含dna聚合酶和/或适合存放从所述个体中获取的所述生物样品的容器。在一些实施方式中,所述试剂盒进一步含使用说明书和/或对试剂盒检测结果的解释。
[0271]
在一些实施方式中,所述试剂盒可包含包装在独立的容器中的反应缓冲液,该反应缓冲液针对由聚合酶介导的引物延伸(例如pcr)进行了优化。优选的是这样的试剂盒:其进一步包括容器,所述容器适合容纳用于在个体的生物样品中确定下组(i)中的至少一个(例如2、3、4或5个)目标标记物以及下组(ii)中的至少一个(例如2、3或4个)目标标记物的甲基化的装置:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a。
[0272]
在一些实施方式中,所述第一试剂包括亚硫酸氢盐试剂或甲基化敏感限制酶(msre)。在一些实施方式中,所述亚硫酸氢盐试剂选自下组:亚硫酸氢铵、亚硫酸氢钠、亚硫酸氢钾、亚硫酸氢钙、亚硫酸氢镁、亚硫酸氢铝、亚硫酸氢根离子,及其任意组合。在一些实施方式中,亚硫酸氢盐试剂是亚硫酸氢钠。在一些实施方式中,所述msre选自下组:hpaii酶、sali酶、酶、scrfi酶、bbei酶、noti酶、smai酶、xmai酶、mboi酶、bstbi酶、clai酶、mlui酶、naei酶、nari酶、pvui酶、sacii酶、hhai酶及其任意组合。
[0273]
在一些实施方式中,所述第一引物池包含至少一个甲基化特异性引物对,用于预扩增选自下组(i)的至少一个目标标记物中的至少一个目标序列:(i)septin9、bcat1和ikzf1。在一些实施方式中,所述第一引物池包含至少一个甲基化特异性引物对,用于预扩增选自下组(ii)的至少一个目标标记物中的至少一个目标序列:pknox2、sox1、crhbp和基因间隔区a。在一些实施方式中,所述第一引物池包含至少两个甲基化特异性引物对,其中一个用于预扩增选自下组(i)的至少一个目标标记物中的至少一个目标序列:(i)septin9、bcat1和ikzf1,另一个用于预扩增选自下组(ii)的至少一个目标标记物中的至少一个目标序列:pknox2、sox1、crhbp和基因间隔区a。
[0274]
在一些实施方式中,所述第一引物池包含用于预扩增以下两组目标标记物的引物
对:所述组(i)中的至少2个或全部3个目标标记物,以及所述组(ii)中的至少2个、至少3个或全部4个目标标记物。
[0275]
在一些实施方式中,所述第一引物池包含用于预扩增组(i)的下述目标标记物的引物对:septin9与bcat1,bcat1与ikzf1,或septin9与ikzf1被扩增。
[0276]
在一些实施方案中,所述第一引物池包含用于预扩增组(ii)的下述目标标记物的引物对:pknox2与crhbp,pknox2与sox1,pknox2与基因间隔区a,crhbp与基因间隔区a,或sox1与基因间隔区a。在一些实施方案中,所述第一引物池包含用于预扩增组(ii)的下述目标标记物的引物对:pknox2、crhbp和sox1,pknox2、crhbp和基因间隔区a,pknox2、sox1和基因间隔区a或crhbp、sox1和基因间隔区a。
[0277]
在一些实施方中,所述第一引物池包含用于预扩增下述目标标记物的引物对:septin9、bcat1和ikzf1、pknox2、crhbp、sox1和基因间隔区a;其中所述目标标记物的至少一部分被预扩增以获得预扩增产物。
[0278]
在一些实施方式中,所述的各个目标标记物包括或是:
[0279]
a)如下所示的通过hg19坐标定义的各个区域:septin9,chr17:75276651-75496678;bcat1,chr12:24964295-25102393;ikzf1,chr7:50343720-50472799;pknox2,chr11:125034583-125303285;crhbp,chr5:76248538-76276983;sox1,chr13:112721913-112726020;基因间隔区a,chr10:130082033-130087148;以及上述每个区域的各个起始位点的上游5kb和各个末端位点的下游5kb;或
[0280]
b)亚硫酸氢盐转化后的a)的对应区域;或
[0281]
c)甲基化敏感限制酶(msre)处理后的a)的对应区域。
[0282]
在一些实施方式中,所述第一引物池至少包含选自以下的引物对中的一对或多对:seq id no:22/23、24/25、26/27、28/29、30/31、32/33和34/35。优选地,所述第一引物池包含选自下组(i)的至少一对、至少两对或全部三对引物对和下组(ii)的至少一对、至少两对、至少三对引物对:(i)seq id no:22/23、24/25、26/27;(ii)seq id no:28/29、30/31、32/33和34/35。在一些实施方式中,所述第一引物池包含以下引物对:seq id no:22/23、24/25、26/27、28/29、30/31、32/33和34/35,任选地其中所述第二引物池包含至少一个与所述第一引物池中的至少一个引物对相同的引物对。在一些实施方式中,第二引物池中的引物对与第一引物池中的引物对完全相同。
[0283]
在一些实施方式中,所述第一引物池和所述第二引物池进一步包含用于扩增对照标记物的引物对。在一些实施方式中,所述对照标记物选自下组:actb、gapdh、微管蛋白、aldoa、pgk1、ldha、rps27a、rpl19、rpl11、arhgdia、rpl32、c1orf43、chmp2a、emc7、gpi、psmb2、psmb4、rab7a、reep5、snrpd3、vcp和vps29。
[0284]
在一些实施方式中,所述试剂盒进一步包含多个容器,每个容器均用于接收所述第二引物池的组分。
[0285]
在一些实施方式中,所述试剂盒还包含可用于进行cpg位置特异性甲基化分析的标准试剂,其中所述分析包括以下一种或多种技术:ms-snupe、msp、methylight
tm
、heavymethyl
tm
、cobra和核酸测序。
[0286]
在一些实施方式中,所述试剂盒可包含选自下组的额外的试剂:缓冲液(例如限制酶、pcr、保存或洗涤缓冲液)、dna回收试剂或试剂盒(例如沉淀、超滤、亲和柱)和dna回收组
件。
[0287]
在一些实施方式中,本技术的试剂盒可包含:
[0288]
a)亚硫酸氢盐试剂;
[0289]
b)第一引物池,所述引物池包含多个甲基化特异性引物对,用于预扩增下组(i)中的至少一个目标标记物和下组(ii)中的至少一个目标标记物:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a,其中所述甲基化特异性引物对包含以下引物对,或由以下引物对组成:seq id no:22/23、24/25、26/27、28/29、30/31、32/33和34/35;
[0290]
c)第二试剂,所述第二试剂用于定量分析被所述第一引物池预扩增的目标标记物的每一个的甲基化水平,其中所述第二试剂包含第二引物池,所述第二引物池包含多个定量引物对,所述定量引物对能够与被所述第一引物池预扩增的所述目标序列的至少9个连续核苷酸在严紧条件下、中等严紧条件下或高度严紧条件下杂交。
[0291]
本技术的试剂盒还可包含包装在独立容器中的其他组分,例如适用于封闭、洗涤或包被的缓冲液或溶液。
[0292]
本技术的试剂盒可进一步包含在dna富集领域中已知的以下组分的一种或几种:蛋白组分,所述蛋白选择性地结合甲基化的dna;三链形成核酸组分,一个或多个接头,任选地在合适的溶液中;用于进行连接的物质或溶液,例如连接酶、缓冲液;用于进行柱层析的物质或溶液;用于进行免疫学为基础的富集(例如免疫沉淀)的物质或溶液;用于进行核酸扩增的物质或溶液,例如pcr;一种染料或几种染料,若适用于偶联剂,若适用于溶液中;用于进行杂交的物质或溶液;和/或用于进行洗涤步骤的物质或溶液。
[0293]
3.用途
[0294]
在另一方面,本技术提供了本技术的试剂盒在制造用于在个体中诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后或监测接受结直肠瘤治疗的个体对治疗的应答的诊断试剂盒中的用途。
[0295]
在另一方面,本技术提供用于定量分析目标标记物的甲基化水平的试剂在制造试剂盒中的用途,所述试剂盒被用于在个体中诊断结直肠进展期腺瘤、筛查结直肠进展期腺瘤形成或形成的风险或评估结直肠进展期腺瘤的进展或预后的方法中。
[0296]
优选地,所述方法中的各个步骤以及各步骤所用的各试剂如本文“1.方法”部分所述,因此,本发明的试剂盒可根据该方法而包括用于该方法各步骤所需的各试剂。
[0297]
优选地,所述试剂盒为本文“2.试剂盒”部分所述。
[0298]
优选地,所述目标标记物包括:所述组(i)中的至少2个或全部3个目标标记物,和所述组(ii)中的至少2个、至少3个或全部4个目标标记物。
[0299]
优选地,所述目标标记物包括septin9、bcat1、ikzf1、pknox2、crhbp、sox1和基因间隔区a。
[0300]
优选地,所述试剂包括扩增引物,用于扩增所述目标标记物的引物对。
[0301]
优选地,所述试剂包括用于扩增:所述组(i)中的septin9与bcat1,bcat1与ikzf1,或septin9与ikzf1的引物对;或所述组(i)的septin9、bcat1和ikzf1的引物对。
[0302]
优选地,所述试剂包括用于扩增:所述组(ii)中的pknox2与crhbp,pknox2与sox1,pknox2与基因间隔区a,crhbp与基因间隔区a,或sox1与基因间隔区a的引物对;所述组(ii)中的pknox2、crhbp和sox1,pknox2、crhbp和基因间隔区a,pknox2、sox1和基因间隔区a或
crhbp、sox1和基因间隔区a的引物对;或所述组(ii)中的pknox2、crhbp、sox1和基因间隔区a的引物对。
[0303]
优选地,用于扩增septin9的引物对为seq id no:22/23;用于扩增bcat1的引物对为seq id no:24/25;用于扩增ikzf1的引物对为seq id no:26/27;用于扩增pknox2的引物对为seq id no:28/29;用于扩增crhbp的引物对为seq id no:30/31;用于扩增sox1的引物对为seq id no:32/33;用于扩增基因间隔区a的引物对为seq id no:34/35。
[0304]
优选地,所述试剂还包括定量引物对,所述定量引物对被设计为用于扩增已用所述扩增引物预扩增的所述目标序列内的至少一部分,能够与被所述第一引物池预扩增的所述目标序列的至少9个连续核苷酸在严紧条件下、中等严紧条件下或高度严紧条件下杂交。
[0305]
优选地,所述定量引物对与所述扩增引物对相同。
[0306]
优选地,所述试剂进一步包含一个或多个封闭寡核苷酸。
[0307]
优选地,所述试剂进一步包含检测试剂。
[0308]
优选地,所述检测试剂选自下组:荧光探针、嵌入染料、生色团标记的探针、放射性同位素标记的探针和生物素标记的探针。
[0309]
优选地,所述探针至少包括选自下组的一条或多条核苷酸序列:seq id no:36-43。
[0310]
优选地,所述探针包括seq id no:36-38中所示的至少一条、至少两条或全部三条核苷酸序列,和seq id no:39或40以及41-43中所示的至少一条、至少两条或至少三条核苷酸序列。
[0311]
优选地,所述探针包括:seq id no:36-38和41-43所示的核苷酸序列,以及seq id no:39和/或40所示的核苷酸序列。
[0312]
优选地,所述荧光探针的5’端标记有荧光染料,3’端标记有猝灭剂;优选地,所述荧光染料选自fam、hex/vic、tamra、texas red或cy5,所述淬灭剂选自bhq1、bhq2、bhq3、dabcyl、tamra或lowa black dark quenchers。
[0313]
优选地,所述试剂还包括亚硫酸氢盐试剂或甲基化敏感限制酶。
[0314]
优选地,所述亚硫酸氢盐试剂选自下组:亚硫酸氢铵、亚硫酸氢钠、亚硫酸氢钾、亚硫酸氢钙、亚硫酸氢镁、亚硫酸氢铝、亚硫酸氢根离子,及其任意组合。
[0315]
优选地,所述msre选自下组:hpaii酶、sali酶、酶、scrfi酶、bbei酶、noti酶、smai酶、xmai酶、mboi酶、bstbi酶、clai酶、mlui酶、naei酶、nari酶、pvui酶、sacii酶、hhai酶及其任意组合。
[0316]
优选地,所述试剂包含用于扩增对照标记物的引物对。
[0317]
优选地,所述对照标记物选自下组:actb、gapdh、微管蛋白、aldoa、pgk1、ldha、rps27a、rpl19、rpl11、arhgdia、rpl32、c1orf43、chmp2a、emc7、gpi、psmb2、psmb4、rab7a、reep5、snrpd3、vcp和vps29。
[0318]
优选地,所述目标标记物包含或是:
[0319]
a)如下所示的通过hg19坐标定义的各个区域:septin9,chr17:75276651-75496678;bcat1,chr12:24964295-25102393;ikzf1,chr7:50343720-50472799;pknox2,chr11:125034583-125303285;crhbp,chr5:76248538-76276983;sox1,chr13:112721913-112726020;基因间隔区a,chr10:130082033-130087148;以及上述每个区域的各个起始位
点的上游5kb和各个末端位点的下游5kb;或
[0320]
b)亚硫酸氢盐转化后的a)的对应区域;或
[0321]
c)甲基化敏感限制酶(msre)处理后的a)的对应区域。
[0322]
优选地,所述方法包括如下步骤:
[0323]
(a)从所述个体获取含有dna的生物样品;
[0324]
(b)用试剂处理步骤(a)中获取的所述生物样品中的dna,所述试剂能够区分所述dna中的甲基化和未甲基化的cpg位点,从而获得经处理的dna;
[0325]
(c)用预扩增引物池预扩增从步骤(b)获取的所述经处理的dna中的以下两组目标标记物(target marker)中每一组目标标记物中的至少一种目标标记物:(i)septin9、bcat1和ikzf1,(ii)pknox2、crhbp、sox1和基因间隔区a;其中所述目标标记物的至少一部分被预扩增以获得预扩增产物;
[0326]
(d)基于步骤(c)获取的预扩增产物来分别定量分析所述被扩增的目标标记物的甲基化水平;
[0327]
(e)分别比较步骤(d)中的所述被扩增的目标标记物的甲基化水平和相应的参考水平,其中:组(i)所述的目标标记物相对于其相应的参考水平具有更高的甲基化水平,且组(ii)所述的目标标记物相对于其相应的参考水平具有较低的甲基化水平表明所述个体患有结直肠进展期腺瘤,或者所述个体有结直肠进展期腺瘤形成或形成的风险,或者所述个体有结直肠进展期腺瘤发展或发展的可能性增加,或者所述个体有结直肠进展期腺瘤预后不良或预后不良的风险。
[0328]
在一些实施方式中,上述方法的步骤(c)中,所述组(i)中的至少2个或全部3个目标标记物被扩增。
[0329]
在一些实施方式中,上述方法的步骤(c)中,所述组(i)中的septin9与bcat1,bcat1与ikzf1,或septin9与ikzf1被扩增。
[0330]
在一些实施方案中,上述方法的步骤(c)中,所述组(ii)中的至少2个、至少3个或全部4个目标标记物被扩增。
[0331]
在一些实施方案中,上述方法的步骤(c)中,pknox2与crhbp,pknox2与sox1,pknox2与基因间隔区a,crhbp与基因间隔区a,或sox1与基因间隔区a被扩增。
[0332]
在一些实施方案中,上述方法的步骤(c)中,pknox2、crhbp和sox1,pknox2、crhbp和基因间隔区a,pknox2、sox1和基因间隔区a或crhbp、sox1和基因间隔区a被扩增。
[0333]
在一些实施方案中,上述方法的步骤(c)中,用预扩增引物池预扩增从步骤(b)获取的所述经处理的dna中的以下目标标记物:septin9、bcat1和ikzf1、pknox2、crhbp、sox1和基因间隔区a;其中所述目标标记物的至少一部分被预扩增以获得预扩增产物。
[0334]
在一些实施方式中,所述各个目标标记物包含或是:
[0335]
a)如下所示的通过hg19坐标定义的各个区域:septin9,chr17:75276651-75496678;bcat1,chr12:24964295-25102393;ikzf1,chr7:50343720-50472799;pknox2,chr11:125034583-125303285;crhbp,chr5:76248538-76276983;sox1,chr13:112721913-112726020;基因间隔区a,chr10:130082033-130087148;以及上述每个区域的各个起始位点的上游5kb和各个末端位点的下游5kb;或
[0336]
b)亚硫酸氢盐转化后的a)的对应区域;或
[0337]
c)甲基化敏感限制酶(msre)处理后的a)的对应区域。
具体实施方式
[0338][0339]
所有实施例中使用的生物材料,包括各种克隆和表达质粒、培养基、酶、缓冲液、各种培养方法、蛋白质提取和纯化方法以及其他分子生物学操作方法,都是本领域技术人员所熟知的。更多细节请参照sambrook et al.,molecular cloning:a laboratory manual,cold spring harbor press,n.y.和frederick m.ausubel等人编写的“short protocols in molecular biology”(yan ziying等译,科学出版社(北京),1998)。
[0340]
实施例
[0341]
本实施例通过检测septin9、bcat1、ikzf1高甲基化及pknox2、crhbp、sox1、基因间隔区(hg19,chr10:130085033-130085148)低甲基化来筛查结直肠进展期腺瘤。
[0342]
为评估甲基化标志物在结直肠进展期腺瘤检测中的临床性能,我们使用预扩增检测法,检测了117份经临床诊断为结直肠进展期腺瘤的血浆样品和100份结肠镜检查为阴性的血浆对照样品。检测位点为septin9、bcat1、ikzf1、pknox2、crhbp、sox1和位于chr10:130085033-130085148的基因间隔区(hg19)。
[0343]
预扩增方法
[0344]
预扩增方法包括以下步骤:
[0345]
1、使用qiaamp circulating nucleic acid kit(qiagen)从1-4ml血浆样品中获得细胞外游离dna(cfdna)样品。
[0346]
2、使用亚硫酸氢盐试剂(methylcodetm bisulfite conversion kit)对20ng cfdna进行亚硫酸氢盐转化以获得转化的cfdna。
[0347]
3、将转化的cfdna样品进行预扩增。简而言之,在甲基化特异性引物对的存在下,通过pcr反应对从上述步骤2获得的转化的cfdna进行预扩增,所述甲基化特异性引物对专门针对septin9、bcat1、ikzf1、pknox2、crhbp、sox1和位于chr10:130085033-130085148的基因间隔区(hg19)而设计。在pcr反应体系中,每个引物的终浓度均为200nm。25μl pcr混合物由10μl转化的cfdna、2.5μl含有上述引物的预混液和12.5μl pcr试剂(universal probe qpcr master mix(neb))组成。
[0348]
pcr反应条件如下:95℃3分钟;95℃30秒,56℃60秒,10个循环。proflex tm pcr系统(thermo fisher)。
[0349]
4、将从上述步骤3获得的预扩增产物稀释10倍,然后用于多重荧光pcr检测,专门针对septin9、bcat1、ikzf1、pknox2、crhbp、sox1和位于chr10:130085033-130085148的基因间隔区(hg19)。qpcr混合物由10μl稀释的预扩增产物、2.5μl引物/探针池、12.5μl pcr试剂(universal probe qpcr master mix(neb))组成。非cpg的actb区域用作每个反应孔的内参。不同标记物的检测探针用不同的荧光进行标记。在pcr反应体系中,每个引物的终浓度为500nm,每个检测探针的终浓度为200nm。pcr反应条件如下:95℃5分钟;95℃15秒,56℃40秒(采集荧光),50个循环。使用abi 7500real-time pcr system在相应的荧光通道检测不同的荧光。
[0350]
结果
[0351]
将没有扩增信号样品的ct值设置为50。分别统计septin9、bcat1、ikzf1的ct平均值及pknox2、crhbp、sox1、基因间隔区a(hg19,chr10:130085033-130085148)的ct平均值。图1显示患有进展期腺瘤的群体和结肠镜检查为阴性的群体中目标标志物septin9、bcat1、ikzf1 ct值分布,患有进展期腺瘤的群体整体ct值比阴性群体要小,提示甲基化水平更高。如图2所示,患有进展期腺瘤的群体中目标标志物pknox2、crhbp、sox1和位于chr10:130085033-130085148的基因间隔区(hg19)的检测ct较阴性对照要大,提示更低的甲基化水平。
[0352]
表3显示了在预扩增方法中检测septin9、bcat1、ikzf1、pknox2、crhbp、sox1和位于chr10:130085033-130085148的基因间隔区(hg19)目标标记物对进展期腺瘤的检测结果。根据septin9、bcat1、ikzf1的平均ct值roc曲线,确定平均ct小于44为检测阳性;根据pknox2、crhbp、sox1和位于chr10:130085033-130085148的基因间隔区(hg19)的平均ct值roc曲线,划定平均ct大于38为检测阳性。样本最终结果septin9、bcat1、ikzf1的高甲基化或pknox2、crhbp、sox1和位于chr10:130085033-130085148的基因间隔区a(hg19)的低甲基化任一为阳性即为检测阳性。如表3所示,预扩增方法显示出对进展期腺瘤具有超高灵敏度(54.7%)和对结肠镜检查为阴性的群体的高特异性(82.7%)。对进展期腺瘤的检出率远高于目前已有的血液检测方法。
[0353]
表3:预扩增方法结果和结肠镜检查结果的对比
[0354][0355]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。