编码aldh2多肽的mrna分子、应用及mrna药物
技术领域
1.本发明涉及制药技术领域,尤其是涉及编码aldh2多肽的mrna分子、应用及mrna药物。
背景技术:
2.人类aldh2(乙醛脱氢酶2,aldehyde dehydrogenase-2)是一种517个氨基酸的多肽,由位于染色体12q24的核基因编码。与aldh家族的大多数成员一样,aldh2是一种四聚体酶,在所有组织中普遍表达,但在肝脏中含量最高,并且在需要高线粒体氧化磷酸化的器官(如心脏和大脑)中也有大量表达。aldh2因其在乙醇代谢中的关键作用而广为人知,且aldh2可能是人体内唯一对乙醛代谢有显着贡献的aldh酶。人体的乙醇解毒途径主要发生在肝脏中,由两个酶促步骤进行。第一步由乙醇脱氢酶(adh)催化,第二步主要由aldh2催化。
3.aldh2*2等位基因是人类最广泛的aldh2变体,它存在于多达三分之一的东亚人和8%世界人口中。杂合子个体(aldh2*1/*2)的aldh2酶活性不到野生型的50%,而aldh2*2/*2纯合子的aldh2酶活性不到野生型的 1-4%。aldh2*2携带者的aldh2酶活性较低,表现为饮酒后特征性的面部潮红、头痛、恶心、头晕和心悸。
4.研究表明乙醛在与摄入乙醇相关的中毒中具有明确的作用。摄入的乙醇会迅速代谢为乙醛(通过乙醇脱氢酶),然后通过线粒体酶aldh2代谢为乙酸盐。在aldh2缺乏的受试者中,即使在适量的乙醇之后,血液中的乙醛浓度也会显着升高。急性暴露于乙醛会导致许多与乙醇中毒相关的不愉快影响,包括恶心、心悸、呕吐、头晕和头痛。过度饮酒的aldh2*1/*2受试者患食道癌和其他上呼吸消化道癌症的风险很大,这可能是乙醛的dna破坏作用的结果。但是现有针对乙醇(酒精)摄入后,并没有有效促进体内乙醇或乙醛分解的方式,如纳络酮、利尿剂等,前者是阿片类药物过量的解毒剂,也能解除酒精的中枢抑制、缩短昏迷时间,只能让人变清醒;后者是通过加强乙醇及其代谢产物乙醛和酮体经尿液排泄,都无法加速乙醛的“解毒”过程,更无法保护肝脏被乙醇及其代谢产物损伤。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于,提供一种编码aldh2多肽的核酸分子,包括mrna分子,采用该mrna分子制备得到的 mrna药物,以期能够加速乙醛代谢过程,弥补目前酒精代谢引发疾病治疗药物的空白。
7.为了解决上述技术问题,实现上述目的,本发明提供以下技术方案:
8.第一方面,本发明提供编码aldh2多肽的核酸分子,包括(a)~(c)任一种:
9.(a)具有seq id no.15~18任一条所示的编码aldh2多肽的核苷酸序列的mrna分子;
10.(b)在(a)限定的核苷酸序列中经过取代、缺失或添加一个或几个核苷酸,具有编
码aldh2多肽功能且与原核苷酸序列具有相同gc碱基对百分比含量的由(a)衍生的mrna分子;
11.(c)在严格条件下与(a)或(b)限定的mrna分子杂交,且aldh2多肽的核酸分子。
12.第二方面,本发明提供构建体,所述构建体包括前述实施方式所述的核酸分子,所述构建体的核苷酸序列还包括 utr序列、5’帽子和poly(a)序列。
13.优选地,所述5’帽子包括7-甲基-鸟苷-5
’‑
三磷酸-5
’‑
腺苷、鸟苷-5
’‑
三磷酸-5
’‑
腺苷、7-甲基-鸟苷-5
’‑
三磷酸-5
’‑
鸟苷、鸟苷-5
’‑
三磷酸-5
’‑
鸟苷和m7g(5’)(2
’‑
omea)pg中的一种或几种;优选为m7g(5’)(2
’‑
omea) pg。
14.优选地,所述poly(a)序列中碱基a的数量为60~120,进一步优选为100。
15.优选地,所述utr序列包括5’utr序列和3’utr序列。
16.进一步优选地,所述5’utr序列具有seq id no.1或seq id no.13所示的核苷酸序列。
17.进一步优选地,所述3’utr序列具有seq id no.3或seq id no.14所示的核苷酸序列。
18.第三方面,本发明提供前述实施方式所核酸分子或前述实施方式所述构建体在制备mrna药物中的应用。
19.在可选的实施方式中,所述mrna药物的用途包括(
ⅰ
)或(
ⅱ
):
20.(
ⅰ
)补充aldh2酶;
21.(
ⅱ
)预防和/或治疗酒精代谢性疾病。
22.优选地,所述酒精代谢性疾病包括酒精引发的肝损伤或酒精性肝炎。
23.第四方面,本发明提供mrna药物,所述mrna药物包括前述实施方式所述的核酸分子或前述实施方式所述的构建体。
24.在可选的实施方式中,所述mrna药物还包括包裹前述实施方式所述核酸分子或前述实施方式所述构建体的脂质纳米颗粒,所述脂质纳米颗粒组成包括dlin-mc3-dma、dscp、胆固醇和peg-dmg。
25.在可选的实施方式中,所述脂质纳米颗粒按照摩尔份数计包括,20~50份的dlin-mc3-dma、5~20份的dscp、 20~50份的胆固醇和1~5份的peg-dmg。
26.在可选的实施方式中,所述脂质纳米颗粒按照摩尔份数计包括50份的dlin-mc3-dma、10份的dscp、38.5份的胆固醇和1.5份peg-dmg。
27.在可选的实施方式中,所述制备方法包括:
28.(a)将编码aldh2多肽的rna溶解于缓冲液,将浓度调整为0.05mg/ml~0.5mg/ml,得到水相;
29.(b)将dlin-mc3-dma、dopg、胆固醇和peg-dmg溶解于无水乙醇,将有机相中的脂质成分的浓度调整至 5mg/ml~7mg/ml,得到有机相;
30.(c)将步骤(a)的水相和步骤(b)的有机相按照1:3的体积比混合,除去乙醇后浓缩至体系中的mrna的浓度为50μg/ml~1000μg/ml,得到包含编码aldh2多肽的rna的脂质纳米颗粒。
31.在可选的实施方式中,所述制备方法包括:
32.(a)将编码aldh2多肽的rna溶解于ph4的柠檬酸盐缓冲液,将浓度调整为0.1mg/
ml,得到水相;
33.(b)将dlin-mc3-dma、dopg、胆固醇和peg-dmg溶解于无水乙醇,将有机相中的脂质成分的浓度调整至 6mg/ml,得到有机相;
34.(c)将步骤(a)的水相和步骤(b)的有机相按照1:3的体积比,使用微流控设备,按照12ml/min的流速混合,混合液立刻用ph7.4的pbs溶液稀释100倍,并使用切向流过滤除去溶液中乙醇,然后浓缩至体系中的mrna 的浓度为550μg/ml,得到包含编码aldh2多肽的rna的脂质纳米颗粒。
35.经过小鼠生存实验验证表明,采用本发明提供的编码aldh2多肽的mrna分子制备得到的mrna药物,能够提高白酒灌胃小鼠的生存率,并且生存率随着药物剂量的提高而提高。同时western blot检测、aldh2多肽活性检测、乙醇代谢产物含量检测和肝脏病理切片检测的多种检测结果表明,该mrna药物能够在小鼠体内成功表达 aldh2多肽,显著提高aldh2多肽活性,并在肝脏发挥促进乙醛代谢的作用,从而提高白酒灌胃小鼠生存率。
附图说明
36.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
37.图1为本发明实验例1中western blot检测结果;
38.图2为本发明实验例2中aldh2-ko小鼠构建检测结果;
39.图3为本发明实验例3中haldh-2和maldh2蛋白表达结果;
40.图4为本发明实验例4中seq id no.4的gc碱基对百分含量;
41.图5为本发明实验例4中seq id no.15的gc碱基对百分含量;
42.图6为本发明实验例3中各mrna序列表达的aldh2蛋白的结果;
43.图7为本发明seq id no.16的gc碱基对百分含量;
44.图8为本发明seq id no.17的gc碱基对百分含量;
45.图9为本发明seq id no.18的gc碱基对百分含量;
46.图10为本发明seq id no.20的gc碱基对百分含量;
47.图11为本发明seq id no.21的gc碱基对百分含量;
48.图12为本发明实验例6中aldh2多肽表达量检测结果;
49.图13为本发明实验例6中aldh2多肽活性检测结果;
50.图14为本发明实验例6中乙醇代谢检测结果;
51.图15为本发明实验例6中小鼠肝脏病理切片中低剂量组和对照组对比结果;
52.图16为本发明实验例6中小鼠肝脏病理切片中低剂量组和高剂量组对比结果;
53.图17为本发明实验例6中小鼠肝脏病理切片中高剂量死亡组镜检结果。
具体实施方式
54.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是
本发明一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本发明实施例的组件可以以各种不同的配置来布置和设计。
55.因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
56.在某次具体实施方式中,第一方面,本发明提供编码aldh2多肽的核酸分子,包括(a)~(c)任一种:
57.(a)具有seq id no.15~18任一条所示的编码aldh2多肽的核苷酸序列的mrna分子;
58.(b)在(a)限定的核苷酸序列中经过取代、缺失或添加一个或几个核苷酸,具有编码aldh2多肽功能且与原核苷酸序列具有相同gc碱基对百分比含量的由(a)衍生的mrna分子;
59.(c)在严格条件下与(a)或(b)限定的mrna分子杂交,且aldh2多肽的核酸分子。
60.本发明提供的seq id no.13~15所示的编码aldh2多肽的核苷酸序列中局部的gc碱基对百分比含量不低于 40%,总体的gc碱基对百分比含量为55%~65%。其中“局部的gc碱基对百分比含量”是指从orf序列的3’端到 5’端,以60bp作为window size的局部序列中gc碱基对百分比含量。
61.上述核酸分子(b)中“gc碱基对百分比含量”包括局部的gc碱基对百分比含量和总体的gc碱基对百分比含量。
62.可以理解的是,上述核酸分子(c)在“严格条件”与(a)或(b)所述的mrna杂交,是指严格依据碱基互补配对原则,以mrna分子(a)或(b)为模板杂交获得的核酸分子(c),例如单链dna或其他rna分子。对于具体的“严格条件”的反应条件,本领域技术人员能够参考现有技术和公知常识,根据目的产物进行常规选择。
63.第二方面,本发明提供构建体,所述构建体包括前述实施方式所述的mrna分子,所述构建体的核苷酸序列还包括utr序列、5’帽子和poly(a)序列。
64.优选地,所述5’帽子包括7-甲基-鸟苷-5
’‑
三磷酸-5
’‑
腺苷、鸟苷-5
’‑
三磷酸-5
’‑
腺苷、7-甲基-鸟苷-5
’‑
三磷酸-5
’‑
鸟苷、鸟苷-5
’‑
三磷酸-5
’‑
鸟苷和m7g(5’)(2
’‑
omea)pg中的一种或几种;优选为m7g(5’)(2
’‑
omea) pg。
65.优选地,所述poly(a)序列中碱基a的数量为60~120,进一步优选为100。
66.优选地,所述utr序列包括5’utr序列和3’utr序列。
67.进一步优选地,所述5’utr序列具有seq id no.1或seq id no.13所示的核苷酸序列。
68.进一步优选地,所述3’utr序列具有seq id no.3或seq id no.14所示的核苷酸序列。
69.第三方面,本发明提供前述实施方式所述mrna分子或前述实施方式所述构建体在制备mrna药物中的应用。
70.在可选的实施方式中,所述mrna药物的用途包括(
ⅰ
)或(
ⅱ
):
71.(
ⅰ
)补充aldh2酶;
72.(
ⅱ
)预防和/或治疗酒精代谢性疾病。
73.优选地,所述酒精代谢性疾病包括酒精引发的肝损伤或酒精性肝炎。
74.第四方面,本发明提供mrna药物,所述mrna药物包括前述实施方式所述的mrna分子或前述实施方式所述的构建体。
75.在可选的实施方式中,所述mrna药物还包括包裹权利要求1所述mrna分子或权利要求2所述构建体的脂质纳米颗粒,所述脂质纳米颗粒组成包括dlin-mc3-dma、dscp、胆固醇和peg-dmg。
76.在可选的实施方式中,所述脂质纳米颗粒按照摩尔份数计包括,20~50份的dlin-mc3-dma、5~20份的dscp、 20~50份的胆固醇和1~5份的peg-dmg。
77.在可选的实施方式中,所述脂质纳米颗粒按照摩尔份数计包括50份的dlin-mc3-dma、10份的dscp、38.5份的胆固醇和1.5份peg-dmg。
78.在可选的实施方式中,所述制备方法包括:
79.(a)将编码aldh2多肽的rna溶解于缓冲液,将浓度调整为0.05mg/ml~0.5mg/ml,得到水相;
80.(b)将dlin-mc3-dma、dopg、胆固醇和peg-dmg溶解于无水乙醇,将有机相中的脂质成分的浓度调整至 5mg/ml~7mg/ml,得到有机相;
81.(c)将步骤(a)的水相和步骤(b)的有机相按照1:3的体积比混合,除去乙醇后浓缩至体系中的mrna的浓度为50μg/ml~1000μg/ml,得到包含编码aldh2多肽的rna的脂质纳米颗粒。
82.在可选的实施方式中,所述制备方法包括:
83.(a)将编码aldh2多肽的rna溶解于ph4的柠檬酸盐缓冲液,将浓度调整为0.1mg/ml,得到水相;
84.(b)将dlin-mc3-dma、dopg、胆固醇和peg-dmg溶解于无水乙醇,将有机相中的脂质成分的浓度调整至 6mg/ml,得到有机相;
85.(c)将步骤(a)的水相和步骤(b)的有机相按照1:3的体积比,使用微流控设备,按照12ml/min的流速混合,混合液立刻用ph7.4的pbs溶液稀释100倍,并使用切向流过滤除去溶液中乙醇,然后浓缩至体系中的mrna 的浓度为550μg/ml,得到包含编码aldh2多肽的rna的脂质纳米颗粒。
86.下面结合附图,对本发明的一些实施方式作详细说明。在不冲突的情况下,下述的实施例及实施例中的特征可以相互组合。
87.实施例1
88.本实施例提供了四条编码aldh2多肽的mrna,具体的核苷酸序列分别如seq id no.15~18所示。
89.实施例2
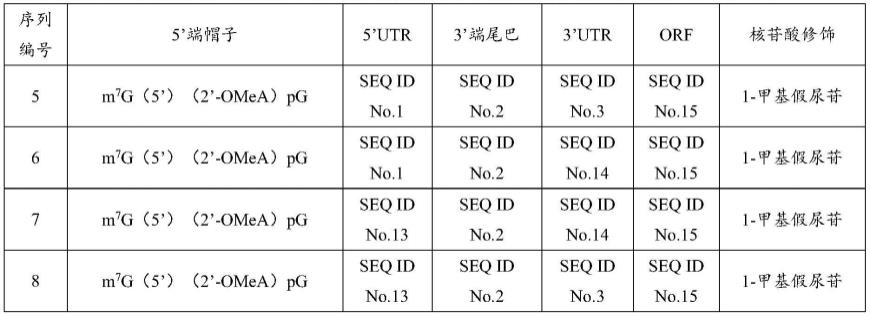
90.本实施例提供了8组编码aldh2多肽的mrna,所述mrna除了包含编码aldh2多肽的orf外,还包含5’端帽子、utr和3’尾巴,并且mrna中尿嘧啶均被替换为1-甲基假尿苷,具体序列编号及组成如下:
[0091][0092][0093]
实施例3
[0094]
本实施例提供8组mrna药物,包括编码aldh2多肽的mrna和包裹该mrna的脂质纳米颗粒,其中脂质纳米颗粒按照摩尔百分比计包括dlin-mc3-dma 50%、dscp 10%、胆固醇38.5%和peg-dmg 1.5%。
[0095]
该mrna药物的制备方法如下:
[0096]
(a)将人工合成的编码aldh2多肽的8组mrna(序列分别如seq id no.5~12所示)溶解于ph4的柠檬酸盐缓冲液,将浓度调整为0.1mg/ml,得到水相。
[0097]
(b)按照配方量将dlin-mc3-dma、dopg、胆固醇和peg-dmg按照配方量溶解于无水乙醇,将有机相中的脂质成分的浓度调整至6mg/ml,得到有机相。
[0098]
(c)将步骤(a)的水相和步骤(b)的有机相按照1:3的体积比,使用微流控设备,按照12ml/min的流速混合,混合液立刻用ph7.4的pbs溶液稀释100倍,并使用切向流过滤(tff)除去溶液中乙醇成分,然后浓缩至体系中的 mrna的浓度为550μg/ml,得到包含编码aldh2多肽的rna的脂质纳米颗粒。
[0099]
实施例4
[0100]
本实施例提供另外8组mrna药物,与实施例3的区别在于,脂质纳米颗粒按照摩尔份数计包括20份的dlin
‑ꢀ
mc3-dma、5份的dscp、20份胆固醇和1份peg-dmg。
[0101]
实施例5
[0102]
本实施例提供另外8组mrna药物,与实施例3的区别在于,脂质纳米颗粒按照摩尔份数计包括50份的dlin
‑ꢀ
mc3-dma、20份的dscp、50份胆固醇和5份peg-dmg。
[0103]
实验例1
[0104]
本实验例检测实施例1提供的aldh2多肽在体外细胞水平的表达情况,具体方法如下:
[0105]
(1)转染
[0106]
将lip2000试剂10μl与40μl opti-mem混合均匀静置,向其中再加入46μl opti-mem,然后分别加入2μl dna质粒和2μl mrna(μg/μl),静置,将其加入hek293细胞中,并在细胞培养箱中孵育。
[0107]
(2)使用western blot法检测细胞内aldh2蛋白的表达
[0108]
将细胞上清液去除,使用pbs清洗细胞2次,加250μl细胞裂解液裂(含pmsf)于离心管中,进行离心,取上清分装于1.5ml离心管中。使用bca试剂盒对细胞的蛋白浓度进行测定。接着使用预制胶进行电泳,加入重组 anti-aldh2抗体和goat anti-rabbit igg h&l(hrp),对pvdf膜进行化学发光,显色。结果如图1所示,其中control 为空脂质组;1为环状质粒;2为实施例1提供的mrna,可以看出,dna质粒和mrna组aldh2蛋白表达量显著高于对照组,aldh2蛋白的dna和mrna能够在hek293细胞中稳定表达。
[0109]
实验例2
[0110]
本实验例构建了aldh2-ko小鼠,具体方法如下:
[0111]
委托上海南方模式生物科技股份有限公司通过crispr/cas9技术获得f0代aldh2-ko小鼠。使用western blot 技术检测小鼠肝脏中aldh2蛋白的表达。结果如图2显示,aldh2-ko小鼠肝脏中的aldh2表达远低于野生型小鼠,ko小鼠模型成立。
[0112]
实验例3
[0113]
本实验例考察人源aldh2 mrna和鼠源aldh2 mrna药物在ko小鼠中的表达情况,具体方法如下:
[0114]
aldh2-ko小鼠数量(“aldh2-ko小鼠”是指“aldh2*2/*2纯合子的小鼠”):9只;对照组为pbs组,给药组为人源aldh2 mrna(haldh2)组,鼠源aldh2 mrna(maldh2)组;共3组,每组3只小鼠。
[0115]
实验方案:(1)对照组:以尾静脉注射方式注射100μl pbs溶液aldh2-ko小鼠;给药组:根据小鼠的体重,以尾静脉注射方式2.5mg/kg的剂量给予ko小鼠人源aldh2 mrna(haldh2)(mrna的orf序列为seq idno.15)或鼠源aldh2 mrna(maldh2)(mrna序列为seq id no.19,5’帽子为:m7g(5’)(2
’‑
omea) pg),其中mrna按照实施例1的方法制备为lnp形式。
[0116]
(2)给药4小时后,根据小鼠的体重,9只aldh2-ko小鼠按照13μg/g的剂量以灌胃方式给与52度白酒。
[0117]
小鼠的肝脏采样时间点:白酒灌胃后2h和6h。样品采集后放入液氮中速冻,然后放入-80冰箱保存。
[0118]
采用western blot检测小鼠肝脏中aldh-2蛋白的表达:将肝脏组织块置于离心管剪碎,加250μl组织裂解液 (含pmsf)于离心管中,进行匀浆离心,取上清分装于1.5ml离心管中。使用bca试剂盒对样品的蛋白浓度进行测定。接着使用预制胶进行电泳,加入重组anti-aldh2抗体和goat anti-mouse igg h&l(hrp),对pvdf膜进行化学发光,显色。
[0119]
实验结果如图3所示:(1)对照组小鼠酒精灌胃后全部死亡,而maldh-2组小鼠存活1只,haldh-2组小鼠存活2只;(2)haldh-2组和maldh-2组中haldh-2和maldh2蛋白均在小鼠肝脏中表达。
[0120]
实验例4
[0121]
对上述seq id no.4和seq id no.15的gc碱基对百分含量进行考察,如图4和图5
所示。seq id no.4的总 gc%含量为54.03%,其中碱基a%含量为24.24%,碱基c%含量为25.21%,碱基g%含量为28.82%,碱基u%含量为21.73%。由图4可以看出seq id no.4局部的gc碱基对百分比含量在40%~65%。
[0122]
seq id no.15的总gc%含量为58.75,其中碱基a%含量为21.24%,碱基c%含量为27.8%,碱基g%含量为 30.95%,碱基u%含量为20.01%。由图5可以看出seq id no.局部的gc碱基对百分比含量在41%~83%。
[0123]
seq id no.16的总gc%含量为59.72%,其中碱基a%含量为21.75%,碱基c%含量为28.19%,碱基g%含量为31.53%,碱基u%含量为18.53%。由图7可以看出seq id no.局部的gc碱基对百分比含量在41%~83%
[0124]
seq id no.17的总gc%含量为59.38%,其中碱基a%含量为23.02%,碱基c%含量为29.08%,碱基g%含量为30.3%,碱基u%含量为17.6%。由图8可以看出seq id no.局部的gc碱基对百分比含量在41%~78%。
[0125]
seq id no.18的总gc%含量为59.42%,其中碱基a%含量为23.02%,碱基c%含量为29.21%,碱基g%含量为30.11%,碱基u%含量为17.67%。由图9可以看出seq id no.局部的gc碱基对百分比含量在42%~77%。
[0126]
seq id no.20的总gc%含量为52.49%,其中碱基a%含量为25.66%,碱基c%含量为23.15%,碱基g%含量为29.34%,碱基u%含量为21.86%。由图10可以看出seq id no.局部的gc碱基对百分比含量在40%~63%。
[0127]
seq id no.21的总gc%含量为66.73%,其中碱基a%含量为18.57%,碱基c%含量为35.01%,碱基g%含量为31.72%,碱基u%含量为14.7%。由图11可以看出seq id no.局部的gc碱基对百分比含量在52%~87%。
[0128]
实验例5
[0129]
参考前述western blot法检测实验例3中各mrna序列表达的aldh2蛋白,结果如图6所示,实验结论:(1) 编辑aldh2多肽的mrna中orf序列为seq id no.15的表达量远远高于orf序列为seq id no.4的表达量; (2)5’utr为seq id no.1和3’utr为seq id no.2时,aldh2多肽的表达量高于其他5’utr和3’utr的组合方式。
[0130]
经过进一步的筛选编辑aldh2多肽的orf序列,发现当orf序列总体的gc%含量为30~70%时,局部的gc%含量不低于40%时(如seq id no.15~18),aldh2多肽的表达量较高;更进一步的,orf序列局部的gc%含量不低于40%时,总体的gc%含量为55%~60%的序列(如seq id no.15~18)aldh2多肽的表达量略高于总体的gc%含量30%~55%以及60%~70%的序列(如seq id no.4,20、21)。
[0131]
实验例6
[0132]
本实验例考察aldh2 mrna药物保护ko小鼠免受酒精损伤情况,具体方法如下:
[0133]
随机将15只aldh2-ko小鼠数量分为3组(分别为pbs组、高剂量组和低剂量组),每组5只。
[0134]
实验方案:(1)给对照组aldh2-ko小鼠用尾静脉注射方式注射100μl pbs溶液;根据小鼠的体重,分别按照2.5mg/kg和1.25mg/kg的剂量给高剂量组和低剂量组aldh2-ko小鼠用尾静脉注射方式注射实施例3提供的编码maldh2多肽的mrna药物,其中mrna的核苷酸序列如seq id no.10所示。
[0135]
(2)4小时后,根据小鼠的体重,15只aldh2-ko小鼠按照13μg/g的剂量以灌胃方式递送52度白酒。
[0136]
ko小鼠血清(50μl)采样时间点:mrna给药前、灌胃前、灌胃后1、6、10、24、48h,采集后放入液氮中速冻,然后放入-80℃冰箱保存。
[0137]
实验结果:
[0138]
1、生存情况
[0139]
白酒灌胃后24h,pbs组小鼠5只全部死亡;低剂量给药组(1.25mg/kg)小鼠死亡2只,存活3只;高剂量给药组(2.5mg/kg)小鼠死亡1只,存活4只。
[0140]
2、aldh2多肽的肝脏表达情况
[0141]
采用western blot分别检测小鼠肝脏中aldh-2蛋白的表达情况。将肝脏组织块置于离心管剪碎,加250μl组织裂解液裂(含pmsf)于离心管中,进行匀浆离心,取上清分装于1.5ml离心管中。使用bca试剂盒对样品的蛋白浓度进行测定。接着使用预制胶进行电泳,加入重组anti-aldh2抗体和goat anti-mouse igg h&l(hrp),对pvdf 膜进行化学发光,显色。结果如图12显示,在高、低剂量组中aldh2蛋白均在小鼠肝脏中表达。
[0142]
3、aldh2多肽的活性
[0143]
使用elisa对小鼠肝脏组织中的aldh2酶活性进行检测。取约10mg小鼠肝脏组织,加入buffer于冰上裂解混匀,使用离心机离心。取上清,稀释20倍于96孔板中。制备标准曲线后,将底物进行水解,将20μl水解底物加入96孔板中孵育,最后使用200μl终止液来终止反应,放入多功能酶标仪中进行检测。结果如图13所示,表明与 pbs组相比,高、低剂量组中aldh2酶活性均显著提高,并且随着mrna给药剂量的提高,其酶活性也显著提高。
[0144]
4、血清中乙醇、乙醛和乙酸的含量变化
[0145]
采用气相色谱法检测顶空进样条件:恒定模式;炉温为65℃;平衡时间为10min;定量温度为105℃;传输线温度为110℃;针温为90℃;样品加压时间为0.1min;定量环充满时间为0.1min;定量环平衡时间:0.05min。取0.2 ml待检小鼠血清,将其置于2ml样品瓶中,压紧瓶盖,置于顶空进样器样品架上进行测定。
[0146]
(1)白酒灌胃前后小鼠血液中的乙醇、乙醛和乙酸含量,检测结果如图12所示,结果说明:白酒灌胃给药后 24h,可以看到:
[0147]
(a)pbs组、高剂量组和低剂量组的小鼠血液中的乙醇、乙醛和乙酸含量(24h)比白酒灌胃给药前(0h)都明显升高。
[0148]
(b)白酒灌胃给药后24h,pbs组小鼠血液中的乙醇含量显著高于高剂量组和低剂量组的小鼠血液中的乙醇含量(p《0.05),以注射编码haldh2多肽的mrna的形式对aldh2-ko小鼠补充haldh2多肽,可以加速乙醇代谢。
[0149]
(c)pbs组小鼠血液中的乙醛含量显著高于高剂量组和低剂量组的小鼠血液中的乙醛含量(p《0.05),pbs组小鼠血液中的乙酸含量显著低于高剂量组和低剂量组的小鼠血液中的乙酸(p《0.05),低剂量组小鼠血液中的乙醛含量显著高于高剂量组的小鼠血液中的乙醛含量(p《0.05),低剂量组小鼠血液中的乙酸含量显著低于高剂量组的小鼠血液中的乙酸含量(p《0.05)。说明以注射编码haldh2多肽的mrna的形式对aldh2-ko小鼠补充haldh2多肽,可以加速乙醛代谢为乙酸;并呈现剂量依赖,如图14所示。
[0150]
5、小鼠肝脏病理切片
[0151]
将小鼠肝脏组织进行脱水切片,首先将肝脏组织经过一系列的酒精脱水以及石蜡包埋与切片;然后将石蜡切片进行苏木素-伊红染色,最后切片封固。在显微镜下观察鼠肝脏组织的病理情况。
[0152]
结果如图15~17所示,pbs组小鼠肝脏出现肝细胞肿胀,脂滴弥漫,炎细胞浸润,见圆形或类圆形脂滴空泡,个别细胞肿大呈气球样变,细胞形态严重破坏。mrna中剂量组小鼠肝脏细胞肿胀程度减少,脂滴弥撒程度减轻,细胞核形态稍微完整规则。mrna高剂量组肝细胞形态恢复正常,肝细胞轮廓清晰可见,脂滴显著减少,无显著炎细胞浸润。
[0153]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。