1.本发明涉及微生物技术领域,尤其涉及调节菌群平衡的唾液乳杆菌。
背景技术:
2.皮肤作为人体最大的器官生活着广泛的微生物,皮肤构成了陷入部、经特化的间隙等多样形态的栖息地,帮助分布广泛的微生物能够生存。微生物与作为宿主的人构成了共生关系,皮肤微生物群在宿主中发挥重要而有用的功能,不仅因为它有能力抵抗皮肤病原体的粘附和发展,还因为它有能力与免疫系统对话和相互作用。当皮肤水平发生生态失调时,益生菌可以充当调节剂并恢复皮肤微生物群的平衡。
3.乳酸菌是人体内的有益微生物之一,其定植在肠粘膜上皮细胞上,担负分解纤维质及复合蛋白质而成为重要营养成分的作用。另外,由于使肠内环境保持酸性,并抑制其它病原菌的粘附。另外,乳酸菌还能增进巨噬细胞及脾脏的活性,表现出分泌及促进免疫反应相关物质的效果。具有免疫调节功能,对特应性及过敏相关疾病有效。在胃肠道400多种厌氧或好氧微生物中,乳酸菌约占10%。
4.近年来随着生物技术的发展,乳酸菌的各种使用价值不断被挖掘出来。乳酸菌除了可以被用到食品、药品外,乳酸菌在化妆品行业的开发与应用正日益受到重视。在化妆品领域,乳酸菌培养液自1955年商品化以来,至今仍在使用,主要利用链球菌(streptococcus)属、乳杆菌(lactobacillus)属、乳球菌(lactococcus)属、明串珠菌(leuconostoc)属、双歧杆菌(bifidobacterium)属等进行着活跃研究,包括直接在培养液中发酵、过滤或提取等原料形态以及接种于活性材料并发酵后过滤或提取等。已经报道了乳酸菌对抗菌、抗氧化和免疫活性的影响。近年来,研究集中在乳酸菌的增白和保湿作用,并且作为化妆品材料的可能性一直在增加。
5.唾液乳杆菌作为一种乳酸菌,广泛分布于含有碳水化合物的动植物发酵产品中,也见于温血动物的口腔、阴道和肠道内,在植物体表、乳制品、肉制品、啤酒、葡萄酒、果汁、麦芽汁、发酵面团、污水以及人畜粪便中,均可分离到。该菌分解糖的能力较强,分解蛋白质类的能力较低。一些如泡菜、腌菜、酒和酸奶食品生产过程中广泛用到该菌。但尚未见唾液乳杆菌在调节皮肤表面菌群平衡方面的报道。
技术实现要素:
6.有鉴于此,本发明要解决的技术问题在于提供调节皮肤表面菌群平衡的唾液乳杆菌。
7.本发明提供了保藏编号为cctcc no:m 20211389的唾液乳杆菌。
8.本发明还提供了保藏编号为cctcc no:m 20211389的唾液乳杆菌在制备调节菌群的产品中的应用。
9.本发明中,所述调节菌群包括促进有益菌增殖和/或抑制有害菌。
10.本发明中,所述抑制有害菌包括抑制有害菌生长、抑制有害菌凝集和/或抑制有害
菌形成生物膜。
11.一些实施例中,所述有害菌包括金黄色葡萄球菌、变异链球菌、人葡萄球菌、溶血葡萄球菌和/或铜绿假单胞菌中至少一种。一些实施例中,所述有益菌包括表皮葡萄球菌。
12.具体的,本发明研究表明,保藏编号为cctcc no:m 20211389的唾液乳杆菌能够抑制金黄色葡萄球菌、变异链球菌、人葡萄球菌、溶血葡萄球菌和/或铜绿假单胞菌中至少一种的活性、生长或增殖。该菌株还能够抑制金黄色葡萄球菌的凝集和/或形成生物膜。
13.本发明还提供了保藏编号为cctcc no:m 20211389的唾液乳杆菌在制备抗氧化的产品中的应用。
14.本发明中,所述抗氧化包括清除羟自由基和/或abts自由基。本发明所述抗氧化还包括提高总抗氧化能力。
15.本发明还提供了保藏编号为cctcc no:m 20211389的唾液乳杆菌在制备抗炎的产品中的应用。
16.一些实施例中,所述抗炎是抗由lps诱导的炎症。具体的,是抗由lps诱导的表皮细胞的炎症。所述表皮细胞为角质形成细胞。本发明中,所述抗炎包括降低no释放量和/或下调炎症因子水平。一些实施例中,所述炎症因子包括il-8、cox-2中至少一种。
17.本发明还提供了保藏编号为cctcc no:m 20211389的唾液乳杆菌在制备修复皮肤的产品中的应用。
18.本发明中所述修复皮肤包括修复细胞损伤和/或修复细胞划痕。
19.一些实施例中,所述修复皮肤细胞损伤包括在sds诱导条件下保护皮肤细胞的存活率。一些实施例中,所述皮肤细胞为角质形成细胞。
20.一些实施例中,所述修复细胞划痕包括为修复皮肤细胞的划痕,所述皮肤细胞为角质形成细胞。
21.本发明还提供了一种药物和/或化妆品,其原料包括保藏编号为cctcc no:m 20211389的唾液乳杆菌。
22.一些实施例中,本发明所述产品中包括如下i)~iv)中至少一种:
23.i)、保藏编号为cctcc no:m 20211389的唾液乳杆菌的活菌;
24.ii)、灭活的保藏编号为cctcc no:m 20211389的唾液乳杆菌;
25.iii)、保藏编号为cctcc no:m 20211389的唾液乳杆菌的培养物;
26.iv)、保藏编号为cctcc no:m 20211389的唾液乳杆菌的提取物。
27.本发明中,所述培养物包括培养获得的培养液,或者所述培养液经分离获得的上清液或菌体,或培养液经细胞破碎后获得的悬浮液。
28.本发明中,所述的提取物包括对培养物提取获得的多糖、蛋白或其他次生代谢产物。
29.本发明还提供了一种护理皮肤的方法,其为给予本发明所述的产品。
30.本发明所述护理皮肤包括调节菌群、抗氧化、抗炎和/或修复皮肤。所述给予的方式包括喷雾、涂抹、贴敷和/或导入。
31.本发明提供了保藏编号为cctcc no:m 20211389的唾液乳杆菌,本发明提供的唾液乳杆菌可以调节人体皮肤微生物菌群,促进表皮细胞增殖及修复,同时具有抗炎、抗氧化的功效,唾液乳杆菌profmic-201和/或其发酵液在医药品、食品、保养品或化妆品中的应
用。
32.生物保藏证明
33.唾液乳杆菌profmic-201 lactobacillus salivarius profmic-201,于2021年11月08日保藏在中国典型培养物保藏中心,地址为:中国,武汉,武汉大学,保藏编号为cctcc no:m 20211389。
附图说明
34.图1示profmic-201金黄色葡萄球菌抑菌能力图;
35.图2示profmic-201金黄色葡萄球菌抑菌率图;
36.图3示profmic-201抑制金黄色葡萄球菌形成生物膜图;
37.图4示profmic-201抑制金黄色葡萄球菌形成生物膜-od变化图;
38.图5示profmic-201共凝集金黄色葡萄球菌;
39.图6示profmic-201病原菌抑菌率图;
40.图7示profmic-201降低raw264.7细胞no释放量图;
41.图8示profmic-201上清液下调炎症相关因子的表达图;
42.图9示profmic-201灭活菌体下调炎症相关因子的表达图;
43.图10示profmic-201促进hacat细胞修复图;
44.图11示profmic-201hacat细胞划痕愈合图;
45.图12示profmic-201促进hacat细胞划痕愈合-愈合率;
46.图13示profmic-201清除自由基能力图。
具体实施方式
47.本发明提供了调节菌群平衡的唾液乳杆菌。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
48.本发明从13个月龄健康男婴鼻腔分离出一株唾液乳杆菌(lactobacillus salivarius),记为profmic-201,该菌株革兰氏阳性,显微镜下呈短杆状,无芽孢,无鞭毛;在mrs平板上生长,可形成粉色、表面光滑圆润的针尖状小菌落,边缘整齐,有溶钙圈;在mrs液体培养基中呈均匀浑浊生长,久置菌体呈白色沉淀。最适生长温度35~38℃,适宜ph为3.0~7.0。将其保藏于中国典型培养物保藏中心,保藏号为cctcc no:m20211389。
49.研究表明,本发明提供的唾液乳杆菌可以调节人体皮肤微生物菌群,促进表皮细胞增殖及修复,同时具有抗炎、抗氧化的功效,唾液乳杆菌profmic-201及/或其发酵液在医药品、食品、保养品或化妆品中的应用。
50.进一步的,本发明提供的保藏编号为cctcc no:m 20211389的唾液乳杆菌应用中的存在形式为存活的或灭活的,或为裂解物和/或提取物的形式,或为细菌产物的形式,或为上清液形式,或衍生物形式。所述衍生物形式包括但不限于:代谢产物、代谢生物产物、益生素、细胞壁或其相关成分、胞外多糖、或含有免疫原性成分的化合物。本发明实施例中,以
保藏编号为cctcc no:m 20211389的唾液乳杆菌的培养上清液、菌体或灭活菌体为受试物进行实验验证。
51.体外抑菌试验表明,本发明的唾液乳杆菌profmic-201具有抑制金黄色葡萄球菌的作用,抑菌圈可达14~25mm,抑菌能力25%~75%,抑菌率45%~80%。
52.体外凝集实验表明,本发明的唾液乳杆菌profmic-201具有凝集金黄色葡萄球菌的作用,凝集能力25%~40%;
53.本发明的唾液乳杆菌profmic-201具有抑制金黄色葡萄球菌成膜的作用,与金黄色葡萄球菌共培养24h后,profmic-201上清液生物膜形成抑制率为65%~80%;
54.本发明的唾液乳杆菌profmic-201具有抑制变异链球菌、人葡萄球菌、溶血葡萄球菌、铜绿假单胞菌等病原菌的作用,抑菌率15.6%~52.1%。
55.体外细胞实验表明,本发明的唾液乳杆菌profmic-201具有抗炎作用,能够降低lps诱导的raw264.7细胞no释放量,与对照组比可降低12%~45%;本发明的唾液乳杆菌profmic-201能够下调炎症因子il-8、cox-2基因的表达,可下调25%~50.2%。
56.体外细胞实验表明,本发明的唾液乳杆菌profmic-201具有促进表皮细胞修复的作用,划痕愈合率可达55%~83%,与对照相比提高5%~42%。
57.体外细胞实验表明,本发明的唾液乳杆菌profmic-201菌株具有消除自由基抗氧化的功能,羟自由基清除率12.1%~21.2%、abts自由基清除率10.0%~18.1%,总抗氧化能力提高25.2%~62.3%。
58.本发明中,所述药物为外用制剂,其剂型包括溶液剂、洗剂、乳剂、粉剂、软膏、糊剂。其中,所述洗剂包括水粉剂或混悬剂。
59.本发明中,所述化妆品可分为:清洁类化妆品、护理类化妆品及美容/修饰类化妆品。所述清洁类化妆品是指以涂抹、喷洒或其他类似方法,施于人体表面(如表皮、毛发、指甲、口唇等),起到清洁卫生作用或消除不良气味的化妆品。所述护理类化妆品是指以涂抹、喷洒或其他类似方法,施于人体表面(如表皮、毛发、指甲、口唇等),起到保养作用的化妆品。所述美容/修饰类化妆品是指以涂抹、喷洒或其他类似方法,施于人体表面(如表皮、毛发、指甲、口唇等),起到美容、修饰、增加人体魅力作用的化妆品。
60.皮肤适用的清洁类化妆品包括:洗面奶、卸妆水(乳)、清洁霜(蜜)、面膜、花露水、痒子粉、爽身粉或浴液;皮肤适用的护理类化妆品包括护肤膏霜、乳液或化妆水;皮肤适用的美容/修饰类化妆品包括:粉饼、胭脂、眼影、眼线笔(液)、眉笔、香水或古龙水;毛发适用清洁类化妆品包括洗发液、洗发膏或剃须膏;毛发适用的护理类化妆品包括护发素、发乳、发油/发蜡或焗油膏;毛发适用的美容/修饰类化妆品包括:定型摩丝/发胶、染发剂、烫发剂、睫毛液(膏)、生发剂或脱毛剂;指甲适用的清洁类化妆品包括洗甲液;指甲适用的护理类化妆品包括护甲水(霜)、指甲硬化剂;指甲适用的美容/修饰类化妆品包括指甲油;口唇适用的清洁类化妆品包括唇部卸妆液;口唇适用的护理类化妆品包括润唇膏;口唇适用的及美容/修饰类化妆品包括:唇膏、唇彩或唇线笔。
61.本发明采用的试材皆为普通市售品,皆可于市场购得。下面结合实施例,进一步阐述本发明:
62.实施例1profmic-201菌株的分离
63.mc琼脂培养基:大豆蛋白胨5g,牛肉浸膏5g,酵母浸膏5g,葡萄糖20g,乳糖20g,碳
酸钙10g,琼脂15g,1%中性红溶液5ml,蒸馏水1000ml,ph值6,121℃灭菌15min。
64.mrs液体培养基:蛋白胨10g,牛肉膏10g,酵母膏5g,柠檬酸氢二铵2g,葡萄糖20g,吐温-80lml,乙酸钠5g,磷酸氢二钾2g,硫酸镁0.58g,硫酸锰0.25g,蒸馏水1000ml,ph值6.2~6.4,121℃灭菌15min。
65.样品来源于13月龄健康男婴志愿者鼻腔。无菌采样于盛有5ml甘油的灭菌取样管中,取回后-20℃冷冻。分离时,将样品回溶,取1g于9ml生理盐水中震荡混匀,取上清划线于mc平板,37℃恒温培养24~48h后,挑取红色有溶钙圈的菌落,反复接种筛选,直至得到均匀的单个菌落,命名为profmic-201。
66.革兰氏染色镜检:菌株proffmic-201为g ,显微镜下呈短杆状,无芽孢,无鞭毛;在mc平板上生长,可形成粉色、表面光滑圆润的针尖状小菌落,边缘整齐,有溶钙圈;在mrs液体培养基中呈均匀浑浊生长,久置菌体呈白色沉淀。
67.实施例2profmic-201菌株的核酸鉴定
68.1、引物:
69.根据genbank中登录的乳酸菌16s rrna的基因序列,参考其368-1049位基因片段,设计引物:
70.f5-tcggctcgtaaaactctg-3’;
71.r5-ggacttaacccaacatctca-3’。
72.引物由上海生物工程有限公司合成,扩增片段为v3-v7,长682bp。
73.2、16srrna基因序列分析:
74.挑取单菌落置mrs离心管中,37℃培养过夜后,离心收集菌体,按照dna提取试剂盒步骤进行操作。pcr扩增体系为50μl体系,95℃预变性10min;93℃ 1min,55℃ 1min,72℃ 1min,35个循环;72℃延伸7min。
75.3、结果
76.用1.2%琼脂糖凝胶电泳分析pcr产物,在682bp处出现特异性目的条带,与预期大小相符合,测序结果与genbank中已发表的标准序列进行同源性比较后得出profmic-201菌株为唾液乳杆菌(lactobacillus salivarius)。
77.实施例3profmic-201抑制金黄色葡萄球菌——抑菌圈实验
78.1.唾液乳杆菌profmic-201菌液制备:
79.将活化的唾液乳杆菌profmic-201菌液以mrs培养于37℃培养箱静置培养18小时,使用分光光度计od600nm测定菌数,调整唾液乳杆菌液浓度为2
×
109cells/ml,为活菌液。活菌液离心取上清,得活菌液上清,30min沸水浴后得灭活菌液。
80.2、金黄色葡萄球菌菌液制备:
81.以肉汤培养基培养于摇床140r/min 37℃过夜,使用分光光度计od600nm测定菌数,调整乳酸菌液浓度为2
×
107cells/ml。
82.3、抑菌盘试验
83.取100μl菌液浓度为2
×
107cells/ml的金黄色葡萄球菌菌液进行涂盘(肉汤琼脂培养基);涂盘15min后,用9mm打孔器在菌盘上均匀打孔,去除孔内培养基,每孔加入待测菌液200μl。
84.4、抑菌能力计算方法
85.抑菌能力(au/ml)=(测试乳酸菌株量得抑菌圈直径-对照组量得抑菌圈直径)/添加盘中菌液体积
86.5、结果如表1:
87.表1 profmic-201抑制金黄色葡萄球菌抑菌能力
88.组别抑菌圈(mm)抑菌能力(au/ml)mrs9-profmic-201活菌液22.366.67profmic-201灭活菌液15.331.67
89.profmic-201活菌液和灭活菌液对金黄色葡萄球菌均具有抑制作用,且活菌液的抑菌能力更强。profmic-201金黄色葡萄球菌抑菌能力结果见图1。
90.实施例4profmic-201抑制金黄色葡萄球菌-菌液浓度变化实验
91.1.唾液乳杆菌profmic-201菌液制备:
92.将活化的唾液乳杆菌profmic-201菌液以mrs培养于37℃培养箱静置培养18小时,使用分光光度计od600nm测定菌数,调整唾液乳杆菌液浓度为2
×
109cells/ml,离心取上清,得活菌液上清;30min沸水浴后得灭活上清。
93.2、金黄色葡萄球菌菌液制备:
94.以肉汤培养基培养于摇床140r/min 37℃过夜,使用分光光度计od600nm测定菌数,调整乳酸菌液浓度为1
×
108cells/ml。
95.3、抑制金黄色葡萄球菌实验
96.分别将唾液乳杆菌活菌液和灭活菌液上清以5vol%加入金黄色葡萄球菌菌液,37℃静置4h,以菌液浓度(od600)降低百分比评价profmic-201对金黄色葡萄球菌生长影响。
97.4、结果如表2
98.表2 profmic-201金黄色葡萄球菌抑菌率
99.组别抑菌率(%)上清液77.2灭活上清液65.9
100.反应24h,唾液乳杆菌profmic-201具有抑制金黄色葡萄球菌的作用,活菌上清抑菌率77.2%,灭活上清抑菌率65.9%。profmic-201金黄色葡萄球菌抑菌率结果见图2。
101.实施例5profmic-201抑制金黄色葡萄球菌成膜试验
102.1.唾液乳杆菌profmic-201菌液制备:
103.将活化的唾液乳杆菌profmic-201菌液以mrs培养于37℃培养箱静置培养18小时,使用分光光度计od600nm测定菌数,调整唾液乳杆菌液浓度为2
×
109cells/ml,离心取上清,0.22μm滤膜过滤得上清液。
104.2、金黄色葡萄球菌菌液制备:
105.将金黄色葡萄球菌过夜培养至对数增长期,用肉汤培养基稀释至od600=0.1,每孔200μl添加至96孔板中。
106.3、抑制金黄色葡萄球菌形成生物膜实验
107.唾液乳杆菌profmic-201上清液以5%添加量添加至已接种金黄色葡萄球菌的96孔板中,添加mrs培养基做空白对照,每个样品重复三次,37℃,50rmp摇床孵育24h,弃上清
液,灭菌1
×
pbs清洗3次,加入固定液固定、结晶紫染色,检测od600。以生物膜形成抑制率评价profmic-201对金黄色葡萄球菌生物膜形成的影响。
108.计算公式:
109.生物膜形成抑制率(%)=(ax-ay)/ax
×
100%
110.注:ax:对照组600nm测得数值;ay:实验组600nm测得数值;
111.4、结果如表3:
112.表3 profmic-201抑制金黄色葡萄球菌形成生物膜
113.组别od600值抑制率(%)control0.801-profmic-201上清液0.23271.04
114.在培养24h后,profmic-201上清液生物膜形成抑制率为71.04%。profmic-201抑制金黄色葡萄球菌形成生物膜结果见图3、图4。
115.实施例6profmic-201促进金黄色葡萄球菌凝集研究
116.1、唾液乳杆菌profmic-201菌液制备:
117.将活化的唾液乳杆菌profmic-201菌液接种于mrs培养基中,培养于37℃培养箱18小时,121℃高压30min灭活,使用分光光度计od600nm测定菌数,4000rpm离心15分钟,弃上清,菌体用无菌1
×
pbs缓冲溶液清洗两次,再以1
×
pbs缓冲液回溶,调整乳酸菌浓度为5
×
109cells/ml。
118.2、金黄色葡萄球菌菌液制备:
119.以肉汤培养基37℃摇床培养18h,使用分光光度计od600nm测定菌液浓度,4000rpm离心15分钟,弃上清,菌体用灭菌后1
×
pbs缓冲溶液洗菌两次,再以1
×
pbs磷酸缓冲溶液回溶,调整金黄浓度为2.5
×
109cells/ml。
120.3、共凝集:将调整过菌液浓度的金黄色葡萄球菌与步骤1制备的唾液乳杆菌profmic-201菌液按照2:1体积比进行混合,以金黄色葡萄球菌加pbs作为对照,震荡15s后观察絮凝情况。
121.4、测定指标:不同时间取样单独乳酸菌、单独病原菌和乳酸菌与病原菌混和反应管溶液,由液面由上往向下50μl至于96孔板中,600nm测其数值。
122.计算公式:
123.凝集能力百分比(%)=[(ax ay)-2amix]/(ax ay)
×
100%;
[0124]
注:ax:单独乳酸菌在反应时间600nm测得数值;ay:单独金黄色葡萄球菌在反应时间600nm测得数值;amix:乳酸菌和病原菌混和作用后在反应时间600nm测得数值。
[0125]
5、结果如表4
[0126]
表4 profmic-201共凝集金黄色葡萄球菌
[0127]
组别od600值凝集率(%)profmic-2010.366-金黄色葡萄球菌0.434-profmic-201 金黄色葡萄球菌0.26633.5
[0128]
在反应2h后,profmic-201菌株凝集率为33.56%,因此profmic-201灭活菌体具有凝集金黄色葡萄球菌的作用。profmic-201共凝集金黄色葡萄球菌结果见图5.
[0129]
实施例7profmic-201菌株抑制病原菌实验
[0130]
1、唾液乳杆菌profmic-201菌液制备:
[0131]
将活化的唾液乳杆菌profmic-201菌液以mrs培养于37℃培养箱静置培养18小时,检测并调整od
600
=2.0,121℃,30min灭活,离心取上清液,0.22μm滤膜过滤,得待测样品。
[0132]
2、病原菌菌液制备:
[0133]
将4种病原菌:人葡萄球菌cgmcc no.1.493、溶血葡萄球菌cgmcc no.1.540、变异链球菌cgmcc no.1.2499、绿脓假单胞菌cgmcc no.1.1783以bhi培养基37℃培养18h,检测od
600
测定菌数,调整病原菌菌液浓度为1
×
108cells/ml。
[0134]
3、抑制病原菌实验
[0135]
将唾液乳杆菌上清液以5%体积分数加入病原菌中,37℃静置4h,以菌液浓度(od600)降低百分比评价profmic-201对病原菌生长影响。
[0136]
4、结果如表5:
[0137]
表5 profmic-201抑制病原菌抑菌率
[0138]
致病菌名称抑菌率(%)变异链球菌43.1人葡萄球菌20.3溶血葡萄球菌23.4铜绿假单胞菌19.7
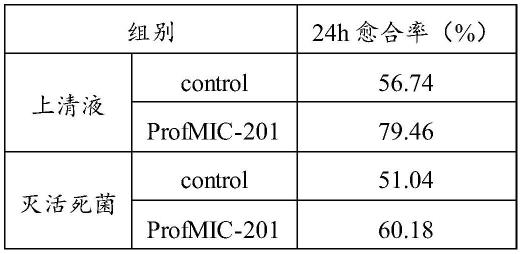
[0139]
反应24h,profmic-201对变异链球菌、人葡萄球菌、溶血葡萄球菌、铜绿假单胞菌等病原菌均具有较强的抑制作用。profmic-201病原菌抑菌率结果见图6。
[0140]
实施例8profmic-201促进表皮葡萄球菌生长实验
[0141]
将活化的唾液乳杆菌profmic-201以mrs液体培养基培养于37℃培养箱,静置培养16-2018h,检测od
600
测定菌数,调整od
600
=2.0,121℃,30min灭活,离心取上清,0.22μm滤膜过滤得灭活上清液。
[0142]
灭活上清液以10%体积分数加入初始od
600
=0.2的表皮葡萄球菌(模式菌株cgmcc no.1.4260)菌液中,37℃静置2h,以相对菌液浓度(样品od600与对照比值)评价唾液乳杆菌profmic-201对表皮葡萄球菌生长的影响。
[0143]
结果如表6:
[0144]
表6 profmic-201促进表皮葡萄球菌生长
[0145]
组别od600促进率(%)control0.89-profmic-2011.072520.5
[0146]
与对照比添加唾液乳杆菌profmic-201上清液促进表皮葡萄球菌的生长,促进率为20.5%。
[0147]
实施例9profmic-201菌株降低lps诱导的raw264.7细胞no释放量
[0148]
1、唾液乳杆菌样品制备
[0149]
将唾液乳杆菌profmic-201用mrs培养过夜,检测od600,调整od
600
=0.2,121℃高压灭菌30min,离心后,离心上清用0.22μm滤膜过滤得上清液,沉淀用1ml pbs回溶得灭活菌体。
[0150]
2、细胞制备
[0151]
将raw264.7细胞消化后以2
×
105cell/孔接种至24孔板,5%二氧化碳培养箱37℃培养过夜。
[0152]
3、profmic-201添加及lps刺激
[0153]
受试组1:受试细胞中添加profmic-201上清液5%(体积分数);
[0154]
受试组2:受试细胞中添加profmic-201灭活菌体10%(质量分数)。
[0155]
将上述两组受试物加入培养过夜的raw264.7细胞中,2h后以200nglps诱导raw264.7细胞发炎,20h后取细胞培养上清用no含量检测试剂盒进行no含量检测,共进行三批实验,每次3个复孔。实验以不添加受试物的经lps诱导raw264.7细胞发炎模型为对照,计算受试组1和受试组2对no生成量的抑制率。
[0156]
4、结果如表7:
[0157]
表7 profmic-201降低raw264.7细胞no释放量
[0158]
组别no抑制率(%)profmic-201上清液13.70profmic-201灭活菌体19.06
[0159]
与lps对照组相比,profmic-201上清液no抑制率13.7%;灭活菌体no抑制率19.1%,profmic-201菌株上清液和灭活菌体均对lps诱导的raw264.7细胞释放的no有抑制作用。profmic-201降低raw264.7细胞no释放量结果见图7。
[0160]
实施例10profmic-201菌株下调金黄色葡萄球菌诱导的hacat炎性因子表达量
[0161]
1、唾液乳杆菌样品制备
[0162]
将唾液乳杆菌profmic-201用mrs培养过夜,检测od600,调整od
600
=0.2,121℃高压灭菌30min,离心上清用0.22μm滤膜过滤得上清液,离心所得沉淀用1ml无菌1
×
pbs回溶得灭活菌体。
[0163]
2、细胞制备
[0164]
将hacat细胞消化后以2
×
105cell/孔接种至24孔板,5%二氧化碳培养箱37℃培养过夜。
[0165]
3、金黄色葡萄球菌制备及添加
[0166]
金黄色葡萄球菌接入肉汤培养基,37℃摇床培养过夜,用mem无血清培养基调整菌液浓度至3
×
109cell/ml,每孔100μl添加入培养过夜的hacat细胞中,刺激细胞产生炎症因子,3h后弃去细胞培养基,pbs清洗5次,每孔重新加入1ml mem无血清培养基。
[0167]
4、唾液乳杆菌样品添加
[0168]
将唾液乳杆菌profmic-201上清液5%体积分数、灭活菌体10%质量分数加入金黄色葡萄球菌刺激过的hacat细胞中,每组3个复孔,培养过夜。
[0169]
5、检测炎性因子表达量
[0170]
将上述细胞弃去培养基后,用rna提取试剂盒提取rna,检测rna浓度及纯度,将所有样品rna总量调整至1000ng进行反转录,对炎症相关基因进行qpcr,根据公式进行计算表达变化倍数。
[0171]
公式:f=2-δδct
[0172]
结果如表8~9:
[0173]
表8 profmic-201上清液下调炎症相关因子的表达
[0174]
炎症因子mrna相对表达倍数抑制率(%)il-80.86413.65cox-20.74725.26
[0175]
表9 profmic-201灭活菌体下调炎症相关因子的表达
[0176]
炎症因子mrna相对表达倍数抑制率(%)il-80.53546.5cox-20.68831.23
[0177]
唾液乳杆菌profmic-201上清液及灭活菌体均能够降低金黄色葡萄球菌诱导的hacat炎性因子il-8、cox-2表达量下调,因此profmic-201具有抗炎的作用。profmic-201下调炎症相关因子的表达结果见图8、图9。
[0178]
实施例11profmic-201菌株促进hacat细胞损伤修复实验
[0179]
接种hacat细胞(5
×
105cell/孔)至96孔板,过夜培养至细胞贴壁。配制50μg/ml sds,每孔加入100μl,孵育8h,
[0180]
实验分为三组:
[0181]
对照组不添加含有seuneu-105的成分;
[0182]
受试组1加入5vol%seuneu-105的灭活上清液;
[0183]
受试组2加入10wt%seuneu-105的灭活菌体。
[0184]
然后各组继续5%上清液液,孵育24h。加入10μl cck-8溶液,孵育4h,检测450nm处吸光值。
[0185]
细胞存活率=(a实验组-a空白对照组)/(a阴性对照组-a空白对照组)。
[0186]
结果表10:
[0187]
表10 profmic-201促进hacat细胞修复
[0188]
组别细胞存活率(%)sds100.00sds profmic-201上清液114.65sds profmic-201灭活菌体109.41
[0189]
profmic-201上清液sds损伤修复细胞存活率为114.65%,与对照比增加了14.65%;灭活菌体sds损伤修复细胞存活率为109.41%,与对照比增加了9.41%,profmic-201上清液及灭活菌体均对sds损伤的hacat细胞有修复作用。profmic-201促进hacat细胞修复结果见图10.
[0190]
实施例12profmic-201促进hacat细胞划痕实验
[0191]
接种人永生化角质形成细胞hacat(5
×
105cell/孔)至6孔板,过夜培养至细胞贴壁,使用1ml枪头垂直于6孔板板底进行划线;
[0192]
实验分为三组:
[0193]
对照组不添加含有profmic-201的成分;
[0194]
受试组1加入5vol%profmic-201的灭活上清液;
[0195]
受试组2加入10wt%profmic-201的灭活菌体。
[0196]
进行拍照,记为d1,并进行培养。隔天继续拍照,记为d2。使用image j进行数据处理,根据公式:愈合率=(d1-d2)/d1。使用graphpad对数据进行作图。
[0197]
结果表11:
[0198]
表11 profmic-201促进hacat细胞划痕愈合
[0199][0200]
唾液乳杆菌profmic-201菌株上清液划痕愈合率与对照比增长了22.72%,灭活菌体增长9.14%,唾液乳杆菌profmic-201具有促进hacat细胞划痕愈合的功效。profmic-201促进hacat细胞划痕愈合结果见图11、图12。
[0201]
实施例13profmic-201菌株的总抗氧化能力检测
[0202]
1、唾液乳杆菌profmic-201上清的制备:将活化的唾液乳杆菌profmic-201菌液以mrs培养于37℃培养箱静置培养18小时,使用分光光度计od600nm测定菌数,调整唾液乳杆菌液浓度度为1
×
109cells/ml,离心取上清高压灭活并过0.22μm的滤膜得到灭菌上清。
[0203]
2、准备总抗氧化能力(t-aoc)检测试剂盒
[0204]
3、使用96孔板200μl体系按照试剂盒说明加入试剂和profmic-201上清液,反应10min后用酶标仪在593nm下测定吸光值。根据吸光值带入标椎曲线计算得到x值。
[0205]
4、总抗氧化能力(μmol/ml)=x
×
v反总
÷
v样=x
×
34
[0206]
v反总:反应总体积,1.02ml;v样:反应中样本体积,0.03ml。
[0207]
5、结果表12:
[0208]
表12 profmic-201总抗氧化能力
[0209]
组别抗氧化能力(μmol/ml)提高率(%)control1.10profmic-2011.754.5
[0210]
按照总抗氧化能力检测试剂盒测定的唾液乳杆菌profmic-201的上清的总抗氧化能力为1.70μmol/ml,与对照比提高54.5%。
[0211]
实施例14profmic-201自由基清除能力检测
[0212]
1.唾液乳杆菌profmic-201菌液制备:
[0213]
将活化的唾液乳杆菌profmic-201菌液以mrs液体培养基培养于37℃培养箱静置培养18h,检测并调整od
600
=2.0,121℃,30min灭活,离心取上清液,0.22μm滤膜过滤获得待测样品。
[0214]
2.羟自由基清除能力检测
[0215]
试剂配制和检测方法按照索莱宝羟自由基清除能力检测试剂盒说明书进行。测定各样品536nm吸光度,求平均值并计算各样品清除率,公式如下:
[0216]
羟自由基清除率d%=[(a测定-a对照)
÷
(a空白-a对照)]
×
100%
[0217]
3.abts自由基清除能力检测
[0218]
试剂配制和检测方法按照索莱宝羟自由基清除能力检测试剂盒说明书进行。测定各样品405nm吸光度,求平均值并计算各样品清除率,公式如下:
[0219]
abts自由基清除率d%=[a空白-(a测定-a对照)]
÷
a空白
×
100%
[0220]
结果如表13:
[0221]
表13 profmic-201自由基清除率
[0222]
组别清除率(%)羟自由基15.40abts自由基12.91
[0223]
结果显示,profmic-201对羟自由基、abts自由基均具有清除作用,因此profmic-201具有抗氧化的功效。profmic-201清除自由基结果见图13。
[0224]
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
