1.本发明属于生物催化转化技术领域,涉及一种糖基转移酶对甜菊糖苷类化合物进行糖基化的方法及其衍生物和应用。
背景技术:
2.甜菊糖苷是从菊科植物甜叶菊的叶子中提取出来的一种糖苷,它具有高甜度、低热能的特点,是天然的甜味剂。其化学结构为一种二萜类化合物,以二萜类甜菊醇为基本骨架
1.。甜菊糖苷主要存在于甜叶菊叶片中,其叶片中含有甜茶苷(rub)、甜菊苷(st)、莱鲍迪苷a(ra)、莱鲍迪苷b(rb)、莱鲍迪苷d(rd)、莱鲍迪苷e(re)、莱鲍迪苷m(rm)等。除了高甜度低热量的优势,甜菊糖甙被认为具有重要的药理学生物活性,如抗氧化,抗菌,抗真菌,抗病毒,抗肿瘤、利尿、保胃(止泻)作用,能止痛,免疫调节作用,降血压、血糖,抑制肿瘤生长,促进细胞再生,以及强化血管
2.。使用甜菊糖甙作为甜味剂对肥胖症,糖尿病(ii型),高血压,心脑血管疾病,低血糖,龋齿等有辅助治疗作用
[2-3]
。因此,甜菊糖苷类化合物不仅作为甜味剂在食品工业中添加,还作为辅助治疗剂在保健药品中使用
[6]
。尽管甜菊糖苷产业处于蓬勃发展中,但口感中的苦涩余味对阻碍其的商业应用
[4]
。
[0003][0004]
大量的文献报道增加苷元上携带的β-葡萄糖的数量可以增强甜菊糖苷类化合物的甜度并改善口感降低苦味
[5]
。或者延长c19(r1)上的β-葡萄糖,同样可以减弱苦涩味。目前常用的酶法修饰为对甜菊糖苷类化合物进行糖基化,一般采用环糊精糖基转移酶和udp-糖基转移酶。前者低区域选择性导致产物混乱,需要配合特定的糖苷酶进行部分糖苷水解
food science and technology,103,264-281.
[0013]
7、chen,l.,sun,p.,zhou,f.,li,y.,chen,k.,jia,h.,
…
ouyang,p.(2018).synthesis of rebaudioside d,using glycosyltransferase ugtsl2 and in situ udp-glucose regeneration.food chemistry,259,286-291.
技术实现要素:
[0014]
本发明所要解决的问题是提出一种酶法糖基化甜菊糖苷类化合物的方法及其衍生物和应用,该方法利用蓝果树、枸杞、葡萄或烟草来源的糖基转移酶(vvugt、lbugt、nsugt、ntugt)和蔗糖合成酶偶联,实现酶法高效糖基化甜菊糖苷类化合物。该应用方法改善甜菊糖苷类化合物的口感,提升它的甜度,适于多种甜菊糖苷类化合物,该反应转化速率快,收率高,专一性强,产品副产物极少,操作流程简单,绿色环保无污染,生产成本低,适合于工业生产。其糖基化产品rub1g、rub1g、st1g、st2g,ra1g、rm2和rm1g等与相应底物相比甜味增加、苦味减少,是潜在的优质甜味剂。
[0015]
为解决上述技术问题,本发明采用的技术方案如下:
[0016]
一种酶法糖基化甜菊糖苷类化合物的方法,在糖基转移酶存在下,将葡萄糖基供体的糖基转移到甜菊糖苷类化合物的c19连接的第一个葡萄糖基的c-6’上和/或将葡萄糖基供体的糖基转移到甜菊糖苷类化合物的c19连接的第一个葡萄糖基的c-2’上。
[0017]
所述的一种酶法糖基化甜菊糖苷类化合物的方法,包括如下步骤:
[0018]
1)构建工程菌:克隆糖基转移酶基因与蔗糖合成酶基因,构建双酶共表达或分别表达的载体,并转移到宿主菌中,获得udp-糖基转移酶和/或蔗糖合成酶的工程菌;
[0019]
2)制备糖基化产物:将构建好的工程菌发酵产酶,发酵得到的菌体超声破碎或高压破碎,获得糖基转移酶和蔗糖合成酶的粗酶液;
[0020]
3)将粗酶液、糖基化底物、蔗糖在转化体系中进行糖基化反应;糖基转移酶催化底物进行转化反应制备得到糖基化产物;蔗糖合成酶将该过程生成的udp催化生成udp-葡萄糖作为糖基供体。
[0021]
所述糖基转移酶为来源于葡萄(vitis vinifera)的vvugt,或来源于枸杞(lycium barbarum)的lbugt,或来源于蓝果树(nyssa sinensis)的nsugt,或来源于烟草(nicotiana tomentosiformis)的ntugt。
[0022]
将糖基转移酶粗酶液、甜菊糖苷类化合物、糖基供体在转化体系中进行糖基化反应,糖基转移酶添加量为0.1~5g/l,甜菊糖苷类化合物添加量为0.1~1000g/l,糖基供体添加量为0.1~3000g/l,反应温度为20~80℃,反应时间为2~96h,反应ph 5-10。
[0023]
所述甜菊糖苷类化合物包括但不仅限于甜茶苷、甜菊苷、莱鲍迪苷a、莱鲍迪苷b、莱鲍迪苷d、莱鲍迪苷e、莱鲍迪苷m。
[0024]
在糖基转移酶vvugt或lbugt或nsugt或ntugt存在下,将葡萄糖基供体的糖基转移到甜菊糖苷类化合物的c19连接的第一个葡萄糖基的c-6’上,从而形成第一糖基化产物;
[0025]
在糖基转移酶vvugt或lbugt或nsugt或ntugt存在下,并且甜菊糖苷类化合物的c19连接的第一个葡萄糖基的c-6’上连接一个β-葡萄糖苷或为第一糖基化产物,将葡萄糖基供体的糖基转移到甜菊糖苷类化合物的c19连接的第一个葡萄糖基的c-2’上,从而形成第二糖基化产物。
[0026]
vvugt氨基酸序列如seq id no:1所示,核苷酸序列如seq id no:2所示;lbugt氨基酸序列如seq id no:3所示,核苷酸序列如seq id no:4所示;nsugt氨基酸序列如seq id no:5所示,核苷酸序列如seq id no:6所示;ntugt氨基酸序列如seq id no:7所示,核苷酸序列如seq id no:8所示。
[0027]
所述蔗糖合酶包括但不限于蔗糖合酶stsus,蔗糖合酶stsus核苷酸序列如seq id no:9所示。
[0028]
一种来源于葡萄(vitis vinifera)的糖基转移酶vvugt,其氨基酸序列如seq id no:1所示;编码vvugt酶的核苷酸序列如seq id no:2所示。
[0029]
所述糖基转移酶vvugt具有以下酶学性质:
[0030]
(1)在45℃、ph 8的条件下达到最大酶活性;
[0031]
(2)在底物存在的条件下,35℃以下酶活力在2h内能够保留95%以上的酶活力;
[0032]
(3)在底物存在的条件下,ph 7-9酶活力在2h内能够保留75%以上的酶活力;
[0033]
(4)额外添加金属离子(edta、zn
2
,mg
2
,ca
2
,ni
2
,mn
2
,cu
2
,和ba
2
),酶活皆呈现下降趋势,zn
2
,ni
2
和cu
2
直接使酶失活;
[0034]
糖基转移酶vvugt对底物甜茶苷、甜菊苷、莱鲍迪苷a、e的动力学参数km分别为1.0mm、2.4mm、7.3mm和25mm。
[0035]
在糖基化反应中,粗酶液在ph6-8的缓冲溶液中进行生物转化,反应温度为20-50℃,反应时间为1-36h,底物(甜茶苷,甜菊苷,莱鲍迪苷a、e、d、m)初始反应浓度为1-50g/l,蔗糖与甜茶苷的质量比为1-15,粗酶液总蛋白浓度为2-10mg/ml,蔗糖合酶与糖基转移酶的粗酶活力比为1-20。甜茶苷为底物,vvugt催化36h,甜茶苷转化率为100%,rub1g产率为45%,rub2g产率为40%;甜菊苷为底物,vvugt催化36h,甜菊苷化率为80%,st1g产率为35%,st2g产率为27%;莱鲍迪苷a为底物vvugt催化36h,莱鲍迪苷a转化率为60%,ra1g产率为30%,rm2产率为18%;莱鲍迪苷e为底物,在糖基转移酶为vvugt时催化36h,莱鲍迪苷e转化率为20%,st2g产率为13%;莱鲍迪苷d、m无新生产物。糖基转移酶vvugt偏好催化甜茶苷并生成rub1g和rub2g。
[0036]
一种来源于枸杞(lycium barbarum)的糖基转移酶lbugt,其氨基酸序列如seq idno:3所示,核苷酸序列如seq id no:4所示;
[0037]
所述糖基转移酶lbugt具有以下酶学性质:
[0038]
(1)在50℃、ph 8的条件下达到最大酶活性;
[0039]
(2)在底物存在的条件下,35℃以下酶活力在2h内能够保留95%以上的酶活力;
[0040]
(3)在底物存在的条件下,ph 7-9酶活力在2h内能够保留75%以上的酶活力;
[0041]
(4)额外添加金属离子(edta、zn
2
,mg
2
,ca
2
,ni
2
,mn
2
,cu
2
,和ba
2
),
[0042]
酶活皆呈现下降趋势,zn
2
,ni
2
和cu
2
直接使酶失活;
[0043]
酶催化对底物甜茶苷、甜菊苷、莱鲍迪苷a、莱鲍迪苷e和d的动力学参数km分别为1.2mm、2.1mm、2.4mm、2.3mm和6.9mm。
[0044]
在糖基化反应中,粗酶液在ph6-8的缓冲溶液中进行生物转化,反应温度为20-50℃,反应时间为1-36h,底物(甜茶苷,甜菊苷,莱鲍迪苷a、e、d、m)初始反应浓度为1-50g/l,蔗糖与甜茶苷的质量比为1-15,粗酶液总蛋白浓度为2-10mg/ml,蔗糖合酶与糖基转移酶的粗酶活力比为1-20。甜茶苷为底物,lbugt催化36h,甜茶苷转化率为80%,rub1g产率为
43%,rub2g产率为25%;甜菊苷为底物,lbugt催化36h,甜菊苷转化率为87%,st1g产率为48%,st2g产率为29%;莱鲍迪苷a为底物,lbugt时催化36h,莱鲍迪苷a转化率为90%,ra1g产率为49%,rm2产率为42%;莱鲍迪苷e为底物,lbugt时催化36h,莱鲍迪苷e转化率为73%,st2g产率为67%;莱鲍迪苷d,lbugt时催化36h,莱鲍迪苷d转化率为65%,rm2产率为58%;莱鲍迪苷m为底物,lbugt时催化36h,莱鲍迪苷m转化率为93%,rm1g产率为87%。糖基转移酶lbugt偏好催化莱鲍迪苷a和m,生成ra1g、rm2和rm1g。
[0045]
一种来源于蓝果树(nyssa sinensis)的糖基转移酶nsugt,氨基酸序列如seq id no:5所示,核苷酸序列如seq id no:6所示;
[0046]
所述糖基转移酶nsugt具有以下酶学性质:
[0047]
(1)在50℃、ph 8的条件下达到最大酶活性;
[0048]
(2)在底物存在的条件下,35℃以下酶活力在2h内能够保留95%以上的酶活力;
[0049]
(3)在底物存在的条件下,ph 7-9酶活力在2h内能够保留75%以上的酶活力;
[0050]
(4)额外添加金属离子(edta、zn
2
,mg
2
,ca
2
,ni
2
,mn
2
,cu
2
,和ba
2
),酶活皆呈现下降趋势,zn
2
,ni
2
和cu
2
直接使酶失活;
[0051]
(5)酶催化对底物甜茶苷、甜菊苷、莱鲍迪苷a、莱鲍迪苷e和d的动力学参数km分别为3.8mm、1.1mm、4.6mm、2.1mm和6.5mm。
[0052]
在糖基化反应中,粗酶液在ph6-8的缓冲溶液中进行生物转化,反应温度为20-50℃,反应时间为1-36h,底物(甜茶苷,甜菊苷,莱鲍迪苷a、e、d、m)初始反应浓度为1-50g/l,蔗糖与甜茶苷的质量比为1-15,粗酶液总蛋白浓度为2-10mg/ml,蔗糖合酶与糖基转移酶的粗酶活力比为1-20。甜茶苷为底物,nsugt催化36h,甜茶苷转化率为75%,rub1g产率为43%,rub2g产率为19%;甜菊苷为底物,nsugt催化36h,甜菊苷转化率为100%,st1g产率为54%,st2g产率为43%;莱鲍迪苷a为底物,nsugt催化36h,莱鲍迪苷a转化率为73%,ra1g产率为34%,rm2产率为22%;莱鲍迪苷e为底物,nsugt催化36h,莱鲍迪苷e转化率为100%,st2g产率为95%;莱鲍迪苷d为底物,nsugt催化36h,莱鲍迪苷d转化率为75%,rm2产率为67%;莱鲍迪苷m为底物,nsugt催化36h,莱鲍迪苷m转化率为72%,rm1g产率为67%。糖基转移酶nsugt偏好催化甜菊苷和莱鲍迪苷e,生成st1g和st2g。
[0053]
一种来源于烟草(nicotiana tomentosiformis)的糖基转移酶ntugt,其氨基酸序列如seq id no:7所示,核苷酸序列如seq id no:8所示。
[0054]
所述糖基转移酶ntugt具有以下酶学性质:
[0055]
(1)在55℃、ph 8的条件下达到最大酶活性;
[0056]
(2)在底物存在的条件下,35℃以下酶活力在2h内能够保留95%以上的酶活力;
[0057]
(3)在底物存在的条件下,ph 7-9酶活力在2h内能够保留80%以上的酶活力;
[0058]
(4)额外添加金属离子(edta、zn
2
,mg
2
,ca
2
,ni
2
,mn
2
,cu
2
,和ba
2
),酶活皆呈现下降趋势,zn
2
,ni
2
和cu
2
直接使酶失活;
[0059]
(5)酶催化对底物甜茶苷、甜菊苷、莱鲍迪苷a、莱鲍迪苷e和d的动力学参数km分别为1.9mm、4.5mm、3.8mm、2.7mm和2.6mm。
[0060]
在糖基化反应中,粗酶液在ph6-8的缓冲溶液中进行生物转化,反应温度为20-50℃,反应时间为1-36h,底物(甜茶苷,甜菊苷,莱鲍迪苷a、e、d、m)初始反应浓度为1-50g/l,蔗糖与甜茶苷的质量比为1-15,粗酶液总蛋白浓度为2-10mg/ml,蔗糖合酶与糖基转移酶的
粗酶活力比为1-20。甜茶苷为底物,ntugt催化36h,甜茶苷转化率为70%,rub1g产率为41%,rub2g产率为17%;甜菊苷为底物,ntugt催化36h,甜菊苷转化率为83%,st1g产率为51%,st2g产率为28%;莱鲍迪苷a为底物,ntugt催化36h,莱鲍迪苷a转化率为67%,ra1g产率为41%,rm2产率为13%;莱鲍迪苷e为底物,ntugt催化36h,莱鲍迪苷e转化率为66%,st2g产率为62%;莱鲍迪苷d为底物,在糖基转移酶为ntugt催化36h,莱鲍迪苷d转化率为100%,rm2产率为96%;莱鲍迪苷m为底物,ntugt催化36h,莱鲍迪苷m转化率为86%,rm1g产率为73%。糖基转移酶ntugt偏好催化莱鲍迪苷d,生成rm2。
[0061]
所述的蓝果树、枸杞、葡萄或烟草来源的糖基转移酶(vvugt、lbugt、nsugt、ntugt)在催化糖基化反应中的应用。在糖基化反应中,所述的糖基转移酶糖基化甜菊糖苷类化合物,在c19连接第一个糖基的c-6’及c-2’添加β-葡萄糖苷。在c-6’未连接糖苷时,优先在c-6’位置添加β-葡萄糖苷;当c-6’已连接糖苷时,在c-2’位置添加β-葡萄糖苷。
[0062]
所述糖基化反应能够广泛应用于催化甜菊糖苷类化合物糖基化反应。所述甜菊糖苷类化合物为以下组中一种或多种:存在于天然植物中的甜菊糖苷类化合物、提取的甜菊糖苷类化合物和合成的甜菊糖苷类化合物。
[0063]
所述甜菊糖苷类化合物包括但不仅限于甜茶苷、甜菊苷、莱鲍迪苷a、莱鲍迪苷b、莱鲍迪苷d、莱鲍迪苷e、莱鲍迪苷m。
[0064]
一种重组载体,含有上述糖基转移酶中的至少一种核苷酸序列。
[0065]
一种重组细胞,含有上述的重组载体或含有上述的糖基转移酶的核苷酸序列,可表达得到所述的糖基转移酶。
[0066]
一种生产糖基转移酶的方法,采用上述重组细胞发酵产酶。
[0067]
克隆糖基转移酶基因,构建表达载体,并转移到宿主菌中,获得糖基转移酶的工程菌,将构建好的工程菌发酵产酶,发酵得到的菌体超声破碎或高压破碎,获得糖基转移酶的粗酶液。所述宿主菌包括但不限于大肠杆菌、酿酒酵母、毕赤酵母或谷氨酸棒杆菌等。
[0068]
所述糖基转移酶能够广泛应用于甜菊糖苷类化合物糖基化反应,例如甜茶苷、甜菊苷、莱鲍迪苷a、莱鲍迪苷b、莱鲍迪苷d、莱鲍迪苷e、莱鲍迪苷m等。
[0069]
来源于蓝果树、枸杞、葡萄或烟草来源的糖基转移酶(vvugt、lbugt、nsugt、ntugt)糖基化甜菊糖苷类化合物反应中的应用,包括以下步骤:
[0070]
(1)构建工程菌:克隆糖基转移酶基因与蔗糖合成酶基因,构建双酶共表达或分别表达的载体,并转移到宿主菌中,获得udp-糖基转移酶和/或蔗糖合成酶的工程菌;
[0071]
(2)制备糖基化产物:将构建好的工程菌发酵产酶,发酵得到的菌体超声破碎或高压破碎,获得糖基转移酶和蔗糖合成酶的粗酶液;
[0072]
(3)将粗酶液、糖基化底物、蔗糖在转化体系中进行糖基化反应;糖基转移酶催化底物进行转化反应制备得到糖基化产物;蔗糖合成酶将该过程生成的udp催化生成udp-葡萄糖作为糖基供体。
[0073]
所述宿主菌包括但不限于大肠杆菌、酿酒酵母、毕赤酵母、枯草芽孢杆菌或谷氨酸棒杆菌等。
[0074]
进一步改进,所述的工程菌是导入udp-糖基转移酶基因(vvugt、lbugt、nsugt或ntugt)和蔗糖合成酶基因stsus的大肠杆菌、酿酒酵母、毕赤酵母、枯草芽孢杆菌和谷氨酸棒杆菌等。
[0075]
所述糖基化底物的初始反应浓度为1-1000g/l,蔗糖与糖基化底物的质量比为1-200,由共表达或分别表达上述两个酶的工程菌制备的粗酶液在反应体系中的总蛋白浓度为2-10mg/ml。蔗糖合酶与糖基转移酶的粗酶活力比为1-20。
[0076]
另一种改进,所述转化反应采用水相体系或双相体系,粗酶液在ph6-8的缓冲溶液中进行生物转化。
[0077]
所述水相体系为ph6-8的缓冲溶液中,所述缓冲液包括但不限于磷酸钾、磷酸钠和hepes缓冲液。
[0078]
所述双相体系为有机相与缓冲液混合的双相体系,所述有机相例如可以是dmso,缓冲液为磷酸缓冲液(ph6-8)。
[0079]
另一种改进,所述转化反应的反应温度为20-50℃,反应时间为1-96h。
[0080]
甜茶苷为底物合成第一糖基化产物rub1g和第二糖基化产物rub2g:
[0081]
所述转化反应采用水相体系,粗酶液在ph6-8的缓冲溶液中进行生物转化,反应温度为20-50℃,反应时间为1-36h,底物初始反应浓度为1-20g/l,蔗糖与甜茶苷的质量比为1-15,粗酶液总蛋白浓度为2-10mg/ml,蔗糖合酶与糖基转移酶的粗酶活力比为1-20。
[0082]
进一步地,粗酶液在ph 7.2的缓冲溶液中进行生物转化,反应温度为37℃,反应时间为1-40h,底物初始反应浓度为10g/l,蔗糖与甜茶苷的质量比为5,粗酶液总蛋白浓度为10mg/ml。在糖基转移酶为vvugt时催化36h,甜茶苷转化率为100%,rub1g产率为45%,rub2g产率为40%;在糖基转移酶为lbugt时催化36h,甜茶苷转化率为80%,rub1g产率为43%,rub2g产率为25%;在糖基转移酶为nsugt时催化36h,甜茶苷转化率为75%,rub1g产率为43%,rub2g产率为19%;在糖基转移酶为ntugt时催化36h,甜茶苷转化率为70%,rub1g产率为41%,rub2g产率为17%。在以甜茶苷为底物,产物rub1g、rub2g的生产中,vvugt产率最高。
[0083]
甜菊苷为底物合成第一糖基化产物st1g和第二糖基化产物st2g:
[0084]
所述转化反应采用水相体系,粗酶液在ph6-8的缓冲溶液中进行生物转化,反应温度为20-50℃,反应时间为1-36h,底物初始反应浓度为1-20g/l,蔗糖与甜菊苷的质量比为1-15,粗酶液总蛋白浓度为2-10mg/ml,蔗糖合酶与糖基转移酶的粗酶活力比为1-20。
[0085]
进一步地,粗酶液在ph 7.2的缓冲溶液中进行生物转化,反应温度为37℃,反应时间为1-40h,底物初始反应浓度为10g/l,蔗糖与甜菊苷的质量比为5,粗酶液总蛋白浓度为10mg/ml。在糖基转移酶为vvugt时催化36h,甜菊苷化率为80%,st1g产率为35%,st2g产率为27%;在糖基转移酶为lbugt时催化36h,甜菊苷转化率为87%,st1g产率为48%,st2g产率为29%;在糖基转移酶为nsugt时催化36h,甜菊苷转化率为100%,st1g产率为54%,st2g产率为43%;在糖基转移酶为ntugt时催化36h,甜菊苷转化率为83%,st1g产率为51%,st2g产率为28%。在以甜菊苷为底物,产物st1g、st2g的生产中,nsugt产率最高。
[0086]
莱鲍迪苷a为底物合成第一糖基化产物ra1g和第二糖基化产物rm2:
[0087]
所述转化反应采用水相体系,粗酶液在ph6-8的缓冲溶液中进行生物转化,反应温度为20-50℃,反应时间为1-36h,底物初始反应浓度为1-20g/l,蔗糖与莱鲍迪苷a的质量比为1-50,粗酶液总蛋白浓度为2-10mg/ml,蔗糖合酶与糖基转移酶的粗酶活力比为1-20。
[0088]
进一步地,粗酶液在ph 7.2的缓冲溶液中进行生物转化,反应温度为37℃,反应时间为1-40h,底物初始反应浓度为10g/l,蔗糖与莱鲍迪苷a的质量比为5,粗酶液总蛋白浓度
为10mg/ml。在糖基转移酶为vvugt时催化36h,莱鲍迪苷a转化率为60%,ra1g产率为30%,rm2产率为18%;在糖基转移酶为lbugt时催化36h,莱鲍迪苷a转化率为90%,ra1g产率为49%,rm2产率为42%;在糖基转移酶为nsugt时催化36h,莱鲍迪苷a转化率为73%,ra1g产率为34%,rm2产率为22%;在糖基转移酶为ntugt时催化36h,莱鲍迪苷a转化率为67%,ra1g产率为41%,rm2产率为13%。在以莱鲍迪苷a为底物,产物ra1g、rm2的生产中,lbugt产率最高。
[0089]
莱鲍迪苷e为底物合成st2g:
[0090]
所述转化反应采用水相体系,粗酶液在ph6-8的缓冲溶液中进行生物转化,反应温度为20-50℃,反应时间为1-36h,底物初始反应浓度为1-20g/l,蔗糖与莱鲍迪苷e的质量比为1-50,粗酶液总蛋白浓度为2-10mg/ml,蔗糖合酶与糖基转移酶的粗酶活力比为1-20。
[0091]
进一步地,粗酶液在ph 7.2的缓冲溶液中进行生物转化,反应温度为37℃,反应时间为1-40h,底物初始反应浓度为10g/l,蔗糖与莱鲍迪苷e的质量比为5,粗酶液总蛋白浓度为10mg/ml。在糖基转移酶为vvugt时催化36h,莱鲍迪苷e转化率为20%,st2g产率为13%;在糖基转移酶为lbugt时催化36h,莱鲍迪苷e转化率为73%,st2g产率为67%;在糖基转移酶为nsugt时催化36h,莱鲍迪苷e转化率为100%,st2g产率为95%;在糖基转移酶为ntugt时催化36h,莱鲍迪苷e转化率为66%,st2g产率为62%。在以莱鲍迪苷e为底物,产物st2g的生产中,nsugt产率最高。
[0092]
莱鲍迪苷d为底物合成rm2:
[0093]
所述转化反应采用采用双相(水相和有机相)体系,粗酶液在ph6-8的缓冲溶液中进行生物转化,反应温度为20-50℃,反应时间为1-40h,底物初始反应浓度为1-20g/l,蔗糖与莱鲍迪苷d的质量比为1-50,粗酶液总蛋白浓度为2-10mg/ml,蔗糖合酶与糖基转移酶的粗酶活力比为1-20。
[0094]
进一步地,粗酶液在ph 7.2的缓冲溶液中进行生物转化,反应温度为37℃,反应时间为1-36h,底物初始反应浓度为5g/l,蔗糖与莱鲍迪苷d的质量比为5,粗酶液总蛋白浓度为10mg/ml。在糖基转移酶为vvugt时催化36h,莱鲍迪苷d转化率为0%,rm2产率为0%;在糖基转移酶为lbugt时催化36h,莱鲍迪苷d转化率为65%,rm2产率为58%;在糖基转移酶为nsugt时催化36h,莱鲍迪苷d转化率为75%,rm2产率为67%;在糖基转移酶为ntugt时催化36h,莱鲍迪苷d转化率为100%,rm2产率为96%。在以莱鲍迪苷d为底物,产物st2g的生产中,ntugt产率最高。
[0095]
莱鲍迪苷m为底物合成rm1g:
[0096]
所述转化反应采用水相体系,粗酶液在ph6-8的缓冲溶液中进行生物转化,反应温度为20-50℃,反应时间为1-36h,底物初始反应浓度为1-20g/l,蔗糖与莱鲍迪苷m的质量比为1-50,粗酶液总蛋白浓度为2-10mg/ml,蔗糖合酶与糖基转移酶的粗酶活力比为1-20。
[0097]
进一步地,粗酶液在ph 7.2的缓冲溶液中进行生物转化,反应温度为37℃,反应时间为1-40h,底物初始反应浓度为5g/l,蔗糖与莱鲍迪苷m的质量比为5,粗酶液总蛋白浓度为10mg/ml。在糖基转移酶为vvugt时催化36h,莱鲍迪苷m转化率为0%,rm1g产率为0%;在糖基转移酶为lbugt时催化36h,莱鲍迪苷m转化率为93%,rm1g产率为87%;在糖基转移酶为nsugt时催化36h,莱鲍迪苷m转化率为72%,rm1g产率为67%;在糖基转移酶为ntugt时催化36h,莱鲍迪苷m转化率为86%,rm1g产率为73%。在以莱鲍迪苷m为底物,产物rm1g的生产
中,lbugt产率最高。
[0098]
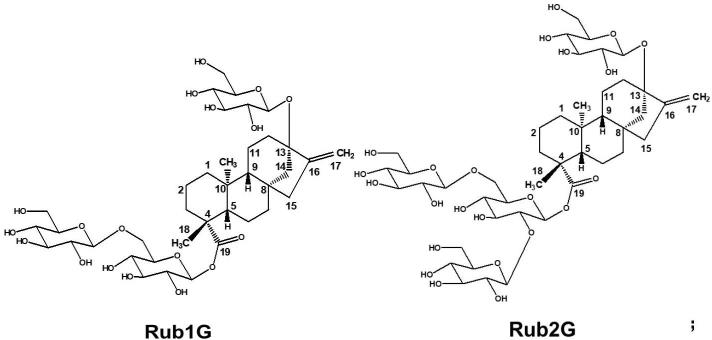
对糖基化甜菊糖苷类化合物的衍生物进行纯化,并通过一维和二维的nmr鉴定结构。确定了rub1g是在甜茶苷的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷,rub2g是在rub1g的c19连接的第一个葡糖糖基连接1,2-o-β-d-葡萄糖苷;st1g是在甜菊苷的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷,st2g是在st1g的c19连接的第一个葡糖糖基连接1,2-o-β-d-葡萄糖苷;ra1g是在莱鲍迪苷a的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷,rm2是在rub1g的c19连接的第一个葡糖糖基连接1,2-o-β-d-葡萄糖苷;st2g是在re的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷;rm2是在rd的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷;rm1g是在莱鲍迪苷m的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷。
[0099]
当所述甜菊糖苷类化合物为甜茶苷时,所述第一糖基化产物为rub1g,第二糖基化产物为rub2g,化学式如下所示:
[0100][0101]
当所述甜菊糖苷类化合物为甜菊苷时,所述第一糖基化产物为st1g,第二糖基化产物为st2g,化学式如下所示:
[0102]
[0103][0104]
当所述甜菊糖苷类化合物为莱鲍迪苷a时,所述第一糖基化产物为ra1g,第二糖基化产物为rm2。
[0105][0106]
当所述甜菊糖苷类化合物为莱鲍迪苷e时,所述第一糖基化产物为st2g。
[0107]
当所述甜菊糖苷类化合物为莱鲍迪苷d时,所述第一糖基化产物为rm2。
[0108]
当所述甜菊糖苷类化合物为莱鲍迪苷m时,所述第一糖基化产物为rm1g,化学式如下所示:
[0109][0110]
糖基化甜菊糖苷类化合物的衍生物高甜度,优质口感可作为潜在优质甜味剂。
[0111]
对糖基化甜菊糖苷类化合物的衍生物甜度及其对应产物甜度及口感评价。
[0112]
以甜茶苷为对照,对纯化后的rub1g、rub1g、st1g、st2g,ra1g、rm2和rm1g和其底物(甜茶苷、甜菊苷、莱鲍迪苷a、莱鲍迪苷d、莱鲍迪苷e、莱鲍迪苷m)进行感官评价。通过多名志愿者对已纯化衍生物极其底物进行甜度、口感评估。甜度评估:待评估样品稀释1~1000
×
,与1-50%的蔗糖水溶液做对照评估。口感评估,以甜茶苷为对照,评价相对口感等级。
[0113]
进一步地,甜度评估包括10名女性和10名男性在内的20名志愿者对口味质量和甜味强度进行了评估。rub1g、rub1g、st1g、st2g,ra1g、rm2、rm1g、甜茶苷、甜菊苷、莱鲍迪苷a、莱鲍迪苷d、莱鲍迪苷e和莱鲍迪苷m分别溶于水,得到5%(w/v)的溶液,然后依次稀释60~510
×
,间隔30
×
。志愿者们品尝了每个样品,并与5%的蔗糖进行比较,估算出甜度。口感评估包括以甜茶苷为“0”级,相对于甜茶苷的口感质量被评估为“极好( 4)、相当好( 3)、更好( 2)、稍好( 1)、相同(0)或更差(-1)”6个级别。甜度评估,糖基化衍生物与相应底物,甜度增长10-20%,口感提升1-2个等级。
[0114]
糖基化甜菊糖苷类化合物的衍生物稳定性强。
[0115]
对糖基化甜菊糖苷类化合物的衍生物在粉末贮藏、酸性水溶液及加热处理下稳定性的评估。以粉末贮藏,评测1-36个月,样品残余量。配置ph1-10的水溶液,评测1-10天,样品残余量。80-98℃水浴加热进行热处理,处理时长10-90min,计算样品残余量。
[0116]
进一步地,纯化后的粉末,置于凉爽通风处保存,保存12个月,样品残余量都达到98%以上。在ph2-7的水溶液中孵育7天,样品残余量都在97-99%之间。在95℃的水浴中热处理30min,残余量都在95-98%之间。
[0117]
udp-糖基转移酶在糖基化时一般固定催化某一类型的糖苷键,比如ugt76g1催化1,3-β-d-glycosidic糖苷键,而ugtsl2催化1,2-β-d-glycosidic糖苷键。但两者不仅催化c19糖基化,也催化c13糖基化,降低延长c19位的糖苷链的效率。此外ugtsl2在催化甜菊糖苷类化合物的1,2-β-d-glycosidic糖苷键的同时还伴有1,6-β-d-glycosidic糖苷键的副产物,导致产品纯度下降,增加提取产品难度,使工艺复杂化。而本发明的4个udp-糖基转移酶,不仅专一性催化c19糖基化,并在催化1,6-β-d-glycosidic糖苷键或1,2-β-d-glycosidic糖苷键的同时不产生其它糖苷键产物,只有在底物在c19连接的第一个葡糖糖基团全部1,6-β-d-glycosidic糖苷键的糖基化后才进入到1,2-β-d-glycosidic糖苷键的糖基化。此糖基化方法有效提高c19糖基化效率,且保证了产品的纯度,简化产品提纯的工艺。
[0118]
有益效果:
[0119]
本发明通过基因挖掘技术得到蓝果树、枸杞、葡萄或烟草来源的糖基转移酶(vvugt、lbugt、nsugt、ntugt),这4个酶具有天然的高稳定性和对甜菊糖苷类化合物亲和力,能够依次糖基化c19连接第一个糖基的c-6’及c-2’,并添加β-葡萄糖苷。
[0120]
本发明将蓝果树、枸杞、葡萄或烟草来源的糖基转移酶利用基因工程技术与蔗糖合成酶构建得到共表达高产重组菌株,得到适合产业化的廉价易得的高活性生物酶,以酶法合成获得大量糖基化产物。
[0121]
与其他糖基化甜菊糖苷类化合物方法相比,本项目涉及糖基转移酶在c19催化稀有的1,6-o-β-d-糖苷反应,且副产物几乎没有;在1,6-o-β-d-糖苷已具有的情况下在c19继续催化1,2-o-β-d-糖苷反应几乎没有副反应。该酶对甜菊糖苷类化合物,尤其是甜菊糖苷
和莱鲍迪苷m的表现出高效转化能力。蓝果树、枸杞、葡萄或烟草来源的糖基转移酶还专注于c19位的糖基化,大大益于甜菊糖苷类化合物的苦味消除,助力研发优质的新型甜菊糖苷类化合物甜味剂的。
附图说明
[0122]
图1.vvugt,lbugt,nsugt和ntugt粗提取物的sds-page分析。(m:蛋白marker,1:vvugt上清,2:vvugt沉淀,3:lbugt上清,4:lbugt沉淀,5:nsugt上清,6:nsugt沉淀,7:ntugt上清,8:ntugt沉淀)
[0123]
图2.纯化vvugt,lbugt,nsugt和ntugt的sds-page分析。(m:蛋白marker,1:纯化的vvugt,2:纯化的lbugt,3:纯化的nsugt,4:纯化的ntugt)
[0124]
图3.vvugt,lbugt,nsugt和ntugt的最适温度和温度稳定性曲线;
[0125]
图4.vvugt,lbugt,nsugt和ntugt的最适ph曲线;
[0126]
图5.vvugt,lbugt,nsugt和ntugt的温度稳定性曲线;
[0127]
图6.vvugt,lbugt,nsugt和ntugt的ph稳定性曲线;
[0128]
图7.部分甜菊糖苷类化合物糖基化衍生物结构。
具体实施方式
[0129]
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例中所描述的具体物料配比、工艺条件及其结果仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
[0130]
实施例1
[0131]
表达糖基转移酶vvugt,lbugt,nsugt及ntugt基因的大肠杆菌工程菌的构建及酶活测定
[0132]
本实施例使用基因挖掘技术获得糖基转移酶vvugt,lbugt,nsugt及ntugt,vvugt氨基酸序列如seq id no:1所示,核苷酸序列如seq id no:2所示;lbugt氨基酸序列如seq id no:3所示,核苷酸序列如seq id no:4所示;nsugt氨基酸序列如seq id no:5所示,核苷酸序列如seq id no:6所示;ntugt氨基酸序列如seq id no:7所示,核苷酸序列如seq id no:8所示。
[0133]
分别将糖基转移酶vvugt,lbugt,nsugt及ntugt两端加上ncoi和ecori酶切位点,通过双酶切、连接,基因片段插入表达载体prsfdue-1相应的酶切位点中,置于t7启动子的控制下,分别构建表达糖基转移酶基因的重组质粒prsf-vvugt,prsf-lbugt,prsf-nsugt,和prsf-ntugt。分别将重组质粒转化到e.coli bl21(de3)中,构建工程菌e.coli bl21(prsf-vvugt),e.coli bl21(prsf-lbugt),e.coli bl21(prsf-nsugt)和e.coli bl21(prsf-ntugt)。sdsp-page分析如图1。
[0134]
分别挑取工程菌e.coli bl21(prsf-vvugt),e.coli bl21(prsf-lbugt),e.coli bl21(prsf-nsugt)和e.coli bl21(prsf-ntugt)到含有50μg/ml卡那霉素的lb培养基(胰蛋白胨10g/l,氯化钠10g/l,酵母浸粉5g/l),37℃振荡培养过夜。当培养基od600值达到0.5-0.6时,然后按2%接种量接种到含有相应抗生素的100mllb培养基中,并在冷却后加入0.1mm iptg,诱导表达36h后,菌液于6500rpm,4℃离心3min,弃上清,沉淀备用。取菌体沉
淀,用磷酸钾缓冲液(100mmol/l,ph 7.2)洗涤两次,洗涤后的沉淀悬浮于磷酸钾缓冲液中,超声破碎处理细胞(功率300w,超声1s,间歇2s,共10min),破碎后的悬浮液于8000rpm,4℃离心20min,取上清即为粗酶液。
[0135]
糖基转移酶的酶活测定为3ml的反应体系中包含50mm,ph 7.2的磷酸钾缓冲液,2mm底物(甜茶苷、甜菊苷、莱鲍迪苷a、莱鲍迪苷e、莱鲍迪苷d、莱鲍迪苷m)和3mm udpg,1mg vvugt,lbugt,nsugt或ntugt粗蛋白,37℃下反应。高效液相制备色谱(hplc)检测,计算酶活。酶活具体数据如表1。
[0136]
表1.vvugt、lbugt、nsugt和ntugt相关酶活数据。
[0137][0138][0139]
实施例2:糖基转移酶vvugt,lbugt,nsugt及ntugt的蛋白纯化
[0140]
纯化的步骤在4℃下进行。分别取实施例1中工程菌e.coli bl21(prsf-vvugt),e.coli bl21(prsf-lbugt),e.coli bl21(prsf-nsugt)和e.coli bl21(prsf-ntugt)的菌体沉淀,将其重悬于适当的裂解缓冲液(包括500mm nacl和10%甘油和20mm磷酸钠缓冲液,ph 8.0)中,随后超声处理细胞。破碎后的悬浮液以6665g离心两次,每次持续15min。将上清液通过0.2μm孔径的水系纤维膜过滤,用高亲和力的带镍树脂ff预装柱(genscript,南京,中国)纯化带有6个his标签的蛋白。用梯度上升的咪唑梯度(以40mm、80mm、120mm、160mm和200mm的咪唑浓度梯度洗脱)从柱上洗脱重组蛋白,合并具有糖基转移酶活性的组分,并用带有μltracel-30膜的μltra-15离心过滤器中浓缩(爱尔兰默克密理博有限公司),同时将缓冲液更换为50mm hepes-naoh(ph 7.0)。纯化目标蛋白vvugt,lbugt,nsugt及ntugt的sds-page分析图如图2。
[0141]
实施例3:酶催化反应的最适温度测定
[0142]
在ph 7.250mm磷酸钠缓冲液反应体系中依次加入3mm udp、2mm甜茶苷,10μg实施例2纯化后的vvugt,lbugt,nsugt或ntugt的单一蛋白至终体积为300μl。分别置于25、30、35、40、45、50和55℃的反应条件下测定酶活。在水浴95℃下孵育5min以终止反应。
[0143]
其中酶活最高的设为100%,依次计算其他反应温度下的酶活相对值。根据结果绘制最适温度曲线(图3),vvugt,lbugt,nsugt和ntugt最适温度分别为45℃,50℃,50℃和55℃。
[0144]
实施例4:酶催化反应的最适ph测定
[0145]
不同ph的缓冲液配制如下:
[0146]
ph 4.0-5.0:100mm disodiumhydrogen-citric acidbuffer
[0147]
ph 6.0-8.0:100mm sodiumphosphatebuffer
[0148]
ph 9.0-10.0:100mm glycine buffer
[0149]
在ph4、5、6、7、8、9、10缓冲液的反应体系中依次加入3mm udp、2mm甜茶苷,10μg实施例2纯化后的vvugt,lbugt,nsugt或ntugt的单一蛋白至终体积为300μl,在37℃的条件下
反应,在水浴95℃下孵育5min以终止反应。hplc检测,计算酶活。
[0150]
其中酶活最高的设为100%,依次计算其他反应ph下的酶活相对值。根据结果绘制最适ph曲线(图4),vvugt,lbugt,nsugt和ntugt最适ph都为ph8。
[0151]
实施例5:酶催化反应的热稳定性测定
[0152]
在反应体系中依次加入3mm udpg,2mm甜菊苷,ph 7.250mm磷酸钠缓冲液反应体系及10μg实施例2纯化后的vvugt,lbugt,nsugt或ntugt的单一蛋白至终体积为300μl。在没有底物存在的条件下分别置于30、35、40、45、50、55和60℃孵育2h,之后加入底物并在37℃下反应,在水浴95℃下孵育5min终止反应。hplc检测,计算酶活。
[0153]
其中酶活最高的设为100%,依次计算其他反应下的酶活相对值,据此绘制热稳定型曲线(图5)。在没有底物存在的条件下,vvugt,lbugt,nsugt和ntugt都可以在35℃以下酶活力在2h内能够保留95%以上的酶活力。
[0154]
实时例6:酶催化反应的ph稳定性测定
[0155]
不同ph的缓冲液配制如实施例4.
[0156]
实施例2纯化后的vvugt,lbugt,nsugt或ntugt的单一蛋白分别置于ph 4、5、6、7、8、9、10孵育2h。随后在反应体系中依次加入3mm udpg,2mm甜菊苷及10μg孵育后的lbugt,ph 7.250mm磷酸钠缓冲液反应体系,反应温度为37℃,反应体积为300μl。在水浴95℃下孵育5min终止反应。hplc检测,计算酶活。
[0157]
其中酶活最高的设为100%,依次计算其他酶活相对值,据此绘制ph稳定型曲线(图6)。在ph7-9条件下孵育2h内vvugt,lbugt和nsugt仍有75%以上的活性,而ntugt仍有80%以上的活性。
[0158]
实施例7:酶催化动力学参数测定
[0159]
将不同底物(甜茶苷、甜菊苷、莱鲍迪苷a、e和d)分别配制成不同浓度(0.1、0.2、0.4、0.8、1.2、2.0、3.0、5.0mm),应体系中依次加入1-10mm udpg,ph 7.250mm磷酸钠缓冲液反应体系及10μg实施例2纯化后的vvugt,lbugt,nsugt或ntugt的单一蛋白,反应温度为37℃,反应体积为300μl。每个浓度的样品做3个平行样,取平均值。以标准浓度作为横坐标,吸光度作为纵坐标,绘制标准曲线,通过origin 2021进行线性回归得到标准方程。分别获得vvugt,lbugt,nsugt和ntugt催化甜茶苷、甜菊苷、莱鲍迪苷a、e和d的酶促动力学参数,详细数据如表2所示。
[0160]
表.2vvugt、lbugt、nsugt和ntugt相关动力学参数
[0161][0162]
实施例8:酶催化反应的二价金属离子影响
[0163]
配制3mm不同二价金属离子(edta,zn
2
,mg
2
,ca
2
,ni
2
,mn
2
,cu
2
,和ba
2
)的溶液。在反应体系中依次加入3mm不同二价金属离子,3mm udpg,2mm甜菊苷及10μg实施例2纯化后的vvugt,lbugt,nsugt或ntugt的单一蛋白,ph 7.250mm磷酸钠缓冲液反应体系,反应温度为37℃,反应体积为300μl。在水浴95℃下孵育5min终止反应。hplc检测,计算酶活。
[0164]
依据以未加金属离子的酶活检测为空白对照,其酶活设定为100%,依次计算其他酶活相对值。初步推断添加的二价金属离子都会降低10-30%的vvugt,lbugt,nsugt或ntugt的酶活。其中zn
2
,ni
2
和cu
2
直接使vvugt,lbugt,nsugt或ntugt失活。这与大多数gt-b折叠的糖基转移酶相似,都为非金属依赖的酶。
[0165]
实施例9:表达双酶基因的大肠杆菌工程菌的构建
[0166]
将来源于土豆的蔗糖合成酶基因stsus两端加上ncoi和ecori酶切位点,通过双酶切、连接,基因片段插入表达载体prsfdue-1相应的酶切位点中,置于t7启动子的控制下,构建表达土豆来源的蔗糖合成酶基因的重组质粒prsf-stsus。
[0167]
采用南京金斯瑞生物科技有限公司的试剂盒,在ndei和xhoi酶切位点间,分别将目的糖基转移酶基因克隆到上述prsf-stsus质粒载体上,获得构建双酶重组表达质粒prsf-vvugt-stsus,prsf-lbugt-stsus,prsf-nsugt-stsus和prsf-ntugt-stsus。将上述双酶重组表达质粒转化到e.coli bl21(de3)中,即得分别获得共表达双酶的工程菌e.coli bl21(prsf-vvugt-stsus),e.coli bl21(prsf-lbugt-stsus),e.coli bl21(prsf-nsugt-stsus)和e.coli bl21(prsf-ntugt-stsus)。
[0168]
实施例10:表达双酶基因的大肠杆菌工程菌发酵产酶
[0169]
挑取实施例9构建的含有表达双酶基因的工程菌e.coli bl21(prsf-lbugt-stsus)到含有50μg/ml卡那霉素的lb培养基(胰蛋白胨10g/l,氯化钠10g/l,酵母浸粉5g/l),37℃振荡培养过夜。当培养基od600值达到0.5-0.6时,然后按2%接种量接种到含有相应抗生素的100ml lb培养基中,并在冷却后加入0.1mm iptg,诱导表达36h后,菌液于6500rpm,4℃离心3min,弃上清,沉淀备用。
[0170]
取菌体沉淀,用磷酸钾缓冲液(100mmol/l,ph 7.2)洗涤两次,洗涤后的沉淀悬浮于磷酸钾缓冲液中,超声处理细胞(功率300w,超声1s,间歇2s,共10min),破碎后的悬浮液于8000rpm,4℃离心20min,取上清即为粗酶液。
[0171]
实施例11:10g/l甜茶苷为底物合成rub1g和rub2g
[0172]
在反应体系中依次加入10g/l甜茶苷,50g/l蔗糖,适量实施例10所述e.coli bl21(prsf-vvugt-stsus),e.coli bl21(prsf-lbugt-stsus),e.coli bl21(prsf-nsugt-stsus)或e.coli bl21(prsf-ntugt-stsus)的粗酶液(10mg/ml总蛋白量)及ph 7.250mm磷酸钠缓冲液至终体积20ml,混合均匀后置于37℃摇床,200rpm搅拌反应36h。置于95℃水浴10min灭活,再12,000rpm离心1min取上清液过0.45μm水系滤膜后用高效液相色谱检测。36h催化具体数据如表3所示。在以甜茶苷为底物,产物rub1g、rub2g的生产中,vvugt产率最高。
[0173]
hplc法色谱分析条件如下,以下实例中产物的检测方法相同:
[0174]
色谱柱:agilenttc-c18柱(250mm
×
4.6mm;荷兰);流动相a:乙腈 1
‰
甲酸,流动相b:水 1
‰
甲酸;流速:1ml
·
min-1;柱温:55℃;检测波长:210nm,检测时间:30min。检测条件:25-47%a相(0-15min),47-100%a相(15-20min),100-25%a相(25-30min)。
[0175]
实施例12:10g/l甜菊苷为底物合成st1g和st2g
[0176]
在反应体系中依次加入10g/l甜菊苷,50g/l蔗糖,适量实施例10所述e.coli bl21(prsf-vvugt-stsus),e.coli bl21(prsf-lbugt-stsus),e.coli bl21(prsf-nsugt-stsus)或e.coli bl21(prsf-ntugt-stsus)的粗酶液(10mg/ml总蛋白量)及ph 7.250mm磷酸钠缓冲液至终体积20ml,混合均匀后置于37℃摇床,200rpm搅拌反应24h。置于95℃水浴
10min灭活,再12,000rpm离心1min取上清液过0.45μm水系滤膜后用高效液相色谱检测。36h催化具体数据如表3所示。在以st为底物,产物st1g、st2g的生产中,nsugt产率最高。
[0177]
实施例13:10g/l莱鲍迪苷a为底物合成ra1g和rm2
[0178]
在反应体系中依次加入10g/l莱鲍迪苷a,50g/l蔗糖,适量实施例10所述e.coli bl21(prsf-vvugt-stsus),e.coli bl21(prsf-lbugt-stsus),e.coli bl21(prsf-nsugt-stsus)或e.coli bl21(prsf-ntugt-stsus)的粗酶液(10mg/ml总蛋白量)及ph 7.250mm磷酸钠缓冲液至终体积20ml,混合均匀后置于37℃摇床,200rpm搅拌反应36h。置于95℃水浴10min灭活,再12,000rpm离心1min取上清液过0.45μm水系滤膜后用高效液相色谱检测。36h催化具体数据如表3所示。在以莱鲍迪苷a为底物,产物ra1g、rm2的生产中,lbugt产率最高。
[0179]
实施例14:10g/l莱鲍迪苷e为底物合成st2g
[0180]
在反应体系中依次加入10g/l莱鲍迪苷e,50g/l蔗糖,适量实施例10所述e.coli bl21(prsf-vvugt-stsus),e.coli bl21(prsf-lbugt-stsus),e.coli bl21(prsf-nsugt-stsus)或e.coli bl21(prsf-ntugt-stsus)的粗酶液(10mg/ml总蛋白量)及ph 7.250mm磷酸钠缓冲液至终体积20ml,混合均匀后置于37℃摇床,200rpm搅拌反应36h。置于95℃水浴10min灭活,再12,000rpm离心1min取上清液过0.45μm水系滤膜后用高效液相色谱检测。36h催化具体数据如表3所示。在以莱鲍迪苷e为底物,产物st2g的生产中,nsugt产率最高。
[0181]
实施例15:5g/l莱鲍迪苷d为底物合成rm2
[0182]
在反应体系中依次加入5g/l莱鲍迪苷d,50g/l蔗糖,适量实施例10所述e.coli bl21(prsf-vvugt-stsus),e.coli bl21(prsf-lbugt-stsus),e.coli bl21(prsf-nsugt-stsus)或e.coli bl21(prsf-ntugt-stsus)的粗酶液(10mg/ml总蛋白量)及ph 7.250mm磷酸钠缓冲液至终体积20ml,混合均匀后置于37℃摇床,200rpm搅拌反应36h。置于95℃水浴10min灭活,再12,000rpm离心1min取上清液过0.45μm水系滤膜后用高效液相色谱检测。36h催化具体数据如表3所示。在以莱鲍迪苷d为底物,产物st2g的生产中,ntugt产率最高。
[0183]
实施例16:5g/l莱鲍迪苷m为底物合成rm1g
[0184]
在反应体系中依次加入5g/l莱鲍迪苷m,50g/l蔗糖,适量实施例10所述e.coli bl21(prsf-vvugt-stsus),e.coli bl21(prsf-lbugt-stsus),e.coli bl21(prsf-nsugt-stsus)或e.coli bl21(prsf-ntugt-stsus)的粗酶液(10mg/ml总蛋白量)及ph 7.250mm磷酸钠缓冲液至终体积20ml,混合均匀后置于37℃摇床,200rpm搅拌反应36h。置于95℃水浴10min灭活,再12,000rpm离心1min取上清液过0.45μm水系滤膜后用高效液相色谱检测。36h催化具体数据如表3所示。在以莱鲍迪苷m为底物,产物rm1g的生产中,lbugt产率最高。
[0185]
表.3vvugt、lbugt、nsugt、ntugt对甜菊糖苷类化合物转化率及其糖基化衍生物的产率
[0186][0187]
实施例17:对糖基化衍生物纯化及结构表征
[0188]
通过大孔树脂对糖基化产物进行吸附,使用30-90%乙醇水溶液进行洗脱,旋蒸仪浓缩,置于4℃冰箱结晶获取纯度95%以上的rub1g、rub1g、st1g、st2g,ra1g、rm2和rm1g。通过检测甲基化产物验证糖苷键种类和1h nmr,
13
c nmr,distortionless enhancement polarization transfer(dept),1h-1
h correlation spectroscopy(cosy),1h-13
c heteronuclear single quantum coherence(hsqc),1h-13
c heteronuclear multiple bond correlation(hmbc),1h-1
h nuclear overhauser effect spectroscopy(noesy)及total correlation spectroscopy(tocsy),对糖基化衍生物进行结构表征。
[0189]
其甲基化产物检测结果如表4所示,部分nmr分析数据如表5所示。确定了rub1g是在甜茶苷的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷,rub2g是在rub1g的c19连接的第一个葡糖糖基连接1,2-o-β-d-葡萄糖苷;st1g是在甜菊苷的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷,st2g是在st1g的c19连接的第一个葡糖糖基连接1,2-o-β-d-葡萄糖苷;ra1g是在莱鲍迪苷a的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷,rm2是在rub1g的c19连接的第一个葡糖糖基连接1,2-o-β-d-葡萄糖苷;st2g是在re的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷;rm2是在rd的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷;rm1g是在莱鲍迪苷m的c19连接的第一个葡糖糖基连接1,6-o-β-d-葡萄糖苷。rub1g、rub1g、st1g、st2g,ra1g、rm2和rm1g结构如下式所示:
[0190]
部分甜菊糖苷类化合物糖基化衍生物结构式
[0191][0192]
表.4 rub1g及rub2g混合物甲基化产物检测结果
[0193][0194]
*相对摩尔量=峰面积/分子量;
[0195]
*相对摩尔比(%)=相对摩尔量/各组分相对摩尔量总和
[0196]
表.5rub2g的一维、二维nmr结构表征数据分析
[0197]
[0198][0199]
实施例18:对lbugt糖基化甜菊糖苷类化合物的衍生物甜度及口感鉴定
[0200]
以甜茶苷为对照,对纯化后的rub1g、rub1g、st1g、st2g,ra1g、rm2和rm1g和其底物(甜茶苷、甜菊苷、莱鲍迪苷a、莱鲍迪苷d、莱鲍迪苷e、莱鲍迪苷m)进行感官评价。包括10名女性和10名男性在内的20名志愿者对口味质量和甜味强度进行了评估。rub1g、rub1g、st1g、st2g,ra1g、rm2、rm1g、甜茶苷、甜菊苷、莱鲍迪苷a、莱鲍迪苷d、莱鲍迪苷e和莱鲍迪苷m分别溶于水,得到5%(w/v)的溶液,然后依次稀释60~510
×
,间隔30
×
。志愿者们品尝了
每个样品,并与5%的蔗糖进行比较,估算出甜度。计算一个主观相等点(pse)来表示每个样品的相对甜味强度[8]。相对于甜茶苷的口感质量被评估为“极好( 4)、相当好( 3)、更好( 2)、稍好( 1)、相同(0)或更差(-1)”。
[0201]
测定结果如表6所示,lbugt糖基化衍生物相对其底物,在甜度增加约10-20%,口感等级增加1-2级,苦味和涩味大大降低,提高相关甜味剂的品质。
[0202]
表.6部分甜菊糖苷类化合物及其糖基化衍生物的感官评价
[0203][0204]a相对甜度:设定5%(质量/体积)蔗糖水溶液相对甜度为1。
[0205]b口感等级:设定甜茶苷口感等级为0,相对于甜茶苷的口感质量被评估为“极好( 4)、相当好( 3)、更好( 2)、稍好( 1)、相同(0)或更差(-1)”。
[0206]
实施例18:对糖基化甜菊糖苷类化合物的衍生物稳定性鉴定
[0207]
考察了vvugt,lbugt,nsugt及ntugt糖基化甜菊糖苷类化合物的衍生物以粉末形式,在干燥阴凉的环境下贮藏稳定性。将纯化的rub1g、rub1g、st1g、st2g,ra1g、rm2和rm1g以粉末的形式在干燥阴凉的环境下贮藏一年。贮藏结束后,分别配置1mg/ml的水溶液,进行hplc检测。
[0208]
考察了vvugt,lbugt,nsugt及ntugt糖基化甜菊糖苷类化合物的衍生物在ph2.0-7.0下的ph稳定性。1毫升各种缓冲液(100mm甘氨酸-盐酸缓冲液,ph 2.0和3.0;100mm氢柠檬酸二钠缓冲液,ph值4.0、5.0、6.0;100mm磷酸钠缓冲液,ph 7.0),含分别配置不同酸性ph下1mg/ml的rub1g、rub1g、st1g、st2g,ra1g、rm2和rm1g,室温孵育7天。
[0209]
考察了糖基化甜菊糖苷类化合物的衍生物的热处理稳定性分别配置1ml的水溶液含1mg/ml的rub1g、rub1g、st1g、st2g,ra1g、rm2或rm1g在95℃的水浴中进行30min的测试。
[0210]
结果表明这些vvugt,lbugt,nsugt及ntugt糖基化甜菊糖苷类化合物的衍生物具有良好的稳定性。以粉末形式贮藏一年后,残余量都达到98%以上。在ph2-7的水溶液中孵育7天,残余量都在98%以上,具体残余量数据如表7所示。在95℃的水浴中热处理30min,残余量都在95-98%之间。确保这些糖基化甜菊糖苷类化合物的衍生物,在长期贮存、添加于饮料及加热灭菌处理的情况下都能保证结构的完整性。
[0211]
表.7糖基化衍生物酸性水环境稳定性
[0212][0213]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。