除草剂耐受性蛋白质、其编码基因及用途
1.本技术为中国专利申请202010194585.0的分案申请,发明名称:除草剂耐受性蛋白质、其编码基因及用途,申请日:2020年3月19日。
技术领域
2.本发明涉及一种除草剂耐受性蛋白质、其编码基因及用途,特别是涉及一种对hppd抑制剂除草剂具有耐受性的蛋白质、其编码基因及用途。
背景技术:
3.羟基苯丙酮酸双加氧酶(hydroxyphenylpyruvate dioxygenase,简称hppd)是一种酶,其在铁离子(fe
2
)和氧的存在下,催化酪氨酸的降解产物-对羟基苯丙酮酸(hydroxyphenylpyruvic acid,简称hpp)转化为植物中生育酚和质体醌(plastoquinone,简称pq)的前体-尿黑酸盐/尿黑酸(homogentisate,简称hg)的反应。生育酚具有膜相关抗氧化剂的作用;pq不仅是psⅱ和细胞色素b6/f复合物之间的电子载体,而且是类胡萝卜素生物合成中八氢番茄红素去饱和酶的必需辅因子。
4.通过抑制hppd而发挥作用的除草剂主要有三酮类、异噁唑类和吡唑啉酮类三个化学家族。在植物中,它们通过抑制hppd阻断了从酪氨酸生物合成pq,从而导致pq耗尽,类胡萝卜素缺乏。上述抑制hppd的除草剂是植物韧皮部可移动的漂白剂,其可以引起暴露于光的新的分生组织和叶片显现出白色,而类胡萝卜素对于光防护是必需的,在缺乏类胡萝卜素的情况下,紫外线辐射和活性氧中间体会破坏叶绿素的合成和功能,从而导致植物生长受到抑制,甚至死亡。
5.用于提供耐受hppd抑制剂除草剂植物的方法主要包括:1)将hppd过量表达从而在植物中产生大量的hppd,尽管存在hppd抑制剂除草剂,但这些hppd与该hppd抑制剂除草剂是充分作用的,从而具有足够的可供使用的功能性酶。2)将目标hppd突变成一种功能性hppd,该功能性hppd对于除草剂或其活性代谢物是较不敏感的,但其保留了转化为hg的性质。关于突变体hppd类,虽然一种给定的突变体hppd可以提供一个有用水平的对于一些hppd抑制剂除草剂的耐受性,但是相同的突变体hppd可能不足以提供一个商业化水平的对于一种不同的、更希望的hppd抑制剂除草剂的耐受性;例如,hppd抑制剂除草剂可以在它们控制的杂草范围、它们的制造成本、以及它们的环境友好性方面是不同的。因此,需要用于向不同的作物和作物品种赋予hppd抑制剂除草剂耐受性的新的方法和/或组合物。
技术实现要素:
6.本发明的目的是提供一种新的蛋白质、其编码基因及用途,所述蛋白质不仅具有hppd酶活性,而且使得转入所述蛋白质编码基因的植物对hppd抑制剂除草剂具有耐受性。
7.为实现上述目的,本发明提供了一种蛋白质,包括:
8.(a)具有seq id no:6或seq id no:9所示的氨基酸序列;
9.(b)在(a)中的氨基酸序列经过取代和/或缺失和/或添加一个或几个氨基酸且具
有羟基苯丙酮酸双加氧酶活性的由(a)衍生的蛋白质。
10.为实现上述目的,本发明提供了一种基因,包括:
11.(a)编码权利要求1所述蛋白质的核苷酸序列;或
12.(b)在严格条件下与(a)限定的核苷酸序列杂交且编码具有羟基苯丙酮酸双加氧酶活性的蛋白质的核苷酸序列;或
13.(c)具有seq id no:7、seq id no:8、seq id no:10或seq id no:11所示的核苷酸序列。
14.所述严格条件可为在6
×
ssc(柠檬酸钠)、0.5%sds(十二烷基硫酸钠)溶液中,在65℃下杂交,然后用2
×
ssc、0.1%sds和1
×
ssc、0.1%sds各洗膜1次。
15.为实现上述目的,本发明还提供了一种表达盒,包含在有效连接的调控序列调控下的所述基因。
16.为实现上述目的,本发明还提供了一种包含所述基因或所述表达盒的重组载体
17.为实现上述目的,本发明还提供了一种扩展植物耐受的除草剂范围的方法,包括:将所述蛋白质或所述表达盒编码的蛋白质在植物中与至少一种不同于所述蛋白质或所述表达盒编码的蛋白质的第二种除草剂耐受性蛋白质一起表达。
18.进一步地,所述第二种除草剂耐受性蛋白质为5-烯醇丙酮酰莽草酸-3-磷酸合酶、草甘膦氧化还原酶、草甘膦-n-乙酰转移酶、草甘膦脱羧酶、草铵膦乙酰转移酶、α酮戊二酸依赖性双加氧酶、麦草畏单加氧酶、乙酰乳酸合酶、细胞色素类蛋白质和/或原卟啉原氧化酶。
19.为实现上述目的,本发明还提供了一种选择转化的植物细胞的方法,包括:用所述基因或所述表达盒转化多个植物细胞,并在允许表达所述基因或所述表达盒的转化细胞生长,而杀死未转化细胞或抑制未转化细胞生长的hppd抑制剂除草剂浓度下培养所述细胞;
20.优选地,所述植物包括单子叶植物和双子叶植物;更优选地,所述植物为燕麦、小麦、大麦、谷子、玉米、高粱、二穗短柄草、水稻、烟草、向日葵、苜蓿、大豆、鹰嘴豆、花生、甜菜、黄瓜、棉花、油菜、土豆、番茄或拟南芥;
21.优选地,所述hppd抑制剂除草剂包括吡唑啉酮类hppd抑制剂除草剂、三酮类hppd抑制剂除草剂和/或异噁唑类hppd抑制剂除草剂;更优选地,所述hppd抑制剂除草剂为苯吡唑草酮、硝磺草酮和/或二酮腈。
22.为实现上述目的,本发明还提供了一种控制杂草的方法,包括:对种植目的植物的大田施用有效剂量的hppd抑制剂除草剂,所述目的植物包含所述基因或所述表达盒或所述重组载体;
23.优选地,所述目的植物包括单子叶植物和双子叶植物;更优选地,所述目的植物为燕麦、小麦、大麦、谷子、玉米、高粱、二穗短柄草、水稻、烟草、向日葵、苜蓿、大豆、鹰嘴豆、花生、甜菜、黄瓜、棉花、油菜、土豆、番茄或拟南芥;进一步优选地,所述目的植物为草甘膦耐受性植物,所述杂草为草甘膦抗性杂草;
24.优选地,所述hppd抑制剂除草剂包括吡唑啉酮类hppd抑制剂除草剂、三酮类hppd抑制剂除草剂和/或异噁唑类hppd抑制剂除草剂;更优选地,所述hppd抑制剂除草剂为苯吡唑草酮、硝磺草酮和/或二酮腈。
25.为实现上述目的,本发明还提供了一种用于保护植物免受由hppd抑制剂除草剂引
起的损伤或赋予植物hppd抑制剂除草剂耐受性的方法,包括:将所述基因或所述表达盒或所述重组载体导入植物,使导入后的植物产生足够保护其免受hppd抑制剂除草剂损害量的除草剂耐受性蛋白质;
26.优选地,所述植物包括单子叶植物和双子叶植物;更优选地,所述植物为燕麦、小麦、大麦、谷子、玉米、高粱、二穗短柄草、水稻、烟草、向日葵、苜蓿、大豆、鹰嘴豆、花生、甜菜、黄瓜、棉花、油菜、土豆、番茄或拟南芥;
27.优选地,所述hppd抑制剂除草剂包括吡唑啉酮类hppd抑制剂除草剂、三酮类hppd抑制剂除草剂和/或异噁唑类hppd抑制剂除草剂;更优选地,所述hppd抑制剂除草剂为苯吡唑草酮、硝磺草酮和/或二酮腈。
28.为实现上述目的,本发明还提供了一种产生耐受hppd抑制剂除草剂的植物的方法,包括向植物的基因组中引入所述基因;
29.优选地,所述引入的方法包括遗传转化方法、基因组编辑方法或基因突变方法;
30.具体地,所述产生耐受hppd抑制剂除草剂的植物的方法包括:通过将亲本植物自交或与第二种植物杂交而产生hppd抑制剂除草剂耐受性植物,所述亲本植物和/或第二种植物包含所述基因或所述表达盒,所述hppd抑制剂除草剂耐受性植物遗传了来自所述亲本植物和/或第二种植物的所述基因或所述表达盒;
31.优选地,所述植物包括单子叶植物和双子叶植物;更优选地,所述植物为燕麦、小麦、大麦、谷子、玉米、高粱、二穗短柄草、水稻、烟草、向日葵、苜蓿、大豆、鹰嘴豆、花生、甜菜、黄瓜、棉花、油菜、土豆、番茄或拟南芥;
32.优选地,所述hppd抑制剂除草剂包括吡唑啉酮类hppd抑制剂除草剂、三酮类hppd抑制剂除草剂和/或异噁唑类hppd抑制剂除草剂;更优选地,所述hppd抑制剂除草剂为苯吡唑草酮、硝磺草酮和/或二酮腈。
33.为实现上述目的,本发明还提供了一种培养耐受hppd抑制剂除草剂的植物的方法,包括:
34.种植至少一个植物繁殖体,所述植物繁殖体的基因组中包括所述基因或所述表达盒;
35.使所述植物繁殖体长成植株;
36.将有效剂量的hppd抑制剂除草剂施加到至少包含所述植株的植物生长环境中,收获与其他不具有所述基因或所述表达盒的植株相比具有减弱的植物损伤和/或具有增加的植物产量的植株;
37.优选地,所述植物包括单子叶植物和双子叶植物;更优选地,所述植物为燕麦、小麦、大麦、谷子、玉米、高粱、二穗短柄草、水稻、烟草、向日葵、苜蓿、大豆、鹰嘴豆、花生、甜菜、黄瓜、棉花、油菜、土豆、番茄或拟南芥;
38.优选地,所述hppd抑制剂除草剂包括吡唑啉酮类hppd抑制剂除草剂、三酮类hppd抑制剂除草剂和/或异噁唑类hppd抑制剂除草剂;更优选地,所述hppd抑制剂除草剂为苯吡唑草酮、硝磺草酮和/或二酮腈。
39.本发明还提供了一种获得加工农产品的方法,包括将由所述方法获得的耐受hppd抑制剂除草剂植物的收获物进行处理以获得加工农产品。
40.为实现上述目的,本发明还提供了一种控制杂草生长的种植系统,包括将hppd抑
6.7g,可以有效防治的杂草,包括但不限于,马唐(鸡爪草)、稗草、牛筋草、野黍、狗尾草(谷莠子)、藜、蓼、青麻、苘麻、野苋、马齿苋、苍耳、龙葵。苞卫加入莠去津后有显著的增效作用,除了对上述杂草具有优异的防效外,还可以对恶性阔叶杂草如刺儿菜(小蓟)、苣荬菜、铁苋菜、鸭跖草(兰花菜)具有良好的防除效果,特别是能有效防除硝磺草酮防效不佳的狗尾草、马唐、牛筋草、野黍。
50.本发明中所述有效剂量苯吡唑草酮是指以25-100g ai/ha使用,包括50-100g ai/ha、60-90g ai/ha或75-85g ai/ha。
51.本发明中,术语“抗性”是可遗传的,并允许植物在除草剂对给定植物进行一般除草剂有效处理的情况下生长和繁殖。正如本领域技术人员所认可的,即使给定植物受到除草剂处理的一定程度损伤,如很少的坏死、溶解、萎黄病或其它损伤,但至少没有在产量上有显著影响,植物仍可被认为“抗性”,也即给定植物具有的抵抗除草剂诱导的各种程度损伤的提高的能力,而在同样的除草剂剂量下一般导致相同基因型野生型植物损伤。本发明中术语“耐性”或“耐受性”比术语“抗性”更广泛,并包括“抗性”。
52.本发明中术语“赋予”是指向植物提供特征或性状,如除草剂耐受性和/或其它所希望的性状。
53.本发明中术语“异源的”是指来自另一个来源。在dna的背景下,“异源的”是指任何外来的“非自身”dna,包括来自相同种类的另一个植物的dna。例如,在本发明中,可以利用转基因的方法在大豆植物中表达大豆hppd基因,该大豆hppd基因仍被认为“异源的”dna。
54.本发明中术语“核酸”包括涉及的单链或双链形式的脱氧核糖核苷酸或核糖核苷酸聚合物,并且除非另有限制,包括具有天然核苷酸的基本性质的已知类似物(例如肽核酸),因为它们以一种类似于天然存在的核苷酸的方式与单链核酸杂交。
55.本发明中,当术语“编码”或“编码的”用于一种特定核酸的上下文中时,其意指核酸包含必需的信息以指导核苷酸序列翻译成一种特定蛋白质。用来编码蛋白质的信息通过使用密码子来详细说明。编码蛋白质的核酸可以包含在核酸的翻译区内的非翻译序列(例如内含子),或者可以缺少此类插入的非翻译序列(例如在cdna中)。
56.本发明中所述除草剂耐受性蛋白质具有hppd酶活性并且在植物中赋予对于某些类别的hppd抑制除草剂的耐受性。编码本发明所述除草剂耐受性蛋白质的dna序列用于提供本发明的植物、作物、植物细胞以及种子它们提供了对于一种或多种hppd除草剂增强的耐受性。
57.编码本发明所述除草剂耐受性蛋白质的基因对于产生耐受hppd抑制除草剂的植物是有用的。所述除草剂耐受性基因特别适合在植物中表达,以便向植物赋予除草剂耐受性。
58.术语“多肽”、“肽”以及“蛋白”在本发明中可互换地使用,指的是氨基酸残基的聚合物。这些术语应用于氨基酸残基的聚合物,所述氨基酸残基的聚合物中的一个或多个氨基酸残基是一个相应的天然存在的氨基酸的一种人工化学类似物,以及天然存在的氨基酸聚合物。本发明的蛋白可以从一种本发明披露的核酸或通过使用标准分子生物学技术来产生。例如,本发明的一种截短的蛋白可以通过在一种适当的宿主细胞中表达本发明的一种重组核酸,或者可选择地通过结合离体方法(如蛋白酶消化和纯化)来产生。
59.本发明还提供了包括编码除草剂耐受性蛋白质的多核苷酸序列的核酸分子,所述
除草剂耐受性蛋白质具有hppd酶活性并且在植物中赋予对于某些类别的hppd抑制除草剂的耐受性。总体上,本发明包括编码在此所述的任何除草剂耐受性蛋白质的任何多核苷酸序列,连同编码相对于在此所述的除草剂耐受性蛋白质具有一个或多个保守性氨基酸替换的除草剂耐受性蛋白质的任何多核苷酸序列。提供功能上相似的氨基酸保守性取代是本领域技术人员所熟知的,以下五组各自包含彼此保守性取代的氨基酸:脂肪族:甘氨酸(g)、丙氨酸(a)、缬氨酸(v)、亮氨酸(l)、异亮氨酸(i);芳香族:苯丙氨酸(f)、酪氨酸(y)、色氨酸(w);含硫的:甲硫氨酸(m)、半胱氨酸(c);碱性的:精氨酸(i)、赖氨酸(k)、组氨酸(h);酸性的:天冬氨酸(d)、谷氨酸(e)、天冬酰胺(n)、谷氨酰胺(q)。
60.因此,具有hppd抑制除草剂耐受性活性并在严格条件下与本发明所述除草剂耐受性蛋白质的编码基因杂交的序列包括在本发明中。示例性的,这些序列与本发明序列seq id no:2、seq id no:3、seq id no:7、seq id no:8、seq id no:10、seq id no:11至少大约75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大的序列同源性。
61.任何常规的核酸杂交或扩增方法都可以用于鉴定本发明除草剂耐受性基因的存在。核酸分子或其片段在一定情况下能够与其他核酸分子进行特异性杂交。本发明中,如果两个核酸分子能形成反平行的双链核酸结构,就可以说这两个核酸分子彼此间能够进行特异性杂交。如果两个核酸分子显示出完全的互补性,则称其中一个核酸分子是另一个核酸分子的“互补物”。本发明中,当一个核酸分子的每一个核苷酸都与另一个核酸分子的对应核苷酸互补时,则称这两个核酸分子显示出“完全互补性”。如果两个核酸分子能够以足够的稳定性相互杂交从而使它们在至少常规的“低度严格”条件下退火且彼此结合,则称这两个核酸分子为“最低程度互补”。类似地,如果两个核酸分子能够以足够的稳定性相互杂交从而使它们在常规的“高度严格”条件下退火且彼此结合,则称这两个核酸分子具有“互补性”。从完全互补性中偏离是可以允许的,只要这种偏离不完全阻止两个分子形成双链结构。为了使一个核酸分子能够作为引物或探针,仅需保证其在序列上具有充分的互补性,以使得在所采用的特定溶剂和盐浓度下能形成稳定的双链结构。
62.本发明中,基本同源的序列是一段核酸分子,该核酸分子在高度严格条件下能够和相匹配的另一段核酸分子的互补链发生特异性杂交。促进dna杂交的适合的严格条件,例如,大约在45℃条件下用6.0
×
氯化钠/柠檬酸钠(ssc)处理,然后在50℃条件下用2.0
×
ssc洗涤,这些条件对本领域技术人员是公知的。例如,在洗涤步骤中的盐浓度可以选自低度严格条件的约2.0
×
ssc、50℃到高度严格条件的约0.2
×
ssc、50℃。此外,洗涤步骤中的温度条件可以从低度严格条件的室温约22℃,升高到高度严格条件的约65℃。温度条件和盐浓度可以都发生改变,也可以其中一个保持不变而另一个变量发生改变。优选地,本发明所述严格条件可为在6
×
ssc、0.5%sds溶液中,在65℃下与本发明除草剂耐受性基因发生特异性杂交,然后用2
×
ssc、0.1%sds和1
×
ssc、0.1%sds各洗膜1次。
63.本发明中,术语“杂交”或“特异性杂交”是指一种分子在严格条件下仅可与特定的核苷酸序列结合、双链化或杂交,这是在该序列存在于一种复合混合物(例如,总细胞)dna或rna中时进行的。
64.由于遗传密码子的丰余性,多种不同的dna序列可以编码相同的氨基酸序列。产生这些编码相同或基本相同的蛋白的可替代dna序列正在本领域技术人员的技术水平内。这
些不同的dna序列包括在本发明的范围内。所述“基本上相同的”序列是指有氨基酸取代、缺失、添加或插入但实质上不影响除草剂耐受性活性的序列,亦包括保留除草剂耐受性活性的片段。
65.术语“功能活性”或“活性”在本发明中指本发明用途的蛋白质/酶(单独或与其它蛋白质组合)具有降解或减弱除草剂活性的能力。产生本发明蛋白质的植物优选产生“有效量”的蛋白质,从而在用除草剂处理植物时,蛋白质表达的水平足以给予植物对除草剂(若无特别说明则为一般用量)完全或部分的耐受性。可以以通常杀死靶植物的用量、正常的大田用量和浓度使用除草剂。优选地,本发明的植物细胞和植物被保护免受除草剂处理引起的生长抑制或损伤。本发明的转化植物和植物细胞优选具有hppd抑制除草剂的耐受性,即转化的植物和植物细胞能在有效量的hppd抑制除草剂存在下生长。
66.本发明中所述的基因和蛋白质不但包括特定的示例序列,还包括保存了所述特定示例的蛋白质的hppd抑制除草剂耐受性活性特征的部分和/片段(包括与全长蛋白质相比在内和/或末端缺失)、变体、突变体、变体蛋白质、取代物(有替代氨基酸的蛋白质)、嵌合体和融合蛋白。
67.本发明术语“变体”意指实质上类似的序列。对于多核苷酸,一种变体包括在参比多核苷酸之内的一个或多个内部位点处的一个或多个核苷酸的缺失和/或添加和/或在除草剂耐受性基因中的一个或多个位点处的一个或多个核苷酸的替换。本发明中术语“参比多核苷酸或多肽”对应地包括除草剂耐受性核苷酸序列或氨基酸序列。本发明中术语“天然多核苷酸或多肽”对应地包括天然发生的核苷酸序列或氨基酸序列。对于多核苷酸,保守型变体包括编码本发明的这些除草剂耐受性蛋白质之一的核苷酸序列(由于遗传密码的简并性)。如这些天然发生的等位基因变体可以使用熟知的分子生物学技术,例如使用以下概述的聚合酶链式反应(pcr)以及杂交技术来鉴定。变体多核苷酸还包括合成衍生的多核苷酸,例如通过使用定点诱变产生的但是仍然编码本发明的一种除草剂耐受性蛋白质的序列。通常,本发明的一种特定的多核苷酸的变体将具有与该特定的多核苷酸至少大约75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同源性,通过序列对比程序和参数来确定同源性。
68.本发明中“变体蛋白质”意指从一种参比蛋白通过在所述除草剂耐受性蛋白质中的一个或多个内部位点处的一个或多个氨基酸的缺失或添加和/或在该除草剂耐受性蛋白质中的一个或多个位点处的一个或多个氨基酸的替换而衍生的一种蛋白质。由本发明涵盖的变体蛋白是生物学活性的,即它们继续具有除草剂耐受性蛋白质的所希望的活性,即,仍具有所述的hppd酶活性和/或除草剂耐性。此类变体可以产生于例如遗传多态性或产生于人工操作。本发明的一种除草剂耐受性蛋白质的生物活性变体将具有与该除草剂耐受性蛋白质的氨基酸序列的全部的至少大约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同源性,此同源性通过序列比对程序和参数所确定。本发明的一种蛋白质的一种生物活性变体可能不同于以少至1-15个氨基酸残基、少至1-10个(如6-10个)、少至5个(如4、3、2个、或甚至1个)氨基酸残基的蛋白质。
69.用于序列对比的方法在本领域中是熟知的并且可以使用数学算法来完成,这些数学算法如myers and miller(1988)cabios 4:11-17的算法;smith et al.(1981)adv.appl.math.2:482的局部比对算法;need eman and wunsch(1970)j.mol.biol.48:
443-453的全局比对算法;以及karlin and altschul(1990)proc.natl.acad.sci.usa 872264的算法,如在karlin and altschul(1993)proc.natl.acad.sci.usa 90:5873-5877中的修改。对于序列比较可以利用这些数学算法的电脑实现方式以确定序列的同源性,此类实现方式包括但不限于:pc/gene程序中的clustal(从intelligenetics,mountain view,california可获得);allgn程序(版本2.0)以及gcg wisconsin genetics software package版本10中的gap、bestfit、blast、fasta以及tfasta(从accelrys inc.,9685scranton road,san diego,california,usa获得)。
70.在某些实施例中,编码本发明除草剂耐受性蛋白质或它们的保留了hppd酶活性的变体的氨基酸可以与任何感兴趣的多核苷酸序列的组合进行叠加从而产生具有一种所希望的性状的植物。术语“性状”是指从特定的序列或序列组得到的表型。例如,编码所述除草剂耐受性蛋白质或保留了hppd酶活性的变体的氨基酸的多核苷酸可以与任何其他的编码赋予一种所希望的性状的多肽的多核苷酸进行叠加,所述性状包括但不限于:对于疾病、昆虫以及除草剂的抗性,对于热和干旱的耐受性,缩短作物成熟时间、改进工业加工(例如,用于将淀粉或生物质转化为可发酵的糖类)以及改进的农艺学品质(例如,高油含量和高蛋白含量)。
71.本领域技术人员所熟知的,两种或更多作用模式的组合在提高受控杂草谱和/或天然更具耐受性物种或抗性杂草物种上的益处还可扩展到通过人工(转基因或非转基因)在作物中产生除hppd耐受性作物外的除草剂耐受性的化学品。事实上,可以单独或以多重组合叠加编码以下抗性的性状以提供有效控制或防止杂草演替对除草剂产生抗性能力:草甘膦抗性(如抗性植物或细菌epsps、gox、gat)、草铵膦抗性(如pat、bar)、乙酰乳酸合酶(als)抑制性除草剂抗性(如咪唑啉酮、磺酰脲、三唑嘧啶、磺苯胺、嘧啶硫代苯甲酸和其它化学品抗性基因如ahas、csrl、sura等)、苯氧基生长素类除草剂抗性(如芳氧基链烷酸酯双加氧酶-aad)、麦草畏除草剂抗性(如麦草畏单加氧酶-dmo)、溴草腈抗性(如bxn)、对八氢番茄红素去饱和酶(pds)抑制剂的抗性、对光系统ⅱ抑制性除草剂的抗性(如psba)、对光系统ⅰ抑制性除草剂的抗性、对原卟啉原氧化酶
ⅸ
(ppo)抑制性除草剂抗性(如ppo-1)、对苯脲除草剂的抗性(如cyp76b1)、二氯甲氧苯酸降解酶等等。
72.草甘膦被广泛地使用,因为它控制非常广谱的阔叶和禾本科杂草物种。然而,在草甘膦耐性作物和非作物应用中重复使用草甘膦已经(而且仍将继续)选择使杂草演替为天然更具有耐性的物种或草甘膦抗性生物型。多数除草剂抗性管理策略建议使用有效用量的罐混除草剂伴侣作为延缓出现抗性杂草的方法,所述除草剂伴侣提供对同一物种的控制,但具有不同的作用模式。将本发明除草剂耐受性基因与草甘膦耐性性状(和/或其他除草剂耐性性状)叠加可通过允许对同一作物选择性使用草甘膦和吡唑啉酮类除草剂(如苯吡唑草酮)而实现对草甘膦耐性作物中草甘膦抗性杂草物种(被一种或多种吡唑啉酮类除草剂控制的阔叶杂草物种)的控制。这些除草剂的应用可以是在含有不同作用模式的两种或更多除草剂的罐混合物中同时使用、在连续使用(如种植前、出苗前或出苗后)中单个除草剂组合物的单独使用(使用的间隔时间范围从2小时到3个月),或者备选地,可以在任何时间(从种植作物7个月内到收获作物时(或对于单个除草剂为收获前间隔,取最短者))使用代表可应用每种化合类别的任意数目除草剂的组合。
73.在控制阔叶杂草中具有灵活性是很重要的,即使用时间、单个除草剂用量和控制
顽固或抗性杂草的能力。作物中与草甘膦抗性基因/本发明除草剂耐受性基因叠加的草甘膦应用范围可以从250至2500g ae/ha;吡唑啉酮类除草剂(一种或多种)可按照从25-500g ai/ha。这些应用的时间的最佳组合取决于具体的条件、物种和环境。
74.除草剂制剂(如酯、酸或盐配方或可溶浓缩剂、乳化浓缩剂或可溶液体)和罐混添加剂(如佐剂或相容剂)可显著影响给定的除草剂或一种或多种除草剂的组合的杂草控制。任意前述除草剂的任意化学组合均在本发明的范围内。
75.此外,可以将编码本发明除草剂耐受性蛋白质的基因单独或与其它除草剂耐受作物特征叠加后再与一种或多种其它输入(如昆虫抗性、真菌抗性或胁迫耐受性等)或输出(如提高的产量、改进的油量、提高的纤维品质等)性状叠加。因此,本发明可用于提供以灵活且经济地控制任何数目的农学害虫的能力和提高作物品质的完整农学解决方案。
76.这些叠加的组合可以通过任何方法来产生,这些方法包括但不限于:通过常规的或顶交方法的杂交育种植物或遗传转化。如果这些序列是通过遗传转化这些植物来进行叠加的,所感兴趣的多核苷酸序列可以在任何时间并且以任何次序进行组合。例如,包括一个或多个所希望的性状的转基因植物可以用做通过后续转化而引入另外性状的靶标。这些性状可以在一个共转化方案中与由表达盒的任何组合提供的感兴趣的多核苷酸同时引入。例如,如果将引入两个序列,这两个序列可以包含在分开的表达盒(反式)中或包含在相同的表达盒(顺式)中。这些序列的表达可以通过相同的启动子或通过不同的启动子来驱动。在某些情况下,可能希望的是引入一个抑制所感兴趣的多核苷酸的表达的表达盒。这可以与其他的抑制表达盒或过量表达盒的任何组合进行组合以在该植物中产生所希望的性状组合。进一步认识到的是,多核苷酸序列可以在一个所希望的基因组位置处使用位点特异性重组系统进行叠加。
77.本发明编码所述除草剂耐受性蛋白质的基因对吡唑啉酮类除草剂具有较高的耐受性,是重要的除草剂耐受作物和选择标记物特征可能性的基础。
78.本发明中术语“表达盒”是指能够在适当的宿主细胞中指引一种特定核苷酸序列表达的一种核酸分子,包括有效连接到感兴趣的核苷酸序列(即,一种单独地或与一种或多种编码赋予所希望的性状的多肽的额外的核酸分子相组合而编码一种除草剂耐受性蛋白质或保留了hppd酶活性的变体的多核苷酸)的启动子,该感兴趣的核苷酸序列有效连接到终止信号。该编码区通常对一种感兴趣的蛋白质进行编码,但是还可以对一种感兴趣的功能性rna进行编码,例如在正义或反义方向上的反义rna或一种非翻译rna。包含该感兴趣的核苷酸序列的表达盒可以是嵌合的,意味着至少一个它的组分相对于至少一个它的其他组分是异源的。该表达盒还可以是一种天然发生的表达盒,但一定是以在对异源表达有用的重组体形式而获得的。然而,典型地,该表达盒对于宿主是异源的,即,该表达盒的特定dna序列并不天然发生于该宿主细胞中,并且必须已通过转化事件而被引入新宿主细胞中。在该表达盒中核苷酸序列的表达可以是在组成型启动子或诱导型启动子的控制之下,该启动子只有当该宿主细胞暴露于一些特殊的外界刺激时才引发转录。另外,该启动子对于一种特定的组织或器官或发育阶段也是特异性的。
79.本发明涵盖了用能够表达一种感兴趣的多核苷酸(即一种单独地或与一种或多种编码赋予所希望的性状的多肽的额外的核酸分子相组合而编码一种除草剂耐受性蛋白质或它的保留了hppd酶活性的变体的多核苷酸)的表达盒来转化植物。该表达盒在5
’‑3’
的转
录方向上包括转录和翻译的起始区(即启动子)和多核苷酸开放阅读框。该表达盒可以任选地包括在植物中起作用的转录和翻译终止区(即终止区)。在一些实施方案中,该表达盒包括一种选择标记基因从而允许选择稳定的转化体。本发明的表达构建体还可以包括前导序列和/或允许感兴趣的多核苷酸的诱导型表达的序列。
80.该表达盒的调控序列有效连接到感兴趣的多核苷酸。本发明中所述调控序列包括但不限于启动子、转运肽、终止子、增强子、前导序列、内含子以及其它可操作地连接到编码所述除草剂耐受性蛋白质除草剂耐受性基因的调节序列。
81.所述启动子为植物中可表达的启动子,所述的“植物中可表达的启动子”是指确保与其连接的编码序列在植物细胞内进行表达的启动子。植物中可表达的启动子可为组成型启动子。指导植物内组成型表达的启动子的示例包括但不限于,来源于花椰菜花叶病毒的35s启动子、玉米ubi启动子、水稻gos2基因的启动子等。备选地,植物中可表达的启动子可为组织特异的启动子,即该启动子在植物的一些组织内如在绿色组织中指导编码序列的表达水平高于植物的其他组织(可通过常规rna试验进行测定),如pep羧化酶启动子。备选地,植物中可表达的启动子可为创伤诱导启动子。创伤诱导启动子或指导创伤诱导的表达模式的启动子是指当植物经受机械或由昆虫啃食引起的创伤时,启动子调控下的编码序列的表达较正常生长条件下有显著提高。创伤诱导启动子的示例包括但不限于,马铃薯和西红柿的蛋白酶抑制基因(pinⅰ和pinⅱ)和玉米蛋白酶抑制基因(mpi)的启动子。
82.所述转运肽(又称分泌信号序列或导向序列)是指导转基因产物到特定的细胞器或细胞区室,对受体蛋白质来说,所述转运肽可以是异源的,例如,利用编码叶绿体转运肽序列靶向叶绿体,或者利用
‘
kdel’保留序列靶向内质网,或者利用大麦植物凝集素基因的ctpp靶向液泡。
83.所述前导序列包含但不限于,小rna病毒前导序列,如emcv前导序列(脑心肌炎病毒5’非编码区);马铃薯y病毒组前导序列,如mdmv(玉米矮缩花叶病毒)前导序列;人类免疫球蛋白质重链结合蛋白质(bip);苜蓿花叶病毒的外壳蛋白质mrna的不翻译前导序列(amv rna4);烟草花叶病毒(tmv)前导序列。
84.所述增强子包含但不限于,花椰菜花叶病毒(camv)增强子、玄参花叶病毒(fmv)增强子、康乃馨风化环病毒(cerv)增强子、木薯脉花叶病毒(csvmv)增强子、紫茉莉花叶病毒(mmv)增强子、夜香树黄化曲叶病毒(cmylcv)增强子、木尔坦棉花曲叶病毒(clcumv)、鸭跖草黄斑驳病毒(coymv)和花生褪绿线条花叶病毒(pclsv)增强子。
85.对于单子叶植物应用而言,所述内含子包含但不限于,玉米hsp70内含子、玉米泛素内含子、adh内含子1、蔗糖合酶内含子或水稻act1内含子。对于双子叶植物应用而言,所述内含子包含但不限于,cat-1内含子、pkannibal内含子、piv2内含子和“超级泛素”内含子。
86.所述终止子可以为在植物中起作用的适合多聚腺苷酸化信号序列,包括但不限于,来源于农杆菌(agrobacterium tumefaciens)胭脂碱合成酶(nos)基因的多聚腺苷酸化信号序列、来源于蛋白酶抑制剂ⅱ(pinⅱ)基因的多聚腺苷酸化信号序列、来源于豌豆ssrubisco e9基因的多聚腺苷酸化信号序列和来源于α-微管蛋白(α-tubulin)基因的多聚腺苷酸化信号序列。
87.本发明中所述“有效连接”表示核酸序列的联结,所述联结使得一条序列可提供对
相连序列来说需要的功能。在本发明中所述“有效连接”可以为将启动子与感兴趣的序列相连,使得该感兴趣的序列的转录受到该启动子控制和调控。当感兴趣的序列编码蛋白并且想要获得该蛋白的表达时“有效连接”表示:启动子与所述序列相连,相连的方式使得得到的转录物高效翻译。如果启动子与编码序列的连接是转录物融合并且想要实现编码的蛋白的表达时,制造这样的连接,使得得到的转录物中第一翻译起始密码子是编码序列的起始密码子。备选地,如果启动子与编码序列的连接是翻译融合并且想要实现编码的蛋白的表达时,制造这样的连接,使得5’非翻译序列中含有的第一翻译起始密码子与启动子相连结,并且连接方式使得得到的翻译产物与编码想要的蛋白的翻译开放读码框的关系是符合读码框的。可以“有效连接”的核酸序列包括但不限于:提供基因表达功能的序列(即基因表达元件,例如启动子、5’非翻译区域、内含子、蛋白编码区域、3’非翻译区域、聚腺苷化位点和/或转录终止子)、提供dna转移和/或整合功能的序列(即t-dna边界序列、位点特异性重组酶识别位点、整合酶识别位点)、提供选择性功能的序列(即抗生素抗性标记物、生物合成基因)、提供可计分标记物功能的序列、体外或体内协助序列操作的序列(即多接头序列、位点特异性重组序列)和提供复制功能的序列(即细菌的复制起点、自主复制序列、着丝粒序列)。
88.本发明中所述的植物、植物组织或植物细胞的基因组,是指植物、植物组织或植物细胞内的任何遗传物质,且包括细胞核和质体和线粒体基因组。
89.在本发明中,术语“植物部分”或“植物组织”包括植物细胞、植物原生质体、植物可以由之再生的植物细胞组织培养物、植物愈伤组织、植物簇以及在植物或以下植物的部分中完整的植物细胞,这些植物的部分是如胚、花粉、胚珠、种子、叶、花、枝、果实、核、穗、穗轴、外壳、茎、根、根尖、花药等等。
90.本发明所述除草剂耐受性蛋白质可应用于多种植物中,所述双子叶植物包括但不限于苜蓿、菜豆、花椰菜、甘蓝、胡萝卜、芹菜、棉花、黄瓜、茄子、莴苣、甜瓜、豌豆、胡椒、西葫芦、萝卜、油菜、菠菜、大豆、南瓜、番茄、拟南芥、花生或西瓜;优选地,所述双子叶植物是指黄瓜、大豆、拟南芥、烟草、棉花、花生或油菜。所述单子叶植物包括但不限于玉米、水稻、高粱、小麦、大麦、黑麦、粟、甘蔗、燕麦或草坪草;优选地,所述单子叶植物是指玉米、水稻、高粱、小麦、大麦、粟、甘蔗或燕麦。
91.在本发明中术语“植物转化”是指将一种抗或耐受除草剂的多核苷酸单独地或与编码赋予所希望的性状的多肽的一种或多种额外的核酸分子结合而克隆到一个表达系统中,它就是被转化到了一种植物细胞中。本发明的受体和目标表达盒可以以多种公知的方法被引入到植物细胞中。在多核苷酸的背景下,术语“引入”(例如,感兴趣的核苷酸构建体)旨在表示以这样一种方式将多核苷酸提供给该植物,使得该多核苷酸获得对一种植物细胞的内部的接近或实现。其中有待引入一个以上的多核苷酸,这些多核苷酸可以作为单个核苷酸构建体的部分而进行组装,或者作为分开的核苷酸构建体,并且可以位于相同的或不同的转化载体上。因此,或作为育种方案的一部分,例如在植物中的在一个单一的转化事件中、在分开的转化事件中可以将这些多核苷酸引入到感兴趣的宿主细胞中。本发明的这些方法并不取决于一种用于引入一个或多个多核苷酸到植物中的具体方法,仅仅是获得这个或这些多核苷酸对于植物的至少一个细胞的内部的接近或实现。在本领域中已知的用于将一个或多个多核苷酸引入到植物中的方法包括但不限于瞬时转化方法、稳定转化方法、病
毒介导的方法或基因组编辑技术。
92.术语“稳定转化”是指将外源基因导入植物基因组,且稳定地整合进该植物及其任何连续世代的基因组中,导致外源基因稳定遗传。
93.术语“瞬时转化”是指核酸分子或蛋白质导入植物细胞中,执行功能但不整合进植物基因组中,导致外源基因不能稳定遗传。
94.术语“基因组编辑技术”是指能够对基因组序列进行精确操作,实现基因定点突变、插入、删除等操作的基因组修饰技术。目前基因组编辑技术主要有he(homing endonuclease,归巢核酸内切酶)、zfn技术(zinc-finger nuclease,锌指核酸酶)、talen技术(transcription activator-like effector nuclease,转录激活样效应因子核酸酶)、crispr技术(clustered regulatory interspaced short palindromic repeat,成簇规律间隔短回文重复)。
95.对本领域技术人员而言,用于植物转化的可获得的众多转化载体是已知的,并且与本发明有关的基因可以与任何上述载体结合使用。载体的选择将取决于优选的转化技术以及用于转化的目标种类。对于某些目标种类,可以优选不同的抗生素或除草剂选择标记。在转化中常规使用的选择标记包括赋予对卡那霉素以及相关抗生素或相关除草剂的抗性的nptll基因(此基因被bevan等人于1983年发表在《自然科学》第304卷184-187页)、赋予对除草剂草丁膦(还被称作草铵膦;参见white等人于1990年发表于《nucl.acidsres》第18卷1062页、spencer等人于1990年发表于《theor.appl.genet》第79卷625-631页以及美国专利5561236和5276268)抗性的pat和bar基因,赋予对抗生素潮霉素的抗性的hpn基因(blochinger&diggelmann,mol.cell biol.4:2929-2931)以及赋予对甲氨蝶呤的抗性的dnfr基因(bourouis等人1983年于《embo j.》第2卷1099-1104页)、赋予对草甘膦的抗性的epsps基因(美国专利4940935和5188642)、也赋予对草甘膦的抗性的草甘膦n-乙酰基转移酶(gat)基因(castle等人于2004年在《science》第304卷1151-1154页;美国申请公开专利20070004912,20050246798和20050060767中有描述)以及提供代谢甘露糖的6-磷酸甘露糖异构酶基因(美国专利5767378和5994629有描述)。
96.用于再生植物的方法在本领域也是熟知的。例如,已经利用ti质粒载体用于传送外源dna,以及直接dna摄入、脂质体、电穿孔、显微注射以及微弹。
97.本发明中所述种植系统是指植物、其显示的任一种除草剂耐受性和/或在植物发育的不同阶段可用的除草剂处理的组合,产生高产和/或减弱损伤的植物。
98.本发明中,所述杂草是指在植物生长环境中与耕种的目的植物竞争的植物。
99.本发明术语“控制”和/或“防治”是指至少将有效剂量的吡唑啉酮类除草剂直接施用(例如通过喷雾)到植物生长环境中,使杂草发育最小化和/或停止生长。同时,耕种的目的植物在形态上应是正常的,且可在常规方法下培养以用于产物的消耗和/或生成;优选地,与非转基因的野生型植株相比具有减弱的植物损伤和/或具有增加的植物产量。所述具有减弱的植物损伤,具体表现包括但不限于改善的茎秆抗性、和/或提高的籽粒重量等。所述除草剂耐受性蛋白质对杂草的“控制”和/或“防治”作用是可以独立存在的,不因其它可“控制”和/或“防治”杂草的物质的存在而减弱和/或消失。具体地,转基因植物(含有编码除草剂耐受性蛋白质的基因)的任何组织同时和/或不同步地,存在和/或产生,所述除草剂耐受性蛋白质和/或可控制杂草的另一种物质,则所述另一种物质的存在既不影响所述除草
剂耐受性蛋白质对杂草的“控制”和/或“防治”作用,也不能导致所述“控制”和/或“防治”作用完全和/或部分由所述另一种物质实现,而与所述除草剂耐受性蛋白质无关。
100.本发明中所述的“植物繁殖体”包括但不限于植物有性繁殖体和植物无性繁殖体。所述植物有性繁殖体包括但不限于植物种子;所述植物无性繁殖体是指植物体的营养器官或某种特殊组织,其可以在离体条件下产生新植株;所述营养器官或某种特殊组织包括但不限于根、茎和叶,例如:以根为无性繁殖体的植物包括草莓和甘薯等;以茎为无性繁殖体的植物包括甘蔗和马铃薯(块茎)等;以叶为无性繁殖体的植物包括芦荟和秋海棠等。
101.本发明可赋予植物新除草剂抗性性状,并且未观察到对表型包括产量的不良影响。本发明中植物能耐受住如至少一种受试除草剂2
×
、3
×
、或4
×
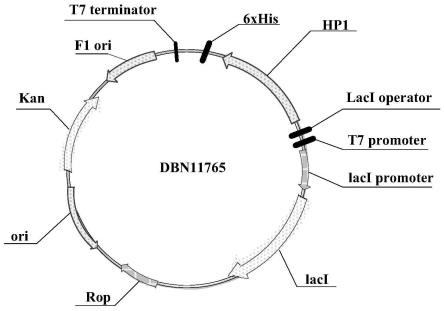
一般应用水平。这些耐性水平的提高在本发明的范围之内。例如可对本领域已知的多种技术进行可预见到的优化和进一步发展,以增加给定基因的表达。
102.本发明提供了一种除草剂耐受性蛋白质、其编码基因及用途,具有以下优点:
103.1、本发明除草剂耐受性蛋白质可以赋予植物对hppd抑制剂除草剂产生耐受性,至少可以耐受1倍大田浓度的苯吡唑草酮。
104.2、本发明除草剂耐受性蛋白质在植物上应用前景广阔。
105.下面通过附图和实施例,对本发明的技术方案做进一步的详细描述。
附图说明
106.图1为本发明含有所述hp1核苷酸序列的原核重组表达载体dbn11765结构示意图;
107.图2为除草剂耐受性蛋白质hp1在不同浓度梯度的hppd抑制剂除草剂(苯吡唑草酮、硝磺草酮或二酮腈)条件下的酶活力效果图;
108.图3为除草剂耐受性蛋白质hp1-1在不同浓度梯度的hppd抑制剂除草剂(苯吡唑草酮、硝磺草酮或二酮腈)条件下的酶活力效果图;
109.图4为除草剂耐受性蛋白质hp1-2在不同浓度梯度的hppd抑制剂除草剂(苯吡唑草酮、硝磺草酮或二酮腈)条件下的酶活力效果图;
110.图5为本发明含有所述hp1m核苷酸序列的拟南芥重组表达载体dbn11770结构示意图;
111.图6为本发明对照重组表达载体dbn11770n结构示意图。
具体实施方式
112.下面通过具体实施例进一步说明本发明除草剂耐受性蛋白质、其编码基因及用途的技术方案。
113.第一实施例、hp1基因的突变和筛选
114.1、合成hp1基因
115.合成所述hp1基因的核苷酸序列,如序列表中seq id no:2所示,其编码hp1蛋白,如序列表中seq id no:1所示。依据拟南芥偏好性密码子获得编码相应于所述hp1的氨基酸序列的hp1m核苷酸序列,如序列表中seq id no:3所示。
116.2、构建hp1基因突变文库
117.将上述合成的hp1基因经pcr扩增后,按照takara公司产品puc118载体(takara,
cat:3318)说明书的操作步骤,克隆到载体puc118上,然后将上述连接后的产物导入大肠杆菌dh5α作为模板,用正向引物和反向引物进行易错pcr,使得hp1基因由于碱基随机错配而发生突变。
118.引物和易错pcr反应体系如下:
119.正向引物:5
’‑
cccaagcttgatggccgccgattccgaaaatc-3’,如序列表中seq id no:4所示(下划线为hindiii酶切位点);
120.反向引物:5
’‑
cgcggatcctcaggcatcgaccgtcacaacg-3’,如序列表中seq id no:5所示(下划线为bamhi酶切位点);
121.易错pcr反应体系(总体积50μl)为:
[0122][0123]
所述质粒dna模板的浓度为1-10ng/μl,所述正向引物的浓度为10μm,所述反向引物的浓度为10μm。
[0124]
易错pcr反应条件为:
[0125][0126]
将上述易错pcr产物通过7g/l的琼脂糖凝胶电泳并切胶回收,利用hindiii和bamhi对切胶回收后的易错pcr产物和puc118载体进行双酶切,并将酶切产物提纯后通过t4-dna连接酶进行酶连,然后转化到对苯吡唑草酮敏感的大肠杆菌dh5α中,构建hp1基因随机突变文库。
[0127]
3、对hp1基因突变文库进行筛选
[0128]
将上述突变文库中的转化产物接种于含有300μm苯吡唑草酮的2ml lb液体培养基(氨苄青霉素100mg/l、酪氨酸800mg/l)的48孔板中,在温度37℃、180rpm恒温摇床中震荡培养。观察菌株的生长状况,待菌株生长至od 0.4-0.6时,向上述lb液体培养基中添加1mm iptg后继续培养,观察培养基的颜色变化。
[0129]
因大肠杆菌中存在酪氨酸氨基转移酶,其可催化酪氨酸生成对羟苯基丙酮酸(hpp),hpp可作为hppd的底物而被利用,hppd催化反应后的产物hg可以自发氧化聚合产生棕红色脓黑素,但hppd抑制剂能够抑制hppd酶活性进而抑制颜色生成。因而,可根据lb液体
培养基中是否产生棕红色来对上述突变文库进行高通量筛选,分离在上述含有300μm苯吡唑草酮的培养基上仍能产生棕红色的大肠杆菌dh5α以获得抗性基因。
[0130]
4、获得突变的抗性基因
[0131]
测序结果表明获得两个hp1突变的抗性基因,分别命名为hp1-1和hp1-2,所述hp1-1核苷酸序列第475位由原来的a突变为g,导致其氨基酸序列第159位由原来的苏氨酸突变为丙氨酸;所述hp1-2核苷酸序列第772和第773位由原来的ca突变为at,导致其氨基酸序列第258位由原来的谷氨酰胺突变为甲硫氨酸。
[0132]
除草剂耐受性蛋白质hp1-1的氨基酸序列,如序列表中seq id no:6所示,编码相应于所述除草剂耐受性蛋白质hp1-1的氨基酸序列的hp1-1核苷酸序列,如序列表中seq id no:7所示;依据拟南芥偏好性密码子获得编码相应于所述除草剂耐受性蛋白质hp1-1的氨基酸序列的hp1-1m核苷酸序列,如序列表中seq id no:8所示。
[0133]
除草剂耐受性蛋白质hp1-2的氨基酸序列,如序列表中seq id no:9所示,编码相应于所述除草剂耐受性蛋白质hp1-2的氨基酸序列的hp1-2核苷酸序列,如序列表中seq id no:10所示;依据拟南芥偏好性密码子获得编码相应于所述除草剂耐受性蛋白质hp1-2的氨基酸序列的hp1-2m核苷酸序列,如序列表中seq id no:11所示。
[0134]
第二实施例、除草剂耐受性蛋白质hp1-1和hp1-2对hppd抑制剂除草剂的耐受性效果检测
[0135]
1、合成hp1、hp1-1和hp1-2的核苷酸序列
[0136]
将所述hp1核苷酸序列(seq id no:2)、hp-1核苷酸序列(seq id no:7)和hp1-2核苷酸序列(seq id no:10)的5’和3’端分别连接通用接头引物1:
[0137]5’
端通用接头引物1:5
’‑
taagaaggagatatacatatg-3’,如序列表中seq id no:12所示;
[0138]3’
端通用接头引物1:5
’‑
gtggtggtggtggtgctcgag-3’,如序列表中seq id no:13所示。
[0139]
2、原核重组表达载体的构建和重组菌株的获得
[0140]
利用限制性内切酶nde i和xho i对原核表达载体dbnbc-01进行双酶切反应,从而对原核表达载体线性化,酶切产物纯化得到线性化的dbnbc-01表达载体骨架(载体骨架:pet-29a( )),将连接所述通用接头引物1的所述hp1核苷酸序列与所述线性化的dbnbc-01表达载体骨架进行重组反应,操作步骤按照takara公司in-fusion无缝连接产品试剂盒(clontech,ca,usa,cat:121416)说明书进行,构建成重组表达载体dbn11765,其载体结构如图1所示(f1 ori:噬菌体f1的复制起点;kan:卡那霉素抗性基因;ori:复制起始点;rop:rop基因,编码rop蛋白;t7 promoter:t7 rna聚合酶启动子;hp1:hp1核苷酸序列(seq id no:2);6xhis:亲和标签,编码6个连续的his,用来作为纯化目标蛋白的标签;t7 terminator:t7 rna聚合酶的终止子;laci operator:乳糖操纵子的操纵区;laci promoter:laci启动子;laci:乳糖操纵子调节基因)。
[0141]
将重组表达载体dbn11765用热激方法转化大肠杆菌bl21(de3)感受态细胞,其热激条件为:50μl大肠杆菌bl21(de3)感受态细胞、10μl质粒dna(重组表达载体dbn11765),42℃水浴30s;37℃振荡培养1h(100rpm转速下摇床摇动);然后在含50mg/l卡那霉素(kanamycin)的所述lb固体平板上于温度37℃条件下培养12h,挑取白色菌落,在lb液体培
养基(胰蛋白胨10g/l、酵母提取物5g/l、nacl 10g/l、卡那霉素50mg/l,用naoh调ph至7.5)中于温度37℃条件下培养过夜。碱法提取其质粒。将提取的质粒进行测序鉴定,结果表明重组表达载体dbn11765在nde i和xho i位点间的核苷酸序列为分别为序列表中seq id no:2所示的核苷酸序列,保存重组菌株bl21(hp1)备用。
[0142]
按照上述构建重组表达载体dbn11765的方法,将连接所述通用接头引物1的所述hp1-1核苷酸序列和hp1-2核苷酸序列分别与所述线性化的dbnbc-01表达载体骨架进行重组反应,依次得到重组表达载体dbn11774和dbn11775。将重组表达载体dbn11774和dbn11775用热激方法分别转化大肠杆菌bl21(de3)感受态细胞并用碱法提取其质粒,将提取的质粒进行测序验证,结果表明重组表达载体dbn11774和dbn11775中的核苷酸序列分别含有序列表中seq id no:7所示核苷酸序列和seq id no:10所示核苷酸序列,即所述hp1-1核苷酸序列和hp1-2核苷酸序列正确插入。保存得到的重组菌株bl21(hp1-1)和bl21(hp1-2)备用。
[0143]
3、除草剂耐受性蛋白质在大肠杆菌中的表达及纯化
[0144]
将所述重组菌株bl21(hp1)、bl21(hp1-1)和bl21(hp1-2)分别单克隆接种在100ml的lb培养基(胰蛋白胨10g/l、酵母提取物5g/l、nacl 10g/l、氨苄青霉素100mg/l,用naoh调ph至7.5)中培养至浓度为od
600nm
=0.6-0.8,加入浓度为0.4mm的iptg,在温度16℃下诱导12h。收集菌体,用15ml pbs缓冲液(50mm,ph 7.4)重悬菌体,超声破碎(x0-900d ultrasonic processor ultrasonic processor,30%intensity)10min,然后离心,收集上清,用镍离子亲和层析柱分别对获得的上述除草剂耐受性蛋白质进行纯化,用sds-page蛋白电泳检测纯化结果,条带大小和理论预测的条带大小一致。
[0145]
4、测定hp1、hp1-1和hp1-2对hppd抑制剂除草剂的耐受性
[0146]
酶活反应体系(1ml):含有25μg反应酶(上述纯化获得的所述除草剂耐受性蛋白质hp1、hp1-1或hp1-2)、0.2mm hpp底物、1mm fe
2
、1mm抗坏血酸、不同浓度梯度(浓度分别为0μm、5μm、10μm、20μm、30μm、40μm和50μm)的苯吡唑草酮(硝磺草酮或二酮腈),缓冲体系为浓度50mm的pbs缓冲液(ph 7.4),温度30℃下在水浴锅中反应20min,每个反应以加入反应酶开始计时,沸水浴5min终止酶反应体系。
[0147]
将上述终止的酶反应体系离心过滤,取20μl滤液进行高效液相色谱(hplc)分析,hplc条件为:流动相为乙腈:水(30:70,v/v),水中添加0.1%的三氟乙酸。c18反相色谱柱(5μm,250mm
×
4.6mm),柱温为40℃,vwd-3100单波长紫外检测器,检测波长为292nm,进样量为20μl,流速为1.0ml/min。经hplc分析,酶促反应产物与尿黑酸标样的出峰时间一致,而不加酶的反应体系中无尿黑酸的生成。根据体系中加入的不同浓度的hppd抑制剂除草剂(苯吡唑草酮、硝磺草酮或二酮腈)来检测hp1、hp1-1和hp1-2的抗性情况,具体为:以不加hppd抑制剂除草剂时的酶活为100%,计算加入hppd抑制剂除草剂时的相对酶活,采用hplc测定产物尿黑酸的生成量来计算hppd抑制剂除草剂对hp1、hp1-1和hp1-2的ic
50
(酶活催化反应被抑制50%时hppd抑制剂除草剂的浓度)。一个酶活力单位定义为:在ph 7.4、温度30℃条件下1min内生成1μmol尿黑酸所需的酶量。实验结果如图2-4所示(除草剂耐受性蛋白质hp1、hp1-1和hp1-2在不同浓度梯度的hppd抑制剂除草剂(苯吡唑草酮、硝磺草酮或二酮腈)条件下的酶活效果图),利用prism 6.0软件,通过非线性拟合计算苯吡唑草酮、硝磺草酮和二酮腈对hp1、hp1-1和hp1-2的ic
50
值,结果如表1所示。
[0148]
表1、hppd抑制剂除草剂苯吡唑草酮、硝磺草酮和二酮腈对hp1、hp1-1和hp1-2的半抑制浓度
[0149][0150]
表1的结果表明:除草剂耐受性蛋白质hp1、hp1-1和hp1-2对hppd抑制剂除草剂(苯吡唑草酮、硝磺草酮和二酮腈)均具有不同程度的耐受性;与所述除草剂耐受性蛋白质hp1相比,纯化后的所述除草剂耐受性蛋白质hp1-1和hp1-2对hppd抑制剂除草剂的抗性更优。
[0151]
第三实施例、转基因拟南芥植株的获得和验证
[0152]
1、分别构建含有hp1、hp1-1或hp1-2基因的拟南芥重组表达载体
[0153]
将上述第一实施例1中所述hp1m核苷酸序列(seq id no:3)、上述第一实施例4中所述hp1-1m核苷酸序列(seq id no:8)和hp1-2m核苷酸序列(seq id no:11)的5’和3’端分别连接通用接头引物2:
[0154]5’
端通用接头引物2:5
’‑
agtttttctgattaacagactagt-3’,如序列表中seq id no:14所示;
[0155]3’
端通用接头引物2:5
’‑
caaatgtttgaacgatcggcgcgcc-3’,如序列表中seq id no:15所示。
[0156]
利用限制性内切酶spe i和asc i对植物表达载体dbnbc-02进行双酶切反应,从而对植物表达载体线性化,酶切产物纯化得到线性化的dbnbc-02表达载体骨架(载体骨架:pcambia2301(cambia机构可以提供)),将连接所述通用接头引物2的所述hp1m核苷酸序列与所述线性化的dbnbc-02表达载体骨架进行重组反应,操作步骤按照takara公司in-fusion无缝连接产品试剂盒(clontech,ca,usa,cat:121416)说明书进行,构建成重组表达载体dbn11770,其结构示意图如图5所示(spec:壮观霉素基因;rb:右边界;efmv:玄参花叶病毒的34s增强子(seq id no:16);prbrcbp:油菜真核延长因子基因1α(tsf1)的启动子(seq id no:17);spatctp2:拟南芥叶绿体转运肽(seq id no:18);epsps:5-烯醇丙酮酸莽草酸-3-磷酸合酶基因(seq id no:19);tpse9:豌豆rbcs基因的终止子(seq id no:20);pratubi10:拟南芥泛素(ubiquitin)10基因的启动子(seq id no:21);spatctp2:拟南芥叶绿体转运肽(seq id no:18);hp1m:hp1m核苷酸序列(seq id no:3);tnos:胭脂碱合成酶基因的终止子(seq id no:22);pr35s:花椰菜花叶病毒35s启动子(seq id no:23);pat:膦丝菌素n-乙酰基转移酶基因(seq id no:24);t35s:花椰菜花叶病毒35s终止子(seq id no:25);lb:左边界)。
[0157]
将重组表达载体dbn11770用热激方法转化大肠杆菌t1感受态细胞,其热激条件为:50μl大肠杆菌t1感受态细胞、10μl质粒dna(重组表达载体dbn11770),42℃水浴30s;37℃振荡培养1h(100rpm转速下摇床摇动);然后在含50mg/l壮观霉素(spectinomycin)的所述lb固体平板(胰蛋白胨10g/l、酵母提取物5g/l、nacl 10g/l、琼脂15g/l,用naoh调ph至7.5)上于温度37℃条件下培养12h,挑取白色菌落,在lb液体培养基(胰蛋白胨10g/l、酵母
提取物5g/l、nacl 10g/l、壮观霉素50mg/l,用naoh调ph至7.5)中于温度37℃条件下培养过夜。碱法提取其质粒:将菌液在12000rpm转速下离心1min,去上清液,沉淀菌体用100μl冰预冷的溶液i(25mm tris-hcl、10mm edta(乙二胺四乙酸)、50mm葡萄糖,ph8.0)悬浮;加入200μl新配制的溶液ii(0.2m naoh、1%sds(十二烷基硫酸钠)),将管子颠倒4次,混合,置冰上3-5min;加入150μl冰冷的溶液iii(3m醋酸钾、5m醋酸),立即充分混匀,冰上放置5-10min;于温度4℃、转速12000rpm条件下离心5min,在上清液中加入2倍体积无水乙醇,混匀后室温放置5min;于温度4℃、转速12000rpm条件下离心5min,弃上清液,沉淀用浓度(v/v)为70%的乙醇洗涤后晾干;加入30μl含rnase(20μg/ml)的te(10mm tris-hcl、1mm edta,ph8.0)溶解沉淀;于温度37℃下水浴30min,消化rna;于温度-20℃保存备用。将提取的质粒进行测序鉴定,结果表明重组表达载体dbn11770在spe i和asc i位点间的核苷酸序列为序列表中seq id no:3所示的核苷酸序列,即所述hp1m核苷酸序列。
[0158]
按照上述构建重组表达载体dbn11770的方法,将分别连接所述通用接头引物2的所述hp1-1m核苷酸序列、hp1-2m核苷酸序列分别与所述线性化的dbnbc-02表达载体骨架进行重组反应,依次得到重组表达载体dbn11777和dbn11778。测序验证重组表达载体dbn11777和dbn11778中的核苷酸序列分别含有序列表中seq id no:8所示核苷酸序列和seq id no:11所示核苷酸序列,即所述hp1-1m核苷酸序列和hp1-2m核苷酸序列正确插入。
[0159]
按照上述构建重组表达载体dbn11770的方法,构建对照重组表达载体dbn11770n,其载体结构如图6所示(spec:壮观霉素基因;rb:右边界;efmv:玄参花叶病毒的34s增强子(seq id no:16);prbrcbp:油菜真核延长因子基因1α(tsf1)的启动子(seq id no:17);spatctp2:拟南芥叶绿体转运肽(seq id no:18);epsps:5-烯醇丙酮酸莽草酸-3-磷酸合酶基因(seq id no:19);tpse9:豌豆rbcs基因的终止子(seq id no:20);pr35s:花椰菜花叶病毒35s启动子(seq id no:23);pat:膦丝菌素n-乙酰基转移酶基因(seq id no:24);t35s:花椰菜花叶病毒35s终止子(seq id no:25);lb:左边界)。
[0160]
2、拟南芥重组表达载体转化农杆菌
[0161]
对己经构建正确的重组表达载体dbn11770、dbn11777、dbn11778和对照重组表达载体dbn11770n分别用液氮法转化到农杆菌gv3101中,其转化条件为:100μl农杆菌gv3101、3μl质粒dna(重组表达载体);置于液氮中10min,37℃温水浴10min;将转化后的农杆菌gv3101接种于lb试管中于温度28℃、转速为200rpm条件下培养2h,涂于含50mg/l的利福平(rifampicin)和50mg/l的壮观霉素的所述lb固体平板上直至长出阳性单克隆,挑取单克隆培养并提取其质粒,将提取的质粒进行测序鉴定,结果表明重组表达载体dbn11770、dbn11777、dbn11778和dbn11770n结构完全正确。
[0162]
3、转基因拟南芥植株的获得
[0163]
将野生型拟南芥种子悬浮于0.1%(w/v)琼脂糖溶液中。将悬浮的种子在4℃下保存2天以完成对休眠的需要以保证种子同步萌发。用蛭石混合马粪土并用水地下灌溉至湿润,使土壤混合物排水24h。将预处理后的种子种在土壤混合物上并用保湿罩覆盖7天。使种子萌发并在恒温(22℃)恒湿(40-50%)光强度为120-150μmol/m2s-1
的长日照条件(16h光照/8h黑暗)下在温室中培养植物。开始用霍格兰营养液灌溉植物,接着用去离子水灌溉,保持土壤潮湿但不湿透。
[0164]
使用花浸泡法转化拟南芥。用选取的农杆菌菌落接种一份或多份15-30ml含壮观
霉素(50mg/l)和利福平(10mg/l)的lb培养液的预培养物。以220rpm转速将预培养物在温度28℃恒速摇动孵育过夜。每个预培养物用于接种两份500ml含壮观霉素(50mg/l)和利福平(10mg/l)的所述yep培养液的培养物并将培养物在温度28℃持续摇动孵育过夜。室温以转速约4000rpm离心20min沉淀细胞,弃去得到的上清液。将细胞沉淀轻柔重悬于500ml渗透培养基中,所述渗透培养基含有1/2
×
ms盐/b5维生素、10%(w/v)蔗糖、0.044μm苄氨基嘌呤(10μl/l(1mg/ml dmso中的原液))和300μl/lsilvet l-77。将约1月龄的拟南芥植物在含重悬细胞的渗透培养基中浸泡5min,确保浸没最新的花序。接着将拟南芥植物侧面放倒并覆盖,黑暗环境下保湿24h后,在温度22℃以16h光照/8h黑暗的光周期正常培养拟南芥植物。约4周后收获种子。
[0165]
将新收获的(hp1m核苷酸序列、hp1-1m核苷酸序列、hp1-2m核苷酸序列、和对照载体dbn11770n)t1种子在室温干燥7天。将种子种在26.5cm
×
51cm萌发盘中,每盘接受200mg t1种子(约10000个种子),所述种子事先已悬浮于蒸馏水中并在温度4℃下保存2天以完成对休眠的需要以保证种子同步萌发。
[0166]
用蛭石混合马粪土并用水底部灌溉至湿润,利用重力排水。用移液管将预处理后的种子均匀地种在土壤混合物上,并用保湿罩覆盖4-5天。在使用出苗后喷洒草铵膦(选择共转化的pat基因)进行最初转化体选择的前1天移去罩。在7个种植天数后(dap)并于11dap再次使用devilbiss压缩空气喷嘴以10ml/盘(703l/ha)的喷洒体积用liberty除草剂(200g ai/l的草铵膦)的0.2%溶液喷洒t1植物(分别为子叶期和2-4叶期),以提供每次应用280g ai/ha有效量的草铵膦。在最后喷洒后4-7天鉴定存活株(生长活跃的植物),并分别移植到用马粪土和蛭石制备的7cm
×
7cm的方盆中(每盘3-5棵)。用保湿罩覆盖移植的植物3-4天,并如前置于温度22℃培养室中或直接移入温室。接着移去罩并在测试hp1m基因、hp1-1m基因和hp1-2m基因提供苯吡唑草酮除草剂耐受性的能力之前至少1天将植物栽种到温室(温度22
±
5℃,50
±
30%rh,14h光照:10h黑暗,最小500μe/m2s-1
天然 补充光)。
[0167]
4、转基因拟南芥植株的除草剂耐受性效果检测
[0168]
首先使用草铵膦选择方案从未转化种子背景中选择t1转化体。转化重组表达载体dbn11770的为转入hp1m核苷酸序列的拟南芥植株(hp1),转化重组表达载体dbn11777的为转入hp1-1m核苷酸序列的拟南芥植株(hp1-1),转化重组表达载体dbn11778的为转入hp1-2m核苷酸序列的拟南芥植株(hp1-2),转化重组表达载体dbn11770n的为转入对照重组表达载体的拟南芥植株(对照载体)。筛选了约20000个hp1的t1种子,并鉴定了213株t1代阳性转化子(pat基因),约1.0%的转化效率;筛选了约20000个hp1-1的t1种子,并鉴定了195株t1代阳性转化子(pat基因),约1.0%的转化效率;筛选了约20000个hp1-2的t1种子,并鉴定了195株t1代阳性转化子(pat基因),约1.0%的转化效率;筛选了约20000个对照载体的t1种子,并鉴定了172株t1代阳性转化子(pat基因),约0.86%的转化效率。
[0169]
分别将hp1拟南芥t1植株、hp1-1拟南芥t1植株、hp1-2拟南芥t1植株、对照载体的拟南芥t1植株和野生型拟南芥植株(ck)(播种后18天)分别用3种浓度的苯吡唑草酮进行喷洒以检测拟南芥的除草剂耐受性,即25gai/ha(1倍大田浓度,1
×
)、100g ai/ha(4倍大田浓度,4
×
)和0g ai/ha(水,0
×
)。在喷施7天(7dat)后,根据叶片白化面积比例(叶片白化面积比例=叶片白化面积/叶片总面积
×
100%)来统计每株植株受除草剂的损伤程度:以基本无白化表型为0级,叶片白化面积比例小于50%为1级,叶片白化面积比例大于50%为2级,
叶片白化面积比例100%为3级。按照公式x=[σ(n
×
s)/(t
×
m)]
×
100对每个重组表达载体的转化事件抗性表现进行评分。(x-药害评分、n-同级受害株数、s-药害等级数、t-总株数、m-最高药害等级),根据分值进行抗性评价:高抗植株(0-15分)、中抗植株(16-33分)、低抗植株(34-67分)、不抗植株(68-100分)。实验结果如表2所示。
[0170]
表2、转基因拟南芥t1植株对苯吡唑草酮的耐受性实验结果
[0171][0172][0173]
表2的结果表明:相比于转入对照载体dbn11770n的拟南芥t1植株和野生型拟南芥植株,转入hp1m核苷酸序列的拟南芥t1植株、转入hp1-1m核苷酸序列的拟南芥t1植株和转入hp1-2m核苷酸序列的拟南芥t1植株均能够对苯吡唑草酮产生不同程度的耐受性;相比转入hp1m核苷酸序列的拟南芥t1植株,转入hp1-1m核苷酸序列的拟南芥t1植株和转入hp1-2m核苷酸序列的拟南芥t1植株对苯唑草酮抗性更优。
[0174]
综上所述,本发明所述除草剂耐受性蛋白质hp1的氨基酸序列第159位由苏氨酸突变为丙氨酸或第258位由谷氨酰胺突变为甲硫氨酸(所述除草剂耐受性蛋白质hp1-1或hp1-2)时可以对hppd抑制剂除草剂表现出较高的耐受性,且上述除草剂耐受性蛋白质可以耐受1倍大田浓度的苯吡唑草酮(中抗),因此在植物上应用前景广阔。
[0175]
最后所应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。