1.本发明涉及有效地除去在肽化合物的合成过程中产生的不需要的c末端活性体从而有效地制造目标肽化合物的方法。
背景技术:
2.作为肽合成的一种形态,使用以能够与氨基酸、肽等胺类反应而形成酰胺键的方式使氨基酸或肽的c末端羧基活化的化合物来进行。此时,如果在反应结束后的反应溶液中残留羧基被活化的化合物,则会引起所生成的肽的品质降低的问题。
3.这样的c末端被活化的化合物不仅包括肽合成反应中使用的羧基被活化的化合物,还包括其在反应中变化为例如吖内酯、nca(n-羧酸酐(n-carboxyanhydride))等而具有活化状态从而能够与胺类反应的化合物(以下,有时将这些化合物称为“c末端活性体”)。另外,肽合成反应中使用的c末端活性体不限于例如非专利文献1或非专利文献2中记载的使用肽缩合剂合成的活性酯、混合酸酐和酰基异脲等,只要以能够与胺类反应的方式进行活化,则包含任意的化合物。
4.作为生成的肽的品质降低的例子,已知有:由于c末端活性体的残留而导致杂质肽的副产、插入序列的肽以最终产物的杂质的形式混入(专利文献1、2)。
5.作为消除这样的残留的c末端活性体的问题的方法,已知用碱水进行处理而将活性酯水解,以对应的氨基酸的碱水溶液的形式除去的方法(专利文献1)。然而,在该方法中,需要进行多次利用碱水的水解处理,操作繁杂。此外,据推测如果利用碱水的处理次数增加、其处理时间变长,则会引起产物的差向异构化(异构化)等副反应,会损害稳定性。
6.另外,已知有如下方法:将残留的c末端活性体用n,n-二甲基丙烷-1,3-二胺等具有伯氨基的多胺捕获,转化为碱性化合物后,通过利用酸性水溶液的水性洗涤使来自残留的c末端活性体的酰胺化合物转移至水层从而除去(专利文献3、非专利文献3)。然而,如果使用亲核性高的伯胺类,则据推断目标肽的亲电子性高的部位与伯胺发生反应,产生形成共价键的杂质,因此不适于高纯度肽的合成。
7.另外,已知使残留的c末端活性体与捕获剂反应,转化为酰胺化合物而除去的方法,所述捕获剂是包含具有保护基的潜在阴离子的胺(专利文献2)。然而,该方法中,在形成酰胺化合物后,经过水性提取阶段,进行加氢裂化后,需要进一步经过再次的水性提取阶段,因此操作繁杂。
8.另外,如果c末端活性体残留,则将生成的肽的n末端的保护基脱保护时,有时也同时发生该c末端活性体的n末端的保护基的脱保护。残留的c末端活性体的脱保护体为杂质,但在吸光系数小的情况下,难以利用通用的hplc进行检测,因此在品质管理上不优选。
9.现有技术文献
10.专利文献
11.专利文献1:日本专利第5171613号公报
12.专利文献2:日本专利第4142907号公报
13.专利文献3:日本专利第5212371号公报
14.非专利文献
15.非专利文献1:chem.rev.,2011,111,6557.
16.非专利文献2:organic process research&development,2016,20,140.
17.非专利文献3:tetrahedron lett.,1974,15,1785.
技术实现要素:
18.发明要解决的课题
19.本发明是鉴于这种情况而完成的,在一个方面,其课题在于,在肽化合物的合成中,有效地除去残留的c末端活性体。
20.用于解决课题的手段
21.本发明人等发现了如下方法:在包含使酸成分的c末端活性体与胺成分缩合的肽化合物的合成中,能够通过使反应混合液中的残留的c末端活性体与叔胺作用而除去。
22.本发明在非限定的具体的一个方式中包含以下内容。
23.〔1〕一种制造肽化合物的方法,其包括:
24.工序a:得到反应混合液的工序,所述反应混合液包含在溶剂中使酸成分的c末端活性体与胺成分缩合而得到的肽化合物;以及
25.工序b:将上述反应混合液、叔胺和水或水溶液混合,除去该c末端活性体的工序。
26.〔2〕一种制造肽化合物的方法,其包括:
27.工序a:得到反应混合液的工序,所述反应混合液包含在溶剂中使酸成分的c末端活性体与胺成分缩合而得到的肽化合物;以及
28.工序b:将上述反应混合液、叔胺和水或水溶液混合,通过使该叔胺与未反应的c末端活性体作用而除去该c末端活性体的工序。
29.〔3〕根据〔1〕或〔2〕所述的方法,其中,酸成分为氨基被保护基保护的第1氨基酸、或n末端的氨基被保护基保护的第1肽。
30.〔4〕根据〔1〕~〔3〕中任一项所述的方法,其中,胺成分为羧基被保护基保护的第2氨基酸、或c末端的羧基被保护基保护的第2肽。
31.〔5〕根据〔1〕~〔4〕中任一项所述的方法,其中,工序a在缩合剂的存在下进行。
32.〔6〕根据〔1〕~〔5〕中任一项所述的方法,其中,上述叔胺对上述c末端活性体具有亲核反应性。
33.〔7〕根据〔1〕~〔6〕中任一项所述的方法,其中,上述叔胺为氮附近的空间位阻小的胺。
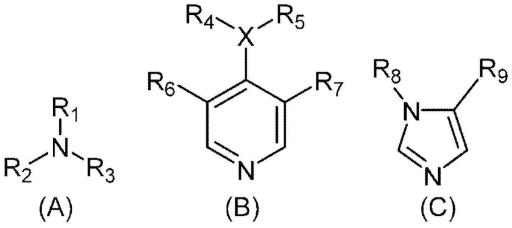
34.〔8〕根据〔1〕~〔7〕中任一项所述的方法,其中,上述叔胺由下述式(a)、(b)、或(c)表示:
[0035][0036]
式中,
[0037]
r1~r3中,(i)r1和r2与它们所键合的氮原子一起形成5~6元非芳香族杂环、且r3为c
1-c2烷基或c2羟基烷基,或者(ii)各自独立地为c
1-c2烷基、或c2羟基烷基,
[0038]
x为n或o,
[0039]
r4和r5各自独立地为c
1-c2烷基、或c2羟基烷基,或者与它们所键合的氮原子一起形成5~6元非芳香族杂环,其中,在x为o的情况下,r5不存在,
[0040]
r6和r7各自独立地为h、c
1-c2烷基、或甲氧基,
[0041]
r8和r9各自独立地为h、c
1-c2烷基、或c2羟基烷基,或者与r8所键合的氮原子和r9所键合的碳原子一起形成5~6元非芳香族杂环。
[0042]
〔9〕根据〔8〕所述的方法,其中,r1~r3各自独立地为c
1-c2烷基。
[0043]
〔10〕根据〔8〕所述的方法,其中,x为n,r4和r5各自独立地为c
1-c2烷基,r6和r7为h。
[0044]
〔11〕根据〔8〕所述的方法,其中,r8和r9各自独立地为h或c
1-c2烷基。
[0045]
〔12〕根据〔1〕~〔11〕中任一项所述的方法,其中,上述叔胺为nmi、dmap或三甲胺。
[0046]
〔13〕根据〔1〕~〔12〕中任一项所述的方法,其中,上述肽化合物包含1个或多个非天然氨基酸。
[0047]
〔14〕根据〔1〕~〔13〕中任一项所述的方法,其中,使上述叔胺与上述c末端活性体作用时的温度为25℃~60℃。
[0048]
〔15〕根据〔1〕~〔14〕中任一项所述的方法,其中,相对于上述胺成分,添加0.5当量以上的上述叔胺。
[0049]
〔16〕根据〔1〕~〔15〕中任一项所述的方法,其中,c末端活性体的残留率为3%以下。
[0050]
〔17〕根据〔1〕~〔16〕中任一项所述的方法,其中,在工序b中,进一步包括将上述反应混合液分层为有机层和水层,接着洗涤该有机层的步骤,该洗涤后的c末端活性体的残留量为1.0%以下。
[0051]
〔18〕根据〔1〕~〔17〕中任一项所述的方法,其中,上述工序a中的溶剂为甲苯、乙腈、四氢呋喃、2-甲基四氢呋喃、乙酸异丙酯、乙酸乙酯、甲基叔丁醚、环戊基甲醚、或n,n-二甲基甲酰胺、或其混合溶剂。
[0052]
〔19〕根据〔1〕~〔18〕中任一项所述的方法,其中,在上述工序b中,上述水溶液为碱水溶液。
[0053]
〔20〕根据〔1〕~〔19〕中任一项所述的方法,其中,第1氨基酸的侧链包含1个以上的碳原子。
[0054]
〔21〕根据〔20〕所述的方法,其中,上述侧链为可以被取代的烷基、可以被取代的烯基、可以被取代的炔基、可以被取代的环烷基、可以被取代的烷氧基烷基、可以被取代的环
烷基烷基、可以被取代的芳烷基、或可以被取代的杂芳基烷基。
[0055]
〔22〕根据〔1〕~〔21〕中任一项所述的方法,其中,使上述叔胺与上述c末端活性体作用时的时间为2小时以下。
[0056]
〔23〕根据〔1〕~〔22〕中任一项所述的方法,其中,使上述叔胺与上述c末端活性体作用时的时间为2分钟~2小时。
[0057]
〔24〕根据〔1〕~〔23〕中任一项所述的方法,其中,使上述叔胺与上述c末端活性体作用时的时间为5分钟~60分钟。
[0058]
〔25〕根据〔1〕~〔24〕中任一项所述的方法,其中,使上述叔胺与上述c末端活性体作用时的时间为5分钟~50分钟。
[0059]
〔26〕根据〔1〕~〔25〕中任一项所述的方法,其中,上述c末端活性体在缩合剂的存在下形成,该缩合剂包含t3p、hatu、bep、dmt-mm、edc与pfpoh的组合、edc与hoobt的组合、或edc与hobt的组合。
[0060]
〔27〕根据〔1〕~〔26〕中任一项所述的方法,其还包括工序c:将上述肽化合物的n末端的保护基脱保护的工序。
[0061]
〔28〕根据〔1〕~〔27〕所述的方法,其中,使上述c末端活性体与上述叔胺作用而水解、除去。
[0062]
〔29〕一种促进该c末端活性体的水解的方法,其包括在包含残留的c末端活性体的溶液中追加叔胺和水或水溶液,使该c末端活性体与叔胺作用的工序。
[0063]
〔30〕一种除去该水解物的方法,其包括对包含残留的c末端活性体的水解物的溶液进行水性洗涤的工序。
[0064]
发明效果
[0065]
通过使用本发明的方法,利用1次水解处理和接着其的水性洗涤,能够简便且在短时间内有效地除去缩合反应后残留的c末端活性体,因此能够不进行柱纯化地纯度良好地合成肽化合物。
附图说明
[0066]
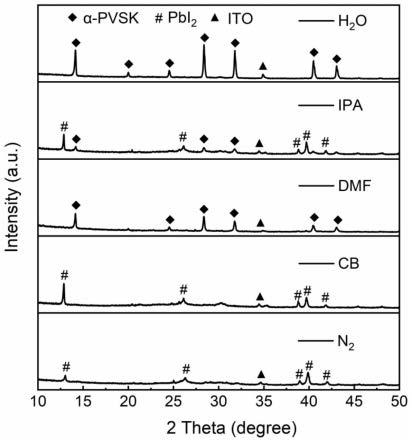
图1是表示c末端活性体的残留量相对值的图。
[0067]
图2是表示c末端活性体的残留量相对值的图。
[0068]
图3是表示c末端活性体的残留量相对值的图。
[0069]
图4是表示c末端活性体的残留率的推移的图。
具体实施方式
[0070]
以下,对本发明的优选的非限定性的实施方式进行说明。
[0071]
后述的本实施例中记载的所有要素(element)不受意图使本专利申请权利化的国家的、能够对实施例中记载的内容进行限定性解释的任何专利实务、习惯、法令等的限制,意图在于在本“具体实施方式”中当然也视为等同地进行了记载。
[0072]
只要基于本领域技术人员的技术常识在技术上不矛盾,则意图将本发明中记载的任何一个或多个要素(element)的部分或全部的任何组合包括在本发明中,并且被记载为是本领域技术人员应当理解的。
[0073]
(缩写)
[0074]
本说明书中使用的缩写如下。
[0075]
氨基酸的缩写
[0076]
aib:α-甲基丙氨酸
[0077]
ala:丙氨酸
[0078]
arg:精氨酸
[0079]
asn:天冬酰胺
[0080]
asp:天冬氨酸
[0081]
asp(tbu):o-叔丁基天冬氨酸
[0082]
aze:氮杂环丁烷-2-羧酸
[0083]
cys:半胱氨酸
[0084]
glu:谷氨酸
[0085]
gln:谷氨酰胺
[0086]
gly:甘氨酸
[0087]
his:组氨酸
[0088]
hph:高苯丙氨酸
[0089]
ile:异亮氨酸
[0090]
leu:亮氨酸
[0091]
lys:赖氨酸
[0092]
meala:n-甲基丙氨酸
[0093]
measp(tbu):n-甲基o-叔丁基天冬氨酸
[0094]
megly:n-甲基甘氨酸
[0095]
meile:n-甲基异亮氨酸
[0096]
meleu:n-甲基亮氨酸
[0097]
mephe:n-甲基苯丙氨酸
[0098]
meval:n-甲基缬氨酸
[0099]
met:甲硫氨酸
[0100]
phe:苯丙氨酸
[0101]
phe-otbu:o-叔丁基苯丙氨酸
[0102]
phe(3-f):3-氟苯丙氨酸
[0103]
pro:脯氨酸
[0104]
ser:丝氨酸
[0105]
ser(tbu):o-叔丁基丝氨酸
[0106]
thr:苏氨酸
[0107]
thr(tbu):o-叔丁基-苏氨酸
[0108]
trp:色氨酸
[0109]
tyr:酪氨酸
[0110]
val:缬氨酸
[0111]
试剂/溶剂的缩写
[0112]
bep:四氟硼酸2-溴-1-乙基吡啶鎓
[0113]
dabco:1,4-二氮杂双环[2.2.2]辛烷
[0114]
dbu:1,8-二氮杂双环[5.4.0]十一碳-7-烯
[0115]
dcm:二氯甲烷
[0116]
dipea:二异丙基二乙胺
[0117]
dmap:二甲基氨基吡啶
[0118]
dmt-mm:4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉鎓氯化物
[0119]
edc:1-(3-二甲基氨基丙基)-3-乙基碳二亚胺
[0120]
hatu:o-(7-氮杂苯并三唑-1-基)-n,n,n’,n
’‑
四甲基脲六氟磷酸盐
[0121]
hoat:1-氮杂羟基苯并三唑
[0122]
hobt:1-羟基苯并三唑
[0123]
hoobt:3,4-二氢-3-羟基-4-氧代-1,2,3-苯并三嗪
[0124]
hosu:n-羟基琥珀酰亚胺
[0125]
mtbe:甲基叔丁醚
[0126]
nmi:n-甲基咪唑
[0127]
nmm:n-甲基吗啉
[0128]
t3p:丙基膦酸酐(环状三聚体)
[0129]
tbaf:四丁基氟化铵
[0130]
tsoh:对甲苯磺酸
[0131]
官能团的缩写
[0132]
bn:苄基
[0133]
boc:叔丁氧基羰基
[0134]
cbz:苄氧基羰基
[0135]
pfp:五氟苯基
[0136]
teoc:2-(三甲基甲硅烷基)乙氧基羰基
[0137]
(官能团等的定义)
[0138]
作为本说明书中的“卤素原子”,可例示f、cl、br或i。
[0139]
本说明书中,“烷基”是指从脂肪族烃中除去1个任意的氢原子而衍生的1价的基团,在骨架中不含有杂原子(是指碳和氢原子以外的原子。)或不饱和碳-碳键,且含有具有氢和碳原子的烃基或烃基结构的子集。烷基不仅包括直链状的烷基,还包括支链状的烷基。作为烷基,具体而言,可举出碳原子数1~20(c
1-c
20
,以下,“c
p-c
q”是指碳原子数为p~q个)的烷基,优选为c
1-c
10
烷基,更优选为c
1-c6烷基,进一步优选为c
1-c2烷基。作为烷基,具体而言,可举出甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、异丁基(2-甲基丙基)、正戊基、仲戊基(1-甲基丁基)、叔戊基(1,1-二甲基丙基)、新戊基(2,2-二甲基丙基)、异戊基(3-甲基丁基)、3-戊基(1-乙基丙基)、1,2-二甲基丙基、2-甲基丁基、正己基、1,1,2-三甲基丙基、1,2,2-三甲基丙基、1,1,2,2-四甲基丙基、1,1-二甲基丁基、1,2-二甲基丁基、1,3-二甲基丁基、2,2-二甲基丁基、2,3-二甲基丁基、3,3-二甲基丁基、1-乙基丁基、2-乙基丁基等。
[0140]
本说明书中,“烯基”是指具有至少1个双键(2个相邻的sp2碳原子)的1价的基团。根据双键和取代基(如果存在的话)的配置,双键的几何构型可以采用entgegen(e)或
c8环烷氧基。作为环烷氧基,具体而言,例如可举出环丙氧基、环丁氧基和环戊氧基等。
[0149]
本说明书中,“芳氧基”是指与上述定义的“芳基”键合的氧基,优选可举出c
6-c
10
芳氧基。作为芳氧基,具体而言,例如可举出苯氧基、1-萘氧基、2-萘氧基等。
[0150]
本说明书中,“氨基”狭义上是指-nh2,广义上是指-nrr’,在此,r和r’独立地选自氢、烷基、烯基、炔基、环烷基、杂环基、芳基、或杂芳基,或者r和r’与它们所键合的氮原子一起形成环。作为氨基,优选可举出-nh2、单c
1-c6烷基氨基、二c
1-c6烷基氨基、4~8元环状氨基等。
[0151]
本说明书中,“单烷基氨基”是指上述定义的“氨基”中r为氢、且r’为上述定义的“烷基”的基团,优选可举出单c
1-c6烷基氨基。作为单烷基氨基,具体而言,例如可举出甲基氨基、乙基氨基、正丙基氨基、异丙基氨基、正丁基氨基、仲丁基氨基、叔丁基氨基等。
[0152]
本说明书中,“二烷基氨基”是指上述定义的“氨基”中,r和r’独立地为上述定义的“烷基”的基团,优选可举出二c
1-c6烷基氨基。作为二烷基氨基,具体而言,例如可举出二甲基氨基、二乙基氨基等。
[0153]
本说明书中,“环状氨基”是指上述定义的“氨基”中,r和r’与它们所键合的氮原子一起形成环的基团,优选可举出4~8元环状氨基。作为环状氨基,具体而言,例如可举出1-氮杂环丁烷基、1-吡咯烷基、1-哌啶基、1-哌嗪基、4-吗啉基、3-噁唑烷基、1,1-二氧化硫代吗啉基-4-基、3-氧杂-8-氮杂双环[3.2.1]辛烷-8-基等。
[0154]
本说明书中的“羟基烷基”是指上述定义的“烷基”的1个或多个氢被羟基取代的基团,优选c
1-c6羟基烷基,更优选c2羟基烷基。作为羟基烷基,具体而言,例如可举出羟基甲基、1-羟基乙基、2-羟基乙基、2-羟基-2-甲基丙基、5-羟基戊基等。
[0155]
本说明书中的“卤代烷基”是指上述定义的“烷基”的1个或多个氢被卤素取代的基团,优选c
1-c6卤代烷基,更优选c
1-c6氟烷基。作为卤代烷基,具体而言,例如可举出二氟甲基、三氟甲基、2,2-二氟乙基、2,2,2-三氟乙基、3,3-二氟丙基、4,4-二氟丁基和5,5-二氟戊基等。
[0156]
本说明书中的“氰基烷基”是指上述定义的“烷基”的1个或多个氢被氰基取代的基团,优选c
1-c6氰基烷基。作为氰基烷基,具体而言,例如可举出氰基甲基、2-氰基乙基等。
[0157]
本说明书中的“氨基烷基”是指上述定义的“烷基”的1个或多个氢被上述定义的“氨基”取代的基团,优选c
1-c6氨基烷基。作为氨基烷基,具体而言,例如可举出1-吡啶基甲基、2-(1-哌啶基)乙基、3-(1-哌啶基)丙基、4-氨基丁基等。
[0158]
本说明书中的“羧基烷基”是指上述定义的“烷基”的1个或多个氢被羧基取代的基团,优选c
2-c6羧基烷基。作为羧基烷基,具体而言,例如可举出羧基甲基等。
[0159]
本说明书中的“烯氧基羰基烷基”是指上述定义的“烷基”的1个或多个氢被上述定义的“烯氧基羰基”取代的基团,优选c
2-c6烯氧基羰基c
1-c6烷基,更优选c
2-c6烯氧基羰基c
1-c2烷基。作为烯氧基羰基烷基,具体而言,例如可举出烯丙氧基羰基甲基、2-(烯丙氧基羰基)乙基等。
[0160]
本说明书中的“烷氧基烷基”是指上述定义的“烷基”的1个或多个氢被上述定义的“烷氧基”取代的基团,优选c
1-c6烷氧基c
1-c6烷基,更优选c
1-c6烷氧基c
1-c2烷基。作为烷氧基烷基,具体而言,例如可举出甲氧基甲基、乙氧基甲基、1-丙氧基甲基、2-丙氧基甲基、正丁氧基甲基、异丁氧基甲基、仲丁氧基甲基、叔丁氧基甲基、戊氧基甲基、3-甲基丁氧基甲
基、1-甲氧基乙基、2-甲氧基乙基、2-乙氧基乙基等。
[0161]
本说明书中的“环烷基烷基”是指上述定义的“烷基”的1个或多个氢被上述定义的“环烷基”取代的基团,优选c
3-c8环烷基c
1-c6烷基,更优选c
3-c6环烷基c
1-c2烷基。作为环烷基烷基,具体而言,例如可举出环丙基甲基、环丁基甲基、环戊基甲基、环己基甲基等。
[0162]
本说明书中的“环烷氧基烷基”是指上述定义的“烷基”的1个或多个氢被上述定义的“环烷氧基”取代的基团,优选c
3-c8环烷氧基c
1-c6烷基,更优选c
3-c6环烷氧基c
1-c2烷基。作为环烷氧基烷基,具体而言,例如可举出环丙氧基甲基、环丁氧基甲基等。
[0163]
本说明书中的“杂环基烷基”是指上述定义的“烷基”的1个或多个氢被上述定义的“杂环基”取代的基团,优选4~7元杂环基c
1-c6烷基,更优选4~7元杂环基c
1-c2烷基。作为杂环基烷基,具体而言,例如可举出2-(四氢-2h-吡喃-4-基)乙基、2-(氮杂环丁烷-3-基)乙基等。
[0164]
本说明书中的“烷基磺酰基烷基”是指上述定义的“烷基”的1个或多个氢被上述定义的“烷基磺酰基”取代的基团,优选c
1-c6烷基磺酰基c
1-c6烷基,更优选c
1-c6烷基磺酰基c
1-c2烷基。作为烷基磺酰基烷基,具体而言,例如可举出甲基磺酰基甲基、2-(甲基磺酰基)乙基等。
[0165]
本说明书中的“氨基羰基烷基”是指上述定义的“烷基”的1个或多个氢被上述定义的“氨基羰基”取代的基团,优选氨基羰基c
1-c6烷基,更优选氨基羰基c
1-c4烷基。作为氨基羰基烷基,具体而言,例如可举出甲基氨基羰基甲基、二甲基氨基羰基甲基、叔丁基氨基羰基甲基、1-氮杂环丁烷基羰基甲基、1-吡咯烷基羰基甲基、1-哌啶基羰基甲基、4-吗啉基羰基甲基、2-(甲基氨基羰基)乙基、2-(二甲基氨基羰基)乙基、2-(1-氮杂环丁烷基羰基)乙基、2-(1-吡咯烷基羰基)乙基、2-(4-吗啉基羰基)乙基、3-(二甲基氨基羰基)丙基、4-(二甲基氨基羰基)丁基等。
[0166]
本说明书中的“芳氧基烷基”是指上述定义的“烷基”的1个或多个氢被上述定义的“芳氧基”取代的基团,优选c
6-c
10
芳氧基c
1-c6烷基,更优选c
6-c
10
芳氧基c
1-c2烷基。作为芳氧基烷基,具体而言,例如可举出苯氧基甲基、2-苯氧基乙基等。
[0167]
本说明书中,“芳烷基(芳基烷基)”是指上述定义的“烷基”的至少一个氢原子被上述定义的“芳基”取代的基团,优选c
7-c
14
芳烷基,更优选c
7-c
10
芳烷基。作为芳烷基,具体而言,例如可举出苄基、苯乙基和3-苯基丙基等。
[0168]
本说明书中,“杂芳基烷基”是指上述定义的“烷基”的至少一个氢原子被上述定义的“杂芳基”取代的基团,优选5~10元杂芳基c
1-c6烷基,更优选5~10元杂芳基c
1-c2烷基。作为杂芳基烷基,具体而言,例如可举出3-噻吩基甲基、4-噻唑基甲基、2-吡啶基甲基、3-吡啶基甲基、4-吡啶基甲基、2-(2-吡啶基)乙基、2-(3-吡啶基)乙基、2-(4-吡啶基)乙基、2-(6-喹啉基)乙基、2-(7-喹啉基)乙基、2-(6-吲哚基)乙基、2-(5-吲哚基)乙基、2-(5-苯并呋喃基)乙基等。
[0169]
本说明书中的“非芳香族杂环”是指在构成环的原子中含有1~5个杂原子的非芳香族性的杂环。非芳香族杂环可以在环中具有双键和/或三键,环中的碳原子可以被氧化而形成羰基。另外,非芳香族杂环可以为单环,也可以为稠环,还可以为螺环。构成环的原子的数量没有限定,优选为5~6(5~6元非芳香族杂环)。作为非芳香族杂环,具体而言,例如可举出氮杂环丁烷、氧杂环丁烷、硫杂环丁烷、吡咯烷、四氢呋喃、四氢噻吩、咪唑烷、吡唑烷、
噁唑烷、异噁唑烷、噻唑烷、异噻唑烷、二氧戊环、二硫杂环戊烷、哌啶、四氢吡喃、硫杂环戊烷、哌嗪、吗啉、硫代吗啉、二噁烷、二噻烷、氮杂环庚烷、氧杂环庚烷、硫杂环庚烷、二氮杂环庚烷等。
[0170]
在本说明书中,“肽链”是指1、2、3、4或其以上的天然氨基酸和/或非天然氨基酸通过酰胺键和/或酯键连接而成的肽链。
[0171]
本说明书中,“可以被取代”是指某一基团可以被任意的取代基取代。
[0172]
本说明书中,“1个或多个”意指1个或2个以上的数。在涉及某一基团的取代基的上下文中使用“1个或多个”时,该术语是指从1个到该基团允许的取代基的最大数目的数。作为“1个或多个”,具体而言,例如可举出1、2、3、4、5、6、7、8、9、10、和/或更多个。
[0173]
本说明书中,“c末端活性体”不仅包括肽合成反应中使用的羧基被活化的化合物(例如,与目标肽化合物的制造相关的活性酯),还包括其在反应中例如变化为吖内酯、nca(n-羧酸酐(n-carboxyanhydride))等而具有活化状态从而与胺类(例如,胺成分)反应而能够提供目标肽化合物的化合物。另外,作为肽合成反应中使用的羧基被活化的化合物的c末端活性体不限于例如chem.rev.,2011,111,6557.或organic process research&development,2016,20(2),140.中记载的使用肽缩合剂合成的活性酯、混合酸酐和酰基异脲等,包含以能够与胺类反应的方式进行活化的任意化合物。
[0174]
本说明书中的“活性酯”是指包含与氨基反应而形成酰胺键的羰基的化合物,是在该羰基上键合有例如obt、oat、osu、opfp等的化合物,是促进与胺的反应的化合物。
[0175]
本说明书中的“氨基酸”包括天然氨基酸和非天然氨基酸。本说明书中的“天然氨基酸”是指gly、ala、ser、thr、val、leu、ile、phe、tyr、trp、his、glu、asp、gln、asn、cys、met、lys、arg、pro。非天然氨基酸没有特别限定,可例示β-氨基酸、γ-氨基酸、d型氨基酸、n取代氨基酸、α,α-二取代氨基酸、侧链与天然不同的氨基酸、羟基羧酸等。作为本说明书中的氨基酸,允许任意的立体构型。氨基酸的侧链的选择没有特别限制,除了氢原子以外,例如也可从烷基、烯基、炔基、芳基、杂芳基、芳烷基、环烷基中自由地选择,这些基团中的不相邻的1个或2个亚甲基可以被氧原子、羰基(-co-)、或磺酰基(-so
2-)、磷酰基、膦酰基取代。可以分别赋予取代基,这些取代基也没有限制,例如可以从包含卤素原子、o原子、s原子、n原子、b原子、si原子或p原子的任意的取代基中独立地自由选择1个或2个以上。即,可例示可以被取代的烷基、烯基、炔基、芳基、杂芳基、芳烷基、环烷基等。在非限定的一个方式中,本说明书中的氨基酸可以为在同一分子内具有羧基和氨基的化合物。
[0176]
氨基酸的主链氨基可以为未取代(nh2基),也可以被取代(即,-nhr基:r表示可以具有取代基的烷基、烯基、炔基、芳基、杂芳基、芳烷基、环烷基,这些基团中的不相邻的1个或2个亚甲基可以被氧原子、羰基(-co-)或磺酰基(-so
2-)取代,另外,如脯氨酸那样与n原子键合的碳链与α位的碳原子也可以形成环。这样的主链氨基被取代的氨基酸在本说明书中称为“n取代氨基酸”。作为本说明书中的“n取代氨基酸”,优选例示n-烷基氨基酸、n-c
1-c6烷基氨基酸、n-c
1-c4烷基氨基酸、n-甲基氨基酸,但不限定于这些。
[0177]
构成本说明书中的肽化合物的“氨基酸”包括分别对应的全部同位素。“氨基酸”的同位素是至少1个原子被原子序数(质子数)相同、质量数(质子和中子的数之和)不同的原子取代的物质。作为构成本发明的肽化合物的“氨基酸”中所含的同位素的例子,有氢原子、碳原子、氮原子、氧原子、磷原子、硫原子、氟原子、氯原子等,分别包括2h、3h、
13
c、
14
c、
15
n、
17
o、
18
o、
31
p、
32
p、
35
s、
18
f、
36
cl等。
[0178]
作为本说明书中的包含卤素原子的取代基,可例示在取代基中具有卤素的烷基、环烷基、烯基、炔基、芳基、杂芳基、芳烷基等,更具体而言,可例示氟烷基、二氟烷基、三氟烷基等。
[0179]
作为包含o原子的取代基,可举出羟基(-oh)、氧基(-or)、羰基(-c(=o)-r)、羧基(-co2h)、氧基羰基(-c(=o)-or)、羰基氧基(-o-c(=o)-r)、硫代羰基(-c(=o)-sr)、羰基硫基(-s-c(=o)-r)、氨基羰基(-c(=o)-nhr)、羰基氨基(-nh-c(=o)-r)、氧基羰基氨基(-nh-c(=o)-or)、磺酰氨基(-nh-so
2-r)、氨基磺酰基(-so
2-nhr)、氨磺酰基氨基(-nh-so
2-nhr)、硫代羧基(-c(=o)-sh)、羧基羰基(-c(=o)-co2h)等基团。
[0180]
作为氧基(-or)的例子,可举出烷氧基、环烷氧基、烯氧基、炔氧基、芳氧基、杂芳氧基、芳烷氧基等。作为烷氧基,优选c
1-c4烷氧基、c
1-c2烷氧基,其中优选甲氧基或乙氧基。
[0181]
作为羰基(-c(=o)-r)的例子,可举出甲酰基(-c(=o)-h)、烷基羰基、环烷基羰基、烯基羰基、炔基羰基、芳基羰基、杂芳基羰基、芳烷基羰基等。
[0182]
作为氧基羰基(-c(=o)-or)的例子,可举出烷氧基羰基、环烷氧基羰基、烯氧基羰基、炔氧基羰基、芳氧基羰基、杂芳氧基羰基、芳烷氧基羰基等。
[0183]
作为羰基氧基(-o-c(=o)-r)的例子,可举出烷基羰氧基、环烷基羰氧基、烯基羰氧基、炔基羰氧基、芳基羰氧基、杂芳基羰氧基、芳烷基羰氧基等。
[0184]
作为硫代羰基(-c(=o)-sr)的例子,可举出烷基硫代羰基、环烷基硫代羰基、烯基硫代羰基、炔基硫基羰基、芳基硫代羰基、杂芳基硫代羰基、芳烷基硫代羰基等。
[0185]
作为羰基硫基(-s-c(=o)-r)的例子,可举出烷基羰基硫基、环烷基羰基硫基、烯基羰基硫基、炔基羰基硫基、芳基羰基硫基、杂芳基羰基硫基、芳烷基羰基硫基等。
[0186]
作为氨基羰基(-c(=o)-nhr)的例子,可举出烷基氨基羰基(例如可例示c
1-c6或c
1-c4烷基氨基羰基,尤其是乙氨基羰基、甲基氨基羰基等。)、环烷基氨基羰基、烯基氨基羰基、炔基氨基羰基、芳基氨基羰基、杂芳基氨基羰基、芳烷基氨基羰基等。除此之外,还可举出与-c(=o)-nhr中的n原子键合的h原子被烷基、环烷基、烯基、炔基、芳基、杂芳基、芳烷基进一步取代的基团。
[0187]
作为羰基氨基(-nh-c(=o)-r)的例子,可举出烷基羰基氨基、环烷基羰基氨基、烯基羰基氨基、炔基羰基氨基、芳基羰基氨基、杂芳基羰基氨基、芳烷基羰基氨基等。除此之外,还可举出与-nh-c(=o)-r中的n原子键合的h原子被烷基、环烷基、烯基、炔基、芳基、杂芳基、芳烷基进一步取代的基团。
[0188]
作为氧基羰基氨基(-nh-c(=o)-or)的例子,可举出烷氧基羰基氨基、环烷氧基羰基氨基、烯氧基羰基氨基、炔氧基羰基氨基、芳氧基羰基氨基、杂芳氧基羰基氨基、芳烷氧基羰基氨基等。除此以外,还可举出与-nh-c(=o)-or中的n原子键合的h原子被烷基、环烷基、烯基、炔基、芳基、杂芳基、芳烷基进一步取代的基团。
[0189]
作为磺酰氨基(-nh-so
2-r)的例子,可举出烷基磺酰氨基、环烷基磺酰氨基、烯基磺酰氨基、炔基磺酰氨基、芳基磺酰氨基、杂芳基磺酰氨基、芳烷基磺酰氨基等。除此以外,还可举出与-nh-so
2-r中的n原子键合的h原子被烷基、环烷基、烯基、炔基、芳基、杂芳基、芳烷基进一步取代的基团。
[0190]
作为氨基磺酰基(-so
2-nhr)的例子,可举出烷基氨基磺酰基、环烷基氨基磺酰基、
烯基氨基磺酰基、炔基氨基磺酰基、芳基氨基磺酰基、杂芳基氨基磺酰基、芳烷基氨基磺酰基等。除此以外,还可举出与-so
2-nhr中的n原子键合的h原子被烷基、环烷基、烯基、炔基、芳基、杂芳基、芳烷基进一步取代的基团。
[0191]
作为氨磺酰基氨基(-nh-so
2-nhr)的例子,可举出烷基氨磺酰基氨基、环烷基氨磺酰基氨基、烯基氨磺酰基氨基、炔基氨磺酰基氨基、芳基氨磺酰基氨基、杂芳基氨磺酰基氨基、芳烷基氨磺酰基氨基等。此外,与-nh-so
2-nhr中的n原子键合的2个h原子可以被独立地选自烷基、环烷基、烯基、炔基、芳基、杂芳基、和芳烷基中的取代基取代,另外,这些中的2个取代基可以形成环。
[0192]
作为包含s原子的取代基,可举出硫醇(-sh)、硫基(-s-r)、亚磺酰基(-s(=o)-r)、磺酰基(-so
2-r)、磺基(-so3h)等基团。
[0193]
作为硫基(-s-r)的例子,可从烷硫基、环烷硫基、烯硫基、炔硫基、芳硫基、杂芳硫基、芳烷硫基等中进行选择。
[0194]
作为磺酰基(-so
2-r)的例子,可举出烷基磺酰基、环烷基磺酰基、烯基磺酰基、炔基磺酰基、芳基磺酰基、杂芳基磺酰基、芳烷基磺酰基等。
[0195]
作为包含n原子的取代基,可举出叠氮(-n3,也称为“叠氮基”)、氰基(-cn)、伯氨基(-nh2)、仲氨基(-nh-r;也称为单取代氨基。)、叔氨基(-nr(r
′
);也称为二取代氨基。)、脒基(-c(=nh)-nh2)、取代脒基(-c(=nr)-nr
′r″
)、胍基(-nh-c(=nh)-nh2)、取代胍基(-nr-c(=nr
″′
)-nr
′r″
)、氨基羰基氨基(-nr-co-nr
′r″
)、吡啶基、哌啶基、吗啉基、氮杂环丁烷基等基团。
[0196]
作为仲氨基(-nh-r;单取代氨基)的例子,可举出烷基氨基、环烷基氨基、烯基氨基、炔基氨基、芳基氨基、杂芳基氨基、芳烷基氨基等。
[0197]
作为叔氨基(-nr(r
′
);二取代氨基)的例子,例如可举出烷基(芳烷基)氨基等具有各自独立地选自烷基、环烷基、烯基、炔基、芳基、杂芳基、芳烷基等中的任意两个取代基的氨基,这些任意两个取代基可以形成环。具体而言,可例示二烷基氨基,尤其是c
1-c6二烷基氨基、c
1-c4二烷基氨基、二甲基氨基、二乙基氨基等。本说明书中的“c
p-cq二烷基氨基”是指氨基上取代有2个c
p-cq烷基的基团,两个c
p-cq烷基可以相同也可以不同。
[0198]
作为取代脒基(-c(=nr)-nr
′r″
)的例子,可举出n原子上的3个取代基r、r
′
、和r
″
各自独立地选自烷基、环烷基、烯基、炔基、芳基、杂芳基、芳烷基中的基团,例如烷基(芳烷基)(芳基)脒基等。
[0199]
作为取代胍基(-nr-c(=nr
″′
)-nr
′r″
)的例子,可举出r、r
′
、r
″
、和r
″′
各自独立地选自烷基、环烷基、烯基、炔基、芳基、杂芳基、芳烷基中的基团、或者它们形成环而成的基团等。
[0200]
作为氨基羰基氨基(-nr-co-nr
′r″
)的例子,可举出r、r
′
、和r
″
各自独立地选自氢原子、烷基、环烷基、烯基、炔基、芳基、杂芳基、芳烷基中的基团、或者它们形成环而成的基团等。
[0201]
本说明书中,有时将构成肽化合物的“氨基酸残基”简称为“氨基酸”。
[0202]
(肽化合物的制造方法)
[0203]
在一个方式中,本发明涉及制造肽化合物的方法,该方法包括以下的工序。
[0204]
工序a:得到反应混合液的工序,所述反应混合液包含在溶剂中使酸成分的c末端
活性体与胺成分缩合而得到的肽化合物,以及
[0205]
工序b:将上述反应混合液、叔胺和水或水溶液混合,除去该c末端活性体的工序。
[0206]
工序a是在溶剂中使用缩合剂使酸成分与胺成分反应从而得到包含肽化合物的反应混合液的工序。虽然不限于特定的理论,但在工序a中酸成分与缩合剂反应,形成酸成分的c末端活性体,接着胺成分亲核攻击该c末端活性体,由此进行反应,生成肽化合物。
[0207]
作为酸成分,可以使用氨基被保护基保护的氨基酸、或n末端的氨基被保护基保护的肽。在本说明书中,有时将用作酸成分的氨基酸称为“第1氨基酸”,将用作酸成分的肽称为“第1肽”。
[0208]
第1氨基酸没有特别限定,可以使用任意的天然氨基酸或非天然氨基酸。另外,第1肽也没有特别限定,可以使用2个以上的任意的天然氨基酸和/或非天然氨基酸连接而成的肽。
[0209]
作为第1氨基酸,优选可举出在其侧链中包含1个以上的碳原子的氨基酸。作为这样的氨基酸,具体而言,可例示在侧链具有可以被取代的烷基、可以被取代的烯基、可以被取代的炔基、可以被取代的环烷基、可以被取代的烷氧基烷基、可以被取代的环烷基烷基、可以被取代的芳烷基、可以被取代的杂芳基烷基等的氨基酸。另外,在上述侧链具有氨基、羧基、羟基等能够影响肽键的形成反应的官能团的情况下,优选用适当的保护基保护这些基团。不受特定理论的束缚,在氨基酸在其侧链具有体积大的基团的情况下,由于其空间位阻,该氨基酸的残留的c末端活性体的水解有时在以往的方法中无法充分进行。即使在这样的情况下,通过使用本发明的方法,也能够迅速且有效地将残留的c末端活性体水解。
[0210]
第1肽中所含的c末端的氨基酸的侧链也可以具有与上述第1氨基酸同样的侧链。
[0211]
作为第1氨基酸的氨基的保护基和第1肽的n末端的氨基的保护基,可以使用本技术领域中通常的氨基的保护基。作为这样的保护基,具体而言,例如可举出cbz、boc、teoc、fmoc、tfa、alloc、壬基、二硝基壬基、t-bu、三苯甲基和枯基等。
[0212]
在一个方式中,酸成分优选以至少与胺成分相同的当量、优选相对于胺成分过量的量使用。具体而言,例如可以使用相对于胺成分为1~1.1当量、1~1.2当量、1~1.3当量、1~1.4当量、1~1.5当量、1~2.0当量、1~3.0当量的酸成分。
[0213]
在一个方式中,本发明中的酸成分的c末端活性体可以是通过在溶剂中使酸成分与缩合剂作用而形成的。作为缩合剂,只要是为了提高酸成分的羰基碳的亲电子性而能够向该酸成分的羧基的羟基部分导入具有离去能力的基团的缩合剂,就没有特别限定,具体而言,例如可举出t3p、hatu、bep、碳二亚胺类(dic、edc等)、碳二亚胺类与添加剂(oxyma、hoobt、hobt等)的组合、dmt-mm、cdi等。
[0214]
使c末端活性体与胺成分缩合而得到肽化合物的工序(工序a)可以通过在-20℃~溶剂的沸点附近的温度、优选为0℃~60℃的温度下将反应混合液搅拌1分钟~48小时、优选15分钟~4小时来进行。
[0215]
在工序a中,酸成分与胺成分的缩合反应可以定量地进行。
[0216]
作为胺成分,可以使用羧基被保护基保护的氨基酸、或c末端的羧基被保护基保护的肽。在本说明书中,有时将用作胺成分的氨基酸称为“第2氨基酸”,将用作胺成分的肽称为“第2肽”。
[0217]
第2氨基酸没有特别限定,可以使用任意的天然氨基酸或任意的非天然氨基酸。另
外,第2肽也没有特别限定,可以使用2个以上的任意的天然氨基酸和/或非天然氨基酸连接而成的肽。
[0218]
作为第2氨基酸的羧基的保护基、和第2肽的c末端的羧基的保护基,可以使用本技术领域中通常的羧基的保护基。作为这样的保护基,具体而言,例如可举出甲基、烯丙基、叔丁基、三苯甲基、枯基、苄基、甲氧基三苯甲基、1-哌啶基等。
[0219]
在一个方式中,作为本发明中的溶剂,只要能够进行缩合反应而得到肽化合物,则可以使用任意的溶剂。作为这样的溶剂,具体而言,例如可举出甲苯、乙腈、四氢呋喃、2-甲基四氢呋喃、乙酸异丙酯、乙酸乙酯、甲基叔丁基醚、环戊基甲醚、n,n-二甲基甲酰胺、将选自它们中的2种以上的溶剂混合而成的溶剂等。
[0220]
在一个方式中,本发明中的使酸成分的c末端活性体与胺成分缩合而得到的“肽化合物”中包含2个以上的氨基酸连接而成的直链状或环状的肽化合物。另外,环状肽化合物的含义与“具有环状部的肽化合物”相同。
[0221]
本发明中的“直链状的肽化合物”只要是天然氨基酸和/或非天然氨基酸通过酰胺键或酯键连接而形成且不具有环状部的化合物,则没有特别限定。构成直链状肽化合物的天然氨基酸或非天然氨基酸的总数可以为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30个,优选的范围为6~20个、7~19个、7~18个、7~17个、7~16个、7~15个、8~14个、9~13个。
[0222]
本发明中的“环状肽化合物”通过天然氨基酸和/或非天然氨基酸通过酰胺键或酯键连接而形成,只要是具有环状部的化合物,则没有特别限定。环状肽化合物可以具有1个以上的直链部。构成环状的肽化合物的天然氨基酸或非天然氨基酸的总数可以为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30个,优选的范围为6~20个、7~19个、7~18个、7~17个、7~16个、7~15个、8~14个、9~13个。
[0223]
构成环状肽化合物的环状部的氨基酸的数量没有限定,例如可举出4以上、6以上、7以上、8以上、9以上、10以上、11以上、12以上、20以下、18以下、16以下、15以下、14以下、13以下、12以下、11以下、7、8、9、10、11、12、13、14、15、和16。构成上述环状部的氨基酸的数量优选为5~15,更优选为5~14、7~14、或8~14,进一步优选为8~13、9~13、8~12、8~11、或9~12,特别优选为9~11。
[0224]
环状肽的直链部的氨基酸的数量优选为0~8,更优选为0~5,更优选为0~3。
[0225]
肽化合物可以包含1个以上、2个以上、3个以上、4个以上、5个以上、或6个以上的非天然氨基酸。另外,肽化合物可以包含20以下、15以下、14以下、13以下、12以下、10以下、9以下的非天然氨基酸。肽化合物中包含非天然氨基酸时,作为非天然氨基酸数的比例,可例示构成肽化合物的总氨基酸数的30%以上、40%以上、50%以上、60%以上、70%以上、80%以上。
[0226]
肽化合物除了上述天然氨基酸和非天然氨基酸的总数的条件以外,或单独地,可以为包含至少2个(优选为2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30个,特别优选为5、6或7个,优选的范围为2~30个、3~30个、6~20个、7~19个、7~18个、7~17个、7~16个、7~15个、8~14个、9~13个)n取代氨基酸且包含至少1个未被n取代的氨基酸的直链或环状肽。作为“n取代”,可举出与n原子键合的氢原子取代成甲基、乙基、丙基、丁基、己基等,但不限定于此。作为n取代氨基酸,优选可举出天然氨基酸中包含的氨基被n-甲基化、n-乙基化、
n-丙基化、n-丁基化、n-戊基化的氨基酸,将它们称为n-甲基氨基酸、n-乙基氨基酸、n-丙基氨基酸、n-丁基氨基酸,n-戊基氨基酸。将n未取代的氨基酸转化为n取代的氨基酸称为n-取代,有时称为n-烷基化、n-甲基化或n-乙基化。作为本发明中的肽化合物中所含的n取代氨基酸数的比例,可例示构成肽化合物的总氨基酸数的30%以上、40%以上、50%以上、60%以上、70%以上、80%以上。
[0227]
肽化合物中可以包含其盐或它们的溶剂合物。
[0228]
本说明书中,“侧链”是指在氨基酸的侧链或环状肽化合物的环状部的侧链等上下文中使用且不包含于各自的主链结构中的部分。
[0229]
本说明书中,“氨基酸的数量”是指构成肽化合物的氨基酸残基的数量,是指切断连接氨基酸的酰胺键、酯键和环化部的键时产生的氨基酸单元的数量。
[0230]
工序b是将工序a中得到的反应混合液中所含的未反应的c末端活性体除去的工序。在一个方式中,未反应的c末端活性体的除去通过使未反应的c-末端活性体与叔胺作用来进行。本说明书中,有时将未反应的c末端活性体、具体而言例如在缩合过程中未与胺成分反应而残留的反应混合液中的c末端活性体称为“残留的c末端活性体”。工序b中,将工序a中得到的反应混合液、叔胺和水或水溶液混合。在工序a中使用了相对于胺成分过量的酸成分的情况下,或者在工序a中缩合反应未充分进行的情况下,未与胺成分反应而残留的酸成分的c末端活性体以杂质的形式残留在反应溶剂中。如果该残留的c末端活性体未被充分分解而存在于体系中,则对后续的肽化合物的脱保护工序、进一步的肽链的延伸反应造成不良影响,因此可靠地除去是重要的。在以往的液相合成法中,已知使用碱水溶液将残留活性酯水解的方法等,但本发明人等确认到,特别是在其侧链具有体积大的官能团的氨基酸的残留的c末端活性体的情况下,或者残留的c末端活性体的离去基团的离去能力不高到容易与水反应的程度的情况下,其分解有时不充分。与此相对,使用通过将包含未反应的c末端活性体的反应混合液与叔胺和水或水溶液混合、或者通过使残留的c末端活性体与叔胺接触来水解c末端活性体的本发明的方法,由此能够解决上述课题。
[0231]
作为叔胺,可以优选使用对酸成分的残留的c末端活性体具有亲核反应性的叔胺。作为这样的叔胺,优选氮附近的空间位阻小的胺。作为这样的叔胺,例如可举出下述式(a)、(b)、或(c)所示的叔胺。
[0232][0233]
在一个方式中,式(a)中,r1~r3中,r1和r2与它们所键合的氮原子一起形成5~6元非芳香族杂环、且r3为c
1-c2烷基(即,甲基或乙基)或c2羟基烷基。作为5~6元非芳香族杂环,优选为吡咯烷、哌啶或吗啉,作为c2羟基烷基,优选为2-羟基乙基。
[0234]
在另一方式中,式(a)中,r1~r3各自独立地为c
1-c2烷基、或c2羟基烷基。作为c2羟基烷基,优选为2-羟基乙基。
[0235]
作为式(a)所示的叔胺,优选可举出r1~r3各自独立地为c
1-c2烷基的叔胺。
[0236]
作为式(a)所示的叔胺,具体而言,可举出三甲胺、n,n-二甲基乙胺、n,n-二乙基甲胺、三乙胺、三乙醇胺等,其中,特别优选三甲胺。
[0237]
在一个方式中,式(b)中,x为n或o。在x为n的情况下,r4和r5各自独立地为c
1-c2烷基、或c2羟基烷基,或者与它们所键合的氮原子一起形成5~6元非芳香族杂环。在x为o的情况下,r4为c
1-c2烷基、或c2羟基烷基,并且r5不存在。作为5~6元非芳香族杂环,优选为吡咯烷、哌啶、或吗啉,作为c2羟基烷基,优选为2-羟基乙基。另外,式(b)中,r6和r7各自独立地为h、c
1-c2烷基、或甲氧基。
[0238]
作为式(b)所示的叔胺,优选可举出x为n、r4和r5各自独立地为c
1-c2烷基、且r6和r7为h的叔胺。
[0239]
作为式(b)所示的叔胺,具体而言,可举出dmap、4-哌啶基吡啶、4-吗啉代吡啶等,其中,特别优选dmap。
[0240]
在一个方式中,式(c)中,r8和r9各自独立地为h、c
1-c2烷基、或c2羟基烷基,或者与r8所键合的氮原子和r9所键合的碳原子一起形成5~6元非芳香族杂环。作为5~6元非芳香族杂环,优选为吡咯烷、哌啶或吗啉,作为c2羟基烷基,优选为2-羟基乙基。
[0241]
作为式(c)所示的叔胺,优选可举出r8和r9各自独立地为h或c
1-c2烷基的叔胺,更优选r8为c
1-c2烷基、且r9为h的叔胺。
[0242]
作为式(c)所示的叔胺,具体而言,可举出nmi、咪唑-1-乙醇、5,6,7,8-四氢咪唑并[1,5-α]吡啶等,其中,特别优选nmi。
[0243]
不受特定理论的束缚,本发明的叔胺可以通过对残留的c末端活性体进行亲核攻击来促进残留的c末端活性体的水解。像dipea那样的叔胺具有大体积取代基,因此亲核性低,是不期望的。残留的c末端活性体的水解物能够移动至水层而除去,因此可以不经过柱纯化等单独的纯化工序而将生成的肽化合物供于接下来的缩合反应。通过使用本发明的方法,可以快速(例如在5分钟内)且以较少次数(例如仅一次)的水解处理有效地除去残留的c末端活性体,在一个方式中,能够除去90%、91%、92%、93%、94%、95%、96%、97%、98%、或99%以上的残留的c末端活性体。换言之,根据本发明,能够使c末端活性体的残留率为10%以下、9%以下、8%以下、7%以下、6%以下、5%以下、4%以下、3%以下、2%以下、1%以下。
[0244]
叔胺相对于胺成分可以使用催化量,可以使用化学计量以上的量。具体而言,例如可以将相对于胺成分为0.1当量~10当量的叔胺添加到反应混合液中,优选添加0.5当量~3当量的叔胺。
[0245]
使叔胺与残留的c末端活性体作用时,可以在-20℃~溶剂的沸点附近的温度、优选25℃~60℃的温度下将反应混合液搅拌1分钟~48小时,优选为2小时以下,例如,2分钟~2小时、5分钟~60分钟、5分钟~50分钟、或5~30分钟。
[0246]
在一个方式中,在利用叔胺对残留的c末端活性体进行处理的工序中,可以加入水或水溶液,作为水溶液,可以优选使用碱水溶液。这样的碱水溶液没有特别限定,具体而言,例如可举出碳酸钾水溶液、氢氧化锂水溶液、碳酸钠水溶液、氢氧化钠、氢氧化钾水溶液、氢氧化钠水溶液、或碳酸铯水溶液等。其中,优选具有温和的碱性的碳酸钾水溶液或碳酸钠水溶液。
[0247]
在一个方式中,本发明还包括使叔胺与残留的c末端活性体作用后,将反应混合液
分层为有机层和水层而取有机层,接着洗涤该有机层的工序。作为一个例子,包括用酸性水溶液和碱性水溶液洗涤有机层。在一个方式中,在经过该工序的情况下,可以使残留的c末端活性体的残留量为1.0%以下、0.5%以下、优选为0.1%以下。
[0248]
在一个方式中,本发明还包括将上述肽化合物的n末端的保护基脱保护的工序(工序c)。保护基的脱保护例如可以通过“greene’s,
‘
protective groups in organic synthesis’(第5版,john wiley&sons 2014)”中记载的常规方法来进行。在现有方法中,有时因残留的c末端活性体而导致脱保护反应无法充分进行,但通过使用本发明的方法,能够以高收率得到所生成的肽化合物的脱保护体。
[0249]
在一个方式中,本发明包括重复工序a和工序b多次。另外,在一个方式中,本发明包括多次重复工序a、工序b和工序c。通过这种重复,延长肽链,能够得到肽化合物。
[0250]
在一个方式中,本发明涉及一种促进残留的c末端活性体的水解的方法,其包括向包含残留的c末端活性体的溶液中追加叔胺和水或水溶液,使该c末端活性体与叔胺作用的工序。在该方式中,残留的c末端活性体和/或叔胺可以使用上述的物质。在向包含残留的c末端活性体的溶液中添加水溶液的情况下,作为该水溶液,优选上述碱水。
[0251]
在一个方式中,本发明涉及除去残留的c末端活性体的水解物的方法,其包括对包含该水解物的溶液进行水性洗涤的工序。在该方式中,作为水性洗涤,除了水以外,还可以实施利用碱性水溶液的洗涤。碱性水溶液没有特别限定,优选碳酸钾水溶液或碳酸钠水溶液。另外,在另一方式中,在所使用的碱与水解物形成盐而变得难以转移至水层的情况下,也可以在将该碱用酸性水溶液洗涤而除去后,用碱水溶液洗涤。酸性水溶液没有特别限定,优选硫酸氢钾水溶液或硫酸氢钠水溶液。碱性水溶液优选碳酸钾水溶液或碳酸钠水溶液。
[0252]
需要说明的是,本说明书中引用的全部现有技术文献作为参照引入到本说明书中。
[0253]
实施例
[0254]
本发明通过以下的实施例进一步例示,但并不限定于下述的实施例。
[0255]
肽化合物(肽合成中的目标物)的纯度、c末端活性体残留量使用具备qda、pda检测器的lcms(柱:ascentis express c18,5cm
×
4.6mm,2.7μm,流动相:0.5%三氟乙酸水溶液/0.5%三氟乙酸乙腈溶液=95/5-0/100,1.0ml/min,检测器:uv210nm)进行测定。
[0256]
关于c末端活性体的残留量的评价,由于残留的c末端活性体有可能在分析条件(lcms)下受到水解,因此将残留的c末端活性体转化为丙酰胺(日文:
プロピルアミド
)来进行。
[0257]
肽化合物(肽合成中的目标物)的纯度以lcms的峰面积百分比的形式记录。c末端活性体残留率和c末端活性体残留量相对值通过各实施例中记载的计算式算出。需要说明的是,总峰面积减去空白峰、溶剂峰的面积值进行了校正。
[0258]
表中的nd表示not detected(未检出)的意思。
[0259]
(实施例1)残留的c末端活性体的水解中的添加胺效果
[0260]
(混合酸酐的调整)
[0261]
将463mg(1.7mmol)的cbz-ile-oh、五甲基苯31mg(内标物:0.21mmol)溶解于2-甲基四氢呋喃3.0ml中。在室温下加入二异丙基乙胺1.1ml(6.2mmol)、t3p/thf50%溶液1.9ml(3.2mmol),在40℃下搅拌1小时,制备混合酸酐(c末端活性体)溶液。从制备的混合酸酐溶
液中取5μl,与正丙胺100μl(1.2mmol)反应后,用甲醇0.9ml稀释,根据lc/ms的峰面积求出向混合酸酐的反应转化率(转化率:97%)。cbz-ile-nhpr/ms(esi):m/z307.1[m h] 。
[0262]
转化率(%)={cbz-ile-nhpr(面积%)/[cbz-ile-oh(面积%) cbz-ile-nhpr(面积%)]}
×
100
[0263]
(水解处理-未添加胺)
[0264]
从制备的混合酸酐溶液的总量(6ml)中取1.0ml,加入碱水(5%氢氧化锂水溶液、5%碳酸钠水溶液、5%碳酸钾水溶液、5%氢氧化钾水溶液、或5%碳酸铯水溶液)0.5ml,在25℃下用搅拌子进行搅拌(1200rpm)。停止搅拌后,静置,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,计算峰面积比[丙酰胺:五甲基苯(内标物)]。
[0265]
(水解处理-添加胺)
[0266]
从制备的混合酸酐溶液总量(6ml)中取1.0ml,加入胺添加剂(0.19mmol)和5%碳酸钾水溶液0.5ml,在25℃下用搅拌子进行搅拌(1200rpm)。停止搅拌,静置,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,计算峰面积比[丙酰胺:五甲基苯(内标物)]。
[0267]
(c末端活性体的残留量评价)
[0268]
使用lc/ms的峰面积比[丙酰胺/五甲基苯(内标物)]。下述表的c末端活性体残留量相对值是将不加入胺添加剂而用5%碳酸钾水溶液处理5分钟时的峰面积比[丙酰胺/五甲基苯]的值3.5设为100(投入1的5min的柱)时的相对值。
[0269]
c末端活性体残留量相对值(%)={[丙酰胺(面积%)/五甲基苯(面积%)]/3.5(投入1,5min时的[丙酰胺(面积%)/五甲基苯(面积%)])}
×
100
[0270]
【表1】
[0271][0272]
1)不适用.
[0273]
表1的c末端活性体残留量相对值的值越小,表示残留的c末端活性体越被水解。在单独使用碱水的情况下,即使改变碱的抗衡阳离子,水解速度也几乎没有变化,与添加胺的
情况相比,水解较慢。另外,发现在添加的胺中,dmap、nmi的添加显著地促进残留的c末端活性体水解。
[0274]
(实施例2)残留的c末端活性体的水解中的添加胺效果
[0275]
(活性酯的调整)
[0276]
将701mg(2.64mmol)的cbz-ile-oh、五甲基苯46mg(0.31mmol)溶解于2-甲基四氢呋喃7.0ml中。在室温下加入1.0g(2.64mmol)的hatu、二异丙基乙胺1.5ml(8.79mmol),在60℃下搅拌4小时,制备活性酯(c末端活性体)溶液。从制备的活性酯溶液中取5μl,与正丙胺100μl(1.2mmol)反应后,用甲醇0.9ml稀释,由lc/ms的峰面积求出向活性酯的反应转化率(转化率:94%)。cbz-ile-nhpr/ms(esi):m/z 307.1[m h] 。
[0277]
转化率(%)={cbz-ile-nhpr(面积%)/[cbz-ile-oh(面积%) cbz-ile-nhpr(面积%)]}
×
100
[0278]
(单独利用碱水的水解处理)
[0279]
从制备的活性酯溶液的总量(9ml)中取1.5ml,加入碱水(5%碳酸钾水溶液)0.75ml,在25℃下用搅拌子进行搅拌(1200rpm)。停止搅拌后,静置,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,计算峰面积比[丙酰胺:五甲基苯(内标物)]。
[0280]
(添加胺的水解处理)
[0281]
从制备的活性酯溶液总量(9ml)中取1.5ml,加入胺添加剂(0.44mmol)和5%碳酸钾水溶液0.75ml,在25℃下用搅拌子进行搅拌(1200rpm)。停止搅拌,静置,使有机层和水层分层,取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,计算峰面积比[丙酰胺:五甲基苯(内标物)]。
[0282]
(c末端活性体的残留量评价)
[0283]
使用lc/ms的峰面积比[丙酰胺/五甲基苯(内标物)]。下述表的c末端活性体残留量相对值是将不加入胺添加剂而用5%碳酸钾水溶液处理5分钟时的峰面积比[丙酰胺/五甲基苯]的值3.0设为100(投入1的5min的柱)时的相对值。
[0284]
c末端活性体残留量相对值(%)={[丙酰胺(面积%)/五甲基苯(面积%)]/3.0(投入1,5min时的[丙酰胺(面积%)/五甲基苯(面积%)])}
×
100
[0285]
【表2】
[0286][0287]
表2的c末端活性体残留量相对值的值越小,表示残留的c末端活性体越被水解。发现与仅使用碱水的情况相比,添加胺会促进残留的c末端活性体水解。即,发现可确认对dbu、me3n、nmi、dmap的添加有效果,特别是对nmi和dmap的添加有显著的效果。
[0288]
(实施例3)残留的c末端活性体的水解中的添加胺效果
[0289]
在由617mg(2.6mmol)的cbz-meala-oh、五甲基苯46mg(0.31mmol)、2-甲基四氢呋喃4.5ml形成的溶液中,在室温下加入二异丙基乙胺1.5ml(8.6mmol)、t3p/thf50%溶液2.6ml(4.4mmol),在40℃下搅拌1小时,制备混合酸酐溶液(c末端活性体)。从制备的混合酸酐溶液中取5μl,与正丙胺100μl(1.2mmol)反应后,用甲醇0.9ml稀释,由lc/ms的峰面积求出向混合酸酐的反应转化率(转化率:90%)。cbz-meala-nhpr/ms(esi):m/z279.1[m h] 。
[0290]
转化率(%)={cbz-meala-nhpr(面积%)/[cbz-meala-oh(面积%) cbz-meala-nhpr(面积%)]}
×
100
[0291]
(单独利用碱水的水解处理)
[0292]
从制备的混合酸酐溶液的总量(9ml)中取1.5ml,加入碱水(5%碳酸钠水溶液或5%碳酸钾水溶液)0.75ml,在25℃下用搅拌子进行搅拌(1200rpm)。停止搅拌后,静置,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,计算峰面积比[丙酰胺:五甲基苯(内标物)]。
[0293]
(添加胺的水解处理)
[0294]
从制备的混合酸酐溶液总量(9ml)中取1.5ml,加入胺添加剂(0.43mmol,0.67当量)和5%碳酸钾水溶液0.75ml,在25℃下用搅拌子进行搅拌(1200rpm)。停止搅拌,静置,使有机层和水层分层,取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,计算峰面积比[丙酰胺:五甲基苯(内标物)]。
[0295]
(c末端活性体的残留量评价)
[0296]
使用lc/ms的峰面积比[丙酰胺/五甲基苯(内标物)]。下述表的c末端活性体残留量相对值是将不加入胺添加剂而用5%碳酸钠水溶液处理5分钟时的峰面积比[丙酰胺/五甲基苯]的值1.1设为100(投入1的5min的柱)时的相对值。
[0297]
c末端活性体残留量相对值(%)={[丙酰胺(面积%)/五甲基苯(面积%)]/1.1(投入1,5min时的[丙酰胺(面积%)/五甲基苯(面积%)]}
×
100
[0298]
【表3】
[0299][0300]
表3的c末端活性体残留量相对值越小,表示残留的c末端活性体越被水解。在单独使用碱水的情况下,即使改变碱的抗衡阳离子,水解速度也几乎没有变化。另外,发现如果添加dmap、nmi,则与单独使用碱水的情况相比,残留的c末端活性体的水解得到促进。发现dmap、nmi的添加在5分钟以内也有充分的效果,特别是在dmap添加下,将残留的c末端活性体完全水解。
[0301]
(实施例4)cbz-ile-phe-otbu的合成
[0302]
(缩合反应)
[0303]
在由h-phe-otbu盐酸盐458mg(1.8mmol)、699mg(2.7mmol)的cbz-ile-oh和2-甲基四氢呋喃4.5ml形成的溶液中,在室温下加入二异丙基乙胺1.6ml(8.9mmol)、t3p/thf50%溶液2.6ml(4.4mmol),在40℃下搅拌1小时,进行肽键形成反应。从反应溶液中取5μl,与正丙胺100μl(1.2mmol)反应后,用甲醇0.9ml稀释,由lc/ms的峰面积求出反应转化率(转化率:100%)。
[0304]
转化率(%)={cbz-ile-phe-otbu(面积%)/[h-phe-otbu(面积%) cbz-ile-phe-otbu(面积%)]}
×
100
[0305]
(单独利用碱水的水解处理)
[0306]
从上述制备的二肽溶液总量(9ml)中取1.5ml,加入5%碳酸钾水溶液0.75ml,在25℃下用搅拌子进行搅拌(1200rpm)。停止搅拌后,静置,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释,进行lc/ms分析,求出丙酰胺和目标肽的峰面积值,算出c末端活性体残留率(%)。除去残留的反应液的水层,将有机层用5%硫酸氢钾水溶液0.5ml和5%碳酸钾水溶液0.5ml依次洗涤。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,求出目标肽和残留的c末端活性体(丙酰胺转化体)的峰面积值。
[0307]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0308]
(添加胺的水解处理)
[0309]
从制备的二肽溶液总量(9ml)中取1.5ml,加入胺(0.15mmol0.5当量、0.30mmol 1.0当量、或0.89mmol 3当量:当量是相对于h-phe-otbu盐酸盐的当量)和5%碳酸钾水溶液0.75ml,在25℃下用搅拌子进行搅拌(1200rpm)。停止搅拌后,静置,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释,进行lc/ms分析,求出丙酰胺和目标肽的峰面积值,算出c末端活性体残留率(%)。除去残留的反应液的水层,将有机层用5%硫酸氢钾水溶液0.75ml和5%碳酸钾水溶液0.75ml依次洗涤。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,求出目标肽和残留的c末端活性体(丙酰胺转化体)的峰面积值。ms(esi):m/z 413.3[m-tbu h] ,469.3[m h] ,491.3[m na] 。
[0310]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0311]
【表4】
[0312][0313]
1)相对于n末氨基酸衍生物(h-phe-otbu盐酸盐)的当量
[0314]
2)lcms的峰面积比率
[0315]
发现通过使用相对于n末端的氨基酸衍生物为0.5~3.0当量的添加胺nmi,与利用碱水单独处理的水解相比,更优势地促进水解。另外,发现通过相对于n末氨基酸衍生物使用0.5~3.0当量的添加胺dmap,与利用碱水单独处理时的水解相比,更优势地促进水解。
[0316]
发现添加胺进行1次水解处理后,用5%khso4、5%k2co3洗涤有机层,由此能够完全除去有机层中的残留的c末端活性体。此时,能以高纯度得到作为目标物的肽。另一方面,在利用碱水的单独处理中,c末端活性体残留,二肽的纯度也低。
[0317]
(实施例5)cbz-ile-phe-otbu的合成
[0318]
(缩合反应)
[0319]
在由h-phe-otbu盐酸盐452mg(1.8mmol)、702mg(2.6mmol)的cbz-ile-oh和2-甲基四氢呋喃4.5ml形成的溶液中,在室温下加入二异丙基乙胺1.5ml(8.8mmol)、t3p/thf50%溶液2.6ml(4.4mmol),在40℃下搅拌1小时,进行肽键形成反应。从反应溶液中取5μl,与正丙胺100μl(1.2mmol)反应后,用甲醇0.9ml稀释,由lc/ms的峰面积求出反应转化率(转化率:100%)。
[0320]
转化率(%)={cbz-ile-phe-otbu(面积%)/[h-phe-otbu(面积%) cbz-ile-phe-otbu(面积%)]}
×
100
[0321]
(单独利用碱水的水解处理)
[0322]
从上述制备的二肽溶液总量(9ml)中取1.5ml,加入5%碳酸钾水溶液0.75ml,在60℃下用搅拌子进行搅拌(1200rpm)。停止搅拌后,静置,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释,进行lc/ms分析,求出丙酰胺和目标肽的峰面积值,算出c末端活性体残留率(%)。除去残留的反应液的水层,将有机层用5%硫酸氢钾水溶液0.75ml和5%碳酸钾水溶液0.75ml依次洗涤。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,求出目标肽和残留的c末端活性体(丙酰胺转化体)的峰面积值。
[0323]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
meile-mephe-ome(面积%)]}
×
100
[0335]
(水解处理)
[0336]
(1)未添加胺的情况
[0337]
在上述制备的包含肽的反应溶液中加入3.0ml的mtbe和5%碳酸钾水溶液3.0ml,在25℃下用搅拌子进行30分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0338]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0339]
(2)添加胺的情况
[0340]
在上述制备的包含肽的反应溶液中加入3.0ml的mtbe、n-甲基咪唑103μl(1.3mmol)和5%碳酸钾水溶液3.0ml,在25℃下用搅拌子进行30分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0341]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0342]
(后处理)
[0343]
停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层用10%硫酸氢钾水溶液3ml
×
2、5%碳酸钾水溶液3ml、水1ml
×
5依次洗涤。停止搅拌,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释,进行lc/ms分析,求出目标肽和残留的c末端活性体(丙酰胺转化体)的峰面积值。将剩余的有机层浓缩,得到肽。通过未添加胺水解而得到的浓缩物(肽)为671.8mg(收率113%:虽然浓缩物中包含杂质(残留的c末端活性体),但设为仅包含肽的浓缩物进行计算)。通过添加胺的水解得到的浓缩物为563.7mg(收率95%)。ms(esi):m/z455.2[m h] ,477.2[m na] 。
[0344]
【表6】
[0345][0346]
1)lcms的峰面积比率
[0347]
发现在利用碱水单独处理的水解中,残留的c末端活性体未被完全水解,通过接下来的水性洗涤也无法除去残留的c末端活性体,但添加nmi进行水解时,残留的c末端活性体的水解完全实现,残留的c末端活性体的除去也能够完全进行。而且,此时能以100%的纯度得到目标二肽(收率95%)。
[0348]
(实施例7)cbz-meval-measp(tbu)-哌啶的合成
[0349]
(缩合反应)
[0350]
将measp(tbu)-哌啶303mg(1.1mmol)、448mg(1.7mmol)的cbz-meval-oh悬浮于乙腈0.6ml、环戊基甲醚2.4ml混合溶剂中,加入二异丙基乙胺586μl(3.4mmol)。接着,在25℃下加入642mg(1.7mmol)的hatu,在25℃下搅拌6.5小时,进行肽键形成反应。取反应液5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,由lc/ms的峰面积值求出转化率(转化率:100%)。
[0351]
转化率(%)={cbz-meval-measp(tbu)-哌啶(面积%)/[measp(tbu)-哌啶(面积%) cbz-meval-measp(tbu)-哌啶(面积%)]}
×
100
[0352]
(水解处理)
[0353]
(1)未添加胺的情况
[0354]
在上述制备的包含肽的反应溶液中加入5%碳酸钾水溶液3.0ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0355]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0356]
(2)添加胺的情况
[0357]
在上述制备的包含肽的反应溶液中加入136mg(1.1mmol)的dmap和5%碳酸钾水溶液3.0ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0358]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0359]
(后处理)
[0360]
停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层依次用10%硫酸氢钾水溶液3ml
×
2、5%碳酸钾水溶液3ml
×
2、水1.5ml
×
3洗涤。停止搅拌,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释,进行lc/ms分析,求出目标肽和残留的c末端活性体(丙酰胺转化体)的峰面积值。将剩余的有机层浓缩,得到肽。通过未添加胺水解而得到的浓缩物(肽)为782.0mg(收率136%:虽然浓缩物中包含杂质(残留的c末端活性体),但设为仅包含肽的浓缩物进行计算)。通过添加胺的水解得到的浓缩物为530.6mg(收率92%)。ms(esi):m/z 518.4[m h] ,540.4[m na] 。
[0361]
【表7】
[0362][0363]
1)lcms的峰面积比率
[0364]
发现在利用碱水单独处理的水解中,残留的c末端活性体未被完全水解,通过接下
来的水性洗涤也无法除去残留的c末端活性体,但如果添加dmap进行水解,则残留的c末端活性体的水解完全实现,残留的c末端活性体的除去也能够完全进行。而且,此时能以100%的纯度得到目标二肽(收率92%)。
[0365]
(实施例8)cbz-meval-measp(tbu)-哌啶的合成
[0366]
(缩合反应)
[0367]
将measp(tbu)-哌啶299mg(1.1mmol)、458mg(1.7mmol)的cbz-meval-oh悬浮于4.5ml的2-methf溶剂中,加入二异丙基乙胺775μl(4.4mmol)。接着,在25℃下加入50%t3p/thf溶液1.6ml(2.8mmol),在25℃下搅拌15小时进行肽键形成反应。取反应液5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,由lc/ms的峰面积值求出转化率(转化率:100%)。
[0368]
转化率(%)={cbz-meval-measp(tbu)-哌啶(面积%)/[measp(tbu)-哌啶(面积%) cbz-meval-measp(tbu)-哌啶(面积%)]}
×
100
[0369]
(水解处理)
[0370]
(1)未添加胺的情况
[0371]
在上述制备的包含肽的反应溶液中加入5%碳酸钾水溶液3.0ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0372]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0373]
(2)添加胺的情况
[0374]
在上述制备的包含肽的反应溶液中加入141mg(1.1mmol)的dmap和5%碳酸钾水溶液3.0ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0375]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0376]
(后处理)
[0377]
停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层依次用10%硫酸氢钾水溶液3ml、5%碳酸钾水溶液3ml洗涤。停止搅拌,使有机层和水层分层。取有机层5μl,加入到正丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释,进行lc/ms分析,求出目标肽和残留的c末端活性体(丙酰胺转化体)的峰面积值。将剩余的有机层浓缩,得到肽。通过未添加胺水解而得到的浓缩物(肽)为561.6mg(收率98%:虽然浓缩物中包含杂质(残留的c末端活性体),但设为仅包含肽的浓缩物进行计算)。通过添加胺的水解得到的浓缩物为501.1mg(收率87%)。ms(esi):m/z 518.4[m h] ,540.4[m na] 。
[0378]
【表8】
ile-nhpr。将剩余的有机层浓缩,得到浓缩物542.7mg(收率82%)。ms(esi):m/z 631.5[m h]
,653.4[m na]
。
[0391]
已明确如果使用单独用碱水处理的残留有c末端活性体的肽溶液,则cbz脱保护反应几乎不进行。另一方面,发现如果使用添加dmap进行处理而得到的残留的c末端活性体被完全除去的肽溶液,则cbz脱保护反应顺利地进行,能够进行接下来的肽合成反应。即,通过使用本发明的方法,能够使生成的肽化合物的n末端的保护基的还原性除去反应不停滞地进行。由此,能够有效地制造具有所期望的氨基酸序列的高纯度的肽化合物。
[0392]
(实施例10)cbz-phe(3-f)-phe-otbu的合成
[0393]
将phe-otbu盐酸盐200mg(0.8mmol)、297mg(0.9mmol)的cbz-phe(3-f)-oh悬浮于甲苯3.0ml中,加入二异丙基乙胺407μl(2.3mmol)。接着,在25℃下加入50%t3p/thf溶液0.9ml(1.6mmol),在室温下搅拌30分钟,进行肽键形成反应(转化率:100%)。反应转化率如下求出:取反应液5μl,加入到正丙胺100μl中,对用甲醇0.9ml稀释而得到的溶液进行lc/ms分析,根据lc/ms的峰面积值求出。
[0394]
转化率(%)={cbz-phe(3-f)-phe-otbu(面积%)/[phe-otbu(面积%) cbz-phe(3-f)-phe-otbu(面积%)]}
×
100
[0395]
在上述的反应溶液中加入95mg(0.8mmol)的dmap、5%碳酸钾水溶液2.0ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层依次用10%硫酸氢钾水溶液1ml、5%碳酸钾水溶液1ml、水1ml洗涤。将得到的有机层5μl加入到正丙胺100μl中,用甲醇0.9ml稀释。对该溶液进行lc/ms分析,求出目标肽和残留的c末端活性体的峰面积百分比。目标肽cbz-phe(3-f)-phe-otbu的纯度为100%,未检测出来自残留的c末端活性体的cbz-phe(3-f)-nhpr。将剩余的有机层浓缩,得到浓缩物387.2mg(收率96%)。ms(esi):m/z 465.2[m-tbu h] ,521.1[m h] ,543.2[m na] 。
[0396]
添加dmap进行水解时,可完全实现残留的c末端活性体的除去,能够以100%的纯度得到目标二肽(收率96%)。
[0397]
(实施例11)cbz-ser(otbu)-phe-otbu的合成
[0398]
将phe-otbu盐酸盐300mg(1.2mmol)、450mg(1.5mmol)的cbz-ser(otbu)-oh悬浮于2-甲基四氢呋喃3.6ml中,加入二异丙基乙胺610μl(3.5mmol)。接着,在25℃下加入50%t3p/thf溶液1.4ml(2.3mmol),在室温下搅拌1小时,进行肽键形成反应(转化率:100%)。反应转化率如下求出:取反应液5μl,加入到正丙胺100μl中,对用甲醇0.9ml稀释而得到的溶液进行lc/ms分析,根据lc/ms的峰面积值求出。
[0399]
转化率(%)={cbz-ser(tbu)-phe-otbu(面积%)/[phe-otbu(面积%) cbz-ser(tbu)-phe-otbu(面积%)]}
×
100
[0400]
在上述反应溶液中加入143mg(1.2mmol)的dmap、20%碳酸钾水溶液1.5ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层依次用10%硫酸氢钾水溶液3.0ml
×
2、5%碳酸钾水溶液3.0ml、水3.0ml洗涤。将得到的有机层5μl加入到正丙胺100μl,用甲醇0.9ml稀释。对该溶液进行lc/ms分析,求出目标肽和残留的c末端活性体的峰面积百分比。目标肽cbz-ser(otbu)-phe-otbu的纯度为100%,未检测出来自残留的c末端活性体的cbz-ser(otbu)-nhpr。将剩余的有机层浓缩,得到浓缩物556.4mg(收率96%)。ms(esi):m/z 387.1[m-2tbu h] ,499.3[m h] ,521.2[m na] 。
[0401]
添加dmap进行水解时,可完全实现残留的c末端活性体的除去,能够以100%的纯度得到目标二肽(收率96%)。
[0402]
(实施例12)boc-meval-phe-哌啶的合成
[0403]
(boc脱保护反应)
[0404]
将boc-phe-哌啶471mg(1.4mmol)溶解于二氯甲烷4.7ml中,加入甲磺酸180μl(2.8mmol)。在35℃下搅拌2小时,进行脱boc反应(转化率100%)。反应转化率如下求出:取反应液5μl,对用乙腈1.0ml稀释而得到的溶液进行lc/ms分析,根据lc/ms的峰面积值求出。
[0405]
转化率(%)={phe-哌啶(面积%)/[boc-phe-哌啶(面积%) phe-哌啶(面积%)]}
×
100
[0406]
(缩合反应)
[0407]
在上述反应溶液中加入二异丙基乙胺742μl(4.3mmol)后,馏去溶剂。接着,加入乙腈1.4ml、2-甲基四氢呋喃3.3ml、二异丙基乙胺742μl(4.3mmol)、492mg(2.1mmol)的boc-meval-oh。在25℃下加入804mg(2.2mmol)的hatu,在室温下搅拌1小时,进行肽键形成反应(转化率:100%)。反应转化率如下求出:取反应液5μl,加入到正丙胺100μl中,对用甲醇0.9ml稀释而得到的溶液进行lc/ms分析,根据lc/ms的峰面积值求出。
[0408]
转化率(%)={boc-meval-phe-哌啶(面积%)/[phe-哌啶(面积%) boc-meval-phe-哌啶(面积%)]}
×
100
[0409]
在上述制备的反应溶液中加入168mg(1.4mmol)的dmap、5%碳酸钾水溶液4.6ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层依次用10%硫酸氢钾水溶液4.6ml、5%碳酸钾水溶液4.6ml、水1.5ml
×
6洗涤。将得到的有机层5μl加入到正丙胺100μl中,用甲醇0.9ml稀释。对该溶液进行lc/ms分析,求出目标肽和残留的c末端活性体的峰面积百分比。目标肽boc-meval-phe-otbu的纯度为99.7%,未检测出来自残留的c末端活性体的boc-meval-nhpr。将剩余的有机层浓缩,得到浓缩物542.3mg(收率86%)。ms(esi):m/z 346.2[m-boc h] ,446.3[m h] ,468.3[m na] 。
[0410]
添加dmap进行水解时,可完全实现残留的c末端活性体的除去,即使n末端的保护基为boc,也能够以99.7%的纯度得到目标二肽(收率86%)。
[0411]
(实施例13)cbz-ile-meala-aze-mephe-megly-otbu/序列号:1(5mer)的合成例
[0412]
(cbz-mephe-megly-otbu的合成)
[0413]
(缩合反应)
[0414]
使megly-otbu盐酸盐2.0g(11.0mmol)悬浮于乙酸异丙酯16ml、乙腈4ml中,加入二异丙基二乙胺7.7ml(44.0mmol)、3.6g(11.5mmol)的cbz-mephe-oh。将反应液冷却至0℃,加入t3p/乙酸乙酯溶液9.7ml(16.5mmol)后,在室温下搅拌30分钟,进行肽键形成反应(转化率:100%)。反应转化率如下求出:取反应液3μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0415]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0416]
接下来,加入1.7ml(22.0mmol)的nmi、5%碳酸钠水溶液20ml,在50℃下搅拌5分钟。停止搅拌,使有机层和水层分层。除去水层,将剩余的有机层用5%硫酸钾水溶液、5%碳酸钾水溶液
×
2洗涤后,将得到的有机层浓缩,得到浓缩物5.0g(收率quant.)。对本浓缩物
进行lc/ms分析,求出目标cbz-mephe-megly-otbu的峰面积百分比(100面积%)。ms(esi):m/z 441.2[m h]
,463.2[m na]
。
[0417]
(cbz-aze-mephe-megly-otbu的合成)
[0418]
(cbz脱保护反应)
[0419]
将通过上述方法得到的cbz-mephe-megly-otbu总量溶解于乙酸异丙酯75ml中,用10%pd/c(3%wet)0.98g和氢气进行氢解反应。在室温下搅拌2小时,得到脱cbz化体(转化率:100%)。反应转化率如下求出:取反应液3μl,对用甲醇1.0ml稀释的溶液进行lc/ms分析,根据lc/ms的峰面积值求出。
[0420]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0421]
(缩合反应)
[0422]
将反应液用过滤器过滤,加入甲苯进行共沸脱水。使浓缩物溶解于乙酸异丙酯39ml、乙腈9.7ml,冷却至0℃。加入2.6g(11.0mmol)的cbz-aze-oh、50%t3p/乙酸乙酯溶液13.0ml(22.0mmol)、二异丙基乙胺7.7ml(44.0mmol)后,在室温下搅拌30分钟,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液3μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0423]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0424]
接下来,加入1.7ml(22.0mmol)的nmi、5%碳酸钠水溶液34ml,在50℃下搅拌5分钟。停止搅拌,使有机层和水层分层。除去水层,将剩余的有机层用5%硫酸钾水溶液34ml、5%碳酸钾水溶液34ml洗涤后,将得到的有机层浓缩,得到浓缩物5.5g(收率96%)。对本浓缩物进行lc/ms分析,求出目标cbz-aze-mephe-megly-otbu的峰面积百分比(99.8面积%)。ms(esi):m/z 546.2[m na]
。
[0425]
(cbz-meala-aze-mephe-megly-otbu/序列号:2的合成)
[0426]
(cbz脱保护反应)
[0427]
将通过上述方法得到的5.5g(10.6mmol)的cbz-aze-mephe-megly-otbu溶解于乙酸异丙酯75ml中,用10%pd/c(3%wet)0.95g和氢气进行氢解反应。在50℃下搅拌2小时,得到脱cbz化体(转化率:100%)。反应转化率如下求出:取反应液3μl,对用甲醇1.0ml稀释的溶液进行lc/ms分析,根据lc/ms的峰面积值求出。
[0428]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0429]
(缩合反应)
[0430]
将反应液用过滤器过滤,加入甲苯进行2次共沸脱水。使浓缩物溶解于乙酸异丙酯32.8ml、乙腈8.2ml。加入2.7g(11.1mmol)的cbz-meala-oh、二异丙基乙胺7.4ml(42.3mmol)后,加入50%t3p/乙酸乙酯溶液12.5ml(21.1mmol)、二异丙基乙胺7.4ml(42.3mmol)。在室温下搅拌2小时后,追加0.39g(1.7mmol)的cbz-meala-oh、t3p/乙酸乙酯溶液1.9ml(3.2mmol)、二异丙基乙胺1.1ml(6.3mmol),进一步在室温下搅拌2小时,进行肽键形成反应(转化率:97%)。反应转化率如下求出:取反应液3μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0431]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0432]
接下来,加入1.7ml(21.1mmol)的nmi、5%碳酸钠水溶液41ml,在50℃下搅拌5分钟。停止搅拌,使有机层和水层分层。除去水层,将剩余的有机层用5%硫酸钾水溶液41ml、5%碳酸钾水溶液41ml洗涤后,将得到的有机层浓缩,得到浓缩物5.8g(收率91%)。对本浓缩物进行lc/ms分析,求出目标cbz-meala-aze-mephe-megly-otbu(序列号:2)的峰面积百分比(99.5面积%)。ms(esi):m/z 609.3[m h]
631.3[m na]
。
[0433]
(cbz-ile-meala-aze-mephe-megly-otbu/序列号:1的合成)
[0434]
(cbz脱保护反应)
[0435]
将通过上述方法得到的cbz-meala-aze-mephe-megly-otbu(序列号:2)5.8g(9.6mmol)溶解于乙酸异丙酯88ml,用10%pd/c(3%wet)0.93g和氢气进行氢解反应。在室温下搅拌5小时后,将反应液用过滤器过滤(转化率:100%)。反应转化率如下求出:取反应液3μl,对用甲醇1.0ml稀释的溶液进行lc/ms分析,根据lc/ms的峰面积值求出。
[0436]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0437]
将滤液浓缩,得到浓缩物4.4g(收率97%)。对本浓缩物进行lc/ms分析,求出目标meala-aze-mephe-megly-otbu(序列号:3)的峰面积百分比(99.7面积%)。ms(esi):m/z 475.3[m h]
。
[0438]
(缩合反应)
[0439]
使上述浓缩物1.5g(3.2mmol)和1.3g(4.7mmol)的cbz-ile-oh溶解于乙酸异丙酯18ml、乙腈4.5ml。加入二异丙基乙胺2.2ml(12.6mmol)、2.4g(6.3mmol)的hatu,在室温下搅拌30分钟,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液3μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0440]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0441]
接下来,加入0.75ml(9.5mmol)的nmi、5%碳酸钠水溶液22.5ml,在50℃下搅拌20分钟。停止搅拌,使有机层和水层分层。除去水层,将剩余的有机层用5%硫酸钾水溶液22.5ml
×
2、5%碳酸钾水溶液22.5ml
×
3洗涤后,将得到的有机层浓缩,得到浓缩物2.4g(收率quant.)。对本浓缩物进行lc/ms分析,求出目标cbz-ile-meala-aze-mephe-megly-otbu(序列号:1)的峰面积百分比(99.1面积%)。ms(esi):m/z 744.3[m na]
。
[0442]
通过添加nmi进行一次水解,然后进行水性洗涤,可实现完全除去残留的c末端活性体,以99.1%的纯度得到目标五肽。其收率从最初的氨基酸起总计为87%。本结果表明,在连续的液相肽合成中,通过使用胺添加剂将残留的c末端活性体完全除去,从而以高收率实现了高纯度的五肽合成。
[0443]
(实施例14)
[0444]
cbz-meala-mephe-leu-meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶/序列号:4(11mer)的合成
[0445]
(cbz-meval-asp(tbu)-哌啶的合成)
[0446]
(缩合反应)
[0447]
使asp(tbu)-哌啶8.6g(33.5mmol)溶解于环戊基甲醚108ml中。加入9.79g(36.9mmol)的cbz-meval-oh、二异丙基乙胺17.6ml(101mmol)。将13.8g(50.3mmol)的bep溶解于乙腈21.5ml后,加入到反应液中,在室温下搅拌3分钟,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0448]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0449]
将反应液用10%硫酸氢钾水溶液150ml洗涤后,加入5%碳酸钾水溶液150ml和三甲胺盐酸盐9.52g(101mmol),在40℃下搅拌90分钟。停止搅拌,使有机层和水层分层。除去水层,将剩余的有机层用5%碳酸钾水溶液150ml洗涤后,将得到的有机层浓缩,得到浓缩物17g(收率:quant.)。对本浓缩物进行lc/ms分析,求出目标cbz-meval-asp(tbu)-哌啶的峰面积百分比(99.7面积%)。
[0450]
(cbz-mephe-meval-asp(tbu)-哌啶的合成)
[0451]
(cbz脱保护反应)
[0452]
将通过上述方法得到的cbz-meval-asp(tbu)-哌啶9.5g(9.6mmol)溶解于环戊基甲醚50ml中,用10%pd/c(3%wet)1.9g和氢气进行氢解反应,在35℃下搅拌2小时(转化率:100%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0453]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0454]
再次进行同样的操作,将合并的反应液用过滤器过滤。将滤液浓缩,得到浓缩物14.0g(收率:quant.)。对本浓缩物进行lc/ms分析,求出目标meval-asp(tbu)-哌啶的峰面积百分比(99.5面积%)。
[0455]
(缩合反应)
[0456]
将上述浓缩物溶解于环戊基甲醚126ml、乙腈14ml中。加入13.0g(41.7mmol)的cbz-mephe-oh、二异丙基乙胺52.9ml(303mmol)。加入50%t3p/乙酸乙酯溶液67.0ml(114mmol),在室温下搅拌1小时,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0457]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0458]
将反应液用5%硫酸氢钾水溶液140ml洗涤后,加入5%碳酸钾水溶液140ml和三甲胺盐酸盐10.9g(114mmol),在室温下搅拌30分钟。停止搅拌,使有机层和水层分层。除去水层,将剩余的有机层用5%碳酸钾水溶液140ml洗涤后,将得到的有机层浓缩,得到浓缩物24.1g(收率96%)。对本浓缩物进行lc/ms分析,求出目标cbz-mephe-meval-asp(tbu)-哌啶的峰面积百分比(99.6面积%)。
[0459]
(cbz-ser(tbu)-mephe-meval-asp(tbu)-哌啶/序列号:5的合成)
[0460]
(cbz脱保护反应)
[0461]
将通过上述方法得到的cbz-mephe-meval-asp(tbu)-哌啶11.5g(9.6mmol)溶解于环戊基甲醚58ml中,利用10%pd/c 2.3g和氢气进行氢解反应,在35℃下搅拌2小时(转化
率:100%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0462]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0463]
再次进行同样的操作,将合并的反应液用过滤器过滤。将滤液浓缩,得到浓缩物18.1g(收率99%)。
[0464]
(缩合反应)
[0465]
使上述浓缩物17.3g(32.6mmol)溶解于环戊基甲醚153ml、乙腈17ml中。加入10.6g(35.9mmol)的cbz-ser(tbu)-oh、二异丙基乙胺45.5ml(261mmol)。加入50%t3p/乙酸乙酯溶液57.6ml(98.0mmol),在室温下搅拌15分钟,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0466]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0467]
将反应液用5%硫酸氢钾水溶液170ml洗涤后,加入5%碳酸钾水溶液170ml和三甲胺盐酸盐9.4g(98.0mmol),在室温下搅拌2小时。停止搅拌,使有机层和水层分层。除去水层,将剩余的有机层用5%碳酸钾水溶液170ml洗涤后,将得到的有机层浓缩,得到浓缩物26.5g(收率:quant.)。对本浓缩物进行lc/ms分析,求出目标cbz-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:5)的峰面积百分比(98.9面积%)。ms(esi):830.4[m na]
。
[0468]
(cbz-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶/序列号:6的合成)
[0469]
(cbz脱保护反应)
[0470]
将cbz-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:5)12.0g(14.9mmol)溶解于环戊基甲醚60ml中,利用10%pd/c2.4g和氢气进行氢解反应,在35℃下搅拌2小时(转化率:>98%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0471]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0472]
再次进行同样的操作,将合并的反应液用过滤器过滤。将滤液浓缩,得到浓缩物19.5g(收率97%)。
[0473]
(缩合反应)
[0474]
使上述浓缩物16.0g(23.7mmol)溶解于环戊基甲醚200ml中。加入7.3g(26.1mmol)的cbz-meile-oh、二异丙基乙胺12.4ml(71.2mmol)。将9.8g(35.6mmol)的bep溶解于乙腈40ml后,加入反应液,在室温下搅拌5分钟,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0475]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0476]
将反应液用10%硫酸氢钠水溶液240ml洗涤后,加入5%碳酸钾水溶液240ml和三甲胺盐酸盐6.7g(71.2mmol),在40℃下搅拌1.5小时。停止搅拌,使有机层和水层分层。除去
水层,将剩余的有机层用5%碳酸钾水溶液240ml洗涤后,将得到的有机层浓缩,得到浓缩物22.2g(收率:quant.)。对本浓缩物进行lc/ms分析,求出目标cbz-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:6)的峰面积百分比(99.4面积%)。
[0477]
(cbz-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶/序列号:7的合成)
[0478]
(cbz脱保护反应)
[0479]
将cbz-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:6)9.5g(10.2mmol)溶解于环戊基甲醚48ml中,利用1.9g的10%pd/c和氢气进行氢解反应,在35℃下搅拌2小时。再次进行同样的操作,将合并的反应液用过滤器过滤。将滤液浓缩,得到浓缩物15.6g(收率96%)。
[0480]
(缩合反应)
[0481]
使上述浓缩物15.3g(19.1mmol)溶解于环戊基甲醚138ml、乙腈15ml。加入4.7g(21.0mmol)的cbz-megly-oh、二异丙基乙胺26.7ml(153mmol)。加入50%t3p/乙酸乙酯溶液33.8ml(57.3mmol),在室温下搅拌15分钟,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0482]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0483]
将反应液用5%硫酸氢钾水溶液153ml洗涤后,加入5%碳酸钾水溶液153ml,在室温下搅拌5分钟。停止搅拌,使有机层与水层分层,除去水层后,加入5%碳酸钾水溶液153ml,在室温下搅拌1小时。除去水层后,将得到的有机层浓缩,得到浓缩物19.5g(收率:quant.)。对本浓缩物进行lc/ms分析,求出目标cbz-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:7)的峰面积百分比(99.6面积%)。
[0484]
(cbz-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶/序列号:8的合成)
[0485]
(cbz脱保护反应)
[0486]
将cbz-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:7)9.5g(10.2mmol)溶解于环戊基甲醚48ml中,利用1.9g的10%pd/c和氢气进行氢解反应,在35℃下搅拌3小时(转化率:100%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0487]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0488]
再次进行同样的操作,将合并的反应液用过滤器过滤。将滤液浓缩,得到浓缩物16.3g(收率99%)。
[0489]
(缩合反应)
[0490]
使上述浓缩物16.0g(18.4mmol)溶解于环戊基甲醚144ml、乙腈16ml中。加入5.1g(20.2mmol)的cbz-val-oh、二异丙基乙胺25.6ml(147mmol)。加入50%t3p/乙酸乙酯溶液32.4ml(55.0mmol),在室温下搅拌30分钟,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0491]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0492]
将反应液用5%硫酸氢钾水溶液160ml洗涤后,加入5%碳酸钾水溶液153ml、三甲胺盐酸盐5.3g(55.0mmol),在60℃下搅拌1小时。停止搅拌,使有机层与水层分层,除去水层后,将得到的有机层用5%碳酸钾水溶液160ml洗涤、浓缩,得到浓缩物20.0g(收率99%)。对本浓缩物进行lc/ms分析,求出目标cbz-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:8)的峰面积百分比(99.6面积%)。
[0493]
(cbz-meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶/序列号:9的合成)
[0494]
(cbz脱保护反应)
[0495]
将cbz-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:8)9.2g(8.3mmol)溶解于环戊基甲醚46ml中,利用1.8g的10%pd/c和氢气进行氢解反应,在35℃下搅拌6小时,进一步在45℃下搅拌4小时(转化率:100%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0496]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0497]
再次进行同样的操作,将合并的反应液用过滤器过滤。将滤液浓缩,得到浓缩物15.9g(收率98%)。对本浓缩物进行lc/ms分析,求出目标val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:10)的峰面积百分比(97.9面积%)。
[0498]
(缩合反应)
[0499]
使上述浓缩物14.5g(14.9mmol)溶解于环戊基甲醚181ml中。加入4.6g(16.4mmol)的cbz-meleu-oh、二异丙基乙胺7.8ml(44.8mmol)。使4.9g(17.9mmol)的bep溶解于乙腈36ml中后,将得到的bep溶液加入到反应液中,在40℃下搅拌1分钟,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0500]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0501]
将反应液用10%硫酸氢钠水溶液128ml洗涤后,加入5%碳酸钾水溶液128ml、三甲胺盐酸盐4.2g(44.8mmol),在40℃下搅拌30分钟。停止搅拌,使有机层与水层分层,除去水层后,将得到的有机层用5%碳酸钾水溶液128ml洗涤、浓缩,得到浓缩物18.0g(收率98%)。对本浓缩物进行lc/ms分析,求出目标cbz-meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:9)的峰面积百分比(96.0面积%)。
[0502]
(cbz-leu-meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶/序列号:11的合成)
[0503]
(cbz脱保护反应)
[0504]
将cbz-meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:9)8.0g(6.5mmol)溶解于环戊基甲醚40ml中,利用1.6g的10%pd/c和氢气进行氢解反应,在45℃下搅拌4小时(转化率:100%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0505]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0506]
再次进行同样的操作,将合并的反应液用过滤器过滤。将滤液浓缩,得到浓缩物14.3g(收率quant.)。对本浓缩物进行lc/ms分析,求出目标meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:12)的峰面积百分比(95.8面积%)。ms(esi):m/z 1098.6[m h]
。
[0507]
(缩合反应)
[0508]
使上述浓缩物13.0g(11.8mmol)溶解于环戊基甲醚117ml、乙腈13ml中。加入3.5g(13.0mmol)的cbz-leu-oh、二异丙基乙胺16.5ml(95.0mmol)。将50%t3p/乙酸乙酯溶液20.9ml(35.5mmol)加入到反应液中,在室温下搅拌30分钟,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0509]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0510]
将反应液用5%硫酸氢钾水溶液130ml洗涤后,加入5%碳酸钾水溶液130ml、三甲胺盐酸盐3.4g(35.5mmol),在60℃下搅拌45分钟。停止搅拌,使有机层与水层分层,除去水层后,将得到的有机层用5%碳酸钾水溶液130ml洗涤、浓缩,得到浓缩物15.6g(收率98%)。对本浓缩物进行lc/ms分析,求出目标cbz-leu-meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:11)的峰面积百分比(97.2面积%)。
[0511]
(cbz-mephe-leu-meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶/序列号:12的合成)
[0512]
(cbz脱保护反应)
[0513]
将cbz-leu-meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:11)10.0g(7.4mmol)溶解于环戊基甲醚50ml中,利用2.0g的10%pd/c和氢气进行氢解反应,在45℃下搅拌4小时(转化率:100%)。将反应液用过滤器过滤后,将滤液浓缩,得到浓缩物8.9g(收率99%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。ms(esi):m/z 1211.7[m h]
,1233.7[m na]
。
[0514]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0515]
(缩合反应)
[0516]
使上述浓缩物7.0g(5.8mmol)溶解于环戊基甲醚87.5ml中。加入2.0g(6.4mmol)的cbz-mephe-oh、二异丙基乙胺3.0ml(17.3mmol)。使1.9g(17.9mmol)的bep溶解于乙腈17.5ml后,将得到的bep溶液加入到反应液中,在室温下搅拌3分钟,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0517]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0518]
将反应液用10%硫酸氢钠水溶液105ml洗涤后,加入5%碳酸钾水溶液105ml、三甲胺盐酸盐1.7g(17.3mmol),在40℃下搅拌30分钟。停止搅拌,使有机层与水层分层,除去水
层后,将得到的有机层用5%碳酸钾水溶液105ml洗涤、浓缩,得到浓缩物8.6g(收率99%)。对本浓缩物进行lc/ms分析,求出目标cbz-mephe-leu-meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:12)的峰面积百分比(97.0面积%)。
[0519]
(cbz-meala-mephe-leu-meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶/序列号:4的合成)
[0520]
(cbz脱保护反应)
[0521]
将cbz-mephe-leu-meleu-val-megly-meie-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:12)7.6g(5.0mmol)溶解于环戊基甲醚38ml中,利用2.0g的10%pd/c和氢气进行氢解反应,在45℃下搅拌4小时(转化率:100%)。将反应液用过滤器过滤后,将滤液浓缩,得到浓缩物6.8g(收率98%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0522]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0523]
(缩合反应)
[0524]
将上述浓缩物500mg(0.4mmol)溶解于环戊基甲醚4.5ml、乙腈0.5ml中。加入95.0mg(0.4mmol)的cbz-meala-oh、二异丙基乙胺509μl(2.9mmol)。加入50%t3p/乙酸乙酯溶液644μl(1.1mmol),在室温下搅拌2小时,进行肽键形成反应(转化率:>99%)。反应转化率如下求出:取反应液5μl,用甲醇1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0525]
转化率(%)={目标化合物(面积%)/[原料(面积%) 目标化合物(面积%)]}
×
100
[0526]
将反应液用10%硫酸氢钠水溶液5.0ml洗涤后,加入5%碳酸钾水溶液5.0ml、三甲胺盐酸盐104mg(1.1mmol),在室温下搅拌1小时。停止搅拌,使有机层与水层分层,除去水层后,将得到的有机层用5%碳酸钾水溶液5.0ml洗涤、浓缩,得到浓缩物555mg(收率96%,cbz-meala-mephe-leu-meleu-val-megly-meile-ser(tbu)-mephe-meval-asp(tbu)-哌啶(序列号:4)为95.3面积%)。ms(esi):m/z 1591.9[m h]
,1613.9[m na]
。
[0527]
通过添加三甲胺进行1次水解,接着进行水性洗涤,实现了残留的c末端活性体的完全除去,能够以高纯度95.3%得到由11个氨基酸构成的肽。其收率从最初的氨基酸起总计为75.3%。本结果表明,在连续的液相肽合成中,通过使用胺添加剂除去残留的c末端活性体,能够实现高纯度的多肽合成。
[0528]
(实施例15)teoc-meleu-phe-otbu的合成
[0529]
(teoc-meleu-opfp的合成)
[0530]
使2.35g(16.2mmol)的meleu-oh溶解于1,4-二氧六环23.5ml中,加入4.61g(17.8mmol)的teoc-osu、水23.5ml、三乙胺4.5ml(32.4mmol)。在室温下搅拌1小时,进行teoc化反应。加入5%硫酸氢钾水溶液,使反应溶液为酸性后,用乙酸乙酯50ml萃取,将有机层用饱和食盐水洗涤。将得到的有机层浓缩干固,使浓缩物溶解于二氯甲烷30ml。加入3.10g(16.2mmol)的pfp-oh、edc盐酸盐4.53g(24.3mmol),在室温下搅拌30分钟,进行pfp化反应。将反应溶液用饱和食盐水洗涤后,将水层用乙酸乙酯50ml萃取。将合并的有机层浓缩,将得到的浓缩物用柱色谱(乙酸乙酯/庚烷)纯化,得到6.63g的teoc-meleu-opfp(收率:
90%)。
[0531]
(缩合反应)
[0532]
将phe-otbu盐酸盐201mg(0.8mmol)、536mg(1.2mmol)的teoc-meleu-opfp悬浮于乙酸异丙酯3.0ml中,加入4-甲基吗啉257μl(2.3mmol),在25℃下搅拌3小时进行肽键形成反应。取反应液5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,由lc/ms的峰面积值求出转化率(转化率:100%)。
[0533]
转化率(%)={teoc-meleu-phe-otbu(面积%)/[phe-otbu(面积%) teoc-meleu-phe-otbu(面积%)]}
×
100
[0534]
(水解处理)
[0535]
(1)未添加胺的情况
[0536]
在上述制备的包含肽的反应溶液中加入5%碳酸钠水溶液2.0ml,在25℃下用搅拌子进行20分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0537]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0538]
(2)添加胺的情况
[0539]
在上述制备的包含肽的反应溶液中加入95mg(0.8mmol)的dmap、5%碳酸钠水溶液2.0ml,在25℃下用搅拌子进行20分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0540]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0541]
(后处理)
[0542]
停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层依次用10%硫酸氢钾水溶液2ml
×
2、5%碳酸钠水溶液2ml洗涤。进一步用5%碳酸钾水溶液1ml、水1ml
×
2反复洗涤3次。取得到的有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释,进行lc/ms分析,求出目标肽和残留的c末端活性体(丙酰胺转化体)的峰面积。通过未添加胺水解而得到的浓缩物(肽)为576.6mg(收率150%:虽然浓缩物中包含杂质(残留的c末端活性体),但设为仅包含肽的浓缩物进行计算)。通过添加胺的水解得到的浓缩物为369.6mg(收率96%)。ms(esi):m/z 437.3[m-tbu h] ,493.3[m h] ,515.3[m na] 。
[0543]
【表9】
[0544]
[0545]
1)lcms的峰面积比率
[0546]
在保护基为teoc、c末端活性体部位为pfp的残留的c末端活性体的在利用碱水单独处理的水解中,残留的c末端活性体未被完全水解,即使继续进行水性洗涤也无法除去残留的c末端活性体。另一方面,发现如果添加dmap进行水解,则残留的c末端活性体的水解完全实现,残留的c末端活性体的除去也能够完全进行。以96.3%的纯度得到目标二肽(收率96%)。
[0547]
(实施例16)cbz-aib-meleu-phe-otbu的合成
[0548]
(使用了在未添加胺的情况下进行水解处理而得到的二肽的teoc脱保护反应)
[0549]
将实施例15中在未添加胺条件下合成的576.6mg的teoc-meleu-phe-otbu(包含8.9面积%的残留的c末端活性体)溶解于2-甲基四氢呋喃2.0ml中。加入tbaf的8.4%含水四氢呋喃溶液1.5ml(1.5mmol)后,在50℃下搅拌2.5小时。由于反应未完成,所以加入tbaf的8.4%含水四氢呋喃溶液0.75ml(0.75mmol),搅拌2.5小时。进一步加入tbaf的8.4%含水四氢呋喃溶液0.75ml(0.75mmol),搅拌30分钟,得到作为脱teoc体的meleu-phe-otbu(转化率100%)。反应转化率如下求出:取反应液5μl,用乙腈1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0550]
转化率(%)={meleu-phe-otbu(面积%)/[teoc-meleu-phe-otbu(面积%) meleu-phe-otbu(面积%)]}
×
100
[0551]
(缩合反应)
[0552]
浓缩至内容量成为约1ml后,加入2-甲基四氢呋喃2ml。将本操作进一步重复2次,在得到的2-甲基四氢呋喃溶液中加入乙腈0.5ml、276mg(1.1mmol)的cbz-aib-oh、二异丙基乙胺0.66ml(3.8mmol)。接着,在25℃下加入441mg(1.1mmol)的hatu,在室温下搅拌14小时。加入579mg(1.5mmol)的hatu,在40℃下搅拌1小时后,加入684mg(1.8mmol)的hatu,升温至60℃,搅拌4.5小时。进一步加入455mg(1.1mmol)的hatu,在60℃下搅拌2小时,在室温下搅拌12小时,在60℃下搅拌2小时,未观察到缩合反应的进行(转化率0%)。反应转化率如下求出:将反应液5μl加入到丙胺100μl中,用甲醇0.9ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0553]
转化率(%)={cbz-aib-meleu-phe-otbu(面积%)/[meleu-phe-otbu(面积%) cbz-aib-meleu-phe-otbu(面积%)]}
×
100
[0554]
(使用通过添加胺进行水解处理而得到的二肽的teoc脱保护反应)
[0555]
使实施例15中在添加胺条件下合成的369.6mg(0.75mmol)的teoc-meleu-phe-otbu溶解于2-甲基四氢呋喃2.0ml中。加入tbaf的8.4%含水四氢呋喃溶液1.5ml(1.5mmol)后,在50℃下搅拌2.5小时,得到作为脱teoc体的meleu-phe-otbu(转化率100%)。反应转化率如下求出:取反应液5μl,用乙腈1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0556]
转化率(%)={meleu-phe-otbu(面积%)/[teoc-meleu-phe-otbu(面积%) meleu-phe-otbu(面积%)]}
×
100
[0557]
(缩合反应)
[0558]
浓缩至内容量成为约1ml后,加入2-甲基四氢呋喃2ml。将本操作进一步重复2次,在得到的2-甲基四氢呋喃溶液中加入乙腈0.5ml、273mg(1.1mmol)的cbz-aib-oh、二异丙基
乙胺0.66ml(3.8mmol)。接着,在25℃下加入439mg(1.1mmol)的hatu,在室温下搅拌14小时。加入576mg(1.5mmol)的hatu,在40℃下搅拌5.5小时。进一步加入452mg(1.1mmol)的hatu,在60℃下搅拌2小时,在室温下搅拌12小时,在60℃下搅拌2小时(转化率86%)。反应转化率如下求出:将反应液5μl加入到丙胺100μl中,用甲醇0.9ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。转化率(%)={cbz-aib-meleu-phe-otbu(面积%)/[meleu-phe-otbu(面积%) cbz-aib-meleu-phe-otbu(面积%)]}
×
100
[0559]
在制备的反应液中加入92mg(0.75mmol)的dmap、10%碳酸钾水溶液4.0ml,在25℃下用搅拌子进行1小时搅拌。停止搅拌后,静置,使有机层和水层分层,除去水层。将得到的有机层5μl加入到丙胺100μl中,用甲醇0.9ml稀释。对该溶液进行lc/ms分析,求出目标肽和残留的c末端活性体的峰面积百分比。目标肽cbz-aib-meleu-phe-otbu为86.7%,原料meleu-phe-otbu为13.3%,未检测出来自残留的c末端活性体的cbz-aib-nhpr。将剩余的有机层浓缩,得到上述组成的浓缩物295.6mg。ms(esi):m/z 568.4[m h] ,590.4[m na] 。
[0560]
明确了如果在n末端被保护的肽的溶液中残留有c末端活性体,则在用含水氟试剂对肽的n末端的保护基(teoc)进行脱保护时,需要大大过量的试剂。推测这是因为脱保护试剂也与残留的c末端活性体反应。
[0561]
另外,明确了脱保护之后的下一工序中的与其他c末端活性体的缩合反应(肽键形成反应)完全不进行。据推测,前一步骤(n末端的脱保护)中使用的过量试剂可能分解了c末端活性体。发现如果像这样c末端活性体残留,则在n末端的脱保护时,需要大大过量的试剂,这会妨碍接下来的缩合反应的进行。另一方面,发现如果使用残留的c末端活性体被完全除去的肽溶液作为原料,则用适量的脱保护试剂完成脱保护反应,也能够实施下一工序的缩合反应。
[0562]
(实施例17)cbz-meala-phe-otbu的合成
[0563]
(缩合反应)
[0564]
将phe-otbu盐酸盐302mg(1.2mmol)、417mg(1.7mmol)的cbz-meala-oh、290mg(1.8mmol)的hoobt悬浮于乙腈0.9ml、mtbe3.6ml中,加入二异丙基乙胺1.0ml(5.8mmol)。接下来,加入edc盐酸盐443mg(2.3mmol),在25℃下搅拌30分钟进行肽键形成反应。取反应液5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,由lc/ms的峰面积值求出转化率(转化率:100%)。
[0565]
转化率(%)={cbz-meala-phe-otbu(面积%)/[phe-otbu(面积%) cbz-meala-phe-otbu(面积%)]}
×
100
[0566]
(水解处理)
[0567]
(1)未添加胺的情况
[0568]
在上述制备的包含肽的反应溶液中加入5%碳酸钠水溶液3.0ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0569]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0570]
(2)添加胺的情况
[0571]
在上述制备的包含肽的反应溶液中加入147mg(1.1mmol)的dmap、5%碳酸钠水溶液3.0ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0572]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0573]
(后处理)
[0574]
停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层依次用10%硫酸氢钠水溶液3ml
×
2、5%碳酸钠水溶液3ml洗涤。将得到的有机层5μl加入丙胺100μl中,用甲醇0.9ml稀释。对该溶液进行lc/ms分析,求出目标肽和残留的c末端活性体的峰面积百分比。ms(esi):m/z 385.2[m-tbu h] ,441.3[m h] ,463.2[m na] 。
[0575]
【表10】
[0576][0577]
1)lcms的峰面积比率
[0578]
即使是作为取代基小的氨基酸的丙氨酸,在利用碱水单独处理的水解中,残留的c末端活性体未被完全水解,在接下来的分液操作(水性洗涤)中也无法充分地除去残留的c末端活性体。另一方面,发现如果添加dmap进行水解,则残留的c末端活性体的水解可完全实现,残留的c末端活性体的除去也能够完全进行。而且,此时能以98.4%的纯度得到目标二肽。
[0579]
(实施例18)cbz-hph-meala-phe-otbu的合成
[0580]
(使用了在未添加胺的情况下进行水解处理而得到的二肽的cbz脱保护反应)
[0581]
将实施例17中在未添加胺条件下合成的cbz-meala-phe-otbu的mtbe溶液置换为2-甲基四氢呋喃并浓缩。利用5%pd/c(50%wet)101mg和氢气进行氢解反应。在25℃下搅拌6小时,但反应未完成(转化率35%)。反应转化率如下求出:取反应液5μl,用乙腈1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0582]
转化率(%)={meala-phe-otbu(面积%)/[cbz-meala-phe-otbu(面积%) meala-phe-otbu(面积%)]}
×
100
[0583]
(使用通过添加胺进行水解处理而得到的二肽的cbz脱保护反应)
[0584]
将实施例17中在添加胺条件下合成的cbz-meala-phe-otbu的mtbe溶液置换为2-甲基四氢呋喃并浓缩。利用5%pd/c(50%wet)102mg和氢气进行氢解反应。在25℃下搅拌3小时,得到作为脱cbz化体的meala-phe-otbu(转化率100%)。反应转化率如下求出:取反应液5μl,用乙腈1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。ms(esi):m/z 307.2[m h] 。
[0585]
转化率(%)={meala-phe-otbu(面积%)/[cbz-meala-phe-otbu(面积%) meala-phe-otbu(面积%)]}
×
100
[0586]
(缩合反应)
[0587]
将通过添加胺进行水解处理而得到的二肽的cbz脱保护体反应液用过滤器过滤,滤去pd/c后,进行浓缩干固。使干固物溶解于2-甲基四氢呋喃2.5ml中,加入474mg(1.5mmol)的cbz-hph-oh、二异丙基乙胺610μl(3.5mmol)。接着,加入t3p/2-甲基四氢呋喃溶液1.37ml(2.33mmol),在25℃下搅拌1.5小时,进行肽键形成反应(转化率:100%)。反应转化率如下求出:将反应液5μl加入到丙胺100μl中,用甲醇0.9ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0588]
转化率(%)={cbz-hph-meala-phe-otbu(面积%)/[meala-phe-otbu(面积%) cbz-hph-meala-phe-otbu(面积%)]}
×
100
[0589]
在制备的反应液中加入74mg(0.6mmol)的dmap、5%碳酸钠水溶液3.0ml,在25℃下进行15分钟搅拌。停止搅拌,静置后,使有机层与水层分层,除去水层。接着,将有机层依次用10%硫酸氢钠水溶液3ml、5%碳酸钠水溶液3ml、水3ml洗涤。将得到的有机层5μl加入到丙胺100μl中,用甲醇0.9ml稀释。对该溶液进行lc/ms分析,求出目标肽和残留的c末端活性体的峰面积百分比。目标肽cbz-hph-meala-phe-otbu为99.0%,未检测出来自残留的c末端活性体的cbz-hph-nhpr。将剩余的有机层浓缩,得到浓缩物618.4mg(从实施例17的phe-otbu起收率88%)。ms(esi):m/z 602.4[m h] ,624.4[m na] 。
[0590]
明确了如果残留有来自edc和hoobt的c末端活性体,则肽延长后的cbz脱保护反应几乎不进行。另一方面,发现如果使用残留的c末端活性体被完全除去的肽溶液作为原料,则cbz脱保护反应顺利地进行,能够进行肽合成反应。即,可知与实施例9的情况同样地,通过使用本发明的方法,能够使生成的肽化合物的n末端的保护基的还原性除去反应不停滞地进行。
[0591]
(实施例19)cbz-aib-d-val-obn的合成
[0592]
(缩合反应)
[0593]
将d-val-obn tsoh盐502mg(1.3mmol)、478mg(2.0mmol)的cbz-aib-oh悬浮于6.0ml的2-methf中,加入二异丙基乙胺1.2ml(6.9mmol)。接着,在25℃下加入50%t3p/2-甲基四氢呋喃溶液1.9ml(3.3mmol),在25℃下搅拌15小时进行肽键形成反应。取反应液5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,由lc/ms的峰面积求出转化率(转化率:100%)。
[0594]
转化率(%)={cbz-aib-d-val-obn(面积%)/[d-val-obn(面积%) cbz-aib-d-val-obn(面积%)]}
×
100
[0595]
(水解处理)
[0596]
(1)未添加胺的情况
[0597]
在上述制备的包含肽的反应溶液中加入5%碳酸钾水溶液5.0ml,在25℃下用搅拌子进行30分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0598]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0599]
(2)添加胺的情况
[0600]
在上述制备的包含肽的反应溶液中加入484mg(4.0mmol)的dmap和5%碳酸钾水溶液5.0ml,在25℃下用搅拌子进行30分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0601]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0602]
(后处理)
[0603]
停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层依次用10%硫酸氢钾水溶液5ml和5%碳酸钾水溶液2.5ml洗涤。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释,进行lc/ms分析,求出目标肽和残留的c末端活性体(丙酰胺转化体)的峰面积值。将剩余的有机层浓缩,得到肽。通过在未添加胺下的水解而得到的浓缩物(肽)为653.8mg(收率116%:虽然浓缩物中包含杂质(残留的c末端活性体),但设为仅包含肽的浓缩物进行计算)。通过添加胺的水解得到的浓缩物为549.4mg(收率97%)。ms(esi):m/z 427.3[m h]
,449.2[m na]
。
[0604]
【表11】
[0605][0606]
1)lcms的峰面积比率
[0607]
发现在利用碱水单独处理的水解中,残留的c末端活性体未被完全水解,在接下来的水性洗涤中也无法充分地除去残留的c末端活性体,但如果添加dmap进行水解,则可完全实现残留的c末端活性体的水解,能够完全地除去残留的c末端活性体。此时,以纯度98.6%得到目标二肽(收率97%)。
[0608]
(实施例20)cbz-thr(tbu)-phe-otbu的合成
[0609]
(缩合反应)
[0610]
将phe-otbu盐酸盐300mg(1.2mmol)、cbz-thr(tbu)-oh二环己基胺盐855mg(1.7mmol)、237mg(1.8mmol)的hobt悬浮于2-methf4.2ml、乙腈0.9ml中,加入二异丙基乙胺813μl(4.6mmol)。接着,在25℃下加入edc盐酸盐447mg(2.3mmol),在25℃下搅拌3小时进行肽键形成反应。取反应液5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,由lc/ms的峰面积求出转化率(转化率:100%)。
[0611]
转化率(%)={cbz-thr(tbu)-phe-otbu(面积%)/[phe-otbu(面积%) cbz-thr(tbu)-phe-otbu(面积%)]}
×
100
[0612]
(水解处理)
[0613]
(1)未添加胺的情况
[0614]
在上述制备的包含肽的反应溶液中加入5%碳酸钾水溶液3.0ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl
(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0615]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0616]
(2)添加胺的情况
[0617]
在上述制备的包含肽的反应溶液中加入142mg(1.2mmol)的dmap和5%碳酸钾水溶液3.0ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0618]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0619]
(后处理)
[0620]
停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层依次用10%硫酸氢钾水溶液3ml、5%碳酸钾水溶液3ml、水1.5ml洗涤。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释,进行lc/ms分析,求出目标肽和残留的c末端活性体(丙酰胺转化体)的峰面积值。将剩余的有机层浓缩,得到肽。ms(esi):m/z 401.2[m-2tbu h]
,457.2[m-tbu h]
,513.3[m h]
,535.3[m na]
。
[0621]
【表12】
[0622][0623]
1)lcms的峰面积比率
[0624]
发现在利用碱水单独处理的水解中,残留的c末端活性体未被完全水解,在接下来的水性洗涤中也无法充分地除去残留的c末端活性体,但如果添加dmap进行水解,则可完全实现残留的c末端活性体的水解,能够完全地除去残留的c末端活性体。此时,以纯度98.4%得到目标二肽。
[0625]
(实施例21)cbz-leu-thr(tbu)-phe-otbu的合成
[0626]
(使用了在未添加胺的情况下进行水解处理而得到的二肽的cbz脱保护反应)
[0627]
将实施例20中在未添加胺条件下合成的cbz-thr(tbu)-phe-otbu的mtbe/2-methf溶液置换为2-甲基四氢呋喃并浓缩。利用5%pd/c(50%wet)99mg和氢气进行氢解反应。在25℃下搅拌1小时,但反应未完成(转化率53%)。反应转化率如下求出:取反应液5μl,用乙腈1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0628]
转化率(%)={thr(tbu)-phe-otbu(面积%)/[cbz-thr(tbu)-phe-otbu(面积%) thr(tbu)-phe-otbu(面积%)]}
×
100
[0629]
(使用通过添加胺进行水解处理而得到的二肽的cbz脱保护反应)
[0630]
将实施例20中在添加胺条件下合成的cbz-thr(tbu)-phe-otbu的mtbe/2-methf溶液置换为2-甲基四氢呋喃并浓缩。利用5%pd/c(50%wet)104mg和氢气进行氢解反应。在25
℃下搅拌1小时,得到作为脱cbz化体的thr(tbu)-phe-otbu(转化率100%)。反应转化率如下求出:取反应液5μl,用乙腈1.0ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0631]
转化率(%)={thr(tbu)-phe-otbu(面积%)/[cbz-thr(tbu)-phe-otbu(面积%) thr(tbu)-phe-otbu(面积%)]}
×
100
[0632]
(缩合反应)
[0633]
将通过添加胺进行水解处理而得到的二肽的cbz脱保护体反应液用过滤器过滤,滤去pd/c后,进行浓缩干固。使干固物溶解于2-甲基四氢呋喃5.0ml,加入382mg(1.4mmol)的cbz-leu-oh、二异丙基乙胺814μl(4.7mmol)。接着,加入50%t3p/2-甲基四氢呋喃溶液1.37ml(2.3mmol),在25℃下搅拌30分钟,进行肽键形成反应(转化率:100%)。反应转化率如下求出:将反应液5μl加入到丙胺100μl中,用甲醇0.9ml稀释后,进行lc/ms分析,根据lc/ms的峰面积值求出。
[0634]
转化率(%)={cbz-leu-thr(tbu)-phe-otbu(面积%)/[thr(tbu)-phe-otbu(面积%) cbz-leu-thr(tbu)-phe-otbu(面积%)]}
×
100在制备的反应液中加入139mg(1.1mmol)的dmap、10%碳酸钠水溶液3.0ml,在25℃下进行5分钟搅拌。停止搅拌,静置后,使有机层与水层分层,除去水层。接着,将有机层依次用10%硫酸氢钠水溶液3ml
×
2、5%碳酸钠水溶液3ml、水3ml洗涤。将得到的有机层5μl加入到丙胺100μl中,用甲醇0.9ml稀释。对该溶液进行lc/ms分析,求出目标肽和残留的c末端活性体的峰面积百分比。目标肽cbz-leu-thr(tbu)-phe-otbu为98.3%,未检测出来自残留的c末端活性体的cbz-leu-nhpr。将剩余的有机层浓缩,得到浓缩物638.0mg(从实施例20的phe-otbu起收率88%)。ms(esi):m/z 514.3[m-2tbu h]
,570.3[m-tbu h]
,626.5[m h]
,648.4[m na]
。
[0635]
可知残留有来自edc和hobt的c末端活性体时,与完全除去残留的c末端活性体的情况相比,cbz脱保护反应进行较慢。发现如果使用残留的c末端活性体被完全除去的肽溶液作为原料,则cbz脱保护反应顺利地进行,能够进行肽合成反应。即,通过使用本发明的方法,与实施例9、实施例18的情况同样地,能够使生成的肽化合物的n末端的保护基的还原性除去反应不停滞地进行。由此,能够有效地制造具有所期望的氨基酸序列的高纯度的肽化合物。
[0636]
(实施例22)cbz-ile-phe-otbu的合成
[0637]
(缩合反应)
[0638]
将phe-otbu盐酸盐301mg(1.2mmol)、465mg(1.8mmol)的cbz-ile-oh悬浮于mtbe3.6ml、乙腈0.9ml中,加入二异丙基乙胺610μl(3.5mmol)。接着,在25℃下加入479mg(1.8mmol)的bep,在25℃下搅拌45分钟,进行肽键形成反应。取反应液5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,由lc/ms的峰面积求出转化率(转化率:100%)。
[0639]
转化率(%)={cbz-ile-phe-otbu(面积%)/[phe-otbu(面积%) cbz-ile-phe-otbu(面积%)]}
×
100
[0640]
(水解处理)
[0641]
(1)未添加胺的情况
[0642]
在上述制备的包含肽的反应溶液中加入5%碳酸钾水溶液3.0ml,在25℃下用搅拌子进行3分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl
505mg(1.5mmol)、hoobt 256mg(1.6mmol)。在25℃下加入edc盐酸盐388mg(2.0mmol),在25℃下搅拌1小时进行肽键形成反应。取反应液5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,由lc/ms的峰面积求出转化率(转化率:100%)
[0659]
转化率(%)={cbz-phe-megly-phe-哌啶(面积%)/[phe-哌啶(面积%) cbz-phe-megly-phe-哌啶(面积%)]}
×
100
[0660]
在上述制备的反应溶液中加入128mg(1.0mmol)的dmap、5%碳酸钾水溶液3.5ml,在25℃下用搅拌子进行3分钟搅拌。停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层用10%硫酸钾水溶液3.5ml
×
2、5%碳酸钾水溶液3.5ml稀释。对该溶液进行lc/ms分析,求出目标肽和残留的c末端活性体的峰面积百分比。目标肽cbz-phe-megly-phe-哌啶的纯度为94.6%,未检测出来自残留的c末端活性体的cbz-phe-megly-nhpr。将剩余的有机层浓缩,得到浓缩物520.4mg(收率94%)。
[0661]
添加dmap进行水解时,可完全实现来自肽片段的残留的c末端活性体的分解、除去,能够以94.6%的纯度得到目标三肽。(收率94%)
[0662]
1)j.org.chem.,2003,68,7505-7508.
[0663]
2)bull.chem.soc.jpn.,2004,77,1187-1193.
[0664]
(实施例24)cbz-val-phe-otbu的合成
[0665]
(缩合反应)
[0666]
将phe-otbu盐酸盐200mg(0.8mmol)、294mg(1.2mmol)的cbz-val-oh悬浮于2-甲基四氢呋喃2.4ml、乙腈0.6ml中,加入n-乙基吗啉294μl(2.3mmol)。接下来,在25℃下加入447mg(1.2mmol)的hatu,在25℃下搅拌2.5小时,进行肽键形成反应。取反应液5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,由lc/ms的峰面积求出转化率(转化率:100%)。ms(esi):m/z 399.3[m-tbu h]
,455.3[m h]
[0667]
转化率(%)={cbz-val-phe-otbu(面积%)/[phe-otbu(面积%) cbz-val-phe-otbu(面积%)]}
×
100
[0668]
(水解处理)
[0669]
(1)未添加胺的情况
[0670]
在上述制备的包含肽的反应溶液中加入5%碳酸钾水溶液2.0ml,在25℃下用搅拌子进行搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率(下表)。
[0671]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0672]
(2)添加胺的情况
[0673]
在上述制备的包含肽的反应溶液中加入下表所示的胺添加剂(0.8mmol)和5%碳酸钾水溶液2.0ml,在25℃下用搅拌子进行搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,根据lc/ms的峰面积值,按照以下的计算式计算c末端活性
体残留率(下表)。
[0674]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽面积%)]}
×
100
[0675]
【表14】
[0676]
c末端活性体残留率的推移
[0677][0678]
dipea的添加与不添加胺的单独碱水的情况相比,稍微促进残留的c末端活性体的水解,但未观察到大的效果。另一方面,明确了dmap和nmi的添加比dipea的添加更显著地促进残留的c末端活性体的水解,特别是在使用dmap时,在5分以内残留的c末端活性体被完全水解。由此明确了:与像dipea这样的在氮附近有空间位阻的胺相比,像dmap这样的氮附近的空间位阻小的胺更能促进残留的c末端活性体的水解。
[0679]
(实施例25)cbz-ile-val-obn的合成
[0680]
(缩合反应)
[0681]
将val-obn盐酸盐300mg(1.2mmol)、495mg(1.9mmol)的cbz-ile-oh悬浮于环戊基甲醚3.0ml、乙腈0.9ml,加入二异丙基乙胺859μl(4.9mmol)。接着,在25℃下加入705mg(1.9mmol)的hatu,在25℃下搅拌1小时,进行肽键形成反应。取反应液5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,由lc/ms的峰面积求出转化率(转化率:100%)。
[0682]
转化率(%)={cbz-ile-val-obn(面积%)/[val-obn(面积%) cbz-ile-val-obn(面积%)]}
×
100
[0683]
(水解处理)
[0684]
(1)未添加胺的情况
[0685]
在上述制备的包含肽的反应溶液中加入中性水3.0ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0686]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0687]
(2)添加胺的情况
[0688]
在上述制备的包含肽的反应溶液中加入91mg(0.7mmol)的dmap和中性水3.0ml,在25℃下用搅拌子进行5分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0689]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0690]
(后处理)
[0691]
停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层依次用10%硫酸氢钠水溶液3ml和5%碳酸钠水溶液3ml
×
2、水1.5ml
×
3洗涤。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释,进行lc/ms分析,求出目标肽和残留的c末端活性体(丙酰胺转化体)的峰面积值。将剩余的有机层浓缩,得到肽。通过未添加胺下的水解而得到的浓缩物(肽)为744mg(收率132%:虽然浓缩物中包含杂质(残留的c末端活性体),但设为仅包含肽的浓缩物进行计算)。通过添加胺的水解得到的浓缩物为528mg(收率94%)。ms(esi):m/z 455.3[m h]
,477.3[m na]
。
[0692]
【表15】
[0693][0694]
1)lcms的峰面积比率
[0695]
发现在中性水单独处理的水解中,残留的c末端活性体未被完全水解,通过接下来的水性洗涤也无法除去残留的c末端活性体,但如果添加dmap进行水解,则残留的c末端活性体的水解可完全实现,残留的c末端活性体的除去也能够完全进行。此时,能以99.5%的纯度得到目标二肽(收率94%)。
[0696]
(实施例26)cbz-meala-phe-otbu的合成
[0697]
(缩合反应)
[0698]
将phe-otbu盐酸盐200mg(0.8mmol)、260mg(1.2mmol)的cbz-meala-oh悬浮于2-甲基四氢呋喃2.4ml、乙腈0.6ml中,加入二异丙基乙胺271μl(1.6mmol)。接着,在25℃下加入dmt-mm-n水合物(4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉鎓氯化物n水合物)265mg(0.8mmol,13w%含水),在25℃下搅拌1小时后,加入dmt-mm-n水合物119mg(0.4mmol,13w%含水),在25℃下搅拌1小时,进行肽键形成反应。取反应液5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。对本溶液进行lc/ms分析,由lc/ms的峰面积求出转化率(转化率:100%)。
[0699]
转化率(%)={cbz-meala-phe-otbu(面积%)/[phe-otbu(面积%) cbz-meala-phe-otbu(面积%)]}
×
100
[0700]
(水解处理)
[0701]
(1)未添加胺的情况
[0702]
在上述制备的包含肽的反应溶液中加入5%碳酸钾水溶液2.0ml,在25℃下用搅拌子进行10分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0703]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0704]
(2)添加胺的情况
[0705]
在上述制备的包含肽的反应溶液中加入96mg(0.8mmol)的dmap和5%碳酸钾水溶液2.0ml,在25℃下用搅拌子进行10分钟搅拌。停止搅拌,使有机层和水层分层。取有机层5μl,加入到丙胺100μl(1.2mmol)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释。根据lc/ms的峰面积值,按照以下的计算式计算c末端活性体残留率。
[0706]
c末端活性体残留率(%)={丙酰胺(面积%)/[丙酰胺(面积%) 二肽(面积%)]}
×
100
[0707]
(后处理)
[0708]
停止搅拌后,静置,使有机层和水层分层,除去水层。接着,将有机层依次用10%硫酸氢钾水溶液2ml和5%碳酸钾水溶液2ml、水1ml
×
2洗涤。取有机层5μl,加入到丙胺100μl(1.2mm0l)中,使残留的c末端活性体转化为丙酰胺后,用甲醇0.9ml稀释,进行lc/ms分析,求出目标肽和残留的c末端活性体(丙酰胺转化体)的峰面积值。将剩余的有机层浓缩,得到肽。通过未添加胺下的水解而得到的浓缩物(肽)为387mg(收率114%:虽然浓缩物中包含杂质(残留的c末端活性体),但设为仅包含肽的浓缩物进行计算)。通过添加胺的水解得到的浓缩物为336mg(收率98%)。ms(esi):m/z 385.2[m-tbu h]
,441.3[m h]
,463.3[m na]
。
[0709]
【表16】
[0710][0711]
1)lcms的峰面积比率
[0712]
发现在使用dmt-mm作为缩合剂的情况下,在利用碱水单独处理的水解中,残留的c末端活性体未被完全水解,通过接下来的水性洗涤也无法除去残留的c末端活性体,但如果添加dmap进行水解,则残留的c末端活性体的水解可完全实现,残留的c末端活性体的除去也能够完全进行。此时,能以98.6%的纯度得到目标二肽(收率98%)。已知由作为在含水溶剂中也能够使用的缩合剂的dmt-mm生成的c末端活性体比较不易受到水解。但是,发现如果使用胺添加剂,则即使是使用dmt-mm制备的残留的c末端活性体,也能够在短时间且一次的处理中完全水解,并在接下来的水性洗涤中完全除去。
[0713]
参考例1:measp(tbu)-哌啶的合成法
[0714]
(缩合反应)
[0715]
将cbz-measp(tbu)-oh二环己胺盐10.2g(19.6mmol)悬浮于乙酸乙酯100ml中,加入二异丙基乙胺20.6ml(118mmol)、哌啶9.7ml(98.0mmol)。在3~10℃下历时45分钟滴加50%t3p/乙酸乙酯溶液35.0ml(58.9mmol)。滴加结束后,取反应液5μl,对用甲醇1.0ml稀释的溶液进行lcms分析,由lc/ms的峰面积值求出反应转化率(转化率:100%)。
[0716]
转化率(%)={cbz-measp(tbu)-哌啶(面积%)/[cbz-measp(tbu)-oh(面积%) cbz-measp(tbu)-哌啶(面积%)]}
×
100
[0717]
将反应液用10%硫酸氢钾水溶液100ml、10%碳酸钾100ml洗涤后,将得到的有机层用硫酸镁干燥、过滤、浓缩。ms(esi)m/z 349.1[m-tbu h]
,405.2[m h]
,427.3[m na]
。
[0718]
(cbz脱保护反应)
[0719]
将上述浓缩液溶解于环戊基甲醚100ml中,利用5%pd/c(50%wet)2.0g和氢气进行氢解反应。在室温下搅拌5小时,得到作为目标物的measp(tbu)-哌啶(转化率100%)。反应转化率如下求出:取反应液5μl,将用乙腈1.0ml稀释的溶液供于lcms分析,由lc/ms的峰面积值求出反应转化率。
[0720]
转化率(%)={measp(tbu)-哌啶(面积%)/[cbz-measp(tbu)-哌啶(面积%) measp(tbu)-哌啶(面积%)]}
×
100
[0721]
将反应液用过滤器过滤后,将滤液浓缩,得到浓缩物5.69g(收率quant.)。对本浓缩物进行lc/ms分析,求出目标measp(tbu)-哌啶的峰面积百分比(99.2面积%)。ms(esi):m/z 215.1[m-tbu h]
,271.1[m h]
。
[0722]
产业上的可利用性
[0723]
本发明在制造肽化合物时,通过有效地除去缩合反应后残留的c末端活性体,能够在不进行柱纯化的情况下制造高纯度的肽化合物。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。