mir-483-5p海绵体及在制备抑制2型糖尿病
β
细胞去分化的药物中的用途
技术领域
1.本发明属于生物医药技术领域,特别涉及mir-483-5p海绵体及在制备抑制2型糖尿病β细胞去分化的药物中的用途。
背景技术:
2.目前,传统降糖药物如胰岛素、葡萄糖苷酶抑制剂、胰岛素促分泌剂和胰岛素增敏剂等在治疗的同时往往会带来耐药、低血糖、乳酸中毒和体重增加等不良反应。而且,在英国前瞻性糖尿病研究(ukpds)报告中显示,无论采取何种传统降糖药物,糖尿病患者胰岛β细胞功能还是进行性丧失,无法保护和维持胰岛β细胞功能和作用。此外,目前的药物都是在2型糖尿病已经诊断确认时,这时胰岛细胞已经功能障碍,对β细胞造成了不可逆的损伤,无法修复β细胞的功能。因此,急需寻找一种保护糖尿病早期β细胞功能、毒副作用小的降糖药物。microrna(mirna)是一类高度保守的非编码小rna,长度约为18-25个核苷酸。mirnas广泛表达于β细胞发育的所有阶段和成熟的β细胞中,是维持胎儿期β细胞发育和功能起主要作用的调控因子,同时也是维持成熟β细胞功能所必需的,mirnas的表达会影响影响胰腺发育和β细胞功能。糖尿病通常可分为糖尿病的“高危人群”阶段、糖调节受损阶段、糖尿病阶段三个阶段,如果能够把握该病不同阶段的特征,并重视起来早干预、早治疗对于该病的防治非常有益处。研究发现,mir-483-5p在2型糖尿病患者以及2型糖尿病小鼠的血清及原代胰岛中显著高表达,高表达的mir-483-5p促使胰岛β细胞去分化,胰岛β细胞胰岛素分泌功能丧失过半,但是这时大多数胰岛β细胞并没有死掉。如果有一种新型药物来诱导去分化的β细胞回复分化,使之发生再分化成为具有正常功能的成熟β细胞,很可能是未来糖尿病治疗一个重要方向。但如果不引起足够重视,在肥胖和胰岛素抵抗、炎症因子损伤等持续性刺激下,这些β细胞会离其成熟状态渐行渐远,最终丧失分泌功能而真正“凋亡”,导致不可治愈的2型糖尿病发生。
技术实现要素:
3.发明目的:本发明目的是提供mir-483-5p海绵体(mir-483-5p sponge)及其在制备抑制2型糖尿病β细胞去分化的药物中的用途。
4.技术方案:针对现有2型糖尿病治疗药物的不足,本发明所述的mir-483-5p海绵体其核苷酸序列如seq id no:1所示,具体为:
[0005][0006]
mir-483-5p sponge(mir-483-5p海绵体)或下调剂及其衍生物在制备或筛选用于抑制2型糖尿病β细胞去分化药物中的应用。mir-483-5p海绵体是一条mrna,其3’非翻译区(utr)包含若干个mir-483-5p靶定位点。更重要的是,这些risc切割位点与靶定位点有一些
错配,这样抑制剂mir-483-5p海绵体就不会被降解。
[0007]
所述的mir-483-5p海绵体在制备抑制2型糖尿病β细胞去分化的药物中的用途。
[0008]
mir-483-5p海绵体(mir-483-5p海绵体)是mir-483-5p的抑制剂,靶向结合mir-483-5p从而抑制其功能。该mir-483-5p海绵体封闭β细胞中mir-483-5p的表达,进一步将其应用于制备用于抑制2型糖尿病β细胞去分化的药物中的应用,以解决2型糖尿病当前治疗药物的匮乏以及副作用的问题。
[0009]
本发明所述mir-483-5p海绵体可以抑制高脂饮食诱导的2型糖尿病β细胞去分化的发生。具体在应用时,所述mir-483-5p海绵体与表达载体有效连接。所述“有效连接”是指本发明的mir-483-5p海绵体与表达载体的连接使所产生的核酸构建体能在细胞或动物体内转录本发明的mir-483-5p海绵体。
[0010]
进一步地,所述表达载体为腺相关病毒表达质粒,优选地,选用腺相关病毒表达质粒phbaav-cmv-mcs-t2am-zsgreen。mir-483-5p核酸构建体可以通过在mir-483-5p海绵序列的两端加上与表达载体相配的酶切位点,合成正向序列和反向序列,以与该表达载体有效连接。
[0011]
进一步地,可以通过如下方法制备mir-483-5p核酸构建体(亦称为mir-483-5p海绵腺相关病毒):
[0012]
(1)选用腺相关病毒载体phbaav-cmv-mcs-t2am-zsgreen;感受态细胞选用大肠杆菌菌株dh5α;抗性:amp;
[0013]
(2)针对目的基因合成mir-483-5p海绵,然后构建腺相关病毒表达载体,大量扩增腺相关病毒载体;在293t细胞内进行腺相关病毒载体的大量包装,进行腺相关病毒的浓缩及纯化,最后对腺相关病毒滴度测定(10^11tu/ml)。
[0014]
本发明通过尾静脉注射或腹腔注射或胰腺导管内注射aav-mmu-mir-483-5p-sponge(mir-483-5p sponge)或对照病毒aav-mmu-nc-gfp(gfp)于高脂饮食小鼠体内,观察小鼠胰岛β细胞的去分化。
[0015]
因此,发明一种明确有效的药物抑制mir-483-5p的表达,在糖尿病早期抑制β细胞去分化,使得胰岛β细胞数量和结构不发生变化,胰岛素分泌功能正常,那么2型糖尿病就不会产生,这对控制糖尿病的发生和发展具有重要意义。
[0016]
有益效果:本发明首次发现了mir-483-5p海绵体在抑制胰岛β细胞去分化的作用。鉴定了mir-483-5p抑制了维持β细胞特异性(βcell identity)必不可少的转录因子pdx1及mafa的表达,而使得内分泌祖细胞标志物(ngn3)及干细胞标志物(oct4、nanog)表达上调。mir-483-5p sponge(mir-483-5p海绵体)或下调剂及其衍生物等可作为mir-483-5p的专一性抑制剂,为2型糖尿病治疗的有效药物的制备或筛选提供了新的靶点,对2型糖尿病的预防和治疗有重要意义。同时,mir-483-5p海绵体作为mir-483-5p抑制剂,具有靶向位点专一性强,本身又是mrna,无毒副作用,体内易自行降解等优势,是预防及治疗2型糖尿病的有效药物的合适选择。
附图说明
[0017]
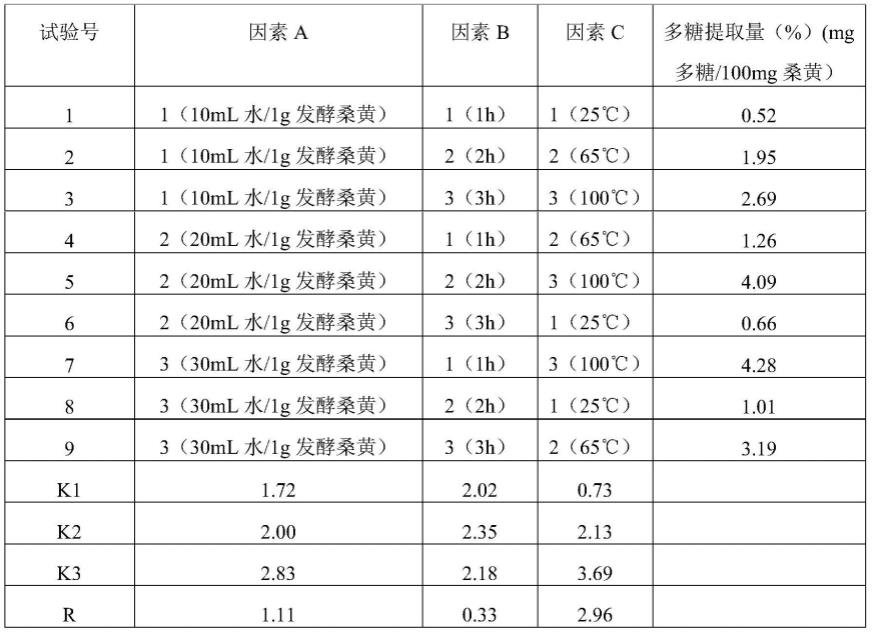
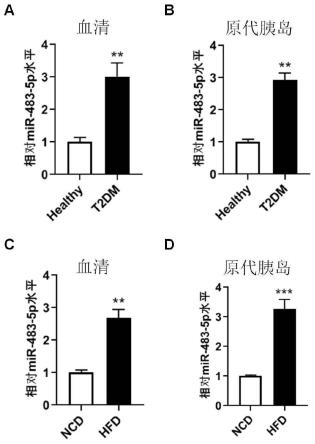
图1:mir-483-5p在2型糖尿病患者及2型糖尿病小鼠的血清及原代胰岛中显著高表达:分别提取2型糖尿病患者及2型糖尿病小鼠血清和原代胰岛rna,荧光定量pcr检测
mir-483-5p的水平;(a和b)图为2型糖尿病患者及正常对照组血清(a)及原代胰岛(b)mir-483-5p的表达水平(n=10);(c和d)图为2型糖尿病小鼠及对照小鼠血清(c)及原代胰岛(d)mir-483-5p的表达水平(n=10),(**p<0.01,***p<0.001);
[0018]
图2:β细胞特异性标志分子(如pdx1、mafa和insulin)的表达在2型糖尿病患者及2型糖尿病小鼠原代胰岛中显著下调,而β细胞去分化标志分子(如:ngn3、oct4、nanog)的表达却明显上调:分别提取2型糖尿病患者及2型糖尿病小鼠原代胰岛rna,荧光定量pcr检测pdx1、mafa、insulin、ngn3、oct4、nanog的水平;(a)图为2型糖尿病患者及正常对照组原代胰岛中上述分子的表达水平(n=8);(b)图为2型糖尿病小鼠及对照小鼠原代胰岛中上述分子的表达水平(n=8),(*p<0.05,**p<0.01);
[0019]
图3:过表达mir-483-5p显著降低β细胞合成和分泌胰岛素的功能,而不影响β细胞的增殖和凋亡:将合成的mir-483-5p模拟物转染min6细胞,48h后进行gsis实验(a),用rip法检测胰岛素的含量(b),用mtt分析min6细胞的增殖(c),用hoechst分析min6细胞的凋亡(d),(n=2-3;*p<0.05,**p<0.01);
[0020]
图4:过表达mir-483-5p明显增强β细胞的去分化:将合成的mir-483-5p模拟物转染min6细胞,48h后进行定量pcr,检测β细胞特异性标志分子pdx1、mafa、insulin 1和insulin 2(a)及去分化标志分子ngn3、oct4、nanog(b)的表达,(n=2-3;*p<0.05,**p<0.01);
[0021]
图5:经高脂喂养12周的雄性c57bl/6j小鼠通过胰腺导管内注射aav-mmu-mir-483-5p-sponge(mir-483-5p sponge)或对照病毒aav-mmu-nc-gfp(gfp)后,继续进行高脂喂养,并对其代谢表型的监测;其中(a)图是实验小鼠体重随时间的变化示意图;(b)图是注射aav-mmu-mir-483-5p-sponge或aav-mmu-nc-gfp 4周后小鼠的ipgtt的结果示意图;(c)图是注射aav-mmu-mir-483-5p-sponge或aav-mmu-nc-gfp 6周后,腹腔注射葡萄糖0、5、30min时的胰岛素分泌量,(n=6;*p<0.05,**p<0.01);
[0022]
图6:胰腺导管内注射aav-mmu-mir-483-5p-sponge或aav-mmu-nc-gfp 6周后,提取小鼠胰岛,实时荧光定量pcr检测pdx1、mafa、insulin 1和insulin 2的表达(a),同时检测去分化标志分子ngn3、oct4及nanog的表达(b),(n=6;*p<0.05,**p<0.01)。
具体实施方式
[0023]
实施例1 2型糖尿病人及2型糖尿病小鼠血清及胰岛中mir-483-5p的表达明显上调。
[0024]
1)血清的制备:
[0025]
a:抽取每一位实验对象3ml外周静脉血入分离胶 促凝剂真空采血管,常温或于37℃水浴箱中静置30-60min;
[0026]
b:室温或者4℃下离心1500g,持续5-10min,离心完毕后分三层,上层淡黄色清亮血清层,中间分离胶层,最底层为暗红色血细胞层;移至超净台进一步操作,从而避免唾液、外界酶等污染标本。
[0027]
c:将取出的血清转移至无酶的epp管中,12000g离心5min,进一步弃去残留的细胞或细胞碎片,离心温度为4℃;移至新的无酶1.5ml冻存管中,-80℃保存备用。
[0028]
2)原代胰岛的提取:
[0029]
2型糖尿病患者及正常对照组的原代胰岛由天津医科大学王树森教授馈赠,在此只描述小鼠原代胰岛的提取。
[0030]
a:分离步骤:小鼠禁食过夜,用3.5%(w/v)水合氯醛进行腹腔注射麻醉;固定动物于手术台上;打开腹腔和胸腔并暴露心脏;找到胆总管在十二指肠开口处,带线结扎;剪破右心耳放血;找到肝总管与胆总管汇合处,准备插管;用静脉输液管插管(插管之前要排气),注入胶原酶v(1.5-2ml/只小鼠),可见胰腺充盈呈透明水泡状;将充盈的胰腺组织沿肠管剪切剥离下来,迅速放在冰上预冷的50ml灭菌的塑料离心管中(每管可放入2只小鼠胰腺);向50ml离心管中加入2-5ml的胶原酶v用于外消化,37℃水浴静置消化28min;将50ml离心管自水浴中取出,立即置于冰上终止消化;涡旋震荡3
×
5sec,直至组织破碎呈泥沙状;加入2倍体积的含10%fbs的hbss(冰上预冷),混匀,进一步终止消化,用30目不锈钢筛子网过滤,除去未消化完全的组织块;4℃、350g离心(加速度:9,减速度:9)2min;弃上清,加入冰hbss重悬细胞沉淀,4℃,350g离心(加速度:9;减速度:9)2min;弃上清,加入5ml histopaque-1077重悬细胞沉淀,转移至10ml玻璃离心管中;小心用巴式管沿玻璃离心管管壁缓慢加入5ml hbss,保持hbss与histopaque-1077之间的分层;4℃,500g离心(加速度:9;减速度:1)20min;离心后,胰岛位于hbss与histopaque-1077之间的夹层中,将此夹层用200μl移液器转移至预先加好含血清hbss的6孔板中,在体式显微镜下用10μl移液器挑拣完整的胰岛。
[0031]
b:纯度鉴定:将100mg胰岛双硫腙(dtz)溶于30mldmso中,加入500μl 25%氨水,充分溶解,过滤除去不溶物,分装到ep管中,-20℃保存作为储存液;将所得胰岛用生理盐水洗涤两次后,加1ml生理盐水及10μl双硫腙储存液,37℃孵育30min,倒置显微镜下观察细胞着色情况,胰岛经dtz染色后呈现猩红色,鉴定胰岛纯度>90%。
[0032]
3)从血清或胰岛中提取rna
[0033]
a:取出-80℃冻存样本置冰上融化,吸取200μl加入到600μl trizol中,于振荡器上充分混匀,所得到的匀浆于室温(15-30℃)静置10min,使核酸蛋白复合物充分分离;
[0034]
b:加入1/5体积的氯仿,即120μl氯仿,剧烈漩涡混匀15sec,并于室温下静置10min;
[0035]
c:将离心机调制4℃,12000g离心15min,可见样品分三层:上层为无色水相(rna溶解于其中),中间层为红色层(dna溶解于其中),下层则为有机层(为蛋白质等有机物质)(离心结束后取样时不可晃动或颠倒管子,防止离心后三层再次混合);
[0036]
d:用200μl移液器吸取上层水相(注意避免吸取中间层)移入新的1.5ml无酶epp管中,并加入等体积的异丙醇,充分混匀后,室温下静置25min;
[0037]
e:静置结束后于4℃,12000g离心10min,弃去上清。
[0038]
f:加入事先配好的75%乙醇600μl,4℃,7500g离心5min。弃去上清,室温晾干约5min,加入20μl rnaase-free ddh2o,轻轻吹打混匀,充分溶解rna;
[0039]
4)rna浓度和纯度检测
[0040]
取提取的rna 1μl,打开紫外分光光度计,获取在260nm和280nm波长下的吸光度,计算二者比值,若260/280 od值处于1.8-2.1范围,则rna浓度大约在25-50ng/μl,则可以进行下一步实验。
[0041]
5)cdna的合成及实时荧光定量pcr
[0042]
使用toyobo公司生产的revertra ace-α-逆转录试剂盒进行逆转录,合成cdna。
[0043]
a:逆转录:体系20μl,所有操作均在冰上进行。取一0.2ml rnaase-free离心管,加入以下试剂:
[0044]
逆转录反应体系
[0045][0046]
b:逆转录程序
[0047]
37℃60min;
[0048]
85℃5min;
[0049]
4℃60min。
[0050]
c:将逆转录的cdna放入-80℃存放或加入rnaase-free h2o稀释至100μl进行下一步。
[0051]
d:pcr反应体系10μl
[0052]
实时荧光定量pcr反应体系
[0053][0054]
e:将上述体系加入八联管中,按下一个程序进行pcr扩增:
[0055]
实时荧光定量pcr反应程序
[0056][0057]
每个样本设定三个副孔,分别记录内参及样本反应的ct值。
[0058]
6)数据统计学分析
[0059]
两组血清样本mirna表达量的比值使用2
‑△△
ct法进行计算,其中
△△
ct=[ct1(mirna)-ct1(内参)]-[ct2(mirna)-ct2(内参)],ct(mirna)是样本mir-483-5p扩增的ct值,ct(内参)是样本内参基因扩增的ct值,ct1是2型糖尿病组样本扩增的ct值,ct2是健康对照组扩增的ct值。本实验所有数据均采用均值
±
标准差(
±
s)表示,组间差异性分析采用t检验,以p<0.05作为统计学差异参考标准。
[0060]
结果如图1所示,mir-483-5p在2型糖尿病人(图1a和图1b)及2型糖尿病小鼠(图1c和图1d)血清及原代胰岛中的表达水平显著升高,具有显著差异(**p<0.01,***p<0.001)。这提示mir-483-5p可能参与了2型糖尿病的发生发展过程。
[0061]
实施例2 2型糖尿病人及2型糖尿病小鼠胰岛中β细胞标志分子明显下调,而β细胞去分化标志分子的表达却明显上调。
[0062]
为了分析糖尿病状态下高表达mir-483-5p的胰岛是否存在去分化,检测了2型糖尿病人及2型糖尿病小鼠胰岛中β细胞标志分子及β细胞去分化标志分子的表达。
[0063]
具体步骤见实施例1所述的原代胰岛实时荧光定量pcr方法。不同的是分别将实施例1的逆转录体系中mirna颈环反向引物替换为oligo(dt)(注:针对具有polya尾的成熟mrna);将实施例1的pcr体系中上下游引物替换为各个检测基因的mrna引物(序列如表1所示)。
[0064]
表1
[0065]
[0066][0067]
结果见图2所示,2型糖尿病人及2型糖尿病小鼠胰岛中β细胞特异性标志分子的表达明显下调,而β细胞去分化标志分子的表达却明显上调。
[0068]
实施例3 mir-483-5p显著抑制了胰岛β细胞合成和分泌胰岛素的功能,而不影响胰岛β细胞的增殖和凋亡。
[0069]
为了探索mir-483-5p对胰岛β细胞可能的调控作用,研究了mir-483-5p对胰岛β细胞合成和分泌胰岛素、增殖及凋亡的影响。
[0070]
1)胰岛β细胞分泌胰岛素实验检测
[0071]
培养于12孔板中的min6细胞转染阴性对照模拟物或mir-483-5p模拟物(序列见表2)48h后,进行gsis实验。具体操作如下:经处理后的min6细胞弃培养上清,pbs漂洗一次,加入1ml无糖的kerbs-ringer-bicarbonate-hepes(krbh)缓冲液,培养1h;弃上清,min6细胞加入1ml含2mmol/l(低糖)或者20mmol/l(高糖)葡萄糖的krbh缓冲液,继续孵育1h后,收集上清至2ml ep管中,冻存于-80℃,待测。结果如图3a所示,同阴性对照模拟物相比,mir-483-5p模拟物明显抑制了min6细胞高糖刺激的胰岛素分泌功能。(*p<0.05)
[0072]
表2
[0073][0074]
2)细胞内胰岛素抽提实验
[0075]
将min6细胞接种于48孔板,用阴性对照模拟物或mir-483-5p模拟物(序列见表2)分别转染细胞48h后,弃培养上清,pbs漂洗一次;细胞每孔加200μl酸乙醇抽提液(acid-ethanol solution:74%ethanol,1.4%hcl),4℃条件下孵育12h左右后,取上清于2mlepp管中。样品可冻存于-80℃超低温冰箱中待测;用胰岛素放免检测试剂盒,放免法(radio immuno assay,ria)检测胰岛素水平。结果如图3b所示,同阴性对照模拟物相比,mir-483-5p模拟物也明显抑制了min6细胞胰岛素合成功能。
[0076]
3)mtt检测细胞活力
[0077]
细胞接种于96孔板中,经阴性对照模拟物或mir-483-5p模拟物(序列见表2)分别转染细胞48h后,向每孔加入mtt 10μl(mtt溶解于无菌pbs(磷酸缓冲盐溶液,phosphate buffer saline),浓度为0.5%(m/v);将96孔板置于37℃培养箱中反应4h;反应完成后用注射器吸尽培养液,每孔加入dmso(二甲基亚砜)100μl溶解紫色结晶甲瓒。37℃培养箱中反应10min;用酶标仪在570nm波长处读取吸光度值,细胞经处理后的活力与该吸光度值成正比关系。结果如图3c所示,同阴性对照模拟物相比,mir-483-5p模拟物并未影响min6细胞的增殖。
[0078]
4)hoechst检测细胞凋亡
[0079]
细胞接种于96孔板中,经阴性对照模拟物或mir-483-5p模拟物(序列见表2)分别转染细胞48h后,向每孔中加入100μl hoechst 33258染色液,在适宜细胞培养的温度下培养20-30min;弃染色液,用pbs或培养液洗涤2-3次,每次3-5min;在荧光显微镜下观察。细胞发生凋亡时,会看到凋亡细胞的细胞核呈致密浓染,或呈碎块状致密浓染。结果如图3d所示,同阴性对照模拟物相比,mir-483-5p模拟物并未影响min6细胞的凋亡。
[0080]
以上结果表明,mir-483-5p明显抑制了min6细胞胰岛素的合成和分泌,而不影响其增殖和凋亡。
[0081]
实施例4 mir-483-5p对胰岛β细胞去分化的影响
[0082]
为了进一步研究mir-483-5p对胰岛β细胞去分化的影响,采用qrt-pcr(实时荧光定量,real-time pcr)方法检测了转染mir-483-5p模拟物的min6细胞中胰岛β细胞标志性分子pdx1、mafa、insulin 1和insulin 2的mrna(信使核糖核酸)水平,同时分析了胰岛β细胞去分化标志分子ngn3、oct4和nanog的表达。引物序列见表1。具体步骤见实施例1和实施例2所述的实时荧光定量pcr方法。在此不再赘述。
[0083]
结果见图4所示,min6细胞转染mir-483-5p后,明显抑制了β细胞特异性标志分子(如:pdx1、mafa、insulin 1和insulin 2)的表达(图4a),却显著促使了β细胞去分化标志分
子ngn3、oct4和nanog的表达(图4b)。
[0084]
实施例5探究mir-483-5p sponge在治疗2型糖尿病胰岛β细胞去分化中的作用
[0085]
为了探讨体内抑制mir-483-5p的表达能否缓解2型糖尿病胰岛β细胞的去分化,设计了mir-483-5p sponge,注射于高脂饮食小鼠体内,并对其表型进行监测。
[0086]
实验动物:经高脂喂养12周的雄性c57bl/6j小鼠,购自南京大学模式动物所,所有实验动物均饲养于南京医科大学实验动物中心屏障设施内。
[0087]
实验方法:
[0088]
1)将高脂喂养12周的雄性c57bl/6j小鼠随机分为三组,每组6只。通过尾静脉或腹腔注射或胰腺原位注射的方式(这里主要介绍胰腺原位注射的方法),将aav-mmu-mir-483-5p-sponge(mir-483-5p sponge组)或aav-mmu-nc-gfp(gfp组)注射入小鼠体内,100μl/只,剂量2*10^8tu/ml,另外一组为假手术组(blank组)。待小鼠恢复后,继续进行高脂饲料喂养。
[0089]
2)高脂喂养4周后,对小鼠进行ipgtt试验;
[0090]
3)高脂喂养6周后,检测小鼠腹腔注射葡萄糖后0,30min的胰岛素的分泌量。并处死小鼠提取小鼠胰岛,荧光定量pcr检测pdx1、mafa、insulin 1和insulin 2的表达,同时检测去分化标志分子ngn3、oct4及nanog的表达。具体引物序列见表1。
[0091]
结果如图5、图6所示,注射gfp和mir-483-5p sponge组的小鼠体重没有明显差异(图5a);但与gfp组相比,注射mir-483-5p sponge组的小鼠在15、30、60min时的糖耐量明显改善(图5b);并且,与gfp组相比,mir-483-5p sponge组小鼠的葡萄糖刺激后胰岛素分泌在30min时明显增加(图5c)。与此相一致的是,同gfp组相比,注射mir-483-5d sponge组的小鼠胰岛中pdx1、mafa、insulin 1和insulin 2的表达明显上调(图6a),而去分化标志分子ngn3、oct4及nanog的表达明显下降(图6b)。
[0092]
综上,本发明发现,在2型糖尿病人及2型糖尿病小鼠血清及胰岛中mir-483-5p的表达明显升高。并且2型糖尿病小鼠胰岛中mir-483-5p与胰岛β细胞特异性标志分子的表达呈负相关,而同β细胞去分化标志分子的表达成正相关。过表达mir-483-5p促使胰岛β细胞去分化。同时,利用高脂喂养小鼠,通过胰腺原位注射技术,注射aav-mmu-mir-483-5p-sponge(mir-483-5p sponge组)或aav-mmu-nc-gfp并继续高脂喂养,通过对其代谢表型的连续监测,发现mir-483-5p sponge可以有效缓解高脂饮食诱导的小鼠糖耐量受损的症状,上调小鼠胰岛β细胞中pdx1、mafa、insulin 1和insulin2的表达,而下调去分化标志分子ngn3、oct4及nanog的表达。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。