牡丹psmyb4基因在改变植物花瓣色斑颜色和大小方面的应用
技术领域
1.本发明属于植物生物技术领域,具体涉及牡丹psmyb4基因在牡丹psmyb4基因在改变植物花瓣色斑颜色和大小方面的应用。
背景技术:
2.牡丹(paeonia suffruticosa andr.)为芍药科(paeoniaceae)芍药属(paeonia)牡丹组(section moutan)多年生木本植物,是原产于我国的重要观赏植物和药用植物,也是我国传统
‘
十大名花’之一,具有极高的观赏价值和经济价值。部分牡丹品种花瓣基部存在深色色斑,除极具观赏价值外,这一特性已成为牡丹品种识别和品种群分类的重要依据。从颜色上分类,色斑可以划分为深紫色、红色和棕色3类(李嘉珏.中国牡丹品种图志,2005,26-39);从大小上分类,可依据色斑在花瓣上的占比分为特大型、大型、中型和小型4类(赵娜,袁涛.西北牡丹品种瓣基色斑形态的初步研究.中国农学通报,2013,29(16):192-197)。
3.前人研究表明,花青素是牡丹花瓣色斑颜色和大小的决定性色素群,色斑中的花青素包括以下六种,分别为天竺葵素-3-o-葡萄糖苷(pelargonidin-3-o-glucoside,pg3g)、天竺葵素-3,5-o-二葡萄糖苷(pelargonidin-3,5-di-o-glucoside,pg3g5g)、矢车菊素-3-o-葡萄糖苷(cyanidin-3-o-glucoside,cy3g)、矢车菊素-3,5-o-二葡萄糖苷(cyanidin-3,5-di-o-glucoside,cy3g5g)、芍药花素-3-o-葡萄糖苷(peonidin-3-o-glucoside,pn3g)和芍药花素-3,5-o-二葡糖苷(peonidin-3,5-di-o-glucoside,pn3g5g)(wang ls,hashimoto f,shiraishi a,aoki n,li jj,shimizu k.phenetics in tree peony species from china by flower pigment cluster analysis.journal of plant research,2001,114:213-221;wang ls,hashimoto f,shiraishi a,aoki n,sakata y.chemical taxonomy ofthe xibei tree peony from china by floral pigmentation.journal of plant research,2004,117:47-55;zhang jj,wang ls,shu qy,liu za,li ch,zhang j,wei xl,tian d.comparison of anthocyanins in non-blotches and blotches ofthe petals ofxibei tree peony.scientia horticulturae,2007,114:104-111)。研究认为,色斑区细胞拥有远高于非斑区细胞的花青素合成能力,而这一差异又涉及内外源环境因子、结构基因和调控基因的相互作用。其中,对于调控基因介导的色斑形成,r2r3-myb家族转录因子是被研究的最为广泛的一大类(quattrocchio f,wing jf,van der woude k,mol jn,koes r.analysis of bhlh and myb domain proteins:species specific regulatory differences are caused by divergent evo lution of target anthocyanin genes.plant journal,1998,13:475-488)。目前,文心兰ogmyb1(chiou cy,yeh kw.differential expression of myb gene (ogmybl)determines color patterning in floral tissue ofoncidium gower ramsey.plant molecular biology,2008,66:379-388)、东方百合lhmyb12(yamagishi m.oriental hybrid lily sorbonne homologue of lhmyb12regulates anthocyanin biosyntheses in flower tepals and tepal spots.molecular breeding,2010,28:381-389)、日本龙胆gtmyb3
(nakatsuka t,saito m,yamada e,nishihara m.production of picotee-type flowers in japanese gentian by cres-t.plant biotechnology,2011,28:173-180)和山字草clmyb1(jiang p,rausher m.two genetic changes in cis-regulatory elements caused evolution ofpetal spot position in clarkia.nature plants,2018,4:14-22)在正向调控色斑形成中的功能被相继研究。在牡丹中仅报道了psmyb12转录因子正向调控紫色色斑在花瓣基部形成,而有关起负调作用的r2r3-myb家族转录因子如何影响牡丹花瓣色斑颜色和大小的研究一直未见报道。
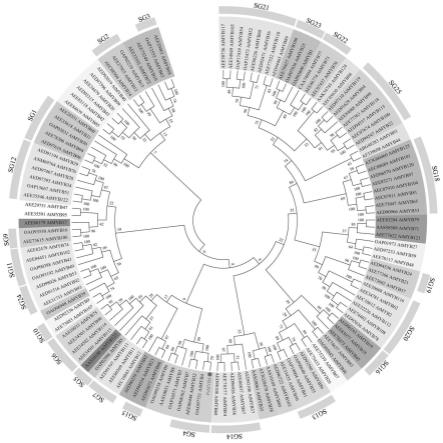
4.近期,我们从牡丹全长转录组文库中分离了1个r2r3-myb家族转录因子,将该基因的氨基酸序列与拟南芥的myb转录因子家族构建了进化树,发现该基因与拟南芥atmyb4转录抑制因子亲缘关系最近(图1),因此,我们将其命名为psmyb4。目前,牡丹psmyb4基因在改变植物花瓣色斑颜色和大小方面的应用尚未报道,因此开展psmyb4基因的深入研究不仅可以丰富该物种的生物信息学资源,拓展牡丹分子生物学研究领域,还可以为今后采用基因工程手段获取色斑颜色和大小多变的牡丹提供优良基因资源和奠定理论基础。
技术实现要素:
5.发明目的:本发明所要解决的技术问题是提供了牡丹psmyb4基因在改变植物花瓣色斑颜色和大小方面的应用。
6.技术方案:为解决上述技术问题,本发明提供了一种牡丹psmyb4基因,所述基因的核苷酸序列如seq id no.1所示。
7.本发明内容还包括所述的牡丹psmyb4基因编码的蛋白质,所述蛋白质的氨基酸序列如seq id no.2所示。
8.本发明内容还包括克隆所述的的牡丹psmyb4基因cdna全长序列的扩增引物,所述扩增引物的序列如seq id no.3和seq id no.4所示。
9.本发明内容还包括表达盒、重组载体、重组细胞或重组菌株,其含有所述的牡丹psmyb4基因。
10.其中,所述重组载体包括基因沉默载体或过表达载体。
11.本发明内容还包括所述的牡丹psmyb4基因、所述的表达盒、重组载体、重组细胞或重组菌株、所述的重组载体在改变植物花瓣色斑颜色和大小方面的应用。
12.其中,所述植物包括但不仅限于牡丹。
13.本发明内容还包括所述的重组载体的构建方法,包括以下步骤:扩增所述的牡丹psmyb4基因片段,并与双元表达载体trv2质粒连接即得。
14.本发明内容还包括获得具有较大花瓣色斑的植物的方法,使所述的psmyb4基因或所述的基因沉默载体在植物花瓣中表达。
15.本发明内容还包括鉴定所述的方法获得的具有较大花瓣色斑的植物的方法,包括以下步骤:
16.1)鉴定所述植物是否包含权利要求5所述的基因沉默载体;或,
17.2)测定所述植物是否低丰度表达权利要求2所述的牡丹psmyb4基因编码的蛋白。
18.本发明通过构建牡丹psmyb4基因的沉默载体,采用农杆菌介导法将trv2-psmyb4沉默载体转入牡丹花瓣中,待花瓣生长7天后,观察花瓣色斑表型,发现转基因牡丹花瓣色
free ddh2o;反应条件为:65℃反应5min,于冰上迅速冷却。第二轮反转录体系为:10μl第一轮反应液、4μl 5
×
primescript ii buffer、0.5μl rnase inhibitor(40u/μl)、1μl primescript ii rtase(200u/μl)、4.5μl rnase free ddh2o;反应条件为:42℃反应60min,95℃反应5min,于冰上冷却。pcr扩增体系为:12.5μl 2
×
phanta flash master mix(vazyme)、1μl forward primer(5
′‑
acttagttcttctactcgtg-3
′
(seq id no.3))、1μl reverse primer(5
′‑
ctccattatgttcactgc-3
′
(seq id no.4))、2μl第二轮pcr扩增产物、8.5μl ddh2o。反应程序:98℃预变性30s;98℃变性10s,60℃退火5s,72℃延伸5s,共35个循环;72℃延伸1min。将产物进行1%琼脂糖凝胶电泳检测,结果见图2。
34.实施例2牡丹psmyb4基因推测得到的氨基酸序列与花青素生物合成相关的myb蛋白的同源性比对
35.将牡丹与其他植物中与花青素生物合成途径相关的myb基因推测得到的氨基酸序列分别保存为txt文件,再载入dnaman5.2.2软件中进行同源性比对,如图3所示,牡丹psmyb4蛋白和其他花青素生物合成相关myb蛋白均在n端含有r2和r3保守结构域,r3保守结构域中还包含与bhlh家族转录因子互作的潜在结合位点,在psmyb4蛋白c端,存在4个保守抑制基序,分别为c1 motif、c2 motif、c3 motif和c4 motif,这些抑制基序赋予psmyb4蛋白负调节花青素生物合成的能力(图3)。
36.实施例3牡丹psmyb4基因沉默载体在牡丹花瓣中的表达
37.牡丹psmyb4基因沉默载体构建:设计含有酶切位点xba i和bamh i用于扩增psmyb4特异性序列的引物(上游引物:5
′‑
aaggttaccgaattctctagagcctaagaaatcataacccgtgtt-3
′
(seq id no.5),下游引物:5
′‑
cgtgagctcggtaccggatccttagtcccccttgtcaacacca-3
′
(seq id no.6))。pcr扩增体系:12.5μl 2
×
phanta flash master mix(vazyme)、1μl forward primer、1μl reverse primer、2μl实施例1中含psmyb4基因的cdna模板、8.5μl ddh2o。反应程序:98℃预变性30s;98℃变性10s,60℃退火5s,72℃延伸5s,共35个循环;72℃延伸1 min。反应结束后将pcr反应液进行琼脂糖凝胶电泳分析,并采用tsp601-dna凝胶回收试剂盒(tsingke)回收含酶切位点的psmyb4特异性片段。取双元表达载体trv2质粒(实验室保存)用xba i和bamhi(neb)进行双酶切,反应体系为:2.0μl 10
×
cutsmart buffer、7μl trv2质粒、0.4μl xba i、0.4μl bamh i、10.2μl ddh2o;37℃反应0.5h。双酶切产物经过琼脂糖凝胶电泳分析,采用tsp601-dna凝胶回收试剂盒(tsingke)回收纯化质粒trv2大片段。用plus one step pcr cloning kit(novoprotein)试剂盒采用同源重组的方法连接两个回收的产物,反应体系为:4.0μl 5
×
反应缓冲液、1.0μlplus重组酶、11μl trv2大片段、4μl psmyb4特异性片段;在50℃金属浴连接15min后置于冰上冷却,取5μl连接产物转化100μl trelief
tm
5α感受态细胞(tsingke),而后在lb平板上(含有kan 50mg/l)37℃过夜培养,挑取阳性单克隆扩大培养,提取质粒trv2-psmyb4,再进行双酶切与测序验证,直至trv2-psmyb4沉默载体构建成功。
38.牡丹psmyb4基因沉默载体转化牡丹花瓣:分别取5μl trv2-psmyb4沉默载体质粒、trv2空载体质粒和trv1载体质粒(实验室保存)转化农杆菌菌株gv3101(psoup-p19)(tolobio公司)感受态细胞(tolobio),而后在yeb平板上(含有rif50 mg/l和kan 50mg/l)28℃培养2d,挑取阳性单克隆于yeb液体培养基中(含有rif50 mg/l和kan 50mg/l),28℃,200rpm培养过夜。取所摇菌液2ml加入50ml含有相同抗生素的液体yeb中,在相同条件下培
养至od
600
=1.5。将摇好的菌倒入50ml离心管中,室温离心5000rpm、10min,弃上清备用。先在灭菌后的三角瓶中配置重悬液(含10mm mes、10mm无水氯化镁和0.2mm乙酰丁香酮),向离心管中加入重悬液溶解菌体,用枪打匀,调整od
600
=1.5,室温条件下将菌液置于黑暗中1-3h,使其复壮。将trv2-psmyb4沉默载体菌液和trv2空载体菌液分别与trv1载体菌液等体积混合备用。选取露色期的牡丹花瓣,取基部含色斑花瓣圆片(直径约为1.5cm),浸没在上述菌液中,抽真空8-10min侵染花瓣,侵染完成后,滤去菌液,取出花瓣,使用灭菌去离子水清洗2遍,用无菌滤纸吸干花瓣表面多余的水分,接种于1/2ms培养基[1/2ms 6.66%琼脂 100mg/l cb],4℃黑暗培养24h后,转入培养箱中进行光照培养(20℃光照16h,16℃黑暗8h),培养7天后,可获得转psmyb4基因牡丹花瓣。
[0039]
实施例4转牡丹psmyb4基因的牡丹花瓣鉴定
[0040]
pcr鉴定:采用nuclean plant genomic dna kit(cwbio)试剂盒提取牡丹花瓣dna。在此基础之上,以牡丹β-tubulin(ef608942)基因为内参(forward primer:5
′‑
aggtaagatgagcaccaaag-3
′
(seq id no.7)、reverse primer:5
′‑
ggaggaatgtcacaaacact-3
′
(seq id no.8)),同时设计trv2载体特异性引物(forward primer:5
′‑
ttgttactcaaggaagcacgat-3
′
(seq id no.9)、reverse primer:5
′‑
tcccctatggtaagacaatgag-3
′
(seq id no.10))进行pcr扩增。反应体系:12.5μl 2
×
rapid taq master mix(vazyme)、1μl forward primer、1μl reverse primer、2μl dna模板、8.5μl ddh2o。反应程序:95℃预变性3min;95℃变性15s,52℃退火15s,72℃延伸5s,共35个循环;72℃延伸5min。反应结束后将pcr反应液进行凝胶电泳检测。从图4可以看出,野生型牡丹花瓣、空载体和转牡丹psmyb4基因牡丹花瓣中均检测到单一而明亮的β-tubulin条带,而就扩增psmyb4条带而言,仅在转牡丹psmyb4基因牡丹花瓣中检测到位置正确的单一、明亮、清晰的条带,在野生型牡丹和空载体中均未检测到。
[0041]
qrt-pcr鉴定:采用minibest plant rna extraction kit(takara)试剂盒提取总rna,并采用hiscript iii rt supermix for qpcr( gdna wiper)(vazyme)试剂盒将总rna反转录成cdna,反应体系为:1.0μl rna(1000ng/μl)、4.0μl 4
×
gdnawiper mix、11.0μl rnase free dh2o;反应条件为:42℃反应2min。反应完成后,再在第一步的反应液中加入4.0μl 5
×
hiscript iii qrt supermix;反应条件为:37℃反应15min,85℃反应5s。将反转录获得的cdna用sybr qpcr supermix plus(novoprotein)试剂盒进行qrt-pcr检测。在此基础之上,以牡丹β-tubulin(ef608942)基因为内参(forward primer:5
′‑
aggtaagatgagcaccaaag-3
′
(seq id no.7)、reverse primer:5
′‑
ggaggaatgtcacaaacact-3
′
(seq id no.8)),同时设计psmyb4基因的特异性引物(forward primer:5
′‑
gaaagcccatacaaacaaag-3
′
(seq id no.11)、reverse primer:5
′‑
ttaggaagtgaccgccag-3
′
(seq id no.12))进行qrt-pcr检测。反应体系:2μl cdna、12.5μlsybr qpcr supermix plus、1 μl forward primer、1μl reverse primer、8.5μl ddh2o。反应程序:95℃预变性3min;95℃变性5s,55℃退火30s,72℃延伸30s,共40个循环;72℃延伸10min。反应结束后采用2-δδct
方法进行基因相对表达水平的分析。qrt-pcr鉴定结果表明,psmyb4在转基因牡丹花瓣中具有显著较低的表达水平(图5)。
[0042]
实施例5转牡丹psmyb4基因的牡丹花瓣色斑大小和颜色相关性指标测定
[0043]
待牡丹花瓣生长7天后,观察转基因牡丹花瓣色斑表型变化,发现与野生型牡丹花瓣相比,转psmyb4基因牡丹花瓣色斑更大,色斑颜色更深(图6),进一步测定牡丹花瓣色斑大小和颜色相关性指标,发现转psmyb4基因牡丹花瓣色斑大小较野生型牡丹花瓣增长了30.43%(图7),色斑颜色相关性指标a*值较野生型牡丹花瓣升高了14.06%(图8),总花青素含量在转psmyb4基因牡丹花瓣色斑中的积累也远高于野生型牡丹花瓣(图9),这表明沉默psmyb4基因具有改变植物花瓣色斑颜色和大小的功能。
[0044]
实施例6转牡丹psmyb4基因的牡丹花瓣色斑中花青素生物合成相关基因表达水平检测
[0045]
以牡丹花瓣为材料,采用minibest plant rna extraction kit(takara)试剂盒来提取总rna,并采用hiscript iii rt supermix for qpcr( gdna wiper)(vazyme)试剂盒将总rna反转录成cdna,反应体系为:1.0μl rna(1000ng/μl)、4.0μl 4
×
gdnawiper mix、11.0μl rnase free dh2o;反应条件为:42℃反应2min。反应完成后,再在第一步的反应液中加入4.0μl 5
×
hiscript iii qrt supermix;反应条件为:37℃反应15min,85℃反应5s。将反转录所获得的cdna采用sybr qpcr supermix plus(novoprotein)进行qrt-pcr检测,以牡丹β-tubulin(ef608942)为内参基因(β-tubulin-f:5
′‑
aggtaagatgagcaccaaag-3
′
(seq id no.7)、β-tubulin-r:5
′‑
ggaggaatgtcacaaacact-3
′
(seq id no.8)),检测花青素生物合成相关基因chs、dfr和ans的表达水平,反应体系为:2μl cdna、12.5μlsybr qpcr supermix plus、1μl forward primer、1μl reverse primer、8.5μl ddh2o。反应程序:95℃预变性3min;95℃变性5s,55℃退火30s,72℃延伸30s,共40个循环;7℃延伸10min。它们的特异型引物分别为:f3h-f:5
′‑
tcctgaatctaagtctgtgg-3
′
(seq id no.13)、f3h-r:5
′‑
cctcattagcttccctgta-3
′
(seq id no.14);fls-f:5
′‑
gctgagttcatccgacca-3
′
(seq id no.15)、fls-r:5
′‑
cccattctttgcttgcac-3
′
(seq id no.16);dfr-f:5
′‑
cgttttcacatcatctgc-3
′
(seq id no.17)、dfr-r:5
′‑
catcttggacacgaaataca-3
′
(seq id no.18);ans-f:5
′‑
caaaccagcatcaccaac-3
′
(seq id no.19)、ans-r:5
′‑
ctttccaaaagctcatcaga-3
′
(seq id no.20)3gt-f:5
′‑
ttcatcactaccgaagcc-3
′
(seq id no.21)、3gt-r:5
′‑
gaaagacgagcaacgacg-3
′
(seq id no.22)。采用公式2-δδct
法计算基因的相对表达量。从图10可以看出,与野生型牡丹相比,chs、dfr和ans在转psmyb4基因牡丹花瓣色斑中的表达水平显著较低。
[0046]
综上所述,本发明提供了一种牡丹psmyb4基因在改变植物花瓣色斑颜色和大小方面的应用,通过将构建的psmyb4基因沉默载体转化到牡丹花瓣中进行表达,发现转基因牡丹花瓣色斑较野生型明显变大,色斑颜色明显加深,色斑中总花青素含量显著增加,色斑中花青素生物合成相关基因的表达水平明显上升,创制了具有较大花瓣色斑的牡丹新种质。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。