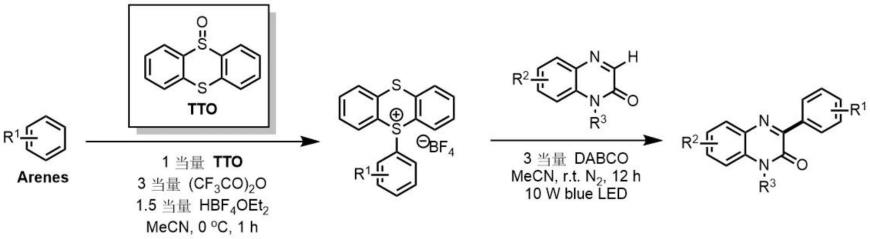
1.本发明涉及化学合成、药物化学领域,具体涉及一种芳基化喹喔啉酮类化合物的制备方法。
背景技术:
2.喹喔啉酮及其衍生物广泛存在于然产物和药物分子中,在抗炎、杀菌、抗血栓以及抗肿瘤等方面均有相当重要的药用价值。鉴于其重要的生物和药物活性,喹喔啉酮类化合物在生命医学,药学,天然产物全合成等方面有着广泛的研究前景和应用价值。其中,芳基化喹喔啉酮具有显著的生物学活性,在抗肿瘤等方面具有重要应用前景(chin.j.org.chem.2018,38,3189),但是目前芳基化喹喔啉酮的合成方法主要使用芳基重氮盐、芳基硼酸为芳基自由基前体,这些方法依赖于过渡金属和强氧化剂的使用,极大地限制了其在药物合成中的实际应用。因而,开发步骤简便、快速高效合成芳基化喹喔啉酮类化合物的制备方法具有重要的研究意义与应用前景。
技术实现要素:
3.本发明提出了一种芳基化喹喔啉酮类化合物的制备方法,该合成方法条件温和、操作简便安全,原料廉价易得,是一种环境友好的绿色合成方法,并且该方法可以成功应用于合成具有抗菌和抗肿瘤活性的潜在药物分子,为生物活性分子及药物合成提供了便捷手段。
4.实现本发明的技术方案是:
5.所述的芳基化喹喔啉酮类化合物的制备方法,其特征在于步骤如下:将喹喔啉酮类化合物和芳基锍盐溶解在乙腈中,然后加入1,4-二氮杂二环[2.2.2]辛烷(dabco),在蓝光照射下搅拌12小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,经柱层析分离得到芳基化喹喔啉酮类化合物。
[0006]
所述的芳基锍盐结构式如下:
[0007][0008]
其中,r1为甲基、氟、氯、溴、环丙基、苄基、苯基、甲氧基等;根据文献报道的方法制备(nature 2019,567,223)。
[0009]
所述制备的芳基化喹喔啉酮类化合物结构式如下:
[0010][0011]
其中,r1为甲基、氟、氯、溴、环丙基、苄基、苯基、甲氧基等;r2为氟、氯、溴;r3为烷基、烷基酯、烯丙基、炔丙基、苄基等。
[0012]
所述喹喔啉酮类化合物的结构式如下:
[0013][0014]
其中,r2为氟、氯、溴;r3为烷基、烷基酯、烯丙基、炔丙基、苄基等。
[0015]
所述溶剂为乙腈。所述喹喔啉酮类化合物、芳基噻嗯盐和dabco的摩尔比为1:2:3。
[0016]
本发明所述制备方法的反应通式如下:
[0017][0018]
本发明的有益效果是:本发明提供了一种芳基化喹喔啉酮类化合物的制备方法,所述方法条件温和,原料廉价易得,操作简便、产率高、无金属及氧化剂参与,可以成功用于合成具有抗菌和抗肿瘤活性的潜在药物分子,为生物活性分子及药物合成提供了便捷手段。
附图说明
[0019]
图1是实施例11中目标产物的体外抗肿瘤活性试验结果图。具体测试方法如下:体外抗ramos细胞增殖试验采用的是celltiter-glo(promega,美国)试验方法。使用培养基将ramos细胞混悬液稀释至合适的浓度后,取95μl加入到96孔板中。向其中加入5μl不同浓度的待测化合物后,培养板在37℃、体积分数5%co2中孵育72小时。取出培养板,放置至室温开始检测。每孔中加入20μl celltiter-glo试剂,在摇床上混合2分钟诱导细胞裂解。室温孵育10 分钟来稳定荧光信号。使用多功能酶标仪记录荧光强度。根据公式和空白对照组的荧光强度算出细胞活力,进而计算出目标化合物的ic50。
具体实施方式
[0020]
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,
本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0021]
实施例1
[0022]
在8ml反应瓶中加入n-甲基-2(1h)喹喔啉酮(0.1mmol),对甲苯基噻嗯锍盐(0.2mmol),dabco(0.3mmol),于2ml乙腈溶液中蓝光照射下搅拌12小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,剩余物用硅胶柱层析分离(石油醚: 乙酸乙酯=3:1),得终产物的产率为86%。
[0023]
具体结果如下:
[0024][0025]
yellow solid(21.5mg,86%);1h nmr(400mhz,chloroform-d)δ8.24(d,j=8.2 hz,2h),7.96
–
7.90(m,1h),7.59
–
7.51(m,1h),7.38
–
7.26(m,4h),3.76(s,3h), 2.42(s,3h);
13
c nmr(101mhz,chloroform-d)δ154.8,154.0,140.6,133.4,133.3, 133.2,130.3,130.0,129.5,128.8,123.7,113.5,29.3,21.5。
[0026]
实施例2
[0027]
在8ml反应瓶中加入n-乙基-2(1h)喹喔啉酮(0.1mmol),对甲苯基噻嗯锍盐 (0.2mmol),dabco(0.3mmol),于2ml乙腈溶液中蓝光照射下搅拌12小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,剩余物用硅胶柱层析分离(石油醚: 乙酸乙酯=3:1),得终产物的产率为85%。
[0028]
具体结果如下:
[0029][0030]
light yellow solid(22.5mg,85%);1h nmr(400mhz,chloroform-d)δ8.25 (d,j=8.2hz,2h),7.95(dd,j=8.2,1.4hz,1h),7.55(td,j=7.8,7.2,1.4hz,1h), 7.38
–
7.32(m,2h),7.29(d,j=8.2hz,2h),4.39(q,j=7.2hz,2h),2.42(s,3h), 1.42(t,j=7.2hz,3h).
13
c nmr(101mhz,chloroform-d)δ154.3,154.0,140.6, 133.5,133.3,132.2,130.6,130.0,129.6,128.8,123.5,113.4,37.6,21.5,12.4。
[0031]
实施例3
[0032]
在8ml反应瓶中加入n-烯丙基-2(1h)喹喔啉酮(0.1mmol),对甲苯基噻嗯锍盐(0.2mmol),dabco(0.3mmol),于2ml乙腈溶液中蓝光照射下搅拌12小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,剩余物用硅胶柱层析分离(石油醚: 乙酸乙酯=3:1),得终产物的产率为85%。
[0033]
具体结果如下:
[0034][0035]
yellowsolid(20.5mg,74%);m.p.107.3
–
108.05℃;1hnmr(400mhz,chloroform-d)δ8.27(d,j=8.2hz,2h),7.98
–
7.91(m,1h),7.57
–
7.47(m,1h),7.32(dt,j=20.5,7.7hz,4h),5.98(m,j=15.6,10.3,5.1hz,1h),5.25(dd,j=27.0,13.9hz,2h),4.97(d,j=5.1hz,2h),2.42(s,3h).
13
cnmr(101mhz,chloroform-d)δ154.3,154.0,140.7,133.3,133.2,132.5,130.7,130.4,129.9,129.6,128.8,123.6,118.1,114.0,44.7,21.5.hrms(esi-tof)m/z:[m na]
calcdforc
18h16
n2nao,299.1155;found:299.1157。
[0036]
实施例4
[0037]
在8ml反应瓶中加入n-炔丙基-2(1h)喹喔啉酮(0.1mmol),对甲苯基噻嗯锍盐(0.2mmol),dabco(0.3mmol),于2ml乙腈溶液中蓝光照射下搅拌12小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,剩余物用硅胶柱层析分离(石油醚:乙酸乙酯=3:1),得终产物的产率为70%。
[0038]
具体结果如下:
[0039][0040]
lightyellowsolid(19.2mg,70%);m.p.170.4
–
171.5℃;1hnmr(400mhz,chloroform-d)δ8.25(d,j=8.3hz,2h),7.94(dd,j=8.0,1.4hz,1h),7.58(m,j=8.6,7.3,1.5hz,1h),7.49
–
7.45(m,1h),7.41
–
7.36(m,1h),7.28(d,j=8.1hz,2h),5.11(d,j=2.5hz,2h),2.42(s,3h),2.30(t,j=2.5hz,1h).
13
cnmr(101mhz,chloroform-d)δ153.83,153.78,140.9,133.3,133.0,131.8,130.5,130.2,129.6,128.9,124.1,114.0,73.1,31.7,21.6.hrms(esi-tof)m/z:[m na]
calcdforc
18h14
n2nao,297.0998;found:297.1003.
[0041]
实施例5
[0042]
在8ml反应瓶中加入n-甲基-2(1h)喹喔啉酮(0.1mmol),环丙基苯基噻嗯锍盐(0.2mmol),dabco(0.3mmol),于2ml乙腈溶液中蓝光照射下搅拌12小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,剩余物用硅胶柱层析分离(石油醚:乙酸乙酯=3:1),得终产物的产率为83%。
[0043]
具体结果如下:
[0044]
[0045]
yellowsolid(22.9mg,83%);m.p.112.9
–
113.6℃;1hnmr(400mhz,chloroform-d)δ8.27(d,j=8.4hz,2h),7.95(dd,j=8.0,1.3hz,1h),7.60
–
7.55(m,1h),7.41
–
7.33(m,2h),7.19(d,j=8.4hz,2h),3.79(s,3h),1.99(m,j=13.4,8.5,5.1hz,1h),1.08
–
1.02(m,2h),0.83
–
0.78(m,2h).
13
cnmr(101mhz,chloroform-d)δ154.8,153.9,146.9,133.3,133.2,130.3,130.0,129.5,125.2,123.6,113.5,29.3,15.6,9.8.hrms(esi-tof)m/z:[m na]
calcdforc
18h16
n2nao,299.1155;found:299.1159.
[0046]
实施例6
[0047]
在8ml反应瓶中加入n-甲基-2(1h)喹喔啉酮(0.1mmol),联苯基噻嗯锍盐(0.2mmol),dabco(0.3mmol),于2ml乙腈溶液中蓝光照射下搅拌12小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,剩余物用硅胶柱层析分离(石油醚:乙酸乙酯=3:1),得终产物的产率为78%。
[0048]
具体结果如下:
[0049][0050]
yellowsolid(24.5mg,78%);1hnmr(400mhz,chloroform-d)δ8.49
–
8.45(m,2h),7.99(dd,j=8.0,1.3hz,1h),7.77
–
7.73(m,2h),7.72
–
7.68(m,2h),7.62
–
7.57(m,1h),7.50(t,j=7.5hz,2h),7.43
–
7.35(m,3h),3.82(s,3h).
13
cnmr(101mhz,chloroform-d)δ154.8,153.6,143.0,140.6,135.0,133.4,133.2,130.5,130.3,130.0,128.8,127.7,127.2,126.8,123.8,113.6,29.3.
[0051]
实施例7
[0052]
在8ml反应瓶中加入n-甲基-2(1h)喹喔啉酮(0.1mmol),对甲氧基苯基噻嗯锍盐(0.2mmol),dabco(0.3mmol),于2ml乙腈溶液中蓝光照射下搅拌12小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,剩余物用硅胶柱层析分离(石油醚:乙酸乙酯=3:1),得终产物的产率为94%。
[0053]
具体结果如下:
[0054][0055]
lightyellowsolid(25.1mg,94%);1hnmr(400mhz,chloroform-d)δ8.42(d,j=8.9hz,2h),7.96
–
7.90(m,1h),7.58
–
7.52(m,1h),7.40
–
7.31(m,2h),7.02(d,j=8.9hz,2h),3.90(s,3h),3.78(s,3h).
13
cnmr(101mhz,chloroform-d)δ161.5,154.8,153.2,133.2,133.1,131.4,130.1,129.7,128.8,123.6,113.49,113.47,55.4,29.3.
[0056]
实施例8
[0057]
在8ml反应瓶中加入n-甲基-2(1h)喹喔啉酮(0.1mmol),对氟苯基噻嗯锍盐(0.2mmol),dabco(0.3mmol),于2ml乙腈溶液中蓝光照射下搅拌12小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,剩余物用硅胶柱层析分离(石油醚:乙酸乙酯=3:1),得终产物的
产率为63%。
[0058]
具体结果如下:
[0059][0060]
yellow solid(16.0mg,63%);1h nmr(400mhz,chloroform-d)δ8.47
–
8.38 (m,2h),7.95(dd,j=8.0,1.3hz,1h),7.59(ddd,j=8.6,7.4,1.5hz,1h),7.43
–ꢀ
7.33(m,2h),7.21
–
7.14(m,2h),3.79(s,3h).
13
c nmr(101mhz,chloroform-d) δ164.2(d,j=251.0hz),154.7,152.7,133.3,133.0,132.2(d,j=3.2hz),131.8(d, j=8.5hz),130.4(d,j=2.7hz),123.8,115.2,114.9,113.6,29.3.
19
f nmr(376 mhz,chloroform-d)δ-110.04.
[0061]
实施例9
[0062]
在8ml反应瓶中加入n-甲基-2(1h)喹喔啉酮(0.1mmol),对三氟甲基苯基噻嗯锍盐(0.2mmol),dabco(0.3mmol),于2ml乙腈溶液中蓝光照射下搅拌12 小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,剩余物用硅胶柱层析分离(石油醚:乙酸乙酯=3:1),得终产物的产率为76%。
[0063]
具体结果如下:
[0064][0065]
yellow solid(23.1mg,76%);1h nmr(400mhz,chloroform-d)δ8.48(d,j= 8.2hz,2h),7.96(d,j=8.0hz,1h),7.74(d,j=8.3hz,2h),7.61(t,j=7.8hz, 1h),7.44
–
7.32(m,2h),3.77(s,3h).
13
c nmr(101mhz,chloroform-d)δ154.5, 152.4,139.3(d,j=1.5hz),133.5,132.9,131.7(q,j=32.3hz),131.0,130.7,129.9, 124.9(q,j=3.9hz),124.1(q,j=272.3hz),123.9,113.7,29.3.
19
f nmr(376 mhz,chloroform-d)δ-62.80.
[0066]
实施例10
[0067]
在8ml反应瓶中加入(对氯苯氨羰甲基)喹喔啉酮(0.1mmol),苯基噻嗯锍盐(0.2mmol),dabco(0.3mmol),于2ml乙腈溶液中蓝光照射下搅拌12小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,剩余物用硅胶柱层析分离(石油醚: 乙酸乙酯=3:1),得到具有抗肿瘤活性产物的产率为72%。
[0068]
具体结果如下:
[0069][0070]
yellowsolid(27.9mg,72%);1hnmr(400mhz,dmso-d6)δ10.63(s,1h),8.30
–
8.24(m,2h),7.95(dd,j=8.0,1.5hz,1h),7.67
–
7.58(m,4h),7.55
–
7.49(m,3h),7.46
–
7.42(m,1h),7.41
–
7.37(m,2h),5.22(s,2h).
13
cnmr(101mhz,dmso-d6)δ165.5,154.4,153.3,138.0,136.1,133.6,132.8,131.2,130.8,130.2,129.8,129.2,128.4,127.6,124.2,121.2,115.2,46.1.
[0071]
实施例11
[0072]
在8ml反应瓶中加入喹喔啉酮(0.1mmol),相应的芳基噻嗯锍盐(0.2mmol),dabco(0.3mmol),于2ml乙腈溶液中蓝光照射下搅拌12小时,反应结束后,经萃取,干燥,旋蒸除去溶剂,剩余物用硅胶柱层析分离(石油醚:乙酸乙酯=3:1),得到具有抗肿瘤活性产物的产率为72%。
[0073]
具体结果如下:
[0074][0075]
colorlessoil(37.6mg,74%);1hnmr(400mhz,chloroform-d)δ8.25
–
8.16(m,1h),8.07(dd,j=8.6,2.0hz,1h),7.88(d,j=7.9hz,1h),7.50(t,j=7.8hz,1h),7.38
–
7.26(m,7h),6.69(dd,j=16.0,8.7hz,1h),5.33(dd,j=8.0,4.4hz,1h),3.81
–
3.64(m,5h),3.16
–
3.03(m,3h),2.46(d,j=3.7hz,3h),2.37
–
2.23(m,2h).
13
cnmr(101mhz,chloroform-d)δ157.5,157.3,157.1,157.0,156.73,156.68,154.7,153.34,153.28,140.6,140.2,133.12,133.07,132.11,132.07,130.0,129.74,129.70,128.9,128.83,128.79,128.7,128.6,128.1,128.0,126.53,126.50,125.6,125.5,123.6,123.58,118.0,117.9,115.1,115.0,113.5,112.1,112.0,47.1,46.59,46.56,37.5,35.60,35.56,35.49,35.41,35.38,34.8,29.2,16.7,16.6.
19
fnmr(376mhz,chloroform-d)δ-68.94,-69.85.hrms(esi-tof)m/z:[m h]
calcdforc
28h26
f3n3nao3,532.1818;found:532.1816.
[0076]
经初步测试,该化合物对ramos肿瘤细胞表现出一定的抗肿瘤活性,ic
50
=10.242μmol/l,表明该方法在开发新型生物活性分子方面具有一定的潜力。
[0077]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。