一种s-烟碱的合成方法
技术领域
1.本发明属于生物化工技术领域,具体涉及一种s-烟碱的合成方法。
背景技术:
2.烟碱又称尼古丁,通常存在于天然烟叶中。高纯度的尼古丁是具有重要潜在价值的有机中间体。在医药领域,可以用于治疗帕金森综合征、阿尔茨海默病、多动症、关节炎,还可帮助提高记忆、缓解抑郁;在农业上,烟碱被用做杀虫剂和除草剂,是一种高效低毒的广谱农药;此外,烟碱还可用于合成医药保健功能蛋白,也是日用化妆品的重要原料(nature.2004,430,980;br.j.addict.1991,86,571-575)。因此具有极大的市场需求量。
3.烟碱具有光学活性,存在r-烟碱和s-烟碱两种对映异构体。公认的是s-烟碱([(s)-3-(1-甲基吡咯烷-2-基)吡啶])的活性高于r-烟碱。因此,制备具有高水平对映异构体纯度的s-烟碱迫切需要。s-烟碱可通过从烟草植株中提取获得,但此种方法不仅受到原材料、气候等多方面因素的影响,同时由于存在相关的生物碱杂质,其化学纯度通常低于95%,难以满足市场对其高纯度的要求。
[0004]
此外,s-烟碱可通过合成方法获得,现有技术合成s-烟碱通常制备r-烟碱和s-烟碱外消旋混合物后拆分获得。如专利cn111511726a报道了外消旋的烟碱的合成,并利用l-dbta进行手性拆分得到s-烟碱;但该方法需要对混合物进行拆分,工艺复杂,反应条件苛刻,得到的产物收率低。现有技术中还存在使用酶作为生物催化剂合成s-烟碱,如专利cn112409327a报道了一种高光学纯度烟碱的制备方法,该方法先采用烟酸酯和乙烯基吡咯烷酮制备得到麦斯明,麦斯明在生物酶体系下(包括葡萄糖脱氢酶和亚胺还原酶)催化还原得到具有高光学纯度的中间体-降烟碱,最后发生氨甲基化反应得到s-烟碱,但该方法存在使用的酶复杂、种类多,且酶使用后无法重复利用的问题。专利cn113272289a公开了利用亚胺还原酶还原麦斯明生成s-降烟碱,将s-降烟碱进行甲基化形成s-烟碱,但该方法同样存在需要制备两种酶且酶无法重复使用的问题。
[0005]
已知几种关于烟碱的制备方法仍未见用于商业化生产,以致可商业化制备高纯度的s-烟碱的合成方法弥足珍贵。因此,建立高光学纯度的s-烟碱的制备方法是一项重要而又极具挑战性的课题,可以填补市场对于s-烟碱需求这一空白。
技术实现要素:
[0006]
本发明的目的是提供一种s-烟碱的合成方法,其采用化学合成法结合生物酶催化技术,实现高纯度、高立体选择性的s-烟碱的制备。
[0007]
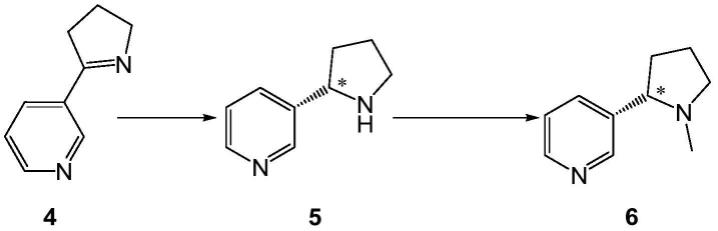
本发明提供了一种s-烟碱的合成方法,它包括如下步骤:
[0008][0009]
(1)以麦斯明4为原料,在含有辅酶循环体系的溶剂中,利用亚胺还原酶与辅酶循环体系用酶连接形成的融合酶为生物催化剂,反应制备得到化合物5s-降烟碱;所述辅酶循环体系由辅酶和辅底物组成;
[0010]
(2)化合物5与甲基化试剂通过甲基化反应得到化合物6s-烟碱。
[0011]
进一步地,
[0012]
步骤(1)中,所述辅酶为nadp
;
[0013]
和/或,步骤(1)中,所述辅底物为葡萄糖、甲酸钠、甲酸铵或异丙醇;
[0014]
和/或,步骤(1)中,所述溶剂为缓冲液;
[0015]
和/或,步骤(1)中,还包括助溶剂;
[0016]
和/或,步骤(2)中,所述甲基化试剂为碘甲烷、硫酸二甲酯或碳酸二甲酯;
[0017]
优选地,步骤(1)中,所述辅酶循环体系由nadp
和异丙醇、或nadp
和葡萄糖、或nadp
和甲酸钠、或nadp
和甲酸铵组成;
[0018]
和/或,步骤(1)中,所述缓冲液为磷酸盐缓冲溶液、tris盐酸盐缓冲溶液、碳酸氢盐缓冲溶液任意一种或多种;
[0019]
和/或,步骤(1)中,所述助溶剂为甲醇、乙醇、异丙醇或二甲亚砜;
[0020]
和/或,步骤(2)中,所述甲基化试剂为碘甲烷或硫酸二甲酯;
[0021]
更优选地,步骤(1)中,所述辅酶循环体系由nadp
和葡萄糖组成;
[0022]
和/或,步骤(1)中,所述缓冲液为磷酸盐缓冲溶液,ph为6.0~10.0;
[0023]
和/或,步骤(1)中,所述助溶剂为浓度为10%的甲醇;
[0024]
进一步优选地,步骤(1)中,所述缓冲液为磷酸盐缓冲溶液,ph为7.0。
[0025]
进一步地,
[0026]
步骤(1)中,所述亚胺还原酶的氨基酸序列如seq id.no1.所示;
[0027]
和/或,步骤(1)中,所述辅酶循环体系用酶为醇脱氢酶、葡萄糖脱氢酶、甲酸脱氢酶中的任意一种;
[0028]
和/或,步骤(1)中,所述亚胺还原酶与辅酶循环体系用酶通过如seq id.no3.所示的氨基酸序列连接;
[0029]
优选地,步骤(1)中,所述辅酶循环体系用酶为异丙醇脱氢酶、葡萄糖脱氢酶、甲酸脱氢酶中的任意一种;
[0030]
更优选地,步骤(1)中,所述辅酶循环体系用酶为葡萄糖脱氢酶,所述葡萄糖脱氢酶的氨基酸序列如seq id.no2.所示;
[0031]
进一步优选地,步骤(1)中,所述融合酶的氨基酸序列如seq id.no4.所示,核苷酸序列如seq id.no5.所示。
[0032]
进一步地,步骤(1)中,所述融合酶为固定化融合酶;
[0033]
优选地,所述固定化融合酶为融合酶和树脂共价结合而得;
[0034]
更优选地,所述树脂为环氧树脂;
[0035]
进一步优选地,所述环氧树脂为lxte-603、lxte-604或es-108。
[0036]
进一步地,
[0037]
步骤(1)中,所述麦斯明4与辅底物的当量比为1:1~5;和/或,所述麦斯明4与辅酶的摩尔比为30:0.01~0.1;和/或,所述麦斯明4与融合酶的摩尔质量比为30mmol:1~10g;
[0038]
和/或,步骤(2)中,所述化合物5与甲基化试剂的当量比为1:1~5;
[0039]
优选地,步骤(1)中,所述麦斯明4与辅底物的当量比为1:2;和/或,所述麦斯明4与辅酶的摩尔比为30:0.04;和/或,所述麦斯明4与融合酶的摩尔质量比为30mmol:4g。
[0040]
进一步地,
[0041]
步骤(1)中,所述反应温度为20℃~40℃,和/或,所述反应时间为8~30小时;
[0042]
和/或,步骤(1)中,所述反应后还包括如下纯化方法:将反应液ph调至12~13终止反应,离心取上清液,用乙酸乙酯萃取,即得;
[0043]
和/或,步骤(2)中,所述甲基化反应的温度为20℃~110℃,反应时间为1~3小时。
[0044]
进一步地,所述麦斯明4的制备方法包括如下步骤:
[0045][0046]
采用一锅反应,首先在酯化条件下,烟酸1与醇类化合物2发生反应;随后加入吡咯烷酮化合物,添加碱性物质后反应;继续加入酸性化合物反应,合成麦斯明4;所述反应在溶剂中进行;
[0047]
其中,n为0或1。
[0048]
进一步地,
[0049]
所述酯化条件中使用的酯化剂为二环己基碳二亚胺、4-二甲氨基吡啶或浓硫酸;
[0050]
和/或,所述醇类化合物为甲醇或乙醇;
[0051]
和/或,所述碱性物质为氢氧化钠、氢化钠或碳酸钾;
[0052]
和/或,所述酸性化合物为盐酸、三氟乙酸、对甲苯磺酸;
[0053]
和/或,所述溶剂为苯、甲苯、二氯甲烷、四氢呋喃;
[0054]
优选地,所述酯化剂为浓硫酸、二环己基碳二亚胺;
[0055]
和/或,所述碱性物质为氢化钠;
[0056]
和/或,所述酸性化合物为盐酸;
[0057]
和/或,所述溶剂为甲苯、二氯甲烷;
[0058]
更优选地,所述盐酸浓度为5m~12m。
[0059]
进一步地,
[0060]
烟酸1、醇类化合物2、酯化剂、吡咯烷酮化合物、碱性物质、酸性化合物的摩尔比为:1:1~5:0.2~3:1~5:1.2~3:0.1~1。
[0061]
进一步地,
[0062]
所述酯化反应的温度为40℃~110℃,反应时间为5~10小时;
[0063]
和/或,所述添加碱性物质后反应的温度为70℃~110℃,反应时间为5~10小时;
[0064]
和/或,所述加入酸性化合物反应的温度为70℃~110℃,反应时间为5~10小时;
[0065]
和/或,所述反应后还包括如下纯化方法:将反应液ph调至9~10,乙酸乙酯萃取,旋蒸后经柱层析分离纯化得到麦斯明4。
[0066]
融合酶指一条多肽链上含有2种或2种以上催化活性的酶。本发明中融合酶ired_pa-gdh含有亚胺还原酶和辅酶循环体系用酶(优选为葡萄糖脱氢酶)。现有技术中制备融合酶并非是将随意两个酶组合就可以制备,因为两个酶融合后的表达和酶活可能会受影响,反而丧失酶的功效。本发明融合酶ired_pa-gdh是通过不断研究制备得到。
[0067]
本发明中辅酶循环体系由辅酶和辅底物组合而成,辅酶为nadp
,辅底物为葡萄糖、甲酸钠、甲酸铵或异丙醇中一种。本发明中辅酶循环体系用酶是葡萄糖脱氢酶、甲酸脱氢酶、异丙醇脱氢酶中一种,作用是利用与辅底物反应供氢给nadp
形成nadph,形成亚胺还原酶可利用的还原力。
[0068]
本发明通过长期深入细致的研究,发现一种s-烟碱的制备方法,与现有的工艺路线相比较,本发明具有以下有益效果:
[0069]
(1)本发明是化学法与生物酶法协同作用合成s-烟碱,成本低廉;
[0070]
(2)可一锅法制备麦斯明;
[0071]
(3)生物酶法可高效实现中间体的定向氢化还原,制备s-烟碱,其手性纯度高达99%;
[0072]
(4)所用的酶催化剂易得或易制备,水相反应条件温和,产物分离提纯方便;
[0073]
(5)固定化酶可重复使用,成本低廉,具有良好的应用前景和可期的经济效益。
[0074]
综上,本发明提供了一种s-烟碱的合成方法,该合成方法采用固定化融合酶,利用化学法与生物酶法协同作用合成s-烟碱,其原料易得,操作简便,反应条件温和,产物分离提纯方便,成本低廉;同时,其合成的s-烟碱收率高,手性纯度高达99%,立体选择性可控,合成产物质量优异。该合成方法具备规模生产的可能性,有望工业化、商业化生产,具有良好的应用前景和可期的经济效益。
[0075]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0076]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
[0077]
图1是融合酶pet 28a-pa-gdh表达质粒的质粒图谱。
[0078]
图2是融合酶pa-gdh的sds-page图。
具体实施方式
[0079]
除另有说明外,本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
[0080]
实施例1、融合酶ired_pa-gdh的制备
[0081]
(1)融合酶ired_pa-gdh的设计
[0082]
在亚胺还原酶(氨基酸序列如seq id.no1.所示,来源于paenibacillus sp.ib182493,ncbi数据库中的编码为wp_190863553.1)的基础上,通过linker(氨基酸序列如seq id.no3.所示)连接葡萄糖脱氢酶(氨基酸序列如seq id.no2.所示),从而形成相应的融合酶(氨基酸序列如seq id.no4.),融合酶的基因核苷酸序列如seq id.no5.所示。
[0083]
seq id.no1.:
[0084]
mennnrsgneqngnsrpigeetvakqdsrmpvtiigmgpmeralagafvknghlatvwnrsagktdalvkegavladtiggavaasplvivcvldydavqsilapvgselqgrtlvnltadtpararemaawaaghgidyldgaimtptpsigtpaasilysgpesvyrnvqsalsslggtasylgsdpgraaahdvalldlfwtsmsgyvhalalaasehisakdfavhargiaailpdiitgiadeadegrypgdasnlvsaeagmahiihaaehhgidasvlsaaralarraideglgedgfgrlaellsrrsga
[0085]
seq id.no2.:
[0086]
mypdlkgkvvaitgaasglgkamairfgkeqakvvinyysnkqdpnevkeevikaggeavvvqgdvtkeedvknivqtaikefgtldiminnaglenpvpshemplkdwdkvigtnltgaflgsreaikyfvendikgnvinmssvheripwplfvhyaaskggiklmsetlaleyapkgirvnnigpgaintpinaekfadpkqkadvesmipmgyigepeeiaavavwlaskessyvtgitlfadggmtkypafqagrg
[0087]
seq id.no3.:
[0088]
gsggggsggggsggggsggggsggggssssskapppslpspsrlpgpsdtpilpq
[0089]
seq id.no4.:
[0090]
mennnrsgneqngnsrpigeetvakqdsrmpvtiigmgpmeralagafvknghlatvwnrsagktdalvkegavladtiggavaasplvivcvldydavqsilapvgselqgrtlvnltadtpararemaawaaghgidyldgaimtptpsigtpaasilysgpesvyrnvqsalsslggtasylgsdpgraaahdvalldlfwtsmsgyvhalalaasehisakdfavhargiaailpdiitgiadeadegrypgdasnlvsaeagmahiihaaehhgidasvlsaaralarraideglgedgfgrlaellsrrsgagsggggsggggsggggsggggsggggssssskapppslpspsrlpgpsdtpilpqmypdlkgkvvaitgaasglgkamairfgkeqakvvinyysnkqdpnevkeevikaggeavvvqgdvtkeedvknivqtaikefgtldiminnaglenpvpshemplkdwdkvigtnltgaflgsreaikyfvendikgnvinmssvheripwplfvhyaaskggiklmsetlaleyapkgirvnnigpgaintpinaekfadpkqkadvesmipmgyigepeeiaavavwlaskessyvtgitlfadggmtkypafqagrg
[0091]
seq id.no5.:
[0092]
atggagaataacaatcgttctggtaatgaacagaacggtaactctcgtccgatcggcgaagaaaccgtagccaaacaggatagccgtatgccggtaacgatcatcggcatgggtcctatggagcgtgcgctggcgggcgcgttcgttaaaaatggtcacctggcgaccgtctggaaccgttccgccggtaagactgatgctctggtcaaagagggcgcagtactggccgacactatcggcggtgcggttgccgcgtccccactggtgatcgtatgtgtgctggattacgacgccgttcagtccattctggcaccggttggcagcgaactgcagggtcgtaccctggtaaacctgaccgcggacactccagcgcgtgctcgcgaaatggctgcatgggcggcgggccacggtatcgattatctggatggtgcaatcatgaccccgaccccgtcta
ttggtaccccagcagcatccattctgtacagcggcccggaatccgtataccgcaacgtgcagtccgctctgagcagcctgggcggcactgcgagctacctgggttccgacccgggccgtgccgctgcgcacgacgttgctctgctggatctgttctggacttccatgagcggctacgttcacgctctggcactggcggccagcgaacatatctctgccaaagatttcgcagtccacgcgcgtggtattgctgcaatcctgccagatattattaccggcatcgcagatgaagccgacgaaggtcgttaccctggtgatgcctctaatctggtttctgcagaagcgggtatggctcatatcattcacgcggcggaacatcacggcattgacgcgtctgtgctgagcgctgctcgtgcgctggctcgtcgcgcaattgacgaaggcctgggcgaagatggctttggccgtctggcggaactgctgtctcgtcgtagcggtgcgggttccggtggcggcggctctggtggtggcggctccggcggtggcggttctggtggcggcggctccggcggcggtggttccagctcctctagcaaagcaccgccgccgagcctgccgtccccgtctcgtctgccaggcccttccgacactccgattctgccacaaatgtacccggacctgaaaggcaaagtggttgcgatcaccggcgcggcctccggtctgggtaaagcaatggccatccgtttcggtaaagaacaggcaaaagtggtaattaactactatagcaacaaacaggacccaaacgaagtgaaagaagaagtcatcaaagcaggtggcgaagctgttgttgtacagggtgacgttactaaagaagaagacgtaaaaaacattgttcagaccgcgatcaaagaattcggtactctggatatcatgatcaacaacgcaggcctggaaaacccagttccgtctcacgaaatgccgctgaaagattgggacaaagtgatcggtacgaacctgaccggtgcattcctgggctctcgtgaagcgatcaagtattttgtggaaaacgatatcaaaggtaacgtcatcaacatgagctctgttcatgaacgcattccgtggccgctgttcgttcactacgctgcatctaaaggcggtatcaagctgatgtccgaaaccctggcgctggaatacgccccgaaaggcatccgtgtgaacaacattggtccgggcgctattaacaccccgattaatgcggagaaattcgctgacccgaaacagaaagctgatgttgaatccatgattccgatgggctacattggtgaaccggaagaaattgcggctgtagcagtttggctggcttctaaagaaagctcttacgttaccggtatcaccctgttcgctgatggtggtatgactaaatatccggcatttcaggcgggtcgcggttaa
[0093]
(2)制备融合酶的基因工程菌
[0094]
将融合酶的核苷酸序列通过两端酶切位点nde i和ecor i与载体pet28a连接,构成双酶融合表达质粒pet 28a-pa-gdh,质粒图谱如图1所示,转入e coli bl 21进行筛选、接种,培养得菌体。
[0095]
(3)融合酶的制备
[0096]
挑取步骤(2)长势良好的单菌落接种至7ml含相应抗生素的种子培养基中,过夜培养作为种子液,按照2%的接种量接种至含400ml发酵培养基的1l锥形瓶中(含相应抗生素),在37℃,200rpm的摇床上培养至od600=0.6-0.8左右,加入iptg(终浓度为0.1mm)在20℃,200rpm条件下诱导18-20h。培养结束后,8000rpm离心5min收集菌体,然后使用40ml的浓度为0.85%的生理盐水清洗菌体以除去多余的培养基,收集菌体-20℃冰箱保存,即为湿菌体,湿菌体冻干可得酶粉。将湿菌体用100mm ph 7.0的kpb缓冲液重悬后进行超声破碎,离心得到上清液,即得到融合酶ired_pa-gdh的粗酶液。
[0097]
将表达的粗酶液进行sds-page蛋白条带鉴定。图2所示为ired_pa-gdh融合酶的蛋白电泳图,其中泳道m为蛋白marker,泳道1为全细胞破碎后的总蛋白,泳道2为全细胞破碎离心后的上清液,其中融合酶的理论分子量为65.42kda,其氨基酸序列如seq id.no4.所示。所述酶为可溶蛋白,且分子量与相应的理论分子量接近。
[0098]
实施例2、固定化融合酶ired_pa-gdh的制备
[0099]
取15g融合酶ired_pa-gdh发酵液离心的菌泥,加150ml100 mm kpb缓冲液(ph7.0)混匀高压均质破碎,离心收集上清液酶液,加入30g k2hpo4·
3h2o和3g kh2po4,搅拌溶解,加入10g树脂(树脂型号具体见下表1,树脂lx系列采购于西安蓝晓科技新材料股份有限公司,
树脂es系列采购于天津南开合成科技有限公司)进行固定,在25℃,200rpm摇床固定20-25h,抽滤,去离子水洗涤,抽滤得到固定化酶。以麦斯明为底物,检测固定化酶的活力,酶活检测方法为:
[0100]
先配制底物溶液:称取2g麦斯明、20mg nadp
、2eq葡萄糖于250ml烧杯,加入70ml 100mm的kpb缓冲液(ph7.0),搅拌溶解,并用该缓冲溶液定容至100ml,待用。
[0101]
量取20ml配制的底物于50ml三角瓶,于30℃、200rpm的摇床保温20min,称取0.8g待测固定化酶加入预热的底物溶液中,30℃,200rpm摇床反应30min,取上清液用10m naoh调ph至12-13终止反应后,离心,hplc检测,计算固定化酶的活力,检测结果如下表1所示。
[0102]
表1.树脂型号及固定化酶活力检测结果
[0103]
树脂型号固定化酶活力(u/g)lxte-600125.04lxte-603200.12lxte-604289.67lxte-609189.28lxte-701187.37lxte-706205.34lxte-707224.49es-1256.48es-103b189.57es-108300.52
[0104]
根据表1中不同树脂制备的固定化酶活力检测结果,选取lxte-604和es-108型号树脂制备的固定化融合酶进行催化反应。
[0105]
实施例3、固定化融合酶催化合成s-降烟碱
[0106]
20ml 100mm kpb缓冲液(ph 7.0),100mg/ml固定化融合酶ired_pa-gdh(es-108型号或lxte-604号树脂制备的固定化酶),2eq葡萄糖,0.1~0.5mg/ml nadp
,底物麦斯明浓度100mg/ml,30℃反应,反应过程中用浓度为2m的碳酸钠溶液调节ph 6.9-7.1,tlc点板监控反应进程。24h后,抽滤收集滤液,固定化酶回收套用,滤液加乙酸乙酯萃取、取乙酸乙酯相加无水硫酸钠干燥,过滤,旋蒸回收乙酸乙酯得到s-降烟碱。固定化酶套用20批,结果如下表2所示。
[0107]
表2.固定化融合酶催化合成s-降烟碱的结果
7.0的kpb缓冲液补齐体系至50ml,30℃搅拌反应,tlc点板监测反应进程,12h反应结束,用氢氧化钠调ph至12-13终止反应,离心去除变性蛋白,取上清液用等体积的乙酸乙酯萃取三次,旋蒸后得到降烟碱,收率84%,向降烟碱中加入1.5eq碘甲烷,室温搅拌1小时后,经浓缩、蒸馏得到s-烟碱,收率80%,ee值99.5%,hplc纯度为99.7%。
[0114]
实施例5、s-烟碱的制备
[0115]
将烟酸(50mmol)、甲醇(50mmol)加入单口烧瓶中,添加二环己基碳二亚胺(dcc,30mmol),加入甲苯(2ml)升温至100℃反应10小时,降温后加入氢化钠(60mmol)搅拌10分钟后,加入n-乙烯基吡咯烷酮(50mmol)升温至110℃反应10小时;冷却至室温,旋干甲苯,再次向反应瓶中加入三氟乙酸(1.0ml)升温至80℃搅拌反应8小时,tlc检测反应完全后,降温,用氢氧化钠调ph至9-10后乙酸乙酯萃取,旋蒸后经柱层析分离纯化得到麦斯明4,收率83%;称取麦斯明(30mmol)、2eq葡萄糖置于100ml三口烧瓶中,10%的甲醇作为助溶剂,4g固定化融合酶(es-108型号),再加入0.04mmol nadp
,最后加入100mm ph 7.0的kpb缓冲液补齐体系至50ml,30℃搅拌反应,tlc点板监测反应进程,12h反应结束,用氢氧化钠调ph至12-13终止反应,离心去除变性蛋白,取上清液用等体积的乙酸乙酯萃取三次,旋蒸后得到降烟碱,收率93%,向降烟碱中加入1.0eq硫酸二甲酯和甲苯(2ml),110℃搅拌1小时后,经浓缩、蒸馏得到s-烟碱,收率82%,ee值99.7%,hplc纯度为99.5%。
[0116]
实施例6、s-烟碱的制备
[0117]
将烟酸(50mmol)、乙醇(50mmol)加入单口烧瓶中,添加4-二甲氨基吡啶(dmap,50mmol),加入甲苯(2ml)升温至100℃反应10小时,降温后加入氢化钠(60mmol)搅拌10分钟后,加入n-乙烯基吡咯烷酮(50mmol)升温至110℃反应10小时;冷却至室温,旋干甲苯,再次向反应瓶中加入12m盐酸(0.5ml)升温至110℃搅拌反应8小时,tlc检测反应完全后,降温,用氢氧化钠调ph至9-10后乙酸乙酯萃取,旋蒸后经柱层析分离纯化得到麦斯明4,收率83%;称取麦斯明(30mmol)、2eq葡萄糖置于100ml三口烧瓶中,10%的甲醇作为助溶剂,4g固定化融合酶(es-108型号),再加入0.04mmol nadp
,最后加入100mm ph 7.0的kpb缓冲液补齐体系至50ml,30℃搅拌反应12h,用氢氧化钠调ph至12-13终止反应,离心去除变性蛋白,取上清液用等体积的乙酸乙酯萃取三次,旋蒸后得到降烟碱,收率83%,向降烟碱中加入1.0eq碳酸二甲酯和甲苯(2ml),110℃搅拌1小时后,经浓缩、蒸馏得到s-烟碱,收率82%,ee值99.4%,hplc纯度为99.6%。
[0118]
实施例7、s-烟碱的制备
[0119]
将烟酸(50mmol)、乙醇(50mmol)加入单口烧瓶中,添加dmap(40mmol),加入苯(2ml)升温至50℃反应10小时,降温后加入碳酸钾(60mmol)搅拌30分钟后,加入n-乙烯基吡咯烷酮(50mmol)升温至90℃反应10小时;冷却至室温,向反应瓶中添加对甲苯磺酸(50mmol)升温至70℃搅拌反应8小时,tlc检测反应完全后,降温,用氢氧化钠调ph至10-11后乙酸乙酯萃取,旋蒸后经柱层析分离纯化得到麦斯明4,收率76%;称取麦斯明(30mmol)、2eq葡萄糖置于100ml三口烧瓶中,10%的甲醇作为助溶剂,4g固定化融合酶(es-108型号),再加入0.04mmol nadp
,最后加入100mm ph 7.0的kpb缓冲液补齐体系至50ml,30℃搅拌反应,tlc点板监测反应进程,12h反应结束,用氢氧化钠调ph至12-13终止反应,离心去除变性蛋白,取上清液用等体积的乙酸乙酯萃取三次,旋蒸后得到降烟碱,收率86%,向降烟碱中加入1.0eq硫酸二甲酯和甲苯(2ml),80℃搅拌1小时后,经浓缩、蒸馏得到s-烟碱,收率
72%,ee值99.4%,hplc纯度为99.7%。
[0120]
s-烟碱的核磁数据为:1h nmr(400mhz,cdcl3)δ(ppm)8.52(d,j=2.0hz,1h),8.49(dd,j=4.8,1.6hz,1h),7.69(d,j=8.0hz,1h),7.26(t,j=6.8hz,1h),3.25(t,j=7.6hz,1h),3.09(t,j=8.0hz,1h),2.35
–
2.29(m,1h),2.24
–
2.16(m,4h),2.00
–
1.74(m,3h).
[0121]
综上,本发明提供了一种s-烟碱的合成方法,该合成方法采用固定化融合酶,利用化学法与生物酶法协同作用合成s-烟碱,其原料易得,操作简便,反应条件温和,产物分离提纯方便,成本低廉;同时,其合成的s-烟碱收率高,手性纯度高达99%,立体选择性可控,合成产物质量优异。该合成方法具备规模生产的可能性,有望工业化、商业化生产,具有良好的应用前景和可期的经济效益。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
