1.本技术涉及间充质干细胞培养领域,更具体地说,它涉及一种永生化间充质干细胞的构建方法及制备外泌体的方法。
背景技术:
2.外泌体是一种能被机体内大多数细胞分泌的微小膜泡,具有脂质双层膜,其广泛存在并分布于各种体液中,携带和传递重要的信号分子,形成了一种全新的细胞-细胞间传递系统;不仅影响细胞的生理状态并与多种疾病的发生与进程密切相关,也可作为癌症疫苗和抗癌药物的载体、细胞治疗的潜在替代物。
3.在再生治疗应用中,外泌体可以避免干细胞治疗的一些缺陷,如伦理问题等,而且外泌体分离简单、稳定性高、储存方便,可以精确定量和分析,可作为干细胞治疗的有效替代物。与间充质干细胞本身相比,外泌体免疫原性低、无致瘤风险,具有较高的安全性和更大的组织再生潜能,因此,间充质干细胞外泌体在组织再生中具有极大的优势。
4.但是,间充质干细胞的体外扩增能力不足,经过几次穿传代之后细胞就开始衰老,衰老的间充质干细胞所分泌的外泌体再生能力明显受损,治疗效果也大打折扣。因此,为了获得足够量且具备再生潜能的外泌体用于治疗,相关企业选择扩大间充质细胞的培养规模、不断重复的制备间充质细胞。
5.针对上述中的相关技术,发明人认为扩大培养规模的方式虽然可以制备大量的间充质干细胞外泌体,但这种扩大细胞培养规模的方式无疑会增加细胞培养的成本,同时还会增加大量劳动力。
技术实现要素:
6.为了解决需要大规模培养间充质干细胞才能制备大量的外泌体的问题,本技术提供一种永生化间充质干细胞的构建方法及制备外泌体的方法。
7.第一方面,本技术提供一种永生化间充质干细胞的构建方法,采用如下的技术方案:一种永生化间充质干细胞的构建方法,包括以下步骤:s1、基因合成:利用p2a序列连接c-myc序列和cd9序列,合成myc-p2a-cd9基因片段;s2、构建重组慢病毒质粒:将myc-p2a-cd9基因片段连接至plv-flag(c1)质粒;s3、慢病毒包装:利用s2中的重组慢病毒质粒转染293t细胞,收集慢病毒;s4、构建永生化间充质干细胞:利用s3中的慢病毒转染间充质干细胞,即得永生化间充质干细胞。
8.通过采用上述技术方案,c-myc是最早发现的原癌基因,有许多与瘤化相关的功能区域,其转录表达的蛋白通过核膜进入细胞核与端粒酶的启动子结合位点特异性结合,诱导端粒酶mrna快速表达,直接激活端粒酶活性,促进细胞进入永生化;cd9具有多种生物学
功能,其在细胞黏附、细胞运动、激活、分化、肿瘤转移等方面发挥着重要的作用,也能够促进细胞分泌外泌体;p2a作为自我剪切肽,能够使一条转录产物产生多种蛋白。传统的将多个基因同时表达的技术方案是利用多个启动子和开放阅读框,多个启动子会导致载体显著增大,可能会导致后续的转染效率低;多个启动子还易给宿主细胞带来代谢负担。p2a的大小只有60bp,在连接c-myc基因和cd9基因时,不会明显增加载体的长度,可降低多启动子带来的宿主细胞代谢负担,可增强后续的细胞转染效率。
9.本技术方案利用p2a连接c-myc基因和cd9基因,构建出重组慢病毒质粒,再用重组慢病毒质粒包装出重组慢病毒,利用重组慢病毒感染间充质干细胞,从而在蛋白质翻译后,p2a经过剪切获得的c-myc和cd9这两种蛋白可分别行驶功能。在c-myc的作用下使得间充质干细胞进入永生化,在cd9的作用下使得间充质干细胞能够大量分泌外泌体,进而获得可无限次传代且能够大量分泌外泌体的永生化间充质干细胞,不需要大规模的培养细胞就能够获得大量的外泌体,一定程度上可降低细胞培养成本。
10.优选的,所述步骤s2中采用以下方法进行连接:1)酶切:对myc-p2a-cd9基因片段进行酶切得到目的基因片段,对plv-flag(c1)质粒进行线性化酶切得到线性化质粒;2)回收目的基因片段和线性化质粒;3)连接:将9.5-10.5μl连接试剂、2.3-2.7μl线性化质粒和7.3-7.7μl目的基因片段混匀,于16℃反应28-32min,得含有重组慢病毒质粒plv-myc-p2a-cd9的连接产物;4)转化:利用3)中的连接产物转化dh5α感受态细胞,并进行质粒抽提,得到重组慢病毒质粒plv-myc-p2a-cd9。
11.通过采用上述技术方案,利用特定用量的连接试剂、线性化质粒和目的基因片段,使得线性化质粒和目的基因片段能够更好的连接,再经过转化和质粒抽提,从而可准确的构建出重组慢病毒质粒。
12.优选的,所述酶切具体采用以下方法进行:myc-p2a-cd9基因片段酶切:取0.8-1.2μg myc-p2a-cd9基因片段、加入0.8-1.2μl限制性内切酶xba i、0.8-1.2μl限制性内切酶ecor i和4.8-5.2μl缓冲液,加入双蒸水至总体积为50μl,置于37℃反应55-65min,得a样品;plv-flag(c1)质粒线性化酶切:取0.8-1.2μg plv-flag(c1)质粒,加入0.8-1.2μl限制性内切酶xba i、0.8-1.2μl限制性内切酶ecor i和4.8-5.2μl缓冲液,加入双蒸水至总体积为50μl,置于37℃反应55-65min,得b样品。
13.通过采用上述技术方案,利用限制性内切酶xba i和限制性内切酶ecor i分别对myc-p2a-cd9基因片段和plv-flag(c1)质粒进行酶切,从而得到所需的目的基因片段和线性化质粒。
14.优选的,所述目的基因片段和线性化质粒采用以下方法将进行回收:1)制备琼脂糖凝胶;2)琼脂糖凝胶电泳:取a样品和b样品分别与5倍浓缩的dna上样缓冲液混合,至dna上样缓冲液终浓度为一倍浓缩后,将混合液加入琼脂糖凝胶点样孔中,120v电压下电泳28-32min;
3)目的条带切胶:切下含目的条带的琼脂糖凝胶并转移到离心管中,再进行回收目的基因片段和线性化质粒。
15.通过采用上述技术方案,采用琼脂糖凝胶电泳的方式进行回收目的基因片段和线性化质粒,可除去蛋白质、其他有机化合物、无机盐离子等杂质,一定程度上可确保获得的目的基因片段和线性化质粒具有较高的纯度。
16.优选的,所述含有重组慢病毒质粒plv-myc-p2a-cd9的连接产物采用以下方法转化dh5α感受态细胞:1)取9.5-10.5μl含有重组慢病毒质粒plv-myc-p2a-cd9的连接产物和98-102μl dh5α感受态细胞,混匀得混合物,将混合物冰浴19-21min;2)冰浴后,将混合物置于42℃热水中85-95s,再冰浴115-125s;3)将混合物加入180-202μl的无抗生素的lb液体培养基中,于37℃下,以200rpm转速复苏55-65min,得混合菌液;4)吸取98-102μl混合菌液,涂布到含有100μg/ml抗生素的lb固体培养基中,于培养箱中培养23-25h。
17.通过采用上述技术方案,选用dh5α感受态细胞进行dna的转化,转化效率高,有利于构建出重组慢病毒质粒。
18.优选的,所述步骤s3中,慢病毒包装的具体操作方式如下:1)细胞接种:将293t细胞接种到含有慢病毒包装培养基的培养板中,培养23-25h;2)稀释重组慢病毒质粒至1μg/μl;制备a管:取248-252μl无血清培养基和6.5-7.5μl转染试剂,混匀;制备b管:取248-252μl无血清培养基、3.8-4.2μg经预处理的质粒和5.5-6.5μl转染试剂,混匀;3)制备脂质体-dna复合物:将a管和b管混匀,室温孵育9-11min;4)转染:将培养板中的每孔均去除1ml培养基,向每孔中均加入495-505μl脂质体-dna复合物,于37℃下孵育7.7-8.2h;更换培养板中的培养基,继续培养12-14h;5)收集:收集培养板每孔中的上清液,离心浓缩,即得重组慢病毒。
19.通过采用上述技术方案,选用293t细胞进行转染试验,转染效率高,有利于包装出重组慢病毒。
20.优选的,所述预处理的质粒由以下原料混合而成:1.8-2.2μl重组慢病毒质粒、1.1-1.3μl pspax2和0.7-0.9μl pmd2g。
21.通过采用上述技术方案,重组慢病毒质粒能转录出慢病毒遗传物质,但不能翻译出慢病毒的外壳及蛋白成分的载体质粒;pspax2是能够表达慢病毒外壳的质粒,且表达产物可通过粘附机制更易穿过细胞膜,pspax2是慢病毒的膜蛋白质粒, pspax2、pspax2和重组慢病毒质粒共转到293t细胞中,在293t细胞的基因组表达时,随之转录出的目的基因、以及pspax2、pspax2翻译出的蛋白可组装为慢病毒。
22.优选的,所述步骤4)中当培养板中的细胞汇合度达到60-70%时进行转染。
23.通过采用上述技术方案,转染试剂一般对细胞具有一定的毒性,汇合度较低时进行转染,细胞对转染试剂的耐受性较低,会影响细胞后续的培养扩增;汇合度过高时进行转染,虽然细胞对转染试剂的耐受性要高,但汇合度过高会影响后续的细胞筛选,同时还会降
低转染效率。通过在细胞的汇合度达到一个特定范围值时进行转染,一定程度上可提高细胞对转染试剂的耐受性,同时可降低由于细胞过度生长而造成细胞活性损害的可能性。
24.第二方面,本技术提供一种制备外泌体的方法,采用如下的技术方案:一种制备外泌体的方法,包括以下步骤:(1)接种永生化间充质干细胞,培养;(2)分离纯化:a)收集上清液,离心,去除细胞碎片,收集上清液,过滤;b)将步骤a)中过滤后的上清液离心,弃上清液,重悬外泌体沉淀,得外泌体重悬液;c)将步骤b)中的外泌体重悬液离心,弃上清液,即得外泌体。
25.通过采用上述技术方案,培养永生化间充质干细胞,使之能够分泌外泌体,收集上清液并离心,从而可获得外泌体。
26.优选的,所述步骤a)以10000g转速离心10min,步骤b)和步骤c)均以120000g转速离心90min。
27.通过采用上述技术方案,有利于外泌体沉淀,使得外泌体能够与其他杂质产生分离,从而可获得纯度较高的外泌体。
28.综上所述,本技术具有以下有益效果:1、本技术利用携带有c-myc基因和cd9基因的重组慢病毒转染间充质干细胞,使得间充质干细胞进入永生化并能够大量分泌外泌体,降低需要大规模培养间充质干细胞的成本,同时也解决了间充质干细胞取材难以及易衰老的问题。
29.2、本技术利用p2a进行连接c-myc基因和cd9基因,使得c-myc和cd9蛋白翻译后悔通过p2a的自切割形成两独立的蛋白质且不影响c-myc和cd9行驶各自的功能,从而使得间充质干细胞能够进入永生化且能够大量分泌外泌体。
30.3、本技术中选用的p2a的大小只有60bp,可减轻多启动子带来的宿主细胞代谢负担,可增强细胞转染效率,有利于构建出永生化间充质干细胞。
附图说明
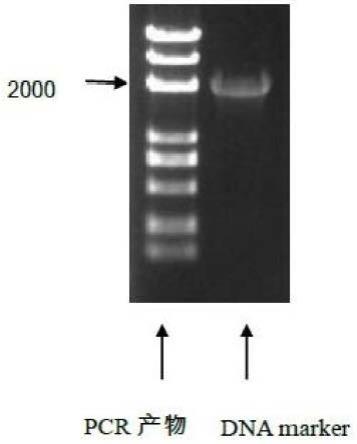
31.图1是本技术实施例1中对获得的myc-p2a-cd9基因片段的电泳检测图。
具体实施方式
32.以下结合实施例对本技术作进一步详细说明。
33.本技术中各原料的来源如表1:表1 各原料的来源1×
tae缓冲液的制备例取4.84g tris缓冲液、0.744g na2edta.2h2o、1.142ml醋酸,加入到ddh2o中,继续添加ddh2o至总体积为1l,搅拌溶解,即得1
×
tae缓冲液。
34.琼脂糖凝胶的制备例取0.5g琼脂糖,加入50ml 1
×
tae缓冲液,混匀,利用微波炉煮沸2min,再加入凝胶槽中冷凝即可。
35.液体培养基的制备例取10g胰蛋白胨、5g酵母提取物和10g nacl,加入ddh2o中溶解,继续加入ddh2o并调节ph为7.0,直至总体积为1l,然后于121℃下高压灭菌15min即可。
36.固体培养基的制备例取10g胰蛋白胨、5g酵母提取物和10g nacl,加入ddh2o中溶解,调节ph为7.0,加入10g琼脂粉,继续加入ddh2o直至总体积为1l,然后于121℃下高压灭菌15min即可。
37.抗生素的制备例取1g对应的抗生素粉末氨苄青霉素,溶解到20ml ddh2o中,利用0.22μm孔径的薄
aggaagcgct gaaggagacc ctccgcctga tccactttgg gctggactgc tgcggtccta caggaagcgt cttcgatgct gccaaagaca tctgtccaaa gcaggaagga ctggccgtcc tcgttaccac gagttgccca aaagccatcg atgaagtatt caacaacaag ctgcacatca tcggtggagt tgggatcggt attggcgtca tcatgatctt tgggatgatc ttcagcatga tcctttgctg tgccatcaag aggtccagag aatatgtgtaa设计后的myc-p2a-cd9序列如下:tctagagccaccatggatttttttcgggtagtggaaaaccagcagcctcccgcgacgatgcccctcaacgttagcttcaccaacaggaactatgacctcgactacgactcggtgcagccgtatttctactgcgacgaggaggagaacttctaccagcagcagcagcagagcgagctgcagcccccggcgcccagcgaggatatctggaagaaattcgagctgctgcccaccccgcccctgtcccctagccgccgctccgggctctgctcgccctcctacgttgcggtcacacccttctcccttcggggagacaacgacggcggtggcgggagcttctccacggccgaccagctggagatggtgaccgagctgctgggaggagacatggtgaaccagagtttcatctgcgacccggacgacgagaccttcatcaaaaacatcatcatccaggactgtatgtggagcggcttctcggccgccgccaagctcgtctcagagaagctggcctcctaccaggctgcgcgcaaagacagcggcagcccgaaccccgcccgcggccacagcgtctgctccacctccagcttgtacctgcaggatctgagcgccgccgcctcagagtgcatcgacccctcggtggtcttcccctaccctctcaacgacagcagctcgcccaagtcctgcgcctcgcaagactccagcgccttctctccgtcctcggattctctgctctcctcgacggagtcctccccgcagggcagccccgagcccctggtgctccatgaggagacaccgcccaccaccagcagcgactctgaggaggaacaagaagatgaggaagaaatcgatgttgtttctgtggaaaagaggcaggctcctggcaaaaggtcagagtctggatcaccttctgctggaggccacagcaaacctcctcacagcccactggtcctcaagaggtgccacgtctccacacatcagcacaactacgcagcgcctccctccactcggaaggactatcctgctgccaagagggtcaagttggacagtgtcagagtcctgagacagatcagcaacaaccgaaaatgcaccagccccaggtcctcggacaccgaggagaatgtcaagaggcgaacacacaacgtcttggagcgccagaggaggaacgagctaaaacggagcttttttgccctgcgtgaccagatcccggagttggaaaacaatgaaaaggcccccaaggtagttatccttaaaaaagccacagcatacatcctgtccgtccaagcagaggagcaaaagctcatttctgaagaggacttgttgcggaaacgacgagaacagttgaaacacaaacttgaacagctacggaactcttgtgcg gga agc gga gct act aac ttc agc ctg aag cag gct gga gac gtg gag aac cct gga cctatgagcgtcctgtcca gctgggagctgtgcgtcaaatacgcaattttcatcttcaactttgtcttctggcttgcagggactggagtgctggctgtgggattatggcttcgtttcgactccaggaccaaagcactgtttgaaggagaagacgcgccctctgtcttcttcactggtgtttatctgctgatcgctgcaggagcgttgatgatggtggtgggattcctgggatgctgtggagccattaaagagtcgccctgcatgctgggactgttcttcatcttcctgctcatcatctttgctgctgaagtggctgcagggatctggggactgtccaacacgcacacggtcatagaggaagtcacagagttttataagcagacttttgacaactacaggaccaccaaacaggaagcgctgaaggagaccctccgcctgatccactttgggctggactgctgcggtcctacaggaagcgtcttcgatgctgccaaagacatctgtccaaagcaggaaggactggccgtcctcgttaccacgagttgcccaaaagccatcgatgaagtattcaacaacaagctgcacatcatcggtggagttgggatcggtattggcgtcatcatgatctttgggatgatcttcagcatgatcctttgctgtgccatcaagaggtccagag aatatgtgtaagaattc;2)myc-p2a-cd9基因片段合成:利用droligo blp192 dna合成仪进行合成目的序列,分别取100g腺嘌呤单体、100g胸腺嘧啶单体、100g鸟嘌呤单体和100g胞嘧啶单体,分别用乙腈溶解后加入到合成仪中,根据合成仪的操作说明,在合成柱上合成引物,利用氨气氨解洗脱后得到引物片段;3)pcr扩增:利用pcr试剂盒kod-plus-neo进行pcr扩增操作:
a、第一轮反应:取5μl 2mm dntp、5μl 步骤2)中合成的引物片段、1μl dna聚合酶、5μl 10x dna聚合酶缓冲液、25μl 25 mm mgso4、9μl ddh2o,总反应体积50μl,充分混匀后放置于pcr扩增仪中,然后按照以下条件进行扩增:于95℃下预变性2min、于98℃下变性30s、于58℃下退火30s(18个循环)、于72℃下进行延伸30s/1kb、于72℃下终延伸2min,得一级产物;b、第二轮反应:取5μl 2mm dntp、2μl引物、5μl 步骤a中得到的一级产物、25μl 25 mm mgso4、5μl 10x dna聚合酶缓冲液、1μl dna聚合酶、10μl ddh2o,总反应体积50μl,充分混匀后加入pcr扩增仪中,然后按照以下条件进行扩增:于95℃下预变性2min、于98℃下变性30s、于58℃下退火30s(25个循环)、于72℃下进行延伸30s/1kb、于72℃下终延伸2min,得到myc-p2a-cd9基因片段。
41.进一步的,对获得的myc-p2a-cd9基因片段经进行检测,具体操作如下:1)取5μg获得的myc-p2a-cd9基因片段,进行电泳检测,检测结果见图1,如图1所示,图1中第一条泳道为pcr产物,第二条泳道为dna marker,图中第一条泳道显示出2000bp左右的条带。分析认为,本技术涉及的myc-p2a-cd9基因片段的大小为2100bp,与图中显示的大小相符,表明本技术合成的产物即为myc-p2a-cd9基因片段;2)将剩余的myc-p2a-cd9基因片段进行琼脂糖凝胶电泳纯化回收。
42.s2、构建重组慢病毒质粒:1)酶切myc-p2a-cd9基因片段酶切:取1.0μg myc-p2a-cd9基因片段、加入1.0μl限制性内切酶xba i、1.0μl限制性内切酶ecor i和5.0μl cutsmart
®ꢀ
buffer缓冲液,最后加入双蒸水至总体积为50μl,置于37℃下反应60min,得a样品;plv-flag(c1)质粒线性化酶切:取1.0μg plv-flag(c1)质粒,加入1.0μl限制性内切酶xba i、1.0μl限制性内切酶ecor i和5.0μl cutsmart
®ꢀ
buffer缓冲液,最后加入双蒸水至总体积为50μl,置于37℃反应60min,得b样品;2)回收目的基因片段和线性化质粒琼脂糖凝胶电泳:利用琼脂糖凝胶回收试剂盒进行操作,取a样品和b样品分别与5倍浓缩的dna上样缓冲液混合,至dna上样缓冲液终浓度为一倍浓缩后,将混合液加入琼脂糖凝胶点样孔中,120v电压下电泳30min;目的条带切胶:利用紫外切胶仪切下含目的条带的琼脂糖凝胶并转移到1.5ml离心管中;目的条带回收:根据琼脂糖凝胶回收试剂盒操作步骤进行回收目的基因片段和线性化质粒,于-20℃下保存;3)连接选用ligation high ver.2连接试剂盒进行操作,取10μl ligation high ver.2、2.5μl线性化质粒和7.5μl目的基因片段,混匀后于16℃下反应30min,得含有重组慢病毒质粒plv-myc-p2a-cd9的连接产物;4)转化a、取100μl dh5α感受态细胞置于冰上解冻,解冻后,加入10μl含有重组慢病毒质粒plv-myc-p2a-cd9的连接产物,混匀后冰浴20min;
b、冰浴后,将混合物置于42℃的水浴锅中热激90s,然后立刻置于冰上2min;c、向混合物中加入200μl无抗生素的lb液体培养基,于37℃下,以200rpm转速复苏60min,得混合菌液;d、取100μl混合菌液,涂布到含有100μg/ml抗生素的lb固体培养基上,于37℃培养箱中倒置24h培养,24h后可观察到lb固体培养基上出现单克隆菌落;5)质粒抽提选用omega质粒小提试剂盒进行操作。
43.a、取步骤4)中的单克隆菌落于离心管中,加入5ml含有100μg/ml抗生素的lb液体培养基,在37℃细菌培养摇床200rpm培养14h;b、取3ml菌液,于室温下10000
×
g离心1min;弃上清液,加入250μl试剂盒中含rnase a的溶液ⅰ,利用涡旋振荡器震荡至菌体完全悬浮;c、再加入250μl试剂盒中的溶液ⅱ,颠倒离心管5次,得到澄清的裂解液;d、再加入350μl试剂盒中的溶液ⅲ,颠倒离心管,直至离心管内出现白色絮状沉淀,于室温下10000
×
g离心10min;e、吸取上清液,移至已装配好容积2ml离心管的吸收柱中,于室温下10000
×
g离心1min,至裂解物完全通过吸收柱;f、弃过滤液,加入500μl buffer hb,以10000
×
g转速离心1min,清洗吸收柱,除去残余蛋白质以确保dna的纯度;g、弃滤过液,利用100%乙醇稀释的750μl wash buffer清洗吸收柱,以10000
×
g转速离心1min,再加50μl wash buffer清洗吸收柱,以10000
×
g转速离心1min;h、将吸收柱放入1.5ml离心管,加入50μl无菌去离子水,10000
×
g转速离心5min,收集上清液,即得重组慢病毒质粒。
44.进一步的,将得到的重组慢病毒质粒进行测序,测序结果与设计的myc-p2a-cd9序列一致,表明重组慢病毒质粒构建成功。
45.s3、慢病毒包装:1)细胞接种于当天下午,取293t细胞,以5*105个细胞/孔的密度接种于含有2ml慢病毒包装培养基的6孔培养板中,于37℃、5%co2条件下孵育过夜,使细胞密度达到70%汇合度;2)于第二天早上进行转染a、利用opti-mem培养基将重组慢病毒质粒稀释至1μg/ml;b、制备a管:取250μl无血清培养基和7μl lipofectamine3000转染试剂,涡旋混匀10s;c、制备b管:取2μl重组慢病毒质粒、1.2μl pspax2和0.8μl pmd2g,混匀,得预处理的质粒;取250μl无血清培养基、4μg预处理的质粒和6μl lipofectamine3000转染试剂,涡旋混匀10s;d、制备脂质体-dna复合物:将a管内容物与b管内容物混匀,室温孵育10min;e、将培养板的每孔均去除1ml培养基,向每孔中均加入500μl脂质体-dna复合物,轻轻搅拌培养板,混匀;于37℃、5%co2条件下孵育8h;
f、更换每孔中的平板培养基:从每孔中吸去包含脂质体-dna复合物的培养基,然后将平板培养基置于2ml预热的慢病毒包装培养基;于37℃、5%co2条件下过夜孵育;g、于第三天收集第一批病毒:转染48h后,从每孔中收集2ml细胞上清液,移入15ml锥形管中并于4℃保存;h、再次更换每孔中的平板培养基:用2ml预热的慢病毒包装培养基替换收集的培养基,于37℃、5%co2条件下过夜孵育;i、于第四天收集第二批病毒:转染72h后,从每孔中收集2ml细胞上清液,与步骤g中收集的上清液混合;于室温下以2000 rpm转速离心10min,去除细胞碎片,收集并转移上清液至离心管中,弃细胞沉淀;j、病毒浓缩:向步骤i中的离心管中按照lenti-x concentrator:上清液为1:3的体积比加入lenti-x concentrator,于4℃下孵育过夜;k、于4℃下,1500g离心60 min,弃上清液,沉淀即为重组慢病毒;加入dmem基础培养基重悬病毒沉淀,50ul/管分装,-80℃冰箱保存备用。
46.s4、构建永生化间充质干细胞:1)间充质干细胞的复苏和培养a、自液氮罐中取出冻存的人脐带间质干细胞,放入-80℃冰箱2-3 min,取出冻存细胞,将冻存管放入37℃温水中融化;b、用75%酒精消毒冻存管口的外壁,将细胞冻存悬液移入装有9ml完全培养基的15ml离心管;c、将细胞悬液经250g离心5min,弃上清液,加入已预热至37℃的2ml完全培养基;d、将细胞接种到t25培养瓶中,并加入完全培养基,于37℃、5%co2、饱和湿度的培养箱培养;后续,每两天更换新鲜的完全培养基,至细胞达到80%汇合度时备用;2)感染间充质干细胞a、将步骤1)中的间充质干细胞按照1*105个细胞/孔接种到含有间充质干细胞完全培养基的6孔板中;b、步骤a中的细胞达到80%汇合度时,将重组慢病毒按照moi=20的感染复数感染间充质干细胞,同时加入聚凝胺,使聚凝胺的终浓度为10μg/ml;设立对照孔,对照孔中未添加重组慢病毒和聚凝胺;c、感染48h后,向病毒感染孔和对照孔中加入嘌呤霉素,使嘌呤霉素的终浓度为3μg/ml进行筛选,继续培养至7天时,可见对照孔中的细胞全部死亡,从而病毒感染孔的中细胞为表达myc和cd9的脐带间充质干细胞msc-myc/cd9细胞株,即永生化间充质干细胞。
47.进一步的,对获得的永生化间充质干细胞进行鉴定,具体鉴定方法如下:1)取永生化间充质细胞和未经重组病毒感染的间充质干细胞各1*106个,分别加入100μl含1%pmsf的ripa裂解液,涡旋混匀30 s,冰上放置30 min;2)于4℃条件下,以12000rpm转速离心30 min,将上清液转移到离心管中;3)加入6
×
protein loading至工作浓度(1
×
),100℃下加热使蛋白质变性;4)分别取40μl步骤3)中的两种细胞裂解物40μl各两份,上样10%sds-page,于120v电压下,电泳120min;5)经由350ma恒流120min,将sds-page中的蛋白转移到pvdf膜,将pvdf膜放置于含
5%脱脂牛奶的封闭液中,于4℃下封闭过夜;6)将封闭后的pvdf膜剪成两份,每份均含有经病毒感染的间充质干细胞裂解物和未感染病毒的间充质干细胞裂解物,将两份pvdf膜分别放入10ml含0.5μg/ml的兔抗人myc一抗和10ml含1:1000稀释的兔抗人cd9 一抗,室温孵育1h;7) 将pvdf膜用tbst缓冲液洗涤5次,每次5min;然后放入10ml按照1:100000稀释后的辣根过氧化物酶标记的山羊抗兔igg二抗,室温孵育1 h;用tbst缓冲液洗涤5次,每次5min;8)加入ecl超敏显色液后,利用天能成像系统进行拍照分析。
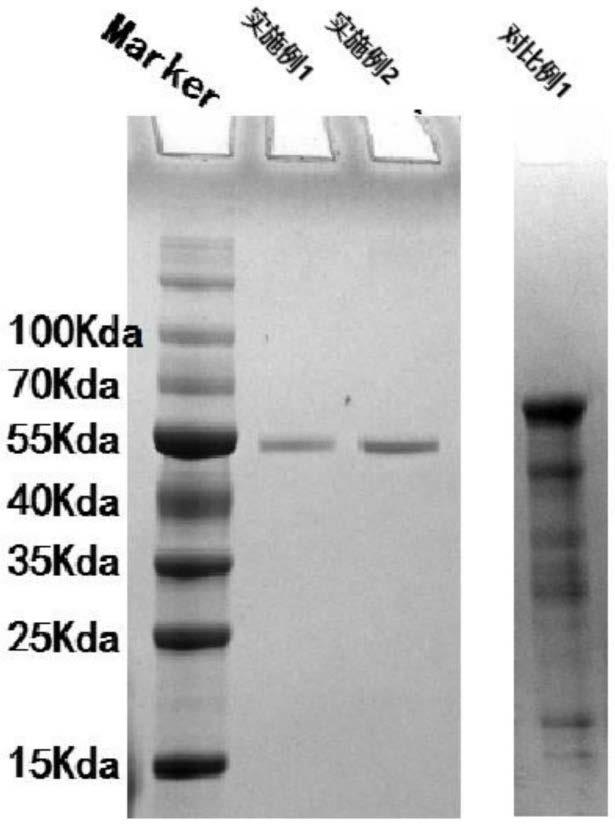
48.结果显示,兔抗人myc一抗孵育的pvdf膜上的经病毒感染的间充质干细胞裂解物显示出两条信号较强的条带,分别位于75kd和50kd;兔抗人cd9一抗孵育的经病毒感染的间充质干细胞裂解物显示出两条信号较强的条带,分别位于75kd和25kd。
49.而对照组中,未感染病毒的间充质干细胞裂解物经兔抗人myc一抗孵育的pvdf膜上检测到一条信号较弱的条带,位于50kd;经兔抗人cd9一抗的pvdf膜上检测到一条信号较弱的条带,位于25kd。
50.分析认为,人c-myc蛋白的分子量大小为50kd,cd9蛋白的分子量大小为25kd,永生化间充质干细胞表达过c-myc蛋白和cd9蛋白。因此,兔抗人myc一抗孵育的pvdf膜上的经病毒感染的间充质干细胞裂解物显示出75kd条带(还未剪切的完整蛋白)和50kd条带(剪切后的c-myc蛋白);兔抗人cd9一抗孵育的经病毒感染的间充质干细胞裂解物显示出75kd条带(还未剪切的完整蛋白)和25kd条带(剪切后的cd9蛋白);对照组中,未感染病毒的间充质干细胞裂解物经兔抗人myc一抗孵育的pvdf膜显示出50 kd条带(剪切后的c-myc蛋白),经兔抗人cd9一抗的pvdf膜显示出25kd条带(剪切后的cd9蛋白)。因此,证明了本技术成功构建出能够稳定表达c-myc蛋白和cd9蛋白的永生化间充质干细胞,且c-myc蛋白和cd9蛋白会通过p2a剪切后形成两个独立的蛋白分子能够各自行驶功能。
51.进一步的,对永生化间充质干细胞进行表型分析鉴定,具体鉴定方法如下:1)将永生化间充质干细胞按照1*105个细胞/管加入到5ml bd管中;2)加入d-pbs缓冲液,于4℃下,以1500rpm离心5min,弃上清液后,并重复此步骤一次;3)弃上清液,加入cd90-pe抗体和cd45-fitc抗体,冰上避光孵育20min;4)弃上清液,加入d-pbs缓冲液,于4℃下,以1500rpm离心5min,弃上清液后,并重复此步骤一次;5)向bd管中加入200μl d-pbs缓冲液重悬细胞,利用bd facsverse流式细胞仪上样检测。
52.结果显示,cd90为阳性,cd45为阴性,表明获得的细胞为稳定的永生化间充质干细胞。
53.进一步,对永生化间充质干细胞进行传代培养鉴定,具体鉴定方法如下:1)利用t75培养瓶培养细胞,用预热至37℃的1
×
pbs缓冲液6ml洗涤细胞3次,吸去1
×
pbs缓冲液;2)加入3ml预热至37℃的trypsin-edta,旋转t75培养瓶,使trypsin-edta覆盖细胞表面,显微镜下观察到约70%
‑ꢀ
80%左右的细胞变圆后,轻拍培养器皿的壁使细胞脱壁;
3)加入6ml预热至37℃的完全培养基终止消化;4)用吸管吸取液体,反复吹打培养器皿底壁,使细胞彻底脱离器皿底壁,将细胞悬液转移至15ml的离心管中,以250g转速离心5min,弃上清液,加入2ml完全培养基重悬细胞;5)对细胞进行台盼蓝染色计数活细胞数量;6)按照2.5*104个细胞/cm
2 密度接种细胞,于37℃、5%co2、饱和湿度的培养箱中培养;7)按照上述传代方法,传代100次,并观察细胞形态和生长速度。
54.结果显示,传代100次时,细胞的形态和生长速度均无明显变化,表明干细胞中的c-myc蛋白能够发挥功能,使干细胞能够无限增殖,从而证明本技术成功构建出永生化间充质干细胞。
55.实施例2一种制备外泌体的方法,利用实施例1中构建的永生化间充质干细胞进行制备外泌体,具体步骤如下:(1)细胞培养1)取1*106个实施例1中构建的永生化间充质干细胞,接种至含20ml间充质干细胞完全培养基的细胞培养皿中,于0.5%氧气、99.5%氮气的力康hf100三气培养箱中进行孵育:2)细胞生长至50%汇合度时,弃上清液,更换为无菌d-pbd缓冲液,于0.5%氧气,99.5%氮气的力康hf100三气培养箱中孵育12h,收集上清液;(2)外泌体分离纯化1)将步骤(1)中收取的上清液于4℃下,以10000g转速离心10min,去除细胞碎片,收集上清液;2)将步骤1)中的上清液利用孔径为0.22 um的薄膜过滤器过滤,收集过滤液;3)将过滤液于4℃下,以120000g转速离心90min,弃上清液,用生理盐水重悬外泌体沉淀;并重复此步骤一次,弃上清液,沉淀即为外泌体。
56.进一步的,对获得的外泌体采用western blot方法进行检测,具体操作如下:1)采用实施例2中记载的制备外泌体的方法,利用非永生化的间充质干细胞进行制备外泌体,然后取实施例2中分离纯化的外泌体和非永生化的间充质干细胞分泌的外泌体各20μl,分别加入100μl含1% pmsf的ripa裂解液,于4℃下孵育15min,以使外泌体充分裂解;2)加入6
×
protein loading至工作浓度(1
×
),100℃下加热5min使蛋白质变性;3)分别取20μl以上两种样品,上样10% sds-page,于100v电压下,电泳120分钟;4)100v电压下转膜120min,使蛋白转移至pvdf膜;转膜后的pvdf膜放置于含5%脱脂奶粉的封闭液中,于4℃下封闭过夜;5)封闭后的pvdf膜放入10ml含0.5ug/ml的兔抗人hsp70一抗,室温下孵育1h;然后用tbst缓冲液洗涤5次,每次5min;6)洗涤后的pvdf膜放入10ml按照1:100000稀释后的辣根过氧化物酶标记的山羊抗兔igg(h&l)二抗,室温下孵育1 h;然后用tbst缓冲液洗涤5次,每次5min;7)加入ecl超敏显色液后,利用天能成像系统进行拍照分析。
57.结果显示,两种外泌体裂解物中均能够检测到50kd条带,而经永生化间充质干细
胞分泌的外泌体裂解物检测到的信号更强。分析认为,人hsp70蛋白的分子量大小为50kd,因此,两种外泌体裂解物均能够检测到50kd条带。而永生化间充质干细胞相较于非永生化的间充质干细胞能够分泌更多的外泌体,因此,经永生化间充质干细胞分泌的外泌体裂解物检测到的信号更强,也证明了本技术中构建的永生化间充质干细胞能够大量分泌外泌体。
58.本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。