一种联产3-羟基丙酸和1,3-丙二醇的基因工程菌ec01 s7、构建方法和应用
技术领域
1.本发明属于生物工程技术领域,具体涉及一种联产3-羟基丙酸和1,3-丙二醇的基因工程菌ec01 s7、构建方法和应用。
背景技术:
2.3-羟基丙酸和1,3-丙二醇是工业上两种重要的平台化合物,作为生物可降解性聚合物的前体物质和食品添加剂广泛使用。3-羟基丙酸和1,3-丙二醇的生产有化学合成法和生物法两种。化学法多以不可再生资源作为原料,其生产过程能耗大,产物副产物多难以分离纯化,生产过程产生不可估量的环境污染。生物法合成3-羟基丙酸或1,3-丙二醇多以葡萄糖和甘油作为底物,其中以甘油作为底物生产3-羟基丙酸或1,3-丙二醇因其步骤简单,原料廉价,备受瞩目。
3.以甘油作为底物生物合成3-羟基丙酸或1,3-丙二醇:首先,经甘油脱水酶将甘油脱水生成中间代谢物3-羟基丙醛;后经nad
依赖型醛脱氢酶和nad(p)h依赖型1,3-丙二醇氧化还原酶/同工酶分别生成3-羟基丙酸和1,3-丙二醇。
4.目前,毒性中间代谢物3-羟基丙醛积累和缺乏必要辅因子供应等问题是从甘油可持续生物合成3-羟基丙酸和1,3-丙二醇的主要瓶颈。一方面,用于3-羟基丙酸和1,3-丙二醇生产的丙醛脱氢酶和1,3-丙二醇氧化还原酶/同工酶活性不足,极易积累毒性3-羟基丙醛,损坏细胞生长及酶系活性;另一方面,合成3-羟基丙酸需要氧化型辅酶nad
,而生产1,3-丙二醇需要还原型辅酶nad(p)h,因此单独生产3-羟基丙酸或1,3-丙二醇会造成细胞内氧化还原状态失调,影响细胞正常代谢和3-羟基丙酸和1,3-丙二醇产量。
技术实现要素:
5.针对现有技术中存在不足,本发明提供了一种联产3-羟基丙酸和1,3-丙二醇的基因工程菌ec01 s7、构建方法和应用。本发明中,利用基因工程和合成生物学技术,筛选和协同表达高活性醛脱氢酶和1,3-丙二醇氧化还原酶同工酶来分摊代谢3-羟基丙醛的负担,然后通过优化gabd4和yqhd的表达提高了3-羟基丙酸和1,3-丙二醇的产量,最后通过辅酶工程调控吡啶核苷酸转氢酶来提高辅酶nad
和nadph循环供应,进而促进3-羟基丙酸和1,3-丙二醇的深合成;所述高效联产3-羟基丙酸和1,3-丙二醇的基因工程菌缓解了毒性中间代谢物3-羟基丙醛积累,并实现细胞内辅酶自给自足,实现了3-羟基丙酸和1,3-丙二醇的高效生产。
6.本发明中提供了一种联产3-羟基丙酸和1,3-丙二醇的基因工程菌ec01 s7,所述ec01 s7 是在大肠杆菌e.coli w3110(de3)中先表达甘油脱水酶及其再激活因子dhab123-gdrab,然后协同表达丙醛脱氢酶gabd4、1,3-丙二醇氧化还原酶同工酶yqhd和膜结合型吡啶核苷酸转氢酶pntab,最后敲除e.coli w3110(de3)基因组中可溶型吡啶核苷酸转氢酶stha基因而得到。
7.其中,所述dhab123-gdrab的核苷酸序列如seqidno:1所示,氨基酸序列如seqidno:2所示;
8.所述gabd4的核苷酸序列如seqidno:5所示,氨基酸序列如seqidno:6所示;
9.所述yqhd的核苷酸序列如seqidno:7所示,氨基酸序列如seqidno:8所示;
10.所述pntab的核苷酸序列如seqidno:11所示,氨基酸序列如seqidno:12所示;
11.所述stha的核苷酸序列如seqidno:13所示,氨基酸序列如seqidno:14所示。
12.本发明中还提供了上述联产3-羟基丙酸和1,3-丙二醇的基因工程菌ec01s7的构建方法,具体包括如下步骤:
13.(1)表达甘油脱水酶及其再激活因子的重组质粒构建:
14.pcr扩增甘油脱水酶-甘油脱水酶再激活因子大亚基dhab123-gdra基因片段和甘油脱水酶再激活因子小亚基gdrb基因,使用融合pcr技术融合上述两个基因,形成完整的甘油脱水酶及其再激活因子dhab123-gdrab基因片段,然后克隆至pacycduet-1质粒,获得表达dhab123-gdrab的重组质粒;
15.(2)协同表达gabd4、yqhd和pntab的重组质粒的构建:
16.pcr扩增来源于钩虫贪铜菌的gabd4基因,然后克隆至petduet-1质粒中,获得表达gabd4的重组质粒;
17.pcr扩增来源于大肠杆菌的1,3-丙二醇氧化还原酶同工酶yqhd基因,然后克隆至petduet-1质粒中,获得表达yqhd的重组质粒;
18.pcr扩增表达yqhd的重组质粒上的yqhd基因,将其克隆至表达gabd4的重组质粒中,获得协同表达gabd4和yqhd的重组质粒;
19.pcr扩增大肠杆菌中膜结合型吡啶核苷酸转氢酶pntab基因,并将其克隆至协同表达gabd4和yqhd的重组质粒中,得到协同表达gabd4、yqhd和pntab的重组质粒;
20.(3)联产3-羟基丙酸和1,3-丙二醇的基因工程菌ec01s7的构建:
21.使用cripsr-cas9基因编辑工具,敲除e.coliw3110(de3)基因组中的可溶型吡啶核苷酸转氢酶stha基因,获得stha基因敲除工程菌;
22.将步骤(2)中协同表达gabd4、yqhd和pntab的重组质粒和步骤(1)中表达dhab123-gdrab的重组质粒转入stha基因敲除工程菌中,得到所述高效联产3-羟基丙酸和1,3-丙二醇的基因工程菌,记为ec01s7;
23.其中,步骤(1)和(2)不分先后顺序。
24.进一步的,步骤(1)~(3)中,pcr反应参数均为:预变性98℃2min;变性98℃15s;退火55℃10s;延伸72℃2min;终延伸72℃5min,33个循环。
25.进一步的,步骤(2)中协同表达gabd4和yqhd的重组质粒可使用utr工程技术设计表达量增强的人工utr序列,使用反向pcr得到gabd4和yqhd表达量增强的重组质粒。
26.本发明中还提供了上述基因工程菌ec01s7在联产3-羟基丙酸和1,3-丙二醇中的应用。
27.进一步的,所述应用为发酵甘油联产3-羟基丙酸和1,3-丙二醇。
28.与现有技术相比,本发明的有益效果在于:
29.本发明中,通过表达甘油脱水酶及其再激活因子(dhab123-gdrab),获得可转化甘油生成3-羟基丙醛的基因工程菌;分别在该工程菌中表达丙醛脱氢酶(puuc或gabd4)或1,
3-丙二醇氧化还原酶/同工酶(yqhd或pduq),从中筛选出高活性的gabd4和yqhd用于联产3-羟基丙酸和1,3-丙二醇;使用utr工程技术进一步优化gabd4和yqhd表达量,提高3-羟基丙酸和1,3-丙二醇产量;最后通过辅因子工程技术表达膜结合型吡啶核苷酸转氢酶(pntab)和敲除可溶型型吡啶核苷酸转氢酶(stha)促进辅因子循环再生;最终实现3-羟基丙酸和1,3-丙二醇的高效联产。
30.本发明通过代谢工程和合成生物学设计,构建了一株可以高效联产3-羟基丙酸和1,3-丙二醇的基因工程,通过筛选获得高效gabd4和yqhd基因,协同表达gabd4和yqhd基因以降低3-羟基丙醛抑制问题,通过过表达pntab基因提高胞内辅酶nad
和naph供应,通过敲除stha基因避免胞内辅酶nad
和naph降解,促进3-羟基丙酸和1,3-丙二醇高效联产。本发明中所构建的基因工程菌可以通过微生物发酵,以生物柴油产物废弃物甘油为底物,高效联产3-羟基丙酸和1,3-丙二醇。
31.本发明中,摒弃了传统3-羟基丙酸或1,3-丙二醇单独生产的方法,使用联合生产3-羟基丙酸和1,3-丙二醇的方式降低中间代谢物积累,通过utr工程优化表达量,并运用辅酶工程策略实现胞内辅酶自给自足,具有重要的理论和实践意义,所构建的基因工程ec01s7可高效生产3-羟基丙酸和1,3-丙二醇,初步具有工业生产的潜力。
附图说明
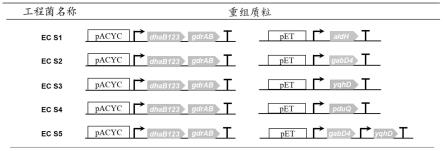
32.图1为基因工程菌ecs1-s5的基因组成图。
33.图2为基因工程菌ecs1-s5的3-羟基丙酸和1,3-丙二醇产量对比图。
34.图3为基因工程菌ecs1-s5的中间代谢物3-羟基丙醛浓度情况图。
35.图4为基因工程ecs5和ecs6的3-羟基丙酸和1,3-丙二醇产量对比图。
36.图5为基因工程菌ecs6、ecs7和ec01s7胞内氧化还原状态图。
37.图6为基因工程菌ecs6、ecs7和ec01s7的3-羟基丙酸和1,3-丙二醇产量图。
38.图7为基因工程菌ec01s7改造策略概况图。
具体实施方式
39.下面结合附图以及具体实施例对本发明作进一步的说明,但本发明的保护范围并不限于此。
40.下列实施例中未注明具体条件者,皆按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。除特殊注明外,本发明所采用的均为该领域现有技术。实施例中,大肠杆菌e.coliw3110(de3)购自优宝生物科技有限公司,pacycduet-1质粒、petduet-1质粒购自淼灵生物科技公司,crisprcas9工具购自addgene平台。
41.实施例1:甘油脱水酶及其再激活因子(dhab123-gdrab)重组质粒的构建
42.(1)根据肺炎克雷伯氏菌甘油脱水酶及其再激活因子dhab123-gdrab基因序列利用oligo7.0软件设计引物:
43.dhabf:gtttaactttaataaggagatataccatgaaaagatcaaaacgatttgcagtactg(seqidno:15);
44.gdrar:cggccccctcgttaacacttaattcgcctgaccggccag(seqidno:16);
45.grdbf:ctggccggtcaggcgaattaagtgttaacgagggggccgtc(seqidno:17);
46.grdbr:ttatgcggccgcaagcttgtcgactcagtttctctcacttaacggcaggac(seqidno:18)。
47.(2)使用dhabf和gdrar引物对扩增dhab123-gdra基因,使用gdrbf和gdrbr引物对扩增gdrb基因,pcr反应参数:预变性,98℃3min;变性,98℃10s;退火,55℃10s;延伸,72℃1.5min;终延伸,72℃5min;33个循环后分别得到dhab123-gdra基因和gdrb基因。
48.(3)将所得dhab123-gdra基因和gdrb基因片段分别作为模板,使用dhabf和gdrbr引物对进行融合pcr,pcr反应参数:预变性,98℃3min;变性,98℃10s;退火,55℃10s;延伸,72℃1.5min;终延伸,72℃5min;33个循环后得到完整的dhab123-gdrab基因,所述dhab123-gdrab的核苷酸序列如seqidno:1所示,氨基酸序列如seqidno:2所示。
49.(4)将pacycduet-1质粒使用ncoi和blni进行双酶切,反应条件为37℃下反应30min;反应结束后获得线性化pacycduet-1质粒骨架。
50.(5)将上述dhab123-gdrab基因和线性化pacycduet-1质粒骨架使用2
×
multifseamlessassemblymix在50℃下吉布森组装30min,获得重组质粒;然后通过标准热激法将重组质粒转化进入e.colidh5α感受态中:具体为冰浴5min后加入重组质粒,冰浴30min,42℃热激45s,冰浴2min,加入1ml无抗生素lb培养基,37℃培养1h后涂布含有25μg/ml氯霉素的lb平板。
51.然后挑取适量单菌落培养并提取重组质粒,送至苏州金唯智测序验证,将验证正确的重组质粒命名为ps0,如图1所示,其中dhab123-gdrab基因表达由t7启动子驱动。
52.实施例2:产3-羟基丙酸或1,3-丙二醇的基因工程菌的构建
53.(1)根据丙醛脱氢酶puuc、gabd4基因序列和1,3-丙二醇氧化还原酶同工酶yqhd、1,3-丙二醇氧化还原酶pduq基因序列,以及petduet-1质粒的序列特征,利用oligo7.0软件设计引物。其中,所述puuc的核苷酸序列如seqidno:3所示,氨基酸序列如seqidno:4所示;所述gabd4的核苷酸序列如seqidno:5所示,氨基酸序列如seqidno:6所示;所述yqhd的核苷酸序列如seqidno:7所示,氨基酸序列如seqidno:8所示;所述pduq的核苷酸序列如seqidno:9所示,氨基酸序列如seqidno:10所示。
54.设计引物序列如下:
55.puucf:gtttaactttaagaaggagatataccatgaattttcatcatctggcttact(seqidno:19);
56.puucr:ttatgcggccgcaagcttgtcgactcaggcctccaggcttatc(seqidno:20);
57.gabd4f:gtttaactttaagaaggagatataccatgtaccaagatctggcact(seqidno:21);
58.gabd4r:ttatgcggccgcaagcttgtcgacttacgcttgggtgatgaact(seqidno:22);
59.yqhdf:attagttaagtataagaaggagatatacatatgaacaactttaatctgcacac(seqidno:23);
60.yqhdr:gtggcagcagcctaggttaattagcgggcggcttcgtat(seqidno:24);
61.pduqf:gtttaactttaagaaggagatataccatggaaaaatttagtatgccaac(seqidno:25);
62.pduqr:ttatgcggccgcaagcttgtcgacttaacgaattattgcttcgtaaatca(seqidno:26)。
63.(2)分别使用puucf和puucr引物对、gabd4f和gabd4r引物对、yqhdf和yqhdr引物对、pduqf和pduqr引物对来pcr扩增puuc、gabd4、yqhd和pduq基因。其中,pcr反应参数:预变性,98℃3min;变性,98℃10s;退火,55℃10s;延伸,72℃1.5min;终延伸,72℃5min;33个循环。
64.(3)将petduet-1质粒使用ncoi和blni在37℃下双酶切30min,反应结束后获得线性化petduet-1质粒骨架;将上述puuc、gabd4、yqhd和pduq基因分别与线性化petduet-1质粒骨架在50℃下吉布森组装30min,分别得到含有puuc、gabd4、yqhd和pduq基因的重组质粒。
65.通过标准热激法将上述得到的含有puuc、gabd4、yqhd和pduq基因的重组质粒转化进入e.colidh5α感受态中,转化步骤具体如下所示:
66.将e.colidh5α感受态冰浴5min后分别加入含有puuc、gabd4、yqhd和pduq基因的重组质粒,冰浴30min,42℃热激45s,冰浴2min,加入1ml无抗生素lb培养基,37℃培养1h后涂布还有100μg/ml氨苄青霉素的lb平板。最后,挑取适量单菌落培养并提取重组质粒,送苏州金唯智测序验证,将验证正确的含有puuc、gabd4、yqhd和pduq基因的重组质粒分别命名为ps1、ps2、ps3和ps4,如图1所示,其中puuc、gabd4、yqhd和pduq基因表达由t7启动子驱动。
67.(4)分别将ps0和ps1、ps0和ps2经电击法转入e.coliw3110(de3)中,电击参数为:电转杯1mm,电压1800v,电阻200ω,电容25μf,分别获得两株产3-羟基丙酸的工程菌,命名为ecs1和ecs2;
68.同理,分别将ps0和ps3以及ps0和ps4经电击法转入e.coliw3110(de3)中,获得两株产1,3-丙二醇的工程菌ecs3和ecs4,其具体基因组成如图1所示,由相容性复制起点的质粒pacycduet-1和petduet-1衍生而来。
69.(5)将上述基因工程菌ecs1、ecs2、ecs3和ecs4在lb培养基(10g/l蛋白胨、5g/l酵母粉和10g/l氯化钠)中过夜活化(37℃、220rpm),按1%v/v接种量接种于改良mr培养基(甘油10g/l,mgso4·
7h2o0.8g/l,(nh4)2hpo44.0g/l,kh2po46.67g/l,citricacid0.8g/l,酵母粉1.0g/l,ph7.0)中培养(37℃、220rpm)4小时后,od600达到约0.8,加入0.05mmiptg和25μm维生素b12,继续培养36h(35℃、220rpm),使用高效液相色谱法测量3-羟基丙酸和1,3-丙二醇产量,液相色谱条件为:aminexhpx-87hcolumn色谱柱、0.4ml/min、65℃、rid检测器35℃、uv检测器210nm;如图2所示,含gabd4基因的ecs2更适合3-羟基丙酸的生产(2.98g/l),而含yqhd的ecs3更适合1,3-丙二醇的生产(2.16g/l)。
70.实施例3:联产3-羟基丙酸和1,3-丙二醇的基因工程菌的构建:
71.(1)根据重组质粒ps3序列以及yqhd基因序列,使用oligo7.0软件设计引物:
72.backbone1f:attagttaagtataagaaggagatatacat(seqidno:27);
73.backbone1f:gtggcagcagcctaggttaa(seqidno:28);
74.yqhd2f:attagttaagtataagaaggagatatacatatgaacaactttaatctgcacac(seqidno:29);
75.yqhd2r:gtggcagcagcctaggttaattagcgggcggcttcgtat(seqidno:30)。
76.(2)以重组质粒ps2为模板,使用引物对backbone1f和backbone1r扩增获得线性化的ps2骨架,使用yqhd2f和yqhd2r引物对扩增重组质粒ps3上的yqhd基因,使用吉布森
组装在50℃下反应30min将yqhd基因连接至线性化的ps2骨架,得到协同表达gabd4和yqhd的重组质粒。
77.通过标准热激法将协同表达gabd4和yqhd的重组质粒转化进入e.colidh5α感受态中,具体步骤如下所示:
78.将e.colidh5α感受态冰浴5min后分别加入协同表达gabd4和yqhd的重组质粒,冰浴30min,42℃热激45s,冰浴2min,加入1ml无抗生素lb培养基,37℃培养1h后涂布还有100μg/ml氨苄青霉素的lb平板。
79.挑取适量单菌落培养并提取重组质粒,送苏州金唯智测序验证,验证正确的重组质粒分别命名为ps5,如图1所示,其中gabd4和yqhd基因的表达由各自的t7启动子驱动。
80.(3)将ps0和ps5经电击法转入e.coliw3110(de3),电击参数为:电转杯1mm,电压1800v,电阻200ω,电容25μf,获得一株联产3-羟基丙酸和1,3-丙二醇的工程菌,命名为ecs5,其具体基因组成如图1所示,由相容性复制起点的质粒pacycduet-1和petduet-1衍生而来。
81.(4)将上述基因工程菌ecs5在lb培养基中过夜活化(37℃、220rpm),按1%v/v接种量接种于改良mr培养基中培养(37℃、220rpm)4小时后,od600达到约0.8,加入0.05mmiptg和25μm维生素b12,继续培养36h(35℃、220rpm),使用高效液相色谱法测量3-羟基丙酸和1,3-丙二醇产量,结果如图2所示。
82.从图2中可以看出,ecs5可以联产3-羟基丙酸和1,3-丙二醇,其中3-羟基丙酸2.49g/l,1,3-丙二醇1.93g/l,净产量(3-羟基丙酸 1,3-丙二醇)为4.42g/l,显著高于3-羟基丙酸生产工程菌ecs2和1,3-丙二醇生产工程菌ecs3;且联产3-羟基丙酸和1,3-丙二醇的工程菌ecs5中3-羟基醛积累量远小于3-羟基丙酸生产工程菌ecs2和1,3-丙二醇生产工程菌ecs3。
83.实施例4:utr工程优化工程菌ecs5中gabd4和yqhd表达量:
84.(1)根据gabd4和yqhd基因序列,使用utrdesigner工具进行utr优化,具体地,gabd4基因的utr由tttaactttaagaaggagatatacc(seqidno:31)优化为taagacgaaaagaaggagattagaa(seqidno:32);
85.pduq基因的utr由ttaagtataagaaggagatatacat(seqidno:33)优化为taagcgcggcgaaggagataacaac(seqidno:34)。
86.(2)根据重组质粒ps5序列,以及优化后的utr序列,使用oligo7.0软件设计引物:
87.gabd4-utrf:taagacgaaaagaaggagattagaaatgtaccaagatctggcac(seqidno:35);
88.gabd4-utrr:ttctaatctccttcttttcgtcttacaaaattatttctagaggggaattg(seqidno:36);
89.yqhd-utrf:taagcgcggcgaaggagataacaacatgaacaactttaatctgcacac(seqidno:37);
90.yqhd-utrr:gttgttatctccttcgccgcgcttactaatatactaagatggggaattgt(seqidno:38)。
91.(2)以重组质粒ps5为模板,使用引物对gabd4-utrf和gabd4-utrr替换gabd4基因前的utr序列,接着使用yqhd-utrf和yqhd-utrr替换yqhd基因前的utr序列,使用吉布
森组装连接utr优化后的重组质粒,反应条件为:50℃30min;反应结束后得到utr优化后的协同表达gabd4和yqhd的重组质粒。
92.通过标准热激法将utr优化后的协同表达gabd4和yqhd的重组质粒转化进入e.colidh5α感受态中,具体步骤如下所示:
93.将e.colidh5α感受态冰浴5min后分别加入协同表达gabd4和yqhd的重组质粒,冰浴30min,42℃热激45s,冰浴2min,加入1ml无抗生素lb培养基,37℃培养1h后涂布还有100μg/ml氨苄青霉素的lb平板。
94.挑取适量单菌落培养并提取重组质粒,送苏州金唯智测序验证,将验证正确的utr优化后的协同表达gabd4和yqhd的重组质粒记为ps6。
95.(3)将ps0和ps6经电击法转入e.coliw3110(de3),电击参数为:电转杯1mm,电压1800v,电阻200ω,电容25μf,获得utr优化后的基因工程菌,命名为ecs6。
96.(4)将上述基因工程菌ecs6在lb培养基中过夜活化(37℃、220rpm),按1%v/v接种量接种于改良mr培养基中培养(37℃、220rpm)4小时后,od600达到约0.8,加入0.05mmiptg和25μm维生素b12,继续培养36h(35℃、220rpm),使用高效液相色谱法测量3-羟基丙酸和1,3-丙二醇产量,测量结果如图4所示。
97.从图4中可以看出,ecs6联产3-羟基丙酸和1,3-丙二醇的能力相较工程菌ecs5得到较大改善,3-羟基丙酸和1,3-丙二醇净产量达到5.80g/l,比ecs5提高了31.2%。
98.实施例5:辅酶工程提高工程菌ecs6中辅酶循环再生:
99.(1)根据大肠杆菌pntab基因序列,结合utr优化后的协同表达gabd4和yqhd的重组质粒ps6序列特性,使用oligo7.0软件设计引物:
100.backbone2f:ttacgcttgggtgatgaacttg(seqidno:39);
101.backbone2r:gtcgacaagcttgcggc(seqidno:40);
102.pntabf:accaagttcatcacccaagcgtaaaaccgatggaagggaatatcatgc(seqidno:41);
103.pntabr:gcggccgcaagcttgtcgacttacagagctttcaggattgcatccac(seqidno:42)。
104.(2)以e.coliw3110为模板,使用引物对pntabf和pntabr扩增pntab基因序列;使用backbone2f和backbone2r扩增重组质粒ps6骨架,将ps6骨架和pntab基因,使用吉布森组装连接获得重组质粒,反应条件为:50℃下反应30min。
105.通过标准热激法将协同表达gabd4、yqhd和pntab的的重组质粒转化进入e.colidh5α感受态中,具体步骤如下所示:
106.将e.colidh5α感受态冰浴5min后分别加入协同表达gabd4和yqhd的重组质粒,冰浴30min,42℃热激45s,冰浴2min,加入1ml无抗生素lb培养基,37℃培养1h后涂布还有100μg/ml氨苄青霉素的lb平板。
107.挑取适量单菌落培养并提取重组质粒,送苏州金唯智测序验证,验证正确的协同表达gabd4、yqhd和pntab的的重组质粒记为ps7。
108.(3)将ps0和ps7经电击法转入e.coliw3110(de3),电击参数为:电转杯1mm,电压1800v,电阻200ω,电容25μf,获得的基因工程菌,命名为ecs7。
109.(4)将上述基因工程菌ecs7在lb培养基中过夜活化(37℃、220rpm),按1%v/v接
种量接种于改良mr培养基中培养(37℃、220rpm)4小时后,od600达到约0.8,加入 0.05mm iptg和25μm维生素b12,继续培养12h(35℃、220rpm),使用碧云天nad(p)h 和nad(p)
试剂盒测量工程菌ec s7胞内nadh/nad
和nadph/nadp
比率,测量结果如图5所示。
110.从图5中可以看出,工程菌ec s7中nadh/nad
较工程菌ec s6有所降低,而工程菌 ec s7中nadph/nadp
较工程菌ec s6有所提高,这表明ec s7中辅酶nad
和nadph 供应增加;将ec s7继续培养36h(35℃、220rpm),使用高效液相色谱法测量3-羟基丙酸和1,3-丙二醇产量,如图6所示,ec s7联产3-羟基丙酸和1,3-丙二醇的能力相较工程菌ec s6 得到较大改善,3-羟基丙酸和1,3-丙二醇净产量达到8.32g/l,比ec s5提高了20.9%。
111.实施例6:辅酶工程降低工程菌ec s7中辅酶循环降解:
112.(1)根据可溶型吡啶核苷酸转氢酶(stha)基因序列,使用sgrnacas9选择合适靶点生成合适的sgrna序列;根据上述基因序列和ptargetf质粒的序列特性使用oligo7.0软件设计用于stha基因敲除的引物:
113.sgrna-stha f:ccgcgccatgtacttatctagttttagagctagaaatagc(seq id no:43);
114.sgrna-stha r:tagataagtacatggcgcggactagtattatacctaggac(seq id no:44);
115.stha-up f:agttcgtctacgtcgcggaaatgc(seq id no:45);
116.stha-up r:gccatttcgataaagttttacatggtagggcttacctgt(seq id no:46);
117.stha-down f:aacaggtaagccctaccatgtaaaactttatcgaaatggccatc(seq id no:47);
118.stha-down r:tcctcgcgctggtgaaaga(seq id no:48)。
119.(2)以ptargetf质粒为模板,使用引物对sgrna-stha f和sgrna-stha r扩增获得靶向stha基因的ptargetf骨架;使用吉布森组装使其自连,获得重组质粒ptargetf-stha。
120.(3)使用大肠杆菌e.coli w3110(de3)基因组为模板,使用引物对stha-up f和stha-upr扩增stha基因上游序列;使用引物对stha-down f和stha-down r扩增stha基因下游序列;并以stha基因上游序列和stha基因下游序列为模板,使用引物对stha-up f和stha-down r 扩增获得stha基因上下游同源臂。
121.(4)stha基因的敲除:
122.将pcas9质粒转化进入e.coli w3110(de3)中,得到含有pcas9质粒的e.coliw3110(de3),然后将其经过0.1m的l-阿拉伯糖诱导后制作成为电转感受态。接着将100ng 的重组质粒ptargetf-stha和400ng的stha基因上下游同源臂使用电击转化入含有pcas9质粒的e.coli w3110(de3)中。所述电转参数为:电压1800v,电阻200ω,电容25μf,电转杯1mm,电击间1.5ms,30℃培养2h后涂布含有50μg/ml壮观霉素和50μg/ml卡那霉素的lb平板,30℃培养24-48h。
123.挑取培养后的单菌落,使用引物对stha up f和stha down r进行菌落pcr验证,将疑似基因敲除的工程菌送苏州金唯智测序验证,将验证正确的stha基因敲除工程菌保存备用。
124.(5)对于上述测序验证正确的stha基因敲除工程菌,将其在含有50μg/ml卡那霉素的 lb液体培养基中进行培养,使用0.5mm iptg进行诱导(30℃12h),除去重组质粒 ptargetf-stha,接着将除去重组质粒ptargetf-stha的工程菌进行过夜培养(37℃)除去pcas9 质粒,获得成功除去重组质粒ptargetf-stha和pcas9的stha基因敲除工程菌,记为
ec01。
125.(3)将ps0和ps7经电击法转入ec01中,电击参数为:电转杯1mm,电压1800v,电阻200ω,电容25μf,获得的基因工程菌,命名为ec01 s7,其基因型见图7。
126.(4)将上述基因工程菌ec01 s7在lb培养基中过夜活化(37℃、220rpm),按1%v/v 接种量接种于改良mr培养基中培养(37℃、220rpm)4小时后,od600达到约0.8,加入 0.05mm iptg和25μm维生素b12,继续培养12h(35℃、220rpm)。
127.使用碧云天nad(p)h和nad(p)
试剂盒测量工程菌ec s7胞内nadh/nad
和 nadph/nadp
比率,结果如图5所示。从图5中可以看出,工程菌ec01 s7中nadh/nad
较工程菌ec s7进一步下降,而工程菌ec01 s7中nadph/nadp
较工程菌ec s6则进一步提高,这表明ec01 s7中辅酶nad
和nadph降解被削弱。
128.将ec01 s7继续培养36h(35℃、220rpm),使用高效液相色谱法测量3-羟基丙酸和1,3
‑ꢀ
丙二醇产量,测量结果如图6所示。从图6中可以看出,ec01 s7联产3-羟基丙酸和1,3-丙二醇的能力相较工程菌ec s7得到较大改善,3-羟基丙酸和1,3-丙二醇净产量达到9.51g/l。
129.综上所述,本发明中所构建的基因工程菌可以通过微生物发酵,以生物柴油产物废弃物甘油为底物,高效联产3-羟基丙酸和1,3-丙二醇。
130.所述实施例为本发明的优选的实施方式,但本发明并不限于上述实施方式,在不背离本发明的实质内容的情况下,本领域技术人员能够做出的任何显而易见的改进、替换或变型均属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。