1.本发明属于药物化学领域,具体涉及一种吖啶类化合物及其制备方法和应用。
背景技术:
2.组蛋白赖氨酸去甲基化酶1(lysine specific demethylase l,lsd1)是由哈佛大学施扬教授于2004年发现的第一个组蛋白赖氨酸去甲基化酶,其主要功能是能够特异性去除组蛋白h3k4的单、双甲基化,从而抑制基因转录以及调控基因表达。lsd1还可与雌激素受体或雄激素受体相互作用,特异性去除h3k9me1/2的甲基化,引起激素受体依赖的基因转录激活。此外,lsd1还可对p53、e2f1、dnmt1和stat3等非组蛋白底物发挥去甲基化作用,并进一步调节它们下游细胞的功能。此外,越来越多研究证实lsd1在小细胞肺癌、胃癌、前列腺癌、乳腺癌、膀胱癌和白血病等肿瘤中高表达,与肿瘤的分化、增殖、转移、侵袭、免疫及不良预后相关,使用lsd1抑制剂或rnai下调lsd1表达可显著抑制肿瘤的发生发展。
3.因此,lsd1是一种极具潜力的抗肿瘤靶标,针对高效低毒的lsd1抑制剂的研究开发,使之有效用于肿瘤的预防和治疗,已成为当前肿瘤药物研究的热点,也是未来重要的研究方向。
4.目前,已有研究报道证实,吖啶类化合物具有抗菌、抗疟、抗癌等生物和药理活性。吖啶类化合物作为新型的具有抗肿瘤潜力的化合物,已成为药物研发的热点和重点。但是,目前尚无将吖啶类化合物与基于lsd1靶点的抗肿瘤作用相联系起到抗肿瘤作用的研究报道。
5.因此,针对性开发一种对lsd1具有良好抑制活性的新型吖啶类药物,对基于lsd1靶点的抗肿瘤药物的研发和相关疾病的研究治疗具有重要意义。
技术实现要素:
6.为了解决上述问题,本发明的目的在于提供一种吖啶类化合物,该化合物对lsd1具有较强的抑制活性。
7.本发明的目的还在于提供一种吖啶类化合物的制备方法,其能够有效制备得到对lsd1具有较强的抑制活性的吖啶类化合物。
8.本发明的目的还在于提供一种吖啶类化合物的应用,具体是在制备基于lsd1靶点的抗肿瘤药物中的应用。
9.本发明的吖啶类化合物,所采用的技术方案是:
10.一种吖啶类化合物,为式ⅰ所示的化合物或其药学上可接受的盐:
[0011][0012]
其中,r1选自h、f、ch3、och3或cf3;r2选自h、cl、f、ch3、ch2ch3、(ch3)2ch、sch3、cn、n
(ch3)2、och3或c6h5;
[0013]
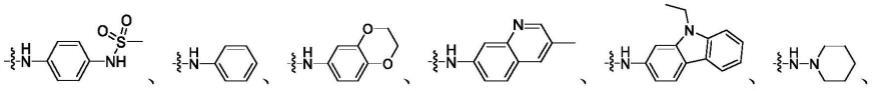
r3选自选自选自中的一种。
[0014]
本发明的吖啶类化合物,在吖啶的9-位引入特征的脂肪胺、芳胺、苯酚和苯硫酚基团修饰,为一种骨架新颖、高效低毒的吖啶类化合物。经lsd1抑制活性试验证实,具有上述特征结构的吖啶类化合物对lsd1具有较好的抑制活性,能够为开发高效的基于lsd1靶点的抗肿瘤药物提供全新的结构骨架。
[0015]
为了进一步提高吖啶类化合物对lsd1的抑制活性,优选地,所述r2选自h、cl、f、ch3、ch2ch3、(ch3)2ch、sch3、cn、och3或c6h5;
[0016]
进一步优选地,所述r3选自选自选自中的一种。
[0017]
根据对吖啶类化合物的制备成本和抑制活性的需求差异,在实际药物制备应用中,r1、r2、r3可选自如下典型的r1、r2、r3基团组,从而构建得到编号为1~56的吖啶类化合物。具体地,r1、r2、r3选自如下基团组:
[0018]
[0019][0020]
为进一步优化吖啶类化合物对lsd1的抑制活性,优选地,r1、r2、r3选自第1-3、5-6、11-14、16-20、25-31、33-42、44-56基团组,得到吖啶类化合物1-3、5-6、11-14、16-20、25-31、33-42、44-56,对于lsd1的抑制率可达80%以上。更为优选地,r1、r2、r3选自第1-3、5-6、11-14、16-17、19-20、25-30、33-42、44-56基团组,得到吖啶类化合物1-3、5-6、11-14、16-17、19-20、25-30、33-42、44-56,对于lsd1的抑制率可达90%以上。
[0021]
本发明的吖啶类化合物的制备方法的技术方案是:
[0022]
一种吖啶类化合物的制备方法,选自合成路线
①
或合成路线
②
;所述合成路线
①
,包括以下步骤:
[0023][0024]
1)将式ⅱ化合物、式ⅲ化合物、碱性物质a、催化剂a于有机溶剂a中反应,制得式ⅳ化合物;2)将式ⅳ化合物在三氯氧磷或氯化亚砜的作用下于有机溶剂b中反应,制得式
ⅴ
化合物;3)将式
ⅴ
化合物、r3h、催化剂b在有机溶剂c中反应,得到式ⅰ所示的吖啶类化合物;
[0025]
所述合成路线
②
,包括以下步骤:
[0026][0027]
a)将式ⅱ化合物、式ⅲ化合物、碱性物质a、催化剂a于有机溶剂a中反应,制得式ⅳ化合物;b)将式ⅳ化合物在三氯氧磷或氯化亚砜的作用下于有机溶剂b中反应,制得式
ⅴ
化合物;c)将式
ⅴ
化合物、胺类物质在有机溶剂d中反应,制得式ⅵ化合物;所述胺类物质为碳酸胺、硫酸铵、氨水中的一种;d)将式ⅵ化合物、r3x、碱性物质b、催化剂c于有机溶剂e中反应,得到式ⅰ所示的吖啶类化合物;其中x为br、cl中的一种。
[0028]
本发明的制备方法,具有反应条件温和、操作简单、收率高的特点。本发明以简单易得的邻氯苯甲酸和不同取代的苯胺为起始原料,首先合成含不同取代基的9-氯吖啶或9-氨基吖啶,并以不同的脂肪胺、芳胺、苯酚和苯硫酚等在吖啶环的9位进行基团修饰,设计合成了本发明的化合物,该类化合物在保留吖啶的活性的同时,也兼具修饰基团的特性,改善了原有分子的生物学活性,对lsd1表现出良好的一致性,提高了目标分子的抗肿瘤活性。
[0029]
为提高合成效率和合成效果,优选地,采用合成路线
①
进行吖啶类化合物1-2、6-29、33-56的合成,采用合成路线
②
进行吖啶类化合物3-5、30-32的合成。
[0030]
优选地,所述有机溶剂a、b、c、e各自独立的选自n,n-二甲基甲酰胺、n-甲基吡咯烷酮、四氢呋喃、乙腈、二氧六环、甲醇、乙醇、甲苯中的一种;所述有机溶剂d为苯酚、二甲基亚砜、n,n-二甲基甲酰胺、聚乙二醇中的一种。
[0031]
为更好地降低副反应的发生,进一步提高反应的选择性,优选地,所述催化剂a为铜粉;所述催化剂b为冰醋酸、盐酸、硫酸中的一种;所述催化剂c为四(三苯基膦)钯、双(三
苯基膦)二氯化钯、双(二亚苄基丙酮)钯中的一种。
[0032]
为进一步促进原料的转化,减少副反应的发生,所述碱性物质a为碳酸钾、碳酸铯、叔丁醇钠、叔丁醇钾、三乙胺、吡啶、氢氧化钠、氢氧化钾中的一种;所述碱性物质b为叔丁醇钠、叔丁醇钾、乙醇钠、甲醇钠中的一种。
[0033]
基于降低反应能耗并保证转化效果的考虑,优选地,步骤1)和步骤a)的反应温度为80~160℃;步骤2)和步骤b)的反应温度为60~150℃;步骤3)的反应温度为20~80℃;步骤c)的反应温度为90~180℃;步骤d)的反应温度为60~150℃。
[0034]
本发明的吖啶类化合物的应用的技术方案是:
[0035]
一种吖啶类化合物的应用,具体是吖啶类化合物在制备基于lsd1靶点的抗肿瘤药物中的应用。
[0036]
本发明提供的吖啶类化合物在制备基于lsd1靶点的抗肿瘤药物中的应用,所涉及的吖啶类化合物对lsd1表现出了良好的抑制活性,显示出良好的药物开发潜力,为基于lsd1靶点的药物研发提供了新方向。
具体实施方式
[0037]
下面结合具体实施方式对本发明做进一步描述。以下实施例所涉及的化学原料,均可通过常规市售渠道获得。其中,本发明的吖啶类化合物,均符合式ⅰ所示的结构通式,为了表述方便,以下实施例中,仅对吖啶类化合物的取代基团r1、r2、r3进行具体限定。此外,实施例1-50所涉及的吖啶类化合物1-2、6-29、33-56,采用合成路线
①
制备得到;实施例51-56所涉及的吖啶类化合物3-5、30-32,采用合成路线
②
制备得到。
[0038]
实施例1
[0039]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0040]
吖啶类化合物1,符合通式式ⅰ,其中,r1=h,r2=h,
[0041]
吖啶类化合物1的制备方法,包括以下步骤:
[0042]
1)将式ⅱ化合物(1.57g,10mmol)、式ⅲ化合物(0.931g,12mmol)溶于无水n,n-二甲基甲酰胺(15ml)中,然后依次加入无水碳酸钾(2.346g,17mmol)和铜粉(0.256g,4mmol),回流反应,tlc监测反应进度。反应完成后,抽滤,向所得滤液中缓慢加入适量水,然后用盐酸(6mol/l)调ph至4,抽滤并烘干所得到的固体即为中间体式ⅳ化合物粗产品;
[0043]
2)将中间体式ⅳ化合物(213mg,1mmol)溶于无水1,4-二氧六环(5ml),然后缓慢滴加三氯氧磷(1ml),回流反应,tlc监测反应进度。反应完成后,旋蒸除去1,4-二氧六环,冷却后,往所得油渣中加入浓氨水(1ml)、碎冰(4g)、二氯甲烷(5ml)的混合溶液,室温搅拌约30分钟,将体系溶于二氯甲烷(25ml)中,用饱和食盐水(3
×
25ml)洗涤,有机相用无水硫酸镁干燥,过滤,旋蒸除去溶剂后,经柱层析分离得到式
ⅴ
(1)
化合物,收率为82.1%。
[0044]
3)将式
ⅴ
化合物(107mg,0.5mmol)溶于n-甲基吡咯烷酮(2ml)中,然后加入4-甲磺酰胺基苯胺(132mg,1mmol),室温反应,tlc监测反应进度。反应完成后,旋蒸除去n-甲基吡咯烷酮,将残余物溶于乙酸乙酯中,依次用水和饱和食盐水洗涤,有机相用无水硫酸镁干燥,过滤,旋蒸除去溶剂后,经柱层析分离得到吖啶类化合物1,收率为58.8%。1h nmr(400mhz,dmso-d6)δ9.78(s,1h),8.06(d,j=6.9hz,2h),7.81
–
7.73(m,4h),7.26(d,j=
8.7hz,2h),7.24
–
7.20(m,2h),7.10(d,j=8.1hz,2h),3.01(s,3h).
13
c nmr(100mhz,dmso-d6)δ152.69,140.75,134.69,133.14,126.25,122.27,122.08,121.88,118.85,115.75,48.55.hr-ms(esi):calcd.c
20h17
n3o2s,[m h]
m/z:364.1119,found:364.1116.
[0045]
实施例2
[0046]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0047]
吖啶类化合物2,符合通式式ⅰ,其中,r1=h,r2=h,
[0048]
吖啶类化合物2的制备方法,与实施例1基本相同,区别仅在于:将步骤3)中的4-甲磺酰胺基苯胺替换为苯胺,制备得到化合物2,收率为60.7%。结构表征为:1h nmr(400mhz,dmso-d6)δ8.26(d,j=8.7hz,2h),8.15(d,j=8.5hz,2h),8.00(t,j=7.7hz,2h),7.53(t,j=7.8hz,2h),7.56
–
7.49(m,5h).
13
c nmr(100mhz,dmso-d6)δ155.19,140.95,140.09,135.20,129.90,127.44,125.76,124.61,123.70,119.20,113.63.hr-ms(esi):calcd.c
19h14
n2,[m h]
m/z:271.1235,found:271.1232.
[0049]
实施例3
[0050]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0051]
吖啶类化合物6,符合通式式ⅰ,其中,r1=h,r2=h,
[0052]
吖啶类化合物6的制备方法,与实施例1的步骤1)、2)相同,步骤3)为:将式
ⅴ
化合物(107mg,0.5mmol)溶解于乙腈(2ml)中,然后加入1-氨基哌啶(100.16mg,1mmol),回流反应,tlc监测反应进度。反应完成后,旋蒸除去乙腈,将残余物溶于乙酸乙酯中,依次用水和饱和食盐水洗涤,有机相用无水硫酸镁干燥,过滤,旋蒸除去溶剂后,经柱层析分离得到吖啶类化合物6,收率为49.6%。1h nmr(400mhz,cdcl3)δ9.17(s,2h),7.80(d,j=8.1hz,2h),7.39(t,j=7.2hz,2h),7.13(t,j=7.6hz,2h),3.21(s,4h),1.79(t,j=5.1hz,4h),1.34(s,1h),1.28
–
1.26(d,j=10.2hz,2h).
13
c nmr(100mhz,cdcl3)δ151.12,140.10,132.88,127.15,122.29,118.48,113.34,55.74,25.57,23.07.hr-ms(esi):calcd.c
18h19
n3,[m h]
m/z:278.1657,found:278.1655.
[0053]
实施例4
[0054]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0055]
吖啶类化合物7,符合通式式ⅰ,其中,r1=h,r2=h,
[0056]
吖啶类化合物7的制备方法,与实施例6的区别在于:实施例6中的1-氨基哌啶替换为n-(2-氨基乙基)吗啉,制备得到吖啶类化合物7,收率为42.3%。结构表征为:1h nmr(400mhz,cdcl3)δ8.35(d,j=8.6hz,2h),8.15(d,j=8.8hz,2h),7.62(t,j=7.7hz,2h),7.32(t,j=7.9hz,2h),4.30(t,j=5.9hz,2h),3.85(t,j=4.2hz,4h),3.03(t,j=5.9hz,2h),2.74(s,4h).
13
c nmr(100mhz,dmso-d6)δ157.82,140.30,135.22,126.21,123.80,119.22,113.10,66.61,56.58,53.21,46.04.hr-ms(esi):calcd.c
19h21
n3o,[m h]
m/z:308.1763,found:308.1760.
[0057]
实施例5
[0058]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0059]
吖啶类化合物8,符合通式式ⅰ,其中,r1=h,r2=h,
[0060]
吖啶类化合物8的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为对甲苯胺,制备得到化合物8,收率为56.2%。结构表征为:1h nmr(400mhz,cdcl3)δ8.00(d,j=8.6hz,2h),7.95(d,j=7.7hz,2h),7.62(t,j=7.6hz,2h),7.25(t,j=7.6hz,2h),7.05(d,j=8.1hz,2h),6.79(d,j=8.3hz,2h),2.31(s,3h).
13
c nmr(100mhz,cdcl3)δ131.36,130.36,129.99,124.51,123.74,119.99,118.01,20.74.hr-ms(esi):calcd.c
20h16
n2,[m h]
m/z:285.1391,found:285.1387.
[0061]
实施例6
[0062]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0063]
吖啶类化合物9,符合通式式ⅰ,其中,r1=h,r2=h,
[0064]
吖啶类化合物9的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为对异丙基苯胺,制备得到化合物9,收率81.6%。结构表征为:1h nmr(400mhz,cdcl3)δ8.01(d,j=8.6hz,4h),7.64(t,j=7.5hz,2h),7.28(d,j=7.5hz,2h),7.11(d,j=8.4hz,2h),6.81(d,j=8.4hz,2h),2.87(dt,j=13.8,6.9hz,1h),1.24(d,j=6.9hz,6h).
13
c nmr(100mhz,cdcl3)δ142.55,130.38,127.34,124.41,123.87,120.04,117.87,33.42,24.12.hr-ms(esi):calcd.c
22h20
n2,[m h]
m/z:313.1704,found:313.1705.
[0065]
实施例7
[0066]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0067]
吖啶类化合物10,符合通式式ⅰ,其中,r1=h,r2=h,
[0068]
吖啶类化合物10的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为对氰基苯胺,制备得到化合物10,收率48.8%。结构表征为:1h nmr(400mhz,dmso-d6)δ8.33(d,j=8.8hz,2h),8.25(d,j=8.6hz,2h),8.07(t,j=7.7hz,2h),7.88(d,j=8.6hz,2h),7.58
–
7.51(m,4h).
13
c nmr(100mhz,dmso-d6)δ154.25,140.32,135.61,133.72,125.89,124.66,122.63,119.61,118.75,115.81,107.16.hr-ms(esi):calcd.c
20h13
n3,[m h]
m/z:296.1187,found:296.1186.
[0069]
实施例8
[0070]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0071]
吖啶类化合物11,符合通式式ⅰ,其中,r1=h,r2=h,
[0072]
吖啶类化合物11的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为对苯二胺,制备得到啶类化合物11,收率60.2%。结构表征为:1h nmr(400mhz,dmso-d6)δ8.19(s,2h),7.92(d,j=8.4hz,2h),7.84(t,j=7.6hz,2h),7.30(t,j=7.5hz,2h),7.00(d,j=8.4hz,2h),6.66(d,j=8.5hz,2h),6.59(s,1h).
13
c nmr(100mhz,dmso-d6)δ153.95,147.74,140.45,134.00,125.81,124.79,122.61,119.07,114.61,113.91.hr-ms(esi):calcd.c
19h15
n3,[m h]
m/z:286.1344,found:286.1349.
[0073]
实施例9
[0074]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0075]
吖啶类化合物12,符合通式式ⅰ,其中,r1=h,r2=h,
[0076]
吖啶类化合物12的制备方法,与实施例1的步骤1)、2)相同,步骤3)为:将式
ⅴ
化合物(107mg,0.5mmol)溶解于1,4-二氧六环(5ml)中,然后加入对氨基苯酚(100.16mg,1mmol)和氢氧化钠(40mg,1mmol),回流反应,tlc监测反应进度。反应完成后,旋蒸除去溶剂,将残余物溶于乙酸乙酯中,依次用水和饱和食盐水洗涤,有机相用无水硫酸镁干燥,过滤,旋蒸除去溶剂后,经柱层析分离得到吖啶类化合物12,收率为49.9%。1h nmr(400mhz,dmso-d6)δ10.49(s,1h),10.04(s,1h),8.23(d,j=8.2hz,2h),8.07(d,j=8.5hz,2h),7.93(t,j=7.6hz,2h),7.39(t,j=7.7hz,2h),7.26(d,j=8.7hz,2h),6.94(d,j=8.7hz,2h).
13
c nmr(100mhz,dmso-d6)δ156.98,155.00,140.07,134.75,126.18,125.72,123.21,118.97,116.48,113.20.hr-ms(esi):calcd.c
19h14
n2o,[m h]
m/z:287.1184,found:287.1182.
[0077]
实施例10
[0078]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0079]
吖啶类化合物13,符合通式式ⅰ,其中,r1=h,r2=h,
[0080]
吖啶类化合物13的制备方法,与实施例1的步骤1)、2)相同,步骤3)为:将式
ⅴ
化合物(107mg,0.5mmol)溶解于1,4-二氧六环(5ml)中,然后加入对氨基苯硫酚(100.16mg,1mmol),回流反应,tlc监测反应进度。反应完成后,旋蒸除去溶剂,将残余物溶于乙酸乙酯中,依次用水和饱和食盐水洗涤,有机相用无水硫酸镁干燥,过滤,旋蒸除去溶剂后,经柱层析分离得到吖啶类化合物13,收率为49.5%。结构表征为:1h nmr(400mhz,dmso-d6)δ8.81(d,j=8.8hz,2h),8.20(d,j=8.7hz,2h),7.88(dd,j=8.3,7.0hz,2h),7.71(t,j=7.9hz,2h),7.01(d,j=8.5hz,2h),6.42(d,j=8.6hz,2h),5.28(s,2h).
13
c nmr(100mhz,dmso-d6)δ149.97,148.55,148.46,142.06,134.31,131.90,130.58,130.44,129.98,129.84,127.74,127.66,127.36,127.10,126.54,126.32,119.19,114.69,114.13.hr-ms(esi):calcd.c
19h14
n2s,[m h]
m/z:303.0956,found:303.0957.
[0081]
实施例11
[0082]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0083]
吖啶类化合物14,符合通式式ⅰ,其中,r1=h,r2=h,
[0084]
吖啶类化合物14的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为邻苯二胺,制备得到化合物14,收率为88.1%。结构表征为:1h nmr(400mhz,dmso-d6)δ8.21(s,2h),7.87(d,j=27.7hz,4h),7.27(s,2h),7.12(s,1h),6.90(t,j=8.7hz,2h),6.60(t,j=7.4hz,1h),5.39(s,2h).
13
c nmr(100mhz,dmso-d6)δ155.04,139.98,133.96,125.98,122.47,118.37,116.55,115.52,114.27.hr-ms(esi):calcd.c
19h15
n3,[m h]
m/z:286.1344,found:286.1345.
[0085]
实施例12
[0086]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0087]
吖啶类化合物15,符合通式式ⅰ,其中,r1=h,r2=h,
[0088]
吖啶类化合物15的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为间苯二胺,其余与实施例1相同,制备得到化合物15,收率为53.4%。结构表征为:hr-ms(esi):calcd.c
19h15
n3,[m h]
m/z:286.1344,found:286.1341.
[0089]
实施例13
[0090]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0091]
吖啶类化合物16,符合通式式ⅰ,其中,r1=h,r2=h,
[0092]
吖啶类化合物16的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为n-甲基对苯二胺,其余与实施例1相同,制备得到化合物16,收率为42.1%。1h nmr(400mhz,dmso-d6)δ10.60(s,1h),7.95(s,1h),7.51
–
7.45(m,4h),7.01(s,1h),6.92(dd,j=8.4,6.4hz,2h),6.68(s,3h),6.55(d,j=8.4hz,2h),5.51(s,1h),2.67(s,6h).
13
c nmr(100mhz,dmso-d6)δ130.92,125.60,119.38,116.41,112.44,40.67.hr-ms(esi):calcd.c
20h17
n3,[m h]
m/z:300.1500,found:300.1503.
[0093]
实施例14
[0094]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0095]
吖啶类化合物17,符合通式式ⅰ,其中,r1=h,r2=h,
[0096]
吖啶类化合物17的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为3-甲氧基苯胺,其余与实施例1相同,制备得到化合物17,收率为45.3%。
[0097]
结构表征为:1h nmr(400mhz,cdcl3)δ7.97(d,j=8.4hz,2h),7.87(d,j=6.2hz,2h),7.59(t,j=7.5hz,2h),7.21(t,j=7.5hz,2h),6.89
–
6.82(m,4h),3.79(s,3h).
13
c nmr(100mhz,cdcl3)δ155.33,147.02,130.39,124.74,123.22,120.29,119.23,114.83,55.57.hr-ms(esi):calcd.c
20h16
n2o,[m h]
m/z:301.1341,found:301.1342.
[0098]
实施例15
[0099]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0100]
吖啶类化合物18,符合通式式ⅰ,其中,r1=h,r2=h,
[0101]
吖啶类化合物18的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为4-(甲硫基)苯胺,制备得到化合物18,收率为69.8%。1h nmr(400mhz,dmso-d6)δ10.96(s,1h),7.89(s,2h),7.52(s,4h),7.24(d,j=8.4hz,2h),7.03(s,2h),6.76(d,j=8.4hz,2h),2.46(s,3h).
13
c nmr(100mhz,dmso-d6)δ131.07,128.79,128.57,118.66,16.09.hr-ms(esi):calcd.c
20h16
n2s,[m h]
m/z:317.1112,found:317.1106.
[0102]
实施例16
[0103]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0104]
吖啶类化合物19,符合通式式ⅰ,其中,r1=h,r2=h,
[0105]
吖啶类化合物19的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为n,n-二甲基-1,4-苯二胺,制备得到化合物19,收率为76.9%。1h nmr(400mhz,dmso-d6)δ8.11(s,2h),7.77(s,4h),7.23(s,2h),7.04(d,j=8.4hz,2h),6.79(d,j=8.7hz,2h),2.94(s,6h).
13
c nmr(100mhz,dmso-d6)δ152.40,147.91,141.12,132.83,
126.03,122.69,121.88,119.23,115.56,113.24,40.33.hr-ms(esi):calcd.c
21h19
n3,[m h]
m/z:314.1657,found:314.1654.
[0106]
实施例17
[0107]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0108]
吖啶类化合物20,符合通式式ⅰ,其中,r1=h,r2=h,
[0109]
吖啶类化合物20的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为n,n-二乙基对苯二胺,制备得到化合物20,收率为92.9%。1h nmr(400mhz,dmso-d6)δ8.26(d,j=6.2hz,2h),8.00(d,j=8.5hz,2h),7.89(t,j=7.6hz,2h),7.35(t,j=7.6hz,2h),7.19(d,j=8.8hz,2h),6.77(d,j=8.7hz,2h),3.39(dd,j=14.0,7.0hz,4h),1.13(t,j=7.0hz,6h).
13
c nmr(100mhz,dmso-d6)δ154.36,146.63,140.19,134.48,125.70,125.49,122.98,118.99,113.52,112.17,43.76,12.29.hr-ms(esi):calcd.c
23h23
n3,[m h]
m/z:342.1970,found:342.1968.
[0110]
实施例18
[0111]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0112]
吖啶类化合物21,符合通式式ⅰ,其中,r1=h,r2=h,
[0113]
吖啶类化合物21的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为4-氨基乙酰苯胺,制备得到化合物21,收率为55.7%。1h nmr(400mhz,dmso-d6)δ10.14(s,1h),8.06(d,j=8.0hz,2h),7.80
–
7.74(m,4h),7.66(d,j=8.7hz,2h),7.22(t,j=7.2hz,2h),7.08(d,j=8.4hz,2h),2.08(s,3h).
13
c nmr(100mhz,dmso-d6)δ168.11,152.73,140.67,136.26,133.18,126.09,122.07,121.94,120.06,118.84,115.50,23.89.hr-ms(esi):calcd.c
21h17
n3o,[m h]
m/z:328.1450,found:328.1446.
[0114]
实施例19
[0115]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0116]
吖啶类化合物22,符合通式式ⅰ,其中,r1=h,r2=h,
[0117]
吖啶类化合物22的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为4-氨基-n,n-二甲基苄基胺,制备得到化合物22,收率为48.2%。1h nmr(400mhz,cdcl3)δ7.96(d,j=8.5hz,2h),7.86(d,j=8.6hz,2h),7.52(t,j=7.5hz,2h),7.21(d,j=8.3hz,2h),7.12(t,j=7.7hz,2h),6.90(d,j=8.3hz,2h),3.50(s,2h),2.31(s,6h).
13
c nmr(100mhz,cdcl3)δ147.84,146.44,145.28,131.13,130.83,130.64,125.30,124.20,123.28,119.12,118.63,63.06,44.36.hr-ms(esi):calcd.c
22h21
n3,[m h]
m/z:328.1813,found:328.1809.
[0118]
实施例20
[0119]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0120]
吖啶类化合物23,符合通式式ⅰ,其中,r1=h,r2=h,
[0121]
吖啶类化合物23的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基
苯胺替换为4-氨基-n,n-二甲基苯甲酰胺,制备得到化合物23,收率为45.7%。1h nmr(400mhz,cdcl3)δ8.01(d,j=8.5hz,2h),7.83(d,j=7.9hz,2h),7.58(t,j=7.5hz,2h),7.36(d,j=8.4hz,2h),7.19(t,j=7.5hz,2h),6.86(d,j=8.4hz,2h),3.07(s,6h).
13
c nmr(100mhz,cdcl3)δ171.79,131.03,129.14,128.73,125.44,123.55,120.00,117.07.hr-ms(esi):calcd.c
22h19
n3o,[m h]
m/z:342.1606,found:342.1602.
[0122]
实施例21
[0123]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0124]
吖啶类化合物24,符合通式式ⅰ,其中,r1=h,r2=h,
[0125]
吖啶类化合物24的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为4-哌啶基苯胺,制备得到化合物24,收率为48.9%。1h nmr(400mhz,dmso-d6)δ10.76(s,1h),7.91(s,2h),7.51(d,j=6.5hz,4h),7.00(s,2h),6.90(d,j=8.8hz,2h),6.71(d,j=8.6hz,2h),3.07
–
3.04(m,2h),1.66
–
1.61(m,4h),1.52(dd,j=10.7,5.5hz,2h).
13
c nmr(100mhz,dmso-d6)δ147.17,130.96,126.44,120.58,119.28,117.35,50.36,25.37,23.76.hr-ms(esi):calcd.c
24h23
n3,[m h]
m/z:354.1970,found:354.1967.
[0126]
实施例22
[0127]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0128]
吖啶类化合物25,符合通式式ⅰ,其中,r1=h,r2=h,
[0129]
吖啶类化合物25的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为4-哌嗪基苯胺,制备得到化合物25,收率为41.7%。1h nmr(400mhz,dmso-d6)δ7.98(s,2h),7.66
–
7.59(m,4h),7.11(s,2h),6.98(d,j=8.8hz,2h),6.89(d,j=8.2hz,2h),3.53(t,j=4.5hz,4h),3.11(t,j=4.7hz,4h).
13
c nmr(100mhz,dmso-d6)δ155.07,147.08,132.10,126.33,124.50,121.40,120.90,117.28,52.35,43.31.hr-ms(esi):calcd.c
23h22
n4,[m h]
m/z:355.1922,found:413.2.
[0130]
实施例23
[0131]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0132]
吖啶类化合物26,符合通式式ⅰ,其中,r1=h,r2=h,
[0133]
化合物26的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为4-吗啉基苯胺,制备得到化合物26,收率为71.8%。1h nmr(400mhz,dmso-d6)δ7.97(s,2h),7.61(s,4h),7.10(s,2h),6.96(d,j=8.7hz,2h),6.88(d,j=8.4hz,2h),3.79
–
3.71(m,4h),3.09(d,j=4.2hz,4h).
13
c nmr(100mhz,dmso-d6)δ147.15,131.94,126.34,121.26,120.67,116.33,66.11,48.90.hr-ms(esi):calcd.c
23h21
n3o,[m h]
m/z:356.1763,found:356.1766.
[0134]
实施例24
[0135]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0136]
吖啶类化合物27,符合通式式ⅰ,其中,r1=h,r2=h,
[0137]
吖啶类化合物27的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基
苯胺替换为4-(4-甲基哌嗪)苯胺,制备得到化合物27,收率为49.9%。1h nmr(400mhz,meod)δ8.09(d,j=8.8hz,2h),7.86
–
7.79(m,4h),7.29(t,j=7.5hz,2h),7.22(d,j=8.9hz,2h),7.05(d,j=8.9hz,2h),3.38(s,4h),3.05(s,4h),2.65(s,3h).
13
c nmr(100mhz,meod)δ156.99,151.31,141.91,136.43,134.18,126.95,126.79,125.03,120.30,118.38,115.03,64.16,55.13,44.64.hr-ms(esi):calcd.c
24h24
n4,[m h]
m/z:369.2079,found:369.2076.
[0138]
实施例25
[0139]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0140]
吖啶类化合物28,符合通式式ⅰ,其中,r1=h,r2=h,
[0141]
吖啶类化合物28的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为4-(4-乙基哌嗪-1-基)苯胺,制备得到化合物28,收率为46.6%。1h nmr(400mhz,dmso-d6)δ7.91(s,2h),7.53(d,j=5.2hz,4h),7.01(s,2h),6.94(d,j=8.7hz,2h),6.76(d,j=8.5hz,2h),3.21(s,4h),2.82(s,4h),2.68(s,2h),1.14(t,j=7.0hz,3h).
13
c nmr(100mhz,dmso-d6)δ145.93,131.22,126.51,120.71,119.58,117.03,51.56,51.20,47.86,10.78.hr-ms(esi):calcd.c
25h26
n4,[m h]
m/z:383.2235,found:383.2232.
[0142]
实施例26
[0143]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0144]
吖啶类化合物29,符合通式式ⅰ,其中,r1=h,r2=h,
[0145]
吖啶类化合物29的制备方法,与实施例1的区别在于:将步骤3)中的4-甲磺酰胺基苯胺替换为4-(4-苄基哌嗪基)苯胺,制备得到化合物29,收率为86.3%。1h nmr(400mhz,dmso-d6)δ8.08(d,j=7.0hz,2h),7.79
–
7.71(m,4h),7.40
–
7.31(m,5h),7.19(t,j=7.3hz,2h),6.99(q,j=9.2hz,4h),3.68(s,2h),3.23(s,4h),2.66(s,4h).
13
c nmr(100mhz,dmso-d6)δ131.63,129.01,128.19,127.07,126.41,121.02,120.29,116.71,61.85,52.46,48.61.hr-ms(esi):calcd.c
30h28
n4,[m h]
m/z:445.2392,found:445.2396.
[0146]
实施例27
[0147]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0148]
吖啶类化合物33,符合通式式ⅰ,其中,r1=h,r2=2-ch3,
[0149]
化合物33的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为对甲苯胺,制备得到式
ⅴ
(2)
化合物,收率为63.1%;将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(2)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到化合物33,收率为40.2%。1h nmr(400mhz,dmso-d6)δ8.07
–
8.02(m,2h),7.91(d,j=8.5hz,1h),7.85(d,j=8.6hz,1h),7.77(t,j=7.6hz,1h),7.69(d,j=8.7hz,1h),7.22(t,j=7.7hz,1h),7.09(d,j=8.7hz,2h),6.80(d,j=8.9hz,2h),2.94(s,6h),2.34(s,3h).
13
c nmr(100mhz,dmso-d6)δ148.08,134.75,132.58,131.62,125.94,124.46,122.96,121.82,119.98,119.75,113.12,40.31,20.99.hr-ms(esi):calcd.c
22h21
n3,[m h]
m/z:328.1813,found:328.1810.
[0150]
实施例28
[0151]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0152]
吖啶类化合物34,符合通式式ⅰ,其中,r1=h,r2=2-cl,
[0153]
吖啶类化合物34的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为对氯苯胺,制备得到式
ⅴ
(3)
化合物,收率为45.1%。将步骤2)中的式
ⅴ
(1)
化合物替换为以上合成的式
ⅴ
(3)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,其它条件相同,制备得到吖啶类化合物34,收率为79.2%。结构表征为:1h nmr(400mhz,dmso-d6)δ10.81(s,1h),8.22(s,1h),7.53(s,4h),7.01(s,2h),6.74(s,4h),2.87(s,6h).
13
c nmr(100mhz,dmso-d6)δ146.49,130.90,130.69,119.51,113.83,40.65.hr-ms(esi):calcd.c
21h18
cln3,[m h]
m/z:348.1267,found:348.1265.
[0154]
实施例29
[0155]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0156]
吖啶类化合物35,符合通式式ⅰ,其中,r1=h,r2=2-cn,
[0157]
吖啶类化合物35的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为对氨基苯腈,制备得到式
ⅴ
(4)
化合物,收率为55.9%。将步骤2)中的式
ⅴ
(1)
化合物替换为以上合成的式
ⅴ
(4)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,其它条件相同,制备得到吖啶类化合物35,收率为43.7%。结构表征为:1h nmr(400mhz,dmso-d6)δ11.12(s,1h),8.40(d,j=134.3hz,1h),7.77(s,1h),7.45(d,j=39.7hz,4h),6.74(dd,j=29.7,8.1hz,5h),2.88(s,6h).
13
c nmr(100mhz,dmso-d6)δ149.33,146.72,132.80,131.64,119.25,119.08,114.10,40.73.hr-ms(esi):calcd.c
22h18
n4,[m h]
m/z:339.1609,found:339.1605.
[0158]
实施例30
[0159]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0160]
吖啶类化合物36,符合通式式ⅰ,其中,r1=h,r2=2-och3,
[0161]
化合物36的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为对甲氧基苯胺,制备得到式
ⅴ
(5)
化合物,收率为77.7%;将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(5)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,其它条件相同,制备得到吖啶类化合物36,收率为67.4%。1h nmr(400mhz,dmso-d6)δ8.04(d,j=8.5hz,1h),7.82(t,j=8.3hz,2h),7.64(t,j=7.5hz,1h),7.49(s,1h),7.40(dd,j=9.2,2.3hz,1h),7.21(t,j=7.5hz,1h),6.91(d,j=8.7hz,2h),6.75(d,j=8.8hz,2h),3.67(s,3h),2.87(s,6h).
13
c nmr(100mhz,dmso-d6)δ154.39,147.00,130.32,125.02,124.19,122.30,121.69,113.42,55.10,40.53.hr-ms(esi):calcd.c
22h21
n3o,[m h]
m/z:344.1763,found:344.1767.
[0162]
实施例31
[0163]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0164]
吖啶类化合物37,符合通式式ⅰ,其中,r1=h,r2=3-och3,
[0165]
化合物37的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为3-甲氧基苯胺,其它条件相同,制备得到式
ⅴ
(6)
化合物,收率为47.8%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(6)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,其它条件
相同,制备得到化合物37,收率为75.6%。1h nmr(400mhz,dmso-d6)δ8.34(d,j=8.4hz,1h),8.03(d,j=9.6hz,1h),7.97(d,j=8.3hz,1h),7.89(t,j=7.6hz,1h),7.40
–
7.37(m,2h),7.22(d,j=8.9hz,2h),6.97(dd,j=9.6,2.3hz,1h),6.81(d,j=8.9hz,2h),3.95(s,3h),2.97(s,6h).
13
c nmr(100mhz,dmso-d6)δ163.74,153.78,149.25,142.91,139.71,134.26,129.15,127.79,125.48,125.37,123.02,118.56,115.23,113.37,112.60,107.71,97.94,55.88,39.92.hr-ms(esi):calcd.c
22h21
n3o,[m h]
m/z:344.1763,found:344.1761.
[0166]
实施例32
[0167]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0168]
吖啶类化合物38,符合通式式ⅰ,其中,r1=h,r2=4-och3,
[0169]
化合物38的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为邻甲氧基苯胺,制备得到式
ⅴ
(7)
化合物,收率为76.2%。将步骤2)中的式
ⅴ
(1)
化合物替换为以上合成的式
ⅴ
(7)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,其它条件相同,制备得到化合物38,收率为42.5%。1h nmr(400mhz,dmso-d6)δ11.43(s,1h),8.04(d,j=8.6hz,2h),7.68(t,j=7.5hz,2h),7.27(d,j=7.7hz,1h),7.14(dt,j=16.1,7.3hz,2h),6.95(d,j=8.4hz,2h),6.76(d,j=8.7hz,2h),4.06(s,3h),2.91(s,6h).
13
c nmr(100mhz,dmso-d6)δ152.06,148.69,147.70,140.85,132.37,125.90,122.33,122.04,121.49,120.08,117.41,113.25,111.13,56.29,40.38.hr-ms(esi):calcd.c
22h21
n3o,[m h]
m/z:344.1763,found:344.1766.
[0170]
实施例33
[0171]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0172]
吖啶类化合物39,符合通式式ⅰ,其中,r1=h,r2=4-ch3,
[0173]
吖啶类化合物39的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为邻甲苯胺,制备得到式
ⅴ
(8)
化合物,收率为66.0%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(8)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,其它条件相同,制备得到吖啶类化合物39,收率为52.7%。1h nmr(400mhz,cdcl3)δ8.03(d,j=7.9hz,1h),7.92(dd,j=19.0,8.6hz,2h),7.57(t,j=7.6hz,1h),7.44(d,j=6.7hz,1h),7.20
–
7.11(m,2h),6.89(d,j=8.9hz,2h),6.68(d,j=8.9hz,2h),2.91(s,6h),2.81(s,3h).
13
c nmr(100mhz,cdcl3)δ147.10,130.29,130.03,124.48,123.22,123.04,122.39,120.82,118.73,118.53,113.96,41.16,18.61.hr-ms(esi):calcd.c
22h21
n3,[m h]
m/z:328.1813,found:328.1809.
[0174]
实施例34
[0175]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0176]
吖啶类化合物40,符合通式式ⅰ,其中,r1=h,r2=4-ch2ch3,
[0177]
化合物40的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为2-乙基苯胺,其它条件相同,制备得到式
ⅴ
(9)
化合物,收率为55.2%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(9)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到化合物40,收率为70.8%。1h nmr(400mhz,cdcl3)δ8.15(d,j=7.2hz,1h),7.95(t,j=7.4hz,2h),7.52(s,1h),7.40(s,1h),7.14(d,j=5.8hz,2h),6.97(d,j=7.1hz,2h),6.67(d,j=
7.8hz,2h),3.32(d,j=5.8hz,2h),2.92(s,6h),1.40(t,j=6.0hz,3h).
13
c nmr(100mhz,cdcl3)δ147.55,135.20,130.70,129.09,124.68,123.22,122.53,121.60,118.03,117.57,113.71,41.02,24.51,14.02.hr-ms(esi):calcd.c
23h23
n3,[m h]
m/z:342.1970,found:342.1968.
[0178]
实施例35
[0179]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0180]
吖啶类化合物41,符合通式式ⅰ,其中,r1=h,r2=4-i
pr,
[0181]
化合物41的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为2-异丙基苯胺,制备得到式
ⅴ
(10)
化合物,收率为87.3%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(10)
,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到化合物41,收率为85.3%。1h nmr(400mhz,dmso-d6)δ8.92(s,1h),8.06(d,j=36.1hz,3h),7.65(s,1h),7.54(s,1h),7.28(s,2h),6.79(s,2h),6.67(d,j=8.3hz,2h),4.46(s,1h),2.83(s,6h),1.36(d,j=6.5hz,6h).
13
c nmr(100mhz,dmso-d6)δ146.20,129.64,125.15,122.83,120.31,113.51,40.64,26.61,23.37.hr-ms(esi):calcd.c
24h25
n3,[m h]
m/z:356.2126,found:356.2118.
[0182]
实施例36
[0183]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0184]
吖啶类化合物42,符合通式式ⅰ,其中,r1=h,r2=4-sch3,
[0185]
吖啶类化合物42的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为2-甲巯基苯胺,其它条件相同,制备得到式
ⅴ
(11)
化合物,收率为59.7%。将步骤2)中的式
ⅴ
(1)
化合物替换为以上合成的式
ⅴ
(11)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到化合物42,收率为65.6%。1h nmr(400mhz,dmso-d6)δ9.06(s,1h),8.13(d,j=8.0hz,1h),7.98(d,j=8.6hz,1h),7.88(d,j=8.2hz,1h),7.68(t,j=7.4hz,1h),7.36
–
7.23(m,3h),6.86(d,j=8.7hz,2h),6.67(d,j=8.9hz,2h),2.85(s,6h),2.49(s,3h).
13
c nmr(100mhz,dmso-d6)δ147.98,146.60,139.88,135.10,129.84,129.41,124.36,123.23,122.85,122.16,121.24,119.60,118.20,117.26,113.30,40.54,13.57.hr-ms(esi):calcd.c
22h21
n3s,[m h]
m/z:360.1534,found:360.1531.
[0186]
实施例37
[0187]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0188]
吖啶类化合物43,符合通式式ⅰ,其中,r1=h,r2=4-n(ch3)2,
[0189]
吖啶类化合物43的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为n,n-二甲基邻苯二胺,制备得到式
ⅴ
(12)
化合物,收率为44.3%。将步骤2)中的式
ⅴ
(1)
化合物替换为以上合成的式
ⅴ
(12)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,其它条件相同,制备得到吖啶类化合物43,收率为43.8%。结构表征为:1h nmr(400mhz,dmso-d6)δ9.85(s,1h),7.97(s,1h),7.92(d,j=8.5hz,1h),7.63(s,1h),7.54(t,j=7.4hz,1h),7.16(d,j=6.8hz,1h),7.09(s,1h),7.01(s,1h),6.72(dd,j=19.2,8.9hz,4h),2.89(s,6h),2.85(s,6h).
13
c nmr(100mhz,dmso-d6)δ146.33,130.37,125.59,121.55,
119.96,113.71,44.09,40.68.hr-ms(esi):calcd.c
23h24
n4,[m h]
m/z:357.2079,found:357.2081.
[0190]
实施例38
[0191]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0192]
吖啶类化合物44,符合通式式ⅰ,其中,r1=h,r2=4-ph,
[0193]
吖啶类化合物44的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为2-氨基联苯,制备得到式
ⅴ
(13)
化合物,收率为46.2%。将步骤2)中的式
ⅴ
(1)
化合物替换为以上合成的式
ⅴ
(13)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,其它条件相同,制备得到吖啶类化合物44,收率为89.7%。结构表征为:1h nmr(400mhz,dmso-d6)δ9.11(s,1h),8.18(s,2h),7.78
–
7.72(m,3h),7.60(s,2h),7.51(t,j=7.5hz,2h),7.42(t,j=7.4hz,1h),7.37
–
7.25(m,2h),6.84(d,j=7.2hz,2h),6.69(d,j=8.8hz,2h),2.85(s,6h).
13
c nmr(100mhz,dmso-d6)δ146.37,130.48,129.88,127.83,127.01,120.46,113.53,40.62.hr-ms(esi):calcd.c
27h23
n3,[m h]
m/z:390.1970,found:390.1969.
[0194]
实施例39
[0195]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0196]
吖啶类化合物45,符合通式式ⅰ,其中,r1=h,r2=2-f,3-f,
[0197]
吖啶类化合物45的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为3,4-二氟苯胺,其它条件相同,制备得到式
ⅴ
(14)
化合物,收率为50.3%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(14)
,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到化合物45,收率为48.1%。结构表征为:1h nmr(400mhz,dmso-d6)δ10.83(s,0.5h),9.16(s,0.5h),8.04(s,2h),7.59(s,3h),7.16(s,1h),6.79
–
6.72(m,4h),2.87(s,6h).
13
c nmr(100mhz,dmso-d6)δ146.69,130.74,113.59,40.52.hr-ms(esi):calcd.c
21h17
f2n3,[m h]
m/z:350.1469,found:350.1468.
[0198]
实施例40
[0199]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0200]
吖啶类化合物46,符合通式式ⅰ,其中,r1=h,r2=2-ch3,3-ch3,
[0201]
化合物46的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为3,4-二甲基苯胺,其它条件相同,制备得到式
ⅴ
(15)
化合物,收率为81.1%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(15)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到化合物46,收率为44.2%。1h nmr(400mhz,dmso-d6)δ8.10(d,j=8.7hz,1h),7.99
–
7.89(m,2h),7.79(t,j=7.6hz,1h),7.68(s,1h),7.25(t,j=7.7hz,1h),7.10(d,j=8.7hz,2h),6.80(d,j=8.9hz,2h),2.95(s,6h),2.42(s,3h),2.22(s,3h).
13
c nmr(100mhz,dmso-d6)δ171.95,152.60,148.82,144.81,140.65,139.68,133.32,132.40,125.73,124.82,124.50,124.34,122.33,119.56,118.73,114.00,112.96,48.55,20.13,19.64.hr-ms(esi):calcd.c
23h23
n3,[m h]
m/z:342.1970,found:342.1974.
[0202]
实施例41
[0203]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0204]
吖啶类化合物47,符合通式式ⅰ,其中,r1=h,r2=2-ch3,4-ch3,
[0205]
吖啶类化合物47的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为2,4-二甲基苯胺,制备得到式
ⅴ
(16)
化合物,收率66.5%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(16)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到吖啶类化合物47,收率为50.0%。1h nmr(400mhz,cdcl3)δ8.11(d,j=8.4hz,1h),7.90(d,j=8.7hz,1h),7.69(s,1h),7.58(t,j=7.4hz,1h),7.34(s,1h),7.19(t,j=7.5hz,1h),6.87(d,j=8.8hz,2h),6.68(d,j=8.9hz,2h),2.90(s,6h),2.83(s,3h),2.40(s,3h).
13
c nmr(100mhz,cdcl3)δ146.92,136.43,133.27,132.85,129.55,124.53,123.37,120.39,120.00,119.35,118.75,114.05,41.26,21.92,18.65.hr-ms(esi):calcd.c
23h23
n3,[m h]
m/z:342.1970,found:342.1969.
[0206]
实施例42
[0207]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0208]
吖啶类化合物48,符合通式式ⅰ,其中,r1=h,r2=3-ch3,4-ch3,
[0209]
吖啶类化合物48的制备方法,与实施例1的区别在于:将步骤1)中的式ⅲ化合物替换为2,3-二甲基苯胺,制备得到式
ⅴ
(17)
化合物,收率55.2%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(17)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到化合物48,收率为45.7%。结构表征为:1h nmr(400mhz,cdcl3)δ8.08(d,j=8.5hz,1h),7.91(d,j=8.6hz,1h),7.82(d,j=8.8hz,1h),7.55(t,j=7.5hz,1h),7.14(t,j=7.6hz,1h),7.04(d,j=8.8hz,1h),6.91(d,j=8.8hz,2h),6.67(d,j=8.9hz,2h),2.91(s,6h),2.76(s,3h),2.42(s,3h).
13
c nmr(100mhz,cdcl3)δ147.18,138.16,136.17,130.07,126.77,124.35,123.02,121.35,121.07,117.83,117.02,113.90,41.15,20.87,13.72.hr-ms(esi):calcd.c
23h23
n3,[m h]
m/z:342.1970,found:342.1967.
[0210]
实施例43
[0211]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0212]
吖啶类化合物49,符合通式式ⅰ,其中,r1=5-ch3,r2=3-ch3,4-ch3,
[0213]
吖啶类化合物49的制备方法,与实施例1的区别在于:将步骤1)中的式ⅱ化合物替换为2-氯-3-甲基苯甲酸,式ⅲ化合物替换为2,3-二甲基苯胺,制备得到式
ⅴ
(18)
化合物,收率41.1%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(18)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到吖啶类化合物49,收率为47.1%。1h nmr(400mhz,cdcl3)δ7.82(d,j=23.6hz,2h),7.50(s,1h),7.15(s,2h),6.83(d,j=7.6hz,2h),6.66(d,j=8.2hz,2h),6.52(s,1h),2.89(s,12h),2.49(s,3h).
13
c nmr(100mhz,cdcl3)δ147.07,146.51,136.64,128.92,127.42,124.44,123.96,123.47,123.17,121.17,119.89,119.10,118.69,117.72,114.08,41.25,20.66,18.52,13.46.hr-ms(esi):calcd.c
24h25
n3,[m h]
m/z:356.2126,found:356.2119.
[0214]
实施例44
[0215]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0216]
吖啶类化合物50,符合通式式ⅰ,其中,r1=6-ch3,r2=3-ch3,4-ch3,
[0217]
吖啶类化合物50的制备方法,与实施例1的区别在于:将步骤1)中的式ⅱ化合物替换为2-氯-4-甲基苯甲酸,式ⅲ化合物替换为2,3-二甲基苯胺,制备得到式
ⅴ
(19)
化合物,收率71.7%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(19)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到吖啶类化合物50,收率为89.9%。1h nmr(400mhz,cdcl3)δ7.97(s,1h),7.89(d,j=8.6hz,1h),7.70(d,j=8.8hz,1h),6.99(t,j=9.0hz,3h),6.88(d,j=8.2hz,1h),6.68(d,j=8.8hz,2h),2.93(s,6h),2.73(s,3h),2.44(s,3h),2.39(s,3h).
13
c nmr(100mhz,cdcl3)δ147.82,126.30,125.31,124.61,122.33,122.05,115.72,114.42,113.55,40.94,21.89,20.99,13.91.hr-ms(esi):calcd.c
24h25
n3,[m h]
m/z:356.2126,found:356.2124.
[0218]
实施例45
[0219]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0220]
吖啶类化合物51,符合通式式ⅰ,其中,r1=7-ch3,r2=3-ch3,4-ch3,
[0221]
化合物51的制备方法,与实施例1的区别在于:将步骤1)中的式ⅱ化合物替换为2-氯-5-甲基苯甲酸,式ⅲ化合物替换为2,3-二甲基苯胺,制备得到式
ⅴ
(20)
化合物,收率47.8%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(20)
,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到化合物51,收率为74.7%。1h nmr(400mhz,cdcl3)δ8.06(s,1h),7.72(s,2h),7.48(s,1h),7.08(s,1h),6.81(d,j=8.1hz,2h),6.67(d,j=7.7hz,2h),6.45(s,1h),2.88(s,9h),2.47(s,3h),2.44(s,3h).
13
c nmr(100mhz,cdcl3)δ146.58,132.09,119.77,114.20,41.35,21.95,20.76,13.70.hr-ms(esi):calcd.c
24h25
n3,[m h]
m/z:356.2126,found:356.2125.
[0222]
实施例46
[0223]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0224]
吖啶类化合物52,符合通式式ⅰ,其中,r1=8-ch3,r2=3-ch3,4-ch3[0225]
吖啶类化合物52的制备方法,与实施例1的区别在于:将步骤1)中的式ⅱ化合物替换为2-氯-6-甲基苯甲酸,式ⅲ化合物替换为2,3-二甲基苯胺,制备得到式
ⅴ
(21)
化合物,收率48.8%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(21)
,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,其它条件相同,制备得到吖啶类化合物52,收率为88.2%。结构表征为:1h nmr(400mhz,cdcl3)δ7.61(s,1h),7.51(s,1h),7.32(s,1h),6.98(s,1h),6.80(s,1h),6.72(d,j=8.3hz,2h),6.66(d,j=7.9hz,2h),2.90(s,6h),2.77(s,3h),2.56(s,3h),2.37(s,3h).
13
c nmr(100mhz,cdcl3)δ146.31,137.56,129.14,125.99,124.01,120.89,119.14,114.42,41.43,23.63,20.68,13.00.hr-ms(esi):calcd.c
24h25
n3,[m h]
m/z:356.2126,found:356.2116.
[0226]
实施例47
[0227]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0228]
吖啶类化合物53,符合通式式ⅰ,其中,r1=7-cf3,r2=3-ch3,4-ch3,
[0229]
吖啶类化合物53的制备方法,与实施例1的区别在于:将步骤1)中的式ⅱ化合物替换为2-氯-5-(三氟甲基)苯甲酸,式ⅲ化合物替换为2,3-二甲基苯胺,制备得到式
ⅴ
(22)
化合物,收率48.4%。将步骤2)中的式
ⅴ
(1)
化合物替换为以上合成的式
ⅴ
(22)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到吖啶类化合物53,收率为91.1%。结构表征为:1h nmr(400mhz,cdcl3)δ8.25(s,1h),7.93(s,1h),7.79
–
7.57(m,2h),7.03(d,j=7.0hz,1h),6.86(d,j=8.7hz,2h),6.69(d,j=8.7hz,2h),2.90(s,6h),2.70(s,3h),2.44(s,3h).
13
c nmr(400mhz,cdcl3)δ147.57,138.61,125.71,124.97,123.01,121.17,117.04,114.13,41.17,20.80,13.50.hr-ms(esi):calcd.c
23h22
n4o2,[m h]
m/z:387.1821,found:387.1818.
[0230]
实施例48
[0231]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0232]
吖啶类化合物54,符合通式式ⅰ,其中,r1=7-f,r2=3-ch3,4-ch3,
[0233]
吖啶类化合物54的制备方法,与实施例1的区别在于:将步骤1)中的式ⅱ化合物替换为2-氯-5-氟苯甲酸,式ⅲ化合物替换为2,3-二甲基苯胺,制备得到式
ⅴ
(23)
化合物,收率93.8%。将步骤2)中的式
ⅴ
(1)
化合物替换为式
ⅴ
(23)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到化合物54,收率为92.5%。1h nmr(400mhz,cdcl3)δ8.17(s,1h),7.75(d,j=8.8hz,1h),7.52(d,j=9.8hz,1h),7.43(t,j=7.5hz,1h),7.19(d,j=7.4hz,1h),6.82(d,j=8.9hz,2h),6.67(d,j=8.8hz,2h),6.43(s,1h),2.90(s,6h),2.86(s,3h),2.50(s,3h).
13
c nmr(100mhz,cdcl3)δ159.73,157.28,146.87,136.85,133.19,128.23,120.67,120.40,120.24,119.62,118.81,118.02,114.04,106.18,41.18,20.72,13.68.hr-ms(esi):calcd.c
24h22
f3n3,[m h]
m/z:360.1876,found:360.1873.
[0234]
实施例49
[0235]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0236]
吖啶类化合物55,符合通式式ⅰ,其中,r1=6-f,7-f,r2=3-ch3,4-ch3,
[0237]
吖啶类化合物55的制备方法,与实施例1的区别在于:
[0238]
将步骤1)中的式ⅱ化合物替换为2-氯-4,5-二氟苯甲酸,式ⅲ化合物替换为2,3-二甲基苯胺,制备得到式
ⅴ
(24)
化合物,收率62.5%。将步骤2)中的式
ⅴ
(1)
化合物替换为以上合成的式
ⅴ
(24)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,制备得到化合物55,收率为92.6%。1h nmr(400mhz,cdcl3)δ7.83(s,1h),7.75(d,j=8.9hz,1h),7.59(dd,j=11.6,9.4hz,1h),7.20(d,j=8.4hz,1h),6.83(d,j=8.8hz,2h),6.67(d,j=8.8hz,2h),6.48(s,1h),2.91(s,6h),2.82(s,3h),2.50(s,3h).
13
c nmr(100mhz,cdcl3)δ154.14,153.96,151.60,151.42,147.19,137.47,135.08,128.13,120.81,119.14,117.52,115.05,
113.94,109.08,41.09,20.77,13.69.hr-ms(esi):calcd.c
23h21
f2n3,[m h]
m/z:378.1782,found:378.1779.
[0239]
实施例50
[0240]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0241]
吖啶类化合物56,其中,r1=6-och3,7-och3,r2=3-ch3,4-ch3,
[0242]
吖啶类化合物56的制备方法,与实施例1的区别在于:将步骤1)中的式ⅱ化合物替换为2-氯-4,5-二甲氧基苯甲酸,式ⅲ化合物替换为2,3-二甲基苯胺,制备得到式
ⅴ
(25)
化合物,收率49.6%。将步骤2)中的式
ⅴ
(1)
化合物替换为以上合成的式
ⅴ
(25)
化合物,将4-甲磺酰胺基苯胺替换为n,n-二甲基对苯二胺,其它条件相同,制备得到吖啶类化合物56,收率为66.4%。结构表征为:1h nmr(400mhz,cdcl3)δ7.85(d,j=8.5hz,1h),7.69(s,1h),7.14
–
6.97(m,4h),6.67(d,j=8.8hz,2h),4.06(s,3h),3.65(s,3h),2.90(s,6h),2.77(s,3h),2.42(s,3h).
13
c nmr(100mhz,cdcl3)δ154.31,147.56,147.28,126.47,122.02,113.64,102.37,56.36,55.59,41.06,20.90,13.91.hr-ms(esi):calcd.c
25h27
n3o2,[m h]
m/z:402.2181,found:402.2178.
[0243]
实施例51
[0244]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0245]
吖啶类化合物3,符合通式式ⅰ,其中,r1=h,r2=h,
[0246]
吖啶类化合物3的制备方法,采用实施例1的步骤1)和2),得到式
ⅴ
化合物,还包含以下步骤:3)将式
ⅴ
化合物(107mg,0.5mmol)溶于苯酚(5ml),加入碳酸铵(192.18mg,1mmol),加热至120℃反应,tlc监测反应进度。反应完成后,向反应体系中加入乙酸乙酯和水,萃取,有机相用无水硫酸镁干燥,过滤,旋蒸除去溶剂后,经柱层析分离得到中间体式ⅵ化合物,收率为83.2%。4)将中间体式ⅵ化合物(214mg,1.1mmol)、6-溴-1,4-苯并恶烷(215mg,1mmol)、双(二亚苄基丙酮)钯(35mg,0.06mmol)、四氟硼酸三叔丁基膦(17mg,0.06mmol)和叔丁醇钠(111mg,1.15mmol)溶于干燥的1,4-二氧六环(10ml),氮气保护的条件下回流反应10小时,冷却至室温,向反应体系中依次加入去离子水(50ml)、饱和亚硫酸钠(15ml)、二氯甲烷(50ml),搅拌约30分钟,有机相依次用适量水和饱和食盐水洗涤,有机相用无水硫酸镁干燥,过滤,旋蒸除去溶剂后,经柱层析分离得到吖啶类化合物3,收率为63.2%。结构表征为:1h nmr(400mhz,dmso-d6)δ10.73(s,1h),7.93
–
7.42(m,1h),7.00(s,2h),6.78(d,j=8.4hz,1h),6.25(dd,j=14.9,6.4hz,2h),4.23(s,4h).
13
c nmr(100mhz,dmso-d6)δ144.04,138.12,131.02,117.73,110.99,106.53,64.20,63.87.hr-ms(esi):calcd.c
21h16
n2o2,[m h]
m/z:329.1290,found:329.1289.
[0247]
实施例52
[0248]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0249]
吖啶类化合物4,符合通式式ⅰ,其中,r1=h,r2=h,
[0250]
吖啶类化合物4的制备方法,与实施例51的区别在于:将实施例51中的6-溴-1,4-苯并恶烷替换为6-溴-2-甲基喹啉,制备得到吖啶类化合物4,收率为46.6%。1h nmr
(400mhz,dmso-d6)δ11.00(s,1h),8.03(d,j=7.1hz,2h),7.86(d,j=8.9hz,1h),7.52
–
6.96(m,9h),2.62(s,3h).
13
c nmr(100mhz,dmso-d6)δ155.72,143.73,134.82,131.33,129.53,127.58,123.57,122.14,24.55.hr-ms(esi):calcd.c
23h17
n3,[m h]
m/z:336.1500,found:336.1507.
[0251]
实施例53
[0252]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0253]
吖啶类化合物5,符合通式式ⅰ,其中,r1=h,r2=h,
[0254]
吖啶类化合物5的制备方法,与实施例51的区别在于:将实施例51中的6-溴-1,4-苯并恶烷替换为2-溴-9-乙基-9h-咔唑,制备得到吖啶类化合物5,收率为57.7%。1h nmr(400mhz,cdcl3)δ8.05(dd,j=16.8,8.7hz,4h),7.84(d,j=8.2hz,2h),7.49
–
7.36(m,4h),7.22(s,2h),7.08(dt,j=32.0,7.6hz,3h),4.29(q,j=7.2hz,2h),1.40(t,j=7.2hz,3h).13c nmr(100mhz,dmso)δ153.24,140.79,140.10,137.27,133.28,126.16,123.01,122.12,122.00,120.79,120.65,118.90,118.76,115.29,113.75,110.18,109.32,37.14,13.74.hr-ms(esi):calcd.c
27h21
n3,[m h]
m/z:388.1813,found:388.1715.
[0255]
实施例54
[0256]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0257]
吖啶类化合物30,符合通式式ⅰ,其中,r1=h,r2=h,
[0258]
吖啶类化合物30的制备方法,与实施例51的区别在于:将实施例51中的6-溴-1,4-苯并恶烷替换为2-溴-5-二甲基氨基吡啶,制备得到吖啶类化合物30,收率为44.7%。1h nmr(400mhz,dmso-d6)δ11.36(s,1h),7.96(s,2h),7.78(s,1h),7.58
–
7.50(m,4h),7.14(dd,j=8.9,2.3hz,1h),7.05(s,2h),6.67(d,j=8.9hz,1h),3.02(s,6h).
13
c nmr(100mhz,dmso-d6)δ155.55,138.22,131.56,129.61,126.42,120.75,118.34,106.19,37.96.hr-ms(esi):calcd.c
20h18
n4,[m h]
m/z:315.1609,found:315.1605.
[0259]
实施例55
[0260]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0261]
吖啶类化合物31,符合通式式ⅰ,其中,r1=h,r2=h,
[0262]
吖啶类化合物31的制备方法,与实施例51的区别在于:将实施例51中的6-溴-1,4-苯并恶烷替换为4-溴-4',4
”‑
二甲基三苯胺,制备得到吖啶类化合物31,收率为68.4%。1h nmr(400mhz,dmso-d6)δ10.93(s,1h),7.92(s,2h),7.52
–
7.40(m,4h),7.08(d,j=8.3hz,4h),7.02(s,2h),6.95(d,j=8.6hz,2h),6.90(d,j=8.3hz,4h),6.73(d,j=8.5hz,2h),2.25(s,6h).
13
c nmr(100mhz,dmso-d6)δ145.27,141.30,131.09,130.81,129.73,125.93,122.63,119.24,20.20.hr-ms(esi):calcd.c
33h27
n3,[m h]
m/z:466.2283,found:466.2282.
[0263]
实施例56
[0264]
本实施例的吖啶类化合物的结构以及制备方法如下:
[0265]
吖啶类化合物32,符合通式式ⅰ,其中,r1=h,r2=h,
[0266]
吖啶类化合物32的制备方法,与实施例51的区别在于:将实施例51中的6-溴-1,4-苯并恶烷替换为9-(4-溴苯基)-咔唑,制备得到吖啶类化合物32,收率为46.3%。1h nmr(400mhz,dmso-d6)δ11.00(s,1h),8.36
–
7.93(m,4h),7.72
–
7.39(m,10h),7.29(t,j=7.4hz,2h),7.05(d,j=8.5hz,4h).
13
c nmr(100mhz,dmso-d6)δ140.60,131.39,128.23,126.14,122.45,120.45,119.69,109.55.hr-ms(esi):calcd.c
31h21
n3,[m h]
m/z:436.1813,found:436.1812.
[0267]
实验例1
[0268]
lsd1抑制活性测定:样品为实施例1~56所制备得到的吖啶类化合物经纯化得到,阳性化合物ory-1001购买自medchemexpress公司。样品储备液的配制过程为:分别称取1~2mg样品,用dmso配制成浓度为20mm的溶液,于4℃环境下保存备用,实验时用dmso稀释至所需浓度。将待测样品与lsd1蛋白在室温孵育后,加入lsd1底物h3k4me2并孵育,最后加入荧光染料amplex和辣根过氧化物酶hrp室温孵育,在酶标仪上激发光530nm、发射光590nm检测荧光数值,抑制率计算公式如下所示。实验结果采用spss软件计算ic
50
值,结果如表1所示。
[0269][0270]
表1本发明吖啶类化合物的lsd1抑制活性和ic
50
[0271]
[0272]
[0273]
[0274][0275]
由表1可知,本发明提供的吖啶类化合物对lsd1有不同程度的抑制活性。其中,当化合物浓度为10μm时,吖啶类化合物5-6、11-14、16-20、25-31、33-42、44-56对lsd1的抑制活性较高,抑制率均达80%以上,吖啶类化合物1-3、5-6、11-14、16-17、19-20、25-30、33-42、44-56抑制活性更高,对lsd1的抑制率可达90%以上。此外,吖啶类化合物16、19、20、27、36、38、39、41、42、48、50、51、53、54、56发挥作用时,ic
50
值较低,均低于0.1μm,说明上述吖啶类化合物发挥有效抑制活性的浓度较低,具有较小的生物毒性。
[0276]
综上,本发明提供的吖啶类化合物对lsd1具有良好的抑制活性,显示出良好的开发潜力,为开发新型抗肿瘤药物、药物的联合用药以及新型lsd1抑制剂药物的开发开辟了一条有效途径,具有良好的市场应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
