1.本发明涉及生物技术领域,具体地说,涉及角鲨烯环氧化酶及其编码基因与应用。
背景技术:
2.三萜类化合物是一类由6个异戊二烯为结构单元(c5h8)组成的含有30碳原子的天然产物,广泛存在于自然界中,是植物中的一类重要次级代谢产物,具有多种药用活性,如甘草中的甘草酸、甘草次酸、11-氧代-β-香树脂醇(11-oxo-β-amyrin),蒺藜苜蓿中的齐墩果酸、熊果酸,人参中的人参皂苷等均具有抗炎、抗肿瘤、抗病毒、保肝护肝等药物活性。一些三萜化合物还是重要的抗虫剂、天然甜味剂和乳化剂,同样具有非常重要的应用和研究价值,如印楝素,浓度在1-10 ppm下即具备很好的杀虫效果,对200余种害虫有明显的驱避和杀虫效果;单葡萄糖醛酸甘草次酸和罗汉果皂苷也都是一种良好的甜味剂,甜度分别是蔗糖的941倍和300倍。由于三萜类化合物复杂的化学结构,源植物中代谢产量低以及多种结构类似物的存在等多种因素,难以通过化学合成及源植物提取获得。合成生物学的发展为获取大量高价值三萜类成分提供新思路。酿酒酵母具有遗传背景清晰、生长周期短、安全性好及易于操作等优点,且其含有合成三萜类化合物所需的所有基因,因此可以作为萜类化合物细胞工厂良好宿主。
3.三萜化合物植物源代谢路径已基本解析清楚,其生物合成一般可分为三个部分:即来自于甲羟戊酸途径(mva)及2-甲基赤癣糖醇-4-磷酸(mep)途径的通用c5组成模块异戊二烯的活性形式异戊烯焦磷酸(ipp)和二甲基丙烯基二磷酸(dmapp)通过法尼烯焦磷酸合酶(fpps)缩合生成法尼烯焦磷酸(fpp),两分子的fpp在鲨烯合酶(fpps)催化下合成鲨烯,鲨烯进一步经角鲨烯环氧化酶(sqe)催化下生成三萜类化合物的共同前体物质2,3-氧化鲨烯;随后在氧化鲨烯环化酶(oscs)环化形成多环三萜骨架。随后该骨架化合物在相应的cyp450s等酶的催化作用下进行进一步修饰作用,最终形成相应的三萜化合物。
4.在上述过程中,sqe在三萜类化合物生物合成途径中起着重要的作用,是三萜化合物生物合成的关键分支点。sqe是一种非细胞色素p450酶系的环氧化烯烃酶,该催化反应在分子氧以及辅助因子fad、nad(p)h的共同作用下,在鲨烯c-c之间插入1个氧原子使其变为单氧态角鲨烯,该中间体经强光和紫外线作用下可生成2,3-氧化鲨烯;2,3-氧化鲨烯是三萜类化合物生成合成的共同底物,充足的底物供应是其终产物的高产的关键因素。sqe已经在多个物种中鉴定,如罗汉果,白色念珠,绞股蓝,拟南芥,东方泽泻,羽叶三七,竹节参,烟草、人参等。由于sqe在酵母等的底盘细胞中的比活力很低,且其催化产物2,3-氧化鲨烯在微生物总代谢流中具有多个分支代谢,因此sqe仍被认为是植物三萜类化合物生物合成途径中的关键限速酶之一,有必要对其进一步进行研究。
技术实现要素:
5.本发明的目的是提供一种具有高催化活性的seq及基因,以促进鲨烯更多的流向三萜代谢流(包括但不限于甘草次酸,甘草酸,人参皂甙,罗汉果苷等)。
6.本发明通过研究得到了不同植物来源的高催化活性的角鲨烯环氧化酶基因,具体通过染色体整合,在高产鲨烯的底盘细胞中过表达本发明的角鲨烯环氧化酶基因(与uni25647基因、gucpr1基因以及β-as基因共表达),通过发酵产物中11-氧代-β-香树脂醇产量的测定,说明了本发明的角鲨烯环氧化酶基因具有较高催化活性,并为后续甘草次酸菌株构建奠定基础。同时本发明所获得的上述菌剂可作为产11-氧代-β-香树脂醇的平台菌株,11-氧代-β-香树脂醇也具有多种功效。
7.本发明通过染色体整合,在产11-氧代-β-香树脂醇的底盘细胞(y81)中过表达角鲨烯环氧化酶基因(与uni25647基因、gucpr1基因、mut72a63以及β-as基因共表达),通过发酵产物中甘草次酸产量的测定,说明了本发明角鲨烯环氧化酶基因可用于提升发酵生产甘草次酸的产量,并可据此获得甘草次酸高产菌株。
8.具体地,本发明的技术方案如下:第一方面,本发明提供一种角鲨烯环氧化酶或其编码基因、或含有其编码基因的生物材料在生物发酵合成11-氧代-β-香树脂醇或三萜化合物中的应用;所述角鲨烯环氧化酶的氨基酸序列如seq id no:9或seq id no:10 所示。
9.所述角鲨烯环氧化酶的编码基因的核酸序列如seq id no:1或seq id no:7所示;和/或,所述生物材料为表达盒、载体或宿主细胞。
10.优选,所述三萜化合物为甘草次酸、甘草酸、人参皂甙或罗汉果苷。
11.本发明中,所述生物发酵时所用的菌株可生产鲨烯。
12.本发明的菌株可在代谢中生产鲨烯,进而用于实现三萜化合物的合成。
13.所述生物发酵时所用的菌株为酵母菌,所述酵母菌在过表达所述角鲨烯环氧化酶的编码基因的基础上,还共表达uni25647基因、gucpr1基因以及β-as基因。
14.所述生物发酵生产甘草次酸时,所述酵母菌还进一步在过表达所述角鲨烯环氧化酶的编码基因的基础上,共表达uni25647基因、gucpr1基因、mut72a63基因以及β-as基因。
15.uni25647基因例如可参见ncbi:ky499143.1,gucpr1基因例如可参见ncbi:ky798117;β-as基因例如可参见ncbi:ab037203,mut72a63基因由cypc72a63(ncbi:ab558146)改造而来,具体参见文献:controlling chemo
‑ꢀ
and regioselectivity of a plant p450 in yeast cell toward rare licorice triterpenoid biosynthesis wentao sun, haijie xue, hu liu, bo lv, yang yu, ying wang, meilan huang, and chun li,acs catalysis 2020 10 (7), 4253-4260,doi: 10.1021/acscatal.0c00128。mut72a63的氨基酸序列如seq id no:11所示。
16.第二方面,本发明提供一种角鲨烯环氧化酶,其氨基酸序列如seq id no:9所示。
17.第三方面,本发明提供一种编码角鲨烯环氧化酶的基因,其核酸序列如seq id no:1或seq id no:7所示。
18.第四方面,本发明提供一种提高生物发酵合成甘草次酸产量的方法,其通过在发酵菌株中过表达角鲨烯环氧化酶的基因,提高所述发酵菌株合成甘草次酸的产量;所述角鲨烯环氧化酶的基因如seq id no:1或seq id no:7所示。
19.本发明的方法中,所述发酵菌株为可生产鲨烯的酵母菌,所述酵母菌中过表达如seq id no:1所示的基因,并共表达uni25647基因、gucpr1基因以及β-as基因。
20.所述发酵菌株进一步过表达如seq id no:1或seq id no:7所示的基因,并共表达
uni25647基因、gucpr1基因、mut72a63以及β-as基因。
21.本发明的有益效果至少在于:本发明发现的sqe具有高催化活性,可促进鲨烯更多的流向三萜代谢流(包括但不限于甘草次酸,甘草酸,人参皂甙,罗汉果苷等),提升三萜类化合物生物合成的产率,为其他三萜类物质改造时提供新的帮助和思路。
附图说明
22.图1为本发明的利用酵母中鲨烯为底物生产萜类化合物的代谢途径示意图;图2为本发明的酵母中以2,3-氧化鲨烯为底物生产甘草次酸的代谢途径示意图;图3为本发明的不同来源的角鲨烯环氧化酶基因和uni25647基因、gucpr1基因以及β-as基因的染色体整合示意图;图4为本发明的产甘草次酸菌株构建时yprc位点的整合示意图;图5为本发明转入不同来源的角鲨烯环氧化酶基因后的菌株发酵生产11-氧代-β-香树脂醇的结果;图6为本发明转入不同来源的角鲨烯环氧化酶基因后的菌株发酵生产鲨烯的结果;图7为本发明转入不同来源的角鲨烯环氧化酶基因后的菌株的od
600
值;图8为本发明转入不同来源的角鲨烯环氧化酶基因后的菌株发酵生产甘草次酸的结果。
具体实施方式
23.下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。本发明中若无特别说明,od值均为波长600nm下的检测结果。
24.实施例1不同来源的角鲨烯环氧化酶基因的获得本实施例选取拟南芥,光果甘草,乌拉尔甘草,雷公藤、人参、印楝、酿酒酵母7种源物种为实验样本进行后续sqe基因研究,本实施例植物材料来源于北京中国科学院植物研究所。植株经流水洗净后,用吸水纸吸干表面水分,用剪刀将使用部分剪下分离,并用锡箔纸包裹,标记后迅速用液氮处理,保存于-80 ℃,备用。目标样本经液氮研磨,rna提取,提取试剂盒为植物rna快速提取试剂盒(天根生化科技有限公司,货号:dp432),以上述rna为模板,根据反转录试剂盒说明书(试剂盒来自北京全式金生物,目录号:at311-02)进行反转录,合成各个组织的cdna备用;根据引物设计原则进行引物设计并进行相应sqe基因扩增(扩增引物见表1),扩增序列如seq id no:1~8所示,seq id no:1~8中,seq id no:1源自印楝(aisqe),其编码蛋白序列如seq id no:9所示,seq id no:2源自拟南芥(atsqe),seq id no:3源自酿酒酵母(erg1),seq id no:4(gusqe1)源自乌拉尔甘草,seq id no:5源自光果甘草(ggsqe),seq id no:6源自人参(pgsqe),seq id no:7源自雷公藤(twsqe),其编码蛋
白序列如seq id no:10所示,以及seq id no:8(gusqe2)源自乌拉尔甘草。将上述基因两端分别连接启动子和终止子形成基因表达簇。各基因的基因表达簇为ptef1-twsqe-tpgk1,ptef1-atsqe-tpgk1,ptef1-erg1-tpgk1,ptef1-pgsqe-tpgk1,ptef1-ggsqe-tpgk1,ptef1-aisqe-tpgk1,ptef1-gusqe1-tpgk1,ptef1-gusqe2-tpgk1。
25.以构建印楝的ptef1-aisqe-tpgk1为例子,具体构建方法如下:1.以上述步骤反转录获得的印楝cdna为模板,使用带有基因同源臂的引物aisqe-(ptef1)-f、aisqe-(tpgk1)-r扩增目的基因aisqe;以实验室保存的ptef1-tpgk1-puc19l载体质粒为模板,以带有同源臂引物tpgk1-(aisqe)-f、ptef1-(aisqe)-r反向扩增载体。
26.ptef1-tpgk1-puc19l记载于:孙梦楚,晁二昆,苏新堯,朱敏,苏勇,钱广涛,陈士林,王彩霞,薛建平.产β-香树脂醇酿酒酵母细胞构建及高密度发酵[j].中国中药杂志,2019,44(07):1341-1349.doi:10.19540/j.cnki.cjcmm.20190129.011。具体为该文献表1中的质粒puc19l-ptef1-erg1-tpgk1。
[0027]
2.分别得到的ptef1-tpgk1-puc19l载体pcr产物及aisqe基因的pcr产物,pcr产物经过凝胶电泳、切胶回收、纯化之后分别置于冰上备用。
[0028]
3.将上述aisqe片段及ptef1-tpgk1-puc19l载体胶回收产物使用无缝连接酶以无缝连接的方法(无缝连接具体通过线性载体与片段之间的同源臂进行无缝连接,方法为目的基因2μl、片段0.5μl、无缝连接酶2.5μl,混匀后50℃,30min。随后将连接产物5μl,加入50μl大肠杆菌感受态进行大肠转化操作)构建质粒ptef1-aisqe-tpgk1-puc19l。
[0029]
4.挑选重组大肠杆菌单菌落进行菌落pcr,筛选阳性菌落。
[0030]
5.将构建成功的大肠杆菌ptef1-aisqe-tpgk1-puc19l提取质粒备用。
[0031]
6.以上述质粒为模板,使用带有同源臂的整合引物s(pgk1p)tef1p-r、s(adh1p)-pgk1t-f(参见表3)进行扩增,得到目的片段pcr产物(带有启动子及终止子的目标基因簇ptef1-aisqe-tpgk1),胶回收后置于﹣20℃备用。
[0032]
其他sqe基因表达簇的制备方法同上,所用的各引物参见表1。
[0033]
ptef1-erg1-tpgk1参见:孙梦楚,晁二昆,苏新堯,朱敏,苏勇,钱广涛,陈士林,王彩霞,薛建平.产β-香树脂醇酿酒酵母细胞构建及高密度发酵[j].中国中药杂志,2019,44(07):1341-1349.doi:10.19540/j.cnki.cjcmm.20190129.011。
[0034]
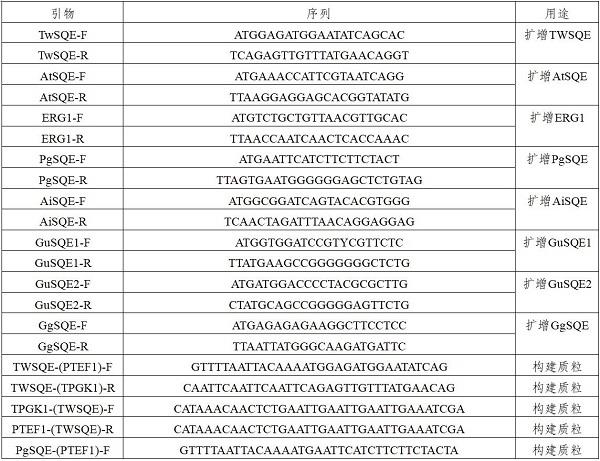
表1 构建质粒所用引物(seq id no:12-55)
实施例2 产11-氧代-β-香树脂醇酵母菌株构建本实施例首先以高产鲨烯酵母菌株y41(其为中国专利cn114107332a实施例2中的
酵母菌株z-cb-9-5)为底盘菌株,该菌株具体信息见表2(y41在表2中的整合片段同样参见中国专利cn114107332a)。将实施例1所获得的8条sqe基因表达簇(ptef1-aisqe-tpgk1,ptef1-atsqe-tpgk1,ptef1-erg1-tpgk1,ptef1-gusqe1-tpgk1,ptef1-ggsqe-tpgk1,ptef1-pgsqe-tpgk1,ptef1-twsqe-tpgk1, ptef1-gusqe2-tpgk1)分别与基因表达簇padh1-uni25647-tadh1, pthd3-gucpr1-ttdh3, ppgk1-β-as-tadh1(本领域技术人员可根据本领域一般常识进行常规构建)以同源重组形式整合入底盘菌株y41染色体的 gal80位点(角鲨烯环氧化酶基因和uni25647基因、gucpr1基因以及β-as基因的染色体整合示意图见图3),pcr 检测阳性克隆,得到的酵母菌株分别命名y81、y82、y83、y84、y85、y86、y87、y88。整合菌株构建信息见表2,整合引物见表3。
[0035]
表2 构建菌株
表3 整合所用引物(seq id no:56-71)
表中,p
tef1-不同sqe-t
pgk1
指代实施例1所获得的8条sqe基因表达簇。酵母基因组的taxonomy id: 559292。
[0036]
菌株构建具体操作如下:(1)菌株活化:将-80℃保存底盘菌株y41于四缺培养基sd-leu-trp-his-ura进行划线,静置于30℃恒温培养箱中培养,挑取单菌落,于装有5 ml缺陷型培养基的50 ml离心管中置于30 ℃,220 rpm培养至od达0.8-1.2,以此为种子液进行后续活化;取该管中种子液接种于装有20 ml缺陷型培养基的100 ml三角瓶中,接种量为2%-5%,30 ℃,220 rpm培养至od达0.8-1.2;菌株活化3次。
[0037]
(2)感受态制备:取上述活化好的酵母菌液200 μl接种于含有20 ml缺陷型培养基的100 ml三角瓶中,于30 ℃摇床中 200 r/min培养至od600 nm值达到0.8-1.2之间;将上述菌液转移至无菌的50 ml离心管中,3 000 r/min离心5 min,弃上清;加入预冷的10 ml无菌水枪头吹打混匀,3 000 r/min离心5 min,弃上清(该步骤为清洗菌体中残留培养基,可重复2-3次);将上述菌体加入1 ml预冷的100 mmol/l liac,枪头吹打重悬,13000r/min离心15s,弃上清;重新加入预冷的100 mmol/l liac至400μl,分装至预冷2 ml离心管中,每管50 ul。
[0038]
(3)酵母转化:向制备好的感受态中依次加入240 μl 50%的peg3350、36 μl的1mol/l liac以及5 μl鲑鱼精子(ssdna,在100℃金属浴中加热10 min使之变性,变性后立即放置于冰上备用)。使用表3中整合扩增引物及表3中各引物对应模板pcr获取整合所需基因片段gal80-up、kanmx、adh1
p-uni25647-adh1t、tdh3p-gucpr1-tdh3t、adh1
p-uni25647-adh1t、tef1p-sqe-pgk1t、pgk1
p-β-as-adh1t、gal80-down(每个片段用量为400 ng,阴性对照为相应体积水),枪头吹打混匀;冰浴30 min,42 ℃热激30min,3000 r/min离心2 min,弃上清,向菌体中加入800 μl,ypd液体培养基,30 ℃摇床200 r/min振荡培养2 h;将转化菌株均匀的涂在sd-leu-trp-his-ura g418的平板上(平板中g418浓度为200μg/ml,g418为一种抗生素,起筛选作用),将平板倒置于30℃培养箱4~6天。
[0039]
(4)阳性检测:挑取单克隆,按天根酵母基因组提取试剂盒进行基因组提取,以基因组为目的模板,表3中引物进行pcr检测。
[0040]
实施例3 产甘草次酸酵母菌株构建
以实施案例2中酵母菌株y81为底盘菌株,将实施例1所获得8条sqe基因表达簇(ptef1-aisqe-tpgk1,ptef1-atsqe-tpgk1,ptef1-erg1-tpgk1,ptef1-gusqe1-tpgk1,ptef1-ggsqe-tpgk1,ptef1-pgsqe-tpgk1,ptef1-twsqe-tpgk1, ptef1-gusqe2-tpgk1)分别与基因表达簇padh1-uni25647-tadh1, pthd3-gucpr1-ttdh3, padh1-mut72a63-tadh1,ppgk1-β-as-tadh1(本领域技术人员可根据本领域一般常识进行常规构建)以实施例2中酵母整合方法及同源重组形式将各基因整合入底盘菌株染色体的yprc位点(整合示意图见图4),pcr检测阳性克隆,得到的酵母菌株分别命名y91、y92、y93、y94、y95、y96、y97、y98。整合菌株构建信息见表4,整合引物见表5。其中,hyg代表潮霉素b,起到筛选的作用。
[0041]
表4 产甘草次酸菌株产甘草次酸菌株
表5 产甘草次酸菌株引物(seq id no:72-79)其中,以p
adh1-mut72a63-t
adh1
为模板时,所用的上游引物和下游引物与以p
adh1-uni25647-t
adh1
为模板时相同。
[0042]
基因表达簇tef1p-sqe-pgk1t、pthd3-gucpr1-ttdh3、ppgk1-β-as-tadh1整合时所用引物和模板参见表3。
[0043]
酵母基因组的taxonomy id: 559292。pea6-hphmx6购自addgene,addgene: pfa6a-a1-flag:hphmx6。
[0044]
实施例4 发酵及产物检测酵母细胞中sqe催化步骤为三萜化合物合成的关键分支点,高催化活力的sqe基因的导入极大的促进了鲨烯向甘草次酸的代谢流。利用酵母中鲨烯为底物生产萜类化合物的代谢途径示意图见图1。酵母中以2,3-氧化鲨烯为底物生产甘草次酸的代谢途径示意图见图2。
[0045]
本实施例通过摇瓶发酵及产物检测,发现了具有高催化活性的sqe基因。
[0046]
具体发酵条件如下:(1)菌株活化:将上述实施例所构建目标菌株于相应筛选标记平板进行划线,静置于30℃恒温培养箱中培养4~6天,挑取单菌落,于装有5 ml缺陷型培养基的50 ml离心管中置于30 ℃,220 rpm培养至od达0.8-1.2,以此为种子液进行后续活化;取该管中种子液接种于装有20 ml缺陷型培养基的100 ml三角瓶中,接种量为2%-5%,30 ℃,220 rpm培养至od达0.8-1.2;菌株活化3次。
[0047]
(2)菌株发酵:将活化后菌株以5%接种量,接种于装有40ml培养液(ypd培养基:20 g/l蛋白胨、10 g/l酵母粉、20 g/l葡萄糖)的100ml三角瓶,2%的葡萄糖含量,每个菌3个平行,30 ℃,220 rpm发酵7天后进行菌液处理,检测上机。
[0048]
实施例5 重组酿酒酵母发酵产物处理及检测方法(1)样品处理:取1ml的重组酿酒酵母工程菌株(实施例4发酵后获得的菌液),12000rmp离心10min弃上清,加入无菌水清洗3次,12000rmp离心10min 弃上清,加入0.5g的玻璃珠和1ml的乙酸乙酯,震荡15min,超声30min,12000rmp 离心 10min收集上清液,过滤膜后取100μl加入内衬管。
[0049]
(2)样品检测:采用气相色谱-质谱联用仪(gc-ms)对酿酒酵母的乙酸乙酯萃取产物进行分析鉴定。所用色谱仪为安捷伦气相色谱质谱联用仪 gcms-7000,色谱柱为 se-30 (0.25μm
×
0.25m m
×
30m),载气氦气的流速为 1.5ml
·
min-1
;进样口温度300℃,不分流进样,进样量1μl;柱箱程序升温起始温度 80℃保持1min,然后以20℃
·
min-1
的速度升温至 280℃,保持15min 后以20℃
·
min-1
的速度升温至300℃,保持5min;质谱扫描范围 m/z40~550,进样体积为 2μl。数据采集模式:tic模式。各代谢产物离子对见表6。
[0050]
表6 各物质gcms检测条件转入不同来源的角鲨烯环氧化酶基因后的菌株发酵生产11-氧代-β-香树脂醇的结果如图5所示;转入不同来源的角鲨烯环氧化酶基因后的菌株发酵生产鲨烯的结果如图6所示。
[0051]
检测实施例4中发酵7天后的各重组酵母菌液的od
600
,结果如图7所示。
[0052]
产11-氧代-β-香树脂醇的酵母发酵结果如图5至图7所示,从中可知:本发明的4条sqe基因表达簇aisqe(seq id no:1)、gusqe1(seq id no:4)、pgsqe(seq id no:6)、twsqe(seq id no:7)与其他4个基因簇(uni25647, gucpr1, β-as)的染色体整合后均能较好地促进鲨烯流向11-氧代-β-香树脂醇代谢流;其中基因簇aisqe(seq id no:1)的酵母菌株y81中11-氧代-β-香树脂醇产量最高,较空白(y41)提高了5.8倍,中间代谢产物鲨烯降低了5.7倍,选取该菌株为后续产甘草次酸酿酒酵母的底盘细胞。
[0053]
转入不同来源的角鲨烯环氧化酶基因后的菌株发酵生产甘草次酸的结果如图8所示,从中可知:本发明的4条sqe基因表达簇aisqe(seq id no:1)、gusqe1(seq id no:4)、pgsqe(seq id no:6)、twsqe(seq id no:7)与其他4个基因簇(uni25647, gucpr1, mut72a63,β-as)的染色体整合后均能较好地促进鲨烯流向甘草次酸代谢流;其中基因簇aisqe(seq id no:1)的酵母菌株y91中甘草次酸产量最高,较空白提(y81)高了5.8倍。
[0054]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。