新型4,6-嘧啶类衍生物及其在抗肿瘤药物中的应用
技术领域
1.本发明公开一种靶向微管蛋白的抑制剂以及在肺癌治疗中的应用,属于抗肿瘤药学技术领域。
背景技术:
2.肺癌是世界上最常见的恶性肿瘤之一,肺癌约占所有肺癌的80%,约75%的患者发现时已处于中晚期,5年生存率很低。
3.微管靶向药物能够影响癌细胞有丝分裂过程中的微管蛋白动态,阻止有丝分裂纺锤体介导的染色体正确分离,导致细胞周期过程的中断甚至细胞死亡。目前已经确认的有七个微管蛋白结合位点,分别是taxane位点、vinca位点、colchicine位点、pironetinsite位点、maytansine位点、laulimalide/peloruside位点和gatorbulin位点。其中秋水仙碱结合位点抑制剂(cbsi)与其他位点抑制剂相比有许多优点,包括有效抑制管蛋白异型的过度表达,克服由p-gp、mrp1和mrp2介导的抗性,以及对肿瘤血管的破坏作用。尽管对患者表现出较好的临床作用,但耐药性发生和水溶性差是限制cbsi临床应用最主要的难题。然而目前对cbsi的研究主要是基于已报道的抑制剂的结构优化。因此,发现具有新型骨架的cbsi是治疗癌症和克服多药耐药肿瘤的有效途径。
技术实现要素:
4.本发明解决的技术问题是提供一种作为秋水仙碱结合位点抑制剂的新化合物。
5.结构式如式i所示的化合物及其药学上可接受的盐:
6.其中r1为为
7.本发明还提供上述化合物或其药学上可接受的盐在制备抗肿瘤药物中的用途。
8.进一步的,所述抗肿瘤治疗药物优选为肺癌治疗药物。
9.进一步的,所述肺癌治疗药物为微管蛋白秋水仙碱结合位点小分子抑制剂,其用途为用于肺癌相关治疗。
10.本发明还提供一种药物组合物,它是包含有效剂量的上述化合物或其药学上可接受的盐的制剂。
11.本发明制备的化合物或其药学上可接受的盐,可以作为微管蛋白秋水仙碱结合位点小分子抑制剂,具有较明显的肺癌治疗效果。
附图说明
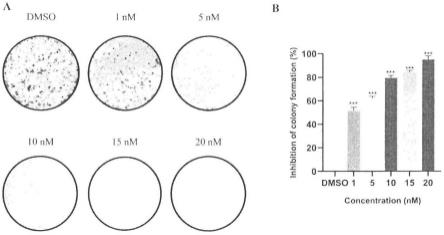
12.图1a用含有不同浓度化合物10的培养基培养处于对数生长期的a549细胞六天后的菌落形成图片。
13.图1b为直方图显示菌落形成抑制率。
14.图2a为化合物10和微管蛋白之间的相互作用(化合物10用黄色表示)和相应结构沿x轴逆时针旋转90
°
的视图。
15.图2b为a549细胞用0.1%dmso、taxol(100nm)、秋水仙碱(100nm)和化合物10(100nm)处理18小时后的图片。
16.图3a为a549细胞用0.1%dmso和不同浓度的化合物10培养48小时后用流式细胞仪进行分析得到的图片。
17.图3b为直方图显示用化合物10处理的细胞凋亡指数分布的百分比。
18.图3c为western blotting分析化合物10对细胞凋亡相关蛋白影响的图片。
19.图4a为伤口愈合实验的代表图片。
20.图4b为用0.1%dmso和化合物10处理12小时后的伤口闭合率图片。
21.图4c为transwell迁移试验的代表图片。
22.图4d为用0.1%dmso和化合物10处理12小时后迁移细胞的直方图。
具体实施方式
23.本发明提供如式i所示的化合物及其药学上可接受的盐:
24.其中r1为为
25.作为一个优选方案,优选r1为
26.下面是本发明的化合物的一些优选结构。
27.本发明还提供本发明所述的化合物的药学上可接受的盐。所述盐可以为硝酸盐、盐酸盐、硫酸盐或磷酸盐等。
28.本发明还提供上述化合物或其药学上可接受的盐在制备治疗肺癌药物中的用途。进一步的,肺癌治疗药物优选为微管小分子抑制剂。
29.本发明还提供一种药物组合物,它是包含有效剂量的上述化合物或其药学上可接受的盐的制剂。可以通过本领域已知的方法可将本发明化合物制成以下形式:片剂、胶囊剂、水性或油性溶液剂、混悬剂、乳剂、乳膏剂、用于吸入的细小分散的粉剂或气雾剂或喷雾剂、用于胃肠道外(包括静脉内、肌内或输注)的无菌水性或油性溶液或混悬剂或无菌乳剂。可将活性组分配制在聚乙二醇水溶液中,也可用水-丙二醇溶液或者无菌水作为溶剂制备液体制剂。用于口服给予的水性溶液可通过将活性组分溶解在水中并按需要加入合适的着色剂、矫味剂,稳定剂和增稠剂来制备。用于口服的水性混悬剂可以通过将微小且分散的活性成分与天然合成胶、树脂、甲基纤维素、羧甲基纤维素和药剂领域已知的其他混悬剂一起分散在水中制成。
30.药物组合物可为单位剂量形式。在这些形式中,将所述组合物分成含适量活性组分的单位剂量。该单位剂量形式可为包装制剂,包装中包括分隔量的制剂,例如盒装片剂、胶囊剂和在管形瓶或安瓻中的粉剂。单位剂量形式还可为扁囊剂或片剂或其可为合适数量的所有这些包装形式。
31.本发明的药物组合物,其活性成分可仅为本发明的化合物,也可与其他抗肺癌化合物组合作为活性成分。
32.在治疗肺癌时,可通过单独、同时或序贯给予各种治疗成分实现联合治疗。此类组合产品应用有效剂量范围内的本发明化合物和准许剂量范围内的其他药学活性剂。
33.下面结合实施例对本发明的具体实施方式做进一步的描述,并不因此将本发明限制在所述的实施例范围之中。
34.实施例1化合物1-15的合成。
35.化合物1-15采用如下反应式合成:
36.reagents and conditions:(a)dipea,etoh,4,6-dichloropyrimidine,80℃;(b)
tfa,dmf,60℃
37.中间体1a制备。
38.将n-(3-氨基苯基)环丙酰胺(0.8g,4.54mmol)溶于15ml乙醇中,加入4,6-二氯嘧啶(1.0g,6.71mmol)和dipea(1.5ml,9.07mmol)。反应混合物在80℃下回流过夜,减压蒸馏,直至完成。将粗品溶解在ch2cl2中,用硅胶柱层析进行纯化(pe/etoac=1.25∶1),得到淡黄色中间体1a(1.04g,产率79.6%)。
39.中间体1a 1
h nmr(400mhz,dmso-d6)δ10.23(s,1h),9.87(s,1h),8.47(s,1h),7.90(s,1h),7.36(dt,j=7.0,2.1hz,1h),7.31-7.20(m,2h),6.81(s,1h),1.80(m,1h),0.79(m,4h)。
40.在dmf中加入不同取代的苯胺(0.26mmol)的中间体1a(50mg,0.17mmol)。将反应混合物滴加3eq的tfa并在60℃下搅拌过夜。最后,用饱和nahco3淬灭混合物,用ea和i-proh(10ml
×
3)提取。合并的有机层在无水na2so4上干燥,减压蒸馏,用硅胶柱层析进行纯化(pe/etoac=3∶1-1∶1),得到化合物1-15。
41.化合物1-15。
42.化合物1,yield:84.6%.m.p.235.9-236.7℃.1h nmr(400mhz,dmso-d6)δ10.19(s,1h),9.40(s,1h),9.22(s,1h),8.38-8.28(m,1h),7.89(s,1h),7.81(s,1h),7.73(ddd,j=8.3,2.4,1.2hz,1h),7.42(t,j=7.9hz,1h),7.30-7.18(m,3h),7.16-6.85(m,2h),6.20(d,j=1.1hz,1h),1.81(m,1h),0.79(m,4h)。
13
c nmr(101mhz,dmso-d6)δ171.55,160.60,160.27,157.65,141.12,140.52,139.71,134.52,129.21,128.84,121.45,118.43,117.34,116.03,114.92,113.01,110.84,86.97,14.47,7.10(2c)。hrms(esi)
[c
21h20
f2n5o
]:calcd 396.1636。
[0043]
化合物2 yield:88.4%.m.p.232.6-234.1℃.1h nmr(400mhz,dmso-d6)δ10.12(s,1h),9.04(s,1h),8.45(s,1h),8.18(s,1h),7.79(t,j=2.0hz,1h),7.26(dt,j=7.8,1.8hz,1h),7.17(m,3h),6.94(d,j=2.7hz,1h),6.70(dd,j=8.4,2.7hz,1h),5.89-5.82(m,1h),3.32(s,3h),2.12(s,3h),1.80(m,1h),0.92-0.66(m,4h)。
13
c nmr(101mhz,dmso-d6)δ171.50,161.43,160.74,157.70(2c),140.84,139.58,138.82,138.30,131.14,128.68,124.58,114.47,112.65,111.08,110.44,84.91,55.00,17.00,14.44,7.06(2c)。hrms(esi)
[c
22h24
n5o
2
]:calcd 390.1930,found 390.1935.hplc purity 97.288%(tr=7.813min)。
[0044]
化合物3,yield:74.6%.m.p.226.5-227.4℃.1h nmr(400mhz,dmso-d6)δ10.24(s,1h),9.12(s,1h),8.70(s,1h),8.18(s,1h),7.81(s,1h),7.33-7.09(m,5h),6.99(ddd,j=9.4,6.9,2.5hz,1h),5.94(s,1h),2.10(d,j=2.1hz,3h),1.84(td,j=7.4,3.7hz,1h),0.77(t,j=5.5hz,4h)。
13
c nmr(101mhz,dmso-d6)δ171.64,162.19,161.30,160.71,159.79,157.67,140.66,139.62,128.67,126.64,121.23,119.73,114.65,112.81,111.20,110.58,85.42,14.41,9.79,7.07(2c)。hrms(esi)
[c
21h21
fn5o
]:calcd 378.1730,found 378.1722.hplc purity 99.452%(tr=7.935min)。
[0045]
化合物4,yield:74.9%.m.p.249.6-250.8℃.1h nmr(400mhz,dmso-d6)δ10.17(s,1h),9.15(s,1h),8.86(s,1h),8.21(s,1h),7.79(t,j=2.0hz,1h),7.35-7.13(m,4h),7.07(td,j=8.3,1.8hz,1h),6.90(td,j=8.1,1.5hz,1h),6.11(s,1h),3.84(s,3h),1.81(m,
1h),0.78(t,j=5.5hz,4h)。
13
c nmr(101mhz,dmso-d6)δ171.78,160.80,160.67,157.58,147.79,147.70,145.98,143.55,140.53,139.55,128.81,128.02,123.61,116.76,114.88,110.83,86.19,56.05,14.47,7.13(2c)。hrms(esi)
[c
21h20
fn5o2na
]:calcd 416.1499,found 416.1501。
[0046]
化合物5,yield:92.9%.m.p.237.9-239.1℃.1h nmr(400mhz,dmso-d6)δ10.18(s,1h),9.15(d,j=3.4hz,2h),8.26(s,1h),7.80(t,j=2.0hz,1h),7.42-7.32(m,1h),7.30-7.15(m,3h),7.14-7.06(m,2h),6.17-6.14(m,1h),3.82(s,3h),1.82(m,1h),0.78(dt,j=8.7,2.8hz,4h)。
13
c nmr(101mhz,dmso-d6)δ171.56,160.55,160.46,157.65,148.03,146.86,145.66,140.62,139.68,137.20,128.80,115.43,114.80,112.92,110.73,106.07,86.21,55.75,14.45,7.09(2c)。hrms(esi)
[c
21h20
fn5o2na
]:calcd 416.1499,found 416.1503。
[0047]
化合物6,yield:81.3%.m.p.223.6-224.9℃.1h nmr(400mhz,dmso-d6)δ10.21(s,1h),9.32(s,1h),9.21(s,1h),8.30(s,1h),7.81(d,j=2.0hz,1h),7.43(d,j=2.2hz,1h),7.34-7.14(m,5h),6.22(s,1h),3.83(s,3h),1.87-1.78(m,1h),0.78(dt,j=7.8,2.9hz,4h)。
13
c nmr(101mhz,dmso-d6)δ171.57,160.55,160.21,157.60,154.37,140.91,140.53,139.70,129.50,128.80,114.87,112.98,112.95,112.07,110.78,104.05,86.96,55.75,14.45,7.10(2c)。hrms(esi)
[c
21h21
cln5o
2
]:calcd 410.1384,found 410.1386。
[0048]
化合物7,yield:81.3%.m.p.239.4-240.8℃.1h nmr(400mhz,dmso-d6)δ10.25(s,1h),9.18(d,j=6.5hz,2h),8.27(s,1h),7.81(s,1h),7.26(m,3h),7.21-7.12(m,2h),7.11-7.05(m,1h),6.52(dd,j=8.3,2.5hz,1h),6.23(d,j=1.1hz,1h),3.99(q,j=6.9hz,2h),1.84(m,1h),1.33(t,j=6.9hz,3h),0.81-0.74(m,4h)。
13
c nmr(101mhz,dmso-d6)δ171.58,160.50,160.38,158.84,157.57,141.74,140.66,139.72,129.31,128.70,114.77,112.86,111.82,110.67,107.23,105.92,86.71,62.77,14.68,14.41,7.07(2c)。hrms(esi)
[c
22h24
n5o
2
]:calcd 390.1930,found 390.193。
[0049]
化合物8,yield:79.5%.m.p.195.6-196.4℃.1h nmr(400mhz,dmso-d6)δ10.17(s,1h),9.38(s,1h),9.20(s,1h),8.31(s,1h),8.12(t,j=1.9hz,1h),7.93(dd,j=8.2,2.3hz,1h),7.82-7.80(m,1h),7.56(d,j=7.6hz,1h),7.44(t,j=7.9hz,1h),7.26-7.21(m,3h),6.20(s,1h),2.57(s,3h),1.81(d,j=5.3hz,1h),0.80-0.78(m,4h)。
13
c nmr(101mhz,dmso-d6)δ197.84,171.57,160.59,160.31,157.82,141.00,140.54,139.69,137.33,129.03,128.85,123.92,121.52,118.53,114.90(2c),110.81,86.84,26.69,14.47,7.11(2c)。hrms(esi)
[c
22h22
n5o
2
]:calcd 388.1773,found 388.1770。
[0050]
化合物9,yield:81.3%.m.p.177.4-178.5℃.1h nmr(400mhz,dmso-d6)δ10.16(s,1h),9.09(m,2h),8.26(s,1h),7.80(t,j=2.0hz,1h),7.41-7.32(m,2h),7.21(m,4h),6.83(d,j=7.5hz,1h),6.18(s,1h),2.58(q,j=7.6hz,2h),1.81(m,1h),1.18(t,j=7.6hz,3h),0.79(dd,j=6.7,4.2hz,4h)。
13
c nmr(101mhz,dmso-d6)δ171.56,160.57,160.53,157.66,144.28,140.66,140.32,139.67,128.81,128.59,121.43,119.30,117.40,114.84,112.88,110.73,86.08,28.28,15.62,14.47,7.09(2c)。hrms(esi)
[c
22h24
n5o
]:calcd 374.1981,found 374.1987。
[0051]
化合物10,yield:77.4%.m.p.232.9-233.7℃.1h nmr(400mhz,dmso-d6)δ10.17
(s,1h),9.16(d,j=10.3hz,2h),8.28(s,1h),7.81(s,1h),7.30-7.15(m,5h),7.14-7.09(m,1h),6.55(dd,j=8.1,2.5hz,1h),6.21(s,1h),3.74(s,3h),1.81(m,1h),0.83-0.72(m,4h)。
13
c nmr(101mhz,dmso-d6)δ171.53,160.59,160.39,159.61,157.64,141.65,140.65,139.68,129.41,128.81,114.79,112.88,112.04,110.71,106.92,105.58,86.52,54.90,14.47,7.10(2c)。hrms(esi)
[c
21h22
n5o
2
]:calcd 376.1773,found 376.1779。
[0052]
化合物11,yield:83.6%.m.p.163.9-165.7℃.1h nmr(400mhz,dmso-d6)δ10.19(s,1h),9.57(s,1h),8.35(d,j=0.9hz,1h),7.88(s,1h),7.39-7.29(m,2h),7.26-7.17(m,2h),6.86(ddd,j=8.3,2.5,0.9hz,1h),6.82-6.74(m,2h),6.13(d,j=0.9hz,1h),3.77(s,3h),1.80(m,1h),0.82-0.74(m,4h)。
13
c nmr(101mhz,dmso-d6)δ171.58,169.23,162.47,160.51,158.12,153.61,139.98,139.70,130.34,128.88,114.63,113.58,113.37,111.22,110.53,107.47,88.80,55.37,14.48,7.12(2c)。hrms(esi)
[c
21h21
n4o
3
]:calcd 377.1614,found 377.1618。
[0053]
化合物12,yield:77.9%.m.p.195.6-196.4℃.1h nmr(400mhz,dmso-d6)δ10.19(s,1h),9.32(s,1h),8.45-8.22(m,2h),7.93(s,1h),7.34(s,1h),7.18(m,4h),6.89(t,j=7.4hz,1h),6.12(s,1h),3.96(t,j=8.6hz,2h),3.19(t,j=8.6hz,2h),1.82(q,j=6.3hz,1h),0.88-0.72(m,4h)。
13
c nmr(101mhz,dmso-d6)δ171.57,160.75,158.96,157.12,143.81,140.68,139.65,131.82,128.83,126.88,124.72,121.21,115.10,114.40,112.71,110.25,86.61,47.94,26.87,14.49,7.12(2c)。hrms(esi)
[c
22h22
n5o
]:calcd 372.1824,found 372.1821。
[0054]
化合物13,yield:81.4%.m.p.201.3-202.5℃.1h nmr(400mhz,dmso-d6)δ10.17(s,1h),9.29(s,1h),8.36(d,j=0.9hz,1h),7.95-7.78(m,1h),7.46(dd,j=8.1,1.6hz,1h),7.33-7.22(m,1h),7.17(dd,j=5.0,1.7hz,2h),7.08-6.83(m,3h),6.53(d,j=1.0hz,1h),4.14(m,4h),1.81(m,1h),0.87-0.67(m,4h)。
13
c nmr(101mhz,dmso-d6)δ171.54,161.04,160.27,157.87,146.77,140.50,139.65,128.80,126.87,124.51,122.98,119.84,117.34,114.54,112.87,110.36,87.94,65.35,41.69,14.47,7.10(2c)。hrms(esi)
[c
22h22
n5o
]:calcd 388.1773,found 388.1768。
[0055]
化合物14,yield:84.6%.m.p.209.7-210.5℃.1h nmr(400mhz,dmso-d6)δ10.18(s,1h),9.29(s,1h),8.37(s,1h),8.13(d,j=8.1hz,1h),7.96-7.88(m,1h),7.38-7.29(m,1h),7.25-7.13(m,2h),7.06(t,j=7.8hz,1h),6.73(d,j=7.5hz,1h),6.11(s,1h),3.97(t,j=8.5hz,2h),3.09(t,j=8.5hz,2h),2.20(s,3h),1.82(m,1h),0.84-0.72(m,4h)。
13
c nmr(101mhz,dmso-d6)δ171.57,160.71,158.94,157.11,143.48,140.69,139.64,133.55,130.50,128.83,126.97,122.28,114.39,112.68(2c),110.24,86.54,47.90,25.71,18.32,14.48,7.12(2c)。hrms(esi)
[c
23h24
n5o
]:calcd 386.1981,found 386.1990。
[0056]
化合物15,yield:72.5%.m.p.231.4-232.5℃.1h nmr(400mhz,dmso-d6)δ10.19(s,1h),9.40(s,1h),8.65(d,j=8.2hz,1h),8.42(d,j=0.8hz,1h),7.93(d,j=1.3hz,1h),7.40-7.32(m,2h),7.23-7.16(m,3h),6.13(d,j=1.0hz,1h),4.05(t,j=8.7hz,2h),3.37(s,1h),3.34-3.31(m,1h),1.82(m,1h),0.83-0.75(m,4h)。
13
c nmr(101mhz,dmso-d6)δ171.58,160.91,158.84,157.11,145.43,140.48,139.66,129.83,128.86,128.12,125.08,122.91,118.68,117.15,114.48,112.88,110.37,87.19,48.06,25.87,14.48,7.12(2c)。
hrms(esi)
[c
23h21
f3n5o
]:calcd 440.1698,found 440.1691。
[0057]
试验例1化合物1-15对a549细胞的抗增殖活性。aic
50
值由细胞活力测定48小时。
[0058]
实验结果表明,本发明的化合物抑制肺癌细胞增殖活性,其中,化合物1,2,4,10的效果较好,最优化合物10具有较强的的肺癌细胞抑制活性。
[0059]
试验例2化合物10抑制a549细胞中的增殖和菌落形成研究。
[0060]
用含有不同浓度化合物10的培养基培养处于对数生长期的a549细胞,用水晶紫染色液对各组细胞进行染色,观察细胞生长和菌落形成。连续培养6天后,菌落形成实验结果表明,化合物10在1nm,5nm,10nm,15nm,20nm浓度下,以浓度依赖性方式显着抑制a549细胞的增殖和菌落形成(图1a),在20nm的浓度下菌落的形成几乎完全被抑制(图1b)。
[0061]
实验结果表明,本发明的化合物10抑制a549细胞增殖和菌落形成。
[0062]
试验例3化合物10抑制微管蛋白聚合在体外研究以及与微管蛋白结合的晶体结构。
[0063]
化合物10中4,6-嘧啶的一个氮原子与β-微管蛋白的d249形成关键的氢键,另一个氮原子在水分子的介导下与α-微管蛋白的n101和t179形成氢键网络(图2a)。
[0064]
通过共聚焦显微镜对a549细胞进行免疫荧光测定。如图2b所示,dmso组微管网络呈正常排列,细长,而紫杉醇处理的微管蛋白呈有序聚合并聚集成束,而秋水仙碱和化合物10处理的微管蛋白呈无序和混沌形态且化合物10的效果比秋水仙碱更显着(图2b)。
[0065]
实验结果表明,本发明的化合物10和秋水仙碱可以与微管蛋白相互作用。
[0066]
试验例4化合物10对促进a549细胞中细胞凋亡研究。
[0067]
对a549细胞进行膜联蛋白v-fitc/pi(av/pi)双染色试验,与对照组凋亡细胞比例(1.21%)相比,化合物10不同浓度处理后凋亡细胞比例呈剂量依赖性显着升高,分别为11.28%、18.00%和30.58%(图3a,图3b)。
[0068]
western blot分析显示bcl-2经化合物10处理后表达下调,但bad表达上调(图3c)
[0069]
实验结果表明,本发明的化合物10以剂量依赖性方式显著诱导a549细胞中的细胞凋亡。
[0070]
试验例5化合物10对a549细胞中的细胞迁移研究。
[0071]
a549细胞经化合物10处理12h后,对照细胞的伤口闭合率为29.5
±
1.34%,经化合物10处理的细胞恢复率分别为23.2
±
1.15%、15.8
±
0.87%、9.8
±
0.96%和6.1
±
0.50%(图4a,图4b)。
[0072]
通过transwell小室试验验证化合物10对a549细胞迁移能力的抑制作用。化合物10处理(5nm、10nm、20nm和40nm)后,a549细胞的迁移数随着药物浓度的增加而减少,迁移到635
±
12、486
±
10、397
±
11和157
±
9个伤口面积,分别显着小于对照组(724
±
16)(图4c,图4d)。
[0073]
实验结果表明,本发明的化合物10显着抑制了体外肿瘤细胞迁移。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。