玉米半矮杆基因zmd13的分子标记及其应用
技术领域
1.本发明涉及生物技术领域,特别涉及玉米半矮杆基因zmd13的分子标记及其应用。
背景技术:
2.玉米是重要的粮食作物,也是重要的动物饲料和工业原料。在过去的一个世纪中,玉米单位面积产量的增加不仅依靠单株产量的提高,种植密度的增加也是其重要因素。玉米耐密品种应当具备株高适宜、株型紧凑、根系发达、茎秆坚韧、抗逆抗病等性状特征。株高是影响玉米品种耐密性的关键性状之一。合理降低品种株高有利于增强玉米抗倒伏能力,提高种植密度,改善群体通透性,优化光能利用效率,从而实现提高单位面积产量的目标。因此挖掘株高调控基因,选育优良的矮杆品种进行推广和应用,是玉米耐密育种的重要方向。
3.上个世纪60年代,水稻和小麦矮杆基因rht1和sd1的发掘以及相关矮生衍生系品种的推广应用掀起了一场“绿色革命”,在全世界范围内极大的提高了小麦和水稻的产量。在玉米中,发掘株高调控基因并开发相关功能标记,对于矮杆玉米品种的选育和应用具有重要意义。
4.snp标记的验证通常使用桑格(sanger)测序法,不过价格较高,通量偏低。如果将snp转化为可以酶切验证的caps或dcaps多态性共显性标记,就可以通过简单的pcr扩增、限制性内切酶切和产物凝胶电泳来高效快速的实现snp位点检测。由于具有这些优势,caps和dcaps标记技术已成为生物学研究中的重要分子标记技术,在遗传图谱构建、种质鉴定和辅助育种等领域得到广泛应用。
技术实现要素:
5.本发明所要解决的技术问题是如何鉴定植物是否含有矮秆基因。
6.为了解决上述技术问题,本发明首先提供了用于检测玉米基因组中snp1477的多态性或基因型的引物组合物。所述引物组合物由序列表中序列5和序列6所示的两条单链dna组成。
7.所述snp1477是玉米基因组中的一个snp位点,其核苷酸种类为c或t,为序列表中序列1的第1477位核苷酸。
8.上文所述引物组合物中,所述两条单链dna的摩尔比可相同。
9.为了解决上述技术问题,本发明还提供了检测玉米基因组中snp1477位点的多态性或基因型的产品。所述产品含有上文所述的引物组合物。所述snp1477位点是玉米基因组中的一个snp位点,其核苷酸种类为c或t,为序列表中序列1的第1477位核苷酸。
10.上文所述产品可为试剂或试剂盒。
11.为了解决上述技术问题,本发明还提供了制备上文所述的引物组合物的方法。所述方法可包括将上文所述的两条单链dna分别单独包装的步骤。
12.为了解决上述技术问题,本发明还提供了检测玉米基因组中snp1477位点的多态
性或基因型的的方法。所述方法可包括如下步骤:
13.1)以玉米的基因组dna为模板,用上文所述的引物组合物进行pcr扩增,得到pcr扩增产物。
14.2)将1)中得到的所述pcr扩增产物使用限制性内切酶taqi进行酶切得到酶切产物,根据所述酶切产物的大小确定所述snp1477位点的多态性或基因型。
15.所述snp1477位点是玉米基因组中的一个snp位点,其核苷酸种类为c或t,为序列表中序列1的第1477位核苷酸。
16.所述snp1477位点的基因型为cc的玉米的酶切产物可为两条条带(185bp和23bp),所述两条条带的核苷酸序列可分别为序列表中序列8所示和序列表中序列7所示。所述snp1477位点的基因型为ct的玉米的酶切产物可为三条条带(185bp、23bp和208bp),所述三条条带的核苷酸序列可分别为序列表中序列8、序列表中序列7和序列表中序列9所示。所述snp1477位点的基因型为tt的玉米的酶切产物可为一条条带(208bp),所述一条条带的核苷酸序列可分别为序列表中序列9所示。
17.上文所述引物组合物的下述任一种应用也属于本发明的保护范围:
18.a1)上文所述的引物组合物在检测玉米基因组中snp1477位点的多态性或基因型中的应用。
19.a2)上文所述的引物组合物在检测矮秆玉米中的应用。
20.a3)上文所述的引物组合物在玉米育种和改良中的应用。
21.所述snp1477位点是玉米基因组中的一个snp位点,其核苷酸种类为c或t,为序列表中序列1的第1477位核苷酸。
22.为了解决上述技术问题,本发明还提供了上文所述的产品的下述任一种应用:
23.b1)上文所述的产品在检测玉米基因组中snp1477位点的多态性或基因型中的应用;
24.b2)上文所述的产品在检测矮秆玉米中的应用。
25.b3)上文所述的产品在玉米育种和改良中的应用。
26.所述snp1477位点是玉米基因组中的一个snp位点,其核苷酸种类为c或t,为序列表中序列1的第1477位核苷酸。
27.上文所述的方法的下述任一种应用也属于本发明的保护范围:
28.c1)上文所述的方法在检测玉米基因组中snp1477位点的多态性或基因型中的应用。
29.c2)上文所述的方法在检测矮秆玉米中的应用。
30.c3)上文所述的方法在玉米育种和改良中的应用。
31.所述snp1477位点是玉米基因组中的一个snp位点,其核苷酸种类为c或t,为序列表中序列1的第1477位核苷酸。
32.所述玉米可选自玉米矮杆突变体d13
×
玉米自交系b73的杂交后代,如f2代或其以上后代;也可选自玉米矮杆突变体d13
×
自交系昌7-2的杂交后代,如f2代或其以上后代。
33.本发明在玉米ems诱变突变体库中发现一个隐性单基因控制的半矮化突变体dwarf13(d13),随后克隆了参与玉米株高发育调控的新基因zmd13,并发现该zmd13基因的snp1477位点的核苷酸种类为c或t,是产生d13矮化表型的关键位点;在此基础上进行了玉
米snp1477位点dcaps标记的开发,对辅助位点选择具有重要作用,可以用于鉴定玉米是否含有矮秆基因。该dcaps标记能够准确快速高效地鉴定矮杆基因d13的突变位点基因型,以辅助该位点在玉米株高育种和改良中的应用。
附图说明
34.图1为突变体d13与野生型(wt)表型分析。(a-d):突变体d13与wt表型对比;(e):d13与wt节间长对比;(f):d13与wt表型值比较,**代表p《0.01。
35.图2为zmd13基因的crispr/cas9编辑突变。(a)编辑突变体与野生型(wt)表型对比;(b)编辑靶点测序分析;(c)编辑突变体与野生型(wt)株高和穗位高值比较,**代表p《0.01;(d)编辑突变体与野生型(wt)节间长度比较。
36.图3为f2群体构建过程。
37.图4为d13与野生型的表型比较。矮杆突变体d13株高约为野生型的50%左右,各茎节明显缩短,叶片长度较野生型短。
38.图5为dcaps标记开发。
39.图6为野生型(wt)、d13突变体和f1的dcaps引物扩增和酶切。
40.图7为f2群体的酶切条带。
41.图8为突变体和育种自交系的酶切条带。
具体实施方式
42.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
43.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
44.本发明实施例中所使用的玉米材料的来源:
45.突变体d13与玉米b73自交系杂交构建获得f2分离群体(图3);
46.玉米20个育种自交系郑58、昌7-2、mo17、b73、综31、齐319、黄早四、黄c、178、掖478、丹340、自330、沈137、ph4cv、ph6wc、cl11、ng5、hd568、11dm124、b195为本实验室保存,相关文献:黎裕,王天宇.我国玉米育种种质基础与骨干亲本的形成.玉米科学2010,18(5):1~8;hu x,wang h,et al..transcriptome profiling and comparison of maize ear heterosis during the spikelet and floret differentiation stages.bmc genomics.2016nov 22;17(1):959.doi:10.1186/s12864-016-3296-8.pmid:27875998。
47.实施例一、玉米株高发育调控的新基因zmd13的发现及克隆
48.1.玉米株高突变体d13的筛选及表型鉴定
49.1.1玉米株高突变体d13的筛选
50.对玉米自交系昌7-2材料进行ems诱变,ems诱变果穗成熟后得到约10,000粒诱变一代(m1)种子,将m1种子单粒播种,自交后单穗收获。m2代种子20粒种成穗行,从苗期到成熟期开展性状调查。在其中一个穗行中发现5株半矮化突变体,将其命名为dwarf13(d13)。后
又对该d13突变体穗行进行自交获得m3和m4代,后代表型观察发现半矮化突变性状可稳定遗传。
51.玉米d13突变体的矮化表型在5叶期即可观察发现,拔节期更为明显。成熟d13株高和穗位仅为野生型昌7-2(图1中wt代表)的50%左右(图1中a)。进一步对突变体和野生型的茎节数目和长度进行调查发现,d13茎节数目与野生型wt无显著差异,但是每个茎节的长度均比野生型短(图1中b和e)。其中穗上3节和穗下4节缩短最为显著。对m4代群体中野生型wt和d13突变体其他农艺性状进行调查发现,除矮化外,d13突变体的叶片和雄穗主轴长度变短(图1中c、d和f)。
52.1.2zmd13基因的遗传分析及图位克隆
53.将d13(父本)与b73(母本)自交系杂交构建f2分离群体,表型调查和卡方检验表明,矮化与正常植株的分离比符合3:1分离规律,d13突变性状受隐性单基因控制。
54.提取双亲及f2分离群体中78株d13突变体的dna,利用靶向测序基因型分型技术(20k gbts)对样品的基因型进行检测。经数据分析,双亲间可用的多态性snp标记共7,029个,均匀覆盖玉米10条染色体,平均每mb约3个snp。分别计算每个snp标记的snp index(即突变亲本d13的基因型频率),并分析全基因组snp index变化规律。在3号染色体短臂1-18mb区间内,标记snp index值超过0.5并逐渐趋近于1,表明该区间与目标性状连锁,是候选区段。分析78个样本在该区段的基因型变化发现,最小初定位区间位于4.1-6.0mb区间。进一步扩大定位群体,开发7个双亲间有多态性的indel标记,将区间缩小到了200kb。根据gramene(http://gramene.org/)网站预测结果,该区间还有5个蛋白编码基因。测序分析发现其中一个编码细胞色素p450酶的新基因,在第8外显子上,存在一个c-t的突变,符合ems诱变特点。该单碱基变异形成了一个终止密码子,d13突变体蛋白翻译提前终止,较野生型缺少了10个氨基酸推测该基因就是候选基因,并将其命名为zmd13。
55.zmd13基因的cds序列如序列表中序列1所示,序列1中,y为c或t。d13突变体蛋白的编码序列如序列表中序列2所示。
56.1.3 zmd13基因的crispr/cas9敲除验证
57.使用crispr/cas9基础载体(cpb载体)(中国农业科学院作物科学研究所谢传晓研究员惠赠相关文献:li c,et al..rna-guided cas9 as an in vivo desired-target mutator in maize.plant biotechnol j.2017dec;15(12):1566-1576.doi:10.1111/pbi.12739.epub 2017may 12.pmid:28379609.),在zmd13蛋白的活性中心血红素结合结构域(heme binding domain)序列上选取2个靶点。构建双靶点sgrna和cas9蛋白的表达盒,并将其插入双元表达载体cpb,完成crispr/cas9敲除载体构建。
58.两个靶向zmd13的sgrna分别为sgrna1和sgrna2。其中sgrna1靶点的核苷酸序列为5
’‑
gaagaggcggaaaaccgacg-3’,靶向于zmd13基因的序列表中序列2的第1044-1063位;sgrna2靶点的核苷酸序列为5
’‑
ggcttcaccccttttggcgg-3’,靶向于zmd13基因的序列表中序列1的第1324-1343位。
59.目的片段(双靶点sgrna和cas9蛋白的表达盒)的获得与纯化:
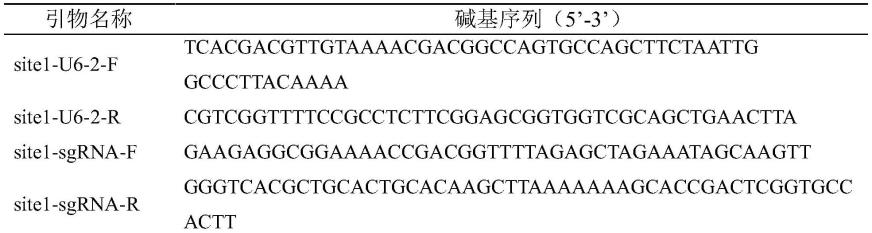
60.目的片段的制备所用引物:
61.表1.引物序列
[0062][0063][0064]
目标片段u6-2启动子由site1-u6-2-f(site2-u6-2-f)、site1-u6-2-r(site2-u6-2-r)引物进行扩增得到。目标片段sgrna片段由site1-sgrna-f(site2-sgrna-f)和site1-sgrna-r(site2-sgrna-r)引物进行扩增得到。具体步骤:以cpb载体为dna模板,进行pcr反应,扩增程序为95℃预变性3min;95℃变性30s,58℃退火20s,68℃延伸20s,35个循环;68℃延伸5min,12℃保存。
[0065]
用1%琼脂糖凝胶电泳检测后,使用m5 gel extraction kit试剂盒进行对u6-2启动子和sgrna片段进行胶回收。
[0066]
靶点片段的制备主要使用重叠pcr技术,重叠pcr反应后得到重叠片段,重叠pcr产物中含有目的片段即u6-2::grna::sgrna(u6-2::grna1::sgrna或u6-2::grna2::sgrna)(序列表中序列3的第300-802位核苷酸或序列表中序列3的第803-1305位核苷酸)。
[0067]
cpb酶切载体的制备和回收:利用hindiii对cpb载体进行消化,其反应体系共50μl:5μl的cpb载体dna(200ng/μl)、5μl的10
×
buffer、1μl的hindiii内切酶、39μl的ddh2o。
[0068]
目的片段与酶切载体的连接及转化
[0069]
使用hieffplus one step cloning kit试剂盒(上海翊圣生物科技有限公司,cat#10911es20)连接酶切后的线性载体(即上述cpb酶切载体)和靶点片段(即上述重叠pcr产物)得到重组载体,将重组载体转化dh 5α感受态细胞后,进行菌落pcr并送菌样测序(引物:5
’‑
aactgtagagtcctgttgtc-3’和5
’‑
cattcgccattcaggctgc-3’),经测序发现,重组载体阳性克隆菌含有双靶点u6-2::grna1::sgrna::u6-2::grna2::sgrna(序列表中序列3)和cas9蛋白的表达盒(序列表中序列4)。将阳性单克隆菌摇菌培养,提取crispr-cas9重组质粒zmd13-grna1-grna2,转化农杆菌eha105菌株中得到重组农杆菌eha105/zmd13-grna1-grna2,使用重组农杆菌eha105/zmd13-grna1-grna2转化玉米b104(北京博美兴奥科技有限公司)幼胚,得到基因编辑玉米t0代植株,t0代玉米自交获得t1代。
[0070]
对基因编辑t0和t1代植株的靶点序列使用引物5
’‑
gcgcctaaacatcagcaga-3’和5
’‑
acaacaccgaggagcacac-3’进行pcr扩增检测并测序,共获得2个双纯合突变体分别命名为zmd13-cr1、zmd13-cr2;对2个双纯合突变体进行表型测定和观察,结果显示2个双纯合突变体的表型与d13突变体表型高度相似,表现为茎节缩短,植株矮化,株高和穗位高分别约为
野生型转基因受体自交系b104(图2中wt)的61.9%~69.5%和90.3%~92.9%(表2和图2)。根据以上结果,zmd13具有调控玉米株高的功能。
[0071]
表2.基因编辑突变体和野生型b104株高和穗位高比较
[0072][0073]
实施例二、玉米半矮杆基因zmd13的dcaps分子标记的开发及应用
[0074]
玉米细胞色素p450酶基因zmd13基因第八个外显子上即序列1的第1477位核苷酸位点为snp位点,命名为snp1477,该snp1477位点的核苷酸为c或t。玉米半矮杆突变体dwarf13(d13)中该zmd13基因的snp1477位点的核苷酸为t,是产生d13矮化表型的关键位点。在玉米植株散粉后期对株高表型的田间鉴定,可见矮杆突变体d13株高约为野生型的50%左右,各茎节明显缩短,叶片长度较野生型短(图4)。
[0075]
1.dcaps标记的开发
[0076]
利用dcaps finder 2.0program(http://helix.wustl.edu/dcaps/dcaps.html)针对zmd13基因的snp1477位点进行dcaps引物开发和内切酶的选择,扩增包含snp1477突变位点的目标片段,扩增片段的长度为208bp。利用primer premier 5.0软件设计相应的下游引物,并在ncbi中blast验证引物特异性。引物由生工生物工程(上海)股份有限公司合成,具体序列如表3所示:
[0077]
表3.dcaps引物序列
[0078][0079]
2.dcaps引物特异性和酶切片段多态性检测
[0080]
在玉米b73自交系和野生型自交系昌7-2等玉米纯合野生型中snp1477位点的核苷酸为c。玉米d13矮杆突变体为纯合突变体,d13的snp1477位点的核苷酸为t。利用dcaps技术,在该snp上游2bp处引入突变碱基t,从而在野生型玉米snp1477位点引入1个taqi的酶切位点(图5中wt代表野生型)。理论上野生型snp1477位点的dcaps引物扩增产物包含1个taqi酶切位点识别序列,可以被taqi限制性内切酶切成23bp(序列表中序列7)和185bp(序列表中序列8)两个片段;突变体d13的snp1477位点的dcaps扩增产物无酶切位点,条带长度为208bp(序列表中序列9)。
[0081]
利用步骤1中设计的该dcaps引物对矮杆突变体d13,野生型自交系昌7-2(wt)及其f1杂交种进行pcr扩增得到三种pcr产物,并用1%的琼脂糖凝胶电泳,扩增条带单一(均为208bp),且明亮清晰,大小正确(图6中的pcr产物泳道中的条带)。将三种pcr扩增产物用taqi限制性内切酶进行酶切,65℃反应10分钟后,利用3%的琼脂糖凝胶电泳。实验结果显示三种pcr产物酶切后共有3种带型:a(208bp)、b(185 23bp)、h(208 185 23bp),但是23bp的条带由于太短在胶上基本不可见。d13突变体条带为a型条带(图6中的taqi酶切泳道中的d13),昌7-2条带为b型条带(图6中的taqi酶切泳道中的wt),f1杂交种条带为h型条带条(图
6中的taqi酶切泳道中的f1)。表明该dcaps标记特异性强与性状共显性分离,可用于d13突变体中突变位点的检测,即snp1477位点多态性的检测。
[0082]
实验步骤如下:
[0083]
玉米材料dna提取:
[0084]
使用天根生物科技(北京)有限公司的植物dna提取试剂盒(dp305)。
[0085]
pcr扩增体系及反应条件:
[0086]
扩增体系(pcr扩增所用的酶为北京聚合美生物科技有限公司,mf-002)
[0087]
templatedna*《1μg
[0088]2×
m5taqhifipcrmix10μl
[0089]
dcaps1477-f(10μm)0.5μl
[0090]
dcaps477-r(10μm)0.5μl
[0091]
ddh2o补足至20μl
[0092]
反应条件:
[0093][0094]
扩增产物酶切体系:
[0095]
taqi限制性内切酶(thermofisherscientific,fd0674),识别位点为5'
…
t^cga
…
3';
[0096]
酶切体系:
[0097]
pcr产物《1μg
[0098]
10xbuffer2μl
[0099]
taqi1μl
[0100]
ddh2o补足至20μl
[0101]
酶切程序:65℃10min,4℃保存。
[0102]
凝胶电泳检测酶切片段:
[0103]
3%琼脂糖凝胶,电压160v,电泳40分钟。
[0104]
3.dcaps引物标记在f2分离群体中的检测
[0105]
利用snp1477位点的dcaps引物标记对突变体d13与玉米b73自交系杂交构建获得的24份f2分离群体(图3)进行snp1477位点的基因型检测,检测方法同步骤2。由图7结果可见,在f2群体的17份株高与正常的玉米b73野生型材料株高相似的材料中,有6份检测带型为b(185 23bp)(图7中的f
2-3、f
2-6、f
2-10、f
2-12、f
2-21、f
2-24,表明该6份f2材料是snp1477位点的基因型为cc的纯合野生型(aa),11份材料检测带型为h(208 185 23bp)(图7中的f
2-1、f
2-4、f
2-5、f
2-7、f
2-8、f
2-9、f
2-15、f
2-17、f
2-18、f
2-20、f
2-22),表明该11份f2材料是snp1477位点的基因型为ct的杂合型(aa);另外7份矮杆突变材料酶切后带型全部为a型
(208bp)(图7中的f
2-2、f
2-11、f
2-13、f
2-14、f
2-16、f
2-19、f
2-23),表明该7份f2材料是snp1477位点的基因型为tt的纯合突变型(aa)。对24份f2植株株高进行测量和计算(表4),可得纯合野生型(cc)的平均株高为:253.5;杂合野生(ct)的平均株高为258.0;纯合突变体(tt)的平均株高为166.6厘米,仅为纯合和杂合野生型的65.7%和64.6%,且差异极显著(t-test,p《0.01)。因此,dcaps引物分子标记的基因型检测结果与表型的准确率达到100.0%。f2分离群体中基因型分布满足1:2:1(χ2《3.84),符合孟德尔遗传规律,这也再次验证了玉米矮杆性状受隐性单基因控制。
[0106]
表4.f2群体植株株高及其基因型
[0107][0108][0109]
4.dcaps引物标记在玉米骨干自交系中的检测
[0110]
进一步利用snp1477位点的dcaps引物对20个玉米育种中的骨干自交系进行检测,检测方法同步骤2。检测结果显示,酶切后产物条带带型均为a型,即检测的20份玉米自交系的snp1477位点的基因型均为纯合野生型(aa),表明骨干自交系中均不包含突变型的snp位点(图8)。因此利用d13矮杆突变体可以对玉米进行株高遗传改良创制矮杆种质,snp1477位点dcaps标记的开发,对辅助位点选择具有重要作用。该dcaps标记能够准确快速高效地鉴定矮杆基因d13的突变位点基因型,以辅助该位点在玉米株高育种和改良中的应用。
[0111]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。