1.本发明属于生物领域,具体涉及一种具有催化功能的蛋白、其编码基因、以此基因为目的基因制备的重组蛋白及应用。
背景技术:
2.齐墩果烷型五环三萜皂苷是灰毡毛忍冬中特有的一类化合物,研究表明其具有抗病毒、抗菌等作用。α-hederin是其中非常重要的一种五环三萜皂苷。研究表明,α-hederin具有保肝、抗肿瘤、止痉、止痛、抗真菌等多种药理活性。以抗肿瘤活性为例,α-hederin可通过多种分子机制抑制结肠癌、胃癌、肝细胞癌、乳腺癌、黑色素瘤等多种肿瘤的发生发展,显示了优异的广谱抗肿瘤活性。
3.研究植物在合成α-hederin过程中相关酶及其编码基因有助于提高α-hederin的产量。
技术实现要素:
4.本发明的目的在于提供一种具有催化功能的蛋白、其编码基因、以此基因为目的基因制备的重组蛋白及应用。
5.本发明上述目的通过如下技术方案实现:
6.一种蛋白,其特征在于:其氨基酸序列如sequence no.1所示。
7.上述蛋白的催化用途,所述催化指将底物caulosidea催化加上一分子鼠李糖生成目标化合物α-hederin。
8.一种编码上述蛋白的编码基因,其核苷酸序列如sequence no.2所示。
9.一种含有上述编码基因的表达载体。
10.上述表达载体在将caulosidea和鼠李糖合成α-hederin中的应用。
11.一种以上述编码基因为目的基因制备的重组蛋白。
12.上述重组蛋白的催化用途,所述催化指将底物caulosidea催化加上一分子鼠李糖生成目标化合物α-hederin。
13.有益效果:
14.本发明在灰毡毛忍冬中发现了一种一个具有催化糖基转移功能的蛋白lmrha-ugt,蛋白lmrha-ugt以及以该蛋白编码基因为目的基因制备的重组蛋白可以将底物caulosidea催化加上一分子鼠李糖生成皂苷α-hederin。因此,蛋白lmrha-ugt、含有蛋白lmrha-ugt编码基因的表达载体以及以该蛋白编码基因为目的基因制备的重组蛋白可以用于制备α-hederin。
附图说明
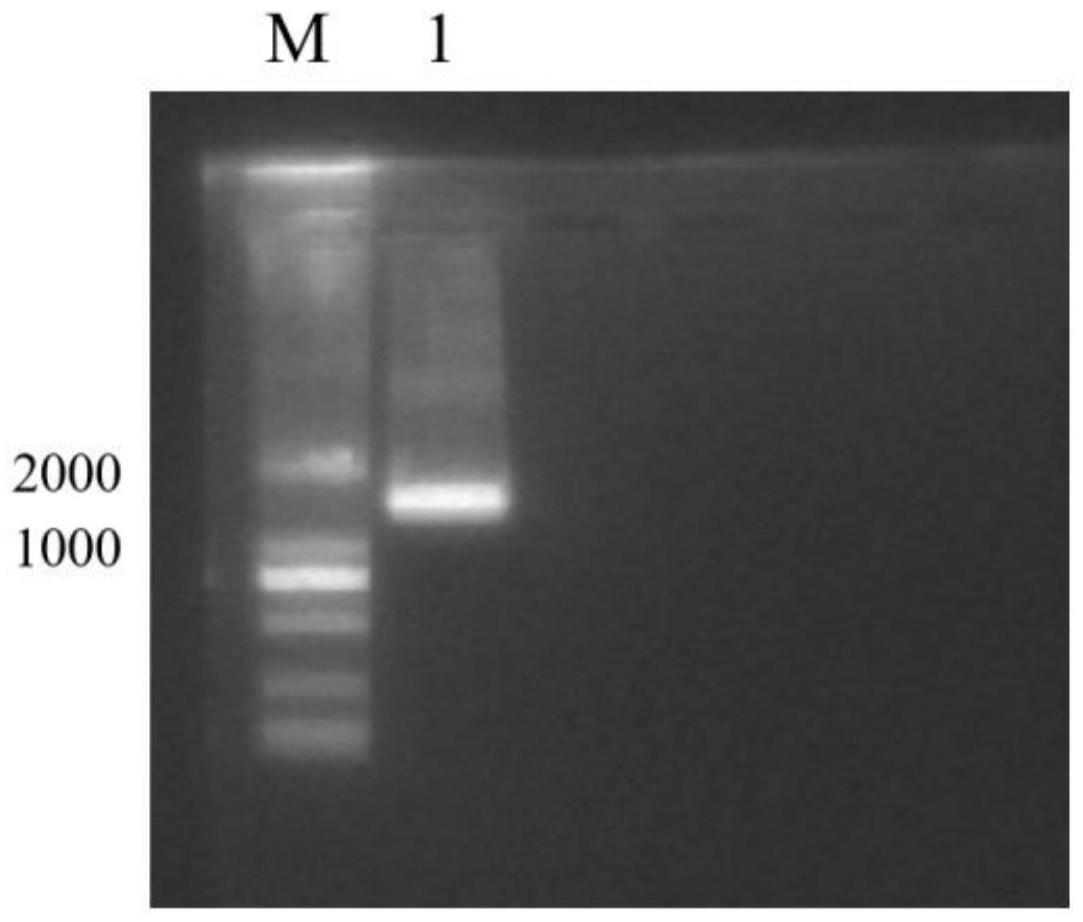
15.图1为lmrha-ugt扩增琼脂糖凝胶电泳图;
16.图2为纯化后的lmugt73p1重组蛋白的sds-page凝胶电泳图;
17.图3为lmrha-ugt与底物caulosidea体外酶活反应的lc/ms检测结果图;
18.图4为phb-lmrha-ugt烟草瞬时表达产物的lc/ms检测图。
具体实施方式
19.下面结合实施例具体介绍本发明实质性内容,但并不以此限定本发明的保护范围。
20.糖基转移酶lmrha-ugt的氨基酸序列如sequence no.1所示,lmrha-ugt的编码基因的核苷酸序列如sequence no.2所示。
21.一、实验材料
22.1、本实验中,所用实验材料为灰毡毛忍冬,栽植于中国药科大学药用植物园内。灰毡毛忍冬幼嫩的茎叶用于dna和rna的提取。烟草瞬时表达所用的烟草材料,为中国药科大学天然药物活性组分与药效国家重点实验室组培室培育种植。
23.2、实验所用的载体与菌株
24.(1)载体:
25.原核表达载体:pet28a
26.瞬时表达载体:phb-3*flag
27.(2)菌株:
28.载体克隆的大肠杆菌菌株:dh5
ɑ
29.原核表达的大肠杆菌菌株:bl21(de3)
30.农杆菌菌株:gv3101
31.3、实验所用的标准品和主要试剂
32.(1)标准品
[0033][0034]
(2)主要生化试剂
[0035]
[0036][0037]
二、实验方法
[0038]
1、lmrha-ugt的克隆
[0039]
1.1灰毡毛忍冬总rna的提取及逆转录合成cdna
[0040]
根据天根生化科技有限公司的微量样本总rna提取试剂盒中的说明书提取总rna,
使用nano测定浓度及纯度,放置-80℃保存,备用。取出上述提取好的rna溶液,按照下面的体系加入试剂。
[0041]
表1-1逆转录体系
[0042][0043]
取出并放置在42℃水浴锅中,孵育2min。加入10μl的2*hifairⅱsupermix plus。并且按照以下温度体系,将反应产物放在pcr仪中进行逆转录反应。
[0044]
表1-2逆转录体系
[0045][0046]
逆转录的产物cdna放在-20℃冰箱中保存备用。
[0047]
1.2 lmrha-ugt的全长扩增
[0048]
根据sequence no.2,设计特异性引物,引物如下表。以灰毡毛忍冬cdna为模板扩增lmugt73p1的全长。pcr扩增体系(总体系为50μl)如下:
[0049]
表1-3 pcr扩增体系
[0050][0051]
表1-4 pet28a载体所用的特异性引物:
[0052][0053]
表1-5 phb载体所用的特异性引物:
[0054][0055]
扩增程序为:
[0056]
94℃下预变性,变性时间为5min;94℃下解链30s;56℃下,退火40s;68℃下,延伸1min 30s,35个循环;68℃下,延伸5min,4℃放置备用。往pcr扩增产物中加入10
×
loading buffer,使用琼脂糖凝胶电泳系统,检测扩增产物,切胶后,按照axygen公司的dna凝胶回收试剂盒方法进行胶回收,测回收产物的浓度及纯度,放置-20℃,保存备用。
[0057]
2、lmrha-ugt原核表达载体构建
[0058]
按照设计引物添加的两个酶切位点,将测定好浓度的回收产物以及选择的原核表达载体质粒分别进行双酶切反应。反应体系分别如下:
[0059]
表2-1目的基因酶切体系(50μl)
[0060][0061]
表2-2 pet28a质粒酶切体系(40μl)
[0062][0063]
双酶切反应条件为37℃水浴30min。酶切后的目的基因按照axygen公司的pcr清洁试剂盒说明书进行清洁纯化,测定回收产物的浓度与纯度,放置-20℃,保存备用;酶切后的质粒,先进行琼脂糖凝胶电泳,切下目的条带,按照axygen公司的dna凝胶回收试剂盒方法进行胶回收,测回收产物的浓度及纯度,放置-20℃,保存备用。
[0064]
将酶切好的目的基因与质粒进行连接,连接体系(10μl)如下:
[0065]
表2-3载体连接程序
[0066][0067]
连接反应条件为金属浴22℃,1h。连接产物4℃暂时保存,及时转化至大肠杆菌dh5
ɑ
感受态,转化方式参考唯地生物提供的说明书步骤。转化产物涂布至含有卡那抗生素的lb固体培养基中,放置37℃培养箱中培养约16h。待长出单菌落,用枪头挑单菌落至800μl含有卡那抗生素的lb液体培养基中,放置于37℃摇床中,震荡培养约6h。待菌液浑浊后,以浑浊的菌液作为模板,进行pcr验证,反应体系(10μl)如下:
[0068]
表2-4菌液pcr体系
[0069][0070]
pcr扩增的程序与上述基因克隆的程序一样。程序结束后,将产物进行琼脂糖凝胶电泳跑胶检测,选择一个阳性菌液,送至金唯智公司进行测序。将测序成功的菌液,先取出600μl菌液,加入400μl 50%甘油,保菌至-80℃;另外再取出约60μl菌液至6ml含有卡那抗生素的lb液体培养基中,放置于37℃摇床中,震荡培养过夜。
[0071]
按照axygen公司的质粒提取试剂盒的说明书,将培养过夜的菌液进行质粒提取,获得的质粒pet28a-lmrha-ugt,使用nano测定其浓度与纯度,放置-20℃,保存备用。
[0072]
将提取好的pet28a-lmrha-ugt质粒,取出1-2μl转化至大肠杆菌bl21(de3)感受态中,转化方式与转化大肠杆菌dh5
ɑ
感受态一样。同样,挑取单克隆,使用菌液pcr进行阳性验证,阳性菌液大摇后,提取相应质粒,-20℃,保存备用或蘸取菌液划线,37℃生长16h,放置4℃保存。
[0073]
3、蛋白诱导及纯化
[0074]
大肠杆菌体系是原核表达体系中的一种,将带有目标基因的载体转化进入大肠杆菌,在温度的控制下,加入诱导剂可以诱导重组质粒表达成为蛋白质。本次实验采用的载体是pet28a表达载体,该载体含有his标签,his标签中带有咪唑基团,咪唑可以与ni
等金属离子形成配位键,因此,将目标基因与含有his标签的载体连接,那么带有his标签的蛋白就
可以与金属离子形成配位键,利用这个原理,我们选择使用ni-nta亲和层析的方法进行蛋白纯化。
[0075]
3.1蛋白诱导
[0076]
挑取pet28a-lmrha-ugt划线后生长的单克隆,于1ml含有卡那抗生素的lb液体培养基中,37℃过夜震荡培养。取3ml浑浊的菌液转移至300ml含有卡那抗生素的lb液体培养基中大摇,37℃,震荡培养约6h,至菌液od
600
值达到0.6-0.8,加入配好的iptg(终浓度达到0.5mm)进行诱导,16℃,160rpm,培养20h后,离心收集菌,放置于-80℃保存。
[0077]
3.2蛋白纯化
[0078]
(1)超声破开细胞壁
[0079]
从-80℃冰箱中取出菌体,加入10ml裂解液(lysis buffer),放置于冰上解冻。超声前加入100μlpmsf。超声条件为30%能量,超声10s,暂停10s,共10次。途中及时补加pmsf。超声结束后,4℃,4000g,离心40min。
[0080]
(2)ni柱树脂预先处理
[0081]
取出树脂,约300μl,4℃,1200rpm,离心1min,弃上清。继续加入1ml的wash buffer(预冷),4℃,1200rpm,离心1min,弃上清。重复使用washbuffer(预冷),洗两次。
[0082]
(3)清除蛋白质杂质
[0083]
将(1)中离心后的蛋白上清取出,与(2)处理过的树脂混合,放置于4℃翻转仪,翻转约1h后,4℃,1000rpm,离心1min,弃上清。加入10ml的wash buffer(预冷),继续使用翻转仪翻转5min后,4℃,1000rpm,离心1min,弃上清。重复使用wash buffer(预冷)清洗一次。
[0084]
(4)收集和脱盐浓缩蛋白质
[0085]
往蛋白质中加入1mlwash buffer(预冷),混匀。4℃,1000rpm,离心1min,弃上清。重复清洗2次。最后加入150μl elutionbuffer(预冷),轻轻混匀,放置冰上1h,期间不断混匀。4℃,6000rpm,离心1min,上清为纯化的蛋白。可以使用10mm的nacl进一步脱盐浓缩,选择50kd的超滤离心管离心脱盐。
[0086]
纯化的蛋白,取出少量,跑sds-page电泳胶检测,剩余加甘油混匀分装,-80℃保存。
[0087]
4、体外酶活反应
[0088]
pet28a-lmrha-ugt纯化蛋白bca测定浓度后,进行体外酶活实验,反应体系如下:
[0089]
表3-1体外酶活反应体系
[0090][0091]
反应条件为37℃,100rpm,孵育过夜,加入200μl甲醇终止反应,12000rpm离心
15min,取出上清,氮吹,挥干,加入100μl甲醇复溶,使用lc/ms检测分析。
[0092]
5、烟草瞬时表达验证实验
[0093]
5.1烟草瞬时表达载体的构建
[0094]
根据lmrha-ugt基因全长及连接载体phb的情况,设计特异性引物,添加合适的酶切位点(psti和saci),进行克隆扩增(引物见表1-5)。目的基因和质粒分别进行双酶切反应,连接,转化,最后质粒提取,具体的载体构建的步骤可参考上述原核载体构建步骤。最终获得重组质粒phb-lmrha-ugt。
[0095]
5.2转化gv3101农杆菌
[0096]
将得到的重组质粒phb-lmrha-ugt转化农杆菌gv3101,转化方法如下:
[0097]
(1)-80℃取出gv3101感受态,室温融化3-5min后,迅速放至冰上。
[0098]
(2)取1-2μl质粒加入感受态细胞菌体中,轻柔混匀,冰上放置30min。
[0099]
(3)液氮冷冻8min后,立即取出,放至37℃水浴中热激5min。
[0100]
(4)加入800μl不含抗生素的lb培养基,28℃,200rpm,震荡活化2h。
[0101]
(5)4000rpm,离心5min,去上清,留约200μl的菌液,重悬,涂布至含有卡那抗生素和利福平抗生素的平板上,28℃,培养2-3天,直到长出单菌落。挑取单菌落,小摇至浑浊,进行菌液pcr。取出少量菌液,提前99℃煮2min,以破除细胞壁,煮好的菌液为pcr模板。
[0102]
经过pcr验证阳性的菌液,保存于-80℃,或者蘸取菌液,划线,培养于含有卡那和利福平抗生素的平板上。
[0103]
5.3瞬时转化烟草
[0104]
(1)挑取农杆菌phb-lmrha-ugt平板上的单克隆,加入800μl含有卡那和利福平抗生素的lb液体培养基,28℃,200rpm,震荡培养2-3天,直到菌液变浑浊,接下来吸取200μl浑浊的菌液,至20ml含有卡那和利福平抗生素的lb液体培养基,28℃,200rpm,震荡培养约6h,直到od
600
值达到1.0左右。将农杆菌集中至50ml离心管,4000rpm,离心10min,弃去上清,加入mes缓冲液重悬,并且调整od
600
值为1.0左右(若od
600
值超过1.0,则稀释至od
600
值为1.0)。黑暗条件下,静置3h。
[0105]
(2)将配制好的caulosidea标准品(2.5mg/ml),加入到重悬的phb-lmrha-ugt农杆菌菌液中(浓度为10μl/ml),混合均匀。其中同样加入标准品的空白phb农杆菌菌液作为对照。
[0106]
(3)选择8株生长状况健壮良好的烟草叶子,分为两组,每组4株。使用不带针头的1ml注射器,将农杆菌菌液注射至烟草叶背面。
[0107]
(4)将注射好的烟草,室温放置于黑暗中,约24h后,取出,正常培养2-3天。剪出注射过的烟草叶片,放置37℃烘箱中烘干,至重量不再变化。
[0108]
(5)将烘干好的烟草叶片放置研钵中,使用液氮研磨成粉末,加入甲醇溶解,震荡提取3h,12000rpm离心15min,吸取上清,过滤膜,lc/ms检测分析。
[0109]
6、产物测定
[0110]
液相色谱分析:酶活反应的产物成分检测以及烟草瞬时表达产物成分测定均使用lc/ms联用方法,采用安捷伦1290超高效液相色谱系统,色谱柱为acquityuplc hss t3(1.8μm,2.1
×
100mm;waters,ireland);柱温箱温度为40℃;流动相:0.1%甲酸水(a)-纯乙腈(b)。
[0111]
流速为0.4ml/min;进样体积为4μl;后运行时间为4分钟。
[0112]
质谱分析条件:采用安捷伦四级杆-飞行时间质谱联用仪(agilent q/tof 6545a质谱仪),设置运行参数,采用负离子模式检测样品,设置参比离子为
[0113]
设置梯度洗脱条件为:
[0114]
time(min)a(%)b(%)0.0095.005.0023.005.0095.0025.005.0095.00
[0115]
三、实验结果
[0116]
1、lmrha-ugt的克隆
[0117]
将糖基转移酶lmrha-ugt进行克隆,该基因的序列长度大小约为1500bp。
[0118]
图1为扩增lmrha-ugt全长的琼脂糖凝胶电泳图,其中m为marker(2000bp),1为目的基因lmrha-ugt。
[0119]
2、pet28a-lmrha-ugt原核表达
[0120]
(1)sds-page凝胶电泳图
[0121]
将筛选出来的糖基转移酶lmrha-ugt构建到原核载体pet28a上,转化至大肠杆菌bl21(de3),iptg继续诱导阳性菌液。将未诱导的重组质粒pet28a-lmrha-ugt作为阴性对照,与诱导之后的纯化前后的重组蛋白pet28a-lmrha-ugt同时跑sds-page凝胶电泳。
[0122]
结果如图2所示。lmrha-ugt蛋白分子量为54.6kda,加上pet28a载体中含有his标签蛋白,重组蛋白的分子量约为60kda,与纯化后所得的蛋白分子量大小一致,表明重组蛋白成功诱导并纯化得到。
[0123]
(2)体外酶活实验的结果
[0124]
按照本章体外酶活实验体系,以cauloside a为底物,udp-rha为糖供体,加入重组蛋白pet28a-lmrha-ugt,37℃,低速震荡,过夜反应。阴性对照为平行条件下,加入诱导后的pet28a空蛋白。产物经过lc/ms分析检测,发现在保留时间为14.6min处,有一个明显的峰,该峰与与猜测的产物α-hederin的标准品峰一致。因此,我们猜测lmrha-ugt可能催化底物cauloside a加上鼠李糖,生成
ɑ-hederin。所以,我们进一步对该产物进行q-tof分析,
[0125]
发现,产物产生的主要碎片离子峰为749.45(m/z),这与标准品α-hederin保持一致。最后,我们确认lmrha-ugt的确有明显的催化活性,这为后续的皂苷合成途径挖掘产生重要影响。
[0126]
lmrha-ugt与底物cauloside a体外酶活反应的lc/ms检测结果图如图3所示。
[0127]
3、烟草瞬时表达实验结果
[0128]
phb空载农杆菌液组为阴性对照,与phb-lmrha-ugt组平行培育,收取烟草叶片,使用甲醇提取后,提取液进入lc/ms检测分析。结果如图4所示,在含有目的基因lmrha-ugt的烟草中可以检测到目标皂苷α-hederin的离子峰749.45(m/z),而在空载(不含目的基因)的烟草中检测不到。该实验结果在植物体内证明lmrha-ugt可能催化底物caulosidea加上鼠李糖,生成
ɑ-hederin。
[0129]
上述实施例的作用在于具体介绍本发明的实质性内容,但本领域技术人员应当知道,不应将本发明的保护范围局限于该具体实施例。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。