用于检测自身免疫系统疾病的抗shroom2自身抗体及其产品和应用
技术领域
1.本发明属于生物技术领域,具体涉及一种自身免疫系统疾病标志物抗shroom2自身抗体及其产品和应用。
背景技术:
2.神经系统自身免疫性疾病是以自身免疫细胞、免疫分子等攻击神经系统为主要致病机制的自身免疫性疾病,该类疾病可发生在中枢神经系统、周围神经系统及神经-肌肉接头处。常见的神经系统自身免疫性疾病包括:自身免疫性脑炎、中枢神经系统脱髓鞘疾病、僵人综合征、免疫介导性周围神经病、自身免疫性小脑共济失调、肌无力综合征等。在免疫反应中,作用于神经系统自身抗原的致病抗体统称为神经系统自身抗体。随着科学的发展,神经系统自身免疫性疾病谱和神经系统自身抗体谱不断完善和发展,检测患者体内自身抗体不仅能够帮助相关疾病确诊,还有助于检测疾病的进程,评价治疗效果。
3.shroom是一类细胞骨架结合蛋白。1999年,jeffrey d在小鼠中发现,shroom是正常神经生长所需的细胞结构的关键因素[jeffrey d.hildebrand and philippe soriano.shroom,a pdz domain
–
containing actin-binding protein,is required for neural tube morphogenesis in mice.cell,1999,99,485-497]。2005年,jeffrey d的研究结果是shroom在多种脊椎动物的神经管形态发生中是必不可少的,shroom通过调节神经上皮细胞的形态促进神经生长[jeffrey d.hildebrand.shroom regulates epithelial cell shape via the apical positioning of an actomyosin network.journal of cell science.2005,118,5191-5203]。
[0004]
shroom家族由4个成员组成,分别是shroom1、shroom2、shroom3和shroom4。shroom2是功能上进化保守的176kda的蛋白质,是shroom基因家族中的一员,其表达蛋白定位于细胞周边的肌动蛋白上,为一种紧密连接蛋白,具有调节细胞内骨架和上皮细胞结构的功能。shroom2是rhoa-rock通路的关键介质,该通路与肿瘤细胞的转移有关系,通过actin的重排和细胞黏着,rhoa-rock和shroom2调控癌细胞转移(jing yuan,lin chen,jingshu xiao.shroom2 inhibits tumor metastasis through rhoa
–
rock pathway-dependent and independent mechanisms in nasopharyngeal carcinoma.cell death and disease.2019,10:58)。
[0005]
shroom2是视网膜黑色素上皮细胞色素沉着的中心调节因子,编码人类shroom2的基因位于两种不同形式的眼白化病的关键区域,shroom2突变可能是这些人类视觉系统疾病的一个关键因素(pamela d.fairbank,chanjae lee,avegiyel ellis.shroom2(apxl)regulates melanosome biogenesis and localization in the retinal pigment epithelium.development 133.2006,4109-4118)。
[0006]
shroom2蛋白共1616个氨基酸,含有一个pdz结构域(aa26-108),2个asd序列(asd1,aa684-773;asd2,aa1317-1161)。该基因在神经细胞发育、细胞骨架形成、胃肠道发
育及相关肿瘤发病中均起到一定的作用。shroom2是高度保守的,使得即使是来自与人类关系较远的物种的shroom2也适合于引发与人抗shroom2抗体的特异性结合。在shroom2同系物中,在各自物种和人类之间保守的、长度在6至12个氨基酸的区域原则上已足以引发与抗shroom2抗体的特异性结合,构成构象表位的保守序列可能会更短。目前,尚未见shroom2自身抗体在检测神经系统自身免疫性疾病方面的相关报道。
技术实现要素:
[0007]
本发明的目的在于提供用于检测自身免疫系统疾病标志物的抗shroom2自身抗体及其产品和应用。
[0008]
为了达到上述目的,本发明采用以下技术方案予以实现:
[0009]
本发明公开了一种自身免疫性疾病标志物,所述自身免疫性疾病标志物为与shroom2蛋白结合的自身抗体,所述shroom2蛋白的氨基酸序列如seq id no:1、seq id no:2或seq id no:3所示。
[0010]
本发明还公开了用于受试者中自身免疫性疾病诊断的多肽或蛋白质,该多肽或蛋白质为包含衍生自shroom2蛋白的一个或多个表位,所述shroom2蛋白的氨基酸序列如seq id no:1、seq id no:2或seq id no:3所示。
[0011]
优选地,本发明使用的多肽或蛋白质包括或具有与shroom2蛋白或根据seq id no:1、seq id no:2或seq id no:3的序列具有至少70%、至少75%、至少80%、至少90%、至少92、至少94%、至少96%、至少98%或至少99%序列同一性的氨基酸序列。在其它实施方案中,本发明涉及具有根据seq id no:1、seq id no:2或seq id no:3的序列的至少20、25、30、40、50、60、70、80、90或100个连续氨基酸的shroom2蛋白或多肽的片段。在本发明进一步的实施方案中,本发明涉及与这样的片段的序列具有至少70%、至少75%、至少80%、至少90%、至少92%、至少94%、至少96%、至少98%或至少99%序列同一性的这样的片段的同系物。
[0012]
更进一步优选地,所述多肽或蛋白质可以是融合其他氨基酸的融合蛋白,所述氨基酸是连接在n端或c端的,具有促进所述多肽或蛋白质的纯化、固定化、沉淀或鉴定的作用。这种氨基酸可以构成本领域已知的标签,例如,his标签、硫氧还蛋白、麦芽糖结合蛋白、谷胱甘肽-s-转移酶、flag标签、myc标签或strep标签。
[0013]
根据本发明,“多肽”应理解为两个、三个、四个、五个、六个、七个、八个、十个或更多个氨基酸的聚合物。
[0014]
在本发明的范围内,“表位”是能够被抗体特异性识别的多肽的一部分。所述表位可以是构象表位(由多肽的不连续氨基酸序列组成)或线性表位(由多肽的连续氨基酸序列组成)。
[0015]
在本发明的范围内,对于表位,术语“衍生的”涉及由多肽或蛋白质的一级氨基酸序列的不连续或连续部分形成的表位。本领域已知的是,表位中的一个或更多个氨基酸可以被取代。因此,术语“衍生的”还涉及这样的表位:当与具有原始氨基酸序列的表位相比,尽管在氨基酸序列上具有差异,所述表位表现出不变的或基本上不变的抗体结合强度或特异性。
[0016]
本发明还公开了一种核酸,所述核酸编码权利要求3所述的用于受试者中自身免
疫性疾病的诊断的多肽或蛋白质,编码seq id no:1所示的多肽或蛋白质的核苷酸序列如seq id no:4所示,编码seq id no:2所示的多肽或蛋白质的核苷酸序列如seq id no:5所示,seq id no:3所示的多肽或蛋白质的核苷酸序列如seq id no:6所示。
[0017]
根据本发明,“核酸”涉及dna或rna序列。本领域已知的是,由于遗传密码的简并性,核酸编码的某些变化不会导致其所编码的肽序列的变化。因此,术语“核酸”还包含编码相同蛋白序列、与原始核酸序列在序列上存在不同的核酸序列,即该原始序列的突变序列。
[0018]
本发明公开了一种细胞,所述细胞含有能够表达上述的用于受试者中自身免疫性疾病诊断的多肽或蛋白质的载体。
[0019]
根据本发明,“细胞”是能够转入载体的任何原核或真核宿主细胞。例如,细胞可以是细菌细胞(如大肠杆菌细胞)或真核细胞(如永生化人细胞,昆虫细胞,酵母)。这样的细胞包括hek293细胞、hela细胞、cho、毕赤酵母、酿酒酵母、sf9、bl21、rosetta等。
[0020]
根据本发明,“载体”包括插入物(例如编码所需蛋白质的原始或突变核酸序列)和其它特征(启动子、多克隆位点、筛选标记、复制子等)的环状或线性核酸序列。这样的载体包括ptriex载体家族、pcdna3家族、pet系列、pbac系列等其他商品化的真核表达系统或原核表达系统的载体。
[0021]
本发明还公开了一种固定化检测试剂,将上述的多肽或蛋白质固定化于固态载体上获得。
[0022]
本发明范围内的“固定”指这样的分子,其与水溶液中不可溶的固态载体结合、更优选地借助共价键、静电相互作用、囊化或包埋或借助疏水相互作用,最优选地借助一个或多个共价键结合。例如载玻片、聚苯乙烯板、玻璃板、膜(尼龙膜、硝酸纤维素膜或pvdf膜)、磁珠、柱色谱介质、生物芯片、聚丙烯酰胺凝胶等。
[0023]
本发明还公开了上述的自身免疫性疾病标志物、多肽或蛋白质或固定化检测试剂在制备用于自身免疫性疾病诊断的检测试剂或检测试剂盒中的应用。
[0024]
优选地,检测时是检测样品与shroom2蛋白结合的自身抗体,所述样品为液体样品或组织样品,液体样品为脑脊液、血液、血浆、淋巴液或组织间液;组织样品为神经组织、肌肉组织或来自消化道的组织。
[0025]
优选地,所述自身免疫性疾病包括小脑变性、精神行为异常、认知障碍、视力障碍、记忆力下降、言语障碍、运动障碍、意识水平下降、自主神经功能障碍或听觉障碍。
[0026]
本发明还公开了一种自身免疫性疾病检测试剂盒,检测试剂盒中包括上述的自身免疫性疾病标志物、上述的多肽或蛋白质或上述的固定化检测试剂。
[0027]
根据本发明,自身免疫性疾病,指与抗shroom2抗体有关的小脑变性、精神行为异常、认知障碍、视力障碍、记忆力下降、言语障碍、运动障碍、意识水平下降、自主神经功能障碍,劳动能力丧失,这些症状大部分与神经疾病有关。
[0028]
与现有技术相比,本发明具有以下有益效果:
[0029]
本发明采用现有的检测方法进行血清抗shroom2蛋白自身抗体的检测,可以较准确地将自身免疫系统疾病患者和正常人鉴别开来。在此背景下提供此方便、快捷、有效的检测自身免疫系统疾病的标志物及该标志物在制备用于自身免疫系统疾病检测的试剂盒用途,本发明可用于临床的自身免疫系统疾病早期诊断。
[0030]
本发明提供了抗shroom2自身抗体的试剂在制备诊断神经系统症状相关疾病的试
剂盒中的应用。本发明所述应用制备得到的试剂盒能够实现shroom2自身抗体的检测,并且可以用来诊断神经系统疾病,尤其是与一种或多种症状相关的神经系统疾病,所述症状包括小脑变性、精神行为异常、认知障碍、视力障碍、记忆力下降、言语障碍、运动障碍、意识水平下降、自主神经功能障碍或听觉障碍。本发明所述应用制备得到的试剂盒还可以用来区分自身免疫疾病,尤其是区分神经系统的自身免疫疾病与非自身免疫疾病。
附图说明
[0031]
图1为血清在大鼠原代神经元上的免疫荧光法染色结果;其中,a为患者1血清染色;b为健康受试者血清染色;
[0032]
图2为患者1血清免疫沉淀结果;
[0033]
图3为患者1血清免疫沉淀物的wb鉴定结果;
[0034]
图4为鼠脑海马组织的免疫荧光染色;其中,a为患者1血清染色;b为健康受试者血清染色;
[0035]
图5为鼠脑皮层组织的免疫荧光染色;其中,a为患者1血清染色;b为健康受试者血清染色;
[0036]
图6为在鼠脑海马组织上患者1血清和shroom2抗体共定位染色;其中,a为患者1血清染色;b为shroom2抗体染色、c为血清和抗体的merge图;
[0037]
图7为在鼠脑皮层组织上患者1血清和shroom2抗体共定位染色;其中,a为患者1血清染色;b为shroom2抗体染色、c为血清和抗体的merge图;
[0038]
图8为血清中和实验验证患者1血清在鼠脑海马组织上的信号;其中,a为加pbst中和血清;b为加入shroom2蛋白中和血清;c为加入对照蛋白中和血清;
[0039]
图9为血清中和实验验证患者1血清在鼠脑皮层组织上的信号;其中,a为加pbst中和血清;b为加入shroom2蛋白中和血清;c为加入对照蛋白中和血清;
[0040]
图10为cba法检测样受试者样本中的自身抗体;其中,a为患者1血清染色;b为健康受试者血清染色;
[0041]
图11为患者1血清的cba法共染实验;其中,a为患者1血清染色;b为shroom2抗体染色;c为血清和抗体的merge图;
[0042]
图12为患者2血清的cba法共染实验;其中,a为患者2血清染色;b为shroom2抗体染色;c为血清和抗体的merge图。
具体实施方式
[0043]
为了使本技术领域的人员更好地理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
[0044]
需要说明的是,本发明的说明书和权利要求书中涉及的术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列步骤或单元的过程、方法、系统、产品或设备不必限于清楚地列出的那些步骤或单元,而是可包括没有清楚地列出
的或对于这些过程、方法、产品或设备固有的其它步骤或单元。
[0045]
下面结合附图对本发明做进一步详细描述:
[0046]
实施例中的受试者信息
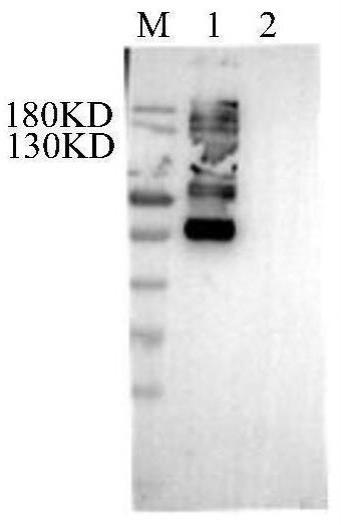
[0047]
患者1和患者2的血清为医院赠予,对患者的血清进行探索性研究,已征求过患者的同意。健康受试者血清来自于医院体检中心赠送的健康体检者血清,已经体检者本人同意。
[0048]
患者1:48岁,女性,一个月前出现视力模糊,行走不稳,向前或者向后倾倒以至于不能进行劳动,与人不能进行正常的沟通交流,来医院就诊,常规生化分析检测及ct正常,医生怀疑患有自身免疫性疾病,送检医院检验科检测脑炎相关项目的自身抗体(包括nmdar、ampar1、ampar2、lgi1、caspr2、gababr、dppx、iglon5、glyr、gabaarα1、gabaarγ2、gabaarβ3、mglur5、d2r、neurexin3α),结果均为阴性。因自身原因回家休息,一周后,再次入院,此时,医生怀疑其可能为其他自身抗体阳性,又将其样本送往检验科检测,经检测,该样本副肿瘤14项(包括ri、hu、yo、cv2、ma2、amphiphysin、titin、ma1、sox1、tr、zic4、pkcγ、recoverin、gad65)阴性,中枢脱髓鞘病变6项(aqp4、mbp、mog、gfap、aqp1、flotillin1/2)阴性,自免性脑炎15项(包括nmdar、ampar1、ampar2、lgi1、caspr2、gababr、dppx、iglon5、glyr、gabaarα1、gabaarγ2、gabaarβ3、mglur5、d2r、neurexin3α)阴性,外周神经病12项(gm1,gd1b,gq1b、sulfatides、gt1b、gt1a、gd3、gd2、gd1a、gm4、gm3、gm2)阴性。
[0049]
患者2:65岁,有高血压高血脂病史,3周前出现视力模糊,精神稍有异常,记忆不佳,对周围的人和事只有短暂的记忆,说话时吐字不清,行动较既往迟缓。遂入院检查,常规化验结果无明显异常,医生将其样本送往检验科,经检测,该样本副肿瘤14项(包括ri、hu、yo、cv2、ma2、amphiphysin、titin、ma1、sox1、tr、zic4、pkcγ、recoverin、gad65)阴性,中枢脱髓鞘病变6项(aqp4、mbp、mog、gfap、aqp1、flotillin1/2)阴性,自免性脑炎15项(包括nmdar、ampar1、ampar2、lgi1、caspr2、gababr、dppx、iglon5、glyr、gabaarα1、gabaarγ2、gabaarβ3、mglur5、d2r、neurexin3α)阴性,外周神经病12项(gm1,gd1b,gq1b、sulfatides、gt1b、gt1a、gd3、gd2、gd1a、gm4、gm3、gm2)阴性。
[0050]
实施例1:大鼠原代神经元细胞的免疫荧光法
[0051]
步骤1大鼠原代神经元细胞分离
[0052]
1、10%水合氯醛麻醉孕鼠,75%酒精浸泡消毒3min,生物安全柜取出胎鼠;
[0053]
2、用预冷的hbss(137mm nacl,5.4mm kcl,0.6mm mgso4·
7h2o,0.5mm mgcl2·
6h2o,0.3mm na2hpo4·
2h2o,0.4mm kh2po
4,
5.6mm grucose,4.2mm nahco3,ph7.2~7.4)冲洗胎鼠两次,在预冷的hbss中解剖出胎脑浸泡在预冷的dmem中;
[0054]
3、弃dmem,用眼科剪将组织块剪成1m3大小的糜状混合物。加入木瓜蛋白酶(浓度为2mg/ml)。在10cm皿中37℃消化处理30分钟,每5min轻轻摇晃一次。一般10至15个大脑组织用消化液20ml;
[0055]
4、消化结束后,将细胞移到50ml离心管,加入20ml dmem重悬,1ml枪头吹打10次,400g,4℃离心5min,
[0056]
5、弃上清液,加入20ml dmem重悬,1ml枪头吹打10次,4℃,400g离心5min,该步骤重复1次;
[0057]
6、弃上清液,加入20ml neurobasal培养基重悬细胞。
[0058]
步骤2、梯度密度法分离纯化神经元细胞
[0059]
本实验所采用密度介质的密度为试剂1(1.32g/ml的optiprep)(为percoll的优化产品)
[0060]
1、取细胞混合原液2ml,并用试剂2(neurobasal b27 l-glutamine)的全培养基稀释至6ml;
[0061]
2、将试剂1和试剂2按照如下表1分别混合,配制介质,并按照1-2-3-4的顺序依次加入到15ml离心管底部;
[0062]
表1
[0063][0064]
3、将样本加入到介质顶层;
[0065]
4、800g,22℃,15min离心分离;
[0066]
5、依次去除上层6ml细胞碎片部分和1ml神经元细胞和少突胶质细胞混合细胞;
[0067]
6、从离心管上层取体积大约为2.5ml的神经元细胞悬液,作为后续实验材料;
[0068]
7、取出神经元细胞后,用5ml的neurobasal b27 l-glutamine的全培养基进行稀释;
[0069]
8、200g,22℃,2min离心,去除上清;
[0070]
9、使用全培养基洗涤一次;
[0071]
10、加入5ml neurobasal b27 l-glutamine的全培养基重悬;
[0072]
11、血球计数板计数后按每孔60000细胞接种至48孔板中。
[0073]
步骤3、对分离好的神经元进行免疫荧光染色,具体操作包括如下步骤:
[0074]
1、将步骤2长有神经元细胞的48孔板从培养箱中拿出,弃上清,1
×
hepes洗2次;
[0075]
2、使用0.4%的多聚甲醛固定10min,弃上清,1
×
hepes洗2次;
[0076]
3、使用1.25m甘氨酸浸泡10min,弃上清,1
×
hepes洗2次;
[0077]
4、血清孵育:将患者1的血清使用pbs按照1:10的比例进行稀释,并将稀释好的样本加至含有神经元细胞的孔中,室温孵育60min,弃上清,1
×
hepes洗3次;
[0078]
5、二抗孵育:使用fitc标记的二抗室温孵育40min,弃上清,1
×
hepes洗3次;
[0079]
6、拍照:荧光显微镜下进行拍照。
[0080]
实验结果:
[0081]
由图1可以看出,患者1血清中存在与大鼠原代神经元结合的抗体,而健康受试者的血清未检出与神经元结合的抗体。
[0082]
实施例2:shroom2的免疫沉淀
[0083]
1、取6皿大鼠原代神经元细胞,弃上清,pbs洗2遍,0.4%多聚甲醛固定10min,1
×
hepes洗3次;
[0084]
2、血清孵育:取10ul患者1血清加至10ml dmem中(1:1000稀释),使用0.22um滤膜过滤后加入到固定好的细胞中,室温孵育2h;
[0085]
3、取15ul珠子加入到2ml管子中,平衡液洗3遍,用300ul 4%bsa封闭2h;
[0086]
4、将孵育好的细胞置于冰上,弃上清,pbs洗2遍,加入500ul裂解液(150mm nacl,1mm edta,100mm tris-hcl,0.5%脱氧胆酸钠,1%tritonx-100,0.1%sds,ph7.5),收集细胞,加入终浓度为1
×
的蛋白酶抑制剂,裂解30min,间隔震荡,15000rpm离心30min,取上清,测浓度;
[0087]
5、将步骤4收集的上清加入到步骤3处理好的珠子中,4℃过夜旋转孵育;
[0088]
6、用裂解液将所有孵育的珠子洗4次,用80ul 2*loading buffer洗脱;
[0089]
7、样本处理:洗脱液中先加入5
×
sds-page loading buffer,再加入终浓度为0.01m的dtt,100℃加热10min,然后再加入终浓度为2%的碘乙酰胺,室温放置30min;
[0090]
8、电泳:处理好的样品跑胶,使用银染试剂盒进行染色,分析结果(银染试剂盒购自于thermo)。
[0091]
实验结果:
[0092]
参见图2,在用患者1血清获得的来自大鼠神经元的免疫沉淀物中检出一种大约160~180kd的蛋白质(图2泳道2),该蛋白质不存在于类似制备的对照中(图2泳道1)。
[0093]
实施例3:免疫印迹
[0094]
1、电泳:取实施例2步骤7得到的样品进行sds-page;
[0095]
2、转膜:电泳完成后,使用湿法转膜,转膜条件为200ma,90min;
[0096]
3、封闭:使用5%的脱脂奶粉室温封闭1h;
[0097]
4、一抗孵育:按照1:2000的比例孵育抗shroom2的多克隆抗体(抗体购自于sigma公司),室温孵育2h;
[0098]
5、洗涤:tbst洗3次,每次5min;
[0099]
6、二抗孵育:加入hrp标记的二抗,室温孵育1h
[0100]
7、洗涤:tbst洗3次,每次5min;
[0101]
8、显色:加入化学发光液,记录结果。
[0102]
实验结果:
[0103]
使用抗shroom2的多克隆抗体对用患者1血清所收到的,但用对照血清未收到的免疫沉淀物进行蛋白质印记分析,结果由图3可以看出,用患者1血清捕获到的免疫沉淀物中存在与shroom2抗体反应的条带,目的蛋白带处于130kd~180kd之间(目前尚不清楚wb结果上其他条带是shroom2的降解物还是杂信号),而健康受试者的免疫沉淀物中无条带出现,证明该患者体内存在与神经元蛋白反应的抗体。
[0104]
实施例4:大鼠脑组织的免疫组化、血清和抗体共染以及血清中和实验验证组织上的信号
[0105]
步骤1取组织,切片
[0106]
1、选成年大鼠,麻醉,待老鼠四肢硬化,打开腹腔,暴露出心尖,从左心尖灌注pbs,以便全身循环;
[0107]
2、取出脑组织;
[0108]
3、甲醇固定10~30min;
[0109]
4、脱水:将样本移入30%蔗糖溶液中,4℃放置至组织块沉底;
[0110]
5、将少量包埋剂oct滴加到标本台,置入-20℃冷冻切片机的冷冻台。待组织略微发白时用oct在标本表面涂一薄层,继续冷冻20min,切片。
[0111]
步骤2大鼠脑组织免疫组化片子的染色
[0112]
1、一抗孵育:取步骤1得到的鼠脑组织片,按照1:100的比例稀释患者1血清,室温孵育1h;
[0113]
2、洗涤:pbst洗3次,每次5min;
[0114]
3、二抗孵育:加入fitc标记的二抗,室温孵育1h;
[0115]
4、洗涤:pbst洗3次,每次5min;
[0116]
5、显微镜下观察结果拍照。
[0117]
步骤3血清和抗体共染验证组织上的信号
[0118]
1、取步骤2经患者1血清染色的组织片,加入shroom2抗体(1:20稀释),室温孵育1h;
[0119]
2、洗涤:pbst洗3次,每次5min;
[0120]
3、二抗孵育:加入alexa fluor 594标记的二抗,室温孵育1h;
[0121]
4、洗涤:pbst洗3次,每次5min;
[0122]
5、显微镜下观察结果拍照。
[0123]
步骤4血清中和实验验证患者1血清在鼠脑组织上染出的信号
[0124]
1、中和蛋白的制备:收集过表达shroom2蛋白的hek293细胞(过表达细胞的制备见实施例6)1皿(10cm皿),加入200ul pbs,超声破碎(破碎条件为:15%功率,破3s,停6s,共超声3次);对照细胞为转入空载pcdna3.1的hek293细胞,对照蛋白的制备条件与shroom2中和蛋白的制备条件相同;
[0125]
2、中和实验:
[0126]
(1)用pbst将患者血清按照1:100的比例稀释,稀释好的血清中分别加入20ul shroom2中和蛋白及对照蛋白,正常组加入20ul pbst,室温孵育10min;
[0127]
(2)一抗孵育:将上述孵育好的样本分别加至鼠脑组织爬片上,室温孵育1h;
[0128]
(3)洗涤:pbst洗3次,每次5min;
[0129]
(4)二抗孵育:加入fitc标记的二抗,室温孵育1h;
[0130]
(5)洗涤:pbst洗3次,每次5min;
[0131]
(6)显微镜下观察结果拍照。
[0132]
实验结果:
[0133]
(1)鼠脑组织免疫荧光染色
[0134]
结果从图4中可以看出,与健康受试者血清染色结果相比,患者1血清在鼠脑海马组织上有明显的点状信号。进一步的实验表明,该信号可与神经元marker neun(proteintech,货号26975)的抗体共定位。
[0135]
结果从图5中可以看出,与健康受试者血清染色结果相比,患者1血清在鼠脑皮层组织上有明显的点状信号。进一步的实验表明,该信号可与神经元marker neun(proteintech,货号26975)的抗体共定位。
[0136]
(2)患者1血清与shroom2抗体在鼠脑组织上的共染
[0137]
从图6中可以看出,用shroom2抗体对经患者1血清染色的组织片进行染色(鼠脑海马组织),结果显示血清的染色和抗体的染色可共定位。
[0138]
从图7中可以看出,用shroom2抗体对经患者1血清染色的组织片进行染色(鼠脑皮层组织),结果显示血清的染色和抗体的染色可共定位。
[0139]
(3)血清中和实验验证鼠脑组织上的信号
[0140]
用过表达shroom2的hek239裂解物及对照裂解物(转入空载pcdna3.1的hek239)进行血清中和实验验证鼠脑海马组织染出的信号,结果由图8可以看出,shroom2中和蛋白明显的封闭了患者1血清在鼠脑海马组织上出现的点状信号,而对照蛋白未封闭住组织上出现的信号,表明该点状信号为鼠脑组织上表达的抗shroom2抗原的特异性信号。
[0141]
用过表达shroom2的hek239裂解物及对照裂解物(转入空载pcdna3.1的hek239)进行血清中和实验验证鼠脑皮层组织染出的信号,结果由图9可以看出,shroom2中和蛋白明显的封闭了患者1血清在鼠脑组织皮层上出现的点状信号,而对照蛋白未封闭住组织上出现的信号,表明该点状信号为鼠脑皮层上表达的抗shroom2抗原的特异性信号。
[0142]
结论:与健康受试者血清相比,患者1血清中存在抗shroom2的自身抗体,且该自身抗体可识别鼠脑组织中的神经元上表达的shroom2蛋白。
[0143]
实施例5质谱法
[0144]
从实施例2sds-page胶上切下蛋白条带送去拜谱生物进行质谱法分析。
[0145]
结果:靶抗原与患者1的血清首先进行免疫沉淀,然后通过sds-page电泳分离蛋白质,再进行凝胶银染(见图2)。从银染胶上切下正常血清无而患者血清有的条带,进行质谱分析。根据肽段鉴定表及肽段解读表所述,所鉴定的蛋白质序列中包括shroom2序列,质谱所鉴定的结果是可信的。
[0146]
实施例6基于hek293细胞的免疫荧光法检测患者血清中抗shroom2自身抗体及血清和抗体共染验证免疫荧光法检出的信号
[0147]
步骤1、重组载体的构建
[0148]
通过pcr或人工合成的方法,将shroom2基因通过分子克隆方法连至pcdna3.1上,得到重组载体pcdna3.1-shroom2,构建好的重组载体经测序正确后大提备用;
[0149]
步骤2、细胞转染
[0150]
(1)293t细胞培养:dmem高糖培养基与fbs按9:1比例配制成10%fbs-dmem高糖培养基,待细胞铺满时按1:5~1:6传代,置37℃,5%co2的细胞培养箱中过夜培养;
[0151]
(2)待细胞密度为30%~40%时,将pcdna3.1-shroom2转入细胞中:
[0152]
步骤3、爬片固定
[0153]
(1)洗涤:将生长48h的细胞用pbs洗涤2次,
[0154]
(2)固定:加入丙酮固定5min;
[0155]
(3)洗涤:丙酮固定后的爬片用pbs洗涤2次,干燥后备用。
[0156]
步骤4、免疫荧光染色
[0157]
(1)使用pbst分别将患者1、患者2的血清稀释10倍,加至步骤3获得的细胞爬片,室温孵育1h;
[0158]
(2)洗涤:pbst洗3次,每次5min;
[0159]
(3)二抗孵育:加入fitc标记的二抗,室温孵育1h;
[0160]
(4)洗涤:pbst洗3次,每次5min;
[0161]
(5)显微镜下观察结果拍照。
[0162]
步骤5、血清和抗体共染验证过表达细胞上的信号
[0163]
取步骤4经患者血清染色的细胞爬片进行抗体共染实验,具体实验步骤同实施例4步骤3。
[0164]
结果从图10中可以看出,与健康受试者血清染色结果相比,患者1血清在表达shroom2抗原的细胞爬片上有明显的信号。
[0165]
参见如图11表达shroom2的hek293细胞用患者1的血清(a)和抗shroom2的鼠的多克隆抗体(b)进行染色,merge后的结果(c),结果显示血清的染色和抗体的染色可共定位。
[0166]
图12表达shroom2的hek293细胞用患者2的血清(a)和抗shroom2的鼠的多克隆抗体(b)进行染色,merge后的结果(c),结果显示血清的染色和抗体的染色可共定位。
[0167]
结论:与健康受试者血清相比,患者1血清中存在抗shroom2的自身抗体,且该自身抗体可识别过表达shroom2蛋白的细胞。表达shroom2蛋白的细胞可用来区分本发明所述症状的患者及健康受试者。
[0168]
实施例7基于细胞的免疫荧光法验证抗shroom2自身抗体的特异性
[0169]
1、取实施例6已经干燥好的过表达shroom2自身抗体的细胞爬片,备用;
[0170]
2、选取具有各种神经自身抗体(抗hu、yo、cv2、ma2、amphiphysin、ma1、sox1、nmdar、ampar1、ampar2、lgi1、caspr2、gababr、dppx、iglon5)的30位患者和40位健康对照的血清,进行免疫荧光染色,具体步骤如下:(1)一抗孵育:按照1:100的比例孵育患者血清,室温孵育1h;(2)洗涤:pbst洗3次,每次5min;(3)二抗孵育:加入fitc标记的二抗,室温孵育40mi;(3)洗涤:pbst洗3次,每次5min;(4);显微镜下观察结果。
[0171]
3、拍照:在表达shroom2的hek293细胞上,上述70例血清均不产生与患者血清相似的细胞形态。
[0172]
实施例7结论:患有本发明描述的神经系统疾病的患者具有针对shroom2蛋白的自身抗体,而另一些患有神经系统疾病的患者和健康受试者样本没有这种抗体。本发明为实现神经系统疾病的诊断提供了待测的与自身抗体结合的新抗原。
[0173]
实施例8抗shroom2自身抗体在患有本发明描述症状的患者中的检出情况
[0174]
1、取实施例6步骤3已经干燥好的过表达shroom2的细胞爬片,备用;
[0175]
2、选取158例具有小脑变性、精神行为异常、认知障碍、视力障碍、记忆力下降、言语障碍、运动障碍、意识水平下降、自主神经功能障碍或听觉障碍等症状中其中一种或多种症状的患者(hu、yo、cv2、ma2、amphiphysin、ma1、sox1、nmdar、ampar1、ampar2、lgi1、caspr2、gababr、dppx、iglon5、d2r、neurexin3、kcna4、gabaarγ2、atp1a3、homer3、arhgap26、itpr1/2、mglur1、carp viii、ap3b2、septin5、gm1,gd1b,gq1b、sulfatides、gt1b、gt1a、gd3、gd2、gd1a、gm4、gm3、gm2自身抗体检测为阴性的患者),使用实施例6获得的细胞爬片进行免疫荧光检测;
[0176]
3、结果:在158例疑似患有神经系统症状的患者中检出3例抗shroom2自身抗体阳性。
[0177]
实施例8结论:抗shroom2自身抗体可在患有神经系统症状的患者中检出,说明该
抗体对神经系统自身免疫疾病的诊断具有辅助作用。
[0178]
以上内容仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明权利要求书的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
