细胞培养方法
1.相关申请的引用
2.本技术要求提交于2019年8月14日的美国临时申请62/886,683的优先权,其全部内容通过引用并入本文。
3.关于联邦资助的研究和开发的声明
4.本发明是在美国国家科学基金会授予的1624718号政府支持下完成的。政府在本发明中具有某些权利。
技术领域
5.本公开涉及细胞培养方法、在哺乳动物细胞中生产蛋白质诸如单克隆抗体、新生物标志物以及使用这些新生物标志物来控制蛋白质生产的方法。
背景技术:
6.哺乳动物细胞诸如中国仓鼠卵巢(cho)细胞系用作在生物制药工业中生产治疗性抗体的宿主。例如,在抗体生产过程中,cho细胞表现出低效和不良调节的代谢,因为它们易于使用许多可用的营养物来产生废代谢产物,而不是其生长所需的量。在生物过程的后期阶段,细胞停止生长并停止产生抗体,即使营养水平足以支持生长和蛋白质生产。在该过程中积累的代谢物是细胞增殖和抗体生产中的主要限速原因之一。为了控制cho细胞的代谢并且增加其产率,识别抑制性废代谢物并且研究其途径是至关重要的。
7.所需的是识别抑制性代谢物和控制策略开发。
技术实现要素:
8.在一个方面,细胞培养方法包括(i)在细胞培养基中培养细胞,以及(ii)将选自乌头酸(aconitic acid,aa)、闪白酸(2-羟基异己酸,leucinic acid,hica)、胞苷单磷酸(cmp)、甲基琥珀酸(msa)、葫芦巴碱(tri)和n-乙酰基腐胺鎓(n-acetylputrescinium,nap)的至少一种代谢物维持在低于该细胞培养基中该至少一种代谢物的抑制浓度。
附图说明
9.图1示出了作为分批培养物中细胞积累的积分活细胞密度。混合物条件排除ica并且包括aa、hica、cmp、msa、tri和nap。
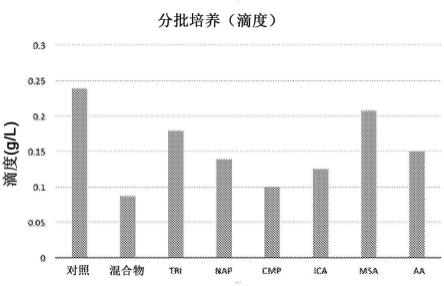
10.图2示出了受抑制性代谢物抑制的抗体产生。产率(产量,productivity)显示为g/l。混合物条件与图1中的相同。
11.图3示出了补料分批掺加(spiking)测试的活细胞密度图。
12.图4示出了hica、cmp、ica和tri(与对照相比30-40%滴度下降)显示更强的产率抑制。这些值是通过hplc以一式三份的标准曲线测量的收获(第14天)滴度值。
13.图5示出了产品质量对g1f的影响,g1f是在igg抗体药物上发现的聚糖谱物质中的一种,表明糖基化水平。与对照组(第9柱)相比,aa、hica、cmp、msa和ica对g1f形成具有更大
的影响。
14.图6示出了产品质量对g2f的影响,g2f是在igg抗体药物上发现的聚糖谱物质中的一种,表明糖基化水平。与对照组(第9柱)相比,aa完全抑制g2f形成,并且所有其他6种抑制剂对g2f形成具有显著影响。
15.图7示出了第14天对照培养物的液相色谱图。在生物过程中观察到g0f、g1f和g2f聚糖谱物质。
16.图8示出了第14天aa掺加培养物的液相色谱图。仅观察到g0f和g1f峰,在生物过程中未形成g2f。
17.图9示出了第14天aa掺加培养物的液相色谱图。
18.图10示出了nap控制策略的实施例。这是cho细胞中的n-乙酰基腐胺鎓(nap)代谢途径。控制策略1:降低培养基(介质,media)中脯氨酸和精氨酸的浓度,这将导致nap的产生减少。在目前的cho细胞生物过程中,过度补料(过高的营养物)是非常常见的,这将影响生物制造的生产和质量。控制策略2:诸如通过引入sirna来降低酶(sat1/2)表达水平。随着酶表达的降低,nap积累速率将减慢。另外,或作为替代方案,上调maob(单胺氧化酶)表达水平以将nap转移到下游的tca循环,这可以为细胞生长和产生蛋白质提供能量。控制策略3:上调maob活性以将nap转移到下游tca循环,这可以为细胞生长和产生蛋白质提供能量。
19.图11示出了在上调用于产生抑制性代谢物的调节酶之后的细胞生长谱。对照指示不转染任何基因的cho k1分批细胞培养对照条件。t1指示具有转染到cho k1细胞系中的got1的细胞生长谱。t2指示got1和hoga1转染。t3指示got1、hoga1、cat和slc35a1转染。在转染后观察到峰值细胞密度的显著增加,而与对照相比,在t2和t3中峰值细胞密度增加50.9%。
20.根据以下详细描述、附图以及所附权利要求书,本领域的技术人员将理解上述和其他特征。
具体实施方式
21.中国仓鼠卵巢(cho)细胞仍然作为单克隆抗体(mab)产生的主力。为了实现高抗体产率,在高细胞密度条件(》1千万个细胞/ml)下进行制备过程。然而,由于高浓度的所分泌的抑制性代谢物,同时细胞密度达到最高记录值,因而生产力达到瓶颈。这些抑制性代谢物的积累损害细胞生长并且总体产物质量还会产生风险,因为已显示废副产物(诸如氨)的积累改变了重组蛋白的关键产物属性。除常见抑制剂之外,在本研究中,使用lc-ms通过代谢组学识别和表征了新的代谢生物标志物。废抑制剂代谢组学的工作流程是候选物识别、抑制影响验证和定量以及控制策略开发。
22.cho细胞和其他哺乳动物细胞中蛋白质生产的新生物标志物是乌头酸(aa),或更具体地乌头酸(aa)、闪白酸(hica)、胞苷单磷酸(cmp)、甲基琥珀酸(msa)、葫芦巴碱(tri)和n-乙酰基腐胺鎓(nap)。先前已经识别的鸟苷单磷酸(gmp)和吲哚-3-羧酸(ica)也在本文的研究中识别并且可以与本文新描述的生物标志物组合。
23.本文描述了细胞培养方法,其中在细胞培养基中将选自乌头酸(aa)、闪白酸(hica)、胞苷单磷酸(cmp)、甲基琥珀酸(msa)、葫芦巴碱(tri)和n-乙酰基腐胺鎓(nap)的至少一种代谢物的浓度维持在低水平。在细胞培养物中,并且特别是在高密度细胞培养物中,
诸如旨在生产大量感兴趣的重组蛋白的补料分批和/或灌注生物加工,可以通过代谢物诸如aa、hica、cmp、msa、tri和/或nap的积累来抑制细胞生长。这些代谢物的抑制作用可通过将它们在细胞培养基中的浓度维持在低于它们抑制细胞生长、重组蛋白产率和产品质量的水平来限制。产品质量包括但不限于糖基化模式、电荷变体、聚集和片段化,所有这些都可以通过本文描述的方法来控制。
24.在一个方面,细胞培养方法包括(i)在细胞培养基中培养细胞以开始细胞培养过程,以及(ii)将选自aa、hica、cmp、msa、tri和nap的至少一种代谢物维持在低于该细胞培养基中的该至少一种代谢物的抑制浓度。在一方面,这些细胞是哺乳动物细胞。
25.示例性cho细胞系包括chok1、cho gs和dg44。其他哺乳动物细胞系包括用于产生人类治疗产品的细胞系,诸如hek 293细胞、ht-1080细胞、工程t细胞以及工程自然杀伤细胞。
26.代谢物的抑制量可以在1nm至50mm,更具体地100nm至10mm的范围内。
27.当代谢物是aa时,抑制浓度可以低于100μm、440μm、880μm、3mm、5mm或10mm。
28.当代谢物是hica时,抑制浓度可以低于10μm、23.5μm、47μm、100μm、1mm或3mm。
29.当代谢物是cmp时,抑制浓度可以低于5μm、10μm、20μm、100μm、500μm或1mm。
30.当代谢物是msa时,抑制浓度可以低于1μm、3.75μm、7.5μm、100μm、1mm或3mm。
31.当代谢物是tri时,抑制浓度可以低于0.1μm、0.35μm、0.7μm、100μm、1mm或3mm。
32.当代谢物是nap时,抑制浓度可以低于0.1μm、0.3μm、0.6μm、100μm、1mm或3mm。
33.在一个方面,该方法包括测量至少一种代谢物的浓度。代谢物的浓度可以通过分析技术人员已知的任何方法测量。
34.可以在细胞培养期间测量代谢物的浓度一次或若干次。在一些方面,连续地、间歇地、每30分钟、每小时、每两小时、每天两次、每天或每两天测量代谢物浓度。在优选的方面,每天测量代谢物的浓度。
35.浓度可以在非自动集成(整合,integrated)到细胞培养方法中的方法中测量。例如,可以采用其中从细胞培养基中手动取出样品从而可以在样品中测量具体浓度的测量方法。可替代地,确定代谢物的浓度可以自动集成至细胞培养方法。
36.用于测量代谢物的浓度的示例性方法包括核磁共振(nmr)光谱、拉曼光谱、高/超高效液相色谱(h/uplc)、液相色谱质谱仪(lc-ms)、气相色谱质谱仪(gc-ms)技术或其组合。例如,在gc-ms中,该实验可以用自动取样器进行,该自动取样器从反应器中抽取样品并且以程序化方式将它们转移到该设备中。在未示出的数据中,aa、hica、cmp、msa、tri和nap的识别是使用一种或多种前述方法的组合来确认的。
37.在一个方面,当一种或多种代谢物的测量浓度高于预定值(诸如抑制浓度)时,采用控制策略来限制抑制代谢物的浓度。在控制策略1中,通过降低提供给细胞的前体的量,降低细胞培养基中至少一种代谢物的前体(例如,氨基酸、葡萄糖)的浓度。限制代谢物的前体将减缓抑制性代谢物的积累。该方法也可以称为培养基控制(介质控制,media control)。该预定义值被选定为使得该前体浓度的降低会防止该一种或多种代谢物的浓度上升到高于该抑制浓度。
38.当代谢物是aa时,前体是谷氨酰胺、葡萄糖、精氨酸和/或天冬酰胺。
39.当代谢物是hica时,前体是亮氨酸和/或异亮氨酸。
40.当代谢物是cmp时,前体是谷氨酰胺、精氨酸和/或天冬氨酸。
41.当代谢物是msa时,前体是赖氨酸、异亮氨酸、丝氨酸、葡萄糖和/或谷氨酰胺。
42.当代谢物是tri时,前体是天冬氨酸、色氨酸和/或谷氨酰胺。
43.当代谢物是nap时,前体是精氨酸、脯氨酸、天冬氨酸、谷氨酰胺和/或天冬酰胺。
44.在该方法中还可以降低前述前体的组合。
45.降低抑制性代谢物的前体的浓度可以降低抑制剂浓度以优化工艺。
46.可以通过降低提供给细胞的前体的量来降低细胞培养基中前体的浓度,例如通过降低补料培养基中前体的浓度、降低补料速率、降低补料的数量或体积、或它们的组合。例如,补料培养基可以由包含较低浓度的前体的补料培养基替换。
47.前体的浓度可以在0.01g/l至2g/l的范围内。更具体地:
48.当前体是精氨酸时,浓度可以低于0.2g/l、0.3g/l、0.4g/l、0.5g/l或0.6g/l。
49.当前体是天冬酰胺时,浓度可以低于0.1g/l、0.3g/l、0.5g/l、0.7g/l或0.9g/l。
50.当前体是天冬氨酸时,浓度可以低于0.1g/l、0.3g/l、0.5g/l、0.7g/l或0.9g/l。
51.当前体是谷氨酰胺时,浓度可以低于0.1g/l、0.6g/l、0.9g/l、1.2g/l或1.5g/l。
52.当前体是异亮氨酸时,浓度可以低于0.05g/l、0.15g/l、0.25g/l、0.35g/l或0.45g/l。
53.当前体是亮氨酸时,浓度可以低于0.1g/l、0.2g/l、0.3g/l、0.4g/l或0.5g/l。
54.当前体是赖氨酸时,浓度可以低于0.1g/l、0.2g/l、0.3g/l、0.4g/l或0.5g/l。
55.当前体是脯氨酸时,浓度可以低于0.05g/l、0.15g/l、0.25g/l、0.35g/l或0.45g/l。
56.当前体是丝氨酸时,浓度可以低于0.05g/l、0.15g/l、0.25g/l、0.35g/l、或0.45g/l。
57.当前体是色氨酸时,浓度可以低于0.01g/l、0.03g/l、0.07g/l、0.1g/l、或0.15g/l。
58.可应用实验的设计,诸如plackett-burman design或response surface methodology(rsm),以从上述浓度范围找到最佳前体浓度,以使抑制性代谢物积累最小化。
59.例如,降低葡萄糖的量可以包括通过使用可替代的碳源(包括但不限于果糖和半乳糖)、使用具有降低的糖酵解酶(包括但不限于己糖转运蛋白或乳酸脱氢酶)蛋白水平的细胞系、采用具有抑制的乳酸脱氢酶和丙酮酸脱氢酶激酶两者的细胞蛋白水平的细胞系、或采用具有丙酮酸羧化酶过表达的细胞系、或通过使用用于调节能量代谢途径(糖酵解、tca循环和氧化还原途径)的活性的信号传导途径(诸如akt、mtor、hif1a)的抑制剂(小分子或基于蛋白的),在低葡萄糖浓度下培养细胞。
60.在控制策略2a和b和3中,操纵上游和下游酶表达(策略2)或活性(策略3)以减少抑制性代谢物的合成。控制策略2和3背后的一般思想是下调上游酶从而使细胞将产生较少的抑制性代谢物,和/或上调下游酶从而使细胞将消耗代谢物以产生能量。图10显示了针对nap示出的三种控制策略。
61.在控制策略2a中,可以使用抑制性核酸(诸如sirna)调节控制代谢物的水平的上游和/或下游酶表达。术语“抑制性核酸”意指能够减少或抑制靶基因或序列的表达的单链或双链rna或dna,特别是rna,诸如三链体寡核苷酸、核酶、适体、小干扰rna(包括sirna(短
干扰rna))和shrna(短发夹rna))、反义rna或其部分、或它们的类似物或模拟物。例如,抑制性核酸可以通过介导降解或抑制与干扰rna序列互补的mrna的翻译来发挥作用。当给予哺乳动物细胞时,抑制性核酸导致靶序列的表达(例如,转录或翻译)降低(例如,减少5%、10%、25%、50%、75%或甚至90-100%)。典型地,核酸抑制剂包括或对应于靶核酸分子或其直系同源体的至少一部分,或包括靶核酸分子的互补链的至少一部分。抑制性核酸可以与靶基因或序列具有显著同一性或完全同一性,或者可以包括错配区域(即,错配基序)。抑制性核酸的序列可对应于全长靶基因或其子序列。在一个方面中,这些抑制性核酸分子是化学合成的。
62.在控制策略2b中,重组dna用于过表达控制代谢物的水平的一种或多种下游酶,从而降低代谢物的水平。
63.在控制策略3中,可以通过两种不同的方法控制酶活化:
64.方法1:调节酶表达以减少代谢物的合成包括添加酶活性的抑制剂。示例性的酶活性抑制剂包括小分子、肽、蛋白质和核酸,其结合酶的活性位点并干扰酶的活性。
65.方法2:由于所有抑制性代谢物可以进一步代谢进入tca循环以提供能量,糖酵解途径激活剂(诸如hk-1和gk)可用于减缓抑制性代谢物的积累。
66.对于某些方面中的控制策略2和3
67.其中,代谢物是aa并且酶是adi1、hoga1、tad1或其组合;
68.其中,代谢物是hica并且酶是got1、d-hicdh、mmut、auh、hmgcl、hadha/b或其组合;
69.其中,代谢物是cmp并且酶是uck1/2、nt5、cmas、cmpk1、ddyd、cda、slc35a1、rrm1、hoga1或其组合;
70.其中,代谢物是msa并且酶是got1、ethe1、amt、hadha/b、mmut或其组合;
71.其中,代谢物是tri并且酶是nadsyn1、nnmt、cat、nmnat1、sult4a1或其组合;
72.其中,代谢物是nap并且酶是sat1/2、hoga1、amd1、odc1、got1、maob或其组合;或
73.其组合。
74.在控制策略4中,将至少一种代谢物维持在低于细胞培养基中至少一种代谢物的抑制浓度包括控制工艺参数,包括温度、溶解氧水平、ph或其组合。最佳温度、溶解氧水平和ph可以通过酶促反应的速率和抑制性代谢物积累来确定。可以针对补料分批和灌注生物过程来优化该过程。
75.示例性温度是约30℃至约40℃,具体地,在细胞培养的早期和晚期为31℃、32℃、33℃、34℃、35℃、36℃和37℃的温度。
76.示例性ph在ph 5.5至8.5的范围内,诸如ph 6.5、6.7、6.9、7、7.2、7.4或7.6。可以使用co2鼓泡和/或na2co3补充来平衡ph。示例性co2鼓泡速率包括0.3slph、0.4slph、0.5slph、0.6slph和0.7slph(标准升/小时)。na2co3补充的示例性搅拌速率包括90rpm、120rpm、150rpm和170rpm(转/分钟)。
77.示例性溶解氧设定点包括5%至50%,诸如20%、30%和40%。
78.可以在细胞培养基中生长的任何细胞可以用于本文所述的方法中。在一些方面,该细胞是哺乳动物细胞。哺乳动物细胞的非限制性实例包括balb/c小鼠骨髓瘤系(nso/i,ecacc号:85110503);人视网膜母细胞(per.c6,crucell,leiden,the netherlands);由sv40转化的猴肾cv1系(cos-7,atcc crl 1651);人胚肾系(293或293细胞亚克隆,用于悬浮
生长);幼仓鼠肾细胞(bhk,atcc ccl 10);中国仓鼠卵巢细胞 /-dhfr(cho,urlaub和chasin,proc.nat1.acad.sci.usa,77:4216,1980);小鼠塞尔托利氏细胞(sertoli cells)(tm4,mather,biol.reprod.,23:243-251,1980);猴肾细胞(cv1 atcc ccl 70);非洲绿猴肾细胞(vero-76,atcc crl-1587);人宫颈癌细胞(hela,atcc ccl 2);犬肾细胞(mdck,atcc ccl 34);水牛大鼠肝细胞(brl 3a,atcc crl 1442);人肺细胞(w138,atcc ccl 75);人肝细胞(hep g2、hb 8065);小鼠乳腺肿瘤(mmt 060562,atcc ccl51);tri细胞;mrc 5细胞;fs4细胞;和人肝瘤系(hep g2)。在一方面,这些细胞是cho细胞、hek 293细胞、ht-1080细胞、工程t细胞和工程自然杀伤细胞。工程t细胞包括car t细胞。
79.任何数量的可商业获得和非商业获得的杂交瘤细胞系可以用于本文描述的方法中。本文使用的术语“杂交瘤”是指从永生化细胞与产生抗体的细胞融合产生的细胞或细胞的子代。这样得到的杂交瘤是产生抗体的永生化细胞。用于产生杂交瘤的个体细胞可以来自任何哺乳动物来源,包括但不限于大鼠、猪、兔、绵羊、山羊和人。在一些方面,杂交瘤是三源杂交瘤细胞系,当异源杂交骨髓瘤融合物(其是人细胞和鼠骨髓瘤细胞系之间的融合产物)的后代随后与浆细胞融合时,其产生三源杂交瘤细胞系。在一些方面,杂交瘤是产生抗体的任何永生化杂交细胞系,诸如四细胞瘤。本领域技术人员将理解,杂交瘤细胞系可以具有不同的营养需求和/或可以需要不同的培养条件以进行最佳生长,并且将能够根据需要改变条件。
80.本文使用的术语“培养物”和“细胞培养物”是指在适合于细胞群存活和/或生长的条件下悬浮在培养基中的细胞群。本领域普通技术人员将清楚的是,在一些方面,如在此使用的这些术语是指包括细胞群和该群悬浮于其中的培养基的组合。在一些方面,细胞培养物的细胞包括哺乳动物细胞。
81.本文描述的方法可以与适合于所希望的过程(例如,重组蛋白(例如,抗体)的产生)的任何细胞培养方法一起使用。作为非限制性实例,细胞可以分批培养或分批补料培养的形式生长,其中在重组蛋白(例如,抗体)充分表达后终止培养,其后收获表达的蛋白(例如,抗体)。或者,作为另一非限制性实例,细胞可以分批再补料的形式生长,其中不终止培养,并且定期或连续将新营养物和其他组分添加至培养物,在此期间定期或连续收获表达的重组蛋白(例如抗体)。其他适合的方法(例如,旋转管培养)在本领域中是已知的并且可以用于进行本文描述的方法。
82.在一些方面,细胞培养是补料分批培养。本文使用的术语“补料分批培养”是指以下培养细胞的方法,其中在培养过程开始后一次或多次地向培养物提供另外的组分。此类提供的组分通常包括在培养过程中已经耗尽的细胞的营养组分。分批补料培养通常在一些点停止,并且收获培养基中的细胞和/或组分并且任选地纯化。在一些方面,补料分批培养包括补充有补料培养基的基础培养基。
83.可替代地,这些细胞可以在灌注过程中生长。在灌注过程中,将细胞保留在生物反应器中,同时连续去除细胞废弃物和耗尽的培养基。以与从系统中去除耗尽的培养基大致相同的速率加入新鲜培养基。去除用过的培养基可以通过交替的切向流、标准切向流过滤、中空纤维过滤等来完成。
84.细胞可以以由从技术人员选择的任何便利体积来生长。例如,细胞可以在体积范围从几毫升至几升的小规模反应容器中生长。可替代地,细胞可以在体积范围从约至少1升
至10、50、100、250、500、1000、2500、5000、8000、10,000、12,000、15000、20000或25000升或更多、或其间的任何体积的大规模商业生物反应器中生长。
85.主要基于细胞培养物保持存活的温度范围和产生高水平所需产物(例如重组蛋白)的范围选择细胞培养物的温度。通常,大多数哺乳动物细胞生长良好,并且可以在约25℃至42℃的范围内产生所需产物(例如,重组蛋白),但是本文描述的方法不限于这些温度。某些哺乳动物细胞生长良好,并且可以在约35℃至40℃的范围内产生所需产物(例如,重组蛋白或抗体)。在某些方面,细胞培养物在细胞培养过程期间在20-45℃的温度下生长一次或多次。本领域普通技术人员将能够根据细胞的具体需要和技术人员的具体生产要求来选择使细胞生长的一个或多个适当的温度。取决于技术人员的需要和细胞本身的要求,细胞生长可以持续任何时间量。在一方面,使细胞在37℃下生长。在其他方面,使细胞在36.5℃下生长。
86.在一些方面,取决于技术人员的需要和细胞本身的要求,细胞在初始生长阶段(或生长阶段)生长更长或更短的时间量。在一些方面,细胞生长持续足以实现预定细胞密度的时间段。在一些方面,细胞生长持续足以实现下述细胞密度的时间段,该细胞密度是如果允许不受干扰地生长,则细胞将最终达到的最大细胞密度的给定百分比。例如,细胞可以生长足以实现最大细胞密度的1-99百分比的期望活细胞密度的时间段。在一些方面,细胞生长直到细胞密度增加不超过15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的培养物每天。在一些方面,细胞生长直到细胞密度增加不超过5%的培养物每天。
87.在一些方面,允许细胞生长限定的时间段。例如,取决于细胞培养物的起始浓度、细胞生长的温度和细胞的固有生长速率,细胞可以生长0-20天或更多天,具体地4至10天。在一些情况下,可以允许细胞生长一个月或更长。技术人员将能够根据蛋白质生产要求和细胞本身的需要来选择初始生长阶段的持续时间。
88.细胞培养物可以在初始培养阶段期间搅动或摇动以增加氧合作用(oxygenation)和营养物向细胞的分散。本领域普通技术人员将理解,在初始生长阶段期间控制或调节生物反应器的某些内部条件可以是有益的,包括但不限于ph、温度、氧合作用等。
89.在初始生长阶段结束时,可以转变(转换,改变,shift)培养条件中的至少一个,从而应用第二组培养条件,并且在培养物中发生代谢转变。可以通过例如细胞培养的温度、溶解氧水平、ph、渗透压或化学诱导剂水平的变化来实现代谢转变。在一个非限制性方面,通过转变培养物的温度来转变培养条件。然而,如本领域已知的,转变温度不是唯一可以实现适当的代谢转变的机制。例如,这样的代谢转变也可以通过转变其他培养条件来实现,包括但不限于ph、溶解氧、渗透压和丁酸钠水平。培养转变的时机将由技术人员基于蛋白质生产要求或细胞本身的需要来确定。
90.当转变培养物的温度时,温度转变可以是相对渐进的。例如,完成温度变化可以消耗几个小时或几天。或者,温度转变可以相对突然。例如,温度变化可以在少于几个小时内完成。考虑到适当的生产和控制设备(例如在多肽或蛋白质的商业大规模生产中作为标准的设备),温度变化甚至可以在少于一小时内完成。
91.在一些方面,一旦细胞培养物的条件已如以上所讨论地发生转变,则在有益于细胞培养物的存活和活力并且适于以商业足量水平表达所希望的多肽或蛋白质的第二组培
养条件下,维持该细胞培养物以进行随后的生产阶段。
92.如以上所讨论的,可以通过转变多种培养条件中的一种或多种来转变培养物,这些培养条件包括但不限于温度、溶解氧、ph、渗透压以及丁酸钠水平。在一些方面,培养物的温度转变。根据这个方面,在随后的生产阶段期间,将培养物的温度或温度范围维持在低于初始生长阶段的温度或温度范围。如以上所讨论的,可以采用多次离散的温度转变来增加细胞密度或活力或增加重组蛋白的表达。
93.细胞可以表达重组蛋白、基因产物或细胞产物。在一些方面,细胞表达重组蛋白并且该细胞培养方法包括生长阶段和生产阶段。本文描述的方法可在生长阶段、生产阶段或二者期间应用。
94.本文描述的方法可以用于在高密度细胞培养物中以高细胞密度改善细胞生长。本文使用的高细胞密度是指高于1
×
106细胞/ml、5
×
106细胞/ml、1
×
107细胞/ml、5
×
107细胞/ml、1
×
108细胞/ml或5
×
108细胞/ml,优选地高于1
×
107细胞/ml,更优选地高于5
×
107细胞/ml的细胞密度。
95.在一些方面,细胞生长由活细胞密度(vcd)、最大活细胞密度或积分活细胞计数(ivcc)确定。在一些方面,细胞生长由最大活细胞密度确定。本文使用的术语“活细胞密度”是指给定体积的培养基中存在的细胞数目。活细胞密度可以通过本领域技术人员已知的任何方法测量。优选地,使用自动化细胞计数器诸如bioprofile 测量活细胞密度。本文使用的术语最大细胞密度是指在细胞培养期间实现的最大细胞密度。本文使用的术语“细胞活力”是指在给定的一组培养条件或实验变化方案下培养物中的细胞存活的能力。例如,可以使用不穿过活细胞的膜、但可以穿过死亡或垂死细胞的破碎膜的染料(例如,台盼蓝),以确定细胞活力。
96.本文使用的术语“积分活细胞计数(ivcc)”是指活细胞密度(vcd)曲线下方的面积。可以使用以下公式计算ivcc:
97.ivcc
t 1
=ivcc
t
(vcd
t
vcd
t 1
)*(δt)/2
98.其中,δt是t时间点与t 1时间点之间的时间差。可以假设ivcc
t=0
可忽略。vcd
t
和vcd
t 1
是在t时间点和t 1时间点的活细胞密度。
99.本文使用的术语“滴度”是指例如在给定量的培养基体积中由细胞培养物产生的重组表达蛋白的总量。滴度通常以每升培养基的蛋白质克数为单位表示。
100.在一些方面,与对照培养物相比,细胞生长增加了至少5%、10%、15%、20%或25%。对照培养物可以与上述培养物相同,不同的是不使用步骤(ii)培养。在一些方面,与对照培养物相比,细胞生长增加了至少10%。在一些方面,与对照培养物相比,细胞生长增加了至少20%。
101.在一些方面,通过滴度和/或体积产率来确定产率。本文使用的术语“滴度”是指例如在给定量的培养基体积中由细胞培养物产生的重组表达蛋白的总量。滴度通常以每升培养基的蛋白质克数为单位表示。在一些实施方式中,通过滴度确定产率。在一些方面,与对照培养物相比,产率增加至少5%、10%、15%、20%或25%。在一些方面,与对照培养物相比,产率增加至少10%。在一些方面,与对照培养物相比,产率增加至少20%。
102.在一些方面,细胞培养物的最大细胞密度大于1
×
106细胞/ml、5
×
106细胞/ml、1
×
107细胞/ml、5
×
107细胞/ml、1
×
108细胞/ml或5
×
108细胞/ml。在一些方面,细胞培养物的
最大细胞密度大于5
×
106细胞/ml。在一些方面,细胞培养物的最大细胞密度大于1
×
108细胞/ml。
103.本文使用的术语“介质”、“细胞培养基”和“培养基”是指含有使哺乳动物细胞营养生长的营养物的溶液。通常,此类溶液提供必需和非必需氨基酸、维生素、能源、脂质、以及细胞所需的微量元素以用于最小生长和/或存活。这种溶液还可以含有增强生长和/或存活超过最低速率的补充组分,包括但不限于激素和/或其他生长因子、特定离子(诸如钠离子、氯离子、钙离子、镁离子和磷酸根)、缓冲剂、维生素、核苷或核苷酸、微量元素(通常以非常低的终浓度存在的无机化合物)、以高终浓度存在的无机化合物(例如,铁)、氨基酸、脂质和/或葡萄糖或其他能源。在一些方面,有利地将培养基配制为对于细胞存活和增殖最佳的ph和盐浓度。在一些方面,培养基是在细胞培养开始后添加的补料培养基。
104.根据本文描述的方法可以使用多种哺乳动物生长培养基。在一些方面,细胞可以在多种化学成分限定培养基(合成培养基,chemically defined media)中的一种中生长,其中培养基的组分是已知的且受控的。在一些方面,细胞可以在复合培养基(复杂培养基,complex media)中生长,其中并非所有的培养基组分都是已知的和/或受控的。
105.在过去几十年中,用于哺乳动物细胞培养的化学成分限定培养基已经被广泛地开发和公布。限定培养基的所有组分都被良好表征,并且因此限定培养基不包含复杂的添加剂诸如血清或水解产物。开发的早期培养基制剂允许细胞生长和维持活力,而与蛋白质产生几乎没有关系或没有关系。最近,已经研发了具有支持高生产性重组蛋白生产细胞培养物的表达目的的培养基制剂。这种培养基通常包含大量的营养物,特别是氨基酸,以支持细胞的高密度生长和/或维持。如果必要,本领域技术人员可以改变这些培养基以用于本文描述的方法。
106.并非所有的复合培养基组分都得到良好表征,并且因此复合培养基可以包含诸如简单和/或复杂碳源、简单和/或复杂氮源以及血清等添加剂。在一些方面,除了如本文描述的限定培养基的其他组分之外,复合培养基还包含添加剂,诸如水解产物。
107.在一些方面,限定培养基通常包括在水中处于已知浓度的大致五十种化学实体。它们中的大多数还包含一种或多种良好表征的蛋白质,诸如胰岛素、igf-1、转铁蛋白或bsa,但其他限定培养基不需要蛋白质组分,并且因此被称为无蛋白质的限定培养基。培养基的常见化学组分分为五大类:氨基酸、维生素、无机盐、微量元素和定义纯分类的混杂类别。
108.细胞培养基可以任选地补充有补充组分。本文使用的术语“补充组分”是指增强生长和/或存活超过最低速率的组分,包括但不限于激素和/或其他生长因子、特定离子(诸如钠离子、钙离子、镁离子和磷酸根)、缓冲剂、维生素、核苷或核苷酸、微量元素(通常以非常低的终浓度存在的无机化合物)、氨基酸、脂质、和/或葡萄糖或其他能源。在一些方面,可以将补充组分添加至初始细胞培养物。在一些方面,可以在细胞培养开始后添加补充组分。
109.通常,微量元素是指以微摩尔或更低水平存在的多种无机盐。例如,通常包括的微量元素是锌、硒、铜等。在一些方面,铁(亚铁盐或铁盐)可以作为微量元素以微摩尔浓度包含在初始细胞培养基中。锰也经常作为二价阳离子(mncl2或mnso4)以纳摩尔浓度到微摩尔浓度范围包含在微量元素中。许多不太常见的微量元素通常以纳摩尔浓度添加。
110.在一些方面,在该方法中使用的培养基是一种适用于在细胞培养中支持高细胞密
度的培养基,诸如1
×
106细胞/ml、5
×
106细胞/ml、1
×
107细胞/ml、5
×
107细胞/ml、1
×
108细胞/ml或5
×
108细胞/ml。在一些方面,该细胞培养物是哺乳动物细胞分批补料培养物,优选地是cho细胞分批补料培养物。
111.在许多情况下,细胞会被选定或工程化以产生高水平的期望产物(例如,重组蛋白或抗体)。通常,将操纵细胞以产生高水平的重组蛋白,例如通过引入编码感兴趣的蛋白质的基因和/或通过引入调控该基因的表达的基因控制元件(无论是内源的还是引入的)。
112.某些蛋白质可以对细胞生长、细胞活力或细胞的一些其他特征具有有害作用,其最终以某种方式限制感兴趣的蛋白质的产生。甚至在被工程化以表达特定蛋白质的一种特定类型的细胞群中,细胞群内存在的变异性使得某些个体细胞将更好地生长、产生更多感兴趣的蛋白质、或产生具有更高活性水平(例如,酶活性)的蛋白质。在某些方面,技术人员凭经验选择细胞系用于在选择用于培养细胞的特定条件下稳健生长。在一些方面,基于细胞生长、最终细胞密度、细胞活力百分比、表达的蛋白质的滴度或这些的任何组合或技术人员认为重要的任何其他条件,选择工程化以表达特定蛋白质的个体细胞用于大规模生产。
113.可根据本文所述的方法产生可在宿主细胞中表达的任何蛋白质。本文使用的术语“宿主细胞”是指被操纵以产生如本文描述的感兴趣的蛋白质的细胞。蛋白质可以从细胞内源的基因表达,或从引入细胞的异源基因表达。蛋白质可以是天然存在的蛋白质,或者可以具有工程化或选定的序列。
114.可期望表达的蛋白质将通常基于感兴趣或有用的生物学或化学活性来选择。例如,这些方法可以用于表达任何药学或商业相关的酶、受体、抗体、激素、调节因子、抗原、结合剂等。在一些方面,由培养物中的细胞表达的蛋白质选自抗体或其片段、纳米抗体、单结构域抗体、糖蛋白、治疗性蛋白质、生长因子、凝血因子、细胞因子、融合蛋白、药物物质、疫苗、酶或small modular immunopharmaceuticals
tm
(smip)。本领域普通技术人员将理解,可以表达的任何蛋白质将能够基于他或她的特定需要来选择有待产生的特定蛋白质。
115.根据本方法,抗体的产生是特别令人感兴趣的。抗体是具有特异性结合特定抗原的能力的蛋白质。可以产生可以在宿主细胞中表达的任何抗体。在一些方面,待表达的抗体是单克隆抗体。
116.在一些方面,该单克隆抗体是嵌合抗体。嵌合抗体含有来源于多于一种生物体的氨基酸片段。例如,嵌合抗体分子可以包括来自小鼠、大鼠或其他物种的抗体的抗原结合结构域,以及人恒定区。
117.在一些方面,例如,单克隆抗体是通过使用核糖体展示或噬菌体展示文库或使用异种物种衍生的人抗体,其中天然抗体基因是失活的并且用人抗体基因功能置换,同时保持天然免疫系统的其他组分完整。
118.在一些方面,该单克隆抗体是人源化抗体。人源化抗体是嵌合抗体,其中大部分氨基酸残基来源于人抗体,因此当递送至人受试者时最小化任何潜在的免疫反应。在人源化抗体中,互补决定区中的氨基酸残基被来自非人物种的赋予期望抗原特异性或亲和力的残基至少部分置换。此类改变的免疫球蛋白分子可通过本领域已知的几种技术中的任何一种来制备。
119.在一些方面,上述单克隆抗体、嵌合抗体或人源化抗体可以含有任何天然物种中的任何抗体中不天然存在的氨基酸残基。例如,可以利用这些外源残基向单克隆抗体、嵌合
抗体或人源化抗体赋予新的或改变的特异性、亲和力或效应子功能。在一些方面,上述抗体可以结合(缀合,conjugated)至用于全身药物疗法的药物,诸如毒素、低分子量细胞毒性药物、生物反应调节剂以及放射性核素。
120.通常,引入细胞中的核酸分子编码期望表达的蛋白质。或者,核酸分子可以编码诱导细胞表达所需蛋白质的基因产物。例如,引入的遗传物质可以编码激活内源或异源蛋白质的转录的转录因子。可替代地或另外地,引入的核酸分子可以增加由该细胞表达的蛋白质的翻译或稳定性。适合于将足以实现感兴趣的蛋白质的表达的核酸引入哺乳动物宿主细胞的方法是本领域已知的。对于哺乳动物细胞,将遗传物质引入哺乳动物细胞的常见方法包括磷酸钙沉淀法或lipofectamine
tm
法。
121.在一些方面,有待引入的核酸处于裸核酸分子的形式。例如,引入细胞中的核酸分子可以仅由编码蛋白质的核酸和必要的基因控制元件组成。可替代地,编码该蛋白质的核酸(包括必要的调节元件)可以包含在质粒载体中。用于在哺乳动物细胞中表达蛋白质的合适载体的非限制性实例包括pcdna1;pcd;pmcineo poly-a;杆状病毒载体,诸如pac 373或pac 610;cdm8;和pmt2pc。在一些方面,有待引入细胞中的核酸分子包含在病毒载体内。例如,可以将编码蛋白质的核酸插入病毒基因组(或部分病毒基因组)中。指导蛋白质表达的调节元件可以与插入病毒基因组中的核酸包括在一起(即,与插入病毒基因组中的基因连接)或可以由病毒基因组本身提供。
122.通过形成含有dna和磷酸钙的沉淀,可以将裸dna引入到细胞中。可替代地,也可以通过形成dna和deae-葡聚糖的混合物并将该混合物与细胞一起温育,或者通过将细胞和dna在合适的缓冲液中一起温育并使细胞经受高压电脉冲(例如,通过电穿孔),将裸dna引入细胞中。向细胞引入裸dna的另一种方法是将dna与含阳离子脂质的脂质体悬浮液混合。然后将dna/脂质体复合物与细胞一起温育。例如,裸dna也可以通过显微注射直接注射到细胞中。可替代地,还可以通过将dna与阳离子(诸如聚赖氨酸)复合而将裸dna引入细胞中,该阳离子偶联至细胞表面受体的配体。dna-配体复合物与受体的结合促使通过受体介导的内吞作用摄取dna。
123.缺陷型逆转录病毒良好地表征用于基因治疗目的的基因转移。可构建重组逆转录病毒,其具有插入到逆转录病毒基因组中的编码感兴趣的蛋白质的核酸。另外,可以去除逆转录病毒基因组的部分以使逆转录病毒复制有缺陷。然后将这种复制缺陷型逆转录病毒包装到可用于通过标准技术使用辅助病毒感染靶细胞的病毒颗粒中。例如,可以操纵腺病毒的基因组,使其编码并表达感兴趣的蛋白质,但就其在正常裂解病毒生命周期中复制的能力而言是失活的。衍生自腺病毒菌株ad 5d1324型或腺病毒的其他菌株(例如,ad2、ad3、ad7等)的示例性腺病毒载体是本领域技术人员已知的。腺相关病毒(aav)是天然存在的缺陷病毒,其需要另一种病毒(诸如腺病毒或疱疹病毒)作为有效复制和生产性生命周期的辅助病毒。
124.当用于将核酸分子引入细胞群中的方法致使大部分细胞发生改变且细胞有效表达蛋白质时,可以使用改变的细胞群而无需进一步分离或亚克隆群内的个体细胞。即,细胞群可以充分产生蛋白质,使得不需要进一步的细胞分离,并且可以立即使用该群接种细胞培养物用于产生蛋白质。或者,可能期望从有效产生蛋白质的几个细胞或单个细胞分离和扩增细胞的同质群。
125.作为将核酸分子引入编码感兴趣蛋白质的细胞中的替代方案,引入的核酸可以编码另一种多肽或蛋白质,该多肽或蛋白质诱导或增加由细胞内源性产生的蛋白质的表达水平。例如,细胞可以能够表达特定蛋白质,但是在没有另外处理细胞的情况下也可以不能表达特定蛋白质。类似地,细胞可以表达对于期望目的而言不足量的蛋白质。因此,刺激感兴趣的蛋白质的表达的试剂可以用于诱导或增加细胞对该蛋白质的表达。例如,引入的核酸分子可以编码激活或上调感兴趣的蛋白质的转录的转录因子。这种转录因子的表达进而导致感兴趣的蛋白质的表达或更稳健的表达。
126.一般而言,通常期望分离和/或纯化根据本文所述方法表达的重组蛋白、基因产物或细胞产物。在某些方面,将表达的蛋白质分泌到培养基中,因此例如,可以通过将离心或过滤作为纯化过程中的第一步骤来去除细胞和其他固体。
127.可替代地,表达的蛋白质可以结合至宿主细胞的表面。例如,可以将除去培养基并裂解表达蛋白质的宿主细胞作为纯化过程中的第一步骤。哺乳动物宿主细胞的裂解可以通过本领域普通技术人员熟知的多种方法中的任一种来实现,包括通过玻璃珠物理破坏以及暴露于高ph条件。
128.可以通过标准方法分离和纯化表达的蛋白质,包括但不限于色谱法(例如,离子交换色谱法、亲和色谱法、尺寸排阻色谱法和羟基磷灰石色谱法)、凝胶过滤、离心或差别溶解度、乙醇沉淀和/或通过用于纯化蛋白质的任何其他可用技术。
129.在某些方面,产生的多肽或蛋白将具有药理学活性并且将可用于制备药物。蛋白质和肽可以配制用于通过任何可用途径递送,包括但不限于肠胃外(例如,静脉内)、皮内、皮下、口服、经鼻、支气管、眼部、透皮(局部)、经粘膜、直肠和阴道途径。药物组合物通常包括从哺乳动物细胞系表达的纯化的多肽或蛋白质、递送剂,与药用载体组合。本文使用的表述“药用载体”包括与药物给予相容的溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。还可以将补充的活性化合物掺入这些组合物中。
130.通过以下非限制性实施例进一步说明本发明。
131.实施例
132.实施例1:抑制剂识别
133.hilic液相色谱柱orbitrap
tm
质谱(lc-ms)用于筛选整个cho代谢组。分析了30000个特征结构,并且在整个细胞培养中积累超过1000个特征结构。通过分析学和生物学测试了前20个特征结构的抑制影响。表1提供了通过(lc-ms)结构确认的代谢物。还用不同的方法使用lc-ms测量了培养结束浓度。
134.表1:具有其培养结束上清液浓度的结构确认的代谢物。
[0135][0136][0137]
实施例2:代谢物的标准生物过程和生物确认
[0138]
cho k-1工业标准分批方法:将nih cho-k1细胞系用6mm谷氨酰胺补充物在接种日培养6天。在125ml摇瓶中的工作体积是30ml,并且接种细胞密度是0.5百万个细胞/ml。振荡培养箱的参数为:125rpm和5%co2。
[0139]
cho gs工业标准分批方法:将细胞系培养6天。在125ml摇瓶中的工作体积是30ml,并且接种细胞密度是0.5百万个细胞/ml。振荡培养箱的参数为:125rpm和5%co2。
[0140]
hek 293工业标准分批方法:将mbl hek 293细胞系培养6天。在125ml摇瓶中的工作体积是30ml,并且接种细胞密度是0.5百万个细胞/ml,在接种日用6mm谷氨酰胺补充物补充。振荡培养箱的参数为:125rpm和5%co2。
[0141]
将细胞在分批培养中以其培养结束浓度暴露于表1的识别的抑制性代谢物持续6天。aa、ica、cmp和混合物条件显示出比对照组更低的细胞密度(图3)。所有抑制性代谢物降低抗体产率(图4)。
[0142]
工业标准补料分批过程:将cho-k1细胞系培养在相应的培养基中。在接种日用6mm谷氨酰胺补充剂补料14天。在125ml摇瓶中的工作体积是30ml,并且接种细胞密度是0.5百万个细胞/ml。振荡培养箱的参数为:125rpm和5%co2。补料策略是从第3天开始至第13天每天10%的相应补料。
[0143]
在标准的工业补料分批工艺中,将细胞暴露于抑制剂持续长的时间段。该实验模拟治疗性抗体产生过程,并在其培养结束细胞浓度突增抑制剂。ica被证实是已知的抑制剂并且用作阳性抑制剂对照。混合物条件排除ica并且包括aa、hica、cmp、msa、tri、nap。该过程持续14天,并且从第6天开始,在抑制剂条件下的细胞密度低于阴性对照批次。结果显示在图3中。与对照批次相比,cmp、ica、tri和hica显示出更强的生长抑制影响,导致在第9天的峰值vcd处40-50%的vcd下降。
[0144]
实施例3:示出代谢物的产率和质量影响
[0145]
igg滴度通过具有蛋白质a柱的hplc测量。通过igg聚糖谱对产品质量进行定量,该谱是通过具有聚糖柱的hplc测量的。
[0146]
所有7种代谢物显示出对产率和产品质量的抑制影响。hica、cmp、ica和tri显示出对产率的强烈抑制,与对照相比,这超过30%的产率下降(图4)。产品质量是生物过程和药物批准的关键参数,其中聚糖谱是最重要的关键质量属性(critical quality attributes,cqa)之一。aa、hica、cmp、msa和ica显示对g1f形成的较高影响(图5),并且aa完全抑制g2f形成,并且所有其他6种抑制剂对g2f形成显著影响(图6)。重复的掺加实验显示对聚糖谱的影响是一致的(图7、图8和图9)。
[0147]
结论
[0148]
通过本文所述的lc-ms代谢组学研究获取了超过30000个特征结构,并且通过多变量数据分析和途径分析选择在识别匹配中具有高置信度的前20个抑制剂候选物。通过高等级候选物掺加的分批培养实验验证了这些候选物,并且在它们中,15种中的11种显示对细胞生长的抑制性影响。在结构和生物学上验证了八种代谢副产物。在它们之中,六种代谢物是细胞生长和/或产率的新的抑制性副产物,并且它们中的4种是第一次识别的cho代谢物(参见表2)。
[0149]
表2:在本研究中,aa、hica、cmp、gmp、msa、ica、tri和nap被识别为cho细胞过程的抑制剂。gmp和ica作为cho细胞培养抑制剂在出版物/专利中报道,并且其余6种代谢物由本文要求。tri、nap、aa和msa第一次被识别为cho细胞代谢物。
[0150]
代谢物id浓度(μm)途径抑制剂已报道aa14359柠檬酸循环否hica64.09亮氨酸否cmp11.27嘧啶否gmp20嘌呤是msa13.59异亮氨酸否ica2.5色氨酸是tri0.812nadph否nap0.196精氨酸和脯氨酸否
[0151]
实施例4:在补料分批培养中抑制性代谢物的积累
[0152]
补料分批条件与实施例2中的cho k-1工业标准补料分批过程相同。分批过程条件与实施例2中的cho k-1工业标准分批过程相同。
[0153]
通过lc-esi-ms识别代谢物。表3显示在该过程中积累的所识别的抑制性代谢物和在分批过程中6天后和在补料分批过程中5、8和14天后它们的积累。
[0154]
表3:在分批和补料分批过程中的抑制代谢物积累
[0155][0156]
该实施例显示了分批培养和分批补料培养中的抑制剂浓度。我们得出结论,抑制性代谢物在主要生物过程中积累。
[0157]
实施例5:分批培养中的cho k1、cho gs和hek 293中的抑制性代谢物积累
[0158]
分批过程条件与实施例2中的cho k-1、cho gs和hek 293工业标准分批过程相同。通过lc-esi-ms识别代谢物。表4显示在该过程中积累的所识别的抑制性代谢物和在分批过程中6天后它们的积累。表4显示六种抑制性代谢物存在于不同的哺乳动物细胞培养系中并在分批培养中积累。
[0159]
表4:分批培养中的cho k1、cho gs和hek 293中的抑制代谢物积累
[0160][0161][0162]
从分批培养结束时的积累,我们得出结论,抑制性代谢物广泛存在于哺乳动物细胞系中。
[0163]
实施例6:减轻抑制性代谢物积累的过程发展
[0164]
将用于产生抑制性代谢物的调节基因转染到分批培养物中的cho k1细胞系中缓解了抑制性代谢物的生长。
[0165]
转染的目的是过表达抑制性代谢物的调节基因/酶。通过在pcdna 3.1( )载体(v79020,thermofisher scientific)上用got1、hoga1、cat、slc35a1构建的质粒将下游酶编码基因敲入cho细胞系中。使用5-α感受态大肠杆菌(c2987i,new england biolabs)扩增质粒。使用聚乙烯亚胺(408727,millipore sigma)将质粒转染到哺乳动物细胞系中,以通过过表达抑制性代谢物的调节基因来减轻抑制性代谢物的浓度。转染与cho k1工业标准分批过程相同地进行,不同之处在于初始接种细胞密度是1百万个细胞/ml。
[0166]
在表5和图11中,对照指示不转染任何基因的cho k1分批细胞培养控制条件;t1表示具有转染到cho k1细胞系中的got1的细胞生长谱;t2表示got1和hoga1转染;并且t3表示got1、hogal、cat和slc35al转染。如表5和图11所示,与对照细胞培养物相比,所有抑制性代谢物的浓度随着将抑制性代谢物调节基因过表达至cho k1细胞系而降低,并且生长谱得到改善。
[0167]
表5:将抑制性代谢物调节基因转染到分批培养物中的cho k1细胞系中。
[0168][0169][0170]
从该数据我们得出结论,在将抑制性代谢物调节基因转染到cho细胞系中之后,抑制剂浓度降低。
[0171]
除非在本文中另外指出或与上下文明显矛盾,否则术语“一”和“一种”和“该”以及类似指示物(尤其在以下权利要求的上下文中)的使用应被解释为涵盖单数和复数两者。本文使用的术语“第一”、“第二”等不表示任何特定的顺序,而是仅仅为了方便地表示多个(例如,层)。除非另外指出,否则术语“包含”、“具有”、“包括”以及“含”应被解释为开放式术语(即,意味着“包括但不限于”)。除非本文中另外指出,否则数值范围的列举仅旨在用作单独地提及落入该范围内的每个单独值的速记方法,并且每个单独值如同其在本文中单独地列举一样结合到说明书中。所有范围的端点包括在范围内并且可独立地组合。除非本文中另有指示或者上下文另有明确冲突,否则,可以以合适的顺序实施在本文中描述的所有方法。任何和所有实施例或示例性语言(例如,“诸如”)的使用仅旨在更好地说明本发明并且不对本发明的范围造成限制,除非另外要求。说明书中的语言不应被解释为指示任何未要求保护的要素对于本文所使用的发明的实践是必不可少的。
[0172]
尽管已经参考示例性实施方式描述了本发明,但本领域技术人员应当理解的是,在不远离本发明的范围的情况下,可以做出各种变化并且可以用等同物替换其要素。此外,在不远离本发明的基本范围的情况下,可以做出许多修改以使特定情况或材料适应本发明的教导。因此,本发明旨在不限于作为用于实施本发明而预期的最佳模式所公开的具体实施方式,而是本发明将包括落入所附权利要求范围内的所有实施方式。除非本文另外指出或上下文明显矛盾,否则本发明涵盖上述要素在其所有可能变型中的任何组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
