1.本发明涉及乳腺癌治疗领域,特别涉及一种逆转乳腺癌耐药性的组合制剂及标志物应用。
背景技术:
2.人类表皮生长因子受体2(her2)的扩增和/或过表达发生在14
–
30%的乳腺癌病例中,这些病例被定义为her2阳性乳腺癌;该亚型与较差的生存结果相关。曲妥珠单抗(也称为herceptin)是第一种抗her2的人源性单克隆抗体,可显着延长早期或转移性her2阳性乳腺癌患者的生存期。尽管曲妥珠单抗疗效显著,但抗her2耐药性已成为her2阳性乳腺癌患者治疗失败的主要原因。曲妥珠单抗耐药在接受辅助治疗的her2阳性乳腺癌患者中很常见,hera试验中曲妥珠单抗治疗后1年复发率接近15%,10年复发率超过31%。用曲妥珠单抗治疗的晚期乳腺癌患者的中位无进展生存期约为11个月,大多数患者在接受曲妥珠单抗治疗后一年内出现继发性耐药。虽然已经开发出一系列抗her2药物并进入临床应用,但仍有一部分患者存在耐药性。目前迫切需要阐明抗her2耐药的潜在分子机制,并制定新的治疗策略来克服耐药性。
3.先前的研究已经揭示了her2阳性乳腺癌中抗her2耐药的几种分子机制。首先,her2的细胞外结构域上曲妥珠单抗结合位点的丧失。例如,p95 her2截短蛋白或muc4过表达分别导致曲妥珠单抗结合位点的丧失并随后保护her2免于在膜外被结合阻断。其次,her2下游通路的持续性激活是由乳腺癌细胞中下游信号组分的失调引起的,包括pik3ca突变或pten丢失。第三,受体酪氨酸激酶(rtk)的增强表达导致旁路信号传导途径的代偿性激活。例如,igf1r表达在抗her2耐药乳腺癌中上调,并在her2阻断后维持细胞内信号通路激活。第四,肿瘤免疫浸润(til),包括淋巴细胞,树突状细胞和自然杀伤细胞,也参与抗her2治疗的耐药作用。例如,内吞作用通过降低adcc介导作用降低对曲妥珠单抗阻断的反应。尽管如此,乳腺癌中引发抗her2耐药的分子机制的完整图景仍不清楚。针对这些靶标开发的大多数抑制剂在临床试验中未能克服抗her2耐药。此外,缺乏准确预测新辅助和辅助抗her2治疗后患者的治疗反应和复发风险的生物标志物。因此,在全基因组水平上鉴定出全新有效的耐药性靶点,为抗her2治疗耐药的患者提供新的治疗策略是一项迫在眉睫的任务。
技术实现要素:
4.本发明中,我们通过含有123411个sgrna、靶向20914个人类基因的crispr/cas9文库,在全基因组水平进行体外和体内筛选,以寻找克服乳腺癌抗her2耐药的靶点。通过分析筛选结果,我们发现一系列介导乳腺癌抗her2耐药的基因。在这些候选基因和相关蛋白中,成纤维细胞生长因子受体4(fgfr4)在体外和体内筛选的结果中排名很靠前。作为一种受体酪氨酸激酶,fgfr4在促进多种消化系统肿瘤的转移,血管生成,化疗耐药和癌细胞的干性等方面发挥重要作用。尽管fgfr4是包含在50基因内在亚型预测因子(pam50)中的聚集基因
之一,但对fgfr4在乳腺癌中的潜在作用知之甚少。据报道其他fgfr家族成员是抗her2耐药的重要介质。fgfr1赋予乳腺癌对拉帕替尼,曲妥珠单抗和tdm-1的耐药性。fgfr2信号传导作为逃避途径,其负责乳腺癌中的抗her2治疗耐药。由fgfr3驱动的自分泌环在her2阳性胃癌中维持获得性曲妥珠单抗耐药。然而,缺乏研究fgfr4在抗her2耐药中的功能的研究。在我们的研究中,发现fgfr4在耐药乳腺癌中表达显著上调,源自患者的异种移植物和类器官模型揭示了roblitinib(fgfr4的选择性抑制剂;也称为fgf-401)在治疗内源性和获得性抗her2耐药乳腺癌中疗效显著。因此,本研究揭示了乳腺癌抗her2耐药的机制,并提供了一种通过抑制her2阳性乳腺癌中的fgfr4来克服这种耐药性的新策略。
5.抑制fgfr4增强乳腺癌患者对抗her2治疗的敏感性。机制上,耐药细胞中的rna m6a低甲基化水平调控fgfr4上调,fgfr4磷酸化gsk-3β并激活β-catenin/tcf4信号,从而驱动抗her2耐药性。值得注意的是,fgfr4的抑制显著降低了谷胱甘肽的合成和通过β-catenin/tcf4-slc7a11/fpn1轴的fe
2
流出效率,导致ros过多产生和不稳定铁池积累。铁死亡是一种独特的铁依赖形式的氧化细胞死亡,在fgfr4被抑制后被触发。通过患者来源的异种移植和类器官的实验,我们发现抗fgfr4和抗her2治疗乳腺癌具有内在或获得性耐药性的协同效应。
附图说明
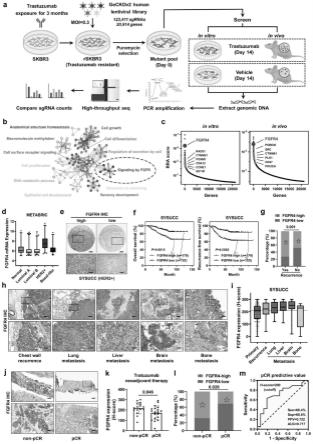
6.图1为全基因组crispr筛选将fgfr4鉴定为乳腺癌中抗her2耐药的关键基因。
7.(a)使用geckov2.0全基因组慢病毒sgrna文库筛选抗her2耐药相关基因的流程图。(b)用metascape进行的抗her2耐药相关基因的功能和通路富集分析。(c)排名聚合评分(rra)揭示了抗her2耐药乳腺癌中的背景依赖性脆弱性。蓝点代表先前研究已报道的抗her2耐药基因。(d)在metabric数据库中,fgfr4在her2阳性乳腺癌中高度表达。正常样(n=140),管腔a(n=679),管腔b(n=461),her2阳性(n=220),基底样(n=199)。(e)代表性的ihc染色图像显示来自sysucc的322个her2阳性乳腺癌组织中fgfr4的高表达或低表达。比例尺=200μm(低倍率)和100μm(高倍率)。(f)在具有高或低fgfr4表达的sysucc队列中her2阳性乳腺癌患者的总体和无复发存活的kaplan-meier分析。(g)(n=80)或无(n=252)复发患者的her2阳性乳腺癌标本中ihc h评分表达fgfr4。(h-1)ihc染色后乳腺癌不同转移灶中fgfr4表达的代表性图像和h评分。比例尺=200μm(低倍率)和100μm(高倍率)。(j)基于抗her2的新辅助治疗后非pcr和pcr乳腺癌组织中fgfr4 ihc染色的代表性图像。治疗前通过核心穿刺活检收集样品。比例尺=200μm(低倍率)和100μm(高倍率)。(k)非pcr(n=16)和pcr(n=19)乳腺癌样品中fgfr4的ihc h评分。数据表示为平均值
±
s.d.(l)来自(n=19)或没有pcr(n=16)的患者的her2阳性乳腺癌样品中fgfr4的表达。(m)接受者操作特征曲线(roc)描绘了在基于抗her2的新辅助治疗前检测fgfr4表达量预测pcr中的准确性。
8.图2为建立和验证抗her2耐药乳腺癌细胞系。
9.(a)将亲本抗her2敏感的her2阳性乳腺癌细胞系连续暴露于曲妥珠单抗三个月以建立抗her2耐药细胞。(b)用曲妥珠单抗治疗后亲本(skbr3,bt474和au565)和耐药细胞(rskbr3,rbt474和rau565)的剂量-反应曲线。使用通过cck-8测定确定的450nm处的吸光度值测量细胞活力。用载体(对照)处理的组定义为100%相对存活率。(c)用载体或曲妥珠单抗(0.1μm)处理24小时的培养的亲本细胞(skbr3,bt474和au565)和培养的耐药细胞
(rskbr3,rbt474和rau565)的明视野显微照片。在实验前将耐药细胞从曲妥珠单抗中取出4周。比例尺=200μm。(d)用曲妥珠单抗(0.1μm)处理72小时后评估曲妥珠单抗对亲本细胞(skbr3,bt474和au565)和耐药细胞(rskbr3,rbt474和rau565)的抑制作用小时。在实验前将耐药细胞从曲妥珠单抗中取出4周。进行cck-8测定以评估细胞活力。(e-g)用载体或曲妥珠单抗(20mg/kg,腹膜内给药)处理由亲本(skbr3,bt474和au565)和耐药细胞(rskbr3,rbt474和rau565)建立的荷瘤小鼠。每7天记录肿瘤体积,绘制肿瘤生长曲线。在实验结束时切除肿瘤并称重。
10.图3为fgfr4在her2阳性乳腺癌中高表达并且与更差的存活结果相关。
11.(a)tcga队列中不同分子亚型乳腺癌中fgfr家族成员的表达水平。除了fgfr4在her2阳性乳腺癌中的高表达外,fgfr家族成员在乳腺癌中的表达水平非常低。(b)her2阳性(tcga n=78,metabric n=220)和非her2阳性(tcga n=867,metabric n=1538)乳腺癌中的fgfr4 mrna表达。(c)在finher试验(组n=102)和cher-lob试验(组n=88)中招募的her2阳性乳腺癌患者中的fgfr4表达。在治疗前从肿瘤分析fgfr4的表达。(d)在sysucc队列中,具有(n=80)或不具有(n=252)复发的her2阳性乳腺癌样本中fgfr4的表达。数据通过对数秩检验进行分析。(e)接受者操作特征曲线描绘了fgfr4表达在预测基于曲妥珠单抗的辅助治疗后复发中的准确性。(f)fgfr4在乳腺癌各种样品中高表达的比例。
12.图4为抑制fgfr4增强了内源性和获得性耐药her2阳性乳腺癌细胞系对抗her2治疗的敏感性。
13.(a)通过qpcr在正常乳腺细胞系和具有不同亚型的乳腺癌细胞系中检测到fgfr4的表达。(b)fgfr4在亲本(skbr3,bt474和au565)和曲妥珠单抗耐药(rskbr3,rbt474和rau565)细胞系中的表达。(c)根据ctrp数据库,对拉帕替尼(一种抗her2抑制剂)具有耐药的细胞具有更高水平的fgfr4表达。敏感n=305。耐药n=298。(d)通过qpcr检查fgfr4过表达的效率。(e)用于抑制fgfr4表达的crispri方法的示意图。(f)通过qpcr分析验证了三种最有效的sgrna的抑制效率。(g)转录抑制后检测fgfr4蛋白,并在共聚焦显微镜下观察。比例尺=20μm。(h-i)用曲妥珠单抗处理后携带sg-nc或sg-fgfr4构建体的曲妥珠单抗耐药细胞(rskbr3和mda-mb-361)的剂量-反应曲线。使用通过cck-8测定确定的450nm处的吸光度值测量细胞活力。用载体(对照)处理的组定义为100%相对存活率。(i)曲妥珠单抗治疗后携带空载体或fgfr4过表达载体构建体的曲妥珠单抗敏感细胞(skbr3和bt474)的剂量-反应曲线。(j)在用载体(veh),0.5μm曲妥珠单抗(traz)和/或0.5μmroblitinib(rob,fgfr4抑制剂)处理的曲妥珠单抗耐药细胞中测量细胞活力。通过组合指数评估抗fgfr4与抗her2疗法的协同作用。(k)进行活细胞的实时监测以评估曲妥珠单抗和罗比替尼在曲妥珠单抗耐药细胞中的功效。(l)用载体或曲妥珠单抗(0.5μm)处理的rskbr3,mda-mb-361和mda-mb-453细胞的集落形成测定,其中增加浓度的roblitinib。(m)mammosphere形成测定揭示了试剂对抑制her2阳性乳腺癌干细胞的作用。比例尺=100μm。
14.图5为fgfr4抑制赋予内源性和获得性耐药细胞对抗her2治疗的敏感性。
15.(a)用曲妥珠单抗处理后携带sg-nc或sg-fgfr4构建体的曲妥珠单抗耐药细胞(mda-mb-453)的剂量-反应曲线。(b)高选择性fgfr4抑制剂roblitinib(也称为fgf-401)的分子结构。(c)在分别用载体(veh),0.5μm曲妥珠单抗(traz)和/或0.5μmroblitinib(rob,fgfr4抑制剂)处理的曲妥珠单抗敏感细胞中测量细胞活力。使用通过cck-8测定确定的
450nm处的吸光度值测量细胞活力。在第0天用载体(对照)处理的组定义为1个相对细胞活力。数据通过单因素方差分析进行分析,并进行多重比较。(d)进行活细胞的实时监测以评估曲妥珠单抗和罗比替尼在曲妥珠单抗耐药mda-mb-453细胞中的功效。(e)mammosphere形成测定揭示了fgfr4在保护her2阳性乳腺癌干细胞免受曲妥珠单抗抑制中的作用。比例尺=100μm。(f)用tdm-1处理后携带载体或fgfr4过表达构建体的敏感细胞(skbr3)的剂量-反应曲线(左)。用tdm-1处理后携带sg-nc或sg-fgfr4构建体的耐药细胞(rskbr3)的剂量-反应曲线(右)。(g)用曲妥珠单抗和帕妥珠单抗以1:1的摩尔比组合处理后携带载体或fgfr4过表达构建体的敏感细胞(skbr3)的剂量-反应曲线(左)。用曲妥珠单抗和帕妥珠单抗以1:1的摩尔比组合处理后携带sg-nc或sg-fgfr4构建体的耐药细胞(rskbr3)的剂量-反应曲线(右)。(h)用曲妥珠单抗和tucatinib以10:1的摩尔比组合处理后携带载体或fgfr4过表达构建体的敏感细胞(skbr3)的剂量-反应曲线(左)。用曲妥珠单抗和tucatinib以10:1的摩尔比组合处理后携带sg-nc或sg-fgfr4构建体的耐药细胞(rskbr3)的剂量-反应曲线(右)。使用通过cck-8测定确定的450nm处的吸光度值测量细胞活力。用载体(对照)处理的组定义为100%相对存活率。
16.图6为患者来源的模型揭示了fgfr4抑制剂在内源性和获得性抗her2耐药乳腺癌中的功效。
17.(a-h)用对照载体,曲妥珠单抗(20mg/kg,腹膜内给药),roblitinib(30mg/kg,口服)处理由rskbr3和mda-mb-361抗her2耐药细胞建立的荷瘤小鼠。或两种药剂的组合。a-b)收获的原发性肿瘤的照片。c-d)每3天记录肿瘤体积,绘制肿瘤生长曲线。e-f)在第36天拍摄的小鼠的代表性生物发光。g-h)收获的异种移植肿瘤的重量。数据表示为平均值
±
s.d.,每组n=5。(i)来自对照载体和罗布替尼组的基于mda-mb-361细胞的肿瘤的代表性h&e和ihc染色图像。(j)在sysucc中从内源性和获得性曲妥珠单抗耐药乳腺癌组织建立患者衍生的异种移植物(pdx)和患者衍生的类器官(pdo)的示意图。(k-p)用载体,曲妥珠单抗(20mg/kg,腹膜内给药),罗比替尼(30mg/kg,口服给药)或两种药剂的组合处理的pdx模型的体内实验。k-l)收获的pdx肿瘤的照片。m-n)每9天记录肿瘤体积,绘制肿瘤生长曲线。o-p)收获的pdx肿瘤的重量。数据表示为平均值
±
s.d.,每组n=3。(q)用对照载体,曲妥珠单抗,罗布替尼或两种药剂的组合治疗的患者衍生的类器官的代表性图像。(r)已建立的患者来源的类器官的组织学图像。比例尺=50μm。(s)用相应试剂处理的患者衍生的类器官的细胞活力测定。
18.图7为患者来源模型揭示了fgfr4抑制剂罗布替尼在曲妥珠单抗耐药her2阳性乳腺癌中具有安全性的有效功效。
19.(a)来自对照载体和罗布替尼组的基于rskbr3细胞的肿瘤的代表性h&e和ihc染色图像。(b-c)在载体和罗布替尼组中通过h评分法定量ihc染色。数据表示为平均值
±
s.d.,每组n=5。(d-e)通过tunel和h&e染色检测,roblitinib在该剂量下对肝脏没有明显毒性,这表明临床应用的安全性。(f)通过ihc染色验证her2表达以确认her2阳性乳腺癌类器官的起源。比例尺=20μm。
具体实施方式
20.为让本领域的技术人员更加清晰直观的了解本发明,下面将结合附图,对本发明
作进一步的说明。
21.研究方法
22.患者样本采集
23.本研究经中山大学肿瘤防治中心机构研究伦理委员会批准,并在赫尔辛基宣言的指导下进行。回顾性分析了本中心从2010年至2020年期间从332名患者中收集了使用抗her2药物辅助治疗的her2阳性原发浸润癌乳腺癌样本。在手术获得组织样本后,使用标准方法进行福尔马林固定和石蜡包埋。从每位患者收集乳腺肿瘤组织核心并用于构建组织芯片用于进一步验证。通过免疫组织化学(ihc)确定分子亚型,如果ihc结果为中等阳性,则通过荧光原位杂交(fish)进一步确认her2状态。没有详细积极随访的患者被排除在外。总生存期(os)定义为从诊断之日起至任何原因死亡或最后一次随访之日的时间。无复发生存期(rfs)定义为从诊断日期到首次复发或最后一次随访日期的时间。对于来自新辅助治疗患者的标本,从36名乳腺癌患者获得her2阳性肿瘤样品,然后根据nccn指南使用基于曲妥珠单抗的方案和紫杉烷进行术前新辅助化疗。病理完全反应(pcr)定义为在手术期间对原发性肿瘤进行显微镜检查时不存在浸润性肿瘤细胞。实体瘤版本1.1(recist 1.1)中的响应评估标准用作评估肿瘤对治疗方案的响应的标准。从所有受试者获得知情同意。
24.细胞系和试剂
25.人乳腺癌细胞系(mda-mb-453,mda-mb-361,skbr3,bt474,au565,mcf-7,t47d,zr-75-1,mda-mb-231,bt549,mda-mb-468和sum-159),正常乳腺上皮mcf-10a细胞系和hek293t细胞系购自american type culture collection并按照制造商的说明进行培养。通过三个月的暴露并用1μm曲妥珠单抗进行选择来开发rskbr3,rbt474和rau565细胞。将这些获得的曲妥珠单抗耐药细胞系在含有曲妥珠单抗的常规培养基中连续培养,曲妥珠单抗在实验前四周取出。将细胞系传代不超过六个月,并通过str分析进行鉴定。任何细胞系均未发现支原体感染。曲妥珠单抗,帕妥珠单抗,tdm-1获自roche(basel,switzerland)。图卡替尼(t2364)购自topscience。fgfr4选择性抑制剂罗比替尼(roblitinib/fgf-401,hy-101568)购自medchemexpress。
26.crispr/cas9文库体外和体内筛选耐药基因
27.将总共2.4亿个曲妥珠单抗耐药rskbr3细胞接种到20个15cm平板中并用geckov2.0慢病毒文库感染。moi为0.3的人类慢病毒文库(覆盖率超过300倍),以确保大多数细胞仅吸收一种稳定的短指导rna(sgrna)。感染后24小时,将嘌呤霉素(1μg/ml)添加到细胞中,并在培养物中保持4天。然后,将细胞以相同的密度分成四组。在这四组中,两组用于体外筛选,两组用于体内筛选。用载体或曲妥珠单抗(1μm用于体外筛选;20mg/kg用于体内筛选)处理突变的曲妥珠单抗耐药rskbr3细胞2周。药物选择后,每组收集细胞和肿瘤,并使用dna提取试剂盒(omega,d3396)分离基因组dna。通过pcr扩增sgrna的序列,并在测序之前纯化产物。使用mageck分析从sgrna筛选测序结果中鉴定耐药基因。mageck算法可以通过比较曲妥珠单抗处理的细胞/肿瘤中的sgrna与载体处理的细胞/肿瘤中的sgrna来优先考虑耐药基因。简而言之,将来自不同样品的每个sgrna的读数计数标准化以调整文库大小和读数计数分布的影响。随后通过使用稳健等级聚集(rra)寻找sgrna始终排名较高的基因来鉴定耐药基因。具有较小rra值的基因在敲除筛选中排名较高。
28.rna分离,定量实时pcr(qpcr)和测序分析
29.trizol试剂(invitrogen)用于从细胞和组织中提取总rna。逆转录完成后,使用sybr green试剂盒(takara,rr420a)在bio-rad cfx96上通过qpcr一式三份检查rna表达水平。使用trizol试剂(invitrogen)从sg-nc或sg-fgfr4组的rskbr3乳腺癌细胞(2
×
106)中提取总rna用于测序分析。在评估rna完整性后,通过capitalbio technology(中国北京)生成mrna文库并测序。用于illumina的neb next ultra rna文库制备试剂盒(neb)用于构建用于测序的文库。所有下一代测序实验均在illumina novaseq测序仪(illumina)上进行。随后筛选出差异表达的基因(deg),并用|log2fc|》1和fdr《0.05的标准进行鉴定。david工具用于进行基因本体论(go)和京都基因和基因组百科全书(kegg)途径富集分析。使用gsea4.1.0桌面应用程序,应用基因集富集分析(gsea)来鉴定两组之间显着富集的途径。
30.免疫组织化学(ihc)和苏木精-伊红(h&e)染色
31.如前所述,使用石蜡包埋的组织进行ihc染色。将具有组织的切片载玻片在二甲苯中脱蜡,并通过梯度乙醇(100%,95%,85%和75%的稀释度)再水化。在与一抗在4℃孵育过夜之前,先进行内源性过氧化物酶活性的阻断和抗原修复。然后在室温下与二抗(hrp偶联)孵育20分钟后,用二氨基联苯胺(dab)底物(dako)进行染色。dab处理后使用苏木精染色切片。使用的抗体列于补充表6中。将每个切片的染色强度评分为0(无染色),1 (弱染色),2 (中度染色)或3 (强染色),并且从五个不同的随机区域确定阳性细胞的百分比。使用h评分法(评分范围,0至300)来量化表达。从0到200的h-score被认为是低表达,并且从201到300的h-score被指定为高表达。对于h&e染色,将切片浸入苏木精中3分钟,用水洗涤30分钟,并用曙红染色3分钟。在不同浓度的乙醇中脱水后,用盖玻片覆盖载玻片。染色的载玻片在光学显微镜(nikon eclipse80i)下成像。
32.细胞活力和集落形成测定
33.使用cell counting kit-8试剂盒(dojindo,japan)评估细胞活力。简而言之,将1
×
103个细胞接种到96孔板中。在特定日期将与培养基混合的cck-8溶液(10μl)加入到每个孔中。在37℃温育2小时后,使用微量滴定板读数器测量450nm处的吸光度。compusyn软件用于评估fgfr4和her2抑制的协同作用。如果组合指数(ci)低于值1,则指示合成致死效应。对于集落形成测定,将1
×
10 3
个细胞接种在24孔板中。24小时后,将不同浓度的药物加入特定孔中以测试细胞的敏感性。将细胞集落用甲醇固定并在拍照前用0.3%结晶紫染色。
34.乳腺癌干细胞球形成测定
35.如前所述进行球囊形成测定。将总共5
×
103个细胞重悬含有b27补充物(gibco),碱性成纤维细胞生长因子(bfgf)(invitrogen),egf(invitrogen)和胰岛素(sigma)的dmem/f-12培养基(gibco)中,并置于超低粘附6孔板中。将细胞培养7天,计数直径》100μm的乳腺球。
36.载体的构建和转染
37.对于fgfr4的crispri抑制,我们使用基于慢病毒的质粒(addgene,#71236)构建了靶向fgfr4启动子序列和dcas9-krab融合蛋白的sgrna。通过sanger测序验证所有载体的序列。使用lipofectamine 3000(invitrogen)转染细胞。
38.患者来源的类器官(pdo)培养和药物敏感性测定
39.切除新鲜乳腺癌组织并在定轨摇床上用2mg/ml胶原酶(sigma)在37℃下消化2-6小时。离心并重悬细胞后,将它们接种在matrigel(corning,356255)中。进入24孔板并用由
advanced dmem/f12(gibco),b27补充物(gibco),hepes(sigma),glutamax(gibco),烟酰胺(sigma),y-27632(abmole),n-乙酰半胱氨酸(sigma),a83-01(tocris),sb202190(sigma),r-spondin 1(r&d),碱性成纤维细胞生长因子(bfgf)(invitrogen),egf(invitrogen),noggin(r&d)和青霉素/链霉素(gibco)。培养1-3周后,计数并传代乳腺癌类器官的数量。对于药物敏感性测定,使用celltiter-glo 3d试剂(promega,g9682)测量atp作为活细胞的代表。用3d试剂裂解细胞后,将板在室温下振荡30分钟,并检测发光。
40.动物药敏实验
41.四周龄雌性balb/c裸鼠和nod-scid小鼠购自beijing vital river laboratories animal technology。将与1:1基质胶(corning,356237)混合的荧光素酶标记的rskbr3和mda-mb-361细胞(1
×
10 7
个细胞)皮下注射到小鼠的脂肪垫中。在肿瘤可触知后,将小鼠随机分成四组(每组五只小鼠),并用对照载体,曲妥珠单抗(20mg/kg,腹膜内给药),roblitinib(30mg/kg,口服给药)或两种药物的组合。每3天测量一次肿瘤体积,根据公式体积=长
×
宽2/2估算体积。为了显现肿瘤大小,在成像前10分钟将150mg/kg d-荧光素钾盐(att bioquest)腹膜内注射到小鼠中。在实验结束时处死小鼠,切除异种移植物,称重并拍照。为了构建pdx模型,将来自患者的新鲜乳腺癌样品皮下接种到nod-scid小鼠中。当建立的pdx达到约500mm 3
时,将肿瘤移植到其他小鼠。在肿瘤可触及后,将小鼠随机分组以试验曲妥珠单抗和roblitinib单独或联合使用的治疗效果。在中山大学肿瘤防治中心的动物设施中将所有小鼠保持在无特定病原体的条件下。将它们保持在具有12小时明暗循环的动物室中,温度为20-22℃,湿度为40-70%。最大允许肿瘤直径为15mm。肿瘤重量不超过小鼠体重的10%。所有动物程序均由中山大学肿瘤防治中心的机构动物护理和使用委员会(iacuc)批准。
42.统计方法
43.所有实验至少进行三次,用于免疫荧光染色,免疫组织化学染色,乳腺球形成测定,蛋白质印迹测定和dna琼脂糖凝胶印迹,显示了代表性图像。使用spss 25.0软件分析数据。未配对的学生t检验用于分析两组之间的差异。使用单向anova分析多组之间的比较。生存曲线由kaplan-meier图描述,并与对数秩检验进行比较。结果表示为平均值
±
标准偏差。所有箱形图表示中位数,第25和第75百分位数,以及最小和最大值。p《0.05被认为具有统计学意义。
44.研究结果
45.一、全基因组crispr筛选将fgfr4鉴定为乳腺癌中抗her2耐药的关键基因
46.基于曲妥珠单抗的抗her2方案是her2阳性乳腺癌治疗的标准治疗方式。因此,我们通过在体外将曲妥珠单抗敏感的her2阳性乳腺癌细胞系skbr3,bt474和au565连续暴露于曲妥珠单抗3个月来产生抗her2耐药细胞(图2a)。抗her2耐药细胞系rskbr3,rbt474和rau565对曲妥珠单抗和未受干扰的增殖显示出比其各自亲本细胞系更高的ic 50值(图2b)。用载体或曲妥珠单抗处理的培养的亲本细胞和耐药细胞的明场显微照片显示在图2c中。在停用曲妥珠单抗四周后,产生的rskbr3,rbt474和rau565细胞保持稳定的抗her2耐药(图2d)。此外,体内实验证实耐药细胞系对曲妥珠单抗治疗具有显著的耐受性(图2e-g)。为了鉴定曲妥珠单抗耐药乳腺癌细胞的脆弱性,我们用含有靶向20914个人基因的123411个sgrna的sgrna慢病毒文库对rskbr3细胞进行了全基因组crispr筛选(图1a)。为了确保功能
丧失遗传筛选的准确性,进行了体外和体内选择。在该筛选策略中,携带对生存力至关重要的sgrna靶向基因的细胞将在曲妥珠单抗治疗条件下(即耐药基因)耗尽。高通量筛选后,分别在体外和体内选择后鉴定出1052个基因和1032个基因。其中,已报道了几种已鉴定的基因(igf1r,src,pik3ca,ctnnb1,ccne1,foxm1,cdk12等)。在先前的研究中作为稳健的抗her2耐药基因,证实了我们筛选方法的适用性。这些耐药基因的功能和途径富集分析在metascape中进一步进行,其中fgfr信号传导是参与抗her2耐药的最重要途径之一(图1b)。作为fgfr信号传导途径的核心家族成员之一,fgfr4在体外和体内筛选中排名很高(图1c)。fgfr4是可药物靶标;为这种蛋白质开发的一流的高选择性和有效抑制剂是roblitinib(fgf-401)。roblitinib在ii期临床试验中显示出有希望的临床疗效和有利的安全性,用于治疗具有高fgfr4表达的肝细胞癌和实体瘤。因此,我们选择fgfr4进行进一步研究,以验证其是否可以成为克服乳腺癌中抗her2耐药的靶标。根据tcga和metabric数据库,fgfr4 mrna在her2阳性乳腺癌中高度过表达(图1d和图3a-b)。在抗her2辅助治疗和新辅助治疗后,fgfr4在复发组(finher试验)和非病理完全缓解(非pcr)组(cher-lob试验)中高表达(图3c))。在sysucc队列中接受辅助抗her2治疗的332例her2阳性乳腺癌中检测到fgfr4表达(图1e)。在sysucc队列中,fgfr4的高表达与较差的无复发生存期和总生存期相关(图1f)。高fgfr4肿瘤患者术后复发率较高(图1g和图3d-e)。进一步的单变量和多变量cox回归分析显示fgfr4表达是her2阳性乳腺癌患者的独立危险因素。为了验证fgfr4在晚期乳腺癌中的表达水平,我们收集了来自不同复发或转移部位的标本。与原发性乳腺癌相比,转移性肿瘤显示出更高的fgfr4表达,尤其是乳腺癌的脑转移(图1h-i和图3f)。为了检查fgfr4表达是否与内在的抗her2耐药相关,我们使用在施用基于抗her2的新辅助疗法之前获得的36个her2阳性乳腺癌活组织检查进行ihc染色(图1j)。非pcr肿瘤患者的fgfr4表达高于pcr肿瘤患者(图1k-l)。另外,接受者操作特征曲线表明fgfr4表达可用作新辅助抗her2治疗前pcr的预测因子(图1m)。
47.二、抑制fgfr4增强了耐药her2阳性乳腺癌细胞系对抗her2治疗的敏感性
48.fgfr4 mrna在正常乳腺上皮细胞(mcf-10a)和三阴性乳腺癌细胞系中以低水平表达(图4a)。与抗her2敏感的her2阳性细胞系(skbr3,bt474和au565)相比,本质上抗her2耐药her2阳性细胞系(mda-mb-453和mda-mb-361)具有更高的fgfr4表达水平(图4a)。一致地,获得的抗her2耐药her2阳性细胞系(rskbr3,rbt474和rau565)中的fgfr4 mrna水平显着高于其相应的亲本细胞系(图4b)。根据癌症治疗反应门户(ctrp)数据库,对拉帕替尼(抗her2抑制剂)具有耐药的细胞具有更高水平的fgfr4表达(图4c)。为了探索fgfr4在驱动抗her2耐药中的作用,我们在抗her2敏感的乳腺癌细胞中建立了fgfr4过表达模型(图4d)。为了更好地模拟小分子抑制剂的作用,使用dcas9-krab crispri技术抑制抗her2耐药细胞中的fgfr4表达(图4e)。通过qpcr和免疫荧光分析验证,crispri的转录抑制在抑制fgfr4表达方面具有极高的效率(图4f-g)。作为抗her2方案的基础,在fgfr4干预后评估曲妥珠单抗敏感性。在具有内在(mda-mb-453和mda-mb-361)或获得性(rskbr3)耐药(图4h和5a)的细胞中抑制fgfr4后,曲妥珠单抗耐药显着逆转。此外,fgfr4的外源性过表达赋予skbr3和bt474细胞系对曲妥珠单抗的耐药(图4i)。roblitinib是一种fgfr4选择性抑制剂,用于进一步评估(图5b)。roblitinib对曲妥珠单抗耐药细胞表现出有效的抗肿瘤作用(图4j和图5c)。另外,曲妥珠单抗和roblitinib的组合在曲妥珠单抗耐药细胞中显示出协同效应,组合指数低于
值1(图4j)。实时监测进一步证实了曲妥珠单抗和roblitinib在治疗曲妥珠单抗耐药的her2阳性乳腺癌细胞中的联合作用(图4k和图5d)。用曲妥珠单抗和roblitinib共同处理导致以浓度依赖性方式显着降低具有内在或获得性耐药的细胞中的集落形成(图4l)。该组合降低了干细胞的特性,形成乳腺球的能力,表明它减少了干细胞,这与复发/转移有关。(图4m和图5e)。接下来,我们进一步研究了fgfr4对目前临床中使用的其他抗her2药物敏感性的影响。曲妥珠单抗emtansine(tdm-1)是一种抗体-药物偶联物(adc),被批准作为her2阳性转移性乳腺癌的第二线治疗。fgfr4的外源性过表达降低了skbr3细胞系对tdm-1的敏感性,而fgfr4抑制增加了rskbr3细胞系对tdm-1处理的敏感性(图5f)。曲妥珠单抗加培妥珠单抗策略是目前her2阳性乳腺癌辅助治疗、新辅助治疗和转移治疗的护理标准。作为靶向her2的酪氨酸激酶抑制剂,tucatinib与曲妥珠单抗一起用于转移性her2阳性乳腺癌。我们发现fgfr4降低了her2阳性乳腺癌对曲妥珠单抗加帕妥珠单抗或tucatinib的敏感性(图5g-h)。因此,抑制fgfr4可能是增加对乳腺癌中多种抗her2策略的敏感性的策略。
49.三、患者来源的模型揭示了fgfr4抑制剂在内源性和获得性抗her2耐药乳腺癌中的疗效
50.在内源性和获得性曲妥珠单抗耐药乳腺癌模型中进一步验证了fgfr4抑制剂roblitinib的抗肿瘤功效。首先,用载体,曲妥珠单抗,roblitinib或组合药剂处理携带rskbr3和mda-mb-361肿瘤的小鼠(图6a-b)。与曲妥珠单抗治疗组相比,roblitinib治疗组肿瘤体积减小。曲妥珠单抗和罗比替尼的组合显示在曲妥珠单抗耐药乳腺癌中具有协同抗肿瘤作用(图6c-h)。如ihc染色所示,fgfr4抑制显着降低p-gsk-3β,活性β-catenin,slc7a11,fpn1和细胞增殖标志物ki67的水平(图6i和图7a-c)。为了更好地验证roblitinib的功效,建立了患者衍生的异种移植物(pdx)和类器官(pdo)模型(图6j)。其中,一种成功的培养模型来源于基于曲妥珠单抗的新辅助治疗后获得的非pcr乳腺癌组织标本,这反映了内在抗her2耐药乳腺癌的生物学特征。另一个代表获得性抗her2耐药乳腺癌的模型是在辅助曲妥珠单抗治疗18个月后发现的肝转移患者中建立的。与载体,曲妥珠单抗和roblitinib组相比,来自组合治疗(曲妥珠单抗和roblitinib)组的组织的肿瘤体积和重量显着降低(图6k-n)。此外,我们检查了药物对小鼠肝脏的毒性(图7d-e)。接下来,我们评估了roblitinib克服类器官中抗her2耐药的作用(图6q-r)。为了排除肝细胞和正常乳腺上皮细胞污染的可能性,在实验前将患者来源的类器官验证为her2过表达乳腺癌类器官(图7f)。曲妥珠单抗和罗比替尼的组合显着减弱了已建立的曲妥珠单抗耐药乳腺癌类器官的生长(图6s)。总之,这些发现表明fgfr4抑制可以恢复耐药乳腺癌细胞对抗her2的敏感性。抗her2和抗fgfr4的组合可能是针对内在和获得性耐药乳腺癌的广泛有效的疗法。
51.结论
52.1.全基因组crispr筛选确定fgfr4是乳腺癌中抗her2耐药性的关键耐药基因
53.术后检测组织fgfr4表达量,可以预测anti-her2辅助治疗后病人的复发风险、总生存期;
54.术前检测组织fgfr4表达量,可以预测anti-her2新辅助治疗后病人的完全缓解率。
55.2.抑制fgfr4可增强耐药her2阳性乳腺癌细胞株对抗her2治疗的敏感性
56.在耐药乳腺癌细胞中敲低fgfr4,可以逆转耐药,使其对anti-her2治疗恢复敏感
性;
57.使用fgfr4抑制剂(roblitinib),可以逆转耐药,使其对anti-her2治疗恢复敏感性。
58.3.m6a低甲基化介导了fgfr4在抗her2耐药乳腺癌中的上调
59.发现耐药细胞中m6a甲基化水平下降,导致fgfr4 mrna的稳定性增加,fgfr4表达量上调。
60.4.fgfr4磷酸化gsk-3来调节β-catenin/tcf信号,并驱动抗her2耐药性
61.5.患者来源的模型显示,使用fgfr4抑制剂roblitinib可以增加抗her2耐药乳腺癌对her2抑制剂的敏感性
62.(采用pdx、类器官模型,证实fgfr4抑制剂(roblitinib),可以逆转耐药,使其对anti-her2治疗恢复敏感性)。
63.上述对实施例的描述是为便于该技术领域的普通技术人员能理解和应用本发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于这里的实施例,本领域技术人员根据本发明的揭示,对于本发明做出的改进和修改都应该在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。