用于处理生物样品的试剂盒及其装置和方法
相关申请的交叉引用
1.本技术要求于2019年10月2日提交的第62/909,476号美国临时申请的优先权,该美国临时申请的内容通过引用的方式以其全文结合于此。
技术领域
2.本公开文本总体上涉及用于处理独立试剂盒中的固体生物组织样品的系统和方法,更具体地说,用于使用超声波能量从独立式试剂盒中的生物组织样品中分离单细胞。
背景技术:
3.从固体生物组织样品中分离单细胞的传统方法要求使用蛋白水解酶,在37℃温育和机械破坏以消化或破坏细胞粘附分子和/或潜在的细胞外基质。例如,机械破碎可包括手动研磨(例如,在移液管内上下移动碎组织)或机械混合器/破碎器(例如,miltenyi gentlemacs
tm
分离器),然后离心并将处理过的组织样品通过过滤器倒入,以除去酶并在细胞悬浮液(例如,水性悬浮液)中回收分离的活细胞。
4.然而,使用酶和机械破坏来进行细胞分离效率低,并导致感兴趣的细胞群的高损失或降解。例如,由于移液、离心和过滤处理的物理应力,以及在组织样品从一个容器转移到另一个容器进行处理期间,许多细胞损失或破裂(即不再完整)。此外,由于使用的酶、使用的酶的浓度、处理温度和使用这些酶所需的长孵育时间,活细胞群会损失。酶解引起的应激也导致原组织样品中不存在的促炎和应激诱导基因的上调。因此,分离的感兴趣细胞的基因表达谱通常不同于原始组织样品的基因表达谱。
5.目前的细胞分离方法也通常是手动过程,要求用户将组织样品从一个容器转移到另一个容器,以获得活的分离细胞。例如,用户可能需要在第一容器中混合酶和生物组织样品,将混合物转移到第二容器以执行机械破碎以获得分离的细胞,然后将混合物从第二容器转移到第三容器以过滤混合物以获得感兴趣的活细胞。转移混合物的过程使组织样品暴露在环境污染中,这可能会使实验或测试不准确。
技术实现要素:
6.如上所述,使用酶和机械干扰物从生物组织样品中分离单细胞是次优的,并导致感兴趣的细胞群的高损失或降解。因此,需要用于改进细胞分离同时保留从组织样品分离的活细胞的基因表达谱的系统、方法和技术。
7.在一些实施方案中,代替使用酶来执行细胞分离,可以使用超声波处理装置将超声波能量引导到组织样品以执行细胞分离。这种方法消除了上面讨论的关于使用酶的缺点。虽然与酶分离相比,使用基于超声波能量的分离方法可以提高分离细胞的质量和数量,但由于在将超声波能量施加到组织样品之前和之后需要在其他装置中执行必要的样品处理步骤,所取得的结果受到限制。
8.特别是,传统的液体处理技术需要集成,以完成从固体组织样品到悬浮细胞的工
作流程,以便安全地转移到下游的细胞分离和分析技术。这些常规技术包括在开放式培养皿中绞碎组织样品,在分离之前移液绞碎的组织,以及移液(例如,抽吸和分配)分离的样品连同酶或化学试剂,以及在各种容器、离心机、冰浴、仪器和过滤装置之间运送样品,以在清洁悬浮液中分离感兴趣的细胞。如上所述,传统的液体处理技术是时间密集的,并将组织样品暴露于环境污染。
9.在一些实施方案中,一种用于处理固体生物组织样品的改进的系统包括独立式试剂盒设备,所述试剂盒设备被配置成装载组织样品,使超声波能量能够从悬浮液中的组织样品中分离单个细胞,并从悬浮液中收集感兴趣的活细胞,而无需使用移液管、离心或酶、加热和延长的处理时间。通过在独立式试剂盒设备内执行细胞分离和活细胞收集过程,改进的系统实现了更高质量的结果,因为分离的细胞不暴露于外部环境。此外,由于在试剂盒设备中不使用酶,因此试剂盒设备中分离细胞的基因表达谱与自然组织(即最初装载到试剂盒设备中的组织样品)的基因表达谱密切一致。
10.在一些实施方案中,一种用于从固体生物组织样品中分离单细胞的设备包括:壳体单元,其被配置成使所述设备能够装载到超声波处理装置中;第一室,其被配置成接收所述固体生物组织样品和水性流体,其中当所述设备装载在所述处理装置中时,所述第一室与所述处理装置的换能器组件对齐,以使所述处理装置施加的超声波能量能够将细胞从所述生物组织样品中分离出来,从而产生水性悬浮液;将所述第一室流体地连接到第二室的通道;和所述第二室,其被配置成收集从所述第一室流过所述通道的所述水性悬浮液中的经分离的细胞。
11.在一些实施方案中,所述第二室可从所述设备上拆卸。
12.在一些实施方案中,所述第一室包括第一入口,用于从所述设备外部接收所述固体组织样品和所述水性流体。在一些实施方案中,所述第一室包括盖子,以将所接收的固体组织样品和所述水性流体相对于外部环境密封。
13.在一些实施方案中,所述第一室包括底表面,所述底表面是导声的,以使所述超声波能量进入所述第一室以将细胞从所述生物组织中分离。在所述设备的一些实施方案中,所述底表面包括平坦层,所述平坦层被配置成当所述设备被装载在所述处理装置中时耦接到所述换能器组件。
14.在一些实施方案中,所述水性流体包括细胞培养基溶液。
15.在一些实施方案中,所述设备包括连接器部件,其耦接到所述通道并配置成与所述处理装置的致动装置连接,其中所述致动装置被配置成控制流体通过所述通道的流动。在一些实施方案中,所述致动装置包括泵或柱塞。在一些实施方案中,所述连接器部件包括配置成连接所述通道和所述致动装置的配件或适配器。
16.在一些实施方案中,所述设备包括阀,其被定位在所述通道中并被配置成由所述处理装置的致动装置控制以控制通过所述通道的流体流动。
17.在一些实施方案中,所述设备包括第三室,所述第三室包括用于将第二水性流体接收到所述设备内部的第三入口。在一些实施方案中,所述设备包括通道,所述通道将所述第三室流体地耦接到所述第一室,以使所述第二水性流体流入所述第一室。
18.在一些实施方案中,所述设备包括将所述第一室连接到所述第二室的一系列两个或更多个过滤室,其中所述通道包括多个子通道,所述多个子通道流体地连接所述一系列
两个或更多个过滤室中的相继的室,以使所述水性流体从所述第一室流到所述第二室。在所述设备的一些实施方案中,所述两个或更多个过滤室被配置成当所述水性流体流过所述多个子通道时捕获所述水性流体中的流出物质,以使靶组分能够被收集在所述第二室中。在一些实施方案中,所述流出物包括非靶组分、细胞碎片和细胞外碎片。
19.在一些实施方案中,来自所述两个或更多个过滤室的过滤室包括一个或多个标记珠,所述标记珠被配置成结合到所述流出物质上以防止所述流出物质流过所述过滤室。
20.在一些实施方案中,来自所述两个或更多个过滤室的过滤室被配置成当所述设备被装载在所述处理装置中时与所述处理装置的第二换能器组件对准,并且其中所述过滤室包括底表面,所述底表面将所述过滤室与所述第二换能器组件声学地耦接,以接收来自所述处理装置的超声波能量,以促进所述靶组份的选择性流动。
21.在一些实施方案中,所述第二室被配置成收集所述细胞内或细胞外靶分析物,并且其中所述设备包括单向通道,其流体地将所述第二室连接到所述第一室以使水性流体回流到所述第一室。
22.在一些实施方案中,所述多个子通道配置成允许所述水性流体回流通过所述一系列的两个或更多个过滤室而不回流到所述第一室中。
23.在一些实施方案中,一种用于从固体生物组织样品中分离单细胞的方法包括:将所述固体生物组织样品和水性液体引入试剂盒设备的第一室;将所述试剂盒设备装载到超声波处理装置中,其中所述第一室与所述处理装置的换能器组件对齐;激活所述超声波处理装置以施加来自所述换能器组件的超声波能量,以超声地将细胞从所述组织样品中分离,从而在所述第一室中产生水性悬浮液;以及控制所述水性悬浮液从所述试剂盒设备的所述第一室流向所述第二室,其中所述第二室被配置成收集所述水性悬浮液中的经分离的细胞。
24.在一些实施方案中,所述方法包括绞碎所述第一室内的所述组织样品。在一些实施方案中,绞碎组织样品包括将杵具和臼具插入所述容器中;以及使用插入的杵具和臼具绞碎所述组织样品。
25.在一些实施方案中,所述方法包括将所述第二室与所述试剂盒设备分离。
26.在一些实施方案中,所述方法包括经由所述第一室的第一入口接收来自所述设备外部的所述固体组织样品和所述水性流体。
27.在一些实施方案中,所述第一室包括盖子,并且所述方法包括通过关闭所述盖子将所接收的固体组织样品和所述水性流体相对于外部环境密封。
28.在一些实施方案中,所述第一室包括底表面,所述底表面是导声的,以使所述超声波能量进入所述第一室以将细胞从所述生物组织中分离。在一些实施方案中,所述底表面包括平坦层,并且所述方法包括当所述试剂盒设备被装载在所述处理装置中时,将所述试剂盒设备的平坦层耦接到所述换能器组件。
29.在一些实施方案中,所述水性流体包括细胞培养基溶液。
30.在一些实施方案中,所述试剂盒设备包括耦接到所述通道的连接器部件,并且所述方法包括使用所述连接器部件将所述通道与所述处理装置的致动装置连接,其中所述致动装置被配置成控制流体通过所述通道的流动。在一些实施方案中,所述致动装置包括泵或柱塞。在一些实施方案中,所述连接器部件包括配置成连接所述通道和所述致动装置的
配件或适配器。
31.在一些实施方案中,所述试剂盒设备包括定位在所述通道中的阀,并且所述方法包括通过所述处理装置的致动装置操作所述阀以控制通过所述通道的流体流动。
32.在一些实施方案中,所述试剂盒设备包括第三室,所述第三室包括第三入口,并且所述方法包括经由所述第三入口将第二水性流体接收到所述设备的内部。
33.在一些实施方案中,所述方法包括经由通道将所述第三室流体地耦接到所述第一室,以使所述第二水性流体流入所述第一室。
34.在一些实施方案中,所述试剂盒设备包括将所述第一室连接到所述第二室的一系列两个或更多个过滤室,并且其中所述通道包括多个子通道,所述多个子通道流体地连接所述一系列两个或更多个过滤室中的相继的室,以使所述水性流体从所述第一室流到所述第二室。
35.在一些实施方案中,所述方法包括当所述试剂盒设备装载在所述处理装置中时,将来自所述两个或更多个过滤室的过滤室与所述处理装置的第二换能器组件对准,其中所述过滤室包括底表面,所述底表面将所述过滤室与所述第二换能器组件声学地耦接,以接收来自所述处理装置的超声波能量,以促进所述靶组份的选择性流动。
36.在一些实施方案中,一种用于增强从固体生物组织样品中分离活细胞的过滤器装置包括:管状体,其被配置成可伸缩地插入到容纳有水性流体中的生物组织样品的容器中;以及覆盖所述管状体的底部开口的细胞过滤网,其中所述细胞过滤网被配置成当所述过滤器装置完全插入所述容器中时压缩所述生物组织样品以从所述组织样品中排出细胞。
37.在一些实施方案中,所述细胞被排出到周围的水性流体中,所述水性流体通过所述细胞过滤网流入所述管状体的中心。
38.在一些实施方案中,所述过滤器装置包括输送通道,其将流入所述管状体中心的排出细胞输送到收集室。在一些实施方案中,所述输送通道包括在所述管状体内部并沿着所述管状体的长度延伸的管。
39.在一些实施方案中,当所述管状体完全插入到所述容器中时,所述管状体的下部浸没在所述容器中,并且其中所述下部包括由一个或多个对应的细胞过滤网覆盖的一个或多个开口。
40.在一些实施方案中,所述细胞被排出到周围的水性流体中,所述水性流体通过与所述下部的一个或多个开口相对应的所述一个或多个细胞过滤网流入所述管状体的中心。
41.在一些实施方案中,所述管状体被配置成延伸到所述容器中至多预定距离,以使所述细胞过滤网能够压缩所述生物组织样品。
42.在一些实施方案中,所述管状体包括凸起部分,所述凸起部分防止所述管状体延伸到所述容器中超过所述预定距离。
43.在一些实施方案中,所述容器包括位于所述容器底部的止挡材料,所述止挡材料防止所述管状体延伸到所述容器中超过所述预定距离。在一些实施方案中,止挡材料包括海绵、橡胶、或塑料。
44.在一些实施方案中,所述生物组织样品在被所述细胞过滤网压缩之前被超声分解成细胞。
45.在一些实施方案中,所述生物组织样品在被所述细胞过滤网压缩之前被酶解成细
胞。
46.在一些实施方案中,所述容器对应于试剂盒设备的反应室。
47.在一些实施方案中,一种用于增强从固体生物组织样品中分离活细胞的方法包括:将所述过滤器装置的管状体伸缩地插入容纳有水性流体中的生物组织样品的容器中,其中所述过滤器装置包括覆盖所述管状体的底部开口的细胞过滤网;将所述过滤器装置的管状体完全插入所述容器中,以用所述细胞过滤网压缩所述生物组织样品,其中所述细胞过滤网压缩所述生物组织样品以将细胞从所述组织样品中排出。
48.在一些实施方案中,所述方法包括:从所述容器中抽出所述过滤器装置的管状体;以及反复执行所述过滤器装置的管状体的完全插入和抽出,以反复压缩所述生物组织样品,以增加排出的细胞量。
49.在一些实施方案中,所述细胞被排出到周围的水性流体中,所述水性流体通过所述细胞过滤网流入所述管状体的中心。
50.在一些实施方案中,所述方法包括将流入所述管状体中心的排出细胞输送到收集室。在一些实施方案中,所述输送通道包括在所述管状体内部并沿着所述管状体的长度延伸的管。
51.在一些实施方案中,所述方法包括当所述管状体完全插入所述容器中时,将所述管状体的下部浸没在容器中,其中所述下部包括由一个或多个对应的细胞过滤网覆盖的一个或多个开口。
52.在一些实施方案中,所述细胞被排出到周围的水性流体中,所述水性流体通过与所述下部的一个或多个开口相对应的所述一个或多个细胞过滤网流入所述管状体的中心。
53.在一些实施方案中,所述方法包括将管状体延伸到容器中至多预定距离,以使细胞过滤网能够压缩生物组织样品。
54.在一些实施方案中,所述管状体包括凸起部分,所述凸起部分防止所述管状体延伸到所述容器中超过所述预定距离。
55.在一些实施方案中,所述容器包括位于所述容器底部的止挡材料,所述止挡材料防止所述管状体延伸到所述容器中超过所述预定距离。在一些实施方案中,止挡材料包括海绵、橡胶、或塑料。
56.在一些实施方案中,所述方法包括在伸缩地插入所述过滤器的管状体以通过所述细胞过滤网压缩所述组织样品之前,超声地将所述组织样品分离成细胞。
57.在一些实施方案中,所述方法包括在伸缩地插入所述过滤器的管状体以通过所述细胞过滤网压缩所述组织样品之前,将所述组织样品酶解成细胞。
58.在一些实施方案中,所述容器对应于试剂盒设备的反应室。
59.在一些方面,本文提供了一种用于从生物样品中分离和获得分开的单个细胞的试剂盒,所述试剂盒包括:(a)样品处理单元,其包括:可密封端口,其被配置成接收所述生物样品以引入所述样品处理单元;样品室,其被配置成收集所述生物样品;以及绞碎器,其中所述绞碎器被配置成与所述样品室接口;(b)反应单元,其包括配置成接收超声波能量的反应室,其中所述样品处理单元与所述反应单元经由第一通道连接;(c)过滤单元,其包括:过滤室;以及过滤装置,其被配置成进入所述过滤室,其中所述反应室与所述过滤单元经由第二通道连接;和(d)收集单元,其被配置成接收来自所述生物样品的分开的单个细胞,其中
所述过滤单元和所述收集单元经由第三通道连接。
60.在一些实施方案中,所述试剂盒进一步包括第一闸门,所述第一闸门被配置成控制以下之间的流体连接:在所述样品处理单元与所述反应单元之间经由所述第一通道的流体连接;和/或在所述反应单元与所述过滤单元之间经由所述第二通道的流体连接。在一些实施方案中,所述第一闸门被配置成定位在第一位置,并且其中当所述第一闸门处于所述第一位置时,所述样品处理单元和所述反应单元流体地连接,并且所述反应单元和所述过滤单元不流体地连接。在一些实施方案中,所述第一闸门被配置成定位在第二位置,并且其中当所述第一闸门处于所述第二位置时,所述反应单元和所述过滤单元流体地连接,并且所述样品处理单元和所述反应单元不流体地连接。
61.在一些实施方案中,所述试剂盒进一步包括第二闸门,其被配置成经由所述第三通道控制所述过滤单元和所述收集单元之间的流体连接。在一些实施方案中,所述第二闸门被配置成定位在第一位置,其中当所述第二闸门处于所述第一位置时,所述过滤单元和所述收集单元不流体地连接。在一些实施方案中,所述第二闸门被配置成定位在第二位置,其中当所述第二闸门位于所述第二位置时,所述过滤单元和所述收集单元流体地连接。
62.在一些实施方案中,所述第一通道、所述第二通道和所述第三通道被定位和配置成使得通过所述试剂盒的倾斜来控制所述样品处理单元、所述反应单元、所述过滤单元和所述收集单元之间的流动。在一些实施方案中,试剂盒的倾斜通过单轴线发生。在一些实施方案中,单轴线基本上垂直于以下轴线中的任何一个或多个:基本上平行于所述绞碎器的杆和/或所述绞碎器的运动方向的轴线;基本上垂直于所述反应室底部的轴线;以及与所述过滤装置的运动基本平行的轴线。在一些实施方案中,样品处理单元、反应单元、过滤单元和收集单元被配置成置于平面上,其中所述试剂盒的倾斜的单轴线基本上垂直于所述平面。
63.在一些实施方案中,所述样品处理单元的可密封端口还配置成接收流体以将其引入所述样品处理单元。在一些实施方案中,所述可密封端口包括壁,其中所述样品处理单元的可密封端口朝向所述样品室倾斜。
64.在一些实施方案中,所述试剂盒进一步包括帽,所述帽被配置成密封所述样品处理单元的可密封端口。
65.在一些实施方案中,所述样品室包括一个或多个向中心倾斜的壁。
66.在一些实施方案中,所述反应单元的所述反应室包括导声的底表面。在一些实施方案中,所述反应室的所述底表面基本平坦。在一些实施方案中,所述反应单元的反应室包括圆柱形壁。
67.在一些实施方案中,所述过滤单元的所述过滤装置包括管状组件,其中所述管状组件的外表面被配置成提供与所述过滤室的侧壁的密封,并且其中所述管状组件包括覆盖所述管状组件的底部开口的细胞过滤网。在一些实施方案中,所述过滤室的所述侧壁是圆柱形的。
68.在一些实施方案中,所述过滤单元的所述过滤室包括具有凸起结构的底表面。在一些实施方案中,所述过滤单元包括通气口。
69.在一些实施方案中,所述收集单元被配置成接收可移除收集装置,所述可移除收集装置用于接收来自所述生物样品的单细胞。在一些实施方案中,所述可移除收集装置为
eppendorf管。
70.在一些实施方案中,所述试剂盒被配置成可装载到超声波处理装置中。
71.在一些方面,本文提供了一种超声波处理装置,包括:(a)超声波换能器;(b)温控水浴;(c)倾斜组件,其中所述倾斜组件被配置成保持根据实施方案65-86中任一实施方案所述的试剂盒,使得(i)所述试剂盒的反应室相对于所述超声波换能器定位,并且(ii)所述试剂盒的反应室、样品室、和过滤室、或其部分相对于所述温控水浴的水位定位,所述倾斜组件包括:倾斜致动器;绞碎器致动器;以及过滤器致动器;以及(d)控制单元。
72.在一些实施方案中,所述超声波处理装置进一步包括一个或多个闸门致动器,每个所述闸门致动器被配置成与所述试剂盒的闸门接口。在一些实施方案中,所述倾斜组件被配置成保持所述试剂盒,使得当可移除收集装置被放置在所述试剂盒的收集单元中时,所述可移除收集装置或其一部分相对于所述温控水浴的水位定位。在一些实施方案中,所述反应室、所述样品室和所述过滤室以及所述可移除收集装置或其部分在所述温控水浴的水位以下。
73.在一些实施方案中,所述绞碎器致动器包括与所述试剂盒的绞碎器接口的夹子。在一些实施方案中,所述过滤器致动器包括与所述试剂盒的过滤装置接口的夹子。
74.在一些实施方案中,所述控制单元包括:一个或多个处理器;以及存储一个或多个程序的存储器,所述一个或多个程序被配置成由所述一个或多个处理器执行,所述一个或多个程序包括用于执行用于从生物样品分离和获得分开的单个细胞的方法的指令。在一些实施方案中,用于执行用于从生物样品分离和获得分开的单个细胞的所述方法的所述指令包括用于以下任何一个或多个的指令:操作所述超声波换能器;操作所述倾斜致动器;操作所述绞碎器致动器;操作所述过滤器致动器;操作一个或多个闸门致动器;以及操作所述温控水浴。
75.在一些方面,本文提供了一种用于从生物样品获得分开的单个细胞的方法,所述方法包括:将本文所述的实施方案中的任一实施方案的试剂盒装载到本文所述的实施方案中的任一实施方案的超声波处理装置中;将生物样品经由可密封端口装载到所述试剂盒的样品处理单元中;以及启动所述超声波处理装置的编程方法以从所述生物样品分离并获得分开的单个细胞。
附图说明
76.结合附图阅读,可以更好地理解前述发明内容以及以下具体实施方式部分。为了说明本公开文本,附图示出了本公开的示例实施方案;然而,本公开文本并不限于所公开的具体方法和工具。在附图中:
77.图1示出了根据一些实施方案的用于在试剂盒设备中处理固体生物组织样品的系统的截面图;
78.图2示出了根据一些实施方案的用于处理固体生物组织样品的试剂盒设备的示意图;
79.图3示出了根据一些实施方案的用于处理固体生物组织样品的试剂盒设备;
80.图4示出了根据一些实施方案的用于增强从固体生物组织样品分离细胞的系统;
81.图5示出了根据一些实施方案的用于操作独立式试剂盒设备以将固体生物组织样
品分离成活细胞的方法;
82.图6示出了根据一些实施方案的用于操作过滤器装置以增强从固体生物组织样品中分离活细胞的方法;
83.图7a是示出当使用超声波能量与酶分离猪肝组织样品时,在所有ensembl sscrofa11.1基因上未处理猪肝组织样品的基因表达谱的代表性变化的图表;
84.图7b是示出当使用超声波能量与酶分离猪肝组织样品时,未处理猪肝组织样品在ensembl sscrofa11.1基因的选择的促炎和应激诱导基因上的基因表达谱的代表性变化的图表;
85.图8是示出当猪肝组织被超声分离和超声分离并压滤时获得的活细胞的代表性数量的表;
86.图9a是示出通过在试剂盒设备中应用超声波分离和压滤从各种大小的猪肝组织样品中获得的每毫克活细胞的代表性数量的图表;并且
87.图9b是示出通过在试剂盒设备中应用超声波分离和压滤从各种大小的猪肝组织样品中获得的每毫克各种大小的活细胞的代表性数量的图表。
88.图10a示出了本文描述的试剂盒的示意图。图10b和10c示出了在倾斜组件中的试剂盒的照片。
具体实施方式
89.在一些方面,本文提供了用于处理包括多个细胞的生物样品以获得包括从多个细胞分离的单个细胞的组合物的试剂盒。在一些实施方案中,所述试剂盒是一次性使用的一次性试剂盒。在一些实施方案中,所述试剂盒被配置成使生物样品或其一部分经受分离力,例如超声波能量。在一些实施方案中,所述试剂盒被配置成接收生物样品,例如固体生物组织样品,执行生物样品的初步处理,促进施加超声体波能量以分离生物样品中的单个细胞,并从分离的细胞中过滤和收集感兴趣的活细胞,而与它们在生物样品中时的状态相比,不实质上改变分开的单个细胞,例如实质上改变分开的单个细胞的基因表达谱。在一些实施方案中,超声体波能量可由如参考美国专利第8,319,398号、第8,127,614号和第6,682,214号所述的超声波处理装置产生,其中每一专利的内容在此通过引用全部并入本文。在其他方面,本文描述的是用于在本文所描述的独立式试剂盒中处理生物样品,例如固体生物组织样品的系统、装置和方法。
90.除非上下文另有明确指示,否则本文所用的单数形式“一”、“一个”和“该”包括复数引用。
91.本文对“约”某个值或参数的提及包括(并且描述)针对所述值或参数本身的变化。例如,提及“约x”的描述包括对“x”的描述。
92.如本文所用,术语“包含”、“具有”、“含有”和“包括”以及其他类似形式及其语法等效语旨在含义上是等效的,并且是开放式结尾的,因为在这些单词中的任何一个后面的一个或多个项目并不意在是此类一个或多个项目的详尽列表,或者意在仅限于列出的一个或多个项目。例如,“包含”组分a、b和c的物品可以由(即仅含有)组分a、b和c组成,或者可以不仅含有组分a、b和c,而且可以含有一种或多种其他组分。因此,意图是并且应理解的是,“包含”及其类似形式及其语法等效语包括“基本上由
……
组成”或“由
……
组成”的实施方案的
公开。
93.应当理解,本文描述的本发明的方面和变型包括“组成”和/或“基本上由...组成”的方面和变型。
94.当提供值的范围时,应当理解,在该范围的上下极限值之间的每个中间值以及在该状态范围内的任何其他所述或中间值都包括在本公开文本的范围内。在所述范围包括上极限值或下极限值的情况下,不包括那些包括的极限值中的任一个的范围也包括在本公开文本中。
95.本发明的描述是为了使本领域的普通技术人员能够制造和使用本发明而提出的,并且是在专利申请及其要求的上下文中提供的。对所描述的实施方案的各种修改对于本领域的技术人员来说将是显而易见的,并且这里的一般原理可以应用于其他实施方案。因此,本发明并不局限于所示的实施方案,而是符合与本文描述的原理和特征一致的最大范围。
96.在此引用的所有出版物、专利和专利申请的披露内容均通过引用全部并入本文。如果通过引用合并的任何引用与本公开文本相冲突,以本公开文本为准。
97.在一些方面,本文描述的试剂盒被配置成执行以下任何一个或多个步骤:(i)接收生物样品;(ii)接收对处理生物样品有用的附加物质输入,例如水溶液,例如,缓冲液;(iii)处理生物样品,例如通过绞碎;(iv)使生物样品或其一部分经受分离力,例如超声波能量;(v)过滤所述生物样品或其部分,以分离所述生物样品的单个细胞;以及(vi)收集生物样品的分开的单个细胞。在一些实施方案中,试剂盒包括可用于执行用于处理生物样品的功能的模块。在一些实施方案中,所述试剂盒包括模块,所述模块被配置成执行与获得生物样品的分开的单个细胞有关的一个或多个功能。在一些实施方案中,所述试剂盒包括多个模块,其中每个模块被配置成执行在获得生物样品的分开的单个细胞中涉及的特定功能或一组功能。例如,在一些实施方案中,试剂盒包括样品处理单元、反应单元、过滤单元、和收集单元。在一些实施方案中,样品处理单元被配置成接收生物样品和输入到试剂盒中的任何附加物质,例如水溶液,例如,缓冲液。在一些实施方案中,样品处理单元被配置成处理生物样品,例如通过将生物样品通过绞碎器进行绞碎。在一些实施方案中,反应单元被配置成使生物样品或其一部分经受分离力,例如超声波能量。在一些实施方案中,过滤单元被配置成过滤生物样品或其部分,以分离,例如分散,生物样品的单个细胞。在一些实施方案中,收集单元被配置成收集生物样品的分开的单个细胞。在一些实施方案中,分开的单个细胞被收集在可移除收集装置中,例如eppendorf管。在一些实施方案中,收集单元包括用于与可移除收集装置接合和形成密封的特征。在一些实施方案中,所述试剂盒包括多个模块,所述试剂盒进一步包括用于流体地连接各个模块的通道。在一些实施方案中,基于从一个模块到另一个模块的期望物质流来配置通道。在一些实施方案中,试剂盒包括用于控制从一个模块到另一个模块的物质流动的一个或多个闸门。在一些实施方案中,所述试剂盒被配置成使得可以使用重力来操纵(例如移动)所述试剂盒中的物质,例如,通过倾倒试剂盒。
98.在一些方面,本文提供了一种用于处理生物样品的试剂盒,例如通过从生物样品中分离和获得分开的单个细胞,所述试剂盒包括:(a)样品处理单元,其包括:可密封端口,其被配置成接收所述生物样品以引入所述样品处理单元;样品室,其被配置成收集所述生物样品;以及绞碎器,其中所述绞碎器被配置成与所述样品室接口;(b)反应单元,其包括配置成接收超声波能量的反应室,其中所述样品处理单元与所述反应单元经由第一通道连
接;(c)过滤单元,其包括:过滤室;以及过滤装置,其被配置成进入所述过滤室,其中所述反应室与所述过滤单元经由第二通道连接;和(d)收集单元,其被配置成接收来自所述生物样品的分开的单个细胞,其中所述过滤单元和所述收集单元经由第三通道连接。
99.在一些实施方案中,所述试剂盒进一步包括配置成控制以下流体连接(例如,物质流)的第一闸门:在所述样品处理单元与所述反应单元之间经由所述第一通道的流体连接;和/或在所述反应单元与所述过滤单元之间经由所述第二通道的流体连接。在一些实施方案中,本文描述的闸门用作阀,并且可以阻塞(例如密封)通道或允许物质流过通道。在一些实施方案中,本文描述的闸门可以提供对通过通道的物质流动的控制,例如通过通道的部分打开/阻塞。在一些实施方案中,所述第一闸门被配置成定位在第一位置,其中当所述第一闸门处于所述第一位置时,所述样品处理单元和所述反应单元流体地连接,并且所述反应单元和所述过滤单元不流体地连接。在一些实施方案中,所述第一闸门被配置成定位在第二位置,其中当所述第一闸门处于所述第二位置时,所述反应单元和所述过滤单元流体地连接,并且所述样品处理单元和所述反应单元不流体地连接。在一些实施方案中,通过在轴线上枢转来控制第一闸门的定位。
100.在一些实施方案中,所述试剂盒进一步包括第二闸门,其被配置成经由所述第三通道控制所述过滤单元和所述收集单元之间的流体连接。在一些实施方案中,所述第二闸门被配置成定位在第一位置,其中当所述第二闸门处于所述第一位置时,所述过滤单元和所述收集单元不流体地连接。在一些实施方案中,所述第二闸门被配置成定位在第二位置,其中当所述第二闸门位于所述第二位置时,所述过滤单元和所述收集单元流体地连接。在一些实施方案中,通过在轴线上枢转来控制第二闸门的定位。
101.在一些实施方案中,所述第一通道、所述第二通道和所述第三通道被定位和配置成使得通过所述试剂盒的倾斜来控制所述样品处理单元、所述反应单元、所述过滤单元和所述收集单元之间的物质流动。在一些实施方案中,通道倾斜以促进物质从一个模块流向另一个模块,例如,从样品处理单元到反应单元。
102.在一些实施方案中,所述样品处理单元的可密封端口配置成接收流体以将其引入所述样品处理单元。在一些实施方案中,所述流体是水性流体,例如缓冲液或细胞培养基溶液。
103.在一些实施方案中,样品处理单元的可密封端口包括壁,其中所述壁或其一部分向样品室倾斜,例如,朝向样品室底部倾斜。在一些实施方案中,所述试剂盒进一步包括帽,所述帽被配置成密封所述样品处理单元的可密封端口。在一些实施方案中,可密封端口具有圆形形状,并且帽是圆形的。在一些实施方案中,所述盖被配置成被移除和替换。
104.在一些实施方案中,样品室被配置成使得生物样品和添加的物质将集中在样品室的预定位置。在一些实施方案中,所述样品室包括一个或多个向中心倾斜的壁。在一些实施方案中,所述样品室包括两个向中心倾斜的壁。在一些实施方案中,所述样品室包括具有基本平坦底部的锥形部分。在一些实施方案中,所述样品室包括基本平坦的底部。
105.在一些实施方案中,所述样品处理单元包括配置成定位所述绞碎器的引导件。在一些实施方案中,所述引导件使绞碎器能够上下滑动,例如,以重复地进入样品室。在一些实施方案中,样品处理单元被配置成控制绞碎器可以滑动的程度,例如深度和/或高度。在一些实施方案中,绞碎器包括杆。在一些实施方案中,绞碎器包括绞碎器端
部上的切割表面,该切割表面与样品室接口。
106.在一些实施方案中,所述反应单元的所述反应室包括导声的底表面。在一些实施方案中,所述反应室的所述底表面基本平坦。在一些实施方案中,所述反应单元的反应室包括圆柱形壁。在一些实施方案中,反应室的体积被配置成容纳预定体积的物质。在一些实施方案中,当物质在反应室中时,反应室的体积被配置成使得诸如弯月液面的物质顶表面处于预定位置或在预定位置的范围内。在一些实施方案中,预定位置或预定位置的范围是相对于超声波换能器而言的。
107.在一些实施方案中,所述过滤单元的所述过滤装置包括管状组件,其中所述管状组件的外表面被配置成提供与所述过滤室的侧壁的密封,并且其中所述管状组件包括覆盖所述管状组件的底部开口的细胞过滤网。在一些实施方案中,管状组件包括没有顶部和底部平坦表面的圆柱形状。在一些实施方案中,管状组件包括一个或多个侧孔,其中侧孔被细胞过滤网覆盖。在一些实施方案中,过滤室的侧壁或其一部分是圆柱形的。在一些实施方案中,所述过滤单元的所述过滤室包括具有凸起结构的底表面。在一些实施方案中,过滤单元包括引导件,所述引导件被配置成诸如经由从所述管状组件延伸的杆将所述管状组件定位在所述过滤室中。在一些实施方案中,引导件使管状组件能够在过滤室中上下滑动。在一些实施方案中,过滤装置被配置成压缩过滤室中的生物样品或其部分,例如从过滤室中排出分开的细胞。在一些实施方案中,过滤单元配置成控制管状组件可滑动的程度,例如深度和/或高度。在一些实施方案中,所述过滤单元包括通气口。在一些实施方案中,所述通气口配置成允许空气流入和流出过滤单元,例如当管状组件在过滤室中上下移动时。在一些实施方案中,所述通气口被配置成阻止流体流离开过滤单元。
108.在一些实施方案中,细胞过滤网被配置成基于颗粒尺寸过滤水溶液中的颗粒,例如细胞。在一些实施方案中,细胞过滤网允许某些颗粒,例如分开的单个细胞,通过细胞过滤网,同时阻止较大颗粒,例如细胞团和/或细胞外基质通过细胞过滤网。在一些实施方案中,细胞过滤网具有约40μm至约125μm的网孔尺寸(例如孔径),例如约60μm至约100μm、约60μm至约80μm、或约65μm至约75μm。在一些实施方案中,细胞过滤网的网孔尺寸小于约125μm,例如小于约120μm、115μm、110μm、105μm、100μm、95μm、90μm、85μm、80μm、75μm、70μm、65μm、60μm、55μm、50μm、45μm、或40μm中的任何一个。在一些实施方案中,细胞过滤网的网孔尺寸大于约40μm,例如大于约45μm、50μm、55μm、60μm、65μm、70μm、75μm、80μm、85μm、90μm、95μm、100μm、105μm、110μm、115μm、120μm、或125μm中的任何一个。在一些实施方案中,细胞过滤网的网孔尺寸约为40μm、45μm、50μm、55μm、60μm、65μm、70μm、75μm、80μm、85μm、90μm、95μm、100μm、105μm、110μm、115μm、120μm、或125μm中的任何一种。在一些实施方案中,细胞过滤网的平均网孔尺寸约为40μm、45μm、50μm、55μm、60μm、65μm、70μm、75μm、80μm、85μm、90μm、95μm、100μm、105μm、110μm、115μm、120μm、或125μm中的任何一种。在一些实施方案中,细胞过滤网包括peek网、聚酯网、尼龙网、聚丙烯网、玻璃纤维网或不锈钢网。
109.在一些实施方案中,收集单元被配置成接收和保持用于接收来自生物样品的分离细胞的可移除收集装置。在一些实施方案中,所述可移除收集装置为eppendorf管。
110.在一些实施方案中,所述试剂盒被配置成可装载到超声波处理装置中。在一些实施方案中,试剂盒的某些特征被配置成附接到超声波处理装置,例如在功能上附接到超声波处理装置。例如,在一些实施方案中,样品处理单元的绞碎器被配置成例如经由超声波处
理装置的夹子与绞碎器致动器接合。在一些实施方案中,过滤单元的过滤器装置的杆被配置成例如通过夹子与超声波处理装置的过滤致动器接合。
111.在一些实施方案中,所述试剂盒包括一种或多种物质,其中所述一种或多种物质与生物样品和任何添加的物质(如缓冲液相容)并与施加于其上的力和温度相容。
112.在一些实施方案中,生物样品包括多个细胞。在一些实施方案中,生物样品包括多个细胞,其中所述细胞的至少一部分例如经由细胞外基质相互连接。在一些实施方案中,生物样品是固体组织样品。在一些实施方案中,生物样品是来自脊椎动物或无脊椎动物的样品。例如,生物样品可以来自哺乳动物、爬行动物、鸟类、鱼、昆虫或线虫样品。在一些实施方案中,所述生物样品来自人类。在一些实施方案中,所述生物样品是植物样品,例如植物组织。在一些实施方案中,所述生物样品包含真核细胞。在一些实施方案中,所述生物样品包含多细胞原核生物(例如,生物膜)。在一些实施方案中,所述生物样品是癌症样品,例如肿瘤组织或活检。在一些实施方案中,所述生物样品是健康的生物样品,例如健康的非病变组织。在一些实施方案中,所述生物样品选自肺、肾、肝、胰腺、胃、脑、皮肤、肠、肌肉、乳房、脾、膀胱、子宫、卵巢、前列腺、心脏和骨髓样品。
113.在一些方面,本文提供了一种超声波处理装置,包括:(a)超声波换能器;(b)温控水浴;(c)倾斜组件,其中所述倾斜组件配置成保持本文所述的试剂盒,使得(i)所述试剂盒的反应室相对于所述超声波换能器定位,并且(ii)所述试剂盒的反应室、样品室、和过滤室、或其部分相对于所述温控水浴的水位定位,所述倾斜组件包括:倾斜致动器;绞碎器致动器;以及过滤器致动器;以及(d)控制单元。
114.在一些实施方案中,所述超声波处理装置进一步包括一个或多个闸门致动器,每个所述闸门致动器被配置成与所述试剂盒的闸门(如第一闸门或第二闸门)接口。
115.在一些实施方案中,诸如倾斜致动器、绞碎器致动器、过滤器致动器或闸门致动器的致动器包括步进电机或伺服电机。
116.在一些实施方案中,所述倾斜组件被配置成保持所述试剂盒,使得当可移除收集装置被放置在所述试剂盒的收集单元中时,所述可移除收集装置或其一部分相对于所述温控水浴的水位定位。在一些实施方案中,所述反应室、所述样品室和所述过滤室以及所述可移除收集装置或其部分在所述温控水浴的水位以下。例如,在一些实施方案中,所述反应室、所述样品室和所述过滤室以及所述可移除收集装置或其部分在所述温控水浴的水位以下,使得当生物样品或其部分存在于试剂盒中时,生物样品保持在期望的温度或温度范围。
117.在一些实施方案中,所述超声波换能器位于所述温控水浴的下方。在一些实施方案中,温控水浴被配置成将流体例如水保持在预定温度或其范围。在一些实施方案中,预定温度或其范围被配置成使得生物样品在从生物样品中分离和获得分开的单个细胞的方法的持续时间内保持在预定温度以下。在一些实施方案中,预定温度或其范围被配置成使得生物样品保持在约20℃以下,例如低于约15℃、10℃、9℃、8℃、7℃、6℃、5℃、4℃、3℃、2℃或1℃中的任何一个。在一些实施方案中,预定温度或其范围为约4℃至约20℃,例如约4℃至约15℃、4℃至约10℃、或4℃至约8℃。在一些实施方案中,温控水浴被配置成容纳流体,例如水,使得流体用作从传感器到样品的耦接介质。
118.在一些实施方案中,绞碎器致动器包括与试剂盒的绞碎器接口的特征,例如夹子。
119.在一些实施方案中,过滤器致动器包括特征,例如夹子,以与试剂盒的过滤装置接
口。
120.在一些实施方案中,所述控制单元包括:一个或多个处理器;以及存储一个或多个程序的存储器,所述一个或多个程序被配置成由所述一个或多个处理器执行,所述一个或多个程序包括用于执行用于从生物样品分离和获得分开的单个细胞的方法的指令。在一些实施方案中,用于执行用于从生物样品分离和获得分开的单个细胞的所述方法的所述指令包括用于以下任何一个或多个的指令:操作所述超声波换能器;操作所述倾斜致动器;操作所述绞碎器致动器;操作所述过滤器致动器;操作一个或多个闸门致动器;以及操作所述温控水浴。在一些实施方案中,用于操作超声波换能器的指令包括用于控制超声波换能器的持续时间和强度的指令。在一些实施方案中,用于操作倾斜致动器的指令包括用于控制试剂盒的定位和移动(例如倾斜程度、移动速度和试剂盒处于特定位置的持续时间)的指令。在一些实施方案中,用于操作绞碎器致动器的指令包括用于控制绞碎器的定位、绞碎器的速度、绞碎器穿透样品室的深度以及绞碎器穿透样品室的次数的指令。在一些实施方案中,用于操作过滤器致动器的指令包括用于控制过滤器装置的定位、过滤器装置的速度、过滤器装置穿透过滤器室的深度以及过滤器装置穿透过滤器室的次数的指令。在一些实施方案中,用于操作一个或多个闸门致动器的指令包括用于控制闸门的定位、闸门的打开和关闭以及闸门阻塞通道的程度的指令。在一些实施方案中,用于操作温控水浴的指令包括用于控制温控水浴中的水的温度和水位的指令。
121.在一些实施方案中,超声波处理装置包括用户接口。在一些实施方案中,用户接口包括具有关于系统和处理生物系统的方法的信息的屏幕。在一些实施方案中,用户接口包括用于将信息输入超声波处理装置的特征,例如按钮或键盘。在一些实施方案中,用户接口向用户传送状态,例如指示需要向试剂盒添加附加物质或方法已经完成的状态。
122.在一些方面,本文提供了一种用于从生物样品获得分开的单个细胞的方法,所述方法包括:将本文所述的试剂盒装载到本文所述的超声波处理装置中;将生物样品经由可密封端口装载到所述试剂盒的样品处理单元中;以及启动所述超声波处理装置的编程方法以从所述生物样品分离并获得分开的单个细胞。在一些实施方案中,所述方法进一步包括通过可密封端口向试剂盒添加附加物质,例如缓冲液。在一些实施方案中,所述方法进一步包括用帽密封可密封端口。
123.图1示出了根据一些实施方案的用于在试剂盒设备102中处理固体生物组织样品140的系统100的截面图。根据一些实施方案,系统100包括超声波处理装置120(也称为处理装置),其具有用于接收试剂盒设备102的开口120a。在一些实施方案中,试剂盒设备102被配置成手持以使得易于使用。例如,试剂盒设备102可以具有在100mm、85mm、70mm或55mm内的宽度,以使试剂盒设备102能够被握在一只手中。
124.如图1所示,试剂盒设备102的壳体单元102a被配置成可放置在处理装置120的开口120a内。在一些实施方案中,试剂盒设备102包括底表面102b,底表面102b是相对于超声波处理装置120的换能器组件130的基准表面。在一些实施方案中,试剂盒设备102被配置成可插入开口120a中,直到底表面102b距离换能器组件130预定距离。例如,预定距离可以小于10mm、8.5mm、7mm或5.5mm。在一些实施方案中,当试剂盒设备102被装载到超声波处理装置120中时,该预定距离被保持,因为改变该距离可以改变由超声波处理装置120产生的超声波能量分离固体组织样品140的方式。
125.在一些实施方案中,试剂盒设备102可包括装载室104和收集室106。在一些实施方案中,装载室104可以具有顶部开口(例如,圆形顶部开口)、底表面104b(例如,圆形表面)和内表面(例如,管状表面)。在一些实施方案中,装载室104的顶部开口可用作用于接收固体组织样品的入口104a。在一些实施方案中,固体组织样品140是动物组织,并且可以是例如脊椎动物或无脊椎动物组织。例如,所述组织可以是但不限于哺乳动物、爬行动物、鸟类、鱼类、昆虫或线虫组织。在一些实施方案中,所述组织是植物组织。在一些实施方案中,所述组织包含真核细胞。在一些实施方案中,所述细胞是多细胞原核生物(例如,生物膜)。在一些实施方案中,所述组织是肿瘤组织或癌组织,或活检样品。生物组织样品140可以是例如肺、肾、肝、胰腺、胃、脑、皮肤、肠、肌肉、乳房、脾、膀胱、子宫、卵巢、前列腺、心脏、骨髓或任何其他固体组织,其可以是病变组织或健康组织,例如癌组织或非癌组织。
126.在一些实施方案中,入口104a还可以接收水性流体142以保持固体组织样品140。在一些实施方案中,水性流体142包括培养基(也称为细胞培养基或生长培养基),其是支持和维持细胞(例如固体组织样品140的分离细胞)的选定组分的液体或凝胶。在一些实施方案中,培养基可以包括人工培养基,例如平衡盐溶液、基础培养基或复合培养基。例如,常用的基础培养基包括最小基本培养基(mem)或杜氏改良eagle培养基(dmem)。例如,复杂的培养基可能包括罗斯威尔公园纪念研究所(rpmi)1640或iscove的改良杜氏培养基(imdm)。在一些实施方案中,在固体组织样品140被插入之后,装载室的入口104a可以被密封,以使试剂盒设备102能够处理固体组织样品140,而不将固体组织样品140暴露于外部环境。例如,试剂盒设备102可以包括可耦接到入口104a的盖子(例如,卡扣帽、螺旋帽等)。在用户插入固体组织样品140之后,盖子可以被按压并耦接到入口104a以提供紧密的密封。
127.在一些实施方案中,装载室104包括底表面104b,用于将水性流体142和固体组织样品140声学耦接到超声波处理装置120。通过提供具有导声底表面104b,装载室104被配置成使处理装置120产生的超声波能量能够使单细胞从生物组织样品140中分离,从而产生水性悬浮液。在一些实施方案中,底表面104b可包括诸如塑料层、玻璃层或陶瓷层的导声层。在一些实施方案中,导声层可以是构成底表面104b的膜(例如,塑料膜)。在一些实施方案中,底表面104b是平坦层,其能够更均匀和紧密地耦接到试剂盒设备102的换能器组件130,如下文将进一步描述。
128.在一些实施方案中,收集室106可以接收从固体组织样品140分离的细胞,如下文将参考图2进一步描述。在一些实施方案中,收集室106可以包括可移除容器(例如,试管或塑料容器),该容器可以从试剂盒设备102分离,以使其内容物能够在下游分析中进一步处理。例如,收集室106的内容物可以在原代细胞培养、单细胞荧光激活细胞分选(facs)分析、单细胞dna和rna分析或单细胞测序中处理。在一些实施方案中,收集室106包括盖子108(例如,卡扣帽、螺旋帽等),以将收集室106中的内容物相对于外部环境密封。
129.在一些实施方案中,试剂盒设备102可以包括其他室,例如流体源室110(也称为试剂室或培养基室)或一个或多个过滤室112和114。在一些实施方案中,流体源室110可包括入口110a,用于接收和保持来自试剂盒设备102外部的水性流体(例如,水性流体142或另一流体)。在一些实施方案中,试剂盒设备102包括通道,该通道将流体源室110流体地连接到装载室104,以使水性流体能够从流体源室110流到装载室104。在一些实施方案中,试剂盒设备102包括多个通道,这些通道通过过滤室112和114将装载室104流体地耦接到收集室
106。在一些实施方案中,过滤室112和114可被配置成选择性地捕获流过多个通道的水性悬浮液中的流出物。
130.如下面将进一步描述的,一旦固体组织样品140在装载室104中装载水性流体142,在处理期间,固体组织样品140保持包含在试剂盒设备102中,直到从固体组织样品140中分离的细胞等靶组份被接收到收集室106。因此,与需要在处理期间在不同容器之间转移固体组织样品和相关的水性悬浮液并因此将固体组织样品暴露于外部环境的常规方法相反,试剂盒设备102提供密封的、独立的环境。
131.在一些实施方案中,超声波处理装置120包括电源132,电源向各种组件供电,以使单个细胞能够从固体组织样品140中分离出来,并随后在收集室106中收集。如图1所示,超声波处理装置120包括至少一个换能器组件130,该换能器组件被配置成当试剂盒设备102的壳体单元102a被装载在超声波处理装置120的开口120a内时与试剂盒设备102的反应室对准。在一些实施方案中,固体组织样品140的处理可以在装载室104中进行。在这些实施方案中,装载室104也是反应室。
132.在一些实施方案中,换能器组件130可以包括换能器和声波引导装置。例如,声波引导装置可以是制造在换能器组件的换能器板上的球形透镜(例如,菲涅尔透镜),以将超声波集中在装载室104中。在美国专利申请第2013/0199298a1号和美国专利第6,682,214号和第8,319,398号中描述了换能器组件130的各种实施方案,以上每个文件的全部内容通过引用全部并入本文。
133.在一些实施方案中,超声波处理装置120包括被配置成控制超声波处理装置120的操作的控制处理器124。例如,控制处理器124可操作换能器组件130以产生超声体波能量并将超声体波能量导向容纳固体组织样品140的反应室。在一些实施方案中,为了产生超声体波能量,换能器组件130被配置成发射具有指向目标方向的高横向声电位分布的超声波,这允许在目标方向内混合流体(例如,保持固体生物组织样品140的水性流体142)。在一些实施方案中,控制处理器124被配置成控制射频(rf)发生器126和rf放大器128以驱动换能器组件130。
134.在一些实施方案中,由换能器组件130产生的超声体波在装载室104中容纳的水性流体142中施加混合和悬浮力,以将单个细胞从固体组织样品140中分离。与传统的细胞分离方法相比,使用超声波能量而不是酶。因此,除了保持从固体组织样品140分开的细胞的基因表达谱之外,还可以实现更快的处理时间。
135.在一些实施方案中,超声波处理装置120可以包括一个或多个另外的换能器组件(类似于换能器组件130),该换能器组件被配置成当试剂盒设备102装载在超声波处理装置120的开口120a中时与一个或多个对应的过滤室112和114对齐。在一些实施方案中,由这些换能器组件产生的超声波能量可以指向流过过滤室112和114的水溶液,以实现正过滤和负过滤,如下文将进一步描述。
136.在一些实施方案中,控制处理器124可以连接到使用户能够与超声波处理装置120交互并控制超声波处理装置的输入装置122。在一些实施方案中,输入装置122包括用于接收用户输入的控制面板或触摸屏。例如,由用户指定的输入可以包括激活换能器组件130以从固体组织样品140中分离细胞的特定时间量。在一些实施方案中,输入装置122可以是提供输入的任何合适的装置,例如触摸屏、键盘或小键盘、鼠标或语音识别装置。在一些实施
方案中,超声波处理装置120包括输出装置136,其可以是提供输出的任何合适的装置,例如触摸屏、触觉装置或扬声器。
137.在一些实施方案中,超声波处理装置120包括连接到试剂盒设备102中的一个或多个通道的致动装置134。在一些实施方案中,试剂盒设备102可以包括一个或多个连接部件,该连接部件耦接到一个或多个通道并被配置成将试剂盒设备102与致动装置134物理连接。例如,连接部件可以包括配件或适配器。
138.在一些实施方案中,控制处理器124可被配置成操作致动装置134,以控制由超声波处理产生的水溶液从装载室104通过一个或多个过滤室112和114到收集室106的流动。例如,致动装置134可以包括真空泵,该真空泵通过一个或多个连接部件连接到试剂盒设备102,并迫使水溶液通过一个或多个过滤室112和114。在一些实施方案中,泵可以包括正排量泵,例如隔膜泵、活塞泵、蠕动泵或无阀泵。
139.在一些实施方案中,将装载室102连接到收集室106的一个或多个试剂盒通道可以包括柱塞装置,如下文将参照图2进一步描述。在这些实施方案中,试剂盒设备102、柱塞装置可包括配置成连接到致动装置134的连接器部件(例如,闩锁、手柄等)。在这些实施方案中,致动装置134可包括马达设备,该马达设备被配置成驱动拉力和/或推力以操作柱塞装置。
140.图2示出了根据一些实施方案的用于处理固体生物组织样品212的试剂盒设备200的图。试剂盒设备200可以是图1的试剂盒设备102的示例实现。在一些实施方案中,试剂盒设备200可包括一个或多个流体源室202(也称为试剂室或培养基室)、装载室204、一个或多个过滤室206和收集室208。在一些实施方案中,试剂盒设备200可被配置成包括流体地耦接室202-208中的两个或更多个的流体通道210a-h,如下文将进一步描述。在一些实施方案中,一个或多个流体通道可包括试剂盒设备102内的管或蚀刻或模制通道。
141.在一些实施方案中,流体源室202可对应于图1的流体源室110,并被配置成接收和存储水性流体214的储液器,以容纳从固体生物组织样品212分开的单个细胞。例如,流体源室202可包括三个流体源室202a-c,该三个流体源室具有用于接收相同或不同的水性流体的相应入口。在一些实施方案中,试剂盒设备200可包括流体通道210a-c,以将相应的流体源室202a-c流体地连接到样品装载室204。在一些实施方案中,一旦试剂盒设备200被装载在超声波处理装置(例如图1的超声波处理装置120)内,来自一个或多个流体源室202a-c的水性流体的流动可由致动装置134控制以流向装载室204。在一些实施方案中,通道210a-c包括相应的阀212a-c,所述阀可由致动装置134控制,以控制来自流体源室202a-c的何种水性流体(例如,试剂)以及可以何种量流向装载室204。例如,阀212a-c中的一个可包括闸门阀,闸门阀可由致动装置134打开或完全关闭,以从相应流体源室202a-c中的一个或多个选择水性流体。在另一示例中,阀212a-c中的一个可包括截止阀,以控制向装载室204的水性流体的流动。
142.在一些实施方案中,装载室204可以包括用于接收固体生物组织样品212的入口。在一些实施方案中,装载室204可配置成从入口或从一个或多个流体源室202接收水性流体214。在一些实施方案中,装载室204被配置成定位成使得当试剂盒设备200被装载到超声波处理装置120中时,装载室204与超声波处理装置120的换能器组件130对齐。在一些实施方案中,装载室204可配置成在绞碎操作期间和/或在细胞从固体组织样品212中超声分离期
间容纳固体生物组织样品212。例如,当装载室204位于换能器组件130上时,来自生物组织样品212的单个细胞可由换能器组件130产生的横向超声体波能量分离。在一些实施方案中,在激活超声波处理装置120以执行超声波细胞分离之前,装载室204可以与外部环境密封。在一些实施方案中,绞碎的生物组织样品212可以被运送到单独的反应室,在反应室中细胞从绞碎的生物组织样品212中分离。
143.在一些实施方案中,在超声分离完成后,装载室204容纳有水性悬浮液,该水性悬浮液包括原始水性流体214、从固体组织样品212分离的靶组份和从固体组织样品212分离的流出物质的混合物。例如,靶组份可包括经分离的感兴趣细胞。例如,流出物质可以包括从组织样品212分离的非靶向成分,例如细胞碎片和细胞外碎片。
144.在一些实施方案中,试剂盒设备200包括一个或多个过滤室206a-c,当水溶液从装载室204流向收集室208时,过滤室206a-c选择性地过滤水溶液中的流出物质。在一些实施方案中,过滤室206a-c包括一系列将装载室204连接到收集室208的两个或更多个过滤室205a-c。在一些实施方案中,过滤室206可以包括正过滤室,感兴趣的分析物被捕获在该正过滤室中,或者包括负过滤室,感兴趣的分析物通过该负过滤室。在一些实施方案中,过滤室(例如,过滤室206a-c之一)可以包括过滤器,该过滤器被配置成基于尺寸(例如,网孔径或膜孔径)过滤水溶液中的颗粒。例如,过滤器可以是网状过滤器,其捕获样品组织212的细胞外基质并允许水溶液中的较小颗粒通过70um的网。
145.在一些实施方案中,过滤室(例如,过滤室206a-c之一)可以包括被配置成与水溶液中的细胞类型结合的标记物(例如,珠或微泡上的抗体)。在正过滤中,这些细胞类型可以包括感兴趣的分析物,而在负过滤中,这些细胞类型可以包括流出物质(例如,非靶组份)。在一些实施方案中,过滤室可以包括防止标记传递到后续室的过滤器(例如,网状过滤器)。在一些实施方案中,除了使用过滤器之外或代替使用过滤器,超声波处理装置120可以包括一个或多个磁体,该磁体对标记施加拉力以防止其通过后续室。
146.在一些实施方案中,试剂盒设备200包括通道210d,该通道被配置成将装载室204流体地耦接到过滤室206a-c中的一个或多个。在一些实施方案中,试剂盒设备200包括多个通道210e-g,其流体地连接过滤室206a-c的相继的室,以使水性悬浮液从装载室204流到收集室208。在一些实施方案中,通道210d-g中的一个或多个可包括由致动装置134操作以控制水溶液流动的一个或多个相应阀(例如,阀或截止阀)。
147.在一些实施方案中,过滤室206a-c中的一个或多个可定位为当试剂盒设备200装载在超声波处理装置120内时与超声波处理装置120的一个或多个对应的换能器组件对准。这些换能器组件可以与换能器组件130分开。在一些实施方案中,一个或多个过滤室206a-c的底表面被配置成声学地耦接到一个或多个对应的换能器组件以接收超声体波能量以促进靶组份的选择性流动。在一些实施方案中,位于换能器组件(与换能器组件130分离)上的过滤室可以实现更高的过滤效率。例如,由换能器组件施加的超声波能量(例如,横向超声体波能量)可以对过滤室中的内容物(即,标记物和水溶液)施加混合力,以增加结合的可能性。
148.在一些实施方案中,当试剂盒设备200装载在超声波处理装置120内时,超声波处理装置120的致动装置134可以控制包括分离的细胞的水性悬浮液通过流体通道210d-210g的流动。例如,如上面关于图1所讨论的,致动装置134可包括泵或机械马达。
149.在一些实施方案中,收集室208可以被配置成从未被过滤室206a-c过滤的固体生物组织样品212的分离细胞接收和收集感兴趣的靶组份。在一些实施方案中,收集室208是可移除的,并且可以配置成从试剂盒设备200分离。
150.在一些实施方案中,试剂盒设备200包括将收集室208流体地耦接到装载室204的通道210h。在一些实施方案中,通道210h被配置成单向流体通道,其允许来自收集室208的水性流体回流到装载室204,但防止流体从装载室204回流到收集室208。例如,通道210h可以包括止回阀210d,以防止流体回流到收集室208中。通道210h提供的一个优点是可重复使用水性流体用于未来的超声分离过程。
151.图3示出了根据一些实施方案的用于处理固体生物组织样品330的试剂盒设备300。在一些实施方案中,试剂盒设备300可以是图1的试剂盒设备102或图2的试剂盒设备200的示例实现,并且其被配置成可放置在图1的超声波处理装置120的开口120a内。
152.如图3所示,试剂盒设备300的基体302包括多个室,例如装载室306和收集室308。类似于图1的装载室104,装载室306可以包括用于接收固体生物组织样品330的入口306a。在一些实施方案中,装载室306的入口306a可配置成还接收水性流体以容纳固体组织样品330。例如,如上面关于图1所述,水性流体可以是诸如mem或dmem的细胞培养基。在一些实施方案中,试剂盒设备300可以包括一个或多个流体源室,具有用于接收一个或多个水性流体并控制这些水性流体中的一个或多个流向装载室306的相应入口。
153.在一些实施方案中,装载室306被配置成允许被包含的固体组织样品330被绞碎设备312绞碎。如图3所示,绞碎设备312可以包括杵具312a和臼具312b。在一些实施方案中,臼具312b包括连接到臼底的手柄,该臼底可以插入到装载室306中,杵具312a包括杵尖,该杵尖可以插入装载室306中,以将固体组织样品330绞碎在插入的臼具312b的臼底上。因此,绞碎操作可以直接在试剂盒设备300处执行,并且不需要生物样品330在被装载到装载室306中之前被绞碎。在一些实施方案中,可以自动执行绞碎操作。例如,超声波处理装置120可包括一个或多个致动装置(例如,马达、活塞等),所述致动装置被配置成在试剂盒设备300被装载到超声波处理装置120中时机械地操作绞碎设备312。
154.在一些实施方案中,可以在固体组织样品330被绞碎之前或之后将试剂盒设备300装载到图1的超声波处理装置120中。如上文关于图1所述,当试剂盒设备300被装载到超声波处理装置120中时,装载室306可以定位成与换能器组件130对齐。在一些实施方案中,容纳在装载室中的绞碎样品组织330可以通过超声波处理装置120产生的超声体波能量被分离成单个细胞。在一些实施方案中,包含在装载室306中的所得流体被称为水性悬浮液,其包括水性流体、固体组织样品330的部分、固体组织样品330的超声分离细胞和流出物。例如,流出物可以包括由绞碎和超声波分离产生的细胞碎片或细胞外碎片。
155.在一些实施方案中,试剂盒设备300的基体302包括具有开口304a的隔离隔间304,该开口用于接收过滤设备310并将其保持在适当位置。在一些实施方案中,在固体组织样品330已经由绞碎设备312绞碎并由超声波处理装置120超声分离之后,装载室306中得到的水性悬浮液可以由过滤设备310过滤。例如,过滤设备310可插入装载设备306中以压缩固体组织样品330的剩余部分以排出从固体组织样品330分开的附加细胞,如下文将参考图4进一步描述。在一些实施方案中,过滤设备310被配置成与装载设备306以滑动配合的方式接合,使得在过滤设备310的外表面和装载设备306的内壁之间存在小间隙。因此,可以对固体组
织样品330执行绞碎和过滤处理,而不需要将固体组织样品330从试剂盒设备202转移到其他设备,这会增加环境污染的风险。在一些实施方案中,过滤操作可以自动执行。例如,超声波处理装置120可包括一个或多个致动装置(例如,马达、活塞等),所述致动装置被配置成在试剂盒设备300被装载到超声波处理装置120中时机械地操作过滤器设备310。例如,
156.在一些实施方案中,试剂盒设备300包括收集室308,收集室被配置成从保持在装载室306中的水性悬浮液中接收和收集分开的感兴趣细胞。在一些实施方案中,收集室308可以是可从试剂盒设备300拆卸的容器。在分离收集室308之前,盖314可以密封收集室308的入口,以防止收集的感兴趣靶组份泄漏或接触外部环境。
157.在一些实施方案中,试剂盒设备300可以包括配置成流体地连接多个室的一个或多个通道。例如,流体通道320可以是塑料管,当过滤设备322插入装载室306中时,该塑料管将装载室306流体地连接到收集室308。在一些实施方案中,包含在装载室306中的水溶液可以通过通道322吸入到收集室308。在一些实施方案中,试剂盒设备300包括盖子324,其配置成流体地连接通道322和通道320,并且可以耦接到收集室308。在一些实施方案中,通道320可耦接到柱塞装置316的一个或多个桶318,柱塞装置可被致动以使水溶液从装载室306通过通道322流到收集室。例如,柱塞装置316可由手柄上的拉力致动,以使空气从通道322吸入到收集室308中,并通过通道320朝向筒体318,从而使水溶液跟随通道322进入收集室308。
158.在一些实施方案中,柱塞装置316可以由用户拉动或推动。在其他实施方案中,当试剂盒设备300被装载到超声波处理装置120中时,柱塞装置316可以由超声波处理装置120机械地致动。例如,超声波处理装置120可以包括被配置成在柱塞装置上施加拉力的致动装置(例如,驱动滑轮、链条或电缆的马达或液压拉动装置)。在一些实施方案中,致动装置可包括真空泵,如图1所述,真空泵诱导通道322内的压力变化,以控制水溶液从装载室306到收集室308的流动。
159.图4示出了根据一些实施方案的用于增强从固体生物组织样品412分离细胞的系统400。在一些实施方案中,系统400包括过滤器装置402,与传统的细胞筛相比,所述过滤器装置可被操作以增加从组织样品412分开的活细胞的回收。
160.在传统的过滤技术中,将包括从固体组织样品中分开的细胞的水性悬浮液倒在细胞过滤器上以获得活细胞。然而,通常残留的活细胞被截留在细胞过滤网本身中,而不是获得。这可能是由物理上位于固体组织样品的细胞基质的纤维网内的分离的活细胞引起的。其他传统的过滤技术要求将水性悬浮液转移到单独的离心机装置中过滤细胞,这也在离心机中留下含有活细胞的残余组织。
161.在一些实施方案中,为了改进现有的过滤技术,过滤器装置402包括管状体402b,该管状体可以伸缩地插入到含有水性流体414中的固体生物组织样品412的容器410中。因此,管状体402b的圆周略小于容器410的圆周,以便能够将过滤器装置402插入容器410中。如上文关于图1-3所述,水性流体414可以是诸如mem或rpmi 1640的细胞培养基。
162.在一些实施方案中,过滤器装置402可以由与固体生物组织样品412相容的材料组成。例如,过滤器装置402的管状体402b可以由不与生物组织反应的塑料(例如,聚苯乙烯)制成。在一些实施方案中,管状体402b被配置成刚性,以在过滤器装置402插入容器410中时与容器410滑动配合,从而不形成紧密密封。在插入期间,滑动配合在管状体402b的外表面
和容器402的内表面之间产生间隙,以允许过滤器装置402容易地从容器410插入和取出,以反复压缩固体生物组织样品412,以排出分离的细胞,如下文将进一步讨论。在一些实施方案中,为了减小当插入到容器410中时在管状体402b的上部内引起的压力,过滤器装置402可以被配置成包括沿着上部的一个或多个孔。例如,管状体402b可包括定位在管状体402b的上部中的一个或多个孔402d。在一些实施方案中,孔402d可以定位在过滤器装置402的顶表面上。在一些实施方案中,孔402d可以具有0.5-3mm、1-2.5mm或1-2mm之间的直径。
163.在一些实施方案中,过滤器装置402包括覆盖管状体402b的底部开口402a的细胞过滤网404。在一些实施方案中,细胞过滤网404可以包括peek网、聚酯网、尼龙网、聚丙烯网、玻璃纤维网或不锈钢网。在一些实施方案中,细胞过滤网404可以具有40μm、70μm、或100μm的网孔尺寸。
164.在一些实施方案中,当过滤器装置402完全插入容器410中时,细胞过滤网404被配置成压缩组织样品412,以从组织样品412的细胞外基质中排出细胞。在一些实施方案中,当管状体402b被插入到容器410的底部和/或不能被进一步插入时发生完全插入。在一些实施方案中,过滤器装置402被配置成以接近预定义的距离403延伸到容器410中,该距离足以使细胞过滤网404能够挤压和压缩组织样品412。在一些实施方案中,预定距离403使得组织样品412能够被压缩至少50%、60%、70%、80%或90%。
165.在一些实施方案中,管状体402b包括防止管状体402b延伸超过预定距离403的凸起部分402e。例如,凸起部分402e可以是附接到管状体402b的突片或环(如图所示)。凸起部分402e可以是与容器410兼容的任何刚性材料,例如塑料、橡胶、陶瓷等。
166.在一些实施方案中,作为凸起部分402e的补充或替代,容器410包括定位在容器410底部的止挡材料418,以防止管状体402e延伸超过预定距离403。在一些实施方案中,止挡材料418可以是由海绵、橡胶或塑料材料组成的一个或多个凸片或环(如图所示)。在一些实施方案中,止挡材料418可以具有至少0.1mm、0.2mm、0.25mm或0.5mm的高度。在一些实施方案中,止挡材料418可以具有小于0.7mm、0.5mm、0.25mm或0.2mm的高度。
167.在一些实施方案中,当过滤器装置402完全插入容器中时,管状体402b的下部402c定位在容器410内。在一些实施方案中,下部402c包括一个或多个开口,所述开口被一个或多个对应的细胞过滤网406a-b覆盖,所述细胞过滤网406a-b可以与细胞过滤网402a相同。
168.在一些实施方案中,当组织样品412被压缩时,从压缩的组织样品412排出水性流体,以排出分离的细胞,并使排出的细胞通过细胞过滤网404,去往管状体402b的内部,例如中心。因此,物理上位于固体组织样品412的细胞外基质内的分开的活细胞可以被释放,以增加活细胞的回收。在一些实施方案中,水性流体414还在管状体402b内通过细胞过滤网孔406a-b流动。
169.在一些实施方案中,在管状体402b内收集的水性流体可被输送到收集室,例如图1的收集室106或图3的收集室308。在一些实施方案中,过滤器装置402包括通道416,该通道被配置成将在管状体402b内收集的流体(包括被驱散的细胞)抽吸到收集室中。例如,通道416可以是塑料管。在一些实施方案中,通道416沿着管状体402b的长度并在管状体402b内延伸到下部402c内的位置。
170.在一些实施方案中,过滤器装置402可以在经历酶解的固体组织样品412上操作。
然而,正如上述背景中所解释的那样,酶的使用需要长时间的孵育和处理时间,并可能改变分离细胞的基因谱表达。因此,在一些实施方案中,可以更有效地在经历超声分离的固体组织样品412上操作过滤器装置402,如上面关于图1-3所述。在这些实施方案中,容器410可以对应于诸如图1的试剂盒设备102或试剂盒设备300的试剂盒设备的反应室或装载室(例如,装载室306)。
171.图5示出了根据一些实施方案的用于操作独立式试剂盒设备以将固体生物组织样品分离成活细胞的方法500。在一些实施方案中,试剂盒设备可以是图1的试剂盒设备102、图2的试剂盒设备200或图3的试剂盒设备300。
172.在步骤502中,将固体生物组织样品和水性液体引入到试剂盒设备的第一室中。在一些实施方案中,第一室包括允许组织样品放置在第一室中的第一入口。在一些实施方案中,第一室可以是例如图2的装载室204或图3的装载室306。在一些实施方案中,可通过一个或多个流体供应室的单独入口将水性液体引入到试剂盒设备中,如上文关于图1-2所述。
173.在一些实施方案中,组织样品可以在试剂盒设备的第一室内绞碎。在一些实施方案中,第一室被配置成接收包括杵具和臼具的绞碎设备,以绞碎组织样品。在一些实施方案中,组织样品可以从第一室转移到试剂盒设备中的另一室中被绞碎。
174.在步骤504中,将试剂盒设备装载到超声波处理装置中,使得第一室与处理装置的换能器组件对齐。在一些实施方案中,在将试剂盒设备装载到超声波处理装置中之后,可以在第一室内绞碎组织样品。
175.在步骤506中,激活超声波处理装置以施加来自换能器组件的超声波能量,以超声分离第一室中的组织样品中的细胞,以产生水性悬浮液。在一些实施方案中,超声波换能器阵列被配置成产生并引导具有高水平横向超声推力的朝向第一室的超声波。这些超声波产生横向体波能量,该能量在第一室中的流体中施加混合和悬浮力,以将细胞从组织样品中分离。在一些实施方案中,水性悬浮液包括步骤502的水性流体、组织样品的残余部分、分开的细胞和诸如细胞碎片和细胞外碎片的流出物。
176.在一些实施方案中,超声波处理装置可以被激活一段由用户选择的预定时间段。在一些实施方案中,可以基于用户控制来控制超声波处理装置以开始和停止超声波的产生。例如,处理单元可以包括允许用户控制其操作的用户接口,如上面关于图1的超声波处理装置120所述。
177.在步骤508中,控制水性悬浮液从试剂盒设备的第一室流到第二室,其中第二室被配置成收集水性悬浮液中的分离细胞。在一些实施方案中,可控制水性悬浮液流过一系列两个或更多个过滤室,以过滤来自水性悬浮液的流出物,如上面关于图2所述。
178.图6示出了根据一些实施方案的用于操作过滤器装置以增强从固体生物组织样品中分离活细胞的方法600。在一些实施方案中,过滤设备可以是过滤设备310,如参照图3所述,或者是过滤设备402,如参照图4所述。
179.在步骤602中,过滤器装置的管状体被伸缩地插入到容纳有水性流体中的生物组织样品的容器中。在一些实施方案中,过滤器装置包括覆盖管状体的底部开口的细胞过滤网。在一些实施方案中,管状体在插入期间与容器形成滑动配合。
180.在步骤604中,过滤器装置的管状体完全插入容器中,以用细胞过滤网压缩生物组织样品。细胞过滤网压缩生物组织样品的动作排出物理上位于生物组织样品的细胞外基质
的纤维网内的游离细胞。在一些实施方案中,当管状体被插入时,过滤器装置被完全插入,直到它到达容器的底部和/或不能被进一步插入。例如,管状体可包括防止管状体延伸超过预定距离的凸起部分。在另一个例子中,容器可以包括附接到容器底部的止挡材料,该止挡材料具有预选的高度,该预选的高度防止管状体延伸到容器中超过预定的距离。
181.在一些实施方案中,管状体可被反复提升(例如,取出)和重新插入,以反复压缩容器中的生物组织样品,以增加排出细胞的量。在一些实施方案中,过滤器装置可以被操作以在水溶液中被排出的细胞被运送到收集室之前反复按压生物组织预定次数。在一些实施方案中,生物组织样品可以在一次或多次压滤之前由超声波处理装置102超声分离。
182.在一些实施方案中,在将水溶液输送到收集室之后,如上面在图1-3中所描述的,可将另外的水性流体引入容器中。然后,过滤器装置可以被配置成执行方法602-604和/或反复地提取和重新插入过滤器装置在容器内,以使进一步的细胞能够从生物组织样品的细胞外基质中排出。示例性实施方案
183.实施方案1.一种用于从固体生物组织样品中分离单细胞的设备,所述设备包括:壳体单元,其被配置成使所述设备能够装载到超声波处理装置中;第一室,其被配置成接收所述固体生物组织样品和水性流体,其中当所述设备装载在所述处理装置中时,所述第一室与所述处理装置的换能器组件对齐,以使所述处理装置施加的超声波能量能够将细胞从所述生物组织样品中分离出来,从而产生水性悬浮液;将所述第一室流体地连接到第二室的通道;和所述第二室,其被配置成收集从所述第一室流过所述通道的所述水性悬浮液中的经分离的细胞。
184.实施方案2.根据实施方案1所述的设备,其中所述第二室可从所述设备上拆卸。
185.实施方案3.根据实施方案1或2所述的设备,其中所述第一室包括第一入口,用于从所述设备外部接收所述固体组织样品和所述水性流体。
186.实施方案4.根据实施方案3所述的设备,其中所述第一室包括盖子,以将所接收的固体组织样品和所述水性流体相对于外部环境密封。
187.实施方案5.根据实施方案1-4中任一实施方案所述的设备,其中所述第一室包括底表面,所述底表面是导声的,以使所述超声波能量进入所述第一室以将细胞从所述生物组织中分离。
188.实施方案6.根据实施方案5所述的设备,其中所述底表面包括平坦层,所述平坦层被配置成当所述设备被装载在所述处理装置中时耦接到所述换能器组件。
189.实施方案7.根据实施方案1-6中任一实施方案所述的设备,其中所述水性流体包括细胞培养基溶液。
190.实施方案8.根据实施方案1-7中任一实施方案所述的设备,进一步包括:连接器部件,其耦接到所述通道并配置成与所述处理装置的致动装置连接,其中所述致动装置被配置成控制流体通过所述通道的流动。
191.实施方案9.根据实施方案8所述的设备,其中所述致动装置包括泵或柱塞。
192.实施方案10.根据实施方案8或9所述的设备,其中所述连接器部件包括配置成连接所述通道和所述致动装置的配件或适配器。
193.实施方案11.根据实施方案8-10中任一实施方案所述的设备,进一步包括阀,其被
定位在所述通道中并被配置成由所述处理装置的致动装置控制以控制通过所述通道的流体流动。
194.实施方案12.根据实施方案1-11中任一实施方案所述的设备,进一步包括第三室,所述第三室包括用于将第二水性流体接收到所述设备内部的第三入口。
195.实施方案13.根据实施方案12所述的设备,进一步包括通道,所述通道将所述第三室流体地耦接到所述第一室,以使所述第二水性流体流入所述第一室。
196.实施方案14.根据实施方案1-13中任一实施方案所述的设备,进一步包括:将所述第一室连接到所述第二室的一系列两个或更多个过滤室,其中所述通道包括多个子通道,所述多个子通道流体地连接所述一系列两个或更多个过滤室中的相继的室,以使所述水性流体从所述第一室流到所述第二室。
197.实施方案15.根据实施方案14所述的设备,其中所述两个或更多个过滤室被配置成当所述水性流体流过所述多个子通道时捕获所述水性流体中的流出物质,以使靶组分能够被收集在所述第二室中。
198.实施方案16.根据实施方案15所述的设备,其中所述流出物包括非靶组分、细胞碎片和细胞外碎片。
199.实施方案17.根据实施方案15或16所述的设备,其中过滤室包括一个或多个标记珠,所述标记珠被配置成结合到所述流出物质上以防止所述流出物质流过所述过滤室。
200.实施方案18.根据实施方案14-17中任一实施方案所述的设备,其中来自所述两个或更多个过滤室的过滤室被配置成当所述设备被装载在所述处理装置中时与所述处理装置的第二换能器组件对准,并且其中所述过滤室包括底表面,所述底表面将所述过滤室与所述第二换能器组件声学地耦接,以接收来自所述处理装置的超声波能量,以促进所述靶组份的选择性流动。
201.实施方案19.根据实施方案15-18中任一实施方案所述的设备,其中所述第二室被配置成收集所述细胞内或细胞外靶分析物,并且其中所述设备进一步包括:单向通道,其流体地将所述第二室连接到所述第一室以使水性流体回流到所述第一室。
202.实施方案20.根据实施方案14-19中任一实施方案所述的设备,其中所述多个子通道配置成允许所述水性流体回流通过所述一系列的两个或更多个过滤室而不回流到所述第一室中。
203.实施方案21.一种用于从固体生物组织样品中分离单细胞的方法,所述方法包括:将所述固体生物组织样品和水性液体引入试剂盒设备的第一室;将所述试剂盒设备装载到超声波处理装置中,其中所述第一室与所述处理装置的换能器组件对齐;激活所述超声波处理装置以施加来自所述换能器组件的超声波能量,以超声地将细胞从所述组织样品中分离,从而在所述第一室中产生水性悬浮液;以及控制所述水性悬浮液从所述试剂盒设备的所述第一室流向所述第二室,其中所述第二室被配置成收集所述水性悬浮液中的经分离的细胞。
204.实施方案22.实施方案21的方法,其进一步包括:绞碎所述第一室内的所述组织样品。
205.实施方案23.根据实施方案22所述的方法,其中绞碎所述组织样品包括:将杵具和臼具插入所述容器中;以及使用插入的杵具和臼具绞碎所述组织样品。
206.实施方案24.根据实施方案21-23中任一实施方案所述的方法,进一步包括:将所述第二室与所述试剂盒设备分离。
207.实施方案25.根据实施方案21-24中任一实施方案所述的方法,进一步包括:经由所述第一室的第一入口接收来自所述设备外部的所述固体组织样品和所述水性流体。
208.实施方案26.根据实施方案21-25中任一实施方案所述的方法,其中所述第一室包括盖子,并且其中所述方法进一步包括:通过关闭所述盖子将所接收的固体组织样品和所述水性流体相对于外部环境密封。
209.实施方案27.根据实施方案21-26中任一实施方案所述的方法,其中所述第一室包括底表面,所述底表面是导声的,以使所述超声波能量进入所述第一室以将细胞从所述生物组织中分离。
210.实施方案28.根据实施方案27所述的方法,其中所述底表面包括平坦层,并且其中所述方法进一步包括:当所述试剂盒设备被装载在所述处理装置中时,将所述试剂盒设备的平坦层耦接到所述换能器组件。
211.实施方案29.根据实施方案21-28中任一实施方案所述的方法,其中所述水性流体包括细胞培养基溶液。
212.实施方案30.根据实施方案21-29中任一实施方案所述的方法,其中所述试剂盒设备进一步包括耦接到所述通道的连接器部件,并且其中所述方法进一步包括:使用所述连接器部件将所述通道与所述处理装置的致动装置连接,其中所述致动装置被配置成控制流体通过所述通道的流动。
213.实施方案31.根据实施方案30所述的方法,其中所述致动装置包括泵或柱塞。
214.实施方案32.根据实施方案30或31所述的方法,其中所述连接器部件包括配置成连接到所述通道和所述致动装置的配件或适配器。
215.实施方案33.根据实施方案30-32中任一实施方案所述的方法,其中所述试剂盒设备进一步包括定位在所述通道中的阀,并且其中所述方法进一步包括:通过所述处理装置的致动装置操作所述阀以控制通过所述通道的流体流动。
216.实施方案34.根据实施方案21-33中任一实施方案所述的方法,其中所述试剂盒设备进一步包括第三室,所述第三室包括第三入口,并且其中所述方法进一步包括:经由所述第三入口将第二水性流体接收到所述设备的内部。
217.实施方案35.根据实施方案34所述的方法,其中所述方法进一步包括:经由通道将所述第三室流体地耦接到所述第一室,以使所述第二水性流体流入所述第一室。
218.实施方案36.根据实施方案21-35中任一实施方案所述的方法,其中所述试剂盒设备进一步包括将所述第一室连接到所述第二室的一系列两个或更多个过滤室,并且其中所述通道包括多个子通道,所述多个子通道流体地连接所述一系列两个或更多个过滤室中的相继的室,以使所述水性流体从所述第一室流到所述第二室。
219.实施方案37.实施方案36的方法,其进一步包括:当所述试剂盒设备装载在所述处理装置中时,将来自所述两个或更多个过滤室的过滤室与所述处理装置的第二换能器组件对准,其中所述过滤室包括底表面,所述底表面将所述过滤室与所述第二换能器组件声学地耦接,以接收来自所述处理装置的超声波能量,以促进所述靶组份的选择性流动。
220.实施方案38.一种用于增强从固体生物组织样品中分离活细胞的过滤器装置,所
述过滤器装置包括:管状体,其被配置成可伸缩地插入到容纳有水性流体中的生物组织样品的容器中;以及覆盖所述管状体的底部开口的细胞过滤网,其中所述细胞过滤网被配置成当所述过滤器装置完全插入所述容器中时压缩所述生物组织样品以从所述组织样品中排出细胞。
221.实施方案39.根据实施方案38所述的过滤器装置,其中所述细胞被排出到周围的水性流体中,所述水性流体通过所述细胞过滤网流入所述管状体的中心。
222.实施方案40.根据实施方案38或39所述的过滤器装置,进一步包括:输送通道,其将流入所述管状体中心的排出细胞输送到收集室。
223.实施方案41.根据实施方案40所述的过滤器装置,其中所述输送通道包括在所述管状体内部并沿着所述管状体的长度延伸的管。
224.实施方案42.根据实施方案38-41中任一实施方案所述的过滤器装置,其中当所述管状体完全插入到所述容器中时,所述管状体的下部浸没在所述容器中,并且其中所述下部包括由一个或多个对应的细胞过滤网覆盖的一个或多个开口。
225.实施方案43.根据实施方案42所述的过滤器装置,其中所述细胞被排出到周围的水性流体中,所述水性流体通过与所述下部的一个或多个开口相对应的所述一个或多个细胞过滤网流入所述管状体的中心。
226.实施方案44.根据实施方案38-43中任一实施方案所述的过滤器装置,其中所述管状体被配置成延伸到所述容器中至多预定距离,以使所述细胞过滤网能够压缩所述生物组织样品。
227.实施方案45.根据实施方案44所述的过滤器装置,其中所述管状体包括凸起部分,所述凸起部分防止所述管状体延伸到所述容器中超过所述预定距离。
228.实施方案46.根据实施方案44或45所述的过滤器装置,其中所述容器进一步包括位于所述容器底部的止挡材料,所述止挡材料防止所述管状体延伸到所述容器中超过所述预定距离。
229.实施方案47.根据实施方案46所述的过滤器装置,其中所述止挡材料包括海绵、橡胶、或塑料。
230.实施方案48.根据实施方案38-47中任一实施方案所述的过滤器装置,其中所述生物组织样品在被所述细胞过滤网压缩之前被超声分解成细胞。
231.实施方案49.根据实施方案38-48中任一实施方案所述的过滤器装置,其中所述生物组织样品在被所述细胞过滤网压缩之前被酶解成细胞。
232.实施方案50.根据实施方案38-49中任一实施方案所述的过滤器装置,其中所述容器对应于试剂盒设备的反应室。
233.实施方案51.一种用于增强从固体生物组织样品中分离活细胞的方法,所述方法包括:将所述过滤器装置的管状体伸缩地插入容纳有水性流体中的生物组织样品的容器中,其中所述过滤器装置包括覆盖所述管状体的底部开口的细胞过滤网;以及将所述过滤器装置的管状体完全插入所述容器中,以用所述细胞过滤网压缩所述生物组织样品,其中所述细胞过滤网压缩所述生物组织样品以将细胞从所述组织样品中排出。
234.实施方案52.实施方案51的方法,其进一步包括:从所述容器中抽出所述过滤器装置的管状体;以及反复执行所述过滤器装置的管状体的完全插入和抽出,以反复压缩所述
生物组织样品,以增加排出的细胞量。
235.实施方案53.根据实施方案51和52所述的方法,其中所述细胞被排出到周围的水性流体中,所述水性流体通过所述细胞过滤网流入所述管状体的中心。
236.实施方案54.根据实施方案51-53中任一实施方案所述的方法,进一步包括:将流入所述管状体中心的排出细胞输送到收集室。
237.实施方案55.根据实施方案54所述的方法,其中所述输送通道包括在所述管状体内部并沿着所述管状体的长度延伸的管。
238.实施方案56.根据实施方案51-55中任一实施方案所述的方法,进一步包括:当所述管状体完全插入到所述容器中时,将所述管状体的下部浸没在所述容器中,其中所述下部包括由一个或多个对应的细胞过滤网覆盖的一个或多个开口。
239.实施方案57.根据实施方案56所述的方法,其中所述细胞被排出到周围的水性流体中,所述水性流体通过与所述下部的一个或多个开口相对应的所述一个或多个细胞过滤网流入所述管状体的中心。
240.实施方案58.根据实施方案51-57中任一实施方案所述的方法,包括:将管状体延伸到容器中至多预定距离,以使细胞过滤网能够压缩生物组织样品。
241.实施方案59.根据实施方案58所述的方法,其中所述管状体进一步包括凸起部分,所述凸起部分防止所述管状体延伸到所述容器中超过所述预定距离。
242.实施方案60.根据实施方案58或59所述的方法,其中所述容器进一步包括位于所述容器底部的止挡材料,所述止挡材料防止所述管状体延伸到所述容器中超过所述预定距离。
243.实施方案61.根据实施方案60所述的方法,其中所述止挡材料包括海绵、橡胶、或塑料。
244.实施方案62.根据实施方案51-61中任一实施方案所述的方法,进一步包括:在伸缩地插入所述过滤器的管状体以通过所述细胞过滤网压缩所述组织样品之前,超声地将所述组织样品分离成细胞。
245.实施方案63.根据实施方案51-62中任一实施方案所述的方法,进一步包括:在伸缩地插入所述过滤器的管状体以通过所述细胞过滤网压缩所述组织样品之前,将所述组织样品酶解成细胞。
246.实施方案64.根据实施方案51-63中任一实施方案所述的方法,其中所述容器对应于试剂盒设备的反应室。
247.实施方案65.一种用于从生物样品中分离和获得分开的单个细胞的试剂盒,所述试剂盒包括:(a)样品处理单元,其包括:可密封端口,其被配置成接收所述生物样品以引入所述样品处理单元;样品室,其被配置成收集所述生物样品;以及绞碎器,其中所述绞碎器被配置成与所述样品室接口;(b)反应单元,其包括配置成接收超声波能量的反应室,其中所述样品处理单元与所述反应单元经由第一通道连接;(c)过滤单元,其包括:过滤室;以及过滤装置,其被配置成进入所述过滤室,其中所述反应室与所述过滤单元经由第二通道连接;和(d)收集单元,其被配置成接收来自所述生物样品的分开的单个细胞,其中所述过滤单元和所述收集单元经由第三通道连接。
248.实施方案66.根据实施方案65所述的试剂盒,进一步包括:第一闸门,所述第一闸
门被配置成控制以下之间的流体连接:在所述样品处理单元与所述反应单元之间经由所述第一通道的流体连接;和/或在所述反应单元与所述过滤单元之间经由所述第二通道的流体连接。
249.实施方案67.根据实施方案66所述的试剂盒,其中所述第一闸门被配置成定位在第一位置,并且其中当所述第一闸门处于所述第一位置时,所述样品处理单元和所述反应单元流体地连接,并且所述反应单元和所述过滤单元不流体地连接。
250.实施方案68.根据实施方案66或67所述的试剂盒,其中所述第一闸门被配置成定位在第二位置,并且其中当所述第一闸门处于所述第二位置时,所述反应单元和所述过滤单元流体地连接,并且所述样品处理单元和所述反应单元不流体地连接。
251.实施方案69.根据实施方案65-68中任一实施方案所述的试剂盒,进一步包括第二闸门,其被配置成经由所述第三通道控制所述过滤单元和所述收集单元之间的流体连接。
252.实施方案70.根据实施方案69所述的试剂盒,其中所述第二闸门被配置成定位在第一位置,其中当所述第二闸门处于所述第一位置时,所述过滤单元和所述收集单元不流体地连接。
253.实施方案71.根据实施方案69或70所述的试剂盒,其中所述第二闸门被配置成定位在第二位置,其中当所述第二闸门位于所述第二位置时,所述过滤单元和所述收集单元流体地连接。
254.实施方案72.根据实施方案65-71中任一实施方案所述的试剂盒,其中所述第一通道、所述第二通道和所述第三通道被定位和配置成使得通过所述试剂盒的倾斜来控制所述样品处理单元、所述反应单元、所述过滤单元和所述收集单元之间的流动。
255.实施方案73.根据实施方案65-72中任一实施方案所述的试剂盒,其中所述样品处理单元的可密封端口还配置成接收流体以将其引入所述样品处理单元。
256.实施方案74.根据实施方案65-72中任一实施方案所述的试剂盒,其中所述样品处理单元的可密封端口的壁朝向所述样品室倾斜。
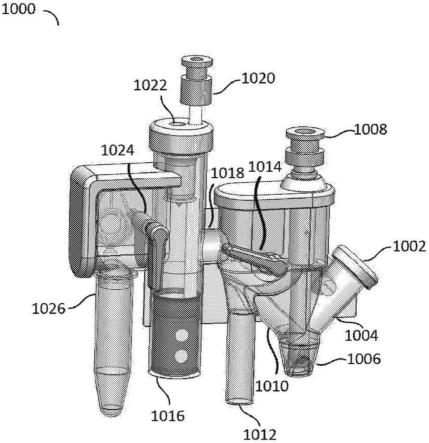
257.实施方案75.根据实施方案65-74中任一实施方案所述的试剂盒,进一步包括帽,所述帽被配置成密封所述样品处理单元的可密封端口。
258.实施方案76.根据实施方案65-75中任一实施方案所述的试剂盒,其中所述样品室包括一个或多个向中心倾斜的壁。
259.实施方案77.根据实施方案65-76中任一实施方案所述的试剂盒,其中所述反应单元的所述反应室包括导声的底表面。
260.实施方案78.根据实施方案77所述的试剂盒,其中所述反应室的所述底表面基本平坦。
261.实施方案79.根据实施方案65-78中任一实施方案所述的试剂盒,其中所述反应单元的反应室包括圆柱形壁。
262.实施方案80.根据实施方案65-79中任一实施方案所述的试剂盒,其中所述过滤单元的所述过滤装置包括管状组件,其中所述管状组件的外表面被配置成提供与所述过滤室的侧壁的密封,并且其中所述管状组件包括覆盖所述管状组件的底部开口的细胞过滤网。
263.实施方案81.根据实施方案80所述的试剂盒,其中所述过滤室的所述侧壁是圆柱形的。
264.实施方案82.根据实施方案65-81中任一实施方案所述的试剂盒,其中所述过滤单元的所述过滤室包括具有凸起结构的底表面。
265.实施方案83.根据实施方案65-82中任一实施方案所述的试剂盒,其中所述过滤单元包括通气口。
266.实施方案84.根据实施方案65-83中任一实施方案所述的试剂盒,其中所述收集单元被配置成接收可移除收集装置,所述可移除收集装置用于接收来自所述生物样品的单细胞。
267.实施方案85.根据实施方案84所述的试剂盒,其中所述可移除收集装置为eppendorf管。
268.实施方案86.根据实施方案85所述的试剂盒,其中所述试剂盒被配置成可装载到超声波处理装置中。
269.实施方案87.一种超声波处理装置,包括:(a)超声波换能器;(b)温控水浴;(c)倾斜组件,其中所述倾斜组件被配置成保持根据实施方案65-86中任一实施方案所述的试剂盒,使得(i)所述试剂盒的反应室相对于所述超声波换能器定位,并且(ii)所述试剂盒的反应室、样品室、和过滤室、或其部分相对于所述温控水浴的水位定位,所述倾斜组件包括:倾斜致动器;绞碎器致动器;以及过滤器致动器;以及(d)控制单元。
270.实施方案88.根据实施方案87所述的超声波处理装置,进一步包括一个或多个闸门致动器,每个所述闸门致动器被配置成与所述试剂盒的闸门接口。
271.实施方案89.根据实施方案87或88所述的超声波处理装置,其中所述倾斜组件被配置成保持所述试剂盒,使得当可移除收集装置被放置在所述试剂盒的收集单元中时,所述可移除收集装置或其一部分相对于所述温控水浴的水位定位。
272.实施方案90.根据实施方案89所述的超声波处理装置,其中所述反应室、所述样品室和所述过滤室以及所述可移除收集装置或其部分在所述温控水浴的水位以下。
273.实施方案91.根据实施方案87-90中任一实施方案所述的超声波处理装置,其中所述绞碎器致动器包括与所述试剂盒的绞碎器接口的夹子。
274.实施方案92.根据实施方案87-91中任一实施方案所述的超声波处理装置,其中所述过滤器致动器包括与所述试剂盒的过滤装置接口的夹子。
275.实施方案93.根据实施方案87-92中任一实施方案所述的超声波处理装置,其中所述控制单元包括:一个或多个处理器;以及存储一个或多个程序的存储器,所述一个或多个程序被配置成由所述一个或多个处理器执行,所述一个或多个程序包括用于执行用于从生物样品分离和获得分开的单个细胞的方法的指令。
276.实施方案94.根据实施方案93所述的超声波处理装置,其中用于执行用于从生物样品分离和获得分开的单个细胞的所述方法的所述指令包括用于以下任何一个或多个的指令:操作所述超声波换能器;操作所述倾斜致动器;操作所述绞碎器致动器;操作所述过滤器致动器;操作一个或多个闸门致动器;以及操作所述温控水浴。
277.实施方案95.一种用于从生物样品获得分开的单个细胞的方法,所述方法包括:将根据实施方案65-86中任一实施方案所述的试剂盒装载到根据实施方案87-94中任一实施方案所述的超声波处理装置中;将生物样品经由可密封端口装载到所述试剂盒的样品处理单元中;以及启动所述超声波处理装置的编程方法以从所述生物样品分离并获得分开的单
个细胞。实施例实施例1经处理组织样品的基因表达谱分析
278.正如在上述背景中所解释的,使用酶从组织样品中分离细胞可能会由于酶解诱导的应激而显著改变分离细胞中基因的基因表达谱。相反,操作试剂盒设备(例如,图3的试剂盒设备300)以施加超声波分离(例如,施加超声体波能量)不太可能改变基因的基因表达谱。
279.为了观察超声波能量与酶相比在细胞分离中的改善,对从同一商业获得的猪肝中切除的四个45mg组织样品进行了实验。第一样品保持在其固体的、未处理的组织状态作为对照样品,其基因表达谱可以与其他处理的组织样品的基因表达谱进行比较。使用标准的miltenyi酶促组织分离方案(由mitenyi提供)将第二样品分离到细胞悬浮液中,该方案代表了当前使用酶进行细胞分离的方法。通过向放置在试剂盒设备300的反应室中的第三样品施加超声波能量,将第三样品分离成细胞悬浮液。第四样品用类似于第三样品的方法进行超声分离。
280.所有四个样品在提取rna和评估有效测序数据的最小rin值之前都被冷冻。然后用illumina公司的truseq链式mrna文库制备套件对四个样品进行rna提取和mrna测序。从四个样品中提取rna并在nextseq 500上测序。最后,利用strand ngs数据分析工具对四个样品的测序数据进行分析,以评估超声分离与酶分离对组织样品基因表达谱的影响。
281.图7a是示出当使用超声波能量与酶分离猪肝组织样品时,在所有ensembl sscrofa11.1基因上未处理猪肝组织样品的基因表达谱的代表性变化的图表700a。通过应用上述实验装置生成图表700a。图表700a的x轴代表猪基因组sscrofa11.1组装中的基因。图表700a的y轴显示了sscrofa11.1基因与0值的对照相比的log2倍数变化。对照样品对应于为第一样品(即对照和未处理样品)计算的sscrofa11.1基因的基因表达谱。线702代表经酶解的第二样品的sscrofa11.1基因的log2倍数变化。线704和706分别代表经超声分离的第三和第四样品的sscrofa11.1基因的log2倍数变化。如图表700a所示,线702与线704和706相比,许多sscrofa11.1基因的log2倍数变化要大得多。换句话说,超声分离的第三和第四样品的基因表达谱与天然的、未加工的组织样品(即第一样品)的基因表达谱更接近。
282.图7b是示出当使用超声波能量与酶分离猪肝组织样品时,未处理猪肝组织样品在ensembl sscrofa11.1基因的选择的促炎和应激诱导基因710上的基因表达谱的代表性变化的图表700b。从图表700a的x轴上的ensembl sscrofa11.1基因中选择18个基因生成图表700b。图表700b的x轴表示从猪基因组的sscrofa11.1组装中选择的基因710。图表700b的y轴显示了与设定值为0的对照相比,所选基因的log2倍数变化,并表示为第一样品(即对照和未处理的样品)计算的基因表达谱。线712代表经酶解的第二样品的选定基因710的log2倍数变化。线714和716分别代表第三和第四样品的选定基因710的log2倍变化,这些基因被超声分离。如图表700b所示,与线714和716相比,线712在所有选定基因710的log2倍数变化要大得多。换句话说,第二样品的酶解细胞在基因表达中显示出应激迹象,表现为所选的促炎和应激诱导基因710的上调。相比之下,第三和第四样品的log2变化要小得多,这意味着他们的基因表达谱与自然的、未经处理的第一样品更加接近。
实施例2用过滤器装置评估获得的活细胞数量
283.如上面在背景技术中和关于图4所解释的,在超声分离之后,许多分离的活细胞可以被捕获在固体组织样品的细胞基质中。过滤器装置402可以根据图6的方法600操作,以压紧并压缩容器内的固体组织样品,以排出捕获的活细胞,以增加获得的活细胞的数量。为了观察使用过滤器装置402所实现的改进,进行了一次基础方案实验和两次压滤实验。
284.在基础方案实验中,在41.3mg猪肝组织样品上反复施加超声分离,而不进行任何压滤。具体而言,执行了以下步骤:1.在没有任何绞碎操作和没有任何酶的情况下,将组织样品装载在试剂盒设备300的直径为9mm的反应室(即,管)中;2.超声波处理装置120施加两分钟的超声波能量,从组织样品中分离活细胞;3.从超声分离的组织样品中评估总回收细胞和总回收活细胞的数量;以及4.步骤2-3重复六轮。
285.在压滤实验中,对两份45mg的猪肝组织进行超声分离,然后用402过滤器装置进行过滤。具体来说,对每个压滤实验执行以下步骤:1.在没有任何绞碎操作和没有任何酶的情况下,将组织样品装载在试剂盒设备300的直径为9mm的反应室(即,管)中;2.超声波处理装置120施加两分钟的超声波能量,从组织样品中分离活细胞;3.使用过滤器装置402对组织样品施加六次压滤;以及4.从超声分离的组织样品中评估总回收细胞和总回收活细胞的数量。
286.图8是示出当猪肝组织被超声分离和超声分离并压滤时获得的活细胞的代表性数量的表800。使用上述实验设置生成表800。具体地说,表800包括如上所述分别从基础方案实验和压滤实验导出的基本情况结果802和压滤结果804。
287.基础方案结果802显示了在六轮超声分离的每一轮结束时每毫克获得的细胞总数和活细胞总数。在六轮超声分离结束时,基础方案实验获得了累积总量39795个活细胞/mg。相反,压滤结果804显示了在两个压滤实验结束时(即,对应于样品3-1和4-1)获得的细胞总数和每毫克活细胞总数。如表800所示,两个压滤实验分别获得了76,220和73,260个活细胞的累积总数,这导致平均每毫克总共有74,740个活细胞。因此,表800中的结果表明,与仅使用超声波分离获得活细胞相比,使用压滤400排出细胞实现了活细胞回收率近两倍的提高。实施例3评估所公开的试剂盒设备的性能
288.为了评估使用所公开的方法和试剂盒设备应用超声分离组织样品的性能,对多个猪肝组织样品大小(即10mg至200mg)执行以下实验方案:1.将选定尺寸的组织样品与370ul的dmem水溶液一起装载到试剂盒设备300的装载室306中;2.绞碎设备312用于对试剂盒设备300中的组织样品施加100次绞碎冲程;3.将另外370ul的dmem水溶液添加到试剂盒设备300的装载室306中;4.超声波处理装置120施加两分钟的超声波能量,从组织样品中分离活细胞;5.使用预湿过滤设备310向试剂盒设备300内的组织样品施加六次压滤;
6.由压滤产生的水性悬浮液通过过滤设备310转移到回收管(例如,收集室308);并且7.在回收管中的水溶液中超声分离的组织样品的一部分被评估以确定回收的活细胞的数量。
289.图9a是示出通过在试剂盒设备300中应用超声波分离和压滤从各种大小的猪肝组织样品中获得的每毫克活细胞的代表性数量的图表900a。将上述实验装置应用于以下大小的猪肝组织样品,生成图表900a:10mg、25mg、50mg、100mg、和200mg。图表900a包括在条形图部分902和与条形图部分902中的条相对应的数据表部分904中示出的结果。如图表900a所示,从猪肝组织样品中分离出一致的活细胞总数(即每毫克至少135,000个活细胞),与组织样品大小无关。
290.图9b是示出通过在试剂盒设备300中应用超声波分离和压滤从各种大小的猪肝组织样品中获得的每毫克各种大小的活细胞的代表性数量的图表900b。通过评估图表900a所示的每毫克获得的活细胞的细胞大小来生成图表900b。图表900b包括条形图部分906和与条形图部分902中的条相对应的数据表部分908。特别地,条形图部分906图形地显示了在五种不同的组织样品规格(即10mg、25mg、50mg、100mg和200mg)下,四种类型的细胞大小(即11-20um、21-30um、31-40um和》40um)每毫克回收的活细胞。数据表部分908示出与条形图部分906中示出的条形相对应的数值。如图表900b所示,从不同大小的组织样品中成功地分离出具有不同细胞大小的不同细胞群。实施例4用于从生物样品中获得分开的单个细胞的示例性试剂盒、装置和方法
291.该实施例展示了本技术的示例性试剂盒,以及用于从生物样品中获得分开的单个细胞的装置和使用方法。
292.所设计的试剂盒在图10a的示意图中被示出。如其中所描绘的,试剂盒1000配置成具有样本处理单元,该样品处理单元包括可密封端口1002和倾斜壁1004,以将诸如生物样品的物质引导至样品室1006。样品室1006配置成具有向中心倾斜的壁,以确保生物样品和任何添加的物质集中在样品室的预定部分中,即绞碎器1008与样品室接口。样品处理单元和绞碎器1008被配置成使得当生物样品重复地下降和上升到样品室时,绞碎器将处理(如破碎)生物样品。试剂盒1000被配置成具有倾斜的第一通道1010,以在倾斜试剂盒1000时将物质从样品处理单元引导到反应室1012。试剂盒1000被配置成具有第一闸门1014,以控制样品室1006和反应室1012以及反应室1012和过滤室1016之间的物质流动。试剂盒1000配置成具有连接反应室1012和过滤单元的第二通道1018。过滤单元被配置成具有:具有凸底表面的过滤室1016、过滤装置1020、和通气口1022。所述试剂盒配置成具有连接所述过滤单元和所述收集单元的第三通道,其中第二闸门1024控制了第三通道的物质流动。试剂盒1000配置成用eppendorf管1026保持和创建密封以收集分开的单个细胞。
293.如图10b和图10c中所示,将设计的试剂盒装载到超声波处理装置的倾斜组件1050中进行处理。倾斜组件显示在超声波处理装置的外部,以便于显示倾斜试剂盒。在从生物样品中获得分开的单个细胞的方法中,通过样品处理单元的可密封端口将生物样品和细胞培养基缓冲液装载到试剂盒中。帽被放置在样品处理单元的可密封端口上。将绞碎器反复放入样品室处理生物样品。在第一闸门被定位成允许物质从样品室流到反应室,但不允许从
反应室流到过滤室的情况下,倾斜组件1050的倾斜致动器被激活,使试剂盒倾斜以将样品室中的材料移动到反应室。倾斜组件的倾斜致动器1050然后被激活,使得所述试剂盒被定位在原始位置(所述原始位置使得当所述倾斜组件位于所述超声波处理装置中时,所述反应室将相对于超声波换能器定位)。所述第一闸门被定位成允许物质从反应室流到过滤室,并且所述过滤装置处于提升位置(图10b),倾斜组件1050的倾斜致动器被激活以使试剂盒倾斜以将反应室中的物质移动到过滤室。过滤装置被重复地降低到过滤室中,以通过允许单个细胞流过细胞过滤网来分离单个细胞。在第二闸门被定位成允许物质通过第三通道从过滤室流到收集单元的情况下,倾斜组件1050的倾斜致动器被激活以使试剂盒倾斜以将过滤材料从过滤室移到收集单元。过滤装置可以接收最终压滤物,当试剂盒倾斜在此位置,以允许任何最终物质(例如,分开的单个细胞和细胞培养基)从处理的生物样品或其一部分移动到收集单元。
294.可以重复所述方法以进一步处理生物样品以从中获得分开的单个细胞。在这样的实施方案中,通过可密封端口将额外的细胞培养基添加到试剂盒中。
295.出于解释的目的,已经参考具体实施方案描述了前述描述。然而,上述说明性讨论并不旨在穷举或将本公开文本限制于所公开的精确形式。鉴于上述教导,许多修改和变化是可能的。选择和描述这些实施方案是为了最好地解释这些技术的原理及其实际应用。因此,本领域的其他技术人员能够最好地利用这些技术和具有各种修改的各种实施方案,以适合预期的特定用途。
296.尽管已经参照附图充分描述了本公开和示例,但是应当注意,各种变化和修改对于本领域技术人员来说将变得显而易见。这种变化和修改应被理解为包括在由权利要求书限定的公开内容和示例的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。