一种针对parp抑制剂耐药性监测的方法、装置、设备及介质
技术领域
1.本发明涉及生物信息领域,尤其涉及一种针对parp抑制剂耐药性监测的方法、装置、设备及介质。
背景技术:
2.目前,以奥拉帕利为代表的多款parp抑制剂已在国内外获批上市,用于治疗携带brca突变的多种晚期肿瘤,包括卵巢癌,胰腺癌,前列腺癌,乳腺癌等;在卵巢癌领域,parp抑制剂可用于铂敏感复发性卵巢癌的维持治疗,2020年医保适应症扩展至brca突变晚期卵巢癌的一线维持治疗。parp抑制剂可有效延长患者无病进展生存期,但其耐药问题已逐渐成为临床医生面临的主要挑战。然而,parp抑制剂耐药机制研究的相关临床数据还比较少,更是缺乏治疗前parp抑制剂药效评估的标志物。
3.现有技术对卵巢癌临床治疗通常是将ca125作为常用的肿瘤标志物,可监测肿瘤进展:ca125表达水平显著升高或观察到持续升高,预示着临床复发,进而通过影像手段(超声、ct、mri、骨扫描、pet-ct等)确认复发。然而,在一些特定的生理状态下,ca125表达水平也可能出现升高,并且在常规的随访和监测中发现ca125水平上升,可能没有肿瘤复发的症状、体征和影像学证据,这给临床治疗策略的制定带来一定的困惑,甚至在相当比例的复发患者中,ca125仍处于正常水平。因此,现亟需找到对parp抑制剂药效监测的肿瘤标志物。
技术实现要素:
4.为了填补治疗前parp抑制剂药效评估的空白,克服现有ca125作为肿瘤标志物对parp抑制剂耐药性监测效能的不足,亟需找到新的肿瘤标志物的问题,本发明提供了一种针对parp抑制剂耐药性监测方法、装置、设备及介质。
5.第一方面,为了解决上述技术问题,本发明提供了一种针对parp抑制剂耐药性监测方法,包括以下步骤:
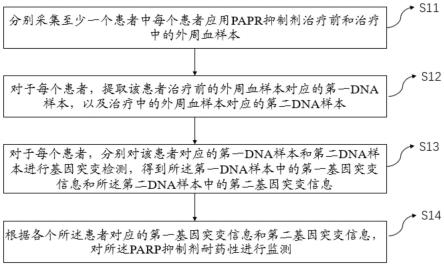
6.s11、分别采集至少一个患者中每个患者应用papr抑制剂治疗前和治疗中的外周血样本;
7.s12、对于每个患者,提取该患者治疗前的外周血样本对应的第一dna样本,以及治疗中的外周血样本对应的第二dna样本;
8.s13、对于每个患者,分别对该患者对应的第一dna样本和第二dna样本进行基因突变检测,得到第一dna样本中的第一基因突变信息和第二dna样本中的第二基因突变信息;
9.s14、根据各个患者对应的第一基因突变信息和第二基因突变信息,对parp抑制剂耐药性进行监测。
10.本发明提供的针对parp抑制剂耐药性监测方法的有益效果是:患者疾病进展或耐药发生,多伴随肿瘤突变负荷的增加,将parp抑制剂耐药性监测指标放在基因突变信息,可提升耐药性监测的特异性和准确性,避免现有技术中通过观察ca125指标出现的误判断。
11.在上述技术方案的基础上,本发明的一种针对parp抑制剂耐药性监测方法还可以
做如下改进。
12.进一步,步骤s14具体包括:
13.根据各个患者对应的第一基因突变信息,确定第三基因突变信息,第三基因突变信息为治疗前对预后产生影响的第一基因突变信息;
14.根据各个患者对应的第二基因突变信息,确定第四基因突变信息,第四基因突变信息为治疗中对预后产生影响的第二基因突变信息;
15.根据第三基因突变信息和第四基因突变信息,对parp抑制剂耐药性进行监测。
16.采用上述进一步方案的有益效果是:基于第一基因突变信息和第二基因突变信息的监测指标较多,通过分析对预后产生显著影响的基因突变信息,可对第一基因突变信息和第二基因突变信息的监测指标进行优化,筛选出更为准确的基因突变信息作为肿瘤耐药监测标志物。
17.进一步,还包括:
18.获取每个患者的病历信息;
19.根据各个患者的病历信息,确定对预后产生影响的病例特征;
20.根据各个患者对应的第三基因突变信息和第四基因突变信息,对parp抑制剂耐药性进行监测,包括:
21.根据各个患者对应的第三基因突变信息、第四基因突变信息和对预后产生影响的病例特征,对parp抑制剂耐药性进行监测。
22.采用上述进一步方案的有益效果是:根据临床实践经验,患者的病历信息中存在对预后产生较大影响的病例特征,因此,parp抑制剂耐药性监测中纳入对预后产生影响的病例特征,可使得监测结果更准确。
23.进一步,还包括对于每个患者的病历信息,病历信息中包括表征该患者是否复发的信息;根据各个患者的病历信息,确定对预后产生影响的病例特征,包括:
24.对于每个患者的病历信息,根据该患者是否复发的信息,将各患者分为复发组和未复发组;
25.对于每个患者的病历信息中的每一项因子,确定该因子在复发组和所述未复发组间存在的差异;
26.对于对于每个因子的组间差异性小于第三阈值,则确定该因子为对预后产生影响的病例特征。
27.采用上述进一步方案的有益效果是:通过统计学对患者病历信息进行联合分析,找出对预后产生影响最大的病例特征。
28.进一步,还包括目标预测模型的构建,具体包括如下步骤:
29.获取第一训练样本,第一训练样本包括各个患者对应的基因突变信息,基因突变信息为第一基因突变信息或第二基因突变信息;
30.对第一训练样本进行第一次筛选,得到第一训练样本中满足第一设定条件的第二训练样本;
31.对所述第二训练样本结合对预后产生影响的病例特征进行第二次筛选,得到所述第二训练样本中满足第二设定条件的第三训练样本;
32.对所述第三训练样本进行第三次筛选,得到所述第三训练样本中满足第三设定条
件的第四训练样本;
33.根据所述第四训练样本,对初始模型进行构建,得到目标预测模型,所述目标预测模型用于根据基因突变信息得到对papr抑制剂耐药性进行监测,得到监测结果。
34.采用上述进一步方案的有益效果是:通过建立目标预测模型,有利于更精准的识别从parp抑制剂治疗中获益的人群,同时有利于早期预警耐药性的发生;为了得到更加准确的预测数据,对第一训练样本进行了三次筛选,筛选出满足设定条件的第四训练样本。
35.进一步,第二训练样本、第三训练样本和第四训练样本的筛选过程如下:
36.对所述第一训练样本进行kaplan-meier分析,得到所述第一训练样本中每一项第一训练样本的第一p值;
37.将所述第一训练样本对应的各第一p值中小于第四阈值的第一p值对应的第一训练样本确定为所述第二训练样本;
38.对所述第二训练样本结合对预后产生影响的病例特征进行cox单因素分析,得到所述第二训练样本中每一项第二训练样本的第二p值;
39.将所述第二训练样本对应的各第二p值中小于第五阈值的第二p值对应的第二训练样本确定为所述第三训练样本;
40.对所述第三训练样本进行cox多因素分析,得到所述第三训练样本中每一项第三训练样本的第三p值;
41.将所述第三训练样本对应的各第三p值中小于第六阈值的第三p值对应的第三训练样本确定为所述第四训练样本。
42.采用上述进一步方案的有益效果是:依次通过生存分析、cox单因素和cox多因素分析的方法,找出更为准确的第一基因突变信息或第二基因突变信息用于模型的训练,使得目标预测模型的预测结果更加准确。
43.进一步,上述根据各个患者对应的第一基因突变信息和第二基因突变信息,对parp抑制剂耐药性进行监测,包括:
44.根据各个患者对应的第一基因突变信息和第二基因突变信息,确定parp抑制剂耐药性对应监测结果,监测结果包括患者总评分、风险等级评定。
45.采用上述进一步方案的有益效果是:医生可以根据患者总评分、风险等级评定的监测结果将计划接受parp抑制剂治疗患者的复发风险分为低风险组和高风险组,还可将正在接受parp抑制剂治疗患者的耐药风险分为低风险组和高风险组,从而实现患者的风险分层,为医生制定治疗方案提供决策依据。
46.第二方面,本发明提供了一种针对parp抑制剂耐药性监测装置,包括:
47.数据采集模块,用于分别采集至少一个患者中每个患者应用papr抑制剂治疗前和治疗中的外周血样本;
48.dna样本提取模块,用于对每个患者,提取该患者治疗前的外周血样本对应的第一dna样本,以及治疗中的外周血样本对应的第二dna样本;
49.基因突变检测模块,用于对每个患者,分别对该患者对应的第一dna样本和第二dna样本进行基因突变检测,得到所述第一dna样本中的第一基因突变信息和所述第二dna样本中的第二基因突变信息;
50.parp抑制剂耐药性监测模块,用于根据各个所述患者对应的第一基因突变信息和
第二基因突变信息,对所述parp抑制剂耐药性进行监测。
51.本发明提供的针对parp抑制剂耐药性监测方法的有益效果是:通过微创的外周血取样方式,实现对患者肿瘤基因突变信息的动态检测,并将其作为parp抑制剂耐药性监测的指标,可实现患者parp抑制剂治疗的全程管理,弥补现有技术中通过观察ca125指标出现误判断的不足,同时基因突变信息可作为潜在药靶,为肿瘤治疗相关药物研发提供理论依据。
52.第三方面,本发明还提供了一种电子设备,包括存储器、处理器及存储在存储器上并在处理器上运行的程序,处理器执行程序时实现上述任一项一种针对parp抑制剂耐药性监测的步骤。
53.第四方面,本发明还提供了一种计算机可读存储介质,计算机可读存储介质中存储的指令,当指令在终端设备上运行时,使得终端设备执行上述任一项一种针对parp抑制剂耐药性监测的步骤。
附图说明
54.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面结合附图和实施例对本发明作进一步说明。
55.图1为本发明实施例的一种针对parp抑制剂耐药性监测方法的流程示意图;
56.图2为本发明实施例治疗前游离dna mre11a基因突变对无进展生存期的影响;
57.图3为本发明实施例治疗中游离dna mre11a基因突变对无进展生存期的影响;
58.图4为本发明实施例治疗前游离dna tp53基因突变对无进展生存期的影响;
59.图5为本发明实施例治疗中游离dna tp53基因突变对无进展生存期的影响;
60.图6为本发明实施例治疗前游离dna atm基因突变对无进展生存期的影响;
61.图7为本发明实施例治疗中游离dna atm基因突变对无进展生存期的影响;
62.图8为本发明实施例治疗前游离dna pms2基因突变对无进展生存期的影响;
63.图9为本发明实施例治疗中游离dna chek2基因突变对无进展生存期的影响;
64.图10为本发明实施例治疗中游离dna pik3ca基因突变对无进展生存期的影响;
65.图11为本发明实施例治疗中游离dna erbb2基因突变对无进展生存期的影响;
66.图12为本发明实施例治疗中游离dna egfr基因突变对无进展生存期的影响;
67.图13为本发明实施例治疗中游离dna nf1基因突变对无进展生存期的影响;
68.图14为本发明实施例brca胚系突变对无进展生存期的影响;
69.图15为本发明实施例治疗前游离dna chek2基因k373e位点突变对无进展生存期的影响;
70.图16为本发明实施例治疗中游离dna chek2基因k373e位点突变变化对无进展生存期的影响;
71.图17为本发明实施例治疗前游离dna chek2基因r406h位点突变对无进展生存期的影响;
72.图18为本发明实施例治疗中游离dna chek2基因r406h位点突变变化对无进展生存期的影响;
73.图19为本发明实施例治疗中游离dna chek2基因r474c位点突变变化对无进展生
存期的影响;
74.图20为本发明实施例治疗中游离dna chek2基因y390c位点突变变化对无进展生存期的影响;
75.图21为本发明实施例治疗前游离dna mre11a基因k464r位点突变对无进展生存期的影响;
76.图22为本发明实施例治疗中游离dna mre11a基因k464r位点突变变化对无进展生存期的影响;
77.图23为本发明实施例治疗中游离dna atm基因i1407t位点突变对无进展生存期的影响;
78.图24为本发明实施例治疗中游离dna pik3ca基因e707k位点突变变化对无进展生存期的影响;
79.图25为本发明实施例第一组输入因子建立治疗前的目标预测模型的列线图;
80.图26为本发明实施例治疗前的目标预测模型对应的roc曲线以及auc值;
81.图27为本发明实施例治疗前的目标预测模型的校准曲线;
82.图28为本发明实施例第二组输入因子建立的治疗后的目标预测模型的列线图;
83.图29为本发明实施例治疗后的目标预测模型对应的roc曲线以及auc值;
84.图30为本发明实施例治疗后的目标预测模型的校准曲线;
85.图31为本发明实施例第三组输入因子建立阳性对照组的目标预测模型的列线图;
86.图32为本发明实施例阳性对照组的目标预测模型对应的roc曲线以及auc值;
87.图33为本发明实施例阳性对照组的目标预测模型的校准曲线。
具体实施方式
88.下列实施例是对本发明的进一步解释和补充,对本发明不构成任何限制。
89.以下结合附图描述本发明实施例的一种针对parp抑制剂耐药性监测方法。
90.如图1所示,本发明实施例的一种针对parp抑制剂耐药性监测方法,包括如下步骤:
91.s11、分别采集至少一个患者中每个患者应用papr抑制剂治疗前和治疗中的外周血样本。
92.其中,采集的患者需要满足如下条件:
93.(1)年龄≥18岁女性;
94.(2)铂敏感复发性为高级别的上皮性卵巢癌患者,铂类敏感疾病定义为在完成最后一剂铂类化疗后疾病进展≥6个月;
95.(3)患者在入组前应至少接受过2线含铂治疗:对于研究入组前的最后一个化疗疗程,研究者认为患者必须有反应(根据recist 1.1标准的部分或完全放射学反应);
96.(4)ecog评分:0-1;
97.(5)患者的预期寿命必须≥16周。
98.另外,采集的患者排除以下条件:
99.(1)近60天内正在参加其他需要服用药物的临床研究;
100.(2)任何先前使用parp抑制剂的治疗,包括奥拉帕尼;
101.(3)入组前有恶性肿瘤病史;
102.(4)在研究治疗前3周内接受任何全身化疗或放疗(姑息性原因除外)的患者;
103.(5)其他研究者认为不适宜入组的情况。
104.另外,对于外周血样本的采集要求如下:
105.(1)治疗前,采集外周血1次。
106.(2)治疗中,每3个月采集一次直至病例出现复发/进展,确认复发/进展后采集外周血1次。
107.另外,静脉血收集采用游离dna采血管,所有受试者均进行10ml全血样本采集,对样品进行血浆和白细胞分离。
108.其中,治疗前指的是患者应用papr抑制剂治疗前,治疗中指的是患者应用papr抑制剂治疗中。
109.s12、对于每个患者,提取该患者治疗前的外周血样本对应的第一dna样本,以及治疗中的外周血样本对应的第二dna样本。
110.具体地,第一dna样本包括第一游离dna和第一基因组dna,第二dna样本指的是第二游离dna;
111.第一dna样本和第二dna样本提取过程如下:
112.对于治疗前的患者外周血样本,确认没有发生凝血和溶血现象,然后对该外周血样本进行离心操作,离心条件为4℃,相对离心力为1600g,时间为10分钟,完成后收集血浆(上层黄色层)和白细胞(中间层),然后将上层血浆进行第二次离心,离心条件为4℃,相对离心力为16000g,时间为10分钟,以去除残留的细胞或细胞碎片;离心操作完成后,血浆和白细胞样本标记对应的患者编号和分离日期,并于-80℃保存直至使用。
113.另外,血浆将用于第一游离dna的提取,提取方式为使用提取试剂盒在血浆中提取第一游离dna,且第一游离dna通过qubit荧光计进行定量和片段分析使用;白细胞将用于第一基因组dna的提取,提取方式为使用提取试剂盒在白细胞样本中提取第一基因组dna。
114.另外,提取第二dna样本的过程与提取第一游离dna的过程完全相同,故不做重复阐述。
115.s13、对于每个患者,分别对该患者对应的第一dna样本和第二dna样本进行基因突变检测,得到第一dna样本中的第一基因突变信息和第二dna样本中的第二基因突变信息。
116.获得第一基因突变信息和第二基因突变信息的过程如下:
117.采用分子诊断法对游离dna和基因组dna进行基因突变检测,分子诊断法包括高通量测序法、突变扩增系统、数字聚合酶链反应、核酸质谱、sanger测序、实时定量聚合酶链式反应中的任一种。
118.具体地,对游离dna和基因组dna进行捕获建库,其中游离dna和基因组dna基于捕获的文库构建具体方法参照kapa文库构建试剂盒的相关操作指南进行;将构建后的游离dna和基因组dna文库在hiseq-2500平台上进行测序,得到测序结果,将测序结果与hg19/grch38人参考序列进行比对,去除由随机ngs错误造成的本底噪声,两者比对不一致的确认为突变体;通过将包含突变体的独有测序结果的数量与用于映射变体位置的所有测序结果的数量进行对比,以计算突变频率;同时,通过基因组dna测序及结果分析可以获得胚系突变和造血克隆突变,将确认的突变体去除胚系突变和造血克隆突变即可获得第一基因突变
信息或第二基因突变信息。
119.s14、根据各个患者对应的第一基因突变信息和第二基因突变信息,对parp抑制剂耐药性进行监测。
120.具体地,可以将第一基因突变信息作为治疗前新的肿瘤标志物对parp抑制剂耐药性进行监测;将第二基因突变信息作为治疗中的肿瘤标志物对parp抑制剂耐药性进行监测,避免了现有ca125作为肿瘤标志物对parp抑制剂耐药性监测效果差的问题。
121.可选地,上述步骤s14具体包括:
122.根据各个患者对应的第一基因突变信息,确定第三基因突变信息,第三基因突变信息为治疗前对预后产生影响的第一基因突变信息;
123.根据各个患者对应的第二基因突变信息,确定第四基因突变信息,第四基因突变信息为治疗中对预后产生影响的第二基因突变信息。
124.具体地,第三基因突变信息和第四基因突变信息的筛选过程如下:
125.针对检测出的第一基因突变信息和第二基因突变信息,为了更准确的找出对预后产生影响的基因突变信息,本实施例通过kaplan-meier法进一步筛选出第三基因突变信息和第四基因突变信息,具体过程如下:
126.若某个第一基因突变信息携带患者占总患者的比例满足预设条件,则确定该第一基因突变信息是对预后产生影响的潜在基因突变信息,进一步对该第一基因突变信息进行kaplan-meier分析,得到其对应的第一p值;
127.将所述第一基因突变信息中对应的各第一p值小于第四阈值的第一基因突变信息确定为第三基因突变信息,其中预设条件根据实际研究或医生经验进行设置;
128.若某个第二基因突变信息携带患者占总患者的比例满足预设条件,则确定该第二基因突变信息是对预后产生影响的潜在基因突变信息,进一步对该第二基因突变信息进行kaplan-meier分析,得到其对应的第一p值;
129.将所述第二基因突变信息中对应的各第一p值小于第四阈值的第二基因突变信息确定为第四基因突变信息,其中预设条件根据实际研究或医生经验进行设置。
130.可选地,在临床实践中,患者的病例特征也是对预后产生影响的因素之一,因此可以引入对预后产生影响的病例特征作为对parp抑制剂耐药性进行监测的因素,具体地:
131.获取每个所述患者的病历信息;
132.根据各个所述患者的病历信息,确定对预后产生影响的病例特征;
133.所述根据各个所述患者对应的第三基因突变信息和第四基因突变信息,对所述parp抑制剂耐药性进行监测,包括:
134.根据各个所述患者对应的第三基因突变信息、第四基因突变信息和对预后产生影响的病例特征,对所述parp抑制剂耐药性进行监测。本实施例中,患者的病例特征包括年龄、肿瘤分期、是否转移、是否早期肿瘤复发、化疗线数、入组前是否进行减瘤术、入组前化疗反应、ca125初始值、是否复发和papr抑制剂治疗的患者无病进展生存期,上述病例特征是根据实际研究和医生经验筛选出的最具有代表性的病例特征。对于每个所述患者的病历信息,所述病历信息中包括表征该患者是否复发的信息;则上述根据各个所述患者的病历信息,确定对预后产生影响的病例特征,包括:
135.对于每个所述患者的病历信息,根据该患者是否复发的信息,将各患者分为复发
组和未复发组;
136.对于每个患者的病历信息中的每一项因子,确定该因子在复发组和所述未复发组间存在的差异;
137.对于每个因子的组间差异性小于第三阈值,则确定该因子为对预后产生影响的病例特征。
138.可选地,还包括目标预测模型的构建,具体包括:
139.获取第一训练样本,所述第一训练样本包括各个患者对应的基因突变信息,所述基因突变信息为第一基因突变信息或第二基因突变信息;
140.对所述第一训练样本进行第一次筛选,得到所述第一训练样本中满足第一设定条件的第二训练样本;
141.对所述第二训练样本结合对预后产生影响的病例特征进行第二次筛选,得到所述第二训练样本中满足第二设定条件的第三训练样本;
142.对所述第三训练样本进行第三次筛选,得到所述第三训练样本中满足第三设定条件的第四训练样本;
143.根据所述第四训练样本,对初始模型进行构建,得到目标预测模型,所述目标预测模型用于根据基因突变信息得到对papr抑制剂耐药性进行监测,得到监测结果。
144.其中,如果将第三基因突变信息作为第一输入样本,则获得的目标预测模型为治疗前的目标预测模型,如果将第四基因突变信息作为第一输入样本,则获得的目标预测模型为治疗中的目标预测模型;
145.可选地,本实施例为了得到更精准的预测,对于治疗前的目标预测模型,将第三基因突变信息结合对预后产生影响的病例特征作为第三训练样本,对第三训练样本进行cox多因素分析得到第四样本,将第四样本作为治疗前的目标预测模型的输入,同样,对于治疗中的目标预测模型,将第四基因突变信息结合对预后产生影响的病例特征作为第三训练样本,对第三训练样本进行cox多因素得到第四样本,将第四样本作为治疗中的目标预测模型的输入。
146.可选地,第二训练样本、第三训练样本和第四训练样本的筛选过程如下:
147.对所述第一训练样本进行kaplan-meier分析,得到所述第一训练样本中每一项第一训练样本的第一p值;
148.将所述第一训练样本对应的各第一p值中小于第四阈值的第一p值对应的第一训练样本确定为所述第二训练样本;
149.对所述第二训练样本结合对预后产生影响的病例特征进行cox单因素分析,得到所述第二训练样本中每一项第二训练样本的第二p值;
150.将所述第二训练样本对应的各第二p值中小于第五阈值的第二p值对应的第二训练样本确定为所述第三训练样本;
151.对所述第三训练样本进行cox多因素分析,得到所述第三训练样本中每一项第三训练样本的第三p值;
152.将所述第三训练样本对应的各第三p值中小于第六阈值的第三p值对应的第三训练样本确定为所述第四训练样本。
153.本实施例中,治疗中的目标预测模型与治疗前的目标预测模型构建过程相同,区
别仅在于将第四基因突变信息结合对预后产生影响的病理特征作为第三训练样本,故不作重复阐述。
154.优选地,构建好目标预测模型后,将目标预测模型以列线图形式进行可视化展示,并通过roc曲线及校准曲线对目标预测模型的准确性和特异性进行评估,确定parp抑制剂耐药性对应监测结果,监测结果包括病例总评分、风险等级评定。通过监测结果可将计划接受parp抑制剂治疗患者的复发风险分为低风险组和高风险组,还可将正在接受parp抑制剂治疗患者的耐药风险分为低风险组和高风险组。
155.基于上述一种针对parp抑制剂耐药性监测方法相同的原理,本发明实施例还提供一种针对parp抑制剂耐药性监测装置,包括:
156.数据采集模块,用于分别采集至少一个患者中每个患者应用papr抑制剂治疗前和治疗中的外周血样本;
157.dna样本提取模块,用于对每个患者,提取该患者治疗前的外周血样本对应的第一dna样本,以及治疗中的外周血样本对应的第二dna样本;
158.基因突变检测模块,用于对每个患者,分别对该患者对应的第一dna样本和第二dna样本进行基因突变检测,得到所述第一dna样本中的第一基因突变信息和所述第二dna样本中的第二基因突变信息。
159.可选的,上述parp抑制剂耐药性监测模块具体用于:
160.根据各个所述患者对应的第一基因突变信息,确定第三基因突变信息,所述第三基因突变信息为治疗前对预后产生影响的第一基因突变信息;
161.根据各个所述患者对应的第二基因突变信息,确定第四基因突变信息,所述第四基因突变信息为治疗中对预后产生影响的第二基因突变信息;
162.根据所述第三基因突变信息和所述第四基因突变信息,对所述parp抑制剂耐药性进行监测。
163.上述parp抑制剂耐药性监测模块在根据各个患者对应的第一基因突变信息和第二基因突变信息,对parp抑制剂耐药性进行监测时,具体用于:
164.根据各个所述患者对应的第三基因突变信息、第四基因突变信息和对预后产生影响的病例特征,对所述parp抑制剂耐药性进行监测。
165.可选地,还包括病例特征筛选模块,用于筛选出确定对预后产生影响的病例特征,包括:
166.对于每个患者的病历信息,根据该患者是否复发的信息,将各所述患者分为复发组和未复发组;
167.对于每个患者的病历信息中的每一项因子,确定该因子在复发组和所述未复发组间存在的差异;
168.对于每个因子的组间差异性小于第三阈值,则确定该因子为对预后产生影响的病例特征。
169.可选地,目标预测模型包括样本筛选模块和训练模块;
170.其中,样本筛选模块用于对第一训练样本进行筛选,分别筛选出第二训练样本、第三训练样本和第四训练样本,具体为:
171.获取第一训练样本,所述第一训练样本包括各个患者对应的基因突变信息,基因
突变信息为第一基因突变信息或第二基因突变信息;
172.对第一训练样本进行第一次筛选,得到第一训练样本中满足第一设定条件的第二训练样本;
173.对所述第二训练样本结合对预后产生影响的病例特征进行第二次筛选,得到所述第二训练样本中满足第二设定条件的第三训练样本;
174.对所述第三训练样本进行第三次筛选,得到所述第三训练样本中满足第三设定条件的第四训练样本;
175.训练模块用于利用第四训练样本训练初始模型,从而获得目标预测模型,具体为:
176.根据第四训练样本,对初始模型进行训练,得到目标预测模型,目标预测模型用于根据基因突变信息及对预后产生影响的病例特征对papr抑制剂耐药性进行监测,得到监测结果。
177.可选地,还包括监测结果评分模型,根据各个患者对应的第一基因突变信息和第二基因突变信息,对parp抑制剂耐药性进行监测,包括:
178.根据各个患者对应的第一基因突变信息和第二基因突变信息,确定所述parp抑制剂耐药性对应监测结果,监测结果包括病例总评分、风险等级评定。
179.本发明实施例的一种电子设备,包括存储器、处理器及存储在存储器上并在处理器上运行的程序,处理器执行程序时实现上述任一种针对parp抑制剂耐药性监测方法的部分或全部步骤。
180.其中,电子设备可以选用电脑、手机等,相对应地,其程序为电脑软件或手机app等,且上述关于本发明的一种电子设备中的各参数和步骤,可参考上文中一种针对parp抑制剂耐药性监测方法的实施例中的各参数和步骤,在此不做赘述。
181.本发明的一种计算机可读存储介质,计算机可读存储介质中存储有指令,当指令在终端设备上运行时,使得终端设备执行一种针对parp抑制剂耐药性监测的步骤。
182.本发明为了更好的验证本实施例的方法,现以一个具体实施例进行详细说明。
183.本实施例选取25个病例患者的病历信息进行说明,将25个检测病例按照复发情况分为三类,复发时间<12月(占15例),复发时间>12月(占4例),未复发(占6例),前期第一基因信息和第二基因信息的获取过程省略,从步骤s13开始叙述;
184.(1)第一基因突变信息和第二基因突变信息的获取;
185.本实施例采用高通量测序法进行基因突变的检测,dna损伤修复通路相关的42个基因纳入基因检测panel,详见下表1。
186.表1
187.atmatrbard1brafbrca1brca2brip1c11orf30chek1chek2egfrerbb2fam175afancafancihraskrasmap2k1metmlh1map2k1msh2msh6nbnnf1nraspalb2parp1pdgfrapik3capms2polerad50rad51brad51crad51drad54lraf1rbbp8tp53tp53bp1vegfa
188.对表1中的基因进行基因突变率的统计(基因突变率指突变携带者在患者人群中所占比率),第一基因突变信息的基因突变率如下表1-1所示,第二基因突变信息的基因突
变率如下表1-2所示:
189.表1-1
190.基因名突变率chek296%tp5332%mre11a16%atm12%pms212%fanci8%rad508%atr8%brca18%brca28%nf18%fanca8%tp53bp14%raf14%rad54l4%rad51c4%pik3ca4%met4%kras4%braf4%pole4%egfr4%
191.表1-2
[0192][0193][0194]
本实施例仅选取突变率前五的基因,经过表1-1统计第一基因突变信息包括:chek(96%)、tp53(32%)、mre11a(16%)、atm(12%)、pms2(12%),经过表1-2统计第二基因突变信息包括:chek2(100%)、mre11a(68%)、tp53(48%)、atm(44%)、egfr(16%);同时还对致病性和可能致病性胚系突变率进行了统计,如下表1-3所示,致病性和可能致病性胚系突变在10个病例中发现,突变率:40%,在各复发组别中均有检出,发现8例为brca胚系突变,突变率:32%,gbrca胚系突变主要在无进展生存期较长的病例中出现。因此,gbrca胚系突变也可作为第一基因突变信息和第二基因突变信息。
[0195]
表1-3
[0196]
基因名突变率brca124%brca28%fanca4%rad51c4%rad51d4%
[0197]
(2)第三基因突变信息和第四基因突变信息的获取;
[0198]
对于本实施例,可将某个第一基因突变信息或第二基因突变信息携带患者达到3人以上的情况所对应的基因突变信息作为对预后产生影响的潜在基因突变信息。如图2-图14所示,均表示治疗前/治疗中游离dna中某个基因突变对无进展生存期的影响,横坐标表示时间(单位是月),纵坐标表示无进展生存期比例,间断线表示应用parp抑制剂时携带该基因突变患者随着治疗时间变长无进展生存期比例情况,点线表示应用parp抑制剂时未携带该基因突变患者随着治疗时间变长无进展生存期比例情况。综上,当间断线和点线随着
parp抑制剂治疗时间变长发生差异走向且差异性第一p值小于第四阈值(本实施例将第四阈值设为0.05),说明该基因突变信息对parp抑制剂的耐药性存在影响。因此,根据图2和图3判断出第三基因突变信息和第四基因突变信息中突变基因均为mre11a。同时,结合临床实践经验,将gbrca胚系突变也作为第三基因突变信息和第四基因突变信息中的突变基因。如图15-图24所示,均表示治疗前/治疗中游离dna中某个基因突变位点对无进展生存期的影响,横坐标表示时间(单位是月),纵坐标表示无进展生存期比例,间断线表示应用parp抑制剂时携带该基因突变位点患者随着治疗时间变长无进展生存期比例情况,点线表示应用parp抑制剂时未携带该基因突变位点患者随着治疗时间变长无进展生存期比例情况。综上,当间断线和点线随着parp抑制剂治疗时间变长发生差异走向且差异性第一p值小于第四阈值(本实施例将第四阈值设为0.05),说明该基因突变信息对parp抑制剂的耐药性存在影响。因此,根据图15和图21判断出第三基因突变信息中基因突变位点包括chek2基因k373e位点和mre11a基因k464r位点。考虑到chek2基因突变在治疗前患者中的高频分布及chek2基因r406h位点的高发性,将chek2基因r406h位点作为潜在基因突变信息纳入第三基因突变信息;根据图16、图18和图22判断出第四基因突变信息中基因突变位点包括chek2基因k373e位点、chek2基因r406h位点和mre11a基因k464r位点。
[0199]
(3)对预后产生影响的病例特征;
[0200]
本实施例选取的患者病例特征如下表2所示:
[0201]
表2
[0202]
[0203][0204]
本实施例中现将每一项因子在复发组和未复发组间存在的差异进行了统计,如下表3。结果显示仅肿瘤分期在复发组和未复发组间对应的差异小于第三阈值(本实施例将第三阈值设为0.15);而临床实践中,患者年龄因素会对预后产生重要影响;因此,本实施例中,选用年龄及肿瘤分期作为对预后产生影响的病例特征。
[0205]
表3
[0206]
[0207][0208]
(4)本实施例中,共构建三个目标模型,分别为治疗前的目标预测模型、ca125阳性对照的目标预测模型和治疗中的目标预测模型,其中第一训练样本为第一基因突变信息和第二基因突变信息,第二训练样本为第一p值小于第四阈值的基因突变信息,以上已做阐述,不重复赘述,第三训练样本及第四训练样本分别采用如下:
[0209]
治疗前的第三训练样本:年龄、肿瘤分期、gbrca胚系突变、chek2.p.k373e、mre11a.p.k464r;
[0210]
ca125阳性对照的第三训练样本:年龄、肿瘤分期、gbrca胚系突变、ca125变化;
[0211]
治疗中的第三训练样本:年龄、肿瘤分期、gbrca胚系突变、mre11a.p.k464r、chek2.p.r406h;
[0212]
本实施例中,通过cox单因素分析和cox多因素分析分别得到第三训练样本和第四训练样本的结果,如下表4所示(本实施例中,第五阈值采用0.1;第六阈值采用0.05):
[0213]
表4
[0214][0215]
由于本实施例研究样本量偏小,gbrca虽然在cox多因素分析中第三p值未小于0.05,但由于已有明确的证据支持其会对parp抑制剂的疗效及预后产生影响,因此将其作为本实施例中第四训练样本,通过上表可以获取到三个模型的第四训练样本分别为:
[0216]
治疗前的目标预测模型:年龄、gbrca胚系突变、mre11a.p.k464r;
[0217]
ca125阳性对照的目标预测模型:年龄、gbrca胚系突变、ca125变化;
[0218]
治疗中的目标预测模型:gbrca胚系突变、mre11a.p.k464r、chek2.p.r406h。
[0219]
对于治疗前的目标预测模型以列线图形式进行展示,图25所示:points代表分值;age代表年龄,年龄《50岁记为0,年龄≥50岁,记为1;pre-mre11a.p.k464r代表治疗前mre11a p.k464r,治疗前mre11ap.k464r为野生型记为0,突变型记为1;gbrca表示gbrca胚系突变,gbrca胚系突变检出致病性或疑似致病性突变记为1,其他类型突变或野生型记为0;total points代表总评分阈值;1-year pfs prob表示1年内患者无病进展生存期的概率,1.5-year pfs prob表示1.5年内患者无病进展生存期的概率,2-year pfs prob表示2年内患者无病进展生存期的概率;另外,如图26所示通过roc曲线对治疗前目标预测模型预测的1年内患者无病进展生存期、1.5年内患者无病进展生存期及2年内患者无病进展生存期的预测效能进行评估,横坐标表示假阳性率,纵坐标表示真阳性率,其横纵坐标构成的曲线下面积——auc值越大,表明治疗前的目标预测模型的预测结果越准确。如图27为治疗前的预测模型的校准曲线图,横坐标表示治疗前的目标预测模型预测的1年内患者无病进展生存期的概率、1.5年内患者无病进展生存期的概率以及2年内患者无病进展生存期的概率
的结果,纵坐标表示实际观察到的临床结果,中间的虚线为校准线,可见治疗前的预测目标模型的预测结果与实际观察到的实际临床结局接近。
[0220]
对于治疗中的目标预测模型以列线图形式进行展示,如图28所示:points代表分值;post-mre11a p.k464r代表治疗中mre11a p.k464r,mre11a p.k464r为治疗中新出现的变异记为1,治疗前存在的变异或野生型记为0;post-chek2 p.r406h为治疗中chek2 p.r406h,chek2p.r406h治疗后新出现的变异或突变丰度升高记为1,突变丰度未发生明显变化或野生型记为0;gbrca表示gbrca胚系突变,gbrca胚系突变检出致病性或疑似致病性突变记为1,其他类型突变或野生型记为0;total points代表总评分阈值;1-year pfs prob表示1年内患者无病进展生存期的概率,1.5-year pfs prob表示1.5年内患者无病进展生存期的概率,2-year pfs prob表示2年内患者无病进展生存期的概率;另外,如图29所示通过roc曲线对治疗中目标预测模型预测的1年内患者无病进展生存期、1.5年内患者无病进展生存期及2年内患者无病进展生存期的预测效能进行评估,横坐标表示假阳性率,纵坐标表示真阳性率,其横纵坐标构成的曲线下面积——auc值越大,表明治疗中的目标预测模型的预测结果越准确。如图30为治疗前的预测模型的校准曲线图,横坐标表示治疗前的目标预测模型预测的1年内患者无病进展生存期的概率、1.5年内患者无病进展生存期的概率以及2年内患者无病进展生存期的概率的结果,纵坐标表示实际观察到的临床结果,中间的虚线为校准线,可见治疗中的预测目标模型的预测结果与实际观察到的实际临床结局接近。
[0221]
对于ca125阳性对照的目标预测模型以列线图形式进行展示,如图31所示:points代表分值;age代表年龄,年龄《50岁记为0,年龄≥50岁,记为1;ca125表示ca125浓度,ca125浓度持续升高记为1,否则记为0;gbrca表示gbrca胚系突变,gbrca胚系突变检出致病性或疑似致病性突变记为1,其他类型突变或野生型记为0;total points代表总评分阈值;1-year pfs prob表示1年内患者无病进展生存期的概率,1.5-year pfs prob表示1.5年内患者无病进展生存期的概率,2-year pfs prob表示2年内患者无病进展生存期的概率;另外,如图32所示通过roc曲线对ca125阳性对照目标预测模型预测的1年内患者无病进展生存期、1.5年内患者无病进展生存期及2年内患者无病进展生存期的预测效能进行评估,横坐标表示假阳性率,纵坐标表示真阳性率,其横纵坐标构成的曲线下面积——auc值越大,表明ca125阳性对照的目标预测模型的预测结果越准确。如图33为ca125阳性对照的目标预测模型的校准曲线图,横坐标表示ca125对照的目标预测模型预测的1年内患者无病进展生存期的概率、1.5年内患者无病进展生存期的概率以及2年内患者无病进展生存期的概率的结果,纵坐标表示实际观察到的临床结果,中间的虚线为校准线,可见ca125阳性对照的目标预测模型的预测结果与实际观察到的实际临床结局接近。
[0222]
通过对比图29和图32,可观察到治疗中的目标预测模型的预测效能要优于ca125阳性对照的目标预测模型的预测效能,体现在对患者无病进展生存期进行预测的auc值均有升高。
[0223]
(5)根据目标预测模型的输出结果,确定parp抑制剂耐药性对应监测结果;
[0224]
本实施例中根据列线图的评分模型先对患者每一项因子进行评分,并将各项因素评分进行累加计算获得该病例的总评分,通过graphpad prism软件绘制roc曲线获得病例总评分阈值、敏感度、特异性的模型参数,如下表5所示:
[0225]
表5
[0226][0227]
依据上表5,对患者进行风险等级评定:以总评分阈值为界将应用某款parp抑制剂的复发风险分为低风险组(《116分)和高风险组(≥116分);以总评分阈值为界将应用某款parp抑制剂的耐药风险分为低风险组(《100分)和高风险组(≥100分)。本实施例以病例总评分和风险等级评定作为parp抑制剂耐药性的监测结果,为医生制定治疗方案提供决策依据。
[0228]
综上所述,本发明建立了一种针对parp抑制剂耐药性监测的方法、装置、设备及介质,并以列线图形式进行展示。该列线图评分模型的预测准确性优于临床常用的ca125指标,该模型简明扼要,通俗易懂,便于临床医生以及患者操作,可对接受parpi治疗后1年、1.5年、2年治疗获益情况进行个体化预测。同时,该列线图评分的模型分为治疗前和治疗中两个部分,有利于对治疗人群进行精准动态管理,从而为临床医生制定治疗方案提供决策依据。
[0229]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。