1.本发明属于食源性致病微生物检测技术领域,具体涉及一种农业用水中食源性致病微生物的富集方法及应用。
背景技术:
2.食源性致病微生物是污染食品、农产品的主要生物危害物,严重威胁人类健康,也给食品、农产品产业造成巨大经济损失。鲜食果蔬中存在多种食源性致病微生物污染风险。产地环境为果蔬中食源性致病微生物的主要污染来源。鲜食果蔬农产品在生产过程中易受诺如病毒、致泻大肠杆菌等致病微生物的污染,且鲜食果蔬因其货架期短需冷链运输,致病微生物易于在供应链中长时间存活(且食源性病毒不易被彻底消杀),加工或生食时存在很大安全风险。
3.农业用水中致病微生物含量低,且种类繁杂,因此,针对农业用水中的致病微生物进行同步、全面有效的富集是同步检测致病菌及食源性病毒的关键环节。目前,常用的富集致病微生物的方法,多仅针对致病菌或食源性病毒,针对农业用水中的所有常见致病微生物(致病细菌和食源性病毒)而言存在一定局限。
4.现有针对农业用水中的微生物的富集方法主要分为针对细菌的滤膜法和针对病毒富集的玻璃棉、石墨烯等材料富集法、加压滤膜法等,目前还没有可用于农业用水中细菌和病毒同时富集的方法。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种农业用水中食源性致病微生物的富集方法及应用,实现同时富集致病细菌和食源性病毒的目的。
6.本发明提供了一种农业用水中食源性致病微生物的富集方法,包括以下步骤:
7.1)将预处理的农业用水经滤膜抽滤,得到截留有微生物的滤膜和滤膜滤液;
8.2)将步骤1)中所述截留有微生物的滤膜进行洗脱,所得洗脱液经固液分离,所得固相为膜细菌组分,所得液相为膜病毒组分;
9.3)将步骤1)中所述滤膜滤液经切向流过滤处理,获得切向流过滤的病毒组分;
10.步骤2)和步骤3)之间没有时间顺序的限制。
11.优选的,步骤1)中滤膜的孔径包括0.2~0.8μm。
12.优选的,步骤1)中滤膜过滤包括依次采用大孔径滤膜、小孔径滤膜过滤;
13.所述大孔径滤膜为孔径0.45~0.8μm的滤膜;所述小孔径滤膜包括0.2μm的滤膜。
14.优选的,步骤2)中所述洗脱用溶液为第一洗脱缓冲液;
15.所述第一洗脱缓冲液包括以下浓度的组分:牛肉粉10~15g/l、tris-base0.1~0.2mol/l、甘氨酸0.05~0.1mol/l;
16.步骤2)中所述分离为离心法,所述离心的转速为3000~6000
×
g,所述离心的时间为5~10min。
17.优选的,步骤3)中切向流过滤处理依次包括切向流过滤浓缩和洗脱。
18.优选的,所述切向流过滤浓缩的时间为30~60min。
19.优选的,所述洗脱用溶液为第二洗脱缓冲液;所述第二洗脱缓冲液包括以下浓度的组分:牛肉粉20~30g/l、tris-base 0.2~0.4mol/l、甘氨酸0.1~0.2mol/l。
20.优选的,还包括步骤2)中含病毒组分的溶液和/或步骤3)中所述切向流过滤的病毒组分进行病毒沉淀,得到含食源性病毒和/或冠状病毒的病毒液。
21.优选的,所述病毒沉淀的方法依次包括peg沉淀试剂处理和固液分离。
22.优选的,所述peg沉淀试剂包括以下浓度的水溶液:peg-80008~200g/l、氯化钠17.5~37.4g/l;
23.所述peg沉淀试剂的处理时间为1~12h;
24.所述peg沉淀试剂的处理温度为1~5℃。
25.所述固液分离包括离心;所述离心的转速为4500~8000rpm,所述离心的时间为30~120min。
26.优选的,所述致病细菌包括以下细菌中的一种或几种:单增李斯特、金黄色葡萄球菌、大肠杆菌和沙门氏菌;
27.所述食源性病毒包括以下病毒中的一种或几种:诺如病毒、甲型肝炎病毒和轮状病毒;
28.所述冠状病毒包括猪流行性腹泻病毒。
29.本发明提供的所述富集方法联合实时荧光定量pcr检测技术或高通量测序技术在快速检测农业用水中食源性致病微生物中的应用。
30.本发明一种农业用水中食源性致病微生物的富集方法,将预处理的农业用水用加压滤膜法实现微生物的初分离,使细菌等微生物被截留在滤膜上,部分病毒可以通过滤膜,存在于滤膜滤液中;被截留在滤膜上的微生物经过洗脱和固液分离,所得固相为膜细菌组分,所得液相为含病毒组分的溶液;同时滤膜滤液经切向流过滤处理,获得切向流过滤病毒组分。采用本发明提供的富集方法,可对水样中的多种致病细菌和食源性病毒同时进行富集、分离,缩短富集时间,食源性病毒回收率最高可达62.60%,致病菌回收率最高可达94.24%,可有效富集多种常见致病细菌(单增李斯特、金黄色葡萄球菌、沙门氏菌、大肠杆菌)、食源性病毒(人诺如病毒(gi和gii型)、甲型肝炎病毒、轮状病毒)和冠状病毒(猪流行性腹泻病毒),配合高通量测序技术可用于农业用水中食源性致病微生物的快速检测。
附图说明
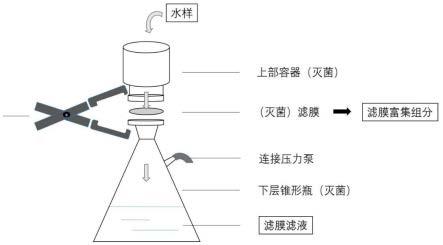
31.图1为本发明所述富集过程涉及的滤膜抽滤装置示意图;
32.图2为本发明所述富集过程涉及的切向流过滤浓缩装置示意图。
具体实施方式
33.本发明提供了一种农业用水中食源性致病微生物的富集方法,包括以下步骤:
34.1)将预处理的农业用水经滤膜抽滤,得到截留有微生物的滤膜和滤膜滤液;
35.2)将步骤1)中所述截留有微生物的滤膜进行洗脱,所得洗脱液经固液分离,所得固相为膜细菌组分,所得液相为膜病毒组分;
36.3)将步骤1)中所述滤膜滤液经切向流过滤处理,获得切向流过滤的病毒组分。
37.本发明将预处理的农业用水经滤膜抽滤,得到截留有微生物的滤膜和滤膜滤液。
38.在本发明中,所述农业用水优选包括农业灌溉用水和/或农业养殖用水。所述预处理的方法优选为去除农业用水中水草、藻类等杂质。去除杂质的方法优选用1~2mm孔径的滤网完成。在本发明实施例中,所述去除杂质的方法采用4~6层灭菌纱布过滤。本发明对所述农业用水的来源没有特殊限制,采用本领域所熟知的农业用水的来源即可。在本发明实施例中,所述农业用水来自南京市、句容市、盐城市农业灌溉水和养殖水的天然样本。
39.在本发明中,所述滤膜的孔径优选包括0.2~0.8μm,具体为0.2、0.45、0.6、0.8μm。当农业用水所含微生物浓度高时,滤膜过滤优选包括依次采用大孔径滤膜过滤,得到截留有微生物的大孔径滤膜和滤液;然后过滤装置更换小孔径滤膜后,将所得滤液进行小孔径滤膜过滤;小孔径滤膜过滤后得到滤膜滤液和截留有微生物的小孔径滤膜。所述大孔径滤膜优选为孔径0.45~0.8μm的滤膜;所述小孔径滤膜优选包括0.2μm的滤膜。所述滤膜抽滤时,优选采用图1所示的滤膜抽滤装置完成。所述滤膜抽滤的压力优选为负压,具体为50~70kpa,更优选为60kpa。
40.得到截留有微生物的滤膜后,本发明将所述截留有微生物的滤膜进行洗脱,所得洗脱液固液分离,所得固相为膜细菌组分,所得液相为膜病毒组分的溶液。
41.在本发明中,所述洗脱的方法优选为对截留有微生物的滤膜(包括截留有微生物的大孔径滤膜和截留有微生物的小孔径滤膜)用洗脱用溶液振荡浸泡滤膜。所述浸泡的时间优选为30~60min,最优选为60min。所述振荡的转速优选为100-300rpm,最优选为200rpm。所述洗脱用溶液为第一洗脱缓冲液。所述第一洗脱缓冲液优选包括以下浓度的组分:牛肉粉10~15g/l、tris-base 0.1~0.2mol/l、甘氨酸0.05~0.1mol/l。所述第一洗脱缓冲液能够将截留在滤膜上的大部分微生物洗脱下来。所述固液分离的方法优选为离心法。所述离心的转速优选为3000~6000
×
g,最优选为6000
×
g。所述离心的时间优选为5~10min,最优选为10min。所得沉淀为膜细菌组分组分,所述上清为膜病毒组分。所述膜细菌组分主要为农业用水中富集到的大部分致病细菌。
42.得到滤膜滤液后,本发明将所述滤膜滤液经切向流过滤处理,获得切向流过滤病毒组分。
43.在本发明中,由于病毒颗粒较小在膜过滤时,大部分病毒会通过滤膜进入滤液中,采用切向流过滤处理方法实现对水体中大部分病毒的富集。所述过滤处理优选采用图2所示的切向流过滤装置中进行。所述切向流过滤处理优选依次包括切向流过滤浓缩和洗脱。在本发明实施例中,所述切向流过滤处理的方法具体为将过滤装置的进水管和出水管放入所述滤液中,开启蠕动泵至过滤装置负压状态;将浓缩后的滤液经出水管全部转移至无菌离心管,再将等体积洗脱用溶液经进水管进入过滤装置,循环洗脱,经出水口转移至无菌离心管,该组分为切向流过滤的病毒富集组分。所述负压的压力优选为1.5~2.0mpa。所述切向流过滤浓缩的时间优选为30~60min,最优选为60min。所述循环洗脱的时间优选为10~20分钟,压力优选为0.5~1.0mpa。所述洗脱用溶液优选为第二洗脱缓冲液;所述第二洗脱缓冲液优选包括以下浓度的组分:牛肉粉20~30g/l、tris-base 0.2~0.4mol/l、甘氨酸0.1~0.2mol/l。本发明对所述切向流过滤浓缩装置的来源没有特殊限制,采用本领域所熟知的切向流过滤浓缩装置即可。
44.在本发明中,优选还包括膜上含病毒组分的溶液和/或所述切向流过滤病毒组分进行病毒沉淀,得到含食源性病毒和/或冠状病毒的病毒液。所述病毒沉淀的方法优选依次包括peg沉淀试剂处理和固液分离。所述peg沉淀试剂优选包括以下终浓度的水溶液:peg-80008~200g/l、氯化钠17.5~37.4g/l,最优选为peg-8000200g/l、氯化钠37.4g/l。所述peg沉淀试剂的处理时间优选为1~12h,最优选为10h。所述peg沉淀试剂的处理温度优选为1~5℃,最优选为4℃。所述固液分离优选包括离心。所述离心的转速优选为4500~8000rpm,最优选为8000rpm。所述离心的时间优选为30~120min,最优选为30min。
45.在本发明中,所述富集方法适合所有种类的致病细菌、食源性病毒以及冠状病毒的富集。优选将富集的细菌组分进行增菌培养,以保证低浓度致病细菌的检出。将含所述致病细菌、食源性病毒和冠状病毒的富集液所获核酸分别采用taqman实时荧光定量pcr检测方法以检测所富集的细菌、病毒。
46.鼠源诺如病毒的引物对及探针来源于kitajima et al.(2010),人诺如病毒(gi和gii型)和甲型肝炎病毒的引物对及探针来源于国际标准iso/ts15216-1(2017),轮状病毒的引物对及探针来源于asmah,et.al.(2001),冠状病毒(猪流行性腹泻病毒)的引物对及探针来源于fan et al.(2019)。致病细菌的的引物对及探针来源于国家标准snt 1870-2016。
47.在本发明实施例中,在南京市、句容市、盐城市农业灌溉水和养殖水的天然样本中检出包括常见致病细菌(单增李斯特、金黄色葡萄球菌、沙门氏菌和大肠杆菌o157)、食源性病毒(gi型、gii型诺如病毒、轮状病毒和甲型肝炎病毒)及冠状病毒(猪流行性腹泻病毒)。致病细菌的最低检测限在1.61~146cfu/ml,食源性病毒的最低检测限在1.32~55基因拷贝(gc)/ml,冠状病毒(猪流行性腹泻病毒)的最低检测限在103基因拷贝(gc)/ml。
48.本发明提供的所述富集方法联合实时荧光定量pcr检测技术或高通量测序技术在快速检测农业用水中食源性致病微生物中的应用。
49.下面结合实施例对本发明提供的一种农业用水中食源性致病微生物的富集方法及应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
50.实施例1
51.对人工添加有食源性致病微生物(单增李斯特、金黄色葡萄球菌、肠炎沙门氏菌、诺如病毒、轮状病毒、鼠源诺如病毒(质控病毒)、甲型肝炎病毒和冠状病毒)农业灌溉水样品中致病微生物的富集方法
52.取500ml农业灌溉水,加入稀释的上述病毒和细菌的混合液,病毒母液数量级为108基因拷贝(gc)/ml,细菌母液数量级为108cfu/ml,水样中病毒和细菌的最终浓度分别为100、101、102、103、104、105gc/ml和100、101、102、103、104、105cfu/ml;所述病毒为人诺如病毒(gi型和gii型)、鼠源诺如病毒或轮状病毒;冠状病毒(猪流行性腹泻病毒);细菌包括单增李斯特、金黄色葡萄球菌或沙门氏菌,依次进行不同孔径滤膜抽滤。
53.大孔径滤膜抽滤:将0.45μm灭菌滤膜装在已灭菌的滤膜抽滤装置中(图1),连接压力泵,开启压力泵至滤膜呈负压状态;将已添加病毒的水样,加入滤膜抽滤装置上部容器,通过滤膜抽滤至下层锥形瓶,获得大孔径滤膜滤液;关闭压力泵,取下滤膜,转移至无菌培养皿中,用洗脱缓冲液浸泡,在摇床上洗脱60分钟,转速为200rpm,该组分为大孔径滤膜富集组分;所述洗脱后,离心分离洗脱组分,转速为6000
×
g,时间为5分钟,沉淀为大孔径膜细菌组分,上清为大孔径膜病毒组分;大孔径膜细菌组分用dpbs溶解。
54.小孔径滤膜抽滤:将0.2μm灭菌滤膜装在(另一个)已灭菌的滤膜抽滤装置中(图1),连接压力泵,开启压力泵至滤膜呈负压状态;所述大孔径滤膜滤液加入上部容器,通过滤膜抽滤至下层锥形瓶,获得0.2μm滤膜滤液;关闭压力泵,取下滤膜,转移至无菌培养皿中,用洗脱缓冲液浸泡,在摇床上洗脱60分钟,转速为200rpm,该组分为0.2μm滤膜富集组分;所述洗脱后,离心分离洗脱组分,转速为6000
×
g,时间为5分钟,沉淀为0.2μm膜细菌组分,上清为0.2μm膜病毒组分;0.2μm膜细菌组分用dpbs溶解。
55.所述0.2μm滤膜滤液(图1,下层锥形瓶)利用切向流过滤富集(图2),将过滤装置的进水管和出水管放入所述滤液中,开启蠕动泵至过滤装置负压状态,压力为2.0mpa,时间为60分钟;将浓缩后滤液经出水管全部转移至无菌离心管,再将等体积洗脱液经进水口进入过滤装置,循环洗脱20分钟,压力为1.0mpa,经出水口转移至无菌离心管,该组分为切向流过滤病毒组分。
56.病毒沉淀:将大孔径和0.2μm滤膜过滤所得膜病毒组分和切向流过滤病毒组分进行病毒沉淀,根据各组分体积加入peg-8000和nacl,peg-8000的终浓度为100g/l,所述氯化钠的终浓度为24g/l;混匀后,在4℃沉淀4h;4℃、8000rpm离心30分钟;膜病毒组分或切向流过滤病毒组分的沉淀用dpbs溶解。
57.食源性病毒核酸提取:(大孔径和0.2μm)滤膜富集的膜病毒组分和切向流过滤病毒组分利用trizol-ls提取rna,利用一步法rna反转录实时荧光定量检测试剂盒(toyobo,japan;qiagen,germany),对各病毒进行taqman探针实时荧光定量检测。引物序列参见表1,反应程序参见表2。
58.表1引物序列表
[0059][0060][0061]
表2病毒检测的反应程序
[0062][0063]
病毒的回收率按照公式i计算得到。
[0064]
回收率(%)=(富集病毒基因拷贝数/添加病毒基因拷贝数)
×
100%公式i
[0065]
结果见表3。人诺如病毒(gi型和gii型)的回收率分别为38.05%~62.60%和14.80%~39.81%,最低检出限分别为4.48gc/ml和11gc/ml;轮状病毒的回收率为17.41%~57.35%,最低检出限为16gc/ml;甲型肝炎病毒的回收率为54.04%~82.22%,最低检出限为8.72gc/ml;冠状病毒(猪流行性腹泻病毒)的回收率为10.96%~30.63%,最低检出限为103gc/ml;鼠源诺如病毒(质控病毒)的回收率为14.69%~65.30%,最低检出限为1.74
×
103gc/ml。
[0066]
表3回收的各病毒的回收率结果
[0067]
[0068][0069]
常见致病菌核酸提取:所述(大孔径和0.2μm)膜细菌组分利用细菌dna提取试剂盒提取细菌dna,利用实时荧光定量检测试剂盒(vazyme,china),对各细菌进行taqman探针实时荧光定量检测,引物序列见表1,反应程序见表4。
[0070]
表4细菌检测反应程序
[0071][0072]
致病菌的回收率利用公式ii计算得到。
[0073]
回收率(%)=(富集细菌数cfu/添加细菌数cfu)
×
100%公式ii
[0074]
结果见表5。单增李斯特的回收率为22.32%~46.44%,最低检出限为0.175cfu/ml,金黄色葡萄球菌的回收率为13.68%~35.48%,最低检出限为0.0293cfu/ml,肠炎沙门氏菌的回收率为45.61%~94.24%,最低检出限为31.9cfu/ml。
[0075]
表5回收的各细菌的回收率结果
[0076]
[0077][0078]
实施例2
[0079]
农业灌溉水、养殖水样品中致病微生物富集方法
[0080]
取500ml农业灌溉水或养殖水,添加质控病毒mnv,依次进行不同孔径滤膜抽滤。
[0081]
大孔径滤膜抽滤:将0.8μm灭菌滤膜装在已灭菌的滤膜抽滤装置中(图1),连接压力泵,开启压力泵至滤膜呈负压状态;将已添加病毒的水样,加入滤膜抽滤装置上部容器,通过滤膜抽滤至下层锥形瓶,获得大孔径滤膜滤液;关闭压力泵,取下滤膜,转移至无菌培养皿中,用洗脱缓冲液浸泡,在摇床上洗脱60分钟,转速为200rpm,该组分为大孔径滤膜富集组分;所述洗脱后,离心分离洗脱组分,转速为6000
×
g,时间为5分钟,沉淀为大孔径膜细菌组分,上清为大孔径膜病毒组分;大孔径膜细菌组分用dpbs溶解。
[0082]
小孔径滤膜抽滤:将0.2μm灭菌滤膜装在(另一个)已灭菌的滤膜抽滤装置中(图1),连接压力泵,开启压力泵至滤膜呈负压状态;所述大孔径滤膜滤液加入上部容器,通过滤膜抽滤至下层锥形瓶,获得0.2μm滤膜滤液;关闭压力泵,取下滤膜,转移至无菌培养皿中,用洗脱缓冲液浸泡,在摇床上洗脱60分钟,转速为200rpm,该组分为0.2μm滤膜富集组分;所述洗脱后,离心分离洗脱组分,转速为6000
×
g,时间为5分钟,沉淀为0.2μm膜细菌组分,上清为0.2μm膜病毒组分;0.2μm膜细菌组分用dpbs溶解。
[0083]
所述0.2μm滤膜滤液(图1,下层锥形瓶)利用切向流过滤富集(图2),将过滤装置的进水管和出水管放入所述滤液中,开启蠕动泵至过滤装置负压状态,压力为2.0mpa,时间为50分钟;将浓缩后滤液经出水管全部转移至无菌离心管,再将等体积洗脱液经进水口进入过滤装置,循环洗脱15分钟,压力为1.0mpa,经出水口转移至无菌离心管,该组分为切向流过滤病毒组分。
[0084]
病毒沉淀:大孔径和0.2μm滤膜富集的膜病毒组分和切向流过滤病毒组分需进行病毒沉淀,根据各组分体积加入peg-8000和nacl,peg-8000的用量为200g/l,所述氯化钠的用量37.4g/l;混匀后,在4℃沉淀10h;4℃、8000rpm下离心30分钟;大孔径和0.2μm滤膜富集的膜病毒组分或切向流过滤病毒组分的沉淀用dpbs溶解。
[0085]
食源性病毒核酸提取:大孔径和0.2μm滤膜富集的膜病毒组分或切向流过滤病毒组分中的病毒利用trizol-ls提取rna,利用一步法rna反转录实时荧光定量检测试剂盒,对人诺如病毒(gi型和gii型)、甲型肝炎病毒、轮状病毒、猪流行性腹泻病毒和质控病毒mnv进行taqman探针实时荧光定量检测。
[0086]
检测结果如下,在南京市的500ml农业灌溉水中检出gi型诺如病毒(5份,2.39~798.63gc/ml)、gii型诺如病毒(6份,0.731~7.22gc/ml)、甲型肝炎病毒(1份,233gc/ml)、轮状病毒(1份,366gc/ml)和猪流行性腹泻病毒(1份,57.6gc/ml),在句容市的500ml农业灌
溉水中检出gi型诺如病毒(2份,7.45~18.78gc/ml)、gii型诺如病毒(6份,0.365~369gc/ml),在盐城市的500ml农业灌溉水和养殖水中检出gi型诺如病毒(3份,29.2~167gc/ml)、gii型诺如病毒(3份,1.3~19.5gc/ml)。质控病毒mnv的回收率为4.24%-62.29%之间,均大于1%。
[0087]
常见致病菌核酸提取:大孔径和0.2μm滤膜富集的膜细菌组分利用细菌dna提取试剂盒提取细菌dna,利用实时荧光定量检测试剂盒,对金黄色葡萄球菌、大肠杆菌o157、沙门氏菌和单增李斯特各细菌进行taqman探针实时荧光定量检测。
[0088]
检测结果如下,在南京市的500ml农业灌溉水中检出金黄色葡萄球菌(1份,2.42
×
10-2
cfu/ml)、沙门氏菌(2份,69.5~201cfu/ml)和单增李斯特(1份,1.89cfu/ml);在句容市的500ml农业灌溉水中检出金黄色葡萄球菌(2份,6.27
×
10-2
~1.26
×
10-2
cfu/ml)、沙门氏菌(5份,62.5~2260cfu/ml)和单增李斯特(3份,0.59~1.77cfu/ml);在盐城市的500ml农业灌溉水中检出沙门氏菌(2份,7.74~66.4cfu/ml)、单增李斯特(1份,3.2cfu/ml);在上述水样中未检出大肠杆菌o157。
[0089]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。