trem2抗体及其用途
技术领域
1.本发明属于医学领域。更具体而言,本发明涉及结合trem2的抗体、包含此类trem2抗体的组合物、以及使用此类trem2抗体治疗神经退行性疾病(如阿尔茨海默病)的方法。
背景技术:
2.髓样细胞上表达的触发受体2(trem2)是一种细胞表面跨膜糖蛋白,在髓样细胞(如树突细胞、粒细胞)和组织特异性巨噬细胞(如破骨细胞、kuppfer细胞和肺泡巨噬细胞)中表达。trem2跨膜区与衔接蛋白dap12和dap10结合,通过衔接蛋白的trem2信号发放导致下游靶标如mtor和mapk的激活。因此,trem2激活导致增加的增殖、存活、吞噬、吞噬细胞氧化爆发及活性氧(ros)产生、以及促炎和抗炎细胞因子表达。在某些情况下,在髓样细胞激活时,膜结合的trem2可以被蛋白酶切割,从而导致可溶性trem2的释放。
3.trem2与神经退行性疾病如阿尔茨海默病相关。trem2由大脑中的小胶质细胞表达,在阿尔茨海默病患者和tau病理学小鼠模型中观察到trem2表达增加。此外,trem2突变与神经退行性疾病相关,已显示trem2敲除小鼠可以免受年龄相关炎症变化、氧化脂质累积和神经元结构丧失(参见例如gerlach等,trem2 triggers microglial density and age-related neuronal loss.glia,67(3):539-550(2019))。trem2缺乏还可以具有神经保护作用,减少创伤性脑损伤后海马体积损失(参见saber等,triggering receptor expressed on myeloid cells 2 deficiency alters acute macrophage distribution and improves recovery after traumatic brain injury,j.neurotrauma,34:423-435(2017))。
4.trem2抗体为本领域已知。例如,pct公开号wo 2016/023019和pct公开号wo 2019/028292公开了trem2抗体。此类抗体可在体内簇集并激活trem2,和/或以纳摩尔亲和力结合人trem2。
5.因此,仍然存在对备选trem2抗体的需要,该抗体:1)以期望的高亲和力以及提供最佳活性的结合和解离速率,结合人trem2;2)减少小胶质细胞激活状态和/或促进小胶质细胞稳态,而不影响小胶质细胞总数(例如,不影响存活);3)抑制trem2信号发放;4)达到体内功效;5)显示低免疫原性潜能;和/或6)展示出适宜的可开发性特征,例如,对于开发和/或用于治疗神经退行性疾病而言,可接受的稳定性、溶解性、低的自结合以及药代动力学特征等。
技术实现要素:
6.因此,本发明提供以高亲和力结合人trem2的新trem2抗体。本发明的抗体被认为提供了一种促进小胶质细胞稳态的手段。本发明的抗体还具有以下至少一种性质:降低小胶质细胞激活状态,和/或恢复小胶质细胞稳态,而不影响小胶质细胞总数(例如,不影响存活),防止巨噬细胞吞噬,抑制trem2信号发放,实现体内功效,显示低免疫原性潜能,和/或展示适合临床开发和/或用于治疗神经退行性疾病的可开发性特征。
7.本发明的抗体可用于治疗神经退行性疾病,如阿尔茨海默病,且可以在较低剂量或较低给药频率下是治疗有效的。
8.在一个实施方案中,本发明提供结合trem2的抗体,其包含轻链可变区(lcvr)和重链可变区(hcvr),其中该lcvr包含互补决定区(cdr)lcdr1、lcdr2和lcdr3,且该hcvr包含互补决定区(cdr)hcdr1、hcdr2和hcdr3,其中lcdr1具有seq id no:1的氨基酸序列,lcdr2具有seq id no:2的氨基酸序列,lcdr3具有seq id no:3的氨基酸序列,hcdr1具有seq id no:4的氨基酸序列,hcdr2具有seq id no:5的氨基酸序列,hcdr3具有seq id no:6的氨基酸序列。在一个实施方案中,该lcvr具有seq id no:7的氨基酸序列,该hcvr具有seq id no:8的氨基酸序列。在一个实施方案中,该抗体包含轻链(lc)和重链(hc),其中该lc具有seq id no:9的氨基酸序列,该hc具有seq id no:10的氨基酸序列。在一个实施方案中,该抗体是人抗体。
9.在一个实施方案中,本发明提供包含编码抗体hc的多核苷酸序列的dna分子,其中该hc包含seq id no:10的氨基酸序列。在一个实施方案中,本发明提供包含编码抗体lc的多核苷酸序列的dna分子,其中该lc包含seq id no:9的氨基酸序列。在一个实施方案中,本发明提供包含编码hc和lc的多核苷酸序列的dna分子,其中该hc包含seq id no:10的氨基酸序列,该lc包含seq id no:9的氨基酸序列。在一个实施方案中,本发明提供包含含有编码抗体hc的多核苷酸序列的dna分子和含有编码抗体lc的多核苷酸序列的dna分子的哺乳动物细胞,其中该hc包含seq id no:10的氨基酸序列,其中该lc包含seq id no:9的氨基酸序列。在一个实施方案中,本发明提供包含含有编码hc和lc的多核苷酸序列的dna分子的哺乳动物细胞,其中该hc包含seq id no:10的氨基酸序列,该lc包含seq id no:9的氨基酸序列。
10.在一个实施方案中,本发明提供药物组合物,其包含本发明的抗体和一种或多种可药用载体、稀释剂或赋形剂。在一个实施方案中,本发明提供用于治疗神经退行性疾病的药物组合物。在一个实施方案中,该神经退行性疾病是阿尔茨海默病、进行性脑瘫、多发性硬化、als或额颞叶痴呆。在一个实施方案中,本发明提供用于治疗创伤性脑损伤的药物组合物。
11.在一个实施方案中,本发明提供治疗患有神经退行性疾病的患者的方法,其包括对该患者施用有效量的本发明抗体。在一个实施方案中,该神经退行性疾病是阿尔茨海默病、进行性脑瘫、多发性硬化、als或额颞叶痴呆。在一个实施方案中,本发明提供治疗患有创伤性脑损伤的患者的方法,其包括对该患者施用有效量的本发明抗体。
12.在一个实施方案中,本发明还提供本发明抗体用于治疗。在一个实施方案中,本发明提供本发明的抗体用于治疗神经退行性疾病。在一个实施方案中,该神经退行性疾病是阿尔茨海默病、进行性脑瘫、多发性硬化、als或额颞叶痴呆。在一个实施方案中,本发明提供本发明的抗体用于治疗创伤性脑损伤。
13.在一个实施方案中,本发明提供本发明的抗体在制备用于治疗神经退行性疾病的药物中的用途。在一个实施方案中,该神经退行性疾病是阿尔茨海默病、进行性脑瘫、多发性硬化、als或额颞叶痴呆。在一个实施方案中,本发明提供本发明的抗体在制备用于治疗创伤性脑损伤的药物中的用途。
[0014]“trem2抗体”是指这样的抗体,该抗体结合trem2(包括trem2变体,如r47h变体),
并且在体外或体内施用时产生至少一种期望的活性,如减少激活的小胶质细胞。
[0015]
就本发明而言,本文中所用的术语“抗体”指改造的非天然存在的多肽复合物,其具有两条hc和两条lc,使得重链和轻链通过二硫键相互连接,其中该抗体为igg同种型抗体。每条重链由n端hcvr和重链恒定区组成。每条轻链由n端lcvr和轻链恒定区组成。当在某些生物系统中表达时,抗体在fc区糖基化。通常,糖基化发生在抗体的fc区的一个高度保守的n-糖基化位点处。n-聚糖通常附着在天冬酰胺上。抗体也可以在其他位置处糖基化。
[0016]
重链的恒定区包含ch1、ch2和ch3结构域。ch1位于hcvr之后;ch1和hcvr形成抗原结合(fab)片段的重链部分,该片段是结合抗原的抗体部分。ch2位于铰链区之后以及ch3之前。ch3位于ch2之后,并在重链的羧基端。轻链的恒定区包含一个结构域cl。cl位于lcvr之后;cl和lcvr形成fab的轻链部分。
[0017]
本发明抗体的hcvr和lcvr区可进一步细分为高可变区,称为互补决定区(“cdr”),中间散布着更保守的区域,称为构架区(“fr”)。每个hcvr和lcvr由三个cdr和四个fr组成,按以下顺序从氨基端到羧基端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。在本文中,将重链的三个cdr称为“hcdr1、hcdr2和hcdr3”,轻链的三个cdr称为“lcdr1、lcdr2和lcdr3”。cdr包含大多数与抗原形成特异性相互作用的残基。kabat cdr定义(kabat等,ann.ny acad.sci.190:382-93(1971);kabat等,sequences of proteins of immunological interest,fifth edition,u.s.department of health and human services,nih publication no.91-3242(1991))基于抗体序列可变性。chothia cdr定义(chothia等,“canonical structures for the hypervariable regions of immunoglobulins”,journal of molecular biology,196,901-917(1987);al-lazikani等,“standard conformations for the canonical structures of immunoglobulins”,journal of molecular biology,273,927-948(1997))基于抗体的三维结构和cdr环的拓扑结构。除hcdr1和hcdr2外,chothia cdr定义与kabat cdr定义相同。north cdr定义(north等,“a new clustering of antibody cdr loop conformations”,journal of molecular biology,406,228-256(2011))基于大量晶体结构的亲和传播聚类。为了本发明的目的,基于众所周知的kabat编号约定,将氨基酸分配到本发明抗体的lcvr和hcvr区域内的cdr结构域。
[0018]
本发明的抗体为人源化抗体或人抗体。优选地,该抗体是人抗体。在单克隆抗体的上下文中,术语“人”(或“全人”)和“人源化”为本领域普通技术人员公知(weiner,l.j.,j.immunother.2006;29:1-9;mallbris l等,j.clin.aesthet.dermatol.2016;9:13-15)。本发明的抗体可以是igg4paa抗体。igg4paa抗体是分别在位置228、234、235(按照eu编号)处具有丝氨酸到脯氨酸的取代和两个亮氨酸到丙氨酸的取代(即s228p、f234a、l235a)的igg4抗体。
[0019]
本发明的dna分子是包含编码多肽的非天然存在的多核苷酸序列的dna分子,该多肽具有本发明抗体的至少一个多肽(例如重链、轻链、可变重链或可变轻链)的氨基酸序列。
[0020]
通过将编码hcvr的dna有效连接到编码重链恒定区的另一个dna分子,可将编码hcvr区的分离的dna转化为全长重链基因。本领域已知人以及其他哺乳动物的重链恒定区基因的序列。可以例如通过标准pcr扩增,获得包含这些区域的dna片段。
[0021]
通过将编码lcvr的dna有效连接到编码轻链恒定区的另一个dna分子,可将编码
lcvr区的分离的dna转化为全长轻链基因。本领域已知人以及其他哺乳动物的轻链恒定区基因的序列。可以通过标准pcr扩增,获得涵盖这些区域的dna片段。轻链恒定区可以是κ或λ恒定区。优选地,对于本发明的抗体,该轻链恒定区是κ恒定区。
[0022]
在将本发明多核苷酸的序列有效连接到表达控制序列后,本发明的多核苷酸可在宿主细胞中表达。表达载体通常可作为附加体或作为宿主染色体dna的组成部分在宿主生物体中复制。通常,表达载体将包含选择标记,例如四环素、新霉素和二氢叶酸还原酶选择标记,以允许检测被期望的dna序列转化的那些细胞。
[0023]
本发明的抗体可容易地在哺乳动物细胞中产生,非限制性实例包括cho、ns0、hek293或cos细胞。可以使用本领域众所周知的技术培养宿主细胞。
[0024]
含有目的多核苷酸序列(例如编码抗体多肽的多核苷酸和表达控制序列)的载体,可以通过众所周知的方法转移到宿主细胞中,该方法取决于细胞宿主的类型而不同。
[0025]
可利用多种蛋白质纯化方法来纯化蛋白质,包括但不限于抗体,且此类方法为本领域已知。
[0026]
本发明的抗体或包含该抗体的药物组合物可通过胃肠外途径施用,其非限制性实例有皮下施用和静脉内施用。本发明的抗体可以以单个或多个剂量与可药用载体、稀释剂或赋形剂一起对患者施用。本发明的药物组合物可通过本领域众所周知的方法制备(例如remington:the science and practice of pharmacy,第22版(2012),loyd,a.等,pharmaceutical press),并包含如本文所公开的抗体和一种或多种可药用载体、稀释剂或赋形剂。
[0027]
术语“治疗”指减缓、中断、阻止、缓解、停止、减少或逆转现有症状、障碍、病症或疾病的进展或严重度。
[0028]“有效量”指本发明的trem2抗体或包含这种抗体的药物组合物的量,所述量引发研究人员、医生或其他临床医生正寻求的对组织、系统、动物、哺乳动物或人的生物学或医学反应或期望的治疗效果。抗体的有效量可根据个体的疾病状态、年龄、性别和体重等因素以及抗体在个体中引发期望反应的能力而变化。这种益处包括但不限于,降低的小胶质细胞激活和减缓脑萎缩或认知丧失的潜力。本领域技术人员可通过使用已知技术并通过观察在类似情况下获得的结果来容易地确定有效量。在确定患者的有效量时,主治诊断医生会考虑许多因素,包括但不限于:患者体型大小、年龄和总体健康状况、所涉及的具体疾病或障碍、疾病或障碍的程度或涉及范围或严重程度、个体患者的反应、所施用的具体化合物、所施用制剂的给药方式、生物利用度特征、所选择的剂量方案、并行药物的使用以及其他相关情况。
[0029]
抗体改造
[0030]
进行了包括抗体种系化、亲和力成熟、去免疫和成药性优化的显著改造来产生本发明的抗体。本发明的抗体是对人trem2具有高亲和力、并具有降低的免疫原性、以及对于人临床研究而言可接受的或最佳的可开发性的人抗体。
[0031]
例如,在重链dsd基序(残基d54、s55和d56)中进行改造,以减少d54和/或d56处的异构化。将55位的丝氨酸突变为谷氨酰胺(s55q)或组氨酸(s55h)。这两种突变对抗体亲和力都是中性的。出乎意料的是,s55q突变导致了异构化从5.1%显著降低到1%,而s55h突变使异构化增加到63%。因此,s55q重链突变在保持结合亲和力的同时减少了异构化。
实施例
[0032]
实施例:抗体表达和纯化
[0033]
本发明的trem2抗体可以基本按以下表达和纯化。可以使用预先确定的最佳hc:lc载体比率(如1:3或1:2)或编码hc和lc二者的单个载体系统,采用分泌抗体表达系统,瞬时或稳定转染适当的宿主细胞,如hek293或cho。可以使用许多常用技术中的任何一种,对抗体已分泌入其中的澄清培养基进行纯化。例如,可将该培养基应用于已用相容的缓冲液(如磷酸缓冲盐溶液(ph 7.4))平衡的柱(ge healthcare)或用于fab片段的kappaselect柱(ge healthcare)。可以洗涤层析柱以去除非特异性结合成分。
[0034]
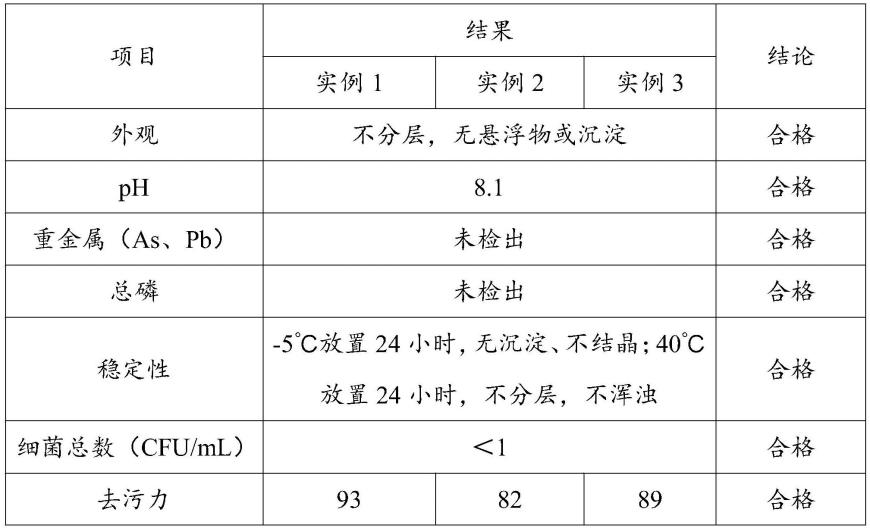
例如,可通过ph梯度(如20mm tris缓冲液ph 7.0至10mm柠檬酸钠缓冲液ph 3.0,或磷酸缓冲盐溶液ph 7.4至100mm甘氨酸缓冲液ph 3.0)洗脱结合的抗体。可以检测抗体级分,如通过sds-page,然后可以将它们合并。取决于预期用途,可选地进一步纯化。纯化的抗体可以使用常见技术进行浓缩和/或无菌过滤。可溶性聚集体和多聚体可通过常用技术有效去除,包括大小排阻、疏水相互作用、离子交换、多模式或羟基磷灰石层析。经过这些层析步骤后,抗体的纯度在约95%至约99%之间。
[0035]
产品可以冷藏,立即冷冻在-70℃,或者可以冻干。表1中显示了本发明的示例性人抗体的氨基酸序列seq id no。
[0036]
表1.trem2抗体1的氨基酸序列
[0037]
lcdr1lcdr2lcdr3hcdr1hcdr2hcdr3seq id no:1seq id no:2seq id no:3seq id no:4seq id no:5seq id no:6
[0038]
lcvrhcvrlchcseq id no:7seq id no:8seq id no:9seq id no:10
[0039]
实施例:抗体1与trem2的结合动力学和亲和力
[0040]
用37℃下的表面等离子体共振(spr)来测定trem2抗体抗体1、参考抗体a或参考抗体b与抗原的结合动力学和亲和力。参考抗体a包含pct公开号wo2019/028292中由seq id no:11、13、15、16、132、135、126给出的hcvr和由seq id no:20、22、23、25、144、131和129给出的lcvr。参考抗体b包含pct公开号wo2016/023019中分别由seq id no:412和413给出的hcvr和lcvr。
[0041]
使用表面等离子体共振生物传感器,如t100、t200或8k(ge healthcare,piscataway,n.j.),测定trem2抗体与融合了c端his标签的人(seq id no:11)、小鼠(seq id no:12)、大鼠(seq id no:14)、兔(seq id no:13)或食蟹猴(seq id no:15)trem2胞外结构域(ecd)的结合动力学和亲和力。
[0042]
将样品溶解在1xhbs-ep 运行缓冲液(teknova)中,并使用蛋白a偶联的cm5系列s传感器芯片(ge healthcare)捕获抗体。使用多个分析循环,评价结合。每个循环在37℃进行,流速50μl/分钟用于抗体捕获,流速30μl/分钟用于配体的结合和解离。每个循环由以下组成:注射7μl的1μg/ml抗体,以捕获150-250个响应单位,注射人、食蟹猴、兔、大鼠或小鼠trem2-his ecd(每个循环从20nm开始,并使用两倍系列稀释液),然后结合200秒,然后是800秒的解离期,并使用ph 1.5的10mm甘氨酸盐酸经过30秒的接触时间进行再生。以平行动力学批处理模式,在biacore8k评价中,使用标准双参考并拟合至“1:1(langmuir)结合”模
型,评价每个循环的结合速率(即k
on
)和解离速率(即k
off
)。根据kd=k
off
/k
on
的关系,从结合动力学计算亲和力(kd)。由于参考抗体a的双相结合数据,使用biacore 8k评价中的混杂配体2:1结合模型(heterogenous ligand 2:1 binding modeling),计算kd。混杂配体2:1报告2个k
on
和2个k
off
值来计算kd值。对于抗体1和参考抗体a,n=3,对于参考抗体b,n=1。
[0043]
在基本上按上文所述进行的实验中,获得了以下数据:
[0044]
表2.结合动力学和亲和力(平均值
±
标准偏差)
[0045][0046][0047]
*结合为双相的,用混杂配体结合模型拟合数据得到两个结合速率(k
on
)和两个解离速率(k
off
)。#在200nm trem2下未检测到背景以上的结合
[0048]
这些数据表明,抗体1以高(pm)亲和力结合人trem2和食蟹猴trem2。抗体1还以nm亲和力结合小鼠trem2,但不结合大鼠trem2。与参考抗体a和参考抗体b相比,抗体1以更高的亲和力结合人trem2,与参考抗体a相比,抗体1还以更高的亲和力结合食蟹猴trem2。对于所测试的任何抗体,未检测到与兔trem2的结合。
[0049]
在25℃进行类似的实验,获得了以下数据。抗体1结合人、小鼠和食蟹猴trem和人r47h trem突变体,结合亲和力分别为150pm、3.9nm、43pm和290pm。r47h突变体与阿尔茨海默病的发展有关。这些数据证明抗体1能够结合r47h trem。
[0050]
实施例:抗体1结合表达trem2的细胞
[0051]
为了研究抗体1是否与表达trem2的细胞结合,进行了结合实验。转导bw5147.g.1.4细胞系以表达人trem2及其衔接分子dnaz衔接蛋白12(dap12)。为了评估结合,在抗体1存在下37℃孵育500,000个细胞30分钟,其中抗体1浓度从30μg/ml开始并进行3倍12点滴定。使用山羊抗人igg alexa fluor 647(jackson labs)检测抗体结合。使用accuri c6 plus流式细胞仪(bd biosciences)测量平均荧光强度(mfi)。
[0052]
按照基本上如上文所述的流程,抗体1以0.08μg/ml的ec
50
结合表达trem2的bw5147.g.1.4细胞。这些数据表明,抗体1与细胞膜结合的trem2结合。
[0053]
实施例:trem2信号发放的抑制
[0054]
为了研究在配体存在下trem2抗体介导的对nfat激活的影响,用磷脂酰丝氨酸(ps,avanti lipids)作为trem2配体。每孔含有1.5mm ps的96孔板在室温下干燥三小时。在同型对照抗体或抗体1存在的情况下,将trem2 nfat荧光素酶bw5147.g.14报告细胞(每孔400,000个细胞)接种在ps包被的平板上,其中抗体1浓度从30μg/ml开始并进行5倍8点滴定。37℃孵育18小时后,使用pierce萤火虫荧光素酶快速测定试剂盒(thermo fisher)和envision 2105读板器(perkin elmer)检测发光。
[0055]
在基本上按上文所述进行的实验中,抗体1以浓度依赖性方式抑制了ps介导的nfat激活,ic
50
为0.40μg/ml。对照抗体不抑制ps介导的nfat激活。这些数据表明,抗体1可以抑制配体触发的trem2信号发放。
[0056]
实施例:巨噬细胞中trem2激活的抑制
[0057]
为了研究抗体1对巨噬细胞中trem2激活的影响,在存在或不存在抗体1或同型对照抗体的情况下,将巨噬细胞培养在pdapp脑组织切片(含有trem2的生理内源性配体)的上方。
[0058]
通过在50ng/ml csf-1(peprotech)存在下培养骨髓细胞5天来产生骨髓来源的巨噬细胞。为了诱导trem2激活,在3μg/ml或12μg/ml对照抗体或抗体1存在下,将400,000个巨噬细胞接种在来自pdapp淀粉样前体转基因小鼠的脑组织切片上3天。使用elisa试剂盒(r&d systems)测量上清液中trem2激活的直接产物骨桥蛋白的水平。
[0059]
按照基本上如上文所述的流程,获得了以下数据。
[0060]
表3.存在或不存在抗体1的情况下巨噬细胞骨桥蛋白水平(pg/ml)
[0061][0062]
这些数据证明,3μg/ml和12μg/ml抗体1抑制了骨桥蛋白的产生。这些结果表明,抗体1抑制响应生理配体的trem2激活。
[0063]
实施例:抗体1在体内对tau介导的神经变性期间小胶质细胞激活状态的影响
[0064]
为了评价抗体1在体内对tau介导的神经变性期间小胶质细胞激活状态的影响,在第0天对7月龄雌性rtg4510 p301l tau转基因小鼠施用抗体1,从每克体重300mg开始,进行3倍6点滴定。在第7天,处死小鼠,采集脑组织进行rna分析。使用taqman qpcr测定测量海马中的clec7a(trem2依赖性基因),并将相对表达相对于看家基因hprt进行归一化。
[0065]
按照基本上如上文所述的流程,获得了以下数据。
[0066]
表4.抗体1处理后的相对clec7a表达( /-sem)
[0067]
抗体1(mg/kg)300100301031相对clec7a表达9.9
±
1.013.4
±
4.013.8
±
1.019.
±
2.016
±
2.018
±
1.0
[0068]
这些数据证明,用抗体1处理后海马中clec7a水平呈抗体浓度依赖性降低;表明抗体1在体内抑制trem2。还测定了可溶性trem2的水平,并观察到csf中可溶性trem2的剂量依赖性增加。
[0069]
实施例:主要组织相容性复合物结合性肽蛋白质组学
[0070]
为了研究抗体1的免疫原性潜能,进行了主要组织相容性复合物结合性肽蛋白质组学(mapp)测定。通过用抗cd14微珠和磁分离器分离cd14阳性细胞,从血沉棕黄层制备了来自10名正常人供体的原代人树突细胞。将cd14阳性细胞以每孔5e6个细胞接种,并在37℃和5%co2下通过与20ng/ml il-4和40ng/ml gm-csf在含有10%胎牛血清的完全rpmi培养基中培养3天,分化为未成熟树突细胞。4天后(第4天),更换培养基,并向细胞中添加含有3μm抗体的新鲜培养基。在第5天,加入5μg/ml lps将细胞转化为成熟树突细胞。第6天,在1ml含有蛋白酶抑制剂的ripa缓冲液中裂解细胞,并将裂解物冷冻在-80℃。
[0071]
通过融化冷冻的裂解物并匀浆5-10秒,制备用于mhc-ii分离的样品。通过离心澄清匀浆的裂解物。使用与链霉抗生物素蛋白珠偶联的生物素化抗mhc-ii抗体进行mhc-ii复合物的免疫沉淀。用5%乙酸、0.1%tfa洗脱结合的复合物。通过使洗脱物通过预先洗涤的10k mwco过滤器,从共洗脱的受体蛋白中分离出mhc-ii肽。使用thermo qe-hfx质谱仪,通过nano lc/ms分析分离的mhc-ii肽。使用无酶的搜索算法和牛/人数据库,通过蛋白质组学管线产生肽鉴定,其中追加测试抗体序列以确定展示来自测试抗体互补决定区的mhc-ii肽的供体的百分比。
[0072]
按照基本上如上文所述的流程,抗体1显示出低的免疫原性风险,0%的供体展示
了重链cdr3中的非种系簇。
[0073]
序列
[0074]
抗体1 lcdr1(seq id no:1)
[0075]
rasqairddlg
[0076]
抗体1 lcdr2(seq id no:2)
[0077]
yaasslqs
[0078]
抗体1 lcdr3(seq id no:3)
[0079]
lqnynypht
[0080]
抗体1 hcdr1(seq id no:4)
[0081]
gfsfntywig
[0082]
抗体1 hcdr2(seq id no:5)
[0083]
iiypgdqdiryspsfqg
[0084]
抗体1 hcdr3(seq id no:6)
[0085]
arygryiygyggyhgmdv
[0086]
抗体1 lcvr(seq id no:7)
[0087]
diqmtqspsslsasvgdrvtitcrasqairddlgwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyyclqnynyphtfgqgtkleik
[0088]
抗体1 hcvr(seq id no:8)
[0089]
evqlvqsgaevkkpgeslkisckgsgfsfntywigwvrqmpgkglewmgiiypgdqdiryspsfqgqvtisadksistaylqwsslkasdtamyycarygryiygyggyhgmdvwgqgttvtvss
[0090]
抗体1 lc(seq id no:9)
[0091]
diqmtqspsslsasvgdrvtitcrasqairddlgwyqqkpgkapklliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyyclqnynyphtfgqgtkleikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
[0092]
抗体1 hc(seq id no:10)
[0093]
evqlvqsgaevkkpgeslkisckgsgfsfntywigwvrqmpgkglewmgiiypgdqdiryspsfqgqvtisadksistaylqwsslkasdtamyycarygryiygyggyhgmdvwgqgttvtvssastkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcpapeaaggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnaktkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprepqvytlppsqeemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflysrltvdksrwqegnvfscsvmhealhnhytqkslslslg
[0094]
人ecd trem2-his(seq id no:11)
[0095]
hnttvfqgvagqslqvscpydsmkhwgrrkawcrqlgekgpcqrvvsthnlwllsflrrwngstaitddtlggtltitlrnlqphdaglyqcqslhgseadtlrkvlvevladpldhrdagdlwfpgesesfedahvehsisrsllegeipfpptshhhhhh
[0096]
小鼠ecd trem2-his(seq id no:12)
[0097]
lnttvlqgmagqslrvsctydalkhwgrrkawcrqlgeegpcqrvvsthgvwllaflkkrngstviaddtlagtvtitlknlqagdaglyqcqslrgreaevlqkvlvevledplddqdagdlwvpeesssfegaqvehstsrnqetsfpptshhhhhh
[0098]
兔ecd trem2-his(seq id no:13)
[0099]
nttvfqgvagqslrvscpydsathwgrrkawcrqlgeegpcervvsthswwllsflkrrngstaitddalggtltvtlrdlqaqdagvyqcqslqgreastlqkilvevlteplehehagdfwvpeesgsfedppversssrspsegepsfppasggggqhhhhhh
[0100]
大鼠ecd trem2-his(seq id no:14)
[0101]
nttvlqgvagqslrvsctydalrhwgrrkawcrqlaeegpcqrvvsthgvwllaflrkqngstvitddtlagtvtitlrnlqagdaglyqcqslrgreaevlqkvvvevledplddqdagdlwvpeesesfegaqvehstsrsqsggggqhhhhhh
[0102]
食蟹猴ecd trem2-his(seq id no:15)
[0103]
hnttvfqgvegqslqvscpydsmkhwgrrkawcrqlgekgpcqrvvsthnlwllsflrrrngstaitddtlggtltitlrnlqphdagfyqcqslhgseadtlrkvlvevladpldhrdagdlwvpgesesfedahvehsisrpsqgshlpsclskeggggqhhhhhh
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。