1.本发明属于细菌分子生物学检测技术领域,具体涉及一种对牛结核病病原的快速检测方法。
背景技术:
2.牛结核病(bovine tuberculosis,btb)是由牛分枝杆菌(mycobacterium bovis,m.bovis)等引起的一种人兽共患的慢性传染病,我国将其列为二类动物疫病。以组织器官的结核结节性肉芽肿和干酪样、钙化的坏死病灶为特征。世界动物卫生组织(oie)将其列为必须通报的动物疫病(notifiable diseases)。2012年,我国发布《国家中长期动物疫病防治规划(2012—2020年)》,将牛结核病列为16种优先防治动物疫病病种。《国家奶牛结核病防治指导意见(2017-2020年)》进一步提出了牛结核病的控制目标。据估计,全世界有超过5000万头牛感染,每年耗费30亿美元。人通过食用未经消毒的牛奶或与患病动物接触,感染牛结核病。
3.牛结核病通常呈慢性经过,潜伏期在半月至数年不等。大多数情况下,细菌以休眠状态潜伏在动物体内,不引起任何临床症状,表现为潜伏感染。有的动物在感染几个月甚至数年后,才出现明显的临床症状,发展为活动性结核。牛结核病病原菌会侵染易感动物几乎所有的组织器官,因患病器官不同,表现出来的临床症状亦不同。整体上,患病动物表现出明显的食欲不振,顽固性腹泻,渐进性消瘦,易疲劳,偶尔出现波浪热,间歇性咳嗽,部分个体伴随淋巴结肿大。全国牛结核病专项调查显示,其感染率波动上升趋势,屠宰环节的检出率更高。奶牛结核病高感染率严重威胁奶业安全和公共卫生安全,其控制净化工作任务非常艰巨。受制于检测技术的瓶颈,我国牛结核病检测的需求,特别是在现场快速检测的需求缺口越来越大。因此,加强牛结核病检测技术研究,为疫病的控制、净化,动物健康,公共卫生安全具有重要意义。
4.目前对牛结核病的诊断方法有如下的几种:
5.1)临床诊断
6.牛结核病以肺结核最为常见,其次是乳房结核和肠结核,以及淋巴结核、胸膜结核和腹膜结核,有时可见肝、脾、肾、生殖器官、脑、骨和关节结核,严重者可表现为全身性粟粒性结核。根据感染累及器官不同,通常可见呼吸症状、腹泻、泌乳减少、生殖性能紊乱、神经症状等。
7.2)实验室诊断
8.牛结核实验室诊断包括细菌学方法、免疫学方法、分子生物学方法。牛分枝杆菌的分离、培养是牛结核病诊断的金标准,特异性好,但缺乏敏感性,且通常需要4-8周时间。直接涂片法的特异性不如细菌分离培养法。结核菌素皮内变态反应试验是国际贸易指定的检测方法。分为尾褶结核菌素皮内检测(cft)、颈部单一结核菌素皮内试验(sict)以及颈部比较结核菌素皮内试验(sicct)。该方法对操作人员要求较低、成本低,适于牛结核病早期诊断。但是耗时长,需要间隔72h测量皮厚,劳动强度大、主观判断性强、易与非结核分枝杆菌
发生交叉反应出现假阳性,不适合所有易感动物检测,对发病后期病情严重的牛易出现假阴性。伽马干扰素体外检测方法作为牛结核病国际贸易替代方法,作为皮内变态反应方法的补充,用于牛结核病的早期诊断。但是,伽马干扰素方法试剂盒较昂贵,采集的全血需经牛结核菌素刺激过夜,收集血浆用于检测,需要经验丰富的实验室人员操作。血清学抗体检测方法适用于牛结核病末期诊断,特别是对皮试或伽马干扰素检测“无反应性个体”,在野生动物牛结核病诊断以及结核病净化过程中,也比较适合用抗体检测方法。分子生物学检测方法包括pcr、巢氏pcr、荧光定量pcr等方法,这些方法具有快速、敏感性和特异性强的特点,广泛用于各种疫病的诊断和流行病学调查。1989年聚合酶链反应首先应用在人结核病检测中,之后就备受关注。针对is6110和is1081等细菌插入序列进行pcr扩增检测,在牛结核病诊断、分型、和流行病学调查中具有重要意义。上述方法虽然特异性和敏感性均较高,重复性好,但仍然具有仪器昂贵、巨大、对实验场地、人员要求高的问题,难以适用于现场大规模筛查,检测时间偏长,需要1~2小时。所有上述方法都不适合在野外、养殖场、屠宰场、食品加工厂等基层现场环境,因此,在保证特异性、灵敏性、重复性的前提下,开发适用于基层兽医、养殖人员等使用的便携、快速牛结核病检测方法,本领域技术人员研究的方向。
技术实现要素:
9.本发明提供了一种基于重组酶等温扩增荧光法(raa荧光法)快速检测牛结核病的引物、探针及检测方法,可实现在39℃条件下20min内完成牛结核病的检测,具有快速、灵敏、操作简便、适用于现场快速检测的特点。
10.本发明首先提供一种检测牛结核病的基于重组酶等温扩增荧光法扩增用引物和探针,所述引物用于检测序列为seq id no:1的片段,探针用于检测所述引物的扩增产物;
11.作为实施例的具体记载,所述的引物包含有:
12.上游引物:5
′‑
agaacccactacgcagccaatctgatg-3
′
(seq id no:2);
13.下游引物:5
′‑
accgcggggagtttgtcggtcagagcgt-3
′
(seq id no:3);
14.本发明还提供用于检测上述引物扩增产物的探针,所述探针的序列如下:5
′‑
cactccatctacgaccagcccgacgccgaatcagttgttgcccaatatgatcg-3
′
(seq id no:4);
15.所述探针采用荧光报告基团和荧光淬灭基团进行修饰,其中荧光报告基团修饰在探针序列离5
′
端碱基数30bp的位置上;荧光淬灭基团修饰在探针序列离3
′
端碱基数18bp的位置上,且荧光报告基团与淬灭基团之间间隔了3个碱基cag,其中a用四氢呋喃残基替换;
16.修饰后的探针结构如下:
[0017]5’‑
cactccatctacgaccagcccgacgccgaa/i6famdt/c/idsp/g/ibhq1dt/tgttgcccaatatgatcg(c3 spacer)-3’。
[0018]
进一步,所述荧光报告基团为fam、hex、tet、joe或vic;所述荧光淬灭基团为bhq1、bhq2或bhq3。
[0019]
优选地,所述荧光报告基团为fam;所述荧光淬灭基团为bhq1。
[0020]
上述的引物和探针用于制备raa荧光检测试剂盒。
[0021]
进一步,本发明还提供一种基于重组酶等温扩增荧光法快速检测牛结核病的方法,具体步骤如下:
[0022]
1)提取待检测对象的核酸样品;
[0023]
2)将恒温荧光基因检测仪接通电源进行预热,对反应参数进行设置;反应参数设置为39℃,反应时间:20分钟;
[0024]
3)在25μl反应缓冲液中加入13.7μl水,浓度为15μm的2.1μl上下游引物和0.6μl探针,充分混合后添加到raa荧光基础反应试剂中混合,得到反应预混液;
[0025]
4)在反应管盖上加2.5μl的mg
2
,将4μl所述步骤1)中得到的核酸样品与所述步骤3)中得到的反应预混液充分混合,得到的反应体系放入恒温荧光基因检测仪检测荧光信号;
[0026]
5)根据raa-f1610检测仪器中的阳性判定方法,选择阈值的方法来判定曲线的阴阳性。在设置自动阈值为300,定性阈值为200,则在20分钟内,荧光值大于300的孔位会被判定为阳性,其余判定为阴性。
[0027]
进一步,所述上游引物和下游引物的使用浓度为1~50μm。
[0028]
优选地,所述上游引物和下游引物的使用浓度为10μm。
[0029]
进一步,所述探针的浓度为1~50μm。
[0030]
优选地,所述探针的浓度为10μm。
[0031]
本发明相比于现有技术具有如下的优点:
[0032]
1)本发明提供的引物和探针适用于基于重组酶等温扩增荧光法检测,并且能够准确、快速地检测出牛结核病,与猪链球菌、沙门氏菌、金黄色葡萄球菌、巴氏杆菌、大肠杆菌、布鲁氏菌无交叉反应,特异性达100%;
[0033]
2)本发明提供的检测方法快速、容易实现高通量,同时降低了检测时间和检测成本,本发明提供的基于基于重组酶等温扩增荧光法快速检测牛结核病的方法,灵敏度高,反应检测灵敏度在95%的概率下达到66copies/反应;
[0034]
3)本发明提供的一种基于重组酶等温扩增荧光法快速检测牛结核病的方法,能方便快速准确地鉴定牛结核病,操作简便,检测时间短,20分钟内完成检测;无需像pcr一样,通过高温变性使dna解旋后退火,最后再延伸,而只需在39℃下进行等温扩增即可完成检测。
附图说明
[0035]
图1:本发明引物探针组合筛选结果图;
[0036]
图2:本发明单次系列稀释质粒后牛结核病灵敏性检测结果图;
[0037]
图3:本发明牛分枝杆菌is1081基因质粒灵敏性概率回归分析图;
[0038]
图4:本发明牛分枝杆菌is1081基因质粒重复性检测结果图;
[0039]
图5:本发明牛分枝杆菌is1081基因质粒的特异性检测结果图;
[0040]
图6:本发明牛结核病临床样本检测结果图。
具体实施方式
[0041]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0042]
实施例1
[0043]
在genbank中查找到相应的牛分枝杆菌全基因序列(www.ncbi.nlm.nih.gov),运用dnastar软件进行同源性分析和blast序列分析,筛出is1081基因高度保守序列如下:
[0044]
ccaggaacgcctcaaccgagaggtacgacgccgaaccgacgtcgtgggcatcttccccgaccgcgcctcgatcatccgcctcgtcggagccgtcctcgccgaacaacacgacgaatggatcgaaggacggcgctacctgggcctcgaggtcctcacccgagcccgagcagcactgaccagcaccgaagaacccgccaagcgatcatggccaaagagctcgacgaagccgtagaggcgtttcggacccgcccgctcgatgccggcccgtataccttcctcgccgccgacgccctggtgctcaaggtgcgcgaggcaggccgcgtcgtcggagtgcacaccttgatcgccaccggcgtcaacgccgagggctaccgagagatcctgggcatccaggtcacctccgccgaggacggggccggctggctggcgttcttccgcgacctggtcgcccgcggcctgtccggggtcgcgctggtcaccagcgacgcccacgccggcctggtggccgcgatcggcgccaccctgcccgcagcggcctggcagcgctgcagaacccactacgcagccaatctgatggcagccaccccgaagccctcctggccgtgggtgcgcaccctgctgcactccatctacgaccagcccgacgccgaatcagttgttgcccaatatgatcgggtactcgacgctctgaccgacaaactccccgcggtggccgagcacctcgacaccgcccgcaccgacctgctggcgttcaccgccttccccaagcagatctggcgccaaatctggtccaacaacccccaggaacgcctcaaccgagaggtacgacgccgaaccgacgtcgtgggcatcttccccgaccgcgcctcgatcatccgcctcgtcggagccgtcctcgccgaacaacacgacgaatggatcgaaggacggcgctacctgggcctcgaggtcctcacccgagcccgagcagcactgaccagcaccgaagaacccgccaagcagcaaaccaccaacaccccagcactgaccacctagactgc(seq id no.1);
[0045]
以筛选获得的高度保守序列作为检测目的基因片段,并进行引物、探针设计筛选检测。
[0046]
根据以上牛分枝杆菌is1081基因保守序列委托生工生物工程(上海)股份有限公司合成dna质粒,重组质粒大小3750bp。
[0047]
(1)引物设计
[0048]
设计raa方法检测用的引物,上游引物和下游引物长度30~35bp;根据牛分枝杆菌is1081基因保守序列,引物设计包括上游引物和下游引物,上游引物和下游引物各设计序列如下:
[0049]
raa-f1:5
’‑
tgcagaacccactacgcagccaatctgatggc-3’;
[0050]
raa-f5:5
’‑
aacccactacgcagccaatctgatggcag-3’;
[0051]
raa-f6:5
’‑
tgcagaacccactacgcagccaatctgatg-3’;
[0052]
raa-f7:5
’‑
agaacccactacgcagccaatctgatg-3’;
[0053]
raa-r1:5
’‑
tgctcggccaccgcggggagtttgtcggtcagag-3’;
[0054]
raa-r3:5
’‑
tcggccaccgcggggagtttgtcggtcagag-3’;
[0055]
raa-r4:5
’‑
accgcggggagtttgtcggtcagagcgt-3’;
[0056]
raa-r5:5
’‑
agtttgtcggtcagagcgtcgagtac-3’;
[0057]
raa-p:
[0058]5’‑
cactccatctacgaccagcccgacgccgaatcagttgttgcccaatatgatcg-3’;
[0059]
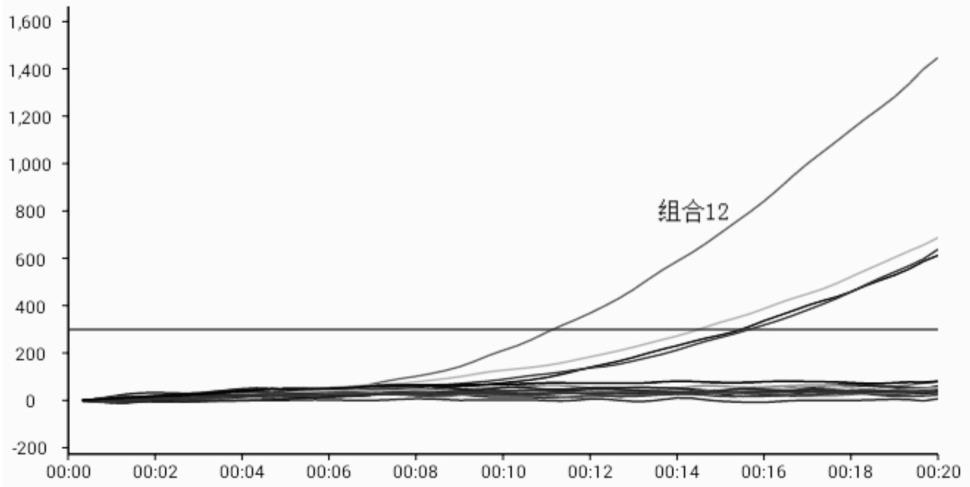
将上述引物组合成16个引物组合,分别为组合1,f1r1;组合2,f5r1;组合3,f6r1;组合4:f7r1;组合5,f1r3;组合6:f5r3;组合7:f6r3;组合8:f7r3;组合9,f1r4;组合10,f5r4;组合11,f6r4;组合12,f7r4;组合13,f1r5;组合14:f5r5;组合15:f6r5;组合16:f7r5,在16个引物探针组合中,组合12在同一动物布鲁氏菌bcsp31基因质粒浓度(50copies/μl)
下,出峰时间较短,荧光值相对较高,因此,更优选为组合12(图1),具体为:
[0060]
raa-f7:5
’‑
agaacccactacgcagccaatctgatg-3’;seq id no.2;
[0061]
raa-r4:5
’‑
accgcggggagtttgtcggtcagagcgt-3’;seq id no.3。
[0062]
(2)探针设计
[0063]
1)采用raa技术探针设计原则设计探针,根据牛分枝杆菌is1081基因保守序列,设计的探针序列为:
[0064]5’‑
cactccatctacgaccagcccgacgccgaatcagttgttgcccaatatgatcg-3’;seq id no.4。
[0065]
2)选择荧光修饰基团和荧光淬灭基团
[0066]
根据实验仪器采用的是无锡奇天生物科学仪器有限公司生产的raa-f1610荧光基因检测仪,所检测的荧光为fam荧光,因此荧光修饰基团选为fam,荧光淬灭基团选为bhq1。
[0067]
3)所述探针的修饰方法包括:荧光报告基团修饰在探针序列离5’端碱基数35bp的位置上;荧光淬灭基团修饰在探针序列离3’端碱基数18bp的位置上,荧光报告基团与淬灭基团之间间隔1个碱基c/g,碱基a用四氢呋喃残基替换;
[0068]5’‑
cactccatctacgaccagcccgacgccgaa/i6famdt/c/idsp/g/ibhq1dt/tgttgcccaatatgatcg(c3 spacer)-3’。
[0069]
(3)引物、探针及质粒均委托生工生物工程(上海)股份有限公司进行合成。(4)基于重组酶等温扩增荧光法快速检测牛结核病的检测试剂,包括raa荧光基础反应试剂、反应缓冲液、纯化水、乙酸镁、阳性质控品、阴性质控品、引物和探针;raa荧光基础反应试剂为经过低温冷冻干燥的冻干粉,购自江苏奇天基因生物科技有限公司,货号为raa-f1610,反应规格为50μl,使用前用反应缓冲液进行重溶,反应缓冲液为raa荧光基础反应试剂配套试剂。合成的牛分枝杆菌is1081基因质粒用超微量紫外分光光度计进行浓度测定并进行拷贝数计算,按浓度梯度稀释制备108copies/μl~10copies/μl标准品备用。阴性质控品为ddh2o或纯化水。上游引物和下游引物的浓度为10μm;探针的浓度为10μm。
[0070]
实施例2
[0071]
基于重组酶等温扩增荧光法检测牛结核病病毒的方法,包括如下步骤:
[0072]
(1)将待检样本组织均浆,按组织提取dna方法提取核酸,-20℃保存备用;如样本为组织、奶样、细菌培养物,采用裂解、磁珠富集、洗涤、洗脱等步骤提取核酸;
[0073]
(2)将恒温荧光基因检测仪raa-f1610接通电源进行预热,对反应参数进行设置,反应参数设置为39℃,反应时间:20min;
[0074]
(3)在25μl反应缓冲液中,加入13.7μl的水,浓度为10μm的2.1μl上下游引物和0.6μl探针,充分混合后添加到raa荧光基础反应试剂中混合,得到反应预混液;
[0075]
(4)在反应管盖上加2.5μl的mg
2
,将4μl所述步骤(1)中得到的核酸提取液与所述步骤(3)中得到的反应预混液充分混合,得到的反应体系放入恒温荧光基因检测仪raa-f1610检测荧光信号;
[0076]
(5)根据raa-f1610检测仪器中的阳性判定方法,选择阈值的方法来判定曲线的阴阳性。在设置自动阈值为300,定性阈值为20,则在20分钟内,荧光值大于300的孔位会被判定为阳性,其余判定为阴性。下面对本发明引物对探针的灵敏度、重复性和特异性进行检测。
[0077]
1、灵敏度实验
[0078]
(1)引物
[0079]
上游引物:5
’‑
agaacccactacgcagccaatctgatg-3’(seq id no:2);
[0080]
下游引物:5
’‑
tgctcggccaccgcggggagtttgtcggtcagag-3’(seq id no:3);
[0081]
(2)探针
[0082]
探针序列为:
[0083]5’‑
cactccatctacgaccagcccgacgccgaatcagttgttgcccaatatgatcg-3’(seq id no:4);
[0084]
采用荧光报告基团(fam)和荧光淬灭基团(bhq1)修饰探针;
[0085]
修饰的探针为:
[0086]5’‑
cactccatctacgaccagcccgacgccgaa/i6famdt/c/idsp/g/ibhq1dt/tgttgcccaatatgatcg(c3 spacer)-3’[0087]
(3)制备质粒工作标准品,分别为:
[0088]
工作标准品1,含有500copies/μl布鲁氏菌质粒非传染性dna片段。
[0089]
工作标准品2,含有250copies/μl布鲁氏菌质粒非传染性dna片段。
[0090]
工作标准品3,含有100copies/μl布鲁氏菌质粒非传染性dna片段。
[0091]
工作标准品4,含有50copies/μl布鲁氏菌质粒非传染性dna片段。
[0092]
工作标准品5,含有25copies/μl布鲁氏菌质粒非传染性dna片段。
[0093]
工作标准品6,含有10copies/μl布鲁氏菌质粒非传染性dna片段。
[0094]
(4)灵敏度实施方法:
[0095]
步骤1、配制反应液(按10个反应进行配制):
[0096]
在250μl反应缓冲液中加入137μl水,浓度为10μm的21μl上下游引物和6μl探针,充分混合后添加到raa荧光基础反应试剂中混合,得到反应预混液;
[0097]
步骤2、raa荧光基础反应试剂重溶
[0098]
准备8个raa荧光基础反应试剂,每次吸取43.5μl步骤1中混匀的反应缓冲液分别加入到准备好的8个raa荧光基础反应试剂管中,使冻干粉充分溶解并混匀,成为raa反应体系,并做好标记。
[0099]
步骤3、加样反应
[0100]
在以上8个配制好的raa荧光基础反应试剂试管盖上加2.5μl mg
2
后,分别向管中加入4μl阴性质控品、4μl标准工作品6、4μl标准工作品5、4μl标准工作品4、4μl标准工作品3、4μl标准工作品2、4μl标准工作品1为模板,加好样后每个反应管进行充分混匀,每个反应管总体积为50μl。
[0101]
步骤4、检测及结果
[0102]
将混匀的6个反应管放入恒温荧光基因检测仪raa-f1610中,设定反应温度为39℃,反应时间20min。
[0103]
根据raa-f1610检测仪器中的阳性判定方法,选择阈值的方法来判定曲线的阴阳性。在设置自动阈值为300,定性阈值为20,则在20分钟内,荧光值大于300的孔位会被判定为阳性,其余判定为阴性。下面对本发明引物对探针的灵敏度、重复性和特异性进行检测。
[0104]
检测结果:如图2所示,为单次的raa灵敏度实验结果;为了确认该方法的检出限,
把上述灵敏度实验共重复8次,同时进行qpcr灵敏度实验比对,结合8次raa灵敏度实验和3次qpcr灵敏度实验结果(表1)进行概率回归分析,分析结果如图3所示,通过概率分析确定基于重组酶等温扩增荧光法的分析灵敏度,结果显示,在20min内,95%概率的检出限为49copies/反应,实现快速灵敏的检出结果。
[0105]
表1:raa和qpcr灵敏度实验表
[0106]
工作标准品copies/μlctqpcrraa150025.97
±
0.563/38/8225026.07
±
0.083/38/8310028.66
±
0.363/38/845030.6
±
1.933/38/852531.54
±
0.133/33/861032.99
±
0.273/31/8
[0107]
2、重复性实验
[0108]
(1)引物、探针及阴性质控品序列与实施例1相同。
[0109]
(2)采用工作标准品3(含有100copies/μl牛分枝杆菌is1081基因质粒非传染性dna片段)进行8个验证重复性:
[0110]
(3)重复性实施方法:
[0111]
步骤1、配制反应液(按10个反应进行配制):
[0112]
在250μl反应缓冲液中加入137μl水,浓度为10μm的21μl上下游引物和6μl探针,充分混合后添加到raa荧光基础反应试剂中混合,得到反应预混液;
[0113]
步骤2、raa荧光基础反应试剂重溶
[0114]
准备9个raa荧光基础反应试剂,每次吸取43.5μl步骤1中混匀的反应缓冲液分别加入到准备好的9个raa荧光基础反应试剂管中,使冻干粉充分溶解并混匀,成为raa反应体系,并做好标记。
[0115]
步骤3、加样反应
[0116]
在以上9个配制好的raa荧光基础反应试剂试管盖上加2.5μl mg
2
后,在以上9个配制好的raa荧光基础反应试剂试管中的一个加入4μl阴性质控品、其他8个反应管中分别加入4μl标准工作品3为模板,加好样后每个反应管进行充分混匀,每个反应管总体积为50μl。
[0117]
步骤4、检测及结果
[0118]
将混匀的9个反应管放入恒温荧光基因检测仪raa-f1610中,设定反应温度为39℃,反应时间20min。
[0119]
根据raa-f1610检测仪器中的阳性判定方法,选择阈值的方法来判定曲线的阴阳性。在设置自动阈值为300,定性阈值为20,则在20分钟内,荧光值大于300的孔位会被判定为阳性,其余判定为阴性。下面对本发明引物对探针的灵敏度、重复性和特异性进行检测。
[0120]
检测结果如图4所示:结果显示除阴性对照外,工作标准品3全部在20min内均有扩增,重复性较好。
[0121]
3、特异性实验
[0122]
(1)引物、探针及阴性质控品序列与实施例1相同。
[0123]
(2)特异性实验中牛分枝杆菌、猪链球菌、沙门氏菌、金黄色葡萄球菌、巴氏杆菌、
大肠杆菌、动物布鲁氏菌由中国动物卫生与流行病学中心人兽共患病监测室提供。
[0124]
(3)样本提取方法:
[0125]
样本先进行预处理(均浆),再按天隆细菌自动提取dna方法提取核酸;-20℃保存备用。
[0126]
(4)特异性实验实施方法:
[0127]
步骤1、配制反应液(按14个反应进行配制)
[0128]
在350μl反应缓冲液中加入191.8μl水,浓度为10μm的29.4μl上下游引物和8.4μl探针,充分混合后添加到raa荧光基础反应试剂中混合,得到反应预混液;
[0129]
步骤2、raa荧光基础反应试剂重溶
[0130]
准备7个raa荧光基础反应试剂,每次吸取43.5μl步骤1中混匀的反应缓冲液分别加入到准备好的13个raa荧光基础反应试剂管中,使冻干粉充分溶解并混匀,成为raa反应体系,并做好标记。
[0131]
步骤3、加样反应
[0132]
在以上13个配制好的raa荧光基础反应试剂试管盖上加2.5μl mg
2
后,在以13个配制好的raa荧光基础反应试剂试管中的1个加入4μl阴性质控品、其他12个反应管中分别加入4μl牛结核阳性样品(i26、16-9、16-31)、猪链球菌、沙门氏菌、金黄色葡萄球菌、巴氏杆菌、大肠杆菌、布鲁氏菌核酸样本核酸,加好样后每个反应管进行充分混匀,每个反应管总体积为50μl。
[0133]
步骤4、检测及结果
[0134]
将混匀的7个反应管放入恒温荧光基因检测仪raa-f1610中,设定反应温度为39℃,反应时间20min。
[0135]
根据raa-f1610检测仪器中的阳性判定方法,选择阈值的方法来判定曲线的阴阳性。在设置自动阈值为300,定性阈值为20,则在20分钟内,荧光值大于300的孔位会被判定为阳性,其余判定为阴性。
[0136]
检测结果如图5所示:结果显示只有牛结核阳性样品(i26、16-9、16-31)有明显扩增,猪链球菌、沙门氏菌、金黄色葡萄球菌、巴氏杆菌、大肠杆菌、布鲁氏菌核酸无明显扩增,显示出良好的特异性。
[0137]
实施例3实际样本检测
[0138]
(1)引物、探针及阴性质控品序列与实施例1相同。
[0139]
(2)实验中临床样本1~14共计14个,由国家动物结核病参考实验室提供;
[0140]
(3)样本提取方法:
[0141]
样本先进行预处理(均浆),再按天隆细菌自动提取dna方法提取核酸;-20℃保存备用。
[0142]
(4)实施方法
[0143]
步骤1、配制反应液(按20个反应进行配制):
[0144]
在350μl反应缓冲液中加入274μl水,浓度为10μm的42μl上下游引物和12μl探针,充分混合后添加到raa荧光基础反应试剂中混合,得到反应预混液;
[0145]
步骤2、raa荧光基础反应试剂重溶
[0146]
准备20个raa荧光基础反应试剂,每次吸取43.5μl步骤1中混匀的反应缓冲液分别
加入到准备好的16个raa荧光基础反应试剂管中,使冻干粉充分溶解并混匀,成为raa反应体系,并做好标记。
[0147]
步骤3、加样反应
[0148]
在以上16个配制好的raa荧光基础反应试剂试管盖上加2.5μl mg
2
后,在以上20个配制好的raa荧光基础反应试剂试管中的1个加入4μl阴性质控品(nc)、1个加入工作标准品1(pc),其他14个反应管中分别加入4μl临床样本核酸,加好样后每个反应管进行充分混匀,每个反应管总体积为50μl。
[0149]
步骤4、检测及结果
[0150]
将混匀的16个反应管放入恒温荧光基因检测仪raa-f1610中,设定反应温度为39℃,反应时间20min。
[0151]
根据raa-f1610检测仪器中的阳性判定方法,选择阈值的方法来判定曲线的阴阳性。在设置自动阈值为300,定性阈值为20,则在20分钟内,荧光值大于300的孔位会被判定为阳性,其余判定为阴性。
[0152]
检测结果如图6所示:结果显示14例临床样本核酸通过raa检测方法和qpcr检测方法的结果一致性为100%,均为阴性;阴性对照样品无扩增,而阳性对照样品出现目标曲线。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。